用于测量心肌缺血、狭窄识别、定位和血流储备分数估计的非侵入式方法和系统
文献发布时间:2023-06-19 11:40:48
本案是基于2017年6月26日提交的专利申请号为201780047004.7、发明名称为“用于测量心肌缺血、狭窄识别、定位和血流储备分数估计的非侵入式方法和系统”的中国专利申请的分案申请。
相关申请
本申请要求2016年6月24日提交的美国临时申请第62/354,673号以及2016年10月17日提交的美国临时申请第62/409,176号的优先权和权益,其每一个的全部内容都通过引用并入本文。
技术领域
本公开总体涉及用于表征心血管循环的非侵入式方法和系统。更具体地,本公开涉及利用未经滤波的宽带心脏相位梯度数据来生成残差子空间和噪声子空间数据以例如,用于预测和定位冠状动脉狭窄、定位和/或估计血流储备分数以及表征心肌缺血的非侵入式方法。
背景技术
血管疾病通常表现为由于血管的动脉粥样硬化闭塞而导致的血流减少。例如,向心肌供血的冠状动脉的闭塞是心脏病的主要原因。用于缓解动脉阻塞的侵入式手术(例如搭桥手术和用导管的支架放置)依赖于对闭塞特征和通过闭塞动脉的血流的估计。这些估计基于对闭塞大小和/或血流的测量。不幸的是,目前的闭塞大小和血流的测量的方法需要侵入式的过程,例如需要心脏导管插入术的冠状动脉造影术。该过程涉及将长、薄、柔性的导管置于手臂、腹股沟(大腿上部)或颈部的血管中;然后将导管拧到心脏上。通过导管,医生可以通过血管造影术或荧光透视法对血管内径进行视觉评估和/或在导丝尖端上使用小的传感器(通常是换能器)来测量诸如压力、温度和流量的参数,以确定病变的严重程度;和血流储备分数(FFR)。这些对心脏的微创诊断测试具有中风、心脏病发作、对插入导管的动脉/心脏的损伤、不规则心律、肾脏损伤、感染和X射线辐射照射的风险。这些过程耗时、需要专业知识来解释结果并且是昂贵的。
在治疗阶段,当随后进行球囊血管成形术、支架置入术或药物递送术时,狭窄几何形状也是重要的。例如,精确的支架放置对于降低再狭窄的风险至关重要。因此,关于是否使用任何阻塞缓解方法以及应该使用哪种方法的决定通常是基于部分信息并且不考虑冠状动脉侧支化(coronary collateralization)。缺血性应激(ischemic stress)通常会引起冠状动脉小血管中侧支循环的增加,其有时会补偿远端血管阻塞。此外,治疗成功的评估也是有问题的,其中必须评估闭塞开口和支架位置。目前主要使用的一类方法需要冗长的过程来发现和确定该病变或多个病变的严重程度、对血流的阻塞。当代技术评估心脏梯度相空间变化并将该变化与心脏计算机断层扫描(CT)、心肌灌注成像和心血管造影相关联。表面心脏梯度包含关于所记录的腔室的电生理学的详细信息。因为表面心脏梯度代表了合胞体中每个心脏细胞的各个动作电位的总和,理论上,任何可能通过测量协调的细胞动作电位来确定的信息都应该可以在表面的“全局”水平上获得。此外,尽管与心肌组织结构对传导性质的影响有关的信息是表面心脏梯度中固有的,但是挑战在于从这些长的准周期性心脏梯度信号中辨别出相关信息,同时排除噪声污染。更进一步地,明显缺乏可用于增强高风险患者识别并因此以非侵入式方式进行试验性预防策略的非侵入式工具。
发明内容
本公开有助于评估心脏组织的宽带相位梯度信息,以评定心脏缺血性心脏病的存在。值得注意的是,本公开提供了一种改进的有效方法,其使用从患者或受试者获取的高分辨率和宽带心脏梯度来对心脏的冠状动脉狭窄进行识别和风险分层。在一些实施例中,患者数据从跨过多个导联的心脏梯度波形导出,从而得到表现出复杂非线性变化的高维数据和长心脏梯度记录。通过数值小波算子,将时空分析用于通过从相空间数据集中提取动态和几何属性来研究作为相空间数据集的心脏梯度数据的形态。数字小波算子促进采集的宽带心脏梯度数据集的实时或近实时处理,以生成残差子空间数据集和噪声子空间数据集。在一些实施例中,残差子空间数据集和噪声子空间数据集被生成为多维数据集(例如,三维)并且非常适合于图像和图形处理。将提取的残差子空间数据集和噪声子空间数据集的形态作为参数和变量馈送到学习算法,以将它们与心脏替补(under study)的异常相关联。
因此,本公开提供了一种非侵入式系统和方法,由此可以采取和转换心脏梯度测量以通过渲染图像将心肌的结构特征(architectural feature)定位和可视化并且表征心脏中的异常和心血管功能。此外,本公开提供了一种系统和方法,用于可视化(例如,逆(inverse)心脏梯度问题)心脏的结构特征并对异常输导/运作的心脏组织进行定位。此外,本公开提供了一种系统和方法,用于将心脏的结构特征以及异常输导/运作的心脏组织的定位作为参数输出到疗法、治疗设备或诊断设备。
在一个方面,公开了一种用于在哺乳动物受试者或患者中非侵入式地识别和/或测量心肌缺血、识别一个或多个狭窄、和/或定位和/或估计血流储备分数的方法,该方法包括:通过至少一个电极(例如,一个或多个表面电极、非接触电极或者其他类型的生物电势感测设备)从受试者同时获取多个宽带梯度信号;以及基于从与所述多个宽带梯度信号相关联的数据导出的残差子空间数据集和噪声子空间数据集,通过一个或多个处理器确定所述受试者选自由以下参数构成的群组中的一个或多个冠状动脉生理参数:血流储备分数估计、狭窄值和心肌缺血估计(例如,和/或其他动脉血流特征)。
在一些实施例中,残差子空间数据集通过以下方式确定:通过对从多个宽带梯度信号导出的数据执行第一小波操作(通过例如第一相位线性小波算子)来生成第一小波信号数据集;通过对第一小波信号数据执行第二小波操作(通过例如第二相位线性小波算子)来产生第二小波信号数据集;以及从第二小波信号数据集的值中减去第一小波信号数据集的值,以生成残差子空间数据集,其中,残差子空间数据集包括空时域中的三维相空间数据集。
在一些实施例中,该方法还包括:提取所述三维相空间数据集的第一组形态特征,其中所提取的第一组形态特征包括选自由以下参数构成的群组中的参数:3D体积值、空隙体积值、表面积值,主曲率方向值和Betti数值。
在一些实施例中,所提取的第一组形态特征是利用alpha-hull算子提取的。
在一些实施例中,该方法还包括:将所述三维相空间数据集划分为多个节段,每个所述节段包括所述三维相空间数据集的非重叠部分;以及提取所述多个节段中每个节段的第二组形态特征,其中所提取的第二组形态特征包括选自由以下参数构成的群组中的参数:3D体积值、空隙体积值、表面积值、主曲率方向值和Betti数值。
在一些实施例中,所提取的第二组形态特征是利用alpha-hull算子提取的。
在一些实施例中,所述多个节段包括的节段的数量选自由3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20构成的群组。
在一些实施例中,所述噪声子空间数据集通过以下方式确定:通过对从所述多个宽带梯度信号导出的数据执行第一小波操作(例如,第一相位线性小波算子)来生成第一小波信号数据集;以及通过对所述第一小波信号数据集执行第二小波操作(例如,第二相位线性小波算子)来生成第二小波信号数据集,所述第二小波信号数据包括所述噪声子空间数据集,其中,所述噪声子空间数据集包括时空域中的三维相空间数据集。
在一些实施例中,该方法还包括:提取所述三维相空间数据集的一组形态特征,其中所提取的该组形态特征包括选自由以下参数构成的群组中的参数:3D体积值、空隙体积值、表面积值、主曲率方向值和Betti数值。
在一些实施例中,所提取的该组形态特征是利用alpha-hull算子提取的。
在一些实施例中,该方法还包括:将所述三维相空间数据集划分为多个节段,每个节段包括所述三维相空间数据集的非重叠部分;以及提取所述第二多个节段中的每个节段的第二组形态特征,其中所提取的第二组形态特征包括选自由以下参数构成的群组中的参数:3D体积值、空隙体积值、表面积值、主曲率方向值和Betti数值。
在一些实施例中,所提取的第二组形态特征是利用alpha-hull算子提取的。
在一些实施例中,所述第二节段包括的节段的数量选自由3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20构成的群组。
在一些实施例中,所述残差子空间数据集与第一噪声几何轮廓的第一形状相关联,并且其中,所述噪声子空间数据集与对应于随机噪声的第二噪声几何轮廓的第二形状相关联。
在一些实施例中,所述多个宽带梯度信号是同时获取的,所述多个宽带梯度信号在每个信号之间具有小于约10飞秒的滞后或偏差。
在一些实施例中,所述多个宽带梯度信号中的每一个在处理之前以及处理期间未被滤波,以生成所述残差子空间数据集和所述噪声子空间数据集。
在一些实施例中,所述多个宽带梯度信号中的每一个包括频域中具有大于约1kHz的频率分量的心脏数据。
在一些实施例中,所述多个宽带梯度信号中的每一个包括选自由以下频率构成的群组中的频率的心率信息:约1kHz、约2kHz、约3kHz、约4kHz、约5kHz、约6kHz、约7kHz、约8kHz、约9kHz和约10kHz。
在一些实施例中,所述多个宽带梯度信号中的每一个包括在约0Hz和约50kHz之间的频率的心率信息。
在一些实施例中,所述多个宽带梯度信号中的每一个包括频率在约0Hz到约500kHz之间的心率信息。
在一些实施例中,该方法还包括:通过第一机器学习(例如神经网络、公式学习等)操作将提取的第一组形态特征与多个候选模型相关联,所述多个候选模型与对所述血流储备分数估计、所述狭窄值和所述心肌缺血估计的估计相关联;以及选择所述多个候选模型中的候选模型以确定对所述储备血流储备分数估计、所述狭窄值和所述心肌缺血估计的估计中每一个的输出。
在一些实施例中,该方法还包括:将所确定的一个或多个冠状动脉生理参数可视化。
在一些实施例中,所述血流储备分数估计、所述狭窄值和所述心肌缺血估计被呈现在心脏图像上的一个或多个相应冠状动脉区域处(例如通过标准的心脏17节段模型)。
在一些实施例中,该方法,还包括:将所确定的一个或多个冠状动脉生理参数输出到手术设备或诊断设备。
在一些实施例中,所述至少一个电极中的一个或多个选自由表面电极、心内电极和非接触电极构成的群组。
在一些实施例中该方法还包括识别一个或多个显著狭窄,所述识别在验证阶段具有大于约0.7的AUC-ROC得分(“曲线下面积”和“接收器工作特征曲线”得分)。
在另一个方面,公开了一种例如通过宽带生物电势测量装置非侵入性地识别和/或测量心肌缺血、识别一个或多个狭窄、和/或定位和/或估计血流储备分数的系统。该系统包括处理器和其上存储有指令的存储器,其中指令的执行使得处理器从一个或多个电极(例如,表面电极,非接触电极或其他类型的生物电势感测设备)同时获取多个宽带梯度信号;并基于残差子空间数据集和噪声子空间数据集确定选自由以下参数构成的群组中的一个或多个冠状动脉生理参数:血流储备分数估计、狭窄值和心肌缺血估计,其中所述残差子空间数据集和噪声子空间数据从与所述多个宽带梯度信号相关联的数据导出。
在一些实施例中,所述指令的执行还使得所述处理器:将所确定的冠状动脉生理参数可视化以呈现在显示器上。
在一些实施例中,所述指令的执行还使所述处理器:将所确定的一个或多个冠状动脉生理参数输出到治疗设备。
在另一个方面中,公开了一种计算机可读介质,具有存储于其上的指令,其中所述指令的执行还使得处理器:基于由与从至少一个表面电极同时获取的多个宽带梯度信号相关联的数据导出的残差子空间数据集和噪声子空间数据集,确定选自由以下参数构成的群组中的一个或多个冠状动脉生理参数:血流储备分数估计、狭窄值和心肌缺血估计。
在一些实施例中,所述指令的进一步执行使得所述处理器:使所确定的冠状动脉生理参数可视化以呈现在显示器上。
在一些实施例中,所述指令的执行还使得所述处理器:将所确定的一个或多个冠状动脉生理参数输出到治疗设备。
附图说明
附图中的组件不一定相对于彼此按比例绘制,相似的附图标记在若干视图中表示相应的部分:
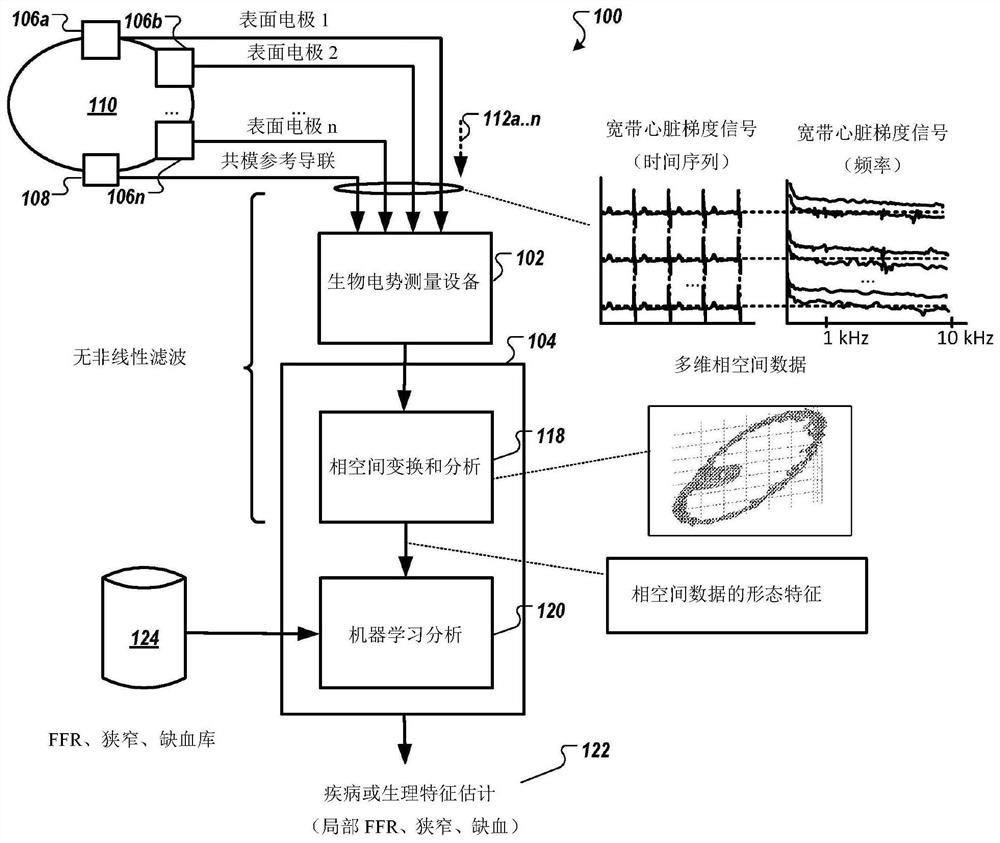
图1是根据示例性实施例的、用于使用宽带心脏梯度数据非侵入式地确定心脏中的动脉血流特征(例如,心肌缺血的存在、狭窄识别、定位和血流储备分数估计)的系统的图。
图2是根据示例性实施例的、示出为时间序列数据的示例宽带心脏梯度信号的图。
图3是根据示例性实施例的、在频域中示出的示例宽带心脏梯度信号的图。
图4是根据示例性实施例的、与单个表面电极相关联的示例宽带心脏梯度信号的时间序列图。
图5是根据示例性实施例的、与三个表面电极相关联的示例宽带心脏梯度信号的频率图。
图6是根据示例性实施例的、与三个表面电极相关联的示例超宽带心脏梯度信号的频率图。
图7是根据示例性实施例的、处理宽带心脏梯度信号以非侵入式地识别和/或估计心肌缺血程度、狭窄识别和/或定位以及血流储备分数估计的方法的图。
图8是根据示例性实施例的、执行例如多维残差子空间数据集、多维噪声子空间数据集和多维小波清理数据集的特征拓扑分析的方法的图。
图9是根据示例性实施例的、执行机器学习分析以创建和选择非线性模型来识别和/或估计心肌缺血程度、狭窄识别和/或定位以及血流储备分数估计的方法的图,如关于图8所描述地。
图10A和10B是根据示例性实施例的、用于生成多维小波清理数据集的示例小波变换的图。
图11是根据示例性实施例的、小波清理数据集的示例时间序列数据集的图。
图12是根据示例性实施例的、用于生成多维残差子空间数据集的示例的基于小波的操作的图。
图13A和13B是根据示例性实施例的、用于生成多维小波清理数据集的示例小波变换的图。
图14是根据示例性实施例的、示例多维残差子空间数据集的描绘。
图15是根据示例性实施例的、示例性多维噪声子空间数据集的描绘。
图16和17中每一个是根据示例性实施例的、示例性多维残差子空间数据集的描绘。图16示出了没有缺血的受试者的示例多维残差子空间数据集。图17示出了缺血的受试者的示例多维残差子空间数据集。
图18和19中每一个是根据示例性实施例的、示例性多维噪声子空间数据集的描绘。图18示出了没有缺血的受试者的示例多维噪声子空间数据集。图。图19示出了缺血的受试者的示例多维噪声子空间数据集。
图20是根据示例性实施例的、使心脏中确定的动脉血流特征可视化的方法的图。
图21和22是示出根据示例性实施例的、使用图1的分析进行的研究的结果的图。
具体实施方式
附图中的组件不一定相对于彼此按比例绘制,相似的附图标记在若干视图中表示相应的部分。
图1是根据示例性实施例的、用于使用宽带心脏梯度数据(wide-band cardiacgradient data)非侵入式地确定心脏中的动脉血流特征(arterial flowcharacteristics)的系统的图。如图1所示,系统100包括宽带生物电势测量设备102和分析子系统104。宽带生物电势测量设备102经由至少一个电极106(示出为表面电极106a,106b,...,106n)和相应的共模参考导联(lead)108从受试者或患者110采集宽带生物电势信号112(示出为112a、...、n)(在此也称为宽带心脏梯度信号数据112),所述至少一个电极106和相应的共模参考导联108都处于图1的系统中且其都附接于哺乳动物受试者或患者110的表面(例如,动物或人的皮肤)。宽带生物电势测量设备102可以是被配置为捕获未经滤波的电生理信号的任何设备,从而信号的频谱分量不被改变。也就是说,所有的捕获信号(如果不是捕获信号的重要部分)包括通常被感知或视为噪声的分量,例如大于约1kHz的频率范围内的分量。为此,宽带生物电势测量设备102捕获、转换和分析所采集的宽带生物电势信号112,而不(通过硬件电路或数字信号处理)进行任何影响宽带生物电势信号112的信号的相位线性度的滤波。即,在相空间变换和分析中仅执行相位确定性操作,数值的或分析的。相位失真是导致信号频率分量发生偏移的非确定性失真。
示例宽带生物电势测量设备102在申请号为15/248,838、公开号为US2017/0119272、发明名称为“Method and Apparatus for Wide-Band Gradient SignalAcquisition”的美国专利申请中进行了描述,其全部内容通过引用并入本文中。在一些实施例中,宽带生物电势测量设备102被配置为以约8kHz的速率记录在患者或受试者(在静止位置)上的多个观察点处的未经滤波的生理信号并持续210秒。然后将得到的信号记录安全地传输到基于云的存储库,然后将其自动排队进行处理。在一些实施例中,所得到的信号记录被安全地传输到基于云的存储库,然后将其自动排队进行处理。处理管线通过对信号进行多维(空间时间)变换导出胸部系统的相位能量(phase energy),并随后将其重建为患者心脏的相空间模型。
发明人已经发现:具有那些超出常规心电图(ECG)的并且传统上被感知或视为随机噪声的能量和频率分量的宽带生物电势信号包括心脏生理学的可测量数据,其可通过遗传算法(以及其他机器学习算法)分辨,以评估心脏的局部流动特征,包括例如狭窄的估计值和缺血的识别以及特定动脉及其分支的血流储备分数(FFR)。去除噪声(例如,通过对数据应用清洁技术,导致与去除噪声之前的数据量相同)是信号处理中的基本步骤。然而,示例性方法和系统在没有任何噪声去除操作的情况下对整个所获得的生物电势信号进行处理。迄今为止在宽带数据中被感知和/或分类为不想要的噪声的在许多情况下是感兴趣的信号。未被执行的噪声消除的示例包括但不限于被配置为改变被处理信号的相位线性度的基于模拟的低通滤波器、带通滤波器、高通滤波器以及基于数字的滤波器(如FIR滤波器、巴特沃斯滤波器,切比雪夫滤波器和中值滤波器(以及其他))。注意,可以使用被配置为相位线性化的基于模拟的低通滤波器、带通滤波器、高通滤波器以及基于数字的滤波器。在一些实施例中,可以通过相位线性化操作来处理信号,以允许分析高频宽带数据的特定方面。
如美国专利申请第15/248,838号所描述地,在一些实施例中,宽带生物电势测量设备102被配置成以微伏或亚微伏(sub-microvolt)分辨率(其为处于或显著低于常规心电图和生物信号获取仪器的本底噪声的分辨率)捕获一个或多个生物信号,例如生物电势信号。在一些实施例中,宽带生物电势测量设备102被配置为获取并记录同时采样的宽带相位梯度信号(例如,宽带心脏相位梯度信号、宽带脑相位梯度信号),在一些实施例中,这些信号具有小于约1μs的时间偏差(skew)或“滞后”,而在其他实施例中,具有不大于约10飞秒的时间偏差或滞后。值得注意的是,例示的系统使所获取的宽带相位梯度信号中的非线性失真(例如,可以通过某些滤波器引入的失真)最小化,以便不影响其中的信息。
仍参见图1,分析系统104被配置为生成要在稍后描述的后续相空间分析118中使用的相空间图。然后使用机器学习分析120评估相空间分析的输出,以评估与疾病的存在或生理特征(例如局部动脉血流特征)相关联的参数122。在一些实施例中,机器学习分析120可以在评估所获得的宽带心脏梯度信号数据112时使用量化的FFR、狭窄和缺血数据的库124。然后将执行分析104的处理器的输出122传输到图形用户接口(例如触摸屏或其他监视器)用于可视化。在一些实施例中,图形用户接口包括在被配置成显示参数122的显示单元中。在一些实施例中,图形用户接口显示中间参数,例如生物电势信号数据和虚拟生物电势信号数据的3D相空间图表示。在其他实施例中,然后将处理器的输出传输到一个或多个非图形用户接口(例如,打印输出、命令行或仅文本用户接口),直接传输到数据库或存储器设备,用于例如稍后检索和/或另外的分析、或其组合。
如本文所使用的,术语“处理器”指的是执行用于对输入执行功能和创建输出的代码化指令的物理硬件设备。处理器可以包括一个或多个处理器,每个处理器被配置为执行指令和处理数据以执行与计算机相关联的用于索引图像的一个或多个功能。处理器可以通信地耦合到RAM、ROM、存储器、数据库、I/O设备以及接口。处理器可以被配置为执行计算机程序指令序列以执行各种处理。
图2(在图1中再现)是根据实施例的、示出为时间序列数据的示例宽带心脏梯度信号112的图。图3(也在图1中再现)是根据实施例的、在频域中示出的图2的示例宽带心脏梯度信号112的图。如图3所示,宽带心脏梯度信号112具有大于1kHz的频率分量,其显著高于传统的心电图测量值。在一些实施例中,宽带心脏梯度信号112具有高达约4kHz(例如,约0Hz至约4kHz)的频率分量。在一些实施例中,宽带心脏梯度信号112具有高达约5kHz(例如,约0Hz至约5kHz)的频率分量。在一些实施例中,宽带心脏梯度信号112具有高达约6kHz(例如,约0Hz至约6kHz)的频率分量。在一些实施例中,宽带心脏梯度信号112具有高达约7kHz(例如,约0Hz至约7kHz)的频率分量。在一些实施例中,宽带心脏梯度信号112具有高达约8kHz(例如,约0Hz至约8kHz)的频率分量。在一些实施例中,宽带心脏梯度信号112具有高达约9kHz(例如,约0Hz至约9kHz)的频率分量。在一些实施例中,宽带心脏梯度信号112具有高达约10kHz(例如,约0Hz至约10kHz)的频率分量。在一些实施例中,宽带心脏梯度信号112具有高达50kHz(例如,约0Hz至约50kHz)的频率分量。
图4是根据实施例的、与单个表面电极相关联的示例宽带心脏梯度信号112的时间序列图。该图示出了随时间(以秒为单位)的以mV为单位的信号。
图5是根据实施例的、与三个表面电极相关联的示例宽带心脏梯度信号112的频率图。如图所示,图5包括高达4kHz的宽带心脏梯度信号112的频率分量。如进一步所示,所呈现的宽带心脏梯度信号112在大于1kHz的频率处具有在频域中介于-20dB到20dB之间的功率。宽带心脏梯度信号112的该部分502包括关于心脏组织及其下层结构的拓扑和功能信息,其可用于确定局部血流特征,例如局部FFR的估计、局部狭窄的估计和识别、和/或局部缺血程度的估计。
宽带心脏梯度信号(例如,具有在约1kHz到约10kHz之间的频率)有助于对不均匀采样数据的相空间分析。在一些实施例中,宽带心脏梯度信号在感兴趣的间隔期间具有较高的采样率,而在其他间隔期间具有较低的采样率,以便于使所得到的数据集大小最小化。这种变化的采样率可以用于数据存储为有限的应用中。许多非线性函数(例如,诸如在相空间分析中使用的那些函数)在识别具有在时域中不均匀间隔开的点的幅度时更有效地操作。与感兴趣的最高频率的采样率相比高得多的采样率(例如,比感兴趣的最高频率的采样率高10倍)有助于正确表征信号系统的形状。这类似于劳伦兹系统,其中非常高的频率有利于在相空间中正确地对系统的形状进行建模。劳伦兹系统的实例在Lorenz,EdwardNorton,“Deterministic non-periodic flow”,Journal of the Atmospheric Sciences20(2),第130-141页(1963)中有描述,其全部内容通过引用结合到本文中。
在一些实施例中,示例化方法和系统用于对具有高至约500kHz(例如,具有在约1kHz和约500kHz之间的频率)的负频谱能量特征(negative spectral energy signature)的超宽带心脏梯度信号进行分类。
图6是根据示例性实施例的、示例超宽带心脏梯度信号的频率图。如图所示,图6是以约200kHz的频率被采样的并且包括高达约100kHz的超宽带心脏梯度信号的频率分量(根据奈奎斯特采样定理)。值得注意的是,如图所示,所呈现的超宽带心脏梯度信号包括频率大于约70-80kHz的负频谱能量特征(示出为频率602);负频谱能量特征在频域中具有在约40dB和约50dB之间的能量。数据表明超宽带心电图中的低能量特征可能具有可用于对身体的形态或功能进行成像和/或用于诊断的信息。
图7是根据示例性实施例的、处理宽带生物电势信号数据112(和超宽带生物电势信号数据)的方法700的图。如图7所示,方法700包括采集宽带梯度心脏信号数据112(示出为“宽带梯度信号未经滤波原ADC数据”112)和对宽带梯度心脏信号数据进行预处理702以产生相空间分析中的相空间数据集(示出为“残差子空间”数据集704和“噪声子空间”数据集706),由此提取相空间数据集(704,704)的特征(操作708)并以嵌套的非线性函数710评估相空间数据集(704,704)的特征以产生狭窄和FFR估计值122。
可以从一个或多个电极(例如,表面电极、非接触电极)中采集宽带梯度心脏信号数据112。在一些实施例中,宽带梯度心脏信号数据112同时从1到大约20或更多个电极(例如,1个电极、2个电极、3个电极、4个电极、5个电极、6个电极、7个电极、8个电极、9个电极、10个电极、11个电极,12个电极、13个电极、14个电极、15个电极、16个电极、17个电极、18个电极、19个电极和20个或更多个电极)收集。在一些实施例中,这些电极的采样可具有小于10飞秒的偏差(skew)或“滞后”。在其他实施例中,这些电极的采样可具有小于100飞秒的偏差或滞后。在其他实施例中,这些电极的采样可具有小于几皮秒的偏差或滞后。在一些实施例中,宽带心脏梯度信号112具有高达约10kHz的频率分量(例如,约0Hz至约4kHz;约0Hz至约5kHz;约0Hz至约6kHz;约0Hz至约7kHz;约0Hz至约8kHz;约0Hz至约9kHz;或约0Hz至约10kHz)。在一些实施例中,宽带心脏梯度信号112具有高达约50kHz(例如,约0Hz至约50kHz)的频率分量。在一些实施例中,宽带梯度心脏信号数据112具有约1/2μV灵敏度的电压分辨率。在其他实施例中,宽带梯度心脏信号数据112具有大于约1/2μV灵敏度的电压分辨率(例如,约1μV、约10μV、约100μV或约1mV)。在一些实施例中,信号数据的分辨率为约24位。在一些实施例中,有效分辨率是20位、21位、22位、或23位或更多位。在一些实施例中,有效分辨率小于20位(例如,18位或14位或更少)。
在一些实施例中,相空间图分析使用几何对比(geometrical contrast),该几何对比由相平面中去极化波与任何其他正交导联(orthogonal leads)的干涉产生。无噪声子空间的存在允许记录这些波的相位。通常,可以测量由这种干扰产生的幅值;然而,这些正交导联的相位仍然携带有关于结构的信息并在图像中生成几何对比。相空间图分析利用了这样的事实:例如心脏及其各种类型的组织内的不同生物电结构具有不同的阻抗,因此频谱和非频谱传导延迟并使穿过心脏的相空间轨道的轨迹弯曲不同的量。轨迹的这些微小变化可以被归一化(normalized)和逐拍量化(quantified beat-to-beat)并且针对异常或差的导联放置进行校正,并且可以使用遗传算法将归一化的相空间积分(integral)可视化或映射到几何网格(geometric mesh)上,以根据回顾性数据(retrospective data)将心室中的17个心肌节段映射到心脏的各种层析成像(tomographic imaging)模式。
仍然参见图7,执行三个单独的相空间分析以生成度量(metrics)和变量集(示出为712a、712b和712c),其将用在非线性函数710中以生成局部(regional)FFR估计值、局部狭窄值和区域缺血值122。表1是示例输出矩阵122。
如上所示,表1包括对应于心脏中主要血管的多个节段的血流储备分数(FFR)参数、估计的狭窄参数和估计的缺血参数。在一些实施例中,矩阵122包括用于标准化的心肌节段图的血流储备分数(FFR)参数、估计的狭窄参数和估计的缺血参数,其具有17个心脏节段,包括左主动脉(LMA)、左回旋支近端(Prox LCX)、左回旋支中部(Mid LCX)、远端左侧动脉(Dist LCX)、左后房室(LPAV)、第一钝缘支(OM1)、第二钝缘支(OM2)、第三钝缘支(OM3)、左前降支近端(Prox LAD),左前降支中段(Mid LAD)、左前降支远端(Dist LAD),左前降支第一对角支(LAD D1)、左前降支第二对角支(LAD D2),右冠状动脉近端(Prox RCA),右冠状动脉中段(中RCA)、右冠状动脉远端(Dist RCA)和后降支右侧的锐缘支(AcM R PDA)。在表1中,用于心肌缺血估计、狭窄识别和/或血流储备分数估计的参数在0到1的范围内示出。可以使用其他比例或范围。
表2-5显示了用于生成对应于心脏中主要血管的若干节段的FFR估计的示例非线性函数。在表2中,提供了用于确定左主动脉的FFR估计的示例函数(“FFR_LEFTMAIN”)。
如表2所示,基于提取的度量和变量(诸如与噪声子空间706相关联的Z分量参数(“noisevectorRz”),Alphahull比率参数(“Alpharatio”)和信号密度云体积(signaldensity cloud volume)4(“DensityV4”))来确定左主动脉的FFR估计。
在表3中,提供了用于确定右冠状动脉中段的FFR估计(“FFR_MIDRCA”)的示例函数。
如表3所示,基于提取的度量和变量(诸如与噪声子空间706相关联的Y分量参数(“noisevectorRy”),Alphahull比率参数(“Alpharatio”)和信号密度云体积3(“DensityV3”))来确定右冠状动脉中段的FFR估计。
在表4中,提供了用于确定左前降支中段的FFR估计(“FFR_MIDLAD”)的示例函数。
如表4所示,基于提取的度量和变量(诸如云簇3的体积与表面积的比率(“AspectRatio3”)和小波残差均值(residue mean)XYZ(“residueLevelMean”))来确定左前降支中段的FFR估计。
在表5中,提供了用于确定左回旋支近端(“FFR_PROXLCX”)的FFR估计的示例函数。
如表5所示,基于提取的度量和变量(诸如小波残差体积XYZ(“residualLevelVolume”)、矢量云6体积(“vectorcloud 6”)和信号密度云体积4(“DensityV4”))来确定左回旋支近端的FFR估计。
再次参见图7,小波算子(wavelet operator)714(示出为“小波清除(cleaning)”714)可以对宽带梯度信号数据112(或从其导出的数据)进行操作。本领域技术人员应该理解,可以在通过小波算子714操作之前对信号数据112执行其他的中间的相位线性处理。在一些实施例中,小波算子714包括双正交小波3.3变换。图10A和10B是根据示例性实施例的用于生成多维小波清理数据集的示例小波变换(即,双正交小波3.3)的图。图10A示出了分解尺度(decomposition scaling)函数φ。图10B示出了分解小波函数ψ。图11是小波清理操作的示例输出1102的图。输出1102与小波清理操作的输入1104一起示出。在一些实施例中,输出是时间序列数据集。
仍然参见图7,通过相空间变换718对小波算子714的输出进行组合和变换,以产生多维小波清理数据集716。对多维小波清理数据集716执行特征拓扑分析(也在框718中示出),以提取度量和变量712a。在一些实施例中,所提取的度量和变量712a包括多维小波清理数据集的形态、拓扑或功能特征,包括例如3D体积值、空隙体积值、表面积值、主曲率方向值和Betti数值。在一些实施例中,可以将多维小波清理数据集分段或分割成子区域,对于这些子区域提取这些子区域的度量和变量。在一些实施例中,还针对每个子区域确定空隙体积值、表面积值、主曲率方向值和Betti数值。在一些实施例中,所生成的子区域的数量(也称为段的数量)在约2和约20之间(例如,2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19和20)。在一些实施例中,子区域的数量大于20。
图8是执行多维小波清理数据集的特征拓扑分析的方法800的图。在一些实施例中,可以类似地对其他数据集执行方法800,其他数据集例如是通过如关于图7所述的相空间分析(例如,残差子空间分析和噪声子空间分析)中的每一个生成的多维噪声子空间数据集712b和多维小波清理数据集712c。如图8所示,在一些实施例中,形态、拓扑或功能特征提取分析(示出为“拓扑分析”802)包括使用alpha-hull算子804计算多维小波清理数据集的至少一个周期的3D体积、空隙和表面积作为时空域数据集。在一些实施例中,alpha-hull算子使用静态alpha半径。在Edelsbrunner等人的“Three-dimensional alpha shapes,”ACMTransactions on Graphics,Vol.13(1):43-72(1994)中描述了alpha-hull算子的进一步细节,其全部内容通过引用并入本文。可以使用其他拓扑或几何封装(geometricencapsulation)操作,包括但不限于例如Delauney三角测量。Delaunay三角测量是对一组点进行的三角测量,使得在三角测量中没有点位于任何三角形的外接圆内,并且使得三角测量中每个三角形中所有角度中的最小角度最大化。
仍然参见图8,可以进一步提取alpha-hull算子(operator)806的所生成的多维输出以计算(算子808)主方向、曲率方向、Betti数和Betti值。另外,将作为时空域数据集的数据集进一步分段(经由算子810)为子区域,并且还使用alpha-hull算子812计算这些子区域的体积、表面积和纵横比。如图所示,时空域数据集被分成5个区域、8个区域和12个区域,其中针对所有这些区域中的一些区域计算体积、表面积和纵横比参数。在一些实施例中,包括25个区域的三组区域可以针对每个区域生成3个参数以提供75个度量或变量712a。结合计算出的alpha-hull输出的体积、表面积和纵横比以及主方向、曲率方向、Betti数和其Betti值,可以有82个度量或变量712a。度量和变量712a可以作为矩阵提供(显示为“拓扑矩阵”814)。
应当理解,除了本文所讨论的或者替代本文所讨论的,也可以提取其他拓扑特征。这些特征可以包括诸如能量、面积变化等特性或诸如尺寸的几何特征。
应当理解,可以根据所执行的操作的数量来提取和使用其他度量和变量,并且本文提供的示例仅用于说明目的。
再次参见图7,注意第二相空间分析,其被执行以确定多维残差子空间数据集704的度量和变量712b。
图12是根据示例性实施例的、用于生成如关于图7所描述的多维残差子空间数据集704的示例的基于小波的操作1202的图。如图7和图12中所示,生成多维残差子空间数据集704作为两个小波算子(例如,714和720)的残差(例如,图12中的减法算子1202)。第一小波算子可以是例如,使用双正交小波3.3算子的小波清除714。第二小波算子可以是逆双正交小波3.7算子720。图13A和13B是根据示例性实施例的、用于生成多维残差子空间数据集的示例小波变换(即,逆双正交小波3.7)的图。图13A示出了分解尺度函数φ。图13B示出了分解尺度函数ψ。应该可以使用其他相位线性小波算子。
仍参见图7,通过相空间变换对针对每个梯度信号的小波算子714和小波算子720的每个残差输出进行组合和变换,以产生多维残差子空间数据集704。对多维小波残差数据集执行特征拓扑分析(也在方框722中示出)以提取度量和变量712b。所提取的度量和变量712b可以包括多维小波残差数据集的形态、拓扑或功能特征,包括例如3D体积值、空隙体积值、表面积值、主曲率方向值和Betti数值。在一些实施例中,可以将多维小波清理数据集分段或分割成子区域,对这些子区域提取这些子区域的度量和变量。在一些实施例中,还针对每个子区域确定空隙体积值、表面积值、主曲率方向值和Betti数值。在一些实施例中,所生成的子区域的数量(也称为段的数量)在约2和约20之间(例如,2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19和20)。在一些实施例中,子区域的数量大于20。在一些实施例中,可以执行如关于图8所描述的类似或相同的拓扑提取分析。
图14是使用双正交3.3和逆双正交3.7运算减去小波模型(例如,714和720)得到的示例残差子空间704的描绘。残差子空间表示生物信号的那些实际过于复杂和非线性而不能适应(即表示)单个小波函数的部分。对该残差子空间进行处理,将其转换为代表性特征,并用于研究心脏梯度数据的动态和几何特性。
图16是已经由残差子空间着色的示例动态相空间体积对象的描绘。通过将残差子空间的值作为颜色强度映射叠加到输入宽带梯度信号数据上来生成相空间体积对象。缺乏强烈着色表明无缺血性心肌组织。即,图16是健康人的示例动态相空间体积对象。
图17是与缺血性患者相关联的示例动态相空间体积对象的描绘。即,使用被诊断具有缺血心肌的患者的宽带梯度信号数据来生成动态相空间体积对象。通过将残差子空间的值作为颜色强度映射叠加到输入宽带梯度信号数据上,动态相空间体积对象已被残差子空间着色。强烈着色(对应于箭头1702)表明存在缺血性心肌。
再次参见图7,注意第三相空间分析,其被执行以确定多维噪声子空间数据集706的度量和变量712c。如图7所示,可以通过减法算子724减去输入的宽带梯度信号数据112(或从其导出的数据集)和小波清理信号数据716的输出来计算多维噪声子空间数据集706。通过相空间变换对减法运算的输出进行组合和变换,以产生多维残差子空间数据集706。对多维噪声子空间数据集执行特征拓扑分析(也在框726中示出)以提取度量和变量712c。所提取的度量和变量712c可以包括多维小波残差数据集的形态、拓扑或功能特征,包括例如3D体积值、空隙体积值、表面积值,主曲率方向值和Betti数值。在一些实施例中,可以将多维小波清理数据集分段或分割成子区域,对于这些子区域提取这些子区域的度量和变量。在一些实施例中,还针对每个子区域确定空隙体积值、表面积值、主曲率方向值和Betti数值。在一些实施例中,所生成的子区域的数量(也称为段的数量)在2到大约20之间(例如,2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19和20)。在一些实施例中,子区域的数量大于20。在一些实施例中,可以执行如关于图8所描述的类似或相同的拓扑提取分析
图15是噪声子空间706的描绘,其是从输入宽带梯度数据112中减去双正交3.3小波模型(例如,714)的结果。类似于残差子空间704,其包含复杂的动态信息。具体而言,噪声子空间包含无法在模型中有效捕获的混沌信息。对该噪声子空间进行处理、将其转换为代表性特征、并用于研究心脏梯度数据的动态和几何特性。
图18是已经由噪声子空间着色的示例噪声子空间相空间对象的描绘。通过将噪声子空间的值作为颜色强度映射叠加到输入宽带梯度信号数据(或其导出数据)的导数变换(例如,数值分数导数)上来生成相空间对象。如图18所示,缺少强烈着色表明无缺血性心肌。即,图18是健康人的示例噪声子空间相空间对象。
图19是与缺血性患者相关联的示例噪声子空间相空间对象的描绘。通过将噪声子空间的值作为颜色强度映射叠加到输入宽带梯度信号数据(或导出数据)的导数变换(例如,数值分数导数)上,相空间对象已经被噪声子空间着色。强烈着色(对应于箭头1902)表明存在缺血性心肌。
图9是根据示例性实施例的、执行机器学习分析以创建和选择非线性模型来识别和/或估计心肌缺血程度、识别一个或多个狭窄、和/或定位和/或估计血流储备分数的方法的图,如关于图8所描述地。如图9所示,血管造影数据集902和血流分数数据集904用于(通过操作906)创建候选非线性模型以识别狭窄(和/或估计其程度)并估计血流储备分数914。用于例如估计心腔大小和机械功能的非性模型的生成的实例例如在发明名称为“Noninvasive electrocardiographic method for estimating mammalian cardiacchamber size and mechanical function”的美国申请第14/295,615号中进行了描述,其全部内容通过引用并入本文。
在一些实施例中,机器学习算法908然后用于从使用具有一定程度狭窄以及缺血的患者或受试者的宽带梯度心脏信号数据912的候选非线性模型中选择一族非线性模型910。在一些实施例中,机器学习算法基于回归随机森林算法或其修改的变型。在一些实施例中,机器学习算法基于深度学习算法。
在一些实施例中,机器学习阶段调用元遗传算法以自动选择从大池中抽取的特征的子集。然后,由AdaBoost算法使用该特征子集来生成预测器(predictor),以诊断代表阳性和阴性病例的患者群体中的显著冠状动脉疾病。候选预测器的表现是通过对先前未见过的患者池进行验证来确定的。在Freund,Yoav和Robert E.Schapire的“A decision-theoretic generalization of on-line learning and an application to boosting,”(发表于关于计算学习理论的欧洲会议,Springer,Berlin,Heidelberg(1995)的)中提供了对AdaBoost算法的进一步描述,其全部内容通过引用并入本文。
在一些实施例中,时空量可以映射到12维空间中的复杂相空间差异。可以使用创建12维时空密度度量的非傅立叶积分来提取相空间矩阵中的空间变化。使用遗传算法建模这些用于心室的度量,以链接17个非线性嵌套的正弦高斯方程,用于冠状动脉区域的心室17节段,作为灌注阻塞(perfusion blockages)。使用左心室的17段模型和5点级别(0=正常示踪剂摄取,1=轻度减少,2=中度减少,3=严重减少,4=无摄取)在视觉上对灌注图像进行评分。缺血性心肌组织(IM)的量计算为总差异得分(总负荷(summed stress)得分与总静息(rest score)得分之间的差异)除以80。患者被分类为:无缺血或可疑(IM<5%),轻度缺血(5%≤IM<10%)和中度/重度缺血(IM≥10%)。这些方程的输出提供缺血心肌组织的量和位置。
在一些实施例中,利用修改的匹配追踪(MMP)算法对宽带生物电势数据112进行操作以创建稀疏数学模型。在Mallat等人的“Matching Pursuits with Time-FrequencyDictionaries”,IEEE Transactions on Signal Processing,Vol.41(12),第3397-2415页(1993)中提供了MMP算法的细节,其全部内容通过引用并入本文。
包括残差量化的模型的特征可以包括在特征集中。在特征提取操作706(图7)中可以提取模型的特性,以确定模型的几何和动态特性。这些子空间可以包括但不限于复杂的次谐波频率(CSF)轨迹、准周期的和混沌子空间、低/高能子空间,以及低/高能子空间的分数导数。这些子空间是表征系统的动态的子空间族的示例,无论是病态的还是正常的。
图20是根据示例性实施例的将心脏中的估计的动脉血流特征可视化的方法的图。如图20所示,可视化引擎2002接收所确定的动脉血流特征并将该特征呈现到3D可视化输出上。在一些实施例中,可视化引擎2002在图形用户接口(GUI)中提供所有动脉血流特征及其相互作用的系统级视图。在一些实施方案中,GUI呈现动脉血流的上游修正对下游循环上的级联效应。
在临床方案下进行的冠状动脉疾病学习和配方开发研究在冠状动脉血管造影术之前采集来自人类受试者的静息(resting)相位信号。使用本文所述的非侵入式获取和分析方法评估所采集的信号,以检测有症状的成人患者或受试者中是否存在显著的冠状动脉疾病。此外,评估所采集的信号以评估左心室射血分数(ejection fraction)并识别显著的冠状动脉疾病的位置。使用比较配对试验设计来评估本文所述的非侵入式获取和分析方法的性能,其结果如图21和图22所示。
在发明名称为“Method and System for Collecting Phase Signals for PhaseSpace Tomography Analysis”的美国临时申请第62/340,410号中提供了对该临床方案的进一步描述,其全部内容通过引用并入本文。
图21和22是示出根据示例性实施例的、在523个人类受试者上进行的该研究的结果的图。所呈现的数据涉及一项前瞻性非随机试验,以改进本文所述的非侵入式获取和分析方法,以在导管插入过程中使用成对的相位信号和评定的临床结果数据检测和评定显著的冠状动脉疾病(CAD)(即,≥70%的狭窄或<0.80的减少的血流速度分数)。
在所呈现的数据中,429个受试者的数据集(总共523个)被用作训练数据集,并且94个受试者的数据集被用作验证群体以评定本文所述的非侵入式获取和分析方法的灵敏度和特异性。对于候选预测器A(图21),该研究提供了0.80的ROC曲线,与血管造影结果相比,其阳性预测器值(PPV)为47%,阴性预测器值(NPV)为96%。对于候选预测器B(图22),该研究提供了0.78的ROC曲线,与血管造影结果相比,其阳性预测器值(PPV)为49%,阴性预测器值(NPV)为92%。候选预测器A和B是机器训练过程中使用的内部参数(例如训练分类器)。
与如J.Am.Coll.Cardiol.8:59(19),1719-28(2012年5月)(示出为“SPECT”)上发表的、使用单光子发射计算断层扫描、心脏磁共振和正电子发射断层扫描检测阻塞性冠状动脉疾病的非侵入式心肌灌注成像的诊断性能相比,本文所述的非侵入式获取和分析方法(示出为“cPSTA”)表现的相当好。这些解决方案在验证阶段常规地实现了大于0.7的AUC-ROC得分,与以前的人工引导方法相比表现同样好或更好。下表6示出了上述的研究与本文的研究之间的诊断性能。
已经如此描述了本公开的若干实施例,对于本领域技术人员来说显而易见的是,前述详细公开旨在仅以示例的方式呈现,而非限制性的。本文已经讨论了用于定位心脏中的异常的非侵入式方法和系统的许多优点。尽管这里没有明确说明,但是对于本领域技术人员而言,将出现各种改变、改进和修改并且其是预期的。这些改变、改进和修改旨在由此提出,并且落入本公开的精神和范围内。另外,所记载的处理元件或处理序列的顺序、或者数字、字母或其他名称的使用并不意在将所要求保护的处理限制为任何顺序,除非在权利要求中明确指定。因此,本公开仅由所附权利要求及其等同物限定。
例如,可以与示例方法和系统一起使用的相空间处理的另外的示例描述于以下文献中:申请号为62/184,796、发明名称为“Latent teratogen-induced heart deficitsare unmasked postnatally with mathematical analysis and machine learning onECG signals”的美国临时专利申请;申请号为15/192,639、发明名称为“Methods andSystems Using Mathematical Analysis and Machine Learning to Diagnose Disease”的美国专利申请;申请号为14/620,388、公开号为US2015/0216426、发明名称为“Methodand system for characterizing cardiovascular systems from single channeldata”的美国专利申请;申请号为14/596,541、授权公告号为US9,597,021、发明名称为“Noninvasive method for estimating glucose,glycosylated hemoglobin and otherblood constituents”的美国专利申请;申请号为14/077,993,公开号为US2015/0133803、发明名称为“Noninvasive electrocardiographic method for estimating mammaliancardiac chamber size and mechanical function”的美国专利申请;申请号为14/295,615、发明名称为“Noninvasive electrocardiographic method for estimatingmammalian cardiac chamber size and mechanical function”的美国专利申请;申请号为13/970,582,授权公告号为US9,408,54、发明名称为“Non-invasive method and systemfor characterizing cardiovascular systems and all-cause mortality and suddencardiac death risk”的美国专利申请;申请号为15/061,090、公开号为US2016/0183822、发明名称为“Non-invasive method and system for characterizing cardiovascularsystems”的美国专利申请;申请号为13/970,580、授权公告号为US9,289,150、发明名称为“Non-invasivemethod and system for characterizing cardiovascular systems”的美国专利申请;申请号为62/354,668、发明名称为“Method and System for Phase SpaceAnalysis to Determine Arterial Flow Characteristics”的美国专利申请;以及申请号为61/684,217、发明名称为“Non-invasive method and system for characterizingcardiovascular systems”的美国专利申请,其中每一个通过引用整体并入于此。
尽管已经结合优选实施例和具体示例描述了方法和系统,但是并不意图将范围限制于所阐述的特定实施例,因为这里的实施例在各个方面都旨在是说明性的而不是限制性。
例如,可以使用示例性方法和系统来生成狭窄和FFR输出,以与介入系统一起使用,该介入系统被配置为使用FFR/狭窄输出来确定和/或修改多个支架及其体内放置操作。
除非另有明确说明,否则决不意图将本文所述的任何方法解释为要求以特定顺序执行其步骤。因此,在方法权利要求实际上没有记载其步骤遵循的顺序的情况下,或者在权利要求或说明书中没有特别说明该步骤仅限于特定的顺序时,并不意在在任何方面推断出顺序。这适用于任何可能的非明确的解释基础,包括:关于步骤或操作流程的安排的逻辑问题;从语法组织或标点符号中得出的简单含义;说明书中描述的实施例的数量或类型。
在整个本申请中,引用了各种出版物。这些出版物的公开内容通过引用整体并入本申请中,以便更全面地描述该方法和系统所属的现有技术。
对于本领域技术人员显而易见的是各种修改和变化。
- 用于测量心肌缺血、狭窄识别、定位和血流储备分数估计的非侵入式方法和系统
- 用于测量心肌缺血、狭窄识别、定位和血流储备分数估计的非侵入式方法和系统
