微囊泡分离方法及微囊泡分离装置
文献发布时间:2023-06-19 18:32:25
技术领域
本发明涉及从生物样品中分离微囊泡的方法和微囊泡分离装置。
背景技术
微囊泡是一种从细胞中释放的膜囊泡,并且包括外泌体或胞外囊泡。来自不同细胞来源的微囊泡具有亲代细胞的特征,并且因此作为一种新的疾病诊断标志物受到关注。然而,微囊泡具有50~200nm的非常小的尺寸,使得难以提取微囊泡。
用于分离胞外囊泡的常规技术包括超速离心分离、体积排阻、免疫亲和分离、微流体芯片和聚合方法等。其中,超速离心分离是分离胞外囊泡最广泛使用的方法,并且由于其原理简单,是最可靠的分离方法。
然而,当使用这种超速离心分离来分离微囊泡时,微囊泡的产率低,并且需要大量时间来分离微囊泡(8小时或更长)。此外,超速离心分离需要提取专业人士,并且需要昂贵的设备,因此在成本方面是不利的。
体积排阻主要与超速离心分离方法一起使用,并且具有简单地提高微囊泡纯度的优点,但是由于微囊泡粘附在过滤器上,因此具有产率低的局限。
免疫亲和分离包括将抗体附着到胞外囊泡,因此可以以非常高的特异性分离特定的微囊泡。然而,存在提取效率低的局限,因为对于一般的微囊泡没有普遍可用的抗体。此外,由于抗体制备过程耗时长且成本高,因此该方案不适合实际诊断。
此外,聚合方法是向样品中加入PEG(聚乙二醇)以降低溶解度以使微囊泡沉淀的技术。该方案仍然是使用离心分离器的沉淀方法,因此检测成本昂贵,需要长的培养时间,并且沉淀物的纯度不好,因为微囊泡与蛋白质一起沉淀下来。因此,该方案不适合用于诊断。
还公开了使用电荷特性分离微囊泡的现有方案。然而,在样品如血浆中,许多血浆蛋白如纤维蛋白原具有类似于微囊泡的zeta电位。因此,据报道,仅使用等电点难以提取微囊泡。
(现有技术文献)
韩国专利申请公开第10-2005-0119128(2005年12月20日)。
发明内容
发明目的
本公开的目的是提供一种微囊泡分离方法和微囊泡分离装置,其可以在没有离心分离的情况下从生物样品快速且容易地获得微囊泡。
此外,本公开的另一目的是提供一种微囊泡分离方法和微囊泡分离装置,其可以以高分离效率分离包含在生物样品中的微囊泡,并且可以不需要额外的后处理。
技术方案
根据本发明的一个方面,本发明的实施方案包括微囊泡分离方法和微囊泡分离装置。
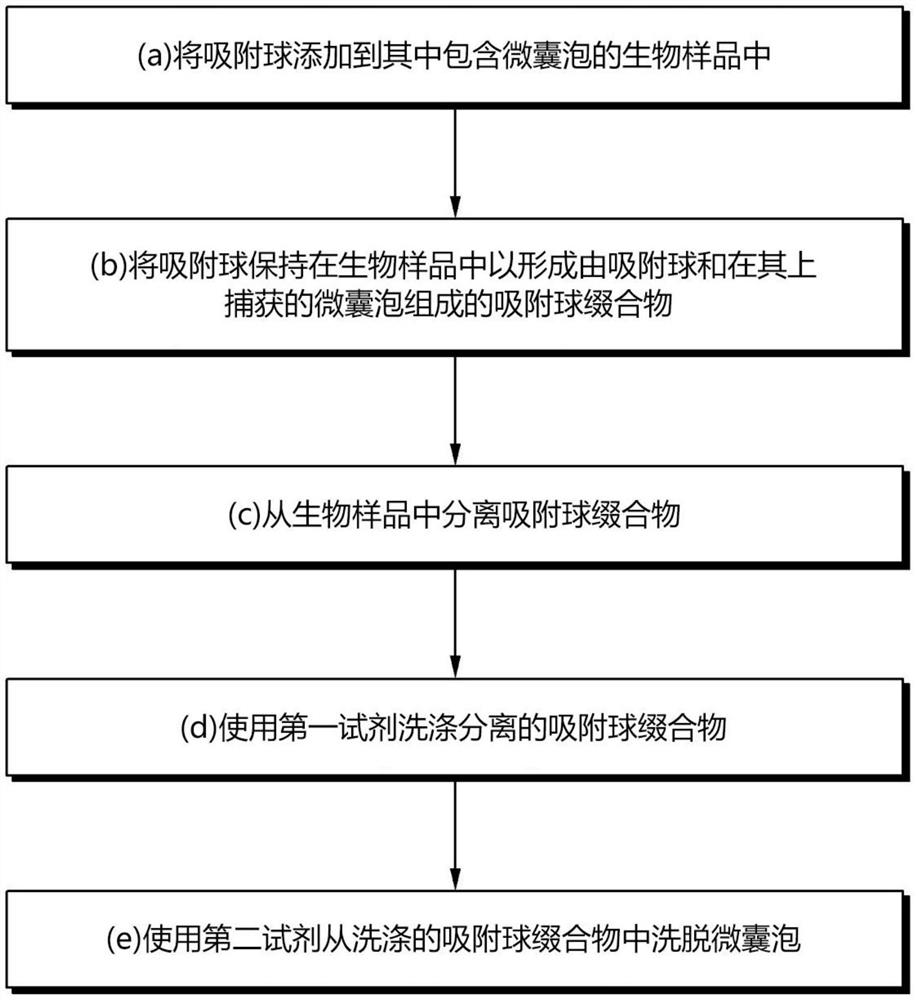
一个示例性的实施方案提供了一种微囊泡分离方法,以从样品中分离出生物样品中含有的微囊泡,该方法包括:(a)向其中含有微囊泡的生物样品中添加吸附球;(b)将吸附球保持在生物样品中以形成由吸附球和其上捕获的微囊泡组成的吸附球缀合物;(c)从生物样品中分离吸附球缀合物;(d)使用第一试剂洗涤分离的吸附球缀合物;和(e)使用第二试剂从洗涤的吸附球缀合物中洗脱微囊泡,其中吸附球包括载体和设置在载体表面上的一种或多种多价阳离子。
在示例性实施方案中,生物样品可包括血液、血浆、血清、尿液、唾液、脑脊液、眼泪、汗液、粪便、腹水、羊水、精液、乳汁、细胞培养基、组织提取物和癌组织中的至少一种。
在示例性实施方案中,载体可包括聚丙烯酸酯、聚丙烯酰胺、聚甲基丙烯酸酯、聚乙二醇、聚苯乙烯-乙烯基苯、聚苯乙烯、水凝胶、琼脂糖、陶瓷、硅胶、乳胶、金属颗粒、玻璃颗粒、磁颗粒、金属线或其上结合有磁性纳米颗粒的金属线中的至少一种。
在示例性实施方案中,多价阳离子可包括聚赖氨酸、鱼精蛋白、聚精氨酸、聚组氨酸、阳离子葡聚糖、阳离子树枝状聚合物、阳离子多糖、聚酰胺胺、聚乙烯亚胺、聚季铵、聚甲基丙烯酸-2-二甲基氨基乙酯(PDMAEMA)、聚(2-二甲基氨基甲基苯乙烯)(PDMAMS)、聚-1-乙烯基吡咯烷酮(p1-VP)、聚丙烯酸二乙基氨基乙酯(pDEAEA)、聚丙烯酸二甲基氨基乙酯(pDMAEA)、聚甲基丙烯酸二乙基氨基乙酯(pDEAMA)、脂多胺、季铵、胍、咪唑、聚苯胺、聚吡咯或壳聚糖中的至少一种。
在示例性实施方案中,载体可包括球形,并且载体的平均直径在200nm(包括200nm)至100μm(包括100μm)的范围内。
在示例性实施方案中,载体可包括多孔颗粒、多孔膜或多孔网中的至少一种。
在示例性实施方案中,载体可以包括形成在其表面上的不规则部。
在示例性实施方案中,载体可以是包含选自铁(Fe)、镍(Ni)、钴(Co)、锰(Mn)、铋(Bi)和锌(Zn)的至少一种金属或其合金,或选自该组的金属的金属氧化物或合金氧化物的磁珠。
在示例性实施方案中,载体可以包括作为其内部部分的核,以及设置成围绕核的外表面的壳,其中核包括聚丙烯酸酯、聚丙烯酰胺、聚甲基丙烯酸酯、聚乙二醇、聚苯乙烯-乙烯基苯、聚苯乙烯、水凝胶、琼脂糖、陶瓷、硅胶或乳胶中的至少一种,其中壳包含选自铁(Fe)、镍(Ni)、钴(Co)、锰(Mn)、铋(Bi)和锌(Zn)中的至少一种金属或其合金,或选自所述组的金属的金属氧化物或合金氧化物,其中多价阳离子包括聚L-赖氨酸聚合物(PLL)、鱼精蛋白、季铵、壳聚糖或聚组氨酸中的至少一种。
在示例性实施方案中,载体可以包括作为其内部部分的核和设置成围绕核的外表面的壳,其中核包含选自铁(Fe)、镍(Ni)、钴(Co)、锰(Mn)、铋(Bi)和锌(Zn)的至少一种金属或其合金,或选自所述组的金属的金属氧化物或合金氧化物,其中壳包括聚丙烯酸酯、聚丙烯酰胺、聚甲基丙烯酸酯、聚乙二醇、聚苯乙烯-乙烯基苯、聚苯乙烯、水凝胶、琼脂糖、陶瓷、硅胶或胶乳中的至少一种,其中多价阳离子包括聚-L-赖氨酸聚合物(PLL)、鱼精蛋白、季铵、壳聚糖或聚组氨酸中的至少一种。
在示例性实施方案中,在步骤(b)中,将吸附球保持在生物样品中可包括在1℃至8℃的温度下搅拌吸附球10分钟至2小时,并在50rpm至150rpm下搅拌。
在示例性实施方案中,在步骤(c)中,可以使用分离构件分离吸附球缀合物,其中分离构件包括捕获过滤器、磁分离、离心分离、基于溶解度的分离或基于颗粒尺寸的分离中的至少一种。
在示例性实施方案中,步骤(d)可以包括在第一条件下使用第一试剂洗涤其上捕获有微囊泡的吸附球,其中第一试剂包含CH
在示例性实施方案中,步骤(e)可以包括在第二条件下使用第二试剂从洗涤的吸附球缀合物洗脱微囊泡,其中第二试剂含有浓度范围为0.2M至3M的CH
在示例性实施方案中,该方法可以进一步包括:在步骤(d)中用第一试剂洗涤吸附球缀合物之后,进行第一辅助分离以分离吸附球缀合物;以及在步骤(e)中用第二试剂洗脱微囊泡之后,进行第二辅助分离以分离吸附球,其中载体被实施为具有圆形横截面的珠,并且由聚丙烯酸酯、聚丙烯酰胺、聚甲基丙烯酸酯、聚乙二醇、聚苯乙烯-乙烯基苯或聚苯乙烯中的至少一种制成,其中第一辅助分离或第二分离是使用具有尺寸为50nm至1000nm的孔的捕获过滤器来执行的。
在示例性实施方案中,该方法可以进一步包括:在步骤(d)中用第一试剂洗涤吸附球缀合物之后,进行第一辅助分离以分离吸附球缀合物;以及在步骤(e)中用第二试剂洗脱微囊泡之后,执行第二辅助分离以分离吸附球,其中载体包括磁颗粒,其中,第一辅助分离或第二辅助分离包括磁分离以使电流在电磁体中流动以产生磁力或使用磁体。
在示例性实施方案中,该方法还可以包括在向其中添加吸附球之前预处理生物样品,其中生物样品的预处理包括过滤生物样品,从而从生物样品中分离出平均直径为0.8μm或更大的物质。
在示例性实施方案中,微囊泡可以通过静电相互作用或插层中的至少一种耦合到吸附球,其中吸附球缀合物的zeta电位在0.5mV至10mV的范围内。
在示例性实施方案中,捕获到吸附球上的每个微囊泡可以具有在20nm至800nm范围内的平均直径,其中多价阳离子包括聚-L-赖氨酸聚合物(PLL)、鱼精蛋白、季铵、壳聚糖或聚组氨酸中的至少一种。
本发明的另一示例性实施方案提供了一种用于微囊泡分离的试剂盒,该试剂盒被配置为分离包含在生物样品中的微囊泡,该试剂包包括:一个或多个具有与微囊泡结合能力的吸附球;包含CH
在示例性实施方案中,该试剂盒可进一步包括分离构件,其用于分离吸附球或具有在表面上捕获的微囊泡的吸附球,其中分离构件包括捕获过滤器、磁分离、离心分离、基于溶解度的分离或基于颗粒尺寸的分离中的至少一种。
在示例性实施方案中,载体可以实施为具有圆形横截面的珠,并且由聚丙烯酸酯、聚丙烯酰胺、聚甲基丙烯酸酯、聚乙二醇、聚苯乙烯-乙烯基苯或聚苯乙烯中的至少一种制成,其中多价阳离子包括聚-L-赖氨酸聚合物(PLL)、鱼精蛋白、季铵、壳聚糖或聚组氨酸中的至少之一,其中分离构件包括具有尺寸为50nm至1000nm的孔的捕获过滤器。
在示例性实施方案中,载体包括磁颗粒,其中多价阳离子包括聚-L-赖氨酸聚合物(PLL)、鱼精蛋白、季铵、壳聚糖或聚组氨酸中的至少一种,其中,分离构件使用使电流在电磁体中流动以产生磁力的装置或使用磁体进行磁分离。
有益效果
根据本公开,微囊泡分离方法和微囊泡分离装置可以在短时间内以高产率和高纯度从生物样品中分离微囊泡,而无需使用离心分离中所需的昂贵设备,因此可以有效地用于其中不能放置例如离心分离装置的大型装置的现场诊断。
此外,本公开可以提供微囊泡分离方法和微囊泡分离装置,其可以在使用小体积的生物样品的同时以非常高的纯度分离微囊泡。
附图说明
图1为显示根据本公开的实施方案的微囊泡分离方法的流程图。
图2为示意性示出根据本公开的实施方案的吸附球的图。
图3a为示意性示出根据本公开的另一实施方案的吸附球的图。
图3b为示意性示出根据本公开的又一实施方案的载体的图。
图4示意性示出了根据发明实施例1的微囊泡分离方法。
图5示出了根据发明实施例1的使用PLL-珠和没有结合阳离子聚合物的珠的裸珠来鉴定胞外囊泡的分离能力的结果。
图6为示意性示出发明实施例1的PLL-珠是如何制备的图。
图7示出了以根据图6的方式制备的PLL-珠的荧光图像。
图8示出了使用发明实施例1基于各种第一试剂鉴定性能的结果。
图9示出了使用发明实施例1基于添加了盐的第一试剂鉴定性能的结果。
图10示出了使用发明实施例1基于各种第二试剂鉴定性能的结果。
图11为示出基于第一试剂类型的与第二试剂中所含颗粒和蛋白质相关的纯度的图。
图12示出了评估常规离心分离方法和根据本公开的发明实施例1的分离方法的结果。
图13为示意性示出根据发明实施例2的微囊泡分离方法的图。
图14示出了基于PLL浓度、孵育温度和孵育时间评估PLL磁珠性能的结果。
图15示出了基于PLL磁珠尺寸评估胞外囊泡分离能力的结果。
图16示出了根据发明实施例2和对比例2的各自的SEM图像、荧光图像和冷冻TEM图像。
图17示出了根据发明实施例2孵育后鉴定zeta电位和体积变化的结果。
图18示出了发明实施例2和对比例2至对比例4的各自的NTA和BCA分析结果。
图19示出了根据发明实施例2和发明实施例3各自的第一试剂的NTA和BCA的分析结果。
图20示出了发明实施例2和对比例2至对比例4各自的蛋白质印迹结果。
图21示出了使用发明实施例2和对比例2至对比例4中的各自的生物分析仪的性能评估结果,以及使用发明实施例2和对比例2至对比例4的各自的RT-qPCR的外泌体miRNA测量结果。
图22示出了使用发明实施例2和发明实施例3各自的RT-qPCR的外泌体miRNA测量结果。
图23为使用根据发明实施例2和对比例2至对比例4各自的微阵列描述基因表达的图。
图24是使用发明实施例3的微阵列的结果。
图25示出了在发明实施例2中使用第一试剂的步骤(a)和使用第二试剂的步骤(b)中的性能评估结果。
具体实施方式
其它示例性实施方案的具体细节包括在详细描述和附图中。
本申请的优点和特点,以及实现这些优点和特点的方法,在参考下面与附图一起详细描述的实施方案后将变得明显。然而,本发明并不局限于以下公开的实施方案,并且可以以各种不同的形式实施,除非在以下描述中另有规定,否则本发明中表达成分、反应条件和成分含量的所有数字、数值和/或表达方式都应理解为在所有情况下都被术语“约”所修饰,因为这些数字本身就是近似值,反映了在获得这些数值时遇到的各种测量不确定性等。此外,当本说明书中公开了一个数字范围时,该数字范围是连续的,除非另有说明,否则包括直到最大值的每个值,其中包括数字范围的最小值到最大值。此外,当数字范围指的是整数时,除非另有说明,否则整数包括到最大值的每个整数,该数字范围包括最小值到最大值。
此外,将理解,在本发明中,当为变量描述范围时,变量包括所描述范围中的所有值,包括该范围中描述的端点。应当理解,例如,范围“5到10”不仅包括5、6、7、8、9和10的值,还包括6到10、7到10、6到9、7到9等的任何子范围,并且还包括所述范围内的适当整数之间的任何值,例如5.5、6.5、7.5、5.5到8.5和6.5到9。应当理解,例如,“10%至30%”的范围不仅包括所有整数,包括10%、11%、12%、13%等的值以及至多30%的值,还包括10%至15%、12%至18%、20%至30%等的任何子范围,并且还包括所述范围内的适当整数之间的任何值,例如10.5%、15.5%和25.5%。
在本公开中,术语“微囊泡”与从古细菌、原核生物或真核生物的细胞膜释放的胞外囊泡同义使用。在本公开中,微囊泡可以包括外泌体、阿尔戈体(argosome)、树突状细胞源体(dexosomes)、核外颗粒体(ectosomes)、外囊泡(exovesicle)、癌小体(oncosome)、前体(prominosome)、前列腺小体(prostasome)、耐受体(tolerosome)、微粒、纳米泡囊、起泡泡囊、出芽泡囊、外泌体状泡囊、基质泡囊、膜泡囊、脱落泡囊、膜颗粒、脱落微囊泡、膜泡、附睾体(epididimosome,)、凸素体(promininosome)、外泌体(texosome)或古细菌脂质体(archeosome)。然而,本公开不限于此。此外,除非本公开中另有规定,胞外囊泡和外泌体可与微囊泡互换使用,而不论其大小。
图1为显示根据本公开的实施方案的微囊泡分离方法的流程图。图2为示意性示出根据本公开的实施方案的吸附球的图。图3a为示意性示出根据本公开的另一实施方案的吸附球的图。图3b为示意性示出根据本公开的又一实施方案的载体的图。
参考图1,本公开的实施方案涉及一种微囊泡分离方法,该方法分离包含在生物样品中的微囊泡,该方法可以包括(a)向包含微囊泡的生物样品中添加吸附球;(b)将吸附球保持在生物样品中以形成由吸附球和由吸附球捕获的微囊泡组成的吸附球缀合物;(c)从生物样品中分离吸附球缀合物;(d)使用第一试剂洗涤分离的吸附球缀合物;和(e)使用第二试剂从洗涤的吸附球缀合物中洗脱微囊泡。吸附球可包括载体和设置在载体表面上的一种或多种多价阳离子。
在步骤(a)中,可以将吸附球添加到生物样品中。生物样品可以包括含有微囊泡的生物样品、细胞培养基、组织样品等。具体地,生物样品可包括血液、血浆、血清、尿液、唾液、脑脊液、眼泪、汗液、粪便、腹水、羊水、精液、乳汁、细胞培养基、组织提取物和癌组织中的至少一种。
步骤(a)还可以包括制备吸附球。吸附球100可以包括载体110和耦合到载体110的外表面的多价阳离子120。具体地,吸附球100可以包括在其表面上具有反应性基团或具有反应性的官能团的载体110,以及具有与载体110的反应性基团或者官能团发生化学反应的基团的多价阳离子120。
载体110可包括聚丙烯酸酯、聚丙烯酰胺、聚甲基丙烯酸酯、聚乙二醇、聚苯乙烯-乙烯基苯、聚苯乙烯、水凝胶、琼脂糖、陶瓷、硅胶、乳胶、金属颗粒、玻璃颗粒、磁颗粒、金属线和其上结合有磁性纳米颗粒的金属线中的至少一种。
多价阳离子120可包括聚赖氨酸、聚精氨酸、聚组氨酸、鱼精蛋白、阳离子葡聚糖、阳离子树枝状聚合物、阳离子多糖、聚酰胺胺、聚乙烯亚胺、聚季铵、聚甲基丙烯酸-2-二甲基氨基乙酯(PDMAEMA)、聚(2-二甲基氨基甲基苯乙烯)(PDMAMS)、聚-1-乙烯基吡咯烷酮(p1-VP)、聚丙烯酸二乙基氨基乙酯(pDEAEA)、聚丙烯酸二甲基氨基乙酯(pDMAEA)和聚甲基丙烯酸二乙基氨基乙酯(pDEAMA)中的至少一种。此外,多价阳离子可以包括脂多胺、季铵、胍、咪唑、聚苯胺、聚吡咯和壳聚糖中的至少一种。
具体地,载体110可以以本身具有官能团的聚合物的形式存在,或者以具有通过等离子体处理或通过使用具有官能团的聚合物进行表面包覆等引入到其上的官能团的聚合物形式存在。
更具体地,载体110可以以水凝胶的形式存在,由于水凝胶的多孔性质,可整体增加吸附球的表面积。因此,水凝胶形式的载体110可以具有增加的与微囊泡接触的面积,使得载体110可以具有进一步提高的微囊泡的捕获能力。
例如,当载体110由聚丙烯酸酯、聚丙烯酰胺、聚甲基丙烯酸酯、聚乙二醇等制成并因此具有反应性基团或官能团时,聚丙烯酸酯、聚丙烯酰胺、聚甲基丙烯酸酯、聚乙二醇等可本身用作载体。此外,当载体本身包含金属颗粒、玻璃颗粒、磁颗粒等并且因此不具有反应性基团或官能团时,可以使用具有反应性基团或官能团的物质对金属颗粒、玻璃颗粒、磁颗粒等进行表面处理或表面包覆。
多价阳离子120可以与载体110化学结合,并且可以覆盖载体110的表面的至少一部分。由于多价阳离子,吸附球100具有正电荷。
具体地,载体110可以具有球形形状。载体110的平均直径可以在200nm至100μm的范围内,特别是在500nm至3μm的范围内。
根据本公开,表面积的大小与珠直径的平方成反比。因此,随着载体110的尺寸变小,形成由吸附球和吸附球捕获的微囊泡组成的吸附球缀合物的效率提高。然而,为了在从吸附球缀合物分离微囊泡之后有效地收集吸附球,载体的平均直径可以在如上所述的范围内。
此外,吸附球100应有效地捕获生物样品中包含的各种物质中的微囊泡。为了尽可能防止生物样品中所含的除微囊泡以外的其它蛋白质粘附到吸附球100上,并且为了有效地捕获具有预定尺寸的微囊泡,载体的平均直径可以优选在500nm至3μm的范围内。
在一个实施方案中,载体110可以包括珠型塑料(例如,聚苯乙烯)或具有用羧基或胺基官能化的表面的珠型金属(例如,铁(Fe))。多价阳离子120可以包括阳离子聚合物。
在另一实施方案中,载体110可以是透明质酸微珠。吸附球100可以包括其中多价阳离子120结合到透明质酸微珠表面的结构。当以这种方式将透明质酸微珠用作载体时,将阳离子聚合物和透明质酸水溶液彼此混合,然后向混合物中加入弱酸性水溶液,并对混合物进行电纺丝以制备透明质酸微球(参见韩国专利第10-1212258号)。
在另一实施方案中,载体可包括多孔颗粒、膜或网中的至少一种。膜或网的孔径可以在200nm至100μm的范围内。优选地,孔的尺寸可以在500nm至2μm的范围内。膜或网可以由塑料材料、多种金属材料或具有磁性的材料制成。然而,本公开不限于此。
或者,可以在载体的表面上形成不平坦。由于在载体表面上形成的不平坦增加了载体的表面积,这可以提高对多价阳离子的结合力。此外,在包括载体和设置在载体表面上的多价阳离子的吸附球中,在载体表面形成的不平坦图案可以基本上类似地转移到多价阳离子,使得也可以增加吸附球的整体表面积。结果,吸附球可捕获微囊泡的面积增加。微囊泡可以通过静电吸引耦合到作为吸附球表面的多价阳离子,同时可以固定地插入由吸附球的表面的不平坦限定的内部窄间隙中。以这种方式,微囊泡可以被吸附球捕获。因此,微囊泡可以更牢固地被吸附球捕获。
在本公开的一个实施方案中,多价阳离子120可以包括分子量为150至300kDa的聚-L-赖氨酸聚合物(PLL)、鱼精蛋白、季铵、壳聚糖和聚组氨酸中的至少一种。载体110可以包括具有羧基的聚苯乙烯。
例如,吸附球100可以以0.5mg/mL至20mg/mL、或1mg/mL至20mg/mL、或3mg/mL至20mg/mL、或5mg/mL至20mmg/mL、或0.5mg/mL至18mg/mL、或者0.5mg/mL至15mg/mL、以及1mg/mL至15mg/mL的浓度包含在生物样品中。具体地,吸附球100可以以5mg/mL至15mg/mL的浓度包含在生物样品中。
当吸附球100过量地包含在生物样品中时,比微囊泡小的更高含量的蛋白质可能包含在形成于吸附球100之间的间隙中,而不是在吸附球100的表面上。因此,微囊泡的捕获能力可能下降。当吸附球100的含量太低时,其上的微囊泡的吸附效率低。
此外,载体110可以是包含选自铁(Fe)、镍(Ni)、钴(Co)、锰(Mn)、铋(Bi)和锌(Zn)中的一种或多种金属和其合金,或选自该组的金属的金属氧化物或合金氧化物的磁珠。
当载体110是磁珠时,多价阳离子可以包覆在载体的表面上。在这方面,可以使用等离子体处理、电子束处理等对载体100的表面进行改性。例如,载体100可以被输入到产生等离子体的腔室中,然后可以用具有预定能量的等离子体处理,使得正离子、负离子、电子等存在于载体100的表面上,或者可以将官能团或反应基团设置在其上。或者,当使用更强的能量(例如电子束)对载体100的表面进行表面处理时,可在载体100表面上形成不规则(irregularities)。当载体100的表面被等离子体处理时,这可以提高对多价阳离子的结合力。当在载体100的表面上形成不平坦或不规则以增加与多价阳离子结合的表面积时,载体100可以更有效地与多价阳离子结合。
可替换地,当载体100是磁珠时,其表面可以被改性为具有正电荷(+)。具体地,磁珠的表面可以用二氧化硅包覆,然后可以用带正电荷的官能团改性二氧化硅表面,例如,胺基,如3-氨基丙基、氨基甲基、2-氨基乙基、N-甲基-3-氨基丙基、N-(2-氨基乙基)-3-氨基丙基、N-氨基乙基-3-氨基丙基或N,N-二(2-氨基乙基)-3-氨基丙基。
可替换地,如图3a所示,载体210可以通过缠绕一根或多根线材(例如金属线或磁性线)来形成。在这方面,可以在缠绕一根或多根线材之前对线材的表面进行表面处理。或者,在缠绕一根或多根线材之前,可以将纳米尺寸的磁性纳米颗粒附着到线材的表面上。在通过将一根或多根线材缠绕成近似圆形而形成载体210之后,多价阳离子220可以包覆在载体的表面上以制备吸附球200。
此外,可选地,载体310可以包括核311和设置成围绕核311的外表面的壳312。
在这方面,当核311由聚丙烯酸酯、聚丙烯酰胺、聚甲基丙烯酸酯、聚乙二醇、聚苯乙烯乙烯基苯、聚苯乙烯、水凝胶、琼脂糖、陶瓷、硅胶和胶乳中的至少一种制成时,壳312可以由选自铁(Fe)、镍(Ni)、钴(Co)、锰(Mn)、铋(Bi)和锌(Zn)中的一种或多种金属或其合金,或选自其中的金属的金属氧化物或合金氧化物制成。
此外,核311可以由选自铁(Fe)、镍(Ni)、钴(Co)、锰(Mn)、铋(Bi)和锌(Zn)中的至少一种金属或其合金,或选自该组的金属的金属氧化物或合金氧化物制成。壳312可以由聚丙烯酸酯、聚丙烯酰胺、聚甲基丙烯酸酯、聚乙二醇、聚苯乙烯乙烯基苯、聚苯乙烯、水凝胶、琼脂糖、陶瓷、硅胶和胶乳中的至少一种制成。
如上所述,核311和形成为围绕核311的外表面的壳312可以由不同的材料制成。在这方面,核311或壳312中的至少一个可以由经由磁分离而分离的材料制成。在这方面,可以通过使电流流过电磁体或使用磁体来执行磁分离。
核311和壳312中各自的材料可以根据生物样品的类型、待从生物样品捕获的微囊泡的特性等而不同地选择。
多价阳离子320包括聚-L-赖氨酸聚合物(PLL)、鱼精蛋白、季铵、壳聚糖和聚组氨酸中的至少一种。可以提供多价阳离子320以包覆壳312的至少一部分以形成吸附球300。
在步骤(b)中,将吸附球保持在生物样品中以形成吸附球缀合物,其中吸附球和微囊泡彼此结合。由于多价阳离子,吸附球可能具有正(+)电荷,而微囊泡可能具有负(-)电荷。因此,微囊泡可以通过静电相互作用和插层中的至少一种耦合到吸附球上。吸附球缀合物的zeta电位可以在0.5mV至10mV的范围内。
吸附球和微囊泡分别具有(+)和(-)电荷,因此彼此结合。在这方面,当吸附球缀合物的zeta电位低于0.5mV时,微囊泡没有被吸附球有效地捕获,并且在用下述第二试剂洗脱之前,大量的微囊泡丢失,使得微囊泡的分离能力降低。相反,当吸附球缀合物的zeta电位超过10mV时,难以用第二试剂洗脱微囊泡。具体而言,吸附球缀合物的zeta电位可以在1mV至10mV、或5mV至10mV、或0.5mV至7mV、或0.5mV至5mV的范围内。
此外,吸附球可具有10mV至30mV、或15mV至30mV、或17mV至30mV,或20mV至30mW、或10mV至27mV、或10mV至25mV、或12mV至25mV,或15mV至25mV、或者17mV至25mV,或者20mV至25mV的zeta电位。吸附球可具有上述范围内的zeta电位,从而更有效地捕获生物样品中的微囊泡。
每个微囊泡的大小在纳米量级。因此,使用体积排阻法从生物样品中分离微囊泡是不容易的。然而,在根据本发明的实施方案的微囊泡分离方法中,微囊泡通过正离子和负离子之间的吸引被吸附球捕获,然后从中分离。在这方面,将吸附球的zeta电位和吸附球缀合物的zeta电位均控制在上述限定的范围内可以允许从生物样品中有效地分离微囊泡。
更具体地,由吸附球捕获的各微囊泡的平均直径为0.5nm至1μm。多价阳离子可包括聚-L-赖氨酸聚合物(PLL),以及载体可包括具有羧基的聚苯乙烯。更具体地,由吸附球捕获的各微囊泡的尺寸可以在1nm至1μm、或10nm至1μm、或50nm至1μm的范围内。
在步骤(b)中,将吸附球保持在生物样品中可包括在1℃至8℃的温度下,和以50rpm至150rpm搅拌生物样品中的吸附球10分钟至2小时。
在步骤(b)中,搅拌温度可以在1℃至8℃的范围内。当温度低于1℃时,可能会出现生物样品冻结等问题。当温度超过8℃时,生物样品中包含的诸如微囊泡和蛋白质等物质的流动性很高,这可能会阻止微囊泡被吸附球捕获。具体而言,温度可以在2℃至8℃,或3℃至8℃,或1℃至7℃,或1℃至6℃,或1℃至5℃,或2℃至7℃,或3℃至6℃的范围内。更具体地,温度可以在3.5℃至4.5℃的范围内。上述温度范围使充当除微囊泡之外的杂质的蛋白质稳定,从而抑制了蛋白质的流动性,使得微囊泡可以更有效地被吸附球捕获。
在步骤(b)中,可以以50rpm至150rpm的搅拌速度和10分钟至2小时的搅拌持续时间进行搅拌。当搅拌速度低于50rpm时,微囊泡不均匀地吸附在吸附球上,并且其中一些可能聚集。当搅拌速度高于150rpm时,微囊泡可能不能稳定地耦合到吸附球的表面上。具体地,搅拌速度可以在70rpm至150rpm、或100rpm至150rpm、或50rpm至170rpm、或50rpm至160rpm、或70rpm至100rpm的范围内。
搅拌持续时间可以在10分钟至2小时的范围内。当持续时间小于10分钟时,微囊泡很难被吸附球充分捕获。当持续时间超过2小时时,不必要地增加微囊泡分离时间。具体地,搅拌持续时间可以在30分钟至2小时、或50分钟至2小时、或1小时至2小时,或10分钟至1.5小时、或10分钟至1小时、或10分钟至50分钟,或20分钟至50分钟的范围内。
与常规使用的方法(例如免疫亲和分离方法)中所需的持续时间相比,形成吸附球缀合物所需的持续时间可以显著减少。
步骤(c)可以从生物样品中分离吸附球缀合物。吸附球缀合物可以具有其中微囊泡结合到吸附球的表面上的结构。
在步骤(c)中,使用分离构件分离吸附球缀合物。分离构件可以采用捕获过滤器、磁分离、离心分离、溶解度分离和基于颗粒尺寸的分离中的至少一种。
例如,当分离构件是捕获过滤器时,捕获过滤器可以是具有尺寸在50nm至1000nm、或100nm至500nm、或150nm至300nm范围内的孔的膜。当捕获过滤器的孔的尺寸在上述范围内时,可以使用捕获过滤器从生物样品中分离吸附球缀合物。
吸附球缀合物以如下方式穿过捕获过滤器:生物样品通过重力或负压穿过捕获过滤器,同时捕获过滤器安装在包含吸附球缀合物和生物样品的反应器、提取管等内。此外,生物样品通过重力或负压穿过捕获过滤器,同时捕获过滤器安装在包含吸附球缀合物和生物样品的反应器、提取管等之外,使得捕获过滤器邻近反应器、提取管等的出口。
例如,捕获过滤器可以由亲水材料或阳离子交换树脂制成,使得具有电荷(+)的吸附球缀合物更容易被捕获过滤器捕获。
当捕获过滤器由亲水材料制成时,吸附球缀合物可以容易地捕集在孔中,并可被过滤器物理捕获。亲水材料可包括银金属、聚醚砜、玻璃纤维、聚碳酸酯径迹蚀刻(PCTE)、聚酯、混合纤维素酯(MCE)、尼龙、乙酸纤维素或其组合。
当捕获过滤器由阳离子交换树脂制成时,吸附球缀合物在电力下被吸附到带负电的捕获过滤器的表面。阳离子交换树脂可以包括羧甲基、甲基磺酸盐、磺酰基或其组合。
具体地,捕获过滤器可以具有这样的结构,使得吸附球缀合物通过电力被具有负电荷的阳离子交换树脂捕获。
在本公开的实施方案中,可以使用孔径为约220nm的注射器过滤器过滤微囊泡聚集体。
此外,分离构件可以包括磁分离。载体可以包括磁颗粒。可以使用使电流在电磁体中流动的装置或使用磁体来分离吸附球缀合物。
具体地,当使用电磁体时,吸附球缀合物被电磁波保持,因此其运动受到限制。此外,当使用磁体时,磁体可以放置在预定位置,然后,吸附球缀合物可以固定到磁体上,然后可以与生物样品分离。磁体可以设置在其中接收生物样品和吸附球的反应器的内部和/或外部。为了防止吸附球附着到反应器的内壁上或沉降到反应器底部,磁体可以以可旋转叶轮的形式设置。
在步骤(d)中,可以在第一条件下使用第一试剂洗涤在步骤(c)中分离的吸附球缀合物。第一试剂从吸附球分离杂质,例如被捕获在吸附球缀合物表面上的除微囊泡以外的物质,例如具有负电荷的蛋白质,从而提高最终分离的微囊泡的纯度。
第一试剂包括离液物质(离液盐)、蛋白酶、CH
此外,第一试剂的浓度可以在0.1至4.5M、0.5至4M和1至3M的范围内。可以提供第一试剂,使得当第一试剂被多次使用时,第一试剂浓度可以逐渐降低。
离液物质是指将水溶液中的水分子的货物结构(cargo structure)去稳定化或破坏的物质或离子。由于向水溶液中添加离液物质,水的熵增加,从而影响蛋白质之间的力、氢键、范德华力或疏水键,从而使其分子结构不稳定。
离液物质可包括包含胍离子的盐,例如异硫氰酸胍、硫氰酸胍或氯化胍、或盐酸胍;正丁醇、乙醇、高氯酸锂、乙酸锂、氯化镁、苯酚、2-丙醇、十二烷基硫酸钠、硫脲、脲或其组合。然而,本公开不限于此。
蛋白酶可包括蛋白酶K、胃蛋白酶、胰蛋白酶或胰凝乳蛋白酶。
第一试剂可以允许微囊泡附着到吸附球缀合物中的吸附球的状态,并且可以使除微囊泡之外的其它物质与吸附球分离。提供第一试剂以维持微囊泡和吸附球之间的结合力,但将除微囊泡之外的其它物质与吸附球分离。
第一条件可以包括pH5.5至6.5和pH7.5至9.5中的一个,并且pH应当在上述范围内,使得例如蛋白质的杂质可以容易地从吸附球缀合物中分离,并且可以防止例如分离的蛋白质的杂质再吸附到吸附球上。
具体地,第一试剂可以包括浓度为2M的硫氰酸胍。
或者,第一试剂可以不包含离液物质。此外,第一试剂可以具有酸性或中性pH,例如pH为3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5或9.0。第一试剂可以使用一次或多次。当多次使用第一试剂时,分别多次使用的第一试剂可以在pH5.5至6.5和pH7.5至9.5之一的pH范围内具有相同或不同的pH值。例如,分别使用多次的第一试剂的pH值可以逐渐降低或增加。
例如,第一次使用的第一试剂的pH值可以保持在低范围内,以在短时间内从吸附球缀合物中分离出例如蛋白质的杂质。然后,在第二次使用的第一试剂的pH值可以高于所述低范围,从而可以防止例如分离的蛋白质之类的杂质再次吸附到吸附球上。具体地,在第一次使用的第一试剂的pH值可以是在3(包括3)至7(不包括7)的范围内的酸性,以及在第二次使用的第一试剂的pH可以是在7(不包括7)到12的范围内的碱性。具体地,第一次使用的第一试剂的pH值可以在3至6、或3至5或3至4.5的范围内。第二次使用的第一试剂的pH可以在7.5至12、或8至11、或9至10的范围内。此外,可以在如在3(包括3)到7(不包括7)的范围内的第一次所使用的第一试剂的pH值进行一次或多次洗涤。此外,可以在如在7到12(不包括12)的范围内的第二次所使用的第一试剂的pH值进行一次或多次洗涤。
在一个实例中,第一试剂可以使用两次或更多次。当第一试剂使用两次或更多次时,第一次使用的第一试剂的pH值可以在5.5至6.5的范围内,第二次使用的(如果有的话,第三次使用的…)第一试剂的pH值可以在5.5到6.5的范围内。此外,可选地,当第一试剂使用两次或更多次时,第一次使用的第一试剂的pH可以在5.5至6.5的范围内,第二次使用的(如果有的话,第三次使用的…)第二试剂的pH可以在7.5至9.5的范围内。
在第一种情况下,温度可以在3℃至30℃、或4℃至30℃、或5℃至30℃、或10℃至30℃、或15℃至30℃、或20℃至30℃或室温范围内。
在第一条件下,持续时间可以在5秒至24小时的范围内。然而,本公开不限于此,并且可以对持续时间进行各种改变。
在本公开的一个实施方案中,pH为6或8.5的0至10mM的NaCl溶液可用作第一试剂。在另一实施方案中,可以依次使用pH6.0、8.5和13的第一试剂。
当第一试剂的pH逐渐改变时,与微囊泡聚集的阴离子蛋白质的等电点特性可以改变,使得例如蛋白质之类的杂质可以从吸附球缀合物中分离出来并可以被洗掉。在这方面,微囊泡具有比大多数蛋白质更强的负电荷。因此,即使当第一试剂是酸性的(例如,pH4.0),微囊泡也保持不变,同时不与吸附球缀合物分离。
第一试剂可包括可有效洗涤杂质的合适的盐。在一个实施方案中,盐可以包括浓度低于50mM的CH
在步骤(e)中,可以在第二条件下使用第二试剂从洗涤的吸附球缀合物中洗脱微囊泡。
第二试剂包括浓度为0.2M至3M范围的离液物质(离液盐)、蛋白酶、CH
在步骤(e)中,吸附球和微囊泡可以在从吸附球缀合物中除去例如蛋白质的杂质的状态下彼此分离。第二试剂可以消除吸附球缀合物中的微囊泡和吸附球之间的电结合力,从而使微囊泡与吸附球分离。
通常为了分离微囊泡,使用昂贵且大体积的装置,例如离心分离装置。使用该装置分离微囊泡需要很长时间。此外,使用该装置很难以高纯度分离微囊泡。
相反,在该实施方案中,可以使用吸附球和适当控制的第一试剂和第二试剂。具体地,吸附球和微囊泡可以彼此结合成吸附球缀合物,然后缀合物可以从生物样品中分离,然后只有微囊泡可以以高纯度从吸附球缀合物中有效分离。此外,该实施方案不需要例如离心分离装置的大型装置,而是可以在外部相对简单地执行该方法。根据本公开的分离装置可以用作用于各种目的的诊断试剂盒,而没有空间和时间限制。
第二试剂和第一试剂可以由相同物质或不同物质制成。在这方面,第二试剂和第一试剂的pH值或浓度值可以彼此不同。
具体地,第一试剂可以包括离液物质或蛋白酶,而第二试剂可以包括离液物质或蛋白酶,其中第二试剂中的离液物质或者蛋白酶的浓度可以高于第一试剂中的离液物质或者蛋白酶的浓度。
在一个实施方案中,当第一试剂由离液物质制成时,第二试剂可以由离液物质制成。当相同的离液物质用于第一试剂和第二试剂时,第一试剂中离液物质的浓度可以低于第二试剂中离液物质的浓度。例如,第一试剂中离液物质的浓度可以在0.1至4.5M、或0.5至4M、或1至3M的范围内,而第二试剂中离液物质浓度可以在4.5M(不含4.5M)至15M,或4.5M(不含4.5M)至10M,或4.5M(不含4.5M)至8M,或4.5M(不含4.5M)至6M的范围内。具体地,第一试剂中离液物质的浓度可以在1.5M至3M的范围内,而第二试剂中离液物质的浓度可以在4M至7M的范围内。
当第一试剂和第二试剂由相同的离液物质制成时,第二试剂可以进一步包括胍离子,而第一试剂可以不含胍离子。此外,第二试剂可以包含浓度高于第一试剂中离液物质浓度的离液物质。
或者,第二试剂可以包含除离液物质之外的物质。即使当第二试剂具有可能改变微囊泡的等电点的pH值时,微囊泡也可能无法与吸附球很好地分离。在这方面,可以通过向第二试剂中添加单独的盐来提高微囊泡的分离能力。
单独的盐可以包含浓度为100mM至5M的CH
此外,第二试剂可包含一价阳离子,如NH
以相同的方式,盐可以包含在第一试剂中。在此方面,盐可以以0.1M或更高、0.25M或更高、0.5M或更,或0.75M或更高至5M或更低,或4M或更低的范围内的浓度包含在其中。具体地,第二试剂可以包含1M、2M、3M或4M的NaCl。在一个实施方案中,第二试剂可以具有4至9的pH值。
第二试剂引起离子交换,其中多种阴离子在吸附球和微囊泡之间交换。
从步骤(a)到步骤(e)的过程在短时间内完成,并产生高收率和高纯度。在一个实施方案中,从步骤(a)到步骤(e)的过程可以在少于60分钟,优选少于45分钟,更优选少于30分钟,最优选少于20分钟内完成。
在本公开的另一实施方案中,微囊泡分离方法可以进一步包括第一辅助分离,其用于在步骤(d)中用第一试剂洗涤吸附球缀合物之后分离吸附球缀合物;以及第二辅助分离,其用于在步骤(e)中用第二试剂洗脱微囊泡之后分离吸附球。
当载体被实施为具有圆形横截面的珠并由聚丙烯酸酯、聚丙烯酰胺、聚甲基丙烯酸酯、聚乙二醇、聚苯乙烯乙烯基苯和聚苯乙烯中的至少一种制成时,第一辅助分离或第二辅助分离可使用孔径为50nm至1000nm的捕获过滤器和具有50nm或更小尺寸的孔的多孔阴离子颗粒中的至少一种进行。
在步骤(d)中,可以用第一试剂洗涤和分离除微囊泡之外的如蛋白质的杂质。然后,可以对已经去除了杂质的吸附球缀合物进行第一辅助分离,该第一辅助分离可以使用捕获过滤器等来执行。当捕获过滤器用于第一辅助分离时,可以通过使具有负电荷的缓冲溶液穿过捕获过滤器来从捕获过滤器分离吸附球缀合物。在一个实例中,缓冲溶液可以包含含有Ca
可以执行第二辅助分离以在从吸附球分离微囊泡之后进一步从微囊泡中去除残留杂质。例如,可以执行第二辅助分离以进一步提高微囊泡的纯度,从而可以从中去除在步骤(d)中不能去除的杂质,例如纤维蛋白原(当生物样品是例如血浆时)等。
第二辅助分离可以使用多孔阴离子颗粒进行。多孔阴离子颗粒可在其上吸附尺寸小于其孔径的蛋白质杂质(例如,纤维蛋白原等),并可从微囊泡中去除蛋白质杂质。在一个实施方案中,多孔阴离子颗粒的各孔的尺寸可以小于50nm。
当载体被实施为磁颗粒时,第一辅助分离或第二辅助分离可以包括使电流在电磁体中流动或者使用磁体的磁分离。
在本公开的另一方面,微囊泡分离方法可进一步包括在向其中添加吸附球之前预处理生物样品。生物样品的预处理可包括过滤生物样品,以便从生物样品中分离出平均直径为0.8μm或更大的物质。
当在将吸附球添加到生物样品之前预先过滤生物样品以从中去除平均直径为0.8μm或更大的物质时,吸附球可以更容易地捕获生物样品中的微囊泡。
根据本公开的另一方面,可以提供用于从生物样品分离微囊泡的微囊泡分离的试剂盒。
分离包含在生物样品中的微囊泡的用于微囊泡分离的试剂盒可以包括:一个或多个具有与微囊泡结合能力的吸附球;第一试剂,其包含SO
试剂盒可进一步包括用于分离吸附球或具有其上捕获的微囊泡的吸附球的分离构件。分离构件可以包括捕获过滤器、磁分离、离心分离、基于溶解度的分离和基于颗粒尺寸的分离中的至少一种。
载体可以实施为具有圆形横截面的珠,并且由聚丙烯酸酯、聚丙烯酰胺、聚甲基丙烯酸酯、聚乙二醇、聚苯乙烯乙烯基苯和聚苯乙烯中的至少一种制成。在此方面,设置在载体表面上的多价阳离子可包括聚赖氨酸、聚精氨酸、聚组氨酸、鱼精蛋白、阳离子葡聚糖、阳离子树枝状聚合物、阳离子多糖、聚酰胺胺、聚乙烯亚胺、聚季铵、聚甲基丙烯酸-2-二甲基氨基乙酯(PDMAEMA)、聚(2-二甲基氨基甲基苯乙烯)(PDMAMS)、聚-1-乙烯基吡咯烷酮(p1-VP)、聚丙烯酸二乙基氨基乙酯(pDEAEA)、聚丙烯酸二甲基氨基乙酯(pDMAEA)和聚甲基丙烯酸二乙基氨基乙酯(pDEAMA)中的一种或多种。分离构件可以包括具有尺寸为50nm至1000nm的孔的捕获过滤器。
可选地,载体可以包括磁颗粒。在这方面,多价阳离子可以包覆磁颗粒的表面以形成吸附球。多价阳离子可包括聚赖氨酸、聚精氨酸、聚组氨酸、鱼精蛋白、阳离子葡聚糖、阳离子树枝状聚合物、阳离子多糖、聚酰胺胺、聚乙烯亚胺、聚季铵、聚甲基丙烯酸-2-二甲基氨基乙酯(PDMAEMA)、聚(2-二甲基氨基甲基苯乙烯)(PDMAMS)、聚-1-乙烯基吡咯烷酮(p1-VP)、聚丙烯酸二乙基氨基乙酯(pDEAEA)、聚丙烯酸二甲基氨基乙酯(pDMAEA)或聚甲基丙烯酸二乙基氨基乙酯(pDEAMA)中的至少一种。在这方面,分离构件可以包括导致电流在电磁体中流动或者使用磁体的磁分离。
此外,用于微囊泡分离的试剂盒可进一步包括多孔颗粒,其可在其上吸附生物样品中包含的除微囊泡以外的如蛋白质的杂质。
下面将描述本公开的发明实施例和对比例。然而,以下实施例仅是本公开的优选示例,但本公开的权利的范围不限于以下实施例。
1、使用多价阳离子结合聚合物载体作为吸附球的分离实验
(1)发明实施例1和对比例1的制备
生物样品(发明实施例1和对比例1)
在获得高丽大学安南医院学院生物伦理研究委员会(IRB项目编号:2016AN0090)和所有血液样品志愿者的同意后,进行本实验。血液样品取自每位志愿者的肘正中静脉,并收集在3mLK2-EDTA真空采血管(Becton Dickinson,USA)中。全血以1900g离心分离10分钟后,然后以12,000g离心分离15分钟分离血浆。然后,将血浆通过孔径为800nm的筛网(800nm过滤器,赛多利斯,货号:91133103)过滤以去除大碎片。以1mL分离每个血浆样品以制备生物样品。
发明实施例1(使用PLL-珠、ExoCAS-1进行胞外囊泡分离)
图4示意性地示出了根据发明实施例1的微囊泡分离方法。
将吸附球添加到制备的血浆样品(生物样品)中,以通过电荷之间的相互作用诱导胞外囊泡和聚合物之间的聚集,从而形成珠和微囊泡彼此结合的缀合物,并使用捕获过滤器分离缀合物。
为了制备具有与其耦合的阳离子聚合物作为吸附球的珠,使用分子量为150至300kDa的聚L-赖氨酸(PLL,Sigma Aldrich,USA)作为阳离子聚合物。在制备浓度为40mg/mL的PLL储备溶液后,将羧基官能化珠粒(1μm,羧基聚苯乙烯珠,EPRUI Nanoparticles&Microspheres公司,中国上海)添加到PLL储备液中,并与其反应6小时。此后,进行离心分离以分离包括珠的固体,然后用磷酸盐缓冲盐水(PBS)洗涤珠以制备具有与其耦合的阳离子聚合物的珠。以相同的方式,分别使用5mg/mL、20mg/mL、40mg/mL和100mg/mL的PLL储备溶液,并且将反应时间设置为3小时、6小时和12小时。因此,制备了阳离子聚合物缀合珠(PLL珠)。比较彼此其与胞外囊泡的结合性能。
以基于当胞外囊泡结合到PLL珠时体积增加的事实分析结合性能的结果作为基础,鉴定在100mg/mL PLL储备溶液中获得了最佳性能,但基本上等同于40mg/mL PLL储备溶液。此外,当反应时间为6小时时,获得了最佳性能。当反应时间为12小时时,结合性能略有下降。因此,鉴定在经济性和效率方面的最佳条件是6小时的反应时间和40mg/mL的浓度。调节制备的阳离子聚合物结合珠,使得每个血浆样品中的最终珠浓度为5mg/mL。
将含有阳离子珠的血浆在4℃下孵育10分钟。在孵育后,使用孔径为220nm的注射器过滤器(220nm过滤器,Millex,R8EA69979)过滤混合物。过滤后,大尺寸的珠颗粒留在过滤器上。
为了洗涤包括结合到阳离子聚合物结合珠上的血浆蛋白杂质,使pH为4.0、8.5和13的第一试剂(各自的浓度为800μL)依次流过在置于过滤器上的珠的表面。使用乙酸(Sigma-Aldrich,货号:695092-100mL)和氢氧化钠(Sigma-Adrich,货号:S8045-500G)调节第一试剂的pH值。第一试剂还含有低浓度(10至50mM)的NaCl、10至50mM的CaCl
为了获得与阳离子聚合物结合珠结合的胞外囊泡,使用200μL的NaCl水溶液3M(氯化钠,SigmaAldrich,货号:S7653-250G)作为第二试剂。使第二试剂在置于在网格(mesh)上的珠上流动。为了鉴定获得的胞外囊泡,进行NTA以测量胞外囊泡的大小和颗粒浓度,并通过BCA测试分析第二试剂中包含的蛋白质的浓度。此外,拍摄并分析SEM图像(Quanta 250FEG;FEI,USA)。
对比例1(UC,通过超速离心分离的胞外囊泡分离)
超速离心(UC)是一种常规的广泛用于分离胞外囊泡的标准方法。尽管UC的分离原理很简单,但UC耗时(平均超过6小时),且劳动密集。将血浆和磷酸盐缓冲盐水(PBS)以1:1的体积比相互混合,离心分离混合物以去除残余细胞成分(4℃,12000g,30分钟)。转移上清液并在相同条件下重复离心分离一次。使用孔径为200μm的注射器过滤器(MerckMillipore,USA)过滤上清液,然后在120,000g和4℃下进行2小时的超速离心(CP100WX;日立,日本)。吸取上清液后,用PBS在120000g和4℃下仔细洗涤沉淀在底部的小球1小时,然后再悬浮在50μL磷酸盐缓冲盐水(PBS)中。
(2)发明实施例1和对比例1的实验
实验实施例1(吸附球缀合物形成)
在将PLL珠作为与阳离子聚合物结合的珠和作为未与阳离子聚合物结合的珠的裸珠以相同的量添加到血浆中后,在4℃下对其进行不同时间的孵育,并鉴定珠和胞外囊泡之间以小球形式的组合(吸附球缀合物)。
实验实施例2(第一试剂的评价)
作为第一试剂,使用作为离液物质的硫氰酸胍(GuTc2M)、乙酸(Sigma-Aldrich,货号:695092-100mL)和氢氧化钠(Sigma-Adrich,货号:S8045)-500G)的混合物。将其pH控制至4.0和8.5(800μL)。此外,使用NaCl(氯化钠,Sigma-Aldrich,货号:S7653-250G)作为盐。在使用第一试剂洗涤与阳离子聚合物结合的珠之后,鉴定所得第一试剂中所含的蛋白质和颗粒的浓度。在这方面,通过浓度分别为29mM和6.1mM的乙酸和氢氧化钠的混合物获得pH4。通过浓度分别为29mM和29mM的乙酸和氢氧化钠的混合物获得pH6。通过浓度分别为29mM和32.3mM的乙酸和氢氧化钠的混合物获得pH8.5。通过浓度分别为29mM和34mM的乙酸和氢氧化钠的混合物获得pH11。通过浓度分别为29mM和35mM的乙酸和氢氧化钠的混合物获得pH13。
实验实施例3(第二试剂评价)
除了在实验实施例3中,第一试剂的pH值为4并且不含盐,第二试剂的pH为7,并且其中的NaCl盐的浓度设置为1M、2M、3M、4M和5M之外,以与实验实施例2相同的方式进行实验实施例3。鉴定第二试剂中PLL-珠的浓度。
实验实施例4(基于第一试剂评价第二试剂中的蛋白质和纯度)
使用pH为4、8.5或13的不含离液盐的溶液作为第一试剂,使用第一试剂从PLL-珠中分离作为杂质的蛋白质。使用pH7的NaCl3M作为第二试剂。在这种情况下,评估第二试剂中的蛋白质和微囊泡。在这方面,纯度比是指胞外囊泡的浓度(颗粒/mL)与蛋白质浓度(μg/mL)的比。
实验实施例5(分离方法的评价)
通过蛋白质印迹法测定使用发明实施例1和对比例1至对比例3分离的胞外囊泡的蛋白质标记物。已知外泌体含有蛋白质标记物,如Alix(ALG-2相互作用蛋白X)、TSG101(肿瘤易感基因101蛋白)、HSP70(热休克蛋白)、跨膜四蛋白CD63、CD81和CD9。因此,使用四种参考蛋白质标记物(ALIX;TSG101:内部蛋白质标记物;CD9和CD81:表面蛋白质标记物(图12中的A))分析分离的胞外囊泡的特征。
简要描述蛋白质印迹过程,首先使用SDS-PAGE Mini-
简要描述RNA提取和定量过程,使用seraMir Exosome RNA纯化试剂盒(RA806A-1,SBI,USA)分离RNA。所有分离程序均按照生产商方案进行。为了定量EV miRNA标记物,使用TaqMan MicroRNA RT试剂盒(4366596,Life Technologies,USA)和TaqManMicroRNA Assay(4427975,Life Technologies(USA))在RNA洗脱液上进行逆转录。在此过程中,使用了TaqMan Universal Master Mix II,no UNG(4440040,Life Technologies,USA)和miRNA测定hsa-let-7a-5p、ID 000377和hsa-miR-142-3p、ID 000464。使用Agilent 2100生物分析仪上的Agilent真核细胞总RNA微芯片(Agilent Technologies,USA)对于RNA洗脱液进行另外的实验。
(3)发明实施例1和对比例1的评价
下面描述发明实施例1和对比例1的评价结果。
图5示出了根据发明实施例1的使用PLL-珠和没有结合阳离子聚合物的珠的裸珠来鉴定胞外囊泡的分离能力的结果。
参考图5,鉴定使用裸珠和PLL-珠在4℃下孵育1ml血浆样品的效果。在孵育2小时期间,裸珠在管的底部聚集。裸珠的体积没有因孵育时间增加至2小时而改变。相反,已经鉴定,随着孵育时间增加到10分钟、30分钟和1小时,小球形式的PLL-珠的体积逐渐增加。也就是说,鉴定裸珠仅作为珠本身存在,并且不能在其上捕获胞外囊泡,而PLL-珠与血浆中所含的胞外囊泡结合,因此,随着孵育时间的增加,与其结合的胞外囊泡的量增加。
图6是示意性地示出发明实施例1的PLL-珠是如何制备的图,以及图7示出了当PLL浓度变化时,按照图6的方式制备的PLL-球的荧光图像。就此而言,使用5mg聚苯乙烯作为裸珠,使用分子量为150至300Kda的聚-L-赖氨酸作为PLL,并将抗体(lgG[Alexa Flour])用于荧光图像。
参考图6,由于裸珠在其表面上包括-COOH官能团,并且PLL在其末端具有-NH
基于图7中荧光图像的确认结果,可以确定出归一化强度随着PLL储备溶液的浓度增加到5mg/mL、10mg/mL和15mg/mL而逐渐增加。换言之,已鉴定PLL有效地附着到裸珠(聚苯乙烯)的表面,并且这种附着取决于PLL的浓度。也就是说,鉴定根据发明实施例1的PLL-珠与生物样品中包含的微囊泡有效结合。
图8示出了使用发明实施例1基于各种第一试剂鉴定性能的结果。图9示出了使用发明实施例1基于添加了盐的第一试剂鉴定性能的结果。
在图8和图9中,使用BCA测试测量蛋白质浓度,并且使用纳米颗粒跟踪分析(NTA)测量颗粒浓度。
在图8和图9中,第一试剂中含有的蛋白质的浓度与分离蛋白质的结果有关,因为蛋白质是部分捕获在结合有阳离子聚合物的珠上的杂质,并且颗粒的浓度与结合有阳离子聚合物的珠有关。
参考图8的a,鉴定GuTc、pH4和pH8.5的所有的第一试剂显示高于去离子水(DW)中的杂质浓度的杂质浓度。也就是说,鉴定GuTc、pH4和pH8.5有效地分离了附着在PLL-珠上的杂质。此外,鉴定GuTc、pH4和pH8.5洗涤和去除PLL-珠的杂质的能力彼此相似。
参考图8的b,鉴定pH值为4和8.5的各蛋白质洗涤能力在GuTC的蛋白质洗涤能力的85至90%的范围内,并且使用pH值4或8.5的颗粒浓度比使用GuTc的颗粒浓度高12.5至20.1倍。
参考图9,可以鉴定第一样品中PLL-珠的损失量如下:GuTc 图10示出了使用发明实施例1基于各种第二试剂鉴定性能的结果。 参考图10,由于第二试剂中所含的颗粒浓度较低,微囊泡被分离,而不会损失至第二试剂中。在这方面,经鉴定第二试剂在pH7下优于用作参考物质的GuTC2M,并且1MNaCl是最优异的。 图11为示出基于第一试剂类型的与第二试剂中所含颗粒和蛋白质相关的纯度的图。 图11显示了当所使用的所有类型的第二试剂相同时在第二试剂中包含的颗粒浓度(在第二试剂中包含的胞外囊泡的浓度)和在第二试剂中包含的蛋白质浓度(在第二试剂中包含作为杂质的蛋白质的浓度),但是为了在使用第二试剂之前洗涤作为杂质的蛋白质,以相同的体积使用不同类型的第一试剂:GuTc 2M,pH 4.0,pH 8.5,pH 13,pH梯度,并进行一次洗涤。在这方面,pH梯度是指逐渐将pH升高至pH 4.0、pH 8.5和pH 13。 参考图11,鉴定所有pH 4.0、pH 8.5、pH 13和pH梯度均表现出优于参考GuTc 2M的性能。 经鉴定,当使用乙酸和氢氧化钠改变pH时,与使用GuTc 2M相比,检测到的蛋白质的量较低。特别地,当使用具有不同pH的多个第一样品(pH梯度)时,观察到检测到的蛋白质的最小量。 可以确定:当使用相同的第二试剂时,根据不同类型的第一试剂的结果彼此不同。也就是说,已经确定,即使第二试剂相同,也应该在前一步骤中有效地去除例如蛋白质的杂质。 经鉴定,当使用具有不同pH浓度的多种第一试剂同时顺序增加pH时,第二试剂中包含的胞外囊泡的量显示出最高纯度。也就是说,可以确定,当第一试剂的pH依次增加到4、8.5或13的pH时,定义为通过将颗粒数量除以蛋白质浓度而获得的值的纯度比在pH梯度情况下具有最大值。 图12示出了评估常规离心分离方法和根据本公开的发明实施例1的分离方法的结果。 在这些方法中,提取根据离心分离方法(对比例1;UC)和PLL-珠(发明实施例1;PLL-珠)中的每一种提取的微囊泡内的总RNA,并使用作为胞外囊泡标记物的引物hsa-let-7a-5p和hsa-miR-142-3p对其进行RT-PCR。结果,鉴定提取的RNA量如下:PLL-珠(发明实施例1)>离心分离法(对比例1)。使用吸附球和第一试剂和第二试剂的发明实施例1显示出最佳的RNA提取量(参见下面图12中的B)。 2、使用具有耦合有多价阳离子的磁性载体作为吸附球的分离实验 (1)发明实施例2、发明实施例3和对比例2至对比例4的制备生物样品(发明实施例2、发明实施例3和对比例2至对比例4) 以下发明实施例和对比例中使用的血浆样品购自ZenBio(Research Triangle,NC,USA)。使用筛网过滤器(800nm孔径筛网,Sartorius Minisart 发明实施例2(使用PLL-珠、ExoCAS-2进行胞外囊泡分离) 图13为示意性地示出根据发明实施例2的微囊泡分离方法的图。 在制备吸附球之后,将吸附球添加到制备的血浆样品(生物样品)中,以通过电荷之间的相互作用诱导胞外囊泡和聚合物之间的聚集,从而形成其中吸附球和微囊泡彼此耦合的缀合物,然后使用磁力分离缀合物。 制备通过使40mg/ml聚-L-赖氨酸(PLL,Sigma-Aldrich,St.Louis,MO,USA)聚合物和5mg球形磁珠(直径为1μm的磁珠)彼此反应而制备的PLL-磁珠作为吸附球,然后将其添加到血浆样品中。PLL具有多价阳离子性质,因此,PLL-磁珠通过静电吸引与带负电的胞外囊泡耦合。在这方面,将添加PLL-珠的生物样品在4℃下以90rpm在摇摆平台混合器中孵育30分钟。在孵育过程中,PLL-磁珠以流动状态存在于生物样品中,并以低速与样品混合,从而实现PLL-磁珠与胞外囊泡(外泌体)之间的优异结合。因此,数百个纳米级的胞外囊泡被捕获在PLL-磁珠的表面上。然后,在将混合物保持5分钟后,将磁体移向含有添加了PLL-珠的生物样品的管,从而分离捕获胞外囊泡的PLL-磁珠。在此方面,分离时间短至2分钟,然后使用移液管分离上清液。 使用pH为6的第一试剂(2mL)仔细洗涤其上捕获了胞外囊泡的PLL-磁珠以去除非靶蛋白质,然后将其上捕获胞外囊的PLL-磁珠重新悬浮在第一试剂中。使用磁体,将捕获胞外囊泡的PLL-磁珠聚集并分离,在此过程中,作为杂质的蛋白质被洗涤并除去。分离捕获有胞外囊泡的PLL-磁珠,然后将分离的捕获有胞外囊泡的PLL-磁珠添加到pH7.0的含有1MNaCl盐的第二试剂(200μL)中,然后将混合物以1000rpm涡旋5分钟。在涡旋过程中,PLL-磁珠和胞外囊泡相互洗脱,磁体在管附近保持2分钟,收集并分离PLL-磁珠。用移液管收集含有纯胞外囊泡的上清液。整个过程在40分钟内完成,并使用纳米点(nanosite,NTA)对其进行分子分析和物理性质分析。 发明实施例3(使用鱼精蛋白-磁珠的胞外囊泡分离) 除了用80μg的鱼精蛋白盐(#P4505,Sigma-Aldrich,St.Louis,MO,USA)代替40mg/ml的聚-L-赖氨酸(PLL,Sigma-Aldrich,St.Louis,MO,USA)聚合物之外,以与发明实施例3相同的方式制备鱼精蛋白-磁珠作为吸附球。将制备的吸附球添加到制备的血浆样品(生物样品)中,以通过电荷之间的相互作用诱导胞外囊泡和聚合物之间的聚集,从而形成其中吸附球和微囊泡彼此耦合的缀合物,然后使用磁场从样品中分离缀合物。 对比例2(使用超速离心(UC)分离的胞外囊泡分离) 超速离心(UC)是用于分离胞外囊泡的最标准方法(金标准方法)。然而,使用UC分离胞外囊泡需要约6小时或更长时间。此外,UC需要大量劳动力。为了使用超速离心分离,将血浆样品与磷酸盐缓冲盐液(PBS)以1:1的体积比混合,并在4℃和12000g下离心分离混合物30分钟,以从中去除残余细胞组分。分离上清液并在相同条件下对其再次离心分离。使用220μm的孔注射器过滤器(Merck Millipore,Burlington,MA,USA)过滤分离的上清液,并使用高速离心分离器(CP100WX;日立,东京,日本)在4℃和12000g下对过滤的上清液进行离心分离2小时。在吸收并分离上清液后,将剩余的小球再悬浮,用磷酸盐缓冲盐液(PBS)在120000g和4℃下洗涤1小时,然后再悬浮在50μLPBS中。 对比例3(EQ,使用市售产品的胞外囊泡分离1) 为了分离胞外囊泡,使用市售可得的ExoQuick 对比例4(exoEasy,使用市售产品的胞外囊泡分离2) 如试剂盒中包括的手册所述,使用exoEasyTM Maxi试剂盒(Qiagen,Valencia,CA,USA)提取血浆外泌体。在其上过滤以除去直径为0.8μm或更大的颗粒后,向其中加入相同体积的XBP缓冲溶液并与其混合,将悬浮液转移至exoEasy旋转柱,并在其上以500g离心分离1分钟。除去流通液(flow-through)后,向其中加入10mL XWP缓冲溶液,并在5000g下对悬浮液进行离心分离5分钟。移除流通液并将旋转柱转移至新管后,向其中加入100μLXE缓冲溶液以制备混合物。将混合物以5000g离心分离5分钟,然后使用外泌体再悬浮溶液B(exo-B)收集流通液。 (2)发明实施例2、发明实施例3和对比例2至对比例4的实验实验实施例6(PLL-磁珠制备和孵育条件) 5mg的平均直径为1μm的球形磁珠与以40mg/ml、200mg/ml和600mg/ml的不同浓度的PLL反应以制备PLL-磁珠,然后评估其胞外囊泡分离能力。将通过40mg/ml的PLL与5mg的平均直径为1μm的球形磁珠反应制备的具有最佳性能的PLL-磁珠添加到血浆样品中。然后,基于孵育持续时间和孵育温度来评估其性能。 实验实施例7(Zeta电位的评价) 使用Zeta电位分析仪(Zetasizer Pro;Malvern Panalytic,Malvern,UK)测量使用发明实施例2(PLL-磁珠)和对比例2(UC)各自分离的胞外囊泡的Zeta电位,并使用Zeta电位分析仪测量发明实施例2中的微米尺寸的PLL-磁珠(吸附球)的Zeta电位。将在1mL血浆中制备的小球聚集的PLL珠(5mg/mL)重新悬浮在10μLNaCl溶液(1M)中(难以将小球聚集的PLL珠重新悬浮在去离子水(DW)中)。向其中加入990μL的去离子水。 实验实施例8(冷冻TEM(冷冻透射电子显微镜)评价) 将使用发明实施例2(PLL-磁珠)和对比例2(UC)分离的胞外囊泡转移到20nm网筛中,然后使用Vitrobot 实验实施例9(扫描电子显微镜(SEM)评价) 使用安装在垫圈上的阳极氧化铝膜(AAO膜)过滤使用发明实施例2(PLL-磁珠)和对比例2(UC)各自分离的胞外囊泡。过滤后,将AAO膜在戊二醛溶液(Sigma Aldrich,St.Louis,MO,USA)中孵育30分钟。此后,依次用25%、50%、75%、90%、100%乙醇洗涤AAO膜,并在37℃的干燥箱中孵育过夜。在用Pt涂布AAO膜后,使用SEM(Quanta 250 FEG;FEI,Hillsboro,OR,USA)鉴定AAO膜上的胞外囊泡和簇物质(cluster substance)。 实验实施例10(纳米颗粒跟踪分析(NTA)评价) 分离1mL通过发明实施例2(PLL-磁珠)、发明实施例3(鱼精蛋白-磁珠),对比例2(UC)、对比例3(ExoQuick)和对比例4(exoEasy)各自获得的胞外囊泡溶液用于NTA分析。将用PBS稀释的样品置于NanoSightLM10系统(Malvern Panalytic,Worcestershire,UK)的组装样品室中,并使用指纹区域作为参考聚焦微粒。记录胞外囊泡图像,并测量平均粒径及其浓度。 实验实施例11(蛋白质印迹法评价) 将从悬浮在200μL洗脱缓冲溶液中的外泌体(如上所述由实验实施例分离的外泌体)分离的蛋白质在含有2-巯基乙醇(Sigma-Aldrich,St.Louis,MO)的Laemmli缓冲溶液(Bio-Rad,Hercules,CA,USA)中在95℃下加热10分钟,然后进行改性。使用SDS-PAGE Mini-PROTEAN TGX 实验实施例12(蛋白质含量的评价) 使用Pierce 实验实施例13(RNA分析评价) 使用SeraMir Exosome RNA纯化试剂盒(RA806A-1,SBI,PaloAlto,CA,USA)分离RNA。所有分离方法均按照制造公司手册进行。为了定量胞外囊泡miRNA标记物,使用TaqManMicroRNA RT试剂盒(4366596,Life Technologies,Carlsbad,CA,USA)和TaqMan MicroRNA测定(4427975,Life Technologies,Carlsbad,CA,USA)在RNA洗脱液上进行逆转录。一起使用TaqMan Universal Master Mix II,no UNG(4440040,Life Technologies,Carlsbad,CA,USA)和miRNAshsa-let-7a-5p,ID000377和hsa-miR-142-3p,ID 000464。使用生物分析仪(在Agilent真核生物总RNA微芯片的Agilent 2100生物分析仪上进行,AgilentTechnologies,Santa Clara,CA,USA)对RNA洗脱液进行额外的实验。 实验实施例14(使用微阵列评估RNA分析) 使用微阵列((Gen-Chip miRNA 4.0 array,Affymetrix Inc.,Santa Clara,CA,USA)分析miRNA表达谱。使用FlashTag用生物素标记包括组织miRNA的总RNA(130ng)。使用根据每个制造公司的手册,使用GeneChip杂交炉,将TM Biotin HSR RNA标记试剂盒(Affymetrix)标记的样品放置在AffymetrixmiRNA微阵列中。标记的RNA在99℃下加热5分钟,然后在45℃加热5分钟。使用 (3)发明实施例2、发明实施例3和对比例2至对比例4的评价下面描述对发明实施例2和对比例2至对比例4的评价结果。 图14示出了基于PLL浓度、孵育温度和孵育时间评估PLL-磁珠性能的结果。 基于图14中的A,当向1ml血浆样品中加入5mgPLL-磁珠并在其上进行孵育,同时将孵育时间分别改变为10分钟、30分钟、60分钟和120分钟时,确定PLL-磁珠的体积增加。图15中的B显示了孵育时间为10分钟、30分钟、60分钟和120分钟,且孵育温度分别为4℃和24℃的不同温度时确定的性能。 随着PLL-磁珠的体积增加,PLL-磁珠与血浆中包含的胞外囊泡之间的结合增加。30分钟的孵育时间似乎比10分钟的孵育时间具有明显更好的结合性能。30分钟、60分钟和120分钟的结果之间没有显著差异,因此优化条件确定为30分钟。然而,对于快速实验,10分钟的孵化时间可以提供不错的结果。 此外,确定4℃孵育温度比24℃孵育温度表现出更好的效果。因此,在本实验中,在4℃下孵育30分钟。 图14中的C显示了当通过使相同的珠与40mg/ml、200mg/ml和600mg/ml的不同浓度下的PLL反应制备的PLL-磁珠,并将由此制备的PLL-磁珠加入到相同的血浆样品中时,确认miRNA提取的效果。当使用40mg/ml、200mg/ml和600mg/ml的不同浓度时,总PLL浓度没有显著差异。然而,发现40mg/ml是最优异的。因此,在本实验中,使用40mg/ml的PLL浓度制备PLL-磁珠。 图14的D示出了基于PLL-磁珠的浓度确认miRNA提取效果的结果。当将PLL-磁珠的浓度改变为0.5mg/ml、2.5mg/ml、5mg/ml、10mg/ml和25mg/ml时,鉴定结果。确定当PLL-磁珠的浓度增加到5mg/ml时,miRNA提取能力增加,而当浓度增加到超过5mg/ml时,性能几乎没有变化。因此,当珠浓度为5mg/ml时进行该实验。 图15示出了基于PLL-磁珠尺寸评估胞外囊泡分离能力的结果。 图15中的A显示了基于血球容积计的评估结果,而PLL-磁珠的平均直径各自为1μm和40μm,且孵育时间各自为3小时和6小时。图16中的B显示了在将PLL-磁珠的平均直径各自设置为0.4μm和1μm之后使用生物分析仪的评价结果。 在图15的a中,当PLL-磁珠的平均直径为1μm,胞外囊泡的分离性能优于当PLL-磁珠的平均直径为40μm时的分离性能。当孵育时间为6小时时的胞外囊泡的分离性能优于孵育时间为3小时时的分离性能。此外,在图15的b中,确认在使用平均直径为1μm的PLL-磁珠的情形(就miRNA和纯度方面)优于使用平均直径0.4μm的PLL-磁珠的情形。 图16示出了根据发明实施例2和对比例2的各自的SEM图像、荧光图像和冷冻TEM图像。 图16中的A示出使用根据发明实施例2的PLL-磁珠(PLL-珠)分离胞外囊泡(EV)的结果,并示出了PLL-磁珠、其上捕获有胞外囊泡的PLL-磁珠和分离的外泌体各自的SEM图像。基于图像,确定磁珠的平均直径为950nm。图16中的B示出了PLL-磁珠(绿色)、其上捕获外泌体的PLL-磁珠(红色)及其组合的荧光图像。图16中的C示出了根据发明实施例2(PLL-珠)和对比例2(UC)分离的胞外囊泡(EV)的冷冻TEM图像。 在发明实施例2中,确认了0.5μm至40μm范围内各种尺寸的PLL-磁珠的SEM图像,然后从中选择1μm尺寸的PLL-磁珠,然后对1μm尺寸的PLL-磁珠进行评价。经鉴定,将PLL-磁珠添加到血浆样品中,此后,作为胞外囊泡的外泌体包覆在PLL-磁珠的表面上。此外,经鉴定,使用PLL-磁珠分离的外泌体的尺寸约为100nm。 经鉴定,基于荧光图像的结果与基于SEM图像的结果相似。PLL-磁珠用FITC染色,并且外泌体用抗CD63(AlexaFluor647)染色以鉴定荧光图像。使用40μm的PLL-磁珠获得荧光图像。绿色表示PLL-磁珠,以及红色表示其上捕获有作为胞外囊泡的外泌体的PLL-磁珠。基于使用发明实施例2(ExoCAS-2)和对比例2(UC)各自分离的胞外囊泡的基于TEM的鉴定结果,经鉴定,当使用发明实施例2和对比例2中的每一种时,分离出直径在70nm至180nm范围内几乎相似尺寸的胞外囊泡。 图17示出了根据发明实施例2孵育后鉴定zeta电位和体积变化的结果。 图17中的A示出了外泌体、发明实施例2(PLL-珠)、其上捕获有胞外囊泡的PPL-磁珠(捕获EV的PLL-珠)以及血浆蛋白中包含的白蛋白、γ-球蛋白和纤维蛋白原各自的zeta电位。图17中的B示出了在血浆中孵育发明实施例2(PLL-珠)前后鉴定的体积变化的结果。 根据发明实施例2的胞外囊泡(PLL-珠)的分离使用PLL-磁珠表面上的阴离子交换。作为胞外囊泡的外泌体的zeta电位为-15.0mV,因为形成了胞外囊泡的阴离子磷脂双层。由于PLL的阳离子和亲水氨基,PLL-磁珠显示出22.6mV的zeta电位。经鉴定,当外泌体被捕获在PLL-磁珠的表面上时,由于外泌体与其结合,zeta电位降低至5.4mV。此外,PLL本身的zeta电位为42.4mV。 也就是说,当PLL与磁珠结合时,PLL的zeta电位降低至22.6mV。PLL-磁珠的zeta电位由于其上捕获的外泌体而降低至5.4mV。血浆蛋白中含有诸如白蛋白、γ球蛋白和纤维蛋白原等的蛋白质。经鉴定,它们具有分别为-6.1mV、2.4mV和-18.7mV的负值zeta电位。因此,具有负zeta电位值的蛋白质与作为胞外囊泡的外泌体一起可以被捕获到PLL-磁珠上。因此,在随后的步骤中需要使用第一试剂除去除外泌体以外的杂质的过程。 经鉴定,当将PLL-磁珠添加到血浆中后,对在孵育前后PLL-磁珠的体积相互比较时,在孵育前和孵育后PLL-磁珠的体积发生变化。确定这是因为外泌体附着于PLL-磁珠上,并且基于孵育时间和温度来控制附着。如发明实施例1所述,经鉴定,在4℃孵育中实现的外泌体与PLL-磁珠的附着比在24℃孵育下的附着更有效。在该实验中,经鉴定,孵育30分钟后体积完全饱和。 图18示出了发明实施例2和对比例2至对比例4的各自的NTA和BCA分析结果。 图18示出了关于发明实施例2和对比例2至对比例4各自的平均粒径(A)、颗粒浓度(B)、蛋白质浓度(C)和纯度比(颗粒/蛋白质的比率)(D)(*:p<0.05,**:p<0.01,***:p<0.001)。在图18的D中,将对比例2的纯度比设定为参考。 我们鉴定了,使用发明实施例2分离的作为胞外囊泡的外泌体的尺寸分布、形状、表面、内部蛋白质标记物和外泌体RNA,进而与使用对比例2的常规使用的超速分离(UC)、对比例3(EQ,exoQuick,SBI)和对比例4(exoEasy)各自的分离的作为胞外囊泡的外泌体的那些进行比较。 确定除了对比例3之外,使用发明实施例2、对比例2和对比例4分离的外泌体的尺寸彼此相似。相反,使用发明实施例2、对比例2以及对比例3和对比例4分离的外泌体的颗粒浓度和蛋白质污染之间存在差异(参见图18中的B和C)。 在具有外泌体分离性能的对比例3中,最大颗粒浓度为22.5x10 图19示出了根据发明实施例2和发明实施例3各自的第一试剂的NTA和BCA的分析结果。 在图19中,发明实施例2和发明实施例3中的第一试剂彼此不同,然后,使用pH7.0的NaCl1M(200μL)作为第二试剂,并在室温下以1000rpm的速度进行涡流5分钟。评价发明实施例2和发明实施例3中的第一试剂各自分离胞外囊泡的能力。下表1示出了使用每种第一试剂进行洗涤的条件。表2示出了根据下表1的条件的NTA、BTA和纯度(纯度比)的结果。在下表1中,第一试剂的条件包括第一试剂的pH和体积,并且第一试剂(另外的)意味着用第一试剂洗涤样品一次,然后用第一试剂对同一样品进行额外的洗涤(洗涤两次)。 【表1】
【表2】
在图19的(a)中,颗粒浓度是指第二试剂中含有的胞外囊泡的浓度。其值越高意味着已分离出更多的胞外囊泡。因此,其值越高意味着分离能力越好。蛋白质浓度是指充当杂质的蛋白质的浓度,而不是包含在第二试剂中的胞外囊泡的浓度。因此,当其值较低时,第一试剂具有更好的洗涤能力。在图19的(b)中,这种能力表示为纯度比(颗粒/蛋白质比)。 经鉴定,当在相同条件下使用2mlpH为6的第一试剂时,发明实施例3(#2)显示出比发明实施例2(#1)更好的效果。经鉴定,如发明实施例3所示,当鱼精蛋白盐用作多价阳离子时,胞外囊泡的分离能力优于PLL。 比较在发明实施例3的不同条件(#2至#6)下用第一试剂洗涤相同样品的情况的结果如下。经鉴定,用第一试剂洗涤样品一次,然后用第一试剂对同一样品进行额外洗涤(洗涤两次)的情况(#3)表现出比使用pH为6的第一试剂(2ml)洗涤样品的情况(#2)更好的结果。 因此,将其中第一试剂洗涤两次(每次:2ml)的情况(#3)和用4ml的第一试剂(其中4ml是2ml的两倍)洗涤一次的情况(#4)彼此比较的结果如下。情况(#3)具有比情况(#4)更好的结果。 使用第一试剂(#3和#5)洗涤两次。#5显示出与#3相似的结果,尽管#5中使用的第一试剂的体积比#3中的少。因此,当如#5中那样使用第一试剂洗涤作为杂质的蛋白质时,以及当首先用弱碱性pH6进行洗涤,然后用弱酸pH8.5进一步进行洗涤时,鉴定出胞外囊泡的分离能力进一步提高。 为了鉴定基于温度的影响,在#6上进行了实验。经鉴定,其结果与#2的结果几乎相似。具体地,在用第一试剂在升高的温度下洗涤的情况下,颗粒浓度降低而蛋白质浓度增加,使得纯度通常与在室温下进行的#2的纯度相似。相反,与#2的情况相比,在#6的情况下,总体分离效率降低,因为在#6情况下,需要额外的处理和时间,例如第一试剂的处理,以便在高温下洗涤样品,并且在洗涤过程中保持温度。 图20示出了发明实施例2和对比例2至对比例4各自的蛋白质印迹结果。图21示出了使用发明实施例2和对比例2至对比例4中的各自的生物分析仪的性能评估结果,以及使用发明实施例2和对比例2至对比例4的各自的RT-qPCR的外泌体miRNA测量结果。图22示出了使用发明实施例2和发明实施例3各自的RT-qPCR的外泌体miRNA测量结果。图23为使用根据发明实施例2和对比例2至对比例4各自的微阵列描述基因表达的图。图24是使用发明实施例3的微阵列的结果。 图20中的A和B示出了根据发明实施例2和对比例2至对比例4各自使用蛋白质印迹法鉴定胞外囊泡的蛋白质标记物的结果。图20中的C示出了使用蛋白质印迹从胞外囊泡提取的蛋白质的分析结果。 图21中的A示出了使用根据发明实施例2和对比例2至对比例4各自的Agilent真核生物总RNA微芯片的生物分析仪分析总外泌体RNA的结果。图21中的B示出了通过RT-qPCR测量的外泌体miRNA(hsa-let-7a-5p、hsa-miR-142-3p)的分析结果。 在图20中,使用蛋白质印迹法研究蛋白质标记物的存在,以鉴定分离的胞外囊泡是否为外泌体。跨膜四蛋白CD9和CD81通常作为外泌体表面蛋白质标记物,以及Alix(ALG-2相互作用蛋白X)和TSG101(肿瘤易感基因101蛋白)作为外泌体内的蛋白质标记物。研究了这四种蛋白质标记物作为外泌体鉴定的参考蛋白质标记物。此外,在本实验中,研究了白蛋白作为血浆蛋白的污染蛋白质标记物。 可以确定,在发明实施例2、对比例2和对比例4(除了对比例3,因为其相对较差的性能)中,发明实施例2在参考蛋白质标记物(ALIX、TSG101、CD9和CD81)中显示出强的带。对带的强度进行了额外的定量分析(图20中的B)。 外泌体蛋白质标记物的强度如下所示:发明实施例2>对比例2>对比例4。经鉴定,基于表面蛋白质标记物(CD9和CD81)和内部蛋白质标记物(TSG101和ALIX),分离的胞外囊泡为外泌体。也就是说,根据本公开的发明实施例2分离的胞外囊泡为外泌体。 在所有的发明实施例2、对比例2和对比例4中,出现了白蛋白的带强度,其中白蛋白的带强度较低,并且在发明实施例2中、对比例2中和对比例4中的白蛋白带强度彼此相似。 参考图21的A,使用发明实施例2和对比例2至对比例4中的每一个从相同的血浆中分离外泌体。使用SeraMir ExosomeRNA纯化试剂盒(SBI,Palo Alto,CA,USA)提取外泌体的RNA。RNA提取后,使用Agilent生物分析仪2100(Agilent Technologies,Santa Clara,CA,USA)测量总RNA。发明实施例2显示出最高的总RNA值,而对比例3显示出最低的值。 参考图21中B,使用RT-qPCR分析从外泌体中提取的RNA的部分。在相同的分离方法中,两种类型的miRNA的Ct值显示相似的值。然而,经鉴定,使用各自的分离方法(即发明实施例2和对比例2至对比例4)获得的值之间存在显著差异。对比例2显示出hsa-let-7a-5p和hsa-miR-142-3p分别为31.1和30.5。对比例3显示出hsa-let-7a-5p和hsa-miR-142-3p分别为37.07和36.29的高值,这可能被认为是由于高的蛋白污染所致。发明实施例2显示出hsa-let-7a-5p和hsa-miR-142-3p分别为22.7和21.2的最低的Ct值。对比例4显示出hsa-let-7a-5p和hsa-miR-142-3p分别为23.3和22.6。 参考图22,可以确定在发明实施例2和发明实施例3中的两种类型的miRNA的Ct值彼此相似。 参考图23中的A,可以确定:基于使用Gen-Chip miRNA 4.0阵列(AffymetrixInc.,Santa Clara,CA,USA)的评估结果,在使用发明实施例2、对比例2和对比例4各自提取的胞外囊泡中鉴定出共2578个miRNA。经鉴定,在所有的发明实施例2、对比例2和对比例4中,观察到92.6%的外泌体miRNA。 参考图23的B,经鉴定26个显示表达差异的miRNA基因不含与癌症相关的特定miRNA。经鉴定,使用发明实施例2、对比例2和对比例4各自鉴定的miRNA的百分比不超过2.5%。 参考图23和图24,可以鉴定,发明实施例3显示出0.65%,因此具有与常规使用的对比例2和对比例4各自的性能大致相似的性能。 图25示出了在发明实施例2中使用第一试剂的步骤(a)和使用第二试剂的步骤(b)中的性能评估结果。 图23的A至C分别示出了:在将PPL-磁珠添加到血浆中以制备捕获有胞外囊泡的PPL-磁珠之后,作为使用第一试剂洗涤和除去除了胞外囊泡的杂质的结果的颗粒浓度、蛋白质浓度和洗涤效率(蛋白质/颗粒比)。图22中的D至F分别分别示出了:作为使用第二试剂洗脱的捕获有胞外囊泡的PPL-磁珠的结果的颗粒浓度、蛋白质浓度和洗涤效率(蛋白质/颗粒比)(*:p<0.05,**:p<0.01)。 参考图23,发明实施例2的PPL-磁珠基于阴离子交换原理,如图22中A所示,用第一试剂洗涤以去除杂质,即附着在PPL-磁珠上的蛋白质。在这方面,应除去带负电的蛋白质,同时除去不会影响捕获在PPL-磁珠上的胞外囊泡。由于第一试剂的pH等于等电点(pI),并且蛋白质电荷变为中性,因此通过离子交换树脂可以容易地从中分离蛋白质。此外,可以将第二试剂的pH调节到低于等电点的值,从而可以诱导蛋白质带正电荷。然而,血浆蛋白的等电点在5至9的宽范围内。这导致问题。 使用第一试剂的不同pH值,鉴定其除去附着在PPL-磁珠上的杂质的能力(图22中的B)。在第一试剂中,通过不同地改变氢氧化钠浓度(6.135nM),同时保持乙酸浓度(29nM)恒定而改变其pH。 结果,经鉴定,蛋白质的浓度在pH8.5时表现出最大值,而颗粒的浓度在不同的浓度处几乎相同。当第一试剂的pH为6时,被定义为洗涤的颗粒总数与被第一试剂洗涤的蛋白质的浓度之间的比率的洗涤效率最高。 使用第二试剂分离捕获在PPL-磁珠上的胞外囊泡(图22中的D)。在使用多种盐(Na 使用不同浓度(200mM至3M范围内)和浓度变化(200mM和1M)的NaCl制备第二试剂。然后,鉴定基于各种浓度(在200mM至3M的范围内)和浓度变化(200mM和1M)从其中洗脱的捕获到PPL-磁珠上的胞外囊泡的量。 在图25的E中,经鉴定收集的颗粒的量随着NaCl浓度的增加而增加,使得该值在1M处具有最大值,然后在3M处再次减小。确定这是因为发生了盐析效应。相反,进行洗脱的第二试剂中所含的蛋白质的浓度随着NaCl浓度的增加而增加。 也就是说,在使用第二试剂从其中将捕获到PPL-磁珠上的胞外囊泡洗脱之后,可以测量定义为颗粒数量与洗脱蛋白质浓度的比率的洗脱效果。经鉴定,当NaCl浓度为1M时,洗脱效果具有最高值,此时,提取了大量外泌体。 本公开所属领域的普通技术人员将理解,本公开可以在不改变其技术精神或基本特征的情况下以其它特定形式实施。因此,应当理解,如上所述的实施例在所有方面都不是限制性的,而是说明性的。本公开的范围由以下权利要求而不是上述详细描述来表示。源自权利要求及其等同物的含义和范围的所有改变或修改应被解释为包括在本公开的范围内。 附图标记 100:吸附球 110:载体 120:多价阳离子
- 基于微流控装置的脂质体囊泡的可控制备方法
- 一种分离细胞表面囊泡的方法
- 一种微囊藻形态种的分离装置和微囊藻形态种的分离方法
- 一种微囊藻形态种的分离装置和微囊藻形态种的分离方法
