一种磁共振可视化且能用于免疫治疗胶质瘤的间充质干细胞制剂
文献发布时间:2023-06-19 18:58:26
技术领域
本发明涉及生物医药领域,尤其涉及一种磁共振可视化且能用于免疫治疗胶质瘤的间充质干细胞制剂。
背景技术
胶质母细胞瘤(glioblastoma,GBM)是最常见的原发性恶性脑肿瘤,约占所有神经胶质瘤的57%,占中枢神经系统所有原发性恶性肿瘤的近50%。尽管近年来胶质母细胞瘤的综合治疗包括手术、放疗、化疗、靶向治疗和支持治疗都取得了进展,但患者的整体预后仍然很差,中位生存期不到2年,5年存活率仍尚不足10%。在GBM的终末期,伴随患者的神经功能和生活质量进行性下降,患者个人与家庭承担了巨大的身体、精神及经济负担,因此急需寻求新的治疗策略。GBM的恶性预后主要表现为肿瘤快速进展、易于耐药和术后不可阻止的复发。造成GBM恶性预后的主要原因包括GBM浸润性生长、易于累及重要脑的功能区的特性,血脑屏障的存在限制了化疗药物充分发挥作用,以及GBM的高度的分子异质性与肿瘤干细胞不断增殖再生的特性,导致其易于对化疗药物及靶向治疗药物发生耐药。随着对GBM的发生、发展的分子生物学机制及其与免疫系统相互作用的认识不断深入,通过激活或调节机体自身免疫系统抑制或杀伤肿瘤的免疫治疗为GBM的治疗供了新思路与新的研究方向。
免疫疗法已经在多种恶性实体瘤,如黑色素瘤、非小细胞肺癌、肾癌等的治疗中均产生了明确的疗效,显著改善了患者的预后与生存,已成为恶性肿瘤最有前景的治疗手段。中枢神经系统具有独特的免疫微环境,长期以来被认为是一个“免疫豁免”的部位。然而,最新研究发现,与硬膜静脉窦平行的脑膜淋巴管能够引流脑实质与组织液中的抗原呈递细胞与代谢废物到达颈部深部淋巴结,激活适应性免疫应答,成为沟通中枢神经系统与外周免疫器官免疫反应的桥梁,打破了中枢神经系统是“免疫豁免”器官的传统认知,为GBM的免疫治疗提供了理论依据。然而,在其他恶性肿瘤发挥明确治疗作用的免疫疗法,如免疫检查点阻断剂、肽疫苗疗法等对GBM中疗效并不理想。例如,针对EGFRvIII阳性GBM开发的肽疫苗rindopepimut在EGFRvIII阳性患者中III期临床试验未能在手术后辅助替莫唑胺改善患者的整体生存率。免疫检查点抑制剂PD-1/PD-L1抗体、CTLA-4抗体等在胶质母细胞瘤中进行的3期试验初步结果也未观察到生存期改善。目前研究表明,GBM对上述免疫治疗方案的治疗效果不佳可能包括以下原因:GBM缺乏T细胞浸润,是一种典型的“冷肿瘤”,导致后续的免疫激活疗法无法发挥效能;肿瘤细胞或肿瘤微环境中的髓系细胞表达多种替代免疫检查点分子,如TIM3、LAG3、TIGIT等,可以阻止T细胞的激活;以及TME中存在多种免疫抑制因素。其中,在上述诸多原因中,GBM的TME中缺少T细胞的浸润是对GBM进行免疫治疗需要突破的首要障碍,因此,向GBM内募集并激活杀伤性T细胞,使“冷肿瘤”变“热”,是对GBM进行免疫治疗亟待解决的关键科学问题。
研究表明,CXCL10/CXCR3信号轴是调控免疫细胞招募、迁徙的关键信号轴。CXCR3高表达于CD8+T细胞。CXCL10能够招募杀伤性T细胞等免疫细胞,并通过促进Th1极化进一步激活免疫细胞,从而产生明显的促炎效应。上调胶质瘤肿瘤微环境(tumormicroenvironment,TME)中的CXCL10水平能够从外周向肿瘤内募集并激活杀伤性T细胞,并通过促进Th1极化进一步激活免疫细胞,从而产生明显的促炎效应。然而,CXCL10半衰期很短,在血液中很容易被分解,常规给药途径难以将CXCL10持续、精准地递送入GBM内。因此,急需一种能向GBM靶向、持续地输送CXCL10的手段。
干细胞具有主动趋化胶质瘤的特性。对干细胞进行基因修饰或药物标记后可用于向胶质瘤输送抗肿瘤增殖蛋白、抗血管生成药物、免疫因子、肿瘤靶向毒素、自杀基因、纳米粒子、溶瘤病毒等治疗物质,对于探索胶质瘤的新治疗方案具有重要价值。相对于胚胎干细胞、神经干细胞及诱导多能干细胞等类型干细胞,骨髓来源的间充质干细胞(mesenchymalstem cells,MSCs)具有取材方便、不存在伦理问题、易于培养且保持多向分化潜能、以及免疫原性低等诸多优点,更具有临床转化前景。前期研究表明,对MSCs进行干扰素β(Interferon-β,IFNβ)修饰,将其作为持续分泌IFNβ的“细胞工厂”,能够对胶质瘤肿瘤微环境(发挥长效的免疫调制作用,从而抑制胶质瘤生长。因此,利用MSCs输送细胞因子对胶质瘤进行免疫治疗是一种极有前景的新治疗模式。
在肿瘤瘤周区移植IFNβ基因修饰MSCs,虽然能够抑制胶质瘤生长,但MSCs的存活率不高,移植后11天存活率约为30%。移植后MSCs的长期存活率低,是限制干细胞作为细胞载体发挥治疗作用的关键因素。胶质瘤TME中的高浓度活性氧自由基(reactive oxygenspecies,ROS)会诱导干细胞凋亡,是导致MSCs在TME中存活率低的重要原因。NF-E2相关因子2(nuclear factor E2-related factor 2,Nrf2)信号通路在细胞抗氧化应激中发挥重要作用,是细胞抗氧化损伤的关键通路。氧化应激状态下,Nrf2通过与抗氧化反应元件ARE相互作用,启动抗氧化蛋白和II相解毒酶表达,从而发挥抑制细胞凋亡和促进细胞存活的作用。因此,上调MSCs的Nrf2表达有望提升其移植至肿瘤后的存活率,从而更好的发挥细胞载体的治疗作用。
作为细胞载体,移植后干细胞的生物学行为需要被在体、实时监测,以明确治疗的安全性以及有效性。MRI具有良好的软组织对比度、高空间分辨率与多参数成像技术,且没有电离辐射,是目前最适用于干细胞活体示踪的影像学手段。利用MRI示踪干细胞,既往较常用的方法是采用SPIO等外源性对比剂对干细胞进行直接标记后成像。然而,用于标记干细胞的外源性对比剂会随着干细胞分裂被“稀释”,或在干细胞死亡后被免疫细胞吞噬产生假阳性信号,难以真实反映移植干细胞的命运。采用MRI报告基因对干细胞进行基因修饰,报告基因会随着细胞分裂复制至子代细胞中表达,因此能对存活干细胞进行长期示踪。FTH铁蛋白重链(ferritin heavy chain,FTH)基因是目前应用最多的MR报告基因。FTH在细胞内过表达能够形成更多氧化铁颗粒,细胞局部横向弛豫时间缩短,从而在T2WI和T2*WI序列上产生对比信号。前期研究表明,采用基于FTH报告基因的MRI活体、动态监测,能够阐明移植后MSCs的生物学行为,进而明确该疗法的安全性。因此,通过对MSCs进行FTH报告基因修饰,能够使其具备MRI可视化的特性。
发明内容
鉴于上述现有技术存在的缺陷,本发明的目的是提出一种磁共振可视化且能用于免疫治疗胶质瘤的间充质干细胞制剂,利用具备抗凋亡能力、MRI可视化的MSCs作为细胞载体免疫治疗GBM,
本发明的目的将通过以下技术方案得以实现:
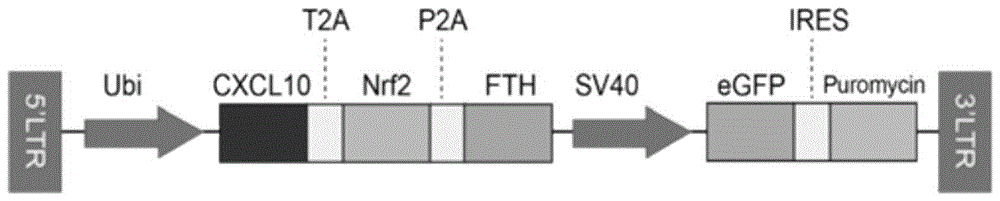
本发明的目的之一在于提供一种基因修饰的骨髓间充质干细胞,所述基因修饰的骨髓间充质干细胞为过表达CXCL10-Nrf2-FTH基因的骨髓间充质干细胞;
所述CXCL10-Nrf2-FTH基因以CXCL10-T2A-Nrf2-P2A-FTH融合基因的形式修饰骨髓间充质干细胞;
所述CXCL10-T2A-Nrf2-P2A-FTH融合基因的编码核苷酸序列如SEQ ID NO.1所示。
本发明的另一个目的在于提供一种骨髓间充质干细胞的制备方法,包括以下步骤:
步骤1,获取用于修饰骨髓间充质干细胞的目的基因,构建CXCL10-Nrf2-FTH过表达慢病毒载体;
步骤2,制备CXCL10-Nrf2-FTH过表达慢病毒;
步骤3,CXCL10-Nrf2-FTH过表达慢病毒转染骨髓间充质干细胞,制备得到所述基因修饰的骨髓间充质干细胞。
本发明的另一个目的在于提供一种骨髓间充质干细胞在制备胶质母细胞瘤免疫治疗药物中的应用。
本发明的突出效果为:
本发明的一种基因修饰的骨髓间充质干细胞及其制备方法和应用,通过对MSCs进行CXCL10(免疫治疗基因)、Nrf2(抗凋亡基因)及FTH(MRI报告基因)联合修饰,获得CXCL10分泌上调,同具有抗凋亡能力的MRI可视化MSCs,上调抗凋亡基因增强MSCs的长期存活率,将其作为持续分泌CXCL10的“细胞工厂”,增强GBM的杀伤性T细胞的募集与激活,实现对GBM的免疫治疗;同时通过FTH报告基因成像在体监测MSCs移植后的生物学行为,明确利用抗凋亡MSCs作为细胞载体的安全性。本发明采用基因工程手段对MSCs进行CXCL10、Nrf2以及FTH三基因联合修饰,构建了一种在肿瘤微环境中存活率高、能够发挥免疫治疗作用,同时能在MRI引导下实现精准定位移植的干细胞。
以下便结合实施例,对本发明的具体实施方式作进一步的详述,以使本发明技术方案更易于理解、掌握。
附图说明
图1为本发明实施例中CXCL10-T2A-Nrf2-P2A-FTH及CXCL10-T2A-FTH重组质粒图谱;
图2为本发明实施例中CXCL10-T2A-Nrf2-P2A-FTH及CXCL10-T2A-FTH目的质粒荧光图;
图3A为本发明实施例中Real-time PCR检测转染后CXCL10、Nrf2与FTH的mRNA水平结果图;
图3B为本发明实施例中Western Blot检测转染后Nrf2与FTH蛋白表达结果图;
图3C为本发明实施例中ELISA检测转染后CXCL10蛋白表达结果图;
图4为本发明实施例中CXCL10-Nrf2-FTH-MSCs的MRI图谱;
图5为本发明实施例中干细胞移植后对肿瘤生长速率影响图谱。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。
实施例
1.CXCL10-T2A-Nrf2-P2A-FTH过表达慢病毒载体的构建及鉴定
1.1目的基因获取
根据GenBank中小鼠CXCL10(NM_021274)基因、Nrf2(NM_010902)基因、FTH(NM_010239)基因序列,采用全基因化学合成法合成CXCL10-T2A-Nrf2-P2A-FTH。设计目的基因序列:fusion gene(NM_021274-T2A-NM_010902-P2A-NM_010239),其编码核苷酸序列如SEQID NO.1所示。
1.2重组质粒构建及测序
产物连接入线性化表达载体,转化新鲜的大肠杆菌感受态细胞,PCR鉴定显示目的条带位于1000bp-1000bp之间(目的基因CXCL10-Nrf2-FTH阳性转化子PCR产物大小为1496bp)。随后,取连接产物质粒CXCL10-Nrf2-FTH-LV、进行测序、分析,并与Genbank中CXCL10(NM_021274)基因、Nrf2(NM_010902)基因、FTH(NM_010239)基因序列比较,结果与目标序列基本一致,则提示序列能正确地插入质粒中,CXCL10-Nrf2-FTH过表达慢病毒载体构建成功。质粒示意图如图1所示。
1.3CXCL10-Nrf2-FTH重组质粒表达检测
将处于对数生长期的5×10
1.4慢病毒包装、收获、浓缩及滴度测定
在293T细胞于10cm
2.C57BL/6小鼠MSCs的培养及传代
取1×10
3.CXCL10-Nrf2-FTH过表达慢病毒转染MSCs
取1×10
实验例
采用携带CXCL10-FTH基因、eGFP基因的病毒以同样步骤转染MSCs获得稳转的CXCL10-FTH-MSCs、eGFP-MSCs,培养、传代作为后续实验的对照组。
1.CXCL10-Nrf2-FTH过表达慢病毒转染MSCs效率测定
1.1流式细胞仪检测CXCL10-Nrf2-FTH-MSCs荧光表达率
MSCs(2×10
1.2Real-time PCR检测转染后CXCL10、Nrf2与FTH的mRNA水平
2×10
CXCL10 F:5’CTGCAACTGCATCCATATCG
CXCL10 R:5’GATGGTCTTAGATTCCGGATTC
NRF2-F:5’CCAGCTGACCTCCTTAGACT
NRF2-R:5’ACAGGTCACAGCCTTCAATAG
FTH1-F:5’GAAACCAGACCGTGATGACT
FTH1-R:5’TGTCAGTAGCCAGTTTGTGC
GAPDH-F:5’GGCCTCCAAGGAGTAAGAAA
GAPDH-R:5’GCCCCTCCTGTTATTATGG。
以=CXCL10-Nrf2-FTH-MSCs作为实验组,采用相似步骤空病毒转染MSCs获得CXCL10-FTH-MSCs、eGFP-MSCs作为阴性对照组,以WT-MSCs作为空白对照组。结果见图3A,Real-time PCR结果显示,对比eGFP-MSCs及WT-MSCs,CXCL10-Nrf2-FTH-MSCs及CXCL10-FTH-MSCs的CXCL10、Nrf2及FTH mRNA水平均有增高,,差异有统计学意义(P<0.05)。(*:CXCL10-Nrf2-FTH-MSCs及CXCL10-FTH-MSCs、eGFP-MSC、WT-MSCs间P<0.05;#:CXCL10-FTH-MSCs及eGFP-MSCs、WT-MSCs间P<0.05)
1.3ELISA检测转染后CXCL10蛋白表达
分泌蛋白CXCL10含量采用ELISA法检测。按上述同样步骤采用CXCL10-T2A-Nrf2-P2A-FTH、CXCL10-T2A-FTH慢病毒转染MSCs,于筛选7天后。采用干扰素γ诱导蛋白(IP10)检测试剂盒进行ELISA检测。同时设置eGFP-MSCs、WT-MSCs分别为阴性对照组、空白对照组,结果见图3B,CXCL10-Nrf2-FTH-MACs及CXCL10-FTH-MSCs的CXCL10蛋白分泌量显著增加,差异有统计学意义(P<0.05)。(*:CXCL10-Nrf2-FTH-MSCs及CXCL10-FTH-MSCs、eGFP-MSC、WT-MSCs间P<0.05;#:CXCL10-FTH-MSCs及eGFP-MSCs、WT-MSCs间P<0.05)
1.4Western Blot检测转染后Nrf2与FTH蛋白表达
胞质蛋白Nrf2及FTH的含量采用Western Blot检测。按上述步骤行CXCL10-T2A-Nrf2-P2A-FTH、CXCL10-T2A-FTH慢病毒转染,于嘌呤霉素全量筛选7d后进行检测。设置eGFP-MSCs作为阴性对照组,WT-MSCs作为空白对照组,结果见图3C,对比eGFP-MSCs及WT-MSCs,CXCL10-Nrf2-FTH-MACs及CXCL10-FTH-MSCs的Nrf2、FTH蛋白表达水平增高,差异有统计学意义(P<0.05)。(*:CXCL10-Nrf2-FTH-MSCs及CXCL10-FTH-MSCs、eGFP-MSC、WT-MSCs间P<0.05;#:CXCL10-FTH-MSCs及eGFP-MSCs、WT-MSCs间P<0.05;**:CXCL10-Nrf2-FTH-MSCs及eGFP-MSC、WT-MSCs间P<0.05)
2.体外MRI
各组细胞经过含枸橼酸亚铁的培养基孵育72h后,体外MRI检测显示,CXCL10-Nrf2-FTH-MSCs+Fc组、CXCL10-FTH-MSCs+Fc组的T2WI及T2*WI上细胞的信号减低,未加枸橼酸亚铁孵育的CXCL10-Nrf2-FTH-MSCs与CXCL10-FTH-MSCs的T2WI及T2*WI信号则无明显减低,与WT-MSCs组无明显差异,提示CXCL10-Nrf2-FTH-MSCs与CXCL10-FTH-MSCs需要经过体外铁孵育后才能实现MRI成像。如图4所示,经枸橼酸亚铁孵育后的CXCL10-Nrf2-FTH-MSCs与CXCL10-FTH-MSCs在T2WI及T2*WI呈低信号,低于其他各组。
3.活体MRI监测及肿瘤生长曲线
在基线时间(Baseline)、MSCs注射当天(D01)、注射后第7天(D07)、第14天(D14)、第21天(D21)五个时间点,采集瘤周注射CXCL10-Nrf2-FTH-MSCs组、CXCL10-FTH-MSCs组、eGFP-MSCs组、PBS组MRI T2WI序列图像。在基线时间,T2WI上均可见类圆形稍高信号的瘤体形成,周围可见少许低信号出血。CXCL10-Nrf2-FTH-MSCs组从Baseline至D21,肿瘤体积逐渐稍增大,增长速率较慢;CXCL10-FTH-MSCs组从基线时间至D21,肿瘤体积逐渐增加,增大增速快于CXCL10-FTH-MSCs,但慢于eGFP-MSCs组、PBS组;eGFP-MSCs组、PBS组肿瘤体积逐渐增大,程度相似,较CXCL10-Nrf2-FTH-MSCs组及CXCL10-FTH-MSCs明显。
基线水平及CXCL10-Nrf2-FTH-MSCs、CXCL10-FTH-MSCs、eGFP-MSCs、PBS注射后各时间点(D01、D07、D14、D21)于T2WI上测量肿瘤体积,对比各组胶质瘤生长速率如图5所示,CXCL10-Nrf2-FTH-MSCs组肿瘤生长速率最慢,显著低于其余各组,差异有显著统计学意义(P<0.05);CXCL10-FTH MSCs组肿瘤生长速度较CXCL10-Nrf2-FTH-MSCs组快,但慢于eGFP-MSCs组及PBS组,差异有统计学意义(P<0.05);eGFP-MSCs组及PBS组肿瘤生长速率最快,组间的差异无统计学意义(P>0.05)。以上结果表明CXCL10-Nrf2-FTH MSCs对胶质瘤有明显治疗效果;CXCL10-FTH-MSCs对胶质瘤也有一定治疗效果,但治疗效果不如前者显著。(*:P<0.05)。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
- 一种用于胶质瘤免疫治疗同时可磁共振示踪的间充质干细胞制剂
- 间充质干细胞的制造方法、间充质干细胞的治疗效果标志物和治疗效果判断方法、以及包含间充质干细胞的细胞制剂
