SH2超亲体蛋白及其与固相缀合所形成的缀合物
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及蛋白质组学技术领域,具体而言,涉及SH2超亲体蛋白及其与固相缀合所形成的缀合物。
背景技术
蛋白质磷酸化在生命活动中具有重要的调控作用,是目前蛋白质组学中翻译后修饰研究的热点。研究表明,在静息状态下真核细胞中约1/3的蛋白处于磷酸化状态。蛋白激酶通过催化特定底物发生磷酸化以实现调控细胞中的各种生物学过程,如细胞周期、细胞生长和细胞分化等。蛋白质磷酸化可发生在许多种类的氨基酸上,其中丝氨酸、苏氨酸和酪氨酸为最为常见磷酸化位点。蛋白质磷酸化是一个可逆的动态过程,受蛋白激酶和磷酸酶的竞争活性调节。磷酸化和去磷酸化是激活关键调控蛋白和控制信号通路传导的开关。一旦磷酸化过程发生异常,则导致相关信号通路功能失调。因此,蛋白质磷酸化的异常与多种类疾病的发生存在关联,例如炎症性疾病、糖尿病、传染病、心血管疾病和癌症等。目前,大量蛋白激酶和磷酸酶都已成为药物开发的热门靶点。
蛋白激酶/磷酸酶调控的信号通路几乎参与了所有类型的癌症的发生和发展,随着人们对蛋白激酶/磷酸酶的了解加深,以蛋白激酶/磷酸酶为靶点的药物开发也越发受到人们的重视。以酪氨酸激酶为例,EGFR作为一种酪氨酸激酶型受体,可以与配体结合形成激活后的二聚体,该二聚体通过激活胞内的激酶通路,磷酸化Y992,Y1045,Y1068,Y1148和Y1173等激活位点,进而激活Ras/Raf/MAPK或PI3K/Akt信号通路,调节肿瘤细胞的存活,增殖和转移。很多针对EGFR受体的抑制剂是迄今为止最成功的靶向癌症治疗实例之一,如Erlotinib,Gefitinib,Lapatinib等。Sorafenib也是用于肿瘤治疗的酪氨酸激酶抑制剂的典型代表之一,它是一种多靶点的酪氨酸激酶抑制剂,包括血管内皮生长因子受体(参与血管发生与生长,创伤修复,炎症等过程),c-Kit激酶和Raf激酶等,对抗肿瘤血管生成以及诱导肿瘤细胞凋亡具有显著影响。虽然酪氨酸激酶的地位如此重要,但目前市场上依旧缺乏足够的靶向药物,其限制性因素为酪氨酸激酶鉴定的数量远远不足,由于酪氨酸磷酸化通常在很低的计量范围内及分布在多个位点上,所以对其鉴定分析的难度很大。为了提高酪氨酸磷酸化位点的鉴定深度,通常会把酪氨酸磷酸化肽段富集后再进行检测,常规流程如下:1.蛋白质的提取及定量;2.用酶的方法将蛋白质分割成多肽;3.从复杂的多肽中富集到自己所要研究的酪氨酸磷酸化多肽;4.用质谱分析酪氨酸磷酸化多肽。
除去蛋白质磷酸化的化学计量值低的缺点,复杂多肽混合物中所包含的非磷酸化修饰的肽段,也将抑制磷酸肽信号的响应。另一方面,要获得满意的修饰图谱需要多次试验,故需要足够的蛋白质样品来满足需求。因此,分析前对磷酸肽的分离与富集方法至关重要。
以富集磷酸化的酪氨酸肽段为例,市面上已出现多种商品化的酪氨酸磷酸化抗体,如:PT66、anti-pTyr-4G10、pY99、P-Tyr-100。但是,这些抗体价格昂贵,批次之间重复性较差且量少,考虑到大量的酪氨酸磷酸化位点需要鉴定,昂贵的抗体很难满足这种需求。
基于SH2超亲体(SH2-superbinder)利用噬菌体展示技术,通过对野生型SH2结构域进行进化突变,最终获得磷酸化酪氨酸捕获力提升1000倍的SH2结构变体。因此,SH2超亲体可以很好地作为抗体替代物,用于复杂样品酪氨酸磷酸化蛋白质组分析。通过在SH2结构域与酪氨酸磷酸化位点的结合口袋引入三个氨基酸突变,使得解离常数值达到与抗体抗原相当的纳摩尔水平,使SH2超亲体用于酪氨酸磷酸化肽段的纯化成为新选择。但目前缺少一种能够既能保持蛋白活性,又能将SH2超亲体固定到支持物便于酪酸磷酸化富集的方法。
发明内容
本发明的目的在于提供一种经过改造的SH2超亲体蛋白,其氨基酸序列如SEQ IDNO:1所示。
该蛋白通过对原有SH2超亲体蛋白改造得到,改造过程并没有对SH2超亲体蛋白活力造成影响,且改造后可通过巯基与固相交联。
本发明还提供了该SH2超亲体蛋白的核酸、载体和含有其的宿主细胞。
本发明还提供如上所述SH2超亲体蛋白C末端的半胱氨酸形成的二硫键与固相缀合所形成的缀合物,以及含有该缀合物试剂盒及其应用。
本发明通过SH2超亲体蛋白C端的半胱氨酸残基和偶联固相孵育时,固相与暴露的巯基(-SH)发生特异性高效反应,形成永久性地将SH2超亲体蛋白连接到树脂的共价且不可逆硫醚键。通过巯基交联方式,保持了SH2蛋白偶联到固相的空间柔性,可以有效地从复杂的蛋白质酶切产物中捕获到酪氨酸磷酸化肽段。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为本发明一个实施例所提供的改造前后SH2超亲体蛋白的活力检测结果;
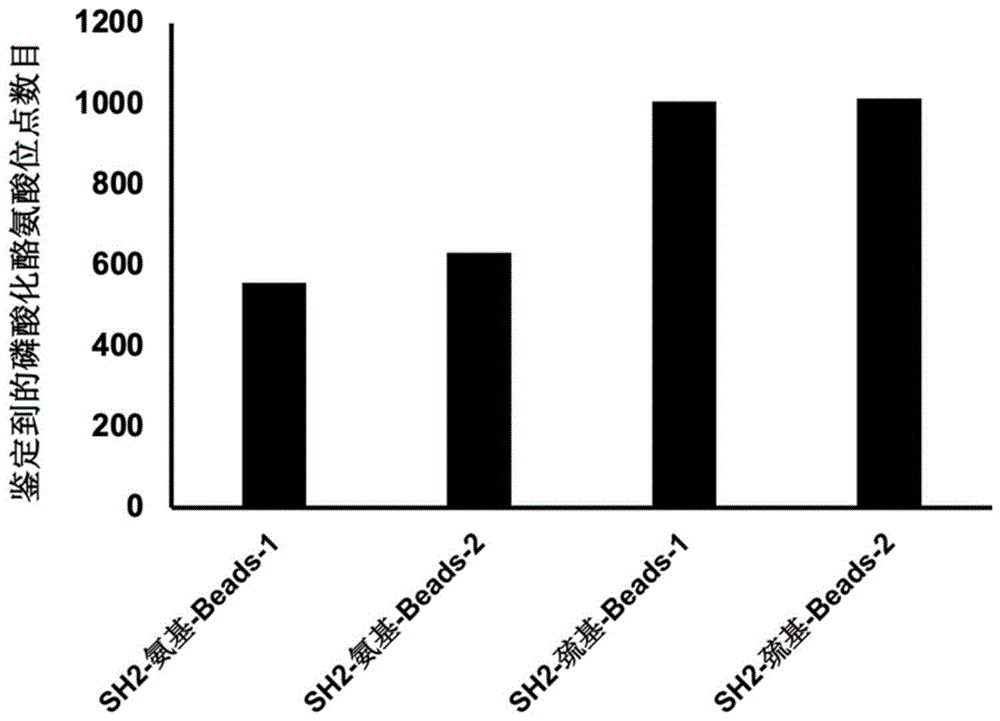
图2为本发明一个实施例所提供的不同交联方式固定SH2-Beads富集的肽段数。
具体实施方式
现将详细地提供本发明实施方式的参考,其一个或多个实例描述于下文。提供每一实例作为解释而非限制本发明。实际上,对本领域技术人员而言,显而易见的是,可以对本发明进行多种修改和变化而不背离本发明的范围或精神。例如,作为一个实施方式的部分而说明或描述的特征可以用于另一实施方式中,来产生更进一步的实施方式。
除非另有说明,用于披露本发明的所有术语(包括技术和科学术语)的意义与本发明所属领域普通技术人员所通常理解的相同。通过进一步的指导,随后的定义用于更好地理解本发明的教导。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。
本文所使用的术语“和/或”、“或/和”、“及/或”的选择范围包括两个或两个以上相关所列项目中任一个项目,也包括相关所列项目的任意的和所有的组合,所述任意的和所有的组合包括任意的两个相关所列项目、任意的更多个相关所列项目、或者全部相关所列项目的组合。需要说明的是,当用至少两个选自“和/或”、“或/和”、“及/或”的连词组合连接至少三个项目时,应当理解,在本申请中,该技术方案毫无疑问地包括均用“逻辑与”连接的技术方案,还毫无疑问地包括均用“逻辑或”连接的技术方案。比如,“A及/或B”包括A、B和A+B三种并列方案。又比如,“A,及/或,B,及/或,C,及/或,D”的技术方案,包括A、B、C、D中任一项(也即均用“逻辑或”连接的技术方案),也包括A、B、C、D的任意的和所有的组合,也即包括A、B、C、D中任两项或任三项的组合,还包括A、B、C、D的四项组合(也即均用“逻辑与”连接的技术方案)。
本发明中所使用的术语“含有”、“包含”和“包括”是同义词,其是包容性或开放式的,不排除额外的、未被引述的成员、元素或方法步骤。
本发明中用端点表示的数值范围包括该范围内所包含的所有数值及分数,以及所引述的端点。
本发明中涉及浓度数值,其含义包括在一定范围内的波动。比如,可以在相应的精度范围内波动。比如2%,可以允许±0.1%范围内波动。对于数值较大或无需过于精细控制的数值,还允许其含义包括更大波动。比如100mM,可以允许±1%、±2%、±5%等范围内的波动。涉及分子量,允许其含义包括±10%的波动。
本发明中,涉及“多个”、“多种”等描述,如无特别限定,指在数量上指大于等于2。
本发明中,以开放式描述的技术特征中,包括所列举特征组成的封闭式技术方案,也包括包含所列举特征的开放式技术方案。
本发明中,“优选”、“更好”、“更佳”、“为宜”仅为描述效果更好的实施方式或实施例,应当理解,并不构成对本发明保护范围的限制。本发明中,“可选地”、“可选的”、“可选”,指可有可无,也即指选自“有”或“无”两种并列方案中的任一种。如果一个技术方案中出现多处“可选”,如无特别说明,且无矛盾之处或相互制约关系,则每项“可选”各自独立。
本文所用术语“肽”或“多肽”定义为氨基酸残基链,其通过肽键结合并且通常具有限定序列。本文所用术语“肽”或“多肽”可以(但不必然)指不具有任何N末端和/或C末端氨基酸残基的氨基酸残基链。也就是,本文所用“肽”或“多肽”可以指嵌入更长氨基酸链的氨基酸链。本文所用术语“肽”包括术语“多肽”、“肽”和“蛋白质”。
“肽段混合样品”指包含多种如上所定义的肽的混合物。其来源可以是需要获得蛋白质酪氨酸磷酸化的概况的任何样品,所述蛋白质酪氨酸磷酸化的概况包括蛋白质激酶活性或免疫受体磷酸酪氨酸信号传导的概况。因此,样品可以是包含生物材料的任何样品,并且其包含或怀疑包含活性蛋白质激酶或由活性蛋白质激酶修饰的肽(如含pTyr的肽),包括在激酶(如激酶活化环)内,在磷酸酶调节区内,在ITRM内,和在激酶和磷酸酶下游靶标内。样品可以包括但不限于:建立的细胞系;细胞培养物,包括原代细胞培养物;生物流体,如血清、血浆、尿或血液;组织样品;或组织提取物。样品可以是人或非人源的,或者可以包含人或非人蛋白质激酶活性或人或非人的含pTyr的肽。肽段混合样品可通过公知的方法获得,例如将蛋白质通过酶(如胰酶等)酶解后所得产物。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。除非和本申请的发明目的和/或技术方案相冲突,否则,本发明涉及的引用文献以全部内容、全部目的被引用。本发明中涉及引用文献时,相关技术特征、术语、名词、短语等在引用文献中的定义也一并被引用。本发明中涉及引用文献时,被引用的相关技术特征的举例、优选方式也可作为参考纳入本申请中,但以能够实施本发明为限。应当理解,当引用内容与本申请中的描述相冲突时,以本申请为准或者适应性地根据本申请的描述进行修正。
本发明涉及一种SH2超亲体蛋白,其氨基酸序列如SEQ ID NO:1所示。
在一些实施方式中,所述的SH2超亲体蛋白的N端连接标签蛋白。
标签出于各种目的而附着在蛋白质,例如以便容易纯化,帮助蛋白质的正确折叠,防止蛋白质沉淀,改变层析特性,修饰蛋白质或者标记蛋白质或给蛋白质贴标签。标签的实例包括Arg标签、His标签、Strep标签、Flag标签、T7标签、V5-肽标签、GST标签和c-Myc标签中的一种或多种。本发明中的优选标签是由六个组氨酸残基组成的His标签。
根据本发明的再一方面,还涉及编码如上所述的SH2超亲体蛋白的核酸。
核酸通常是RNA或DNA,核酸分子可以是单链或双链的,但优选是双链DNA。当将核酸与另一个核酸序列置于功能关系中时,核酸是“有效连接的”。例如,如果启动子或增强子影响编码序列的转录,那么启动子或增强子有效地连接至所述编码序列。当其连入载体时优选采用DNA核酸。此外,核酸分子可根据不同的宿主细胞进行密码子优化。
需要说明的是,在一个方面,该SH2超亲体蛋白/核酸还包含其在适宜范围内发生突变的变体,例如与SEQ ID NO:1所示氨基酸序列具有大于85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列/核苷酸序列,且突变后都位点不产生半胱氨酸。术语“%同一性”在两个或更多个核苷酸序列或氨基酸序列的上下文中,指的是相同或具有特定百分比的相同氨基酸残基或核苷酸的两个或多个序列或子序列,当比较和比对以用于最大对应时,如使用以下序列比较算法之一或通过目视检查来测量的。例如,%同一性是相对于要比较的序列的编码区域的整个长度。
该SH2超亲体蛋白相比改造前具有基本相同的亲和力。
根据本发明的再一方面,还涉及含有如上所述核酸的载体。
术语“载体(vector)”是指,可将多聚核苷酸插入其中的一种核酸运载工具。当载体能使插入的多核苷酸编码的蛋白获得表达时,载体称为表达载体。载体可以通过转化,转导或者转染导入宿主细胞,使其携带的遗传物质元件在宿主细胞中获得表达。载体是本领域技术人员公知的,包括但不限于:质粒;噬菌粒;柯斯质粒;人工染色体,例如酵母人工染色体(YAC)、细菌人工染色体(BAC)或P1来源的人工染色体(PAC);噬菌体如λ噬菌体或M13噬菌体及动物病毒等。可用作载体的动物病毒包括但不限于,逆转录酶病毒(包括慢病毒)、腺病毒、腺相关病毒、疱疹病毒(如单纯疱疹病毒)、痘病毒、杆状病毒、乳头瘤病毒、乳头多瘤空泡病毒(如SV40)。在一些实施方式中,本发明所述载体中包含基因工程中常用的调控元件,例如增强子、启动子、内部核糖体进入位点(IRES)和其他表达控制元件(例如转录终止信号,或者多腺苷酸化信号和多聚U序列等)。
根据本发明的再一方面,还涉及宿主细胞,其含有如上所述的核酸,或如上所述的载体。
在癌症磷酸化蛋白质组学研究领域中,磷酸化酪氨酸鉴定数目的提升是整个组学的基础,例如通过提高鉴定数目,可以在靶点发现、靶点鉴定、药物重定位、生物标志物发现等方面全面助力精准医疗的新药研发。所以针对磷酸化酪氨酸富集方法的改进对于整个磷酸化蛋白组学具有很重要的意义。发明人在实验过程中,研究了不同的交联化方式进行固定SH2超亲体蛋白,意外地发现通过巯基将SH2超亲体交联与固相之上,能有效提升磷酸化酪氨酸鉴定数目,因而能够大大提升SH2超亲体在磷酸化酪氨酸鉴定中的准确度和效率。
术语“宿主细胞”是指,可用于导入载体的细胞,其包括但不限于,如大肠杆菌或枯草菌等的原核细胞,如酵母细胞或曲霉菌等的真菌细胞,如S2果蝇细胞或Sf9等的昆虫细胞,或者如纤维原细胞,CHO细胞,NSO细胞,HeLa细胞,HEK 293细胞等的动物或人细胞。宿主细胞优选为原核细胞,更优选为大肠杆菌。
根据本发明的再一方面,还涉及如上所述SH2超亲体蛋白C末端的半胱氨酸与固相通过二硫键缀合所形成的缀合物。
本发明所用术语“固相”指代并且包括能够结合本文所公开的亲和力试剂的任何支持物。熟知的支持物或运载体包括玻璃(例如硼硅酸盐玻璃)、琼脂、琼脂糖、琼脂糖衍生物、磁珠、二氧化硅、二氧化钛、藻酸盐、纤维素、纤维素衍生物、葡聚糖、淀粉、环糊精、壳聚糖、角叉菜胶、瓜尔胶、阿拉伯胶、印度胶、黄蓍胶、刺梧桐树胶、槐豆胶、黄原胶、果胶、粘蛋白、肝硫酯和明胶、硅、陶瓷、玻璃、聚氨酯、聚苯乙烯、聚苯乙烯二乙烯基苯、聚甲基丙烯酸甲酯、聚丙烯酰胺、聚乙二醇对苯二甲酸酯、聚乙酸乙烯酯、聚乙烯、聚丙烯、聚氯乙烯、聚乙烯吡咯烷酮中的任一种,或任意几种形成的共聚物或混合物。支持物材料实际上可以具有任何结构构造,只要偶联的亲和力试剂能够结合肽和/或蛋白质。因此,支持物构造可以是SPE固相萃取柱、带分离膜的离心管、EP管、分离膜、微量反应板凹孔、微球、柱状体、片状物或多孔板。本领域技术人员将知晓用于结合亲和力试剂的许多其它合适的运载体,或将能够采用常规实验确定此类载体。
在一些实施方式中,所述固相为琼脂糖微球。微球的粒径范围优选为0.1μm~1mm,例如0.1μm、0.5μm、1μm、2μm、5μm、10μm、20μm、50μm、100μm、500μm、700μm。
本发明还涉及含有如上所述的缀合物的试剂盒。
术语“试剂盒”是指包括至少一个设备的任何制品(例如,包装或容器),试剂盒可进一步包括在本文中描述的方法或其步骤中使用的使用说明书、补充试剂和/或组分或组件。
在一些实施方式中,试剂盒中还可以包含洗涤缓冲液,洗脱液等组分。
本发明还涉及一种富集酪氨酸磷酸化肽段的方法,包括:
a)将肽段混合样品与如上所述的缀合物共孵育以使得其中的酪氨酸磷酸化肽段与固相结合;
b)清洗所述固相,并将所述酪氨酸磷酸化肽段从所述固相上分离。
根据本发明的再一方面,还涉及测试酪氨酸磷酸化肽段的方法,包括:
采用如上所述的方法富集酪氨酸磷酸化肽段并鉴定分离的酪氨酸磷酸化肽段。
在一些实施方式中,所述的方法还包括对所述分离的酪氨酸磷酸化肽段定量。
在一些实施方式中,所述鉴定或所述定量的方法包括质谱技术。
质谱技术可以包括例如多重反应监测(MRM)、选择性反应监测(SRM)或平行反应监测(PRM)技术。
下面将结合实施例对本发明的实施方案进行详细描述。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,优先参考本发明中给出的指引,还可以按照本领域的实验手册或常规条件,还可以参考本领域已知的其它实验方法,或者按照制造厂商所建议的条件。
下述的具体实施例中,涉及原料组分的量度参数,如无特别说明,可能存在称量精度范围内的细微偏差。涉及温度和时间参数,允许仪器测试精度或操作精度导致的可接受的偏差。
在下述实施例中,所用到的实验材料主要包括:
A菌半裂解液(50mM NaH
B菌裂解液配方(91.5%菌半裂解液,1%PMSF,0.5%TECP,1%溶菌酶,1%核酶,5%Triton X-100)
C IAP buffer(自配试剂,配方为:pH 7.6,50mM Tris-HCl,50mM NaCl,10mMNaHPO
D Washing buffer(可配置储液,配方为:pH 8.0,50Mm NaH
E Elution buffer(现配现用,配方为:pH 8.0,50Mm NaH
F(Beads-SH2)coupling buffer(自配试剂,配方为:pH 8.0,菌半裂解液)
G巯基交联(Beads-SH2)washing buffer(自配试剂,配方为:pH 8.0,50mM Tris-HCl,1M NaCl)
H氨基交联(Beads-SH2)washing buffer(自配试剂,配方为:pH 8.0,50mMNaH
I巯基交联(Beads-SH2)Blocking buffer(自配试剂,配方为:pH 8.0,50mM L-Cysteine)
J氨基交联(Beads-SH2)Blocking buffer(自配试剂,配方为:pH 8.0,50mMNH
K(Beads-SH2)storage buffer(自配试剂,配方为:pH 8.0,1×IAP,0.2%叠氮化钠)
L镍柱纯化材料
(SulfoLink
(AminoLink
M荧光肽段
FITC-GGpYGG用于检测SH2超亲体的pY肽段结合活性测定
对比实施例
SH2超亲体与固相支持物连接处的官能团靶点为非选择性靶点,或选自氨基、羧基、巯基、醛基、羟基和叠氮基中的任一种。用于蛋白质偶联的常用交联反应基团示例如下:
交联时使用含有化学反应基团的固相支持物,功能基团的游离端与所述携带化学反应集团的固定修饰物偶联;
对SH2超亲体蛋白交联到固定载体分析:以伯氨基和巯基作为交联官能团的交联工艺,更适合于把SH2超亲体蛋白通过偶联反应交联到偶联树脂颗粒上,以羧基官能团交联的EDC一步法,可以同时连接蛋白上的氨基和羧基,同时还会产生一些副反应,不好实现,一般不用。羟基官能团交联一般用在糖类等其他交联工艺上。若以巯基官能团交联,由于SH2超亲体蛋白具有两个半胱氨酸,且位于蛋白内部,会导致交联位点不确定,效果无法预期。
综合上述分析,通过氨基反应偶联到固定支持物上是当前最优的技术方案。
选择氨基反应偶联SH2超亲体蛋白,由于SH2超亲体蛋白本身存在游离的伯氨基,因此不需要对蛋白质进行进一步的改造,直接可以交联到支持物上,详细流程如下:
1、表达SH2蛋白
把插入有原有SH2超亲体蛋白的重组质粒转化到DH5α大肠杆菌,使用抗体筛选阳性单株,菌株测序,挑选出DNA序列符合条件的阳性菌株,摇菌,保菌及进行质粒提取,使用质粒转化到BL21(DE3)表达菌株,从而进行蛋白的表达。
原有SH2超亲体序列(添加了His标签从而使蛋白质能够纯化):
MKHHHHHHPMS(His标签)-DYDIPTTENLYFQGAMDSIQAEEWYFGKITRRESERLLLNAENPRGTFLVRESETVKGAYALSVSDFDNAKGLNVRHYLIRKLDSGGFYITSRTQFNSLQQLVAYYSKHADGLCHRLTTVCPTSK(SEQ ID NO:2)
蛋白表达,首先需要对BL21阳性菌株加入对应的抗生素进行小摇,16小时后转大摇,准备1L的LB培养液,加入对应的抗生素,以1:1000的比例转接大肠杆菌,37℃摇3-4小时,OD值为0.6-0.8之间,加IPTG诱导蛋白表达,16℃过夜表达,第二天,离心机5000g 4℃收集细胞沉淀,存放与-80℃冰箱。
2、清洗Beads
蛋白纯化,配制菌裂解液和菌半裂解液,用菌裂解液把表达有SH2超亲体蛋白的大肠杆菌沉淀重悬起来,用超声波破碎仪,破碎大肠杆菌,高速离心,收集上清,首先平衡镍柱,洗涤镍柱纯化Beads,蛋白提取液与镍柱纯化Beads 4℃,共同孵育30min,过柱子,用Washing buffer,清洗Beads,把非特异性结合的杂蛋白洗脱掉,直至Broadford测定,流出液中无杂蛋白时,即可,收集流出的液体样本,跑胶检测使用,用Elution buffer,把SH2超亲体蛋白,从Beads上洗脱下来。收集的提取过程中产生的蛋白质样品跑胶并进行考染,观察纯化的蛋白是否与预期大小相符。
3、氨基反应交联
1).BCA测蛋白质浓度;
2).用AminoLink
3).用PBS缓冲液清洗亲和层析柱,平衡柱子pH值,在柱子里加入对应比例的Beads混悬液,清洗Beads 3次;
4).Beads与SH2蛋白结合,4℃旋转结合15分钟,冰上静止30min;
5).过亲和层析柱,收集Beads,用含有NH
6).使用20ml洗涤buffer,把SH2超亲体Beads洗涤3次;
7).用1×IAP把Beads转移到15ml离心管,加入叠氮化钠,终浓度0.2%,放入4℃保存。
4、将连接的SH2-Beads,进行pY肽段富集
实验样本:所检测的对象为过矾酸钠处理10分钟的人源A549肿瘤细胞多肽,所述人源A549肿瘤细胞多肽根据基于SH2-superbinder的酪氨酸磷酸化富集方法中的前处理操作所得。
取200ug过矾酸钠处理10分钟的人源A549肿瘤细胞多肽,然后按照如下技术方案进行磷酸化酪氨酸富集。浓度测定所用试剂盒为thermo公司的BCA试剂盒,货号为23225。
①向200ug多肽干粉中加入IAP溶解多肽干粉。
②清洗带有SH2-superbinder蛋白琼脂糖微球Agarose Beads,制备成40%混悬液。
③吸取150μl Agarose Beads加入到样品中,进行孵育。
④离心弃上清。
⑤加入高盐清洗液进行清洗。
⑥加入50mM碳酸氢铵水溶液进行清洗。
⑦加入0.5%三氟乙酸进行洗脱。
⑧洗脱后样本进行C18脱盐。
将得到的肽段溶液抽干,复溶后按照上述的方法进行液相联用串联质谱进行DDA检测(LC-MS/MS),即可得到鉴定和定量结果。
富集到的肽段干粉为例,按照如下方法进行检测:
所得到的肽段使用液相联用串联质谱进行检测,其中液相色谱仪采用的是ThermoUltimate 3000系列型号,质谱仪是Thermo Scientific公司orbitrap exploris 480型号。
做3个技术重复,每个重复注射1针,每针跑2个小时,总检测时长为6小时。
质谱主要参数为:
离子源电压设置为2.1kV;一级质谱扫描范围400~1200m/z;分辨率设置为60,000;二级质谱DDA采集模式循环时间为3s。离子碎裂模式为高能碰撞解离模式(HCD),碎片离子在Orbitrap中进行检测。动态排除时间设定为30s。AGC设置为:一级3E6,二级1E5。
质谱数据分析所用软件为Proteome Discoverer 2.5,搜索鉴定主要参数:数据库为swissprot的homo蛋白数据库;一级质谱质量误差范围10ppm;二级质谱质量误差范围0.02Da;固定修饰为“Carbamidomethyl(C)”;可变修饰为“Oxidation(M),Acetyl(ProteinN-terminus),Phosphorylation(STY)”,酶切方式Trypsin,最大允许漏切数为2。
经检测SH2超亲体富集得到的磷酸化酪氨酸肽段数量约为600左右,磷酸化酪氨酸位点数目不超过500。该效果未达到发明人预期。
实施例1 SH2超亲体的改造
为进一步改善SH2超亲体对磷酸化酪氨酸肽段数的富集能力,发明人尝试采用巯基官能团进行交联。
首先通过质粒改造,将原有SH2超亲体进行突变消除其内部的半胱氨酸,并给SH2超亲体的C端引入含有半胱氨酸的肽段。
改造后的SH2超亲体序列为:
MKHHHHHHPMS(His标签)-DYDIPTTENLYFQGAMDSIQAEEWYFGKITRRESERLLLNAENPRGTFLVRESETVKGAYALSVSDFDNAKGLNVRHYLIRKLDSGGFYITSRTQFNSLQQLVAYYSKHADGLSHRLTTVSPTSKGGSGGCLE(SEQ ID NO:1)
采用对比实施例中的方法表达改造后的SH2超亲体蛋白。
为了验证SH2超亲体经过改造后,与PY肽段的亲和力是否受到影响,我们针对该问题设计了荧光偏振结合实验,以便对原SH2超亲体蛋白和改造后SH2超亲体蛋白进行亲和力的评价,此实验以FITC-GGpYGG荧光肽段作为底物,与原SH2超亲体(SEQ ID NO:1所示)和改造后的SH2超亲体,分别进行结合,孵育在室温下pH 7.4的磷酸盐缓冲盐水(PBS)缓冲液中进行,通过EnVision HTS多标记板读数器(Perkin Elmer)上测量荧光偏振结合信号,通过实验获得,原SH2超亲体与磷酸化酪氨酸荧光肽段的解离常数(Kd)为1.8μM,改造后SH2超亲体与磷酸化酪氨酸荧光肽段的解离常数为1.3μM,由于解离常数越小,亲和力越强,通过图1可以看出,改造后的SH2超亲体蛋白的亲和力并没有明显的变化,该改造并没有对SH2超亲体蛋白活力造成影响。
实施例2巯基反应交联
将改造后的SH2超亲体蛋白通过巯基与固相交联,交联过程如下:
1)BCA测蛋白质浓度;
2)用SulfoLink
3)首先需要清洗亲和层析柱,平衡柱子pH值,在柱子里加入对应比例的Beads混悬液,清洗Beads 3次;
4)Beads与SH2蛋白结合,4℃旋转结合15分钟,冰上静止30min;
5)过亲和层析柱,收集Beads,用含有半胱氨酸的Blocking buffer封闭Beads上未结合的半胱氨酸结合位点,封闭完成;
6)使用20ml洗涤buffer,把SH2超亲体Beads洗涤3次;
7)用1×IAP把Beads转移到15ml离心管,加入叠氮化钠,终浓度0.2%,放入4℃保存。
采用对比实施例的方法中方法,将巯基连接的SH2-Beads,对相同的样本进行pY肽段富集,并将质谱结果进行比较,结果如表1和图2所示。
表1.使用不同交联方式的SH2-Beads富集的pY肽段质谱结果
从表中的结果显示,在使用相同材料时,使用巯基交联到树脂的Beads,与氨基交联的Beads,用于pY肽段的富集,用质谱鉴定到的pY肽段的数量和位点数存在明显的差异,巯基交联方式的SH2-Beads富集效率要提高将近一倍。
通过分析研究后,我们猜测可能是以下原因造成,氨基虽然可以将SH2蛋白固定在偶联树脂Beads,但蛋白质N端或含伯氨基的氨基酸侧链一旦与Beads发生连接,将大大降低SH2蛋白构象的灵活性,不利于结合酪氨酸磷酸化肽。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准,说明书及附图可以用于解释权利要求的内容。
- 亲硫性固相以及包含硫代羰基核苷酸的寡核苷酸的缀合物
- 亲硫性固相以及包含硫代羰基核苷酸的寡核苷酸的缀合物
