APY29在制备RSK4激酶抑制剂中的用途
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于肿瘤药物研究领域,具体涉及一种APY29在制备RSK4激酶抑制剂中的用途。
背景技术
肾细胞癌(renal cell carcinoma,RCC)是泌尿系统常见的恶性肿瘤,起源于肾小管上皮细胞,约占肾脏恶性肿瘤的80-90%,组织类型多样,以肾透明细胞癌(clear cellrenal cell carcinoma,ccRCC)为主,其组织学特征为富含血管。肾细胞癌中血管生成与肿瘤的发生、发展及治疗密切相关。目前RCC的治疗方式仍以手术切除为主,对于转移性或不可切除性RCC,一线治疗为针对血管生成相关的VEGF/VEGFR(血管内皮细胞生长因子/血管内皮细胞生长因子受体)使用酪氨酸激酶抑制剂舒尼替尼等。但是,靶向药物带来的不良反应较多,约70%的患者会出现高血压或者高血压进展的不良反应,且普遍在一年左右的时间就会出现耐药。因此探索研究防治RCC血管生成的相关策略具有重要临床意义,可以为其靶向治疗提供新的理论依据和有效补充。
RSK4是核糖体S6蛋白激酶(ribosomal s6 kinase,RSK)家族成员之一,由746个氨基酸编码,作为MAPK通路的下游分子,在细胞的增殖、存活、周期进展等过程中具有重要作用,同时也在一些肿瘤如食管癌、子宫内膜癌及乳腺癌的发生发展、侵袭转移中起重要的促癌作用。因此,探讨特异性针对RSK4激酶的抑制剂并为晚期肾细胞癌患者提供一条新的治疗途径显得尤为重要。
发明内容
鉴于以上技术问题,本发明提供以下技术方案:
本发明第一方面,提供一种APY29在制备RSK4激酶抑制剂中的用途。
优选地,所述APY29用于制备RSK4下游底物核糖体蛋白S6磷酸化的抑制剂。
本发明第二方面,提供一种所述APY29在制备治疗/预防与RSK4激酶相关疾病的药物中的用途。
优选地,所述与RSK4激酶相关疾病为肾癌。
优选地,所述肾癌是肾透明细胞癌。
优选地,所述APY29用于制备肾透明细胞癌的增殖抑制剂。
优选地,所述APY29用于制备肾透明细胞癌侵袭和迁移的阻断剂。
本发明第三方面,提供一种治疗/预防与RSK4激酶相关疾病的药物,其包括所述APY29。
优选地,所述药物包括舒尼替尼。
本发明第四方面,提供一种所述药物在制备抑制肾透明细胞癌导致的异常活跃血管生成的药物中的用途。
对比现有技术,本发明的有益效果为:
本发明提供了APY29在制备RSK4激酶抑制剂中的用途。试验结果表明,APY29能够有效抑制RSK4的磷酸化,抑制RSK4的激活,APY29对RSK4激酶抑制率为98.4%。体内试验结果证明,APY29能够抑制肾癌细胞的增殖、生长及肾癌细胞的侵袭和迁移。APY29与舒尼替尼协同使用,还能够显著降低肾透明细胞癌导致的异常活跃的血管生成。
附图说明
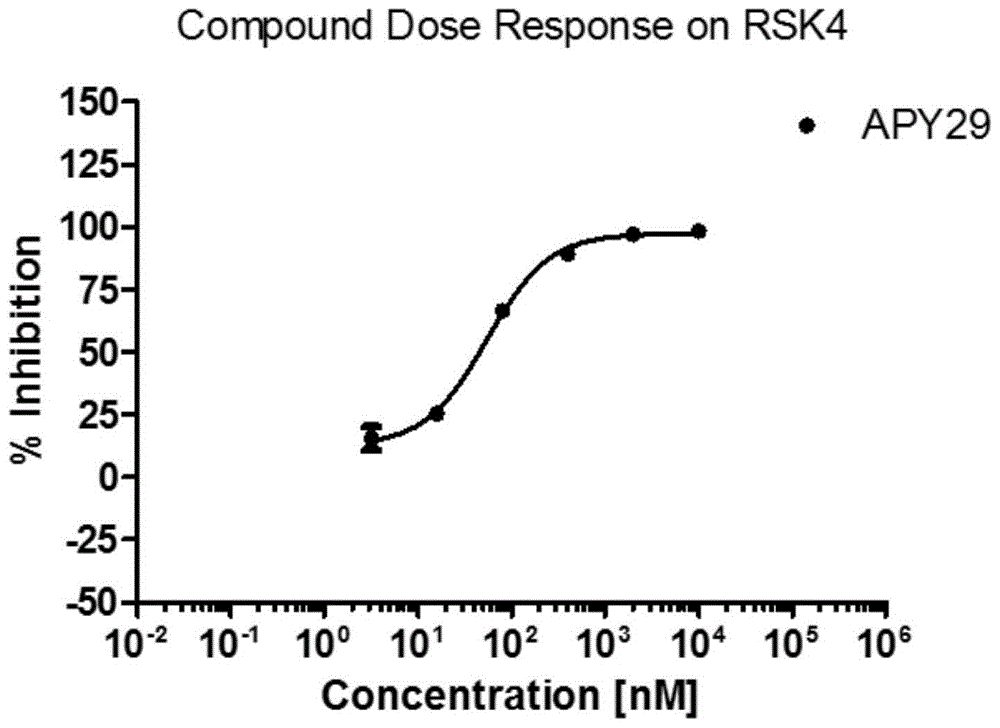
图1是不同浓度APY29对RSK4酶的抑制作用;
图2是Westernblot检测不同浓度APY29对RSK4下游底物的磷酸化水平的影响;
图3是各组对细胞ACHN细胞增殖的影响;
图4是在ACHN细胞中,APY29的IC50=0.6233μM;
图5是Transwell检测APY29对ACHN细胞侵袭的影响;A、APY29对ACHN细胞侵袭的transwell实验;B、Transwell实验的统计数据;
图6是敲低RSK4后APY29对ACHN细胞的影响;A、敲低RSK4后ACHN侵袭迁移能力减弱;B、侵袭迁移实验的统计数据;
图7是各组对小鼠体内肿瘤生长的抑制作用;
图8是单用舒尼替尼和联用APY29对HUVEC细胞成管的影响;
图9是单用舒尼替尼和联用APY29对HUVEC细胞成管数量影响的统计数据。
具体实施方式
为了进一步理解本发明,下面结合实施例对本发明优选实施方案进行描述,但是应当理解,这些描述只是为了进一步说明本发明的特征和优点,而不是对发明权利要求的限制。本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明内。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。虽然相信本领域普通技术人员充分了解以下术语,但仍陈述以下定义以有助于说明本发明所公开的主题。
如本文所使用,术语“包含”与“包括”、“含有”或“特征在于”同义,并且是包括端点在内或是开放式的,并且不排除额外的未叙述的要素或方法步骤。“包含”是权利要求语言中使用的技术术语,意思指存在所述要素,但也可以增加其它要素并且仍形成在所述权利要求范围内的构造或方法。
本发明所用APY29的CAS号为1216665-49-4,结构如式Ⅰ所示:
实施例1
APY29对RSK4酶的抑制作用
1、实验方法
本次实验利用ADP-Glo方法检测待测化合物APY29在RSK4酶上的作用。
待测化合物起始浓度为10μM,5倍梯度稀释,得到6个不同浓度的化合物APY29溶液。
具体操作过程如下:
(1)冰上解冻RSK4酶、RSK Substrate、激酶缓冲液III(5×缓冲液)、二硫苏糖醇(DTT,0.1M)和ATP(10mM),并且以上试剂在整个实验过程中需要一直放置在冰上。
(2)将5×的激酶缓冲液III用去离子水配置成1×的缓冲液,并在其中加入DTT,DTT在1×缓冲液中的浓度为50μM;
(3)将1μl/孔5×待测化合物APY29加入到白色微孔板中,微孔板在离心机上1000r/min离心1分钟;
阳性对照孔(Pos.Ctrl):1μl/孔化合物稀释溶剂;
空白对照孔(Blank):1μl/孔1×缓冲液。
(4)RSK4酶完全解冻后,使用1×的激酶缓冲液III将RSK4酶稀释到1ng/μl,取2μl/孔加入到白色微孔板中,此时每孔中RSK4的酶量为2ng;空白对照孔加入2μl/孔1×缓冲液;此步骤请在冰上进行,加完后,微孔板在离心机上1000r/min离心1分钟;
(5)配制RSK Substrate/ATP混合液:
RSK Substrate/ATP混合液:取130μl的RSK Substrate(1mg/ml)加入3.25μl 5mMATP和127μl的2×缓冲液(注意此处是按比例稀释),此时混合液中ATP浓度为62.5μM、RSKSubstrate浓度为0.5mg/ml;此步骤请在冰上进行;
(6)取2μl/孔RSK Substrate/ATP的混合溶液到白色微孔板中,此时RSKSubstrate浓度为0.2mg/ml、ATP浓度为25μM,加完后微孔板1000r/min离心1分钟;
(7)离心完毕后,给微孔板贴上膜,压紧贴膜,在25℃中孵育1小时;
(8)将Promega的试剂盒中需要用的ADP-GloTM reagent和激酶检测相关试剂平衡到室温,并按照说明书将激酶检测缓冲液和激酶检测底物混合备用。
(9)结束孵育后,取5μl/孔ADP-GloTM reagent加入到白色微孔板中,微孔板1000转离心1分钟,25℃中孵育40分钟;
(10)结束孵育后,取Kinase Detection混合液10μl/孔加入到微孔板中,微孔板1000r/min离心1分钟,25℃中孵育30分钟;
(11)结束孵育后在读板器上进行化学发光检测,读取发光值(RLU);
(12)酶抑制率计算:
酶抑制率(%)=100-(样品发光值-空白发光值)/(阳性发光值-空白发光值)×100%。
2、实验结果
如图1所示,随着APY29浓度的升高,APY29对RSK4酶的抑制作用也增强。采用GraphPad软件进行曲线拟合,得出IC50值为55.1nM。表明化合物APY29能够有效抑制RSK4的磷酸化,抑制RSK4的激活,是有效的RSK4抑制剂。
实施例2
APY29对RSK4下游底物的磷酸化水平的影响
1、实验方法
本次实验采用不同浓度APY29刺激肾癌细胞系,Westernblot检测RSK4下游底物的磷酸化水平的影响。具体操作过程如下:
(1)蛋白提取,使用康为世纪RIPA裂解液。细胞培养瓶置于冰上裂解20min,来回摇动,可用枪头吹打。用细胞刮刀刮下细胞,转移至EP管中,4℃离心。可吸取10-20μl进行蛋白定量。加入上样缓冲液(上样缓冲液是由100μlRIPA裂解液(strong)、1μl磷酸酶抑制剂及1μl蛋白质抑制剂配制而成,均来自康为世纪试剂公司),并煮沸5min,12000rpm离心5min,于超低温冰箱保存。组织蛋白提取:液氮研磨,融化后转入EP管中,冰上裂解20min,4℃离心。
(2)蛋白定量,使用康为世纪BCA定量试剂盒。每个样品做两个复孔,取平均值做标准曲线及计算样品浓度。
(3)蛋白电泳,使用康为世纪SDS-PAGE凝胶制备试剂盒。分离胶浓度为8%,浓缩胶浓度为5%。分离胶距前玻璃板上沿1.5cm,注水封胶。用滤纸吸干水封液,灌入浓缩胶,插梳子。电压100V恒压1小时30min至溴酚蓝跑出停止电泳。
(4)转膜,将胶、滤纸、海绵垫浸泡于4℃预冷的转膜缓冲液中平衡10min,将PVDF膜用甲醇浸润5min,充分湿润后转移至转膜缓冲液浸润10min。安装转膜夹顺序:黑色版、海绵、3层滤纸、胶、膜、3层滤纸、海绵、白色版。每步都需赶出气泡,一次性放好膜。在冰浴中300mA恒流转膜100min。
(5)封闭,使用5%脱脂奶粉室温摇床封闭1h。用TBST漂洗10min×3次。
(6)一抗孵育,孵育抗体时膜与胶接触一面始终朝上,4℃摇床孵育过夜。次日用TBST漂洗。
(7)二抗孵育,室温孵育1h。用TBST漂洗。
(8)发光,使用康为世纪化学发光检测试剂盒,用化学发光成像仪扫描检测结果。
(9)使用Photoshop软件对图像进行半定量灰度分析,计算蛋白相对表达量。
2、实验结果
如图2所示,使用浓度1uM及10uMAPY29分别刺激肾癌细胞系,通过Westernblot检测发现不同浓度的APY29均能够抑制RSK4下游底物磷酸化,下调P-RPS6(S235/S236)的表达。
实施例3
APY29对肾癌细胞的影响
1、实验方法
本次实验采用1uM及10uMAPY29分别刺激肾癌细胞系(ACHN),CCK8检测APY29对肾癌细胞增殖的影响,Transwell检测APY29对肾癌细胞迁移的影响,同时以BI-D1870作为阳性对照,不加药物作为空白对照(Blank)。
1.1、CCK8检测步骤:
使用上海陶术生物科技有限公司的CCK-8细胞增殖试剂盒完成。具体操作过程如下:
(1)96孔板接种细胞悬液,每孔100μL,每孔2,000个细胞。
(2)按照实验需要,进行培养或给与药物,处理适当时间。
(3)每孔加入CCK-8溶液10μL,37℃孵育。
(4)酶标仪选择450nm波长测定吸光度值。以时间和吸光度值绘制生长曲线。
1.2、Transwell迁移实验步骤:
(1)消化细胞。用PBS洗一遍,用无血清培养基重悬,调整细胞密度为5×10
(2)24孔板下室加入500ul合10%胎牛血清的培养基。取细胞悬液200μl加入小室注意小室与下层培养液无气泡。
(3)常规培养16-24h。
(4)吸出小室内培养基,用无水甲醇固定小室细胞15min,PBS漂洗。
(5)柒色:24孔板中加入古姆萨染色液,将膜浸没在染液中染色20min,PBS清洗。
(6)用棉签小心擦去膜内层细胞,将膜风干。
(7)显微镜下拍照,取5个高倍视野计数,取平均值。
2实验结果
与空白对照相比,APY29和BI-D1870均能够抑制ACHN细胞的增殖,且相同药物浓度下,APY29的抑制作用更强。由图3可知,APY29可以显著抑制ACHN肿瘤细胞的增殖活性。由图4可知,APY29的IC50为0.62μM。由图5可知,APY29可以在体外抑制RCC侵袭和迁移。由图6可知,敲低RSK4后,APY29的抑制作用减弱。
实施例4
APY29在体内抑制肾癌细胞的生长
1、实验方法
裸鼠成瘤实验:
(1)4~6周龄雌性BALB/c裸鼠进行裸鼠成瘤实验,每组5只裸鼠,每只鼠皮下约注射1×10
(2)待肿瘤体积达到150mm
(3)裸鼠成瘤实验观察时间持续20天,老鼠出现感染、情况不良时及时处理。期间每3~5天进行肿瘤体积的测量。
(4)实验时间终止时处死老鼠,取出皮下肿瘤,拍照,称重,统计。
2、实验结果
与阴性对照及RSK4光谱抑制剂BI-D1870相比,APY29在对肿瘤生长的抑制作用更强,见图7。
实施例5
APY29与舒尼替尼协同治疗肾细胞癌血管生成
1、实验方法
采用舒尼替尼(2μm)及舒尼替尼(2μm)+APY29(10μm)分别刺激与ACHN共培养的HUVEC(人脐静脉血管内皮细胞)细胞,检测不同药物对HUVEC细胞成管的影响。
成管实验:
A、huvec细胞细达到80%汇合度后准备消化,一般过夜培养后的细胞状态更佳,收集细胞进行计数,并按照需求梯度稀释调整细胞的浓度,请一定保证细胞状态完好。
B、24孔板加入200ul的HUVEC细胞悬液,浓度约为12~20万个细胞,建议做复孔;细胞加入后不应该移动培养板,放入37℃孵箱约4小时左右即可进行观察血管是否形成。
C、一般在15小时后成管会开始缓慢皱缩凋亡。
D、结果分析、图片采集。根据需求可用固定后进行荧光染色。
2、实验结果
从图8~9可以看出,联合用药能够显著降低肾透明癌导致的异常活跃的血管生成。说明舒尼替尼和APY29能够起到协同增效的作用,该结果为肾癌的治疗提供新的思路。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
