IgD基因在制备治疗感染病原菌药物中的应用
文献发布时间:2024-04-18 19:52:40
技术领域
本发明涉及基因突变技术领域,具体涉及IgD基因在制备治疗感染病原菌药物的应用。
背景技术
免疫球蛋白是脊椎动物获得性免疫的重要组成成分,到目前为止,硬骨鱼类中发现存在三种免疫球蛋白IgM、IgD和IgZ/IgT,其中IgM和IgZ/T被认为分别在系统和黏膜免疫抗病原感染中扮演重要的角色,然而,IgD的免疫功能至今还是一个谜团。究其原因:一是缺乏IgD敲除的不同基因型的鱼,二是缺乏良好的抗体工具和成熟的检测手段。
自从1965年首次发现免疫球蛋白D(immunoglobulinD,IgD)以来,IgD一直是最为神秘的抗体家族成员。从鱼类到人类演化过程中,IgD一直保留并发挥重要的免疫功能。IgD最初被认为是一类演化产生不久的、仅表达于部分哺乳动物体内的免疫球蛋白。1997年,在鲶鱼中发现一种类似于哺乳类IgDδ链的嵌合基因,表明IgD应该是出现于进化早期脊椎动物的一类古老免疫球蛋白。随后,在大西洋鲑(Salmo salar)、大西洋鳕(Gadus morhua)、牙鲆(Paralichthys olivaceus)、红鳍东方鲀(Tkaifugu rubripes)和团头鲂(Megahbramaamblycephala)中也先后发现了类似基因。
IgD存在膜结合型mIgD(membrane IgD,mIgD)和分泌型sIgD(secreted IgD,slgD)两种形式。sIgD与mIgD是B淋巴细胞通过不同的剪接方式形成的两种不同形式IgD分子,它们具有相似的免疫球蛋白重链结构,仅在恒定区羧基端序列有所差异,mIgD与sIgD相比多一段膜结合区。mIgD在B细胞表面表达构成B细胞抗原受体(B cellreceptor,BCR),推测其主要功能可能是识别和结合抗原,发挥信号转导的作用。sIgD主要存在于血清及体液中,介导体液免疫应答,鱼类sIgD仅在虹鳟与斑点叉尾鮰中有相关的研究报道,然而,IgD的免疫学功能至今尚不明确。
在小鼠中,基因敲除实验显示,IgD可以替代IgM在B细胞发育早期发挥作用,且无论IgD或IgM重链缺陷都对小鼠影响轻微。Lutz指出IgD可以很大程度替代IgM的功能,IgD缺陷小鼠外周血成熟B细胞数量减少30%~50%,研究提示IgD在功能上优于IgM并在调节免疫应答和免疫系统平衡中扮演重要角色。
然而,在病原菌感染下,还未有现有技术报道IgD对病原菌的作用。
发明内容
为解决IgD对病原菌感染作用未知的技术问题,本发明提供了IgD基因在制备治疗感染病原菌药物中的应用。
IgD基因在制备治疗感染病原菌药物中的应用。
优选的,所述IgD基因来自于团头鲂;通过团头鲂IgD基因敲除的方式,筛选出能治疗感染病原菌的药物(IgD基因具有抗病原菌的作用,敲除该基因后,团头鲂抗病原菌的能力下降,用药物作用感染病原菌的团头鲂后,如果有治疗效果,则该药物为能够治疗感染病原菌的药物,筛选出的药物可以是现有技术生产的药物,也可以是纯的化合物)。
优选的,所述药物为团头鲂IgD基因的过表达产物。
优选的,构建IgD基因敲除团头鲂的方法包括以下步骤:
(4.1)选择团头鲂IgD基因敲除的靶位点;
(4.2)构建包含步骤(4.1)所述的靶位点的gRNA;
(4.4)根据步骤(4.1)中团头鲂IgD基因敲除的靶点序列设计引物;
(4.4)将步骤(4.2)获得的gRNA与CAS9蛋白导入体外培养的团头鲂受精卵中,得到基因敲除P0代突变个体。
优选的,步骤(4.2)中所述的靶位点的g-RNA的序列如SEQ ID 12-14所示。
优选的,步骤(4.3)中所述引物的序列如SEQ ID 1-4所示。
优选的,步骤(4.4)中gRNA的浓度为100-500pg,CAS9蛋白的浓度为300-1500pg。
优选的,步骤(4.4)中将gRNA与CAS9蛋白导入体外培养的团头鲂受精卵中的具体方法为:将gRNA-3和CAS9蛋白共注射体外培养1细胞时期的团头鲂受精卵。
优选的,构建IgD基因过表达团头鲂的方法包括以下步骤:
(9.1)将IgD基因插入到CMV启动子驱动的转基因载体上,得到转基因组件;
(9.2)在转基因组件两侧插入Tol2转座子,得到含有IgD的转基因载体;
(9.3)转座酶RNA和含有IgD的转基因载体共显微注射到体外培养的1细胞时期受精卵中,获得IgD基因过表达阳性P0代团头鲂。
优选的,所述的构建IgD基因敲除团头鲂的方法得到的IgD基因敲除团头鲂在制备治疗感染嗜水气单胞菌药物的应用。
与现有技术相比,本发明的有益效果在于:
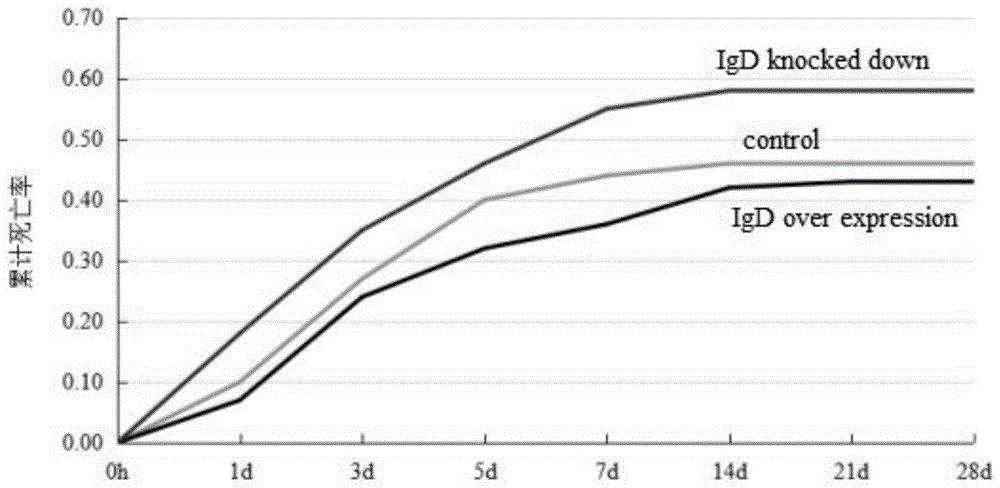
利用CRISPR/Cas9技术对团头鲂的IgD基因进行敲除,筛选获得F1代杂合体团头鲂(IgD+/-),并通过转基因技术获得IgD基因过表达的P0代团头鲂。利用嗜水气单胞菌腹腔注射感染IgD基因敲降(F1代杂合体)与过表达(P0代)的团头鲂,发现IgD基因敲降的团头鲂死亡率显著高于对照组,IgD基因过表达的团头鲂死亡率低于对照组,得到IgD可能在团头鲂抗嗜水气单胞菌感染过程中发挥重要的作用。
附图说明
图1为gRNA及CAS9蛋白对团头鲂细胞的毒性检测结果图;
图2为团头鲂IgD基因敲除位点的设计及检测;A:位于IgD基因δ1外显子中的三个靶位点;B:三个靶位点敲除对团头鲂胚胎发育的影响;C:三个靶位点的突变率;
图3为15个克隆中位点3发生突变的类型及数量;
图4为IgD基因敲降与过表达团头鲂感染嗜水气单胞菌后的累计死亡率;
图5为团头鲂IgD恒定区基因结构示意图;
图6为团头鲂IgD基因敲除F1代电泳图;其中1、9、10、11为团头鲂IgD基因敲除F1代杂合体,2、3、4、5、6、7、8为非突变体;
图7为团头鲂IgD基因过表达F1代电泳图,其中1-6、1-9为团头鲂IgD基因过表达阳性个体,1-0、1-1、1-2、1-3、1-4、1-5、1-7、1-8、1-10为阴性个体。
具体实施方式
下面对本发明的具体实施方式进行详细描述,但应当理解本发明的保护范围并不受具体实施方式的限制。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。本发明各实施例中所述实验方法,如无特殊说明,均为常规方法。
CAS9蛋白购买自TAKARA公司;
T载体购买自TAKARA公司;
PDRgRNA质粒购买自TAKARA公司。
需要说明的是,实施例中所用的胚胎为离体培养的胚胎。
实施例1:CRISPR/Cas9技术在团头鲂IgD基因敲除中的应用条件
为了更好的利用CRISPR/Cas9技术在团头鲂中敲除IgD基因,对gRNA及CAS9蛋白在团头鲂中的浓度进行了摸索。
利用CRISPR/Cas9技术在团头鲂中敲除IgD基因,首先要检测gRNA及CAS9蛋白对团头鲂胚胎的毒性。分别注射不同剂量的gRNA及CAS9蛋白,以未注射gRNA和CAS9蛋白为对照,检测被注射团头鲂胚胎的正常、畸形和死亡比例来界定gRNA及CAS9蛋白对团头鲂细胞的毒性。
设计3个gRNA剂量梯度,每个胚胎中注射的量分别是100pg、300pg、500pg。试验结果表明,随着gRNA注射量的增加,胚胎畸形率和死亡率无统计学差异,即gRNA在设置的剂量范围内不会对团头鲂胚胎产生毒性。
设计6个CAS9蛋白剂量梯度,每个胚胎中注射的量分别是300pg、600pg、900pg、1200pg、1500pg、1800pg。试验结果表明,CAS9蛋白注射量在300pg至1500pg范围内,虽然随着注射量的增加,畸形率和死亡率略有增加,但正常率均在60%以上。但是,当注射量达到的1800pg时,畸形率和死亡率显著上升,对团头鲂胚胎产生毒性。
实验结果表明:注射剂量高达500pg的gRNA都不会对团头鲂胚胎细胞产生明显毒性,说明正常注射量不会对团头鲂细胞产生毒性。在对CAS9蛋白注射剂量摸索的实验中,发现随着注射剂量的增加,胚胎死亡率和畸形率也随机增加,但注射剂量在1500pg以下时,胚胎的正常率均能达到65%以上,注射剂量在1500pg以上时,细胞毒性显著增强,胚胎死亡率显著升高(图1)。
实施例2:团头鲂IgD基因敲除位点的筛选及引物设计
对团头鲂IgD基因序列进行了分析,团头鲂IgD基因cDNA的全长序列如SEQ ID 15所示,具体为:
/>
/>
其中加粗标记为δ1区核酸序列。
如图5所示,团头鲂IgD基因cDNA序列为嵌合体结构,其中包含IgM的第一个恒定区μ1,为避免敲除IgD基因后影响IgM基因的功能,我们将敲除靶点设置在δ1外显子处,δ1外显子发生有效的移码突变之后,δ1-δ2-δ3-δ4-δ5-δ6-δ7-TMs基因序列发生变化,IgD基因失去功能。
根据团头鲂IgD基因序列,在团头鲂IgD基因δ1外显子上设计3个靶位点,如图2中的A所示,在湖南擎科生物有限公司合成引物,以PDRgRNA质粒为模板,通过PCR技术扩增,获得包含sp6启动序列(ATTTAGGTGACACTATAGAGNG)、敲除靶位点和gRNA序列双链DNA序列,再以扩增获得的双链DNA序列为模板,利用北京天恩泽基因科技有限公司SP6体外转录试剂盒,转录获得gRNA-1、gRNA-2和gRNA-3。构建含有靶位点的3个gRNA(gRNA-1、gRNA-2和gRNA-3,gRNA的序列如表1所示,gRNA扩增引物序列如表2所示,扩增反应体系如表3所示。
表1gRNA的序列
表2gRNA扩增引物序列
表3gRNA双链DNA序列扩增反应体系
反应条件为:95℃预变性5分钟,95℃变性30秒、56℃退火30秒、72℃延伸30秒、共35个循环,、72℃延伸8分钟,4℃终止。
三个gRNA分别与CAS9蛋白共同显微注射体外培养的1细胞时期的团头鲂受精卵,进行3个靶位点的共敲除,三个gRNA的注射剂量均为100pg,CAS9蛋白的注射剂量为1500pg,以未注射gRNA和CAS9做对照,实验结果显示三个敲除靶位点敲除,胚胎的正常率分别为65%,54%及58%,然而位点3的突变率最高(图2)。
实施例3:团头鲂IgD基因位点3的突变类型检测
为了解团头鲂IgD基因位点3的突变类型,在显微注射1天后,提取8个尚未出膜的胚胎组织基因组DNA,设计跨突变位点的引物进行扩增,引物序列如表4所示,扩增反应体系如表5所示,扩增PCR产物连接T载体,转化大肠杆菌,挑取15个菌落扩大培养,提取质粒载体,送公司测序。
表4团头鲂IgD基因位点3的突变类型检测所用引物
表5扩增反应体系
反应条件为:95℃预变性5分钟,95℃变性30秒、56℃退火30秒、72℃延伸30秒、共35个循环,、72℃延伸8分钟,4℃终止。
测序后,发现有9个样品发生了突变,突变类型如图3所示。
实施例4:IgD基因敲除团头鲂模型的构建
根据实施例2筛选出的靶位点3,构建含有靶位点3的gRNA-3,将100pg的gRNA-3和1500pg的CAS9蛋白共注射体外培养的1细胞时期的团头鲂受精卵,在显微注射1天后,进行PCR鉴定。
PCR鉴定具体方法为:用动物组织基因组DNA提取试剂盒(天根)提取8个尚未出膜的胚胎组织基因组DNA,以提取的基因组DNA为模板,使用表2设计的引物,使用表6的扩增反应体系进行PCR扩增,反应条件为:95℃预变性5分钟,95℃变性30秒、58℃退火30秒、72℃延伸30秒、共35个循环,、72℃延伸8分钟,4℃终止。于IgD基因的δ1外显子处设计3个引物,三个引物中两条位于突变位点两侧,另一条引物的3’端跨突变位点,引物序列如表5所示。
表5引物序列
表6扩增反应体系
PCR产物经过琼脂糖凝胶电泳检测,跑胶结果有大小两DNA条带的为非突变个体,只有一条较长条带的个体为团头鲂IgD基因敲除P0代突变个体(QP0代)。
待团头鲂IgD基因敲除P0代突变个体(QP0代)性成熟后进行自交,获得F1团头鲂,用动物组织基因组DNA提取试剂盒(天根)提取F1代3月龄团头鲂鳍条组织基因组DNA为模板,使用表5所示的引物进行三引物PCR扩增,扩增反应体系如表6所示,PCR产物经过琼脂糖凝胶电泳检测,跑胶结果有大小两DNA条带的为非突变个体,只有一条较长条带的个体为团头鲂IgD基因敲除F1代杂合体(QF1代),如图6所示。
待团头鲂IgD基因敲除F1代杂合体(QF1代)性成熟后进行自交,获得F2团头鲂,用动物组织基因组DNA提取试剂盒(天根)提取F1代3月龄团头鲂鳍条组织基因组DNA为模板,使用表5所示的引物进行三引物PCR扩增,扩增反应体系如表6所示,PCR产物经过琼脂糖凝胶电泳检测,跑胶结果有大小两DNA条带的为非突变个体,只有一条较长条带的个体为团头鲂IgD基因敲除F2代纯合体(QF2代)。
实施例5:IgD基因过表达团头鲂模型的构建
将IgD基因的开放阅读框插入到CMV启动子驱动的转基因载体上,得到转基因组件,同时在转基因组件两侧插入Tol2转座子(Tol2-CMV-IgD-PolyA-Tol2),保证了转基因组件成功插入团头鲂基因组的效率,得到含有IgD的转基因载体,转座酶RNA和含有IgD的转基因载体共显微注射到体外培养的1-cell时期受精卵中,养殖3个月后提取鳍条组织DNA,并用跨转座子和表7所示的IgD基因的检测引物,进行PCR筛选获得IgD基因过表达阳性P0代团头鲂(GP0代),如图7所示。
待团头鲂IgD基因过表达P0代(GP0代)性成熟后进行自交,获得F1团头鲂,养殖3个月后提取鳍条组织DNA,并用相应的跨转座子和IgD基因的检测引物,进行PCR筛选,获得IgD基因过表达阳性F1代杂合体团头鲂(GF1代)。
扩增反应体系如表8所示,反应条件为:95℃预变性5分钟,95℃变性30秒、55℃退火30秒、72℃延伸1分钟、共30个循环,72℃延伸10分钟,4℃终止。
表7引物序列
表8扩增反应体系
实施例6:IgD基因敲降与过表达团头鲂感染嗜水气单胞菌后的累计死亡率
利用0.1mL(1×10
需要说明的是,本发明权利要求书中涉及数值范围时,应理解为每个数值范围的两个端点以及两个端点之间任何一个数值均可选用,为了防止赘述,本发明描述了优选的实施例。
尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例作出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
- EGR-1基因在制备治疗脓毒症药物中的用途及相关药物
- LKB1基因在制备抗腹主动脉瘤药物中的应用
- 多表位抗原及其制备方法与在制备防治鹦鹉热衣原体感染的药物中的应用
- 一种治疗HPV感染的药物以及该药物在制备治疗HPV感染药物中的应用
- 锦鲤Ladderlectin蛋白或其编码基因在调控锦鲤抗病原菌感染中的应用
