检测装置及其电化学发光检测方法
文献发布时间:2024-04-18 19:58:21
技术领域
本发明涉及生物化学反应,特别涉及检测装置及其电化学发光检测方法。
背景技术
已经开发了一些扩增装置,可以对靶分子进行扩增。另外,也已经开发了一些检测装置,可以对靶分子进行检测。然而,期望在同一个液相反应体系中同时对多个类型的靶分子进行多重扩增和多重检测。
目前存在一些技术,其采用环形对流室进行PCR扩增,采用微阵列进行检测,并且采用常规光学方法读取芯片。然而,这种技术的反应结构复杂,环形对流室的耗材加工复杂,难以密封,易造成产物污染;检测通量低,难以实现高通量的样本检测;微阵列制作效率低,难以实现产业化;对靶分子进行扩增的效率低,多使用无外切酶活性的聚合酶,保真度低,难以有效地扩增多种相关靶分子;激发光源需要外部引入,强光照射产生的光热效应可能对反应体系造成影响;采用直射光激发的方式,导致反应体系的所有染料分子都被激发,造成读取信号的信噪比较低,易造成信号误读。
另外,也存在一些技术,其采用常规电化学发光检测设备读取芯片。然而,这种技术需要设置流动室,以避免溶液中悬浮的荧光物质产生背景干扰,难以应用到封闭式同质多重反应容器中;存在非特异性发光现象,可能造成读取结果不准确。
因此亟需一种检测装置,不仅可以在同一个液相反应体系中同时对多个类型的靶分子进行多重扩增和多重检测,而且可以降低产物污染的可能性,增加检测通量,降低使用成本,有效降低非特异性发光和背景噪声对于读取结果的影响,提供较高的信噪比,增加检测结果的可靠性。
发明内容
为了解决现有技术中的上述问题,本发明提供了检测装置及其电化学发光检测方法,不仅可以在同一个液相反应体系中同时对多个类型的靶分子进行多重扩增和多重检测,而且可以降低产物污染的可能性,增加检测通量,降低使用成本,有效避免整个反应体系受到光源辐照的影响,降低光毒性效应,并且有效降低非特异性发光和背景噪声对于读取结果的影响,提供较高的信噪比,增加检测结果的可靠性。本发明中的靶分子是指待检测的目标核酸分子或核酸片段,它可以是经扩增待检测的目标核酸分子所形成的核酸分子片段,或者可以是未经扩增的待检测的目标核酸分子。
本发明提供了一种检测装置,所述装置包括:
反应容器,所述反应容器提供反应空间,并且所述反应容器具有第一端以及与所述第一端相对的第二端,其中,所述反应容器的所述第一端为开口端,并且所述反应容器的所述第二端为闭口端,所述反应容器为用于核酸扩增反应的容器;
反应芯片,所述反应芯片设置在所述反应空间的内部,并且位于所述反应容器的所述第一端处,其中,所述反应芯片的反应表面上设置有芯片电极,并且所述芯片电极上设置有分别与所述芯片电极电连接的多个阵列电极,其中,所述反应芯片的所述反应表面与所述多个阵列电极对应的位点上固定有核酸探针,所述核酸探针用于检测在所述反应容器内经扩增靶分子而形成的核酸分子;
盖,所述盖可分离地设置在所述反应容器的所述第一端上,以封闭所述反应空间。
本发明的一个实施例中,所述芯片电极由金、铂、铝和铜中的一个或多个制作。
本发明的一个实施例中,所述芯片电极的厚度为10nm至10μm。
本发明的一个实施例中,所述多个阵列电极中的每个阵列电极由金属导体和非导体相间组成,所述金属导体用于与所述芯片电极电连接,并且所述非导体用于与核酸探针耦接。
本发明的一个实施例中,所述核酸探针是与多个类型的靶分子分别对应的多个类型的核酸探针。
本发明的一个实施例中,所述多个类型的核酸探针的数量为2、3至10、3至20、3至30、3至300、3至3000或者3至3000000。
本发明的一个实施例中,所述多个类型的核酸探针以原位合成或异位合成的方式固定到与所述多个阵列电极对应的位点上。
本发明的一个实施例中,所述多个类型的靶分子包括RNA分子或DNA分子、RNA基因组中的RNA片段或DNA基因组中的DNA片段以及RNA分子或DNA分子中的变异结构中的一个或多个。
本发明的一个实施例中,所述多个类型的靶分子包括RNA病毒核酸分子和DNA病毒核酸分子中的一个或多个,其中,所述RNA病毒包括甲型流感病毒InfA、甲型流感病毒H1N12009、甲型流感病毒H3N2、人副流感病毒HPIV1、人副流感病毒HPIV2、人副流感病毒HPIV3、人副流感病毒HPIV4、人偏肺病毒hMPV、呼吸道腺病毒AdV、呼吸道合胞病毒RSV、博卡病毒BoV、严重急性呼吸道综合征冠状病毒SARS-CoV、中东呼吸综合症冠状病毒MERS-CoV和严重急性呼吸系统综合征冠状病毒2SARS-CoV-2中的一个或多个,其中,所述DNA病毒包括人类疱疹病毒HSV-1、人类疱疹病毒HSV-2、人类疱疹病毒VZV、人类疱疹病毒CMV、人类疱疹病毒EBV、人类疱疹病毒HHV-6、人类疱疹病毒HHV-7和人类疱疹病毒HHV-8中的一个或多个。
本发明的一个实施例中,所述多个类型的靶分子源于人类、动物、植物、微生物或者由人工或化学合成,其中,所述微生物包括病毒、细菌和真菌中的一个或多个。
本发明的一个实施例中,所述金属导体由金、铂、铝和铜中的一个或多个制作,并且所述非导体由氧化硅组成。
本发明的一个实施例中,所述多个阵列电极中的每个阵列电极的厚度为10nm至10μm,并且面积为1*10
本发明的一个实施例中,在所述多个阵列电极之间设置有保护层。
本发明的一个实施例中,所述保护层由氮化硅制作。
本发明的一个实施例中,采用光刻和原子沉积工艺来制作所述芯片电极和所述多个阵列电极。
本发明的一个实施例中,所述反应芯片由硅制作。
本发明的一个实施例中,所述反应芯片的所述反应表面位于所述反应芯片的一侧或相对的两侧。
本发明的一个实施例中,所述装置进一步包括光信号检测器,所述光信号检测器检测所述反应芯片上的光信号。
本发明的一个实施例中,所述装置进一步包括:
第一加热器,所述第一加热器位于所述反应容器的所述第一端处;
第二加热器,所述第二加热器位于所述反应容器的所述第二端处。
本发明的一个实施例中,所述装置进一步包括一个或多个第三加热器,所述第三加热器位于所述反应容器的所述第一端和所述第二端之间。
本发明的一个实施例中,在所述第一加热器和所述第二加热器两者进行加热的情况下,或者在所述第一加热器和所述第二加热器加上所述第三加热器进行加热的情况下,所述反应容器能够被加热,以使得所述反应容器的所述第一端处的温度为30℃至75℃,并且使得所述反应容器的所述第二端处的温度为35℃至110℃。
本发明的一个实施例中,所述反应容器为管状结构,所述反应容器的所述第一端和所述第二端在所述管状结构的长度方向上相对设置,所述反应容器的所述第一端和所述第二端同心或非同心设置,并且所述反应容器的所述第一端和所述第二端的横截面相同或不同。
本发明的一个实施例中,所述反应容器的所述第一端和所述第二端的所述横截面分别由曲线边和直线边中的至少一个组成。
本发明的一个实施例中,所述反应容器的所述第一端和所述第二端的所述横截面的内径或最小边长为0.5mm至5mm,所述管状结构的长度为5mm至50mm,并且所述反应空间的容积为5μl至5000μl。
本发明的一个实施例中,所述反应芯片的所述反应表面朝向所述管状结构的径向方向,或者朝向所述管状结构的所述长度方向并且朝向所述反应容器的所述第二端。
本发明的一个实施例中,所述第一加热器集成到所述反应芯片中。
本发明进一步提供了一种用于根据上面所述的检测装置的电化学发光检测方法,所述方法包括:
将反应体系和检测样本注入由反应容器提供的反应空间的内部,所述检测样本包括一个或多个待检测的靶分子;
将反应芯片的反应表面上的芯片电极通电,使得在所述反应容器内经扩增一个或多个所述靶分子而形成的核酸分子与所述反应芯片的所述反应表面与阵列电极对应的位点上固定的对应核酸探针分子杂交之后能够产生光信号;
由光信号检测器检测所述光信号;
基于检测到所述光信号的所述对应核酸探针的位置或类型,确定与所述对应核酸探针分子杂交的所述一个或多个待检测的靶分子的类型。
本发明的一个实施例中,所述反应体系包括引物和DNA聚合酶。
本发明的一个实施例中,所述DNA聚合酶具有3’→5’外切酶活性。
本发明的一个实施例中,通过电化学发光法来产生所述光信号,其中,实现电化学发光的反应中间体被修饰到所述引物,当所述一个或多个靶分子在所述反应容器内被扩增之后,所述反应中间体被附着到经扩增所述靶分子而形成的核酸分子并与所述对应核酸探针分子杂交之后,所述反应中间体被引入到所述对应核酸探针所在位置中,并且在电场和还原剂的作用下产生所述光信号。
本发明的一个实施例中,通过电化学发光-荧光共振能量转移法来产生所述光信号,所述反应体系进一步包括dNTP,其中,实现电化学发光的反应中间体被修饰到所述dNTP,当所述一个或多个靶分子在所述反应容器内被扩增之后,所述反应中间体被附着到经扩增所述靶分子而形成的核酸分子作为供体分子,而受体分子被修饰到所述对应核酸探针分子,当具有所述供体分子的所述核酸分子与具有所述受体分子的所述对应核酸探针分子杂交之后,所述供体分子和所述受体分子相互作用,并且在电场和还原剂的作用下产生所述光信号。
本发明的一个实施例中,通过预先设定的核酸探针在所述反应芯片的所述反应表面上的位置来识别所述核酸探针的类型。
本发明的一个实施例中,所述方法进一步包括,由第一加热器和第二加热器对所述反应容器进行加热,以使得所述反应体系和所述检测样本能够在热对流的作用下在所述反应容器的第一端和第二端之间形成对流以进行流动,并且使得所述检测样本中的所述一个或多个待检测的靶分子不仅能够与所述反应体系中的对应引物杂交实现扩增,而且能够与反应芯片的反应表面上固定的对应核酸探针分子杂交。
本发明的一个实施例中,所述方法进一步包括,由一个或多个第三加热器对所述反应容器进行加热。
本发明的一个实施例中,所述第一加热器和所述第二加热器两者或者所述第一加热器和所述第二加热器加上所述第三加热器的加热被分别控制,以使得所述反应容器的所述第一端处的温度为30℃至75℃,并且使得所述反应容器的所述第二端处的温度为35℃至110℃。
本发明的一个实施例中,所述反应容器为竖直放置或倾斜放置。
本发明的一个实施例中,当所述反应容器为倾斜放置时,所述反应容器与竖直方向之间的夹角为0°至45°。
如上所述,本发明具有以下有益效果:
本发明将可以用于多重检测的反应芯片置于可以进行热对流扩增反应的反应容器中,在进行多重扩增的同时进行探针分子与靶分子的杂交,并且观察反应芯片的光信号,在整个检测过程中只有一个液相、一个反应系统以及一步操作。此外,与直射反应芯片的激发光相比,本发明采用电化学发光法或电化学发光-荧光共振能量转移法,可以有效避免整个反应体系受到光源辐照的影响,降低光毒性效应,并且可以有效降低非特异性发光和背景噪声对于读取结果的影响,提供较高的信噪比,增加检测结果的可靠性。
附图说明
图1是根据本发明的一个实施例的检测装置的侧视图;
图2是根据本发明的一个实施例的检测装置中的反应芯片的示意图;
图3A至图3B分别是根据本发明的一个实施例的检测装置中的反应芯片的设置方式的示意图;
图4A至图4B分别是根据本发明的另一个实施例的检测装置的部分结构主视图和侧视图;
图5A至图5B分别是根据本发明的又一个实施例的检测装置的部分结构主视图和侧视图;
图6A至图6B分别是根据本发明的一个实施例的检测装置中的第一加热器和反应芯片的集成方式的示意图;
图7A至图7B分别是根据本发明的一个实施例的用于检测装置的电化学发光检测方法的原理图。
具体实施方式
以下根据附图对本发明的实施例进行说明。
这里将详细地对示例性实施例进行说明,其示例表示在附图中。下面的描述涉及附图时,除非另有表示,不同附图中的相同数字表示相同或相似的要素。以下示例性实施例中所描述的实施方式并不代表与本申请相一致的所有实施方式。相反,它们仅是与如所附权利要求书中所详述的、本申请的一些方面相一致的装置和方法的例子。
在本申请中使用的术语是仅仅出于描述特定实施例的目的,而非旨在限制本申请。在本申请和所附权利要求书中所使用的单数形式的“一种”、“所述”和“该”也旨在包括多数形式,除非上下文清楚地表示其他含义。还应当理解,本文中使用的术语“和/或”是指并包含一个或多个相关联的列出项目的任何或所有可能组合。“包括”或者“包含”等类似词语意指出现在“包括”或者“包含”前面的元件或者物件涵盖出现在“包括”或者“包含”后面列举的元件或者物件及其等同,并不排除其他元件或者物件。
第一实施方式
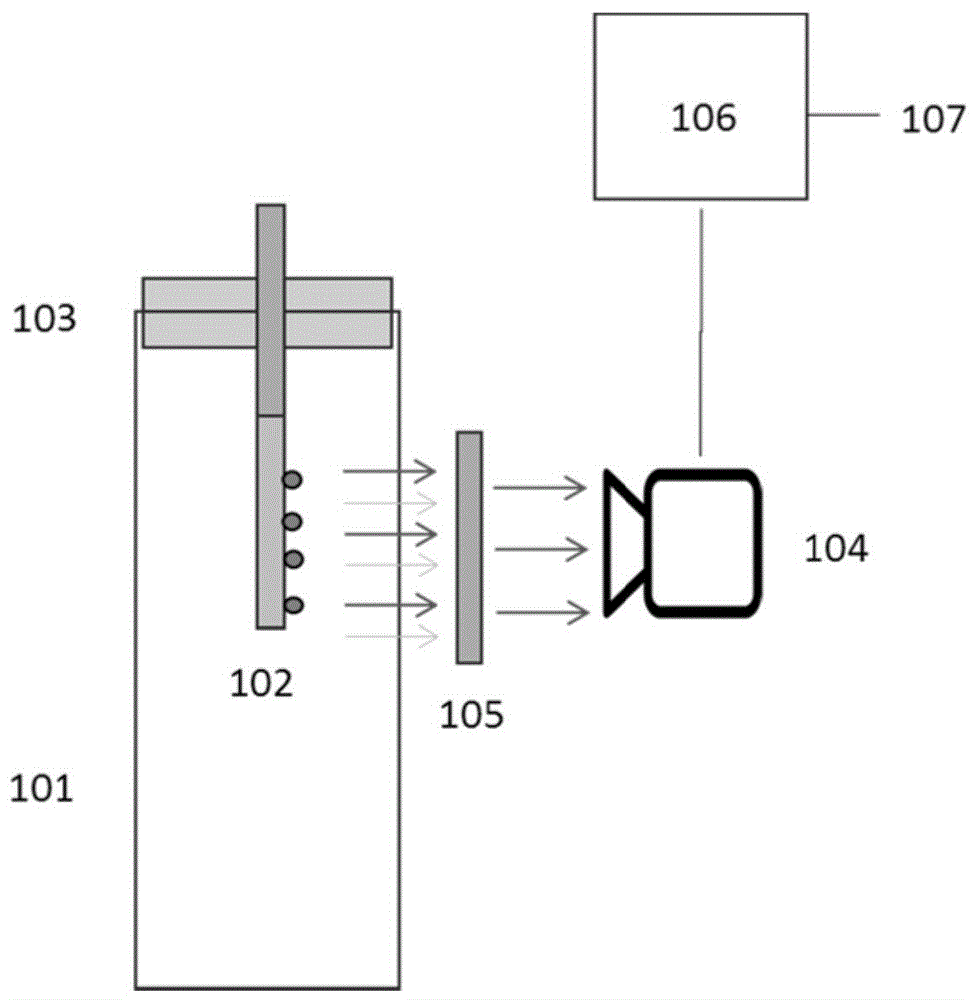
本发明的第一实施方式提供了一种检测装置。图1是根据本发明的一个实施例的检测装置的侧视图。
如图1所示,检测装置可以包括反应容器101、反应芯片102和盖103。
反应容器101也可以被称为反应试管,反应容器101可以提供反应空间,该反应空间也可以被称为反应腔体,并且反应容器101可以具有第一端以及与第一端相对的第二端,其中,反应容器101的第一端可以为开口端,并且反应容器101的第二端可以为闭口端。
盖103可以可分离地设置在反应容器101的第一端上,以封闭反应空间,并且盖103可以不与反应空间中的反应体系接触,从而大大降低因产物渗出而造成污染的可能性。
在一个实施例中,反应容器101可以为管状结构,诸如圆管状结构或方管状结构,相比于片状结构的反应容器,管状结构的反应容器更加容易被封装。反应容器101的第一端和第二端可以在管状结构的长度方向上相对设置,在图1中,反应容器101的第一端也可以被称为管状结构的上端,并且反应容器101的第二端也可以被称为管状结构的下端。
在一个实施例中,反应容器101的第一端和第二端可以同心或非同心设置。
在一个实施例中,反应容器101的第一端和第二端的横截面可以相同或不同。
在一个实施例中,反应容器101的第一端和第二端的横截面可以分别由曲线边和直线边中的至少一个组成。
在一个实施例中,反应容器101的第一端和第二端的横截面可以分别包括圆形和方形。换句话说,反应容器101的第一端和第二端的横截面可以均为圆形,从而反应容器101可以为圆管状结构。替代地,反应容器101的第一端和第二端的横截面可以均为方形,从而反应容器101可以为方管状结构。替代地,反应容器101的第一端和第二端中的一个的横截面可以为圆形,并且另一个的横截面可以为方形,从而反应容器101可以为异形管状结构。
在一个实施例中,反应容器101的第一端和第二端的横截面的内径或最小边长可以为0.5mm至5mm,管状结构的长度可以为5mm至50mm,并且反应空间的容积可以为5μl至5000μl。
在一个实施例中,反应容器101可以由耐热材料制作,该耐热材料的耐热温度例如可以大于150℃。
在一个实施例中,反应容器101可以由透明材料或不透明材料制作。
相比于环形对流室,管状结构的反应容器101更加容易被加工,诸如可以采用传统的注塑工艺一次成形,生产成本低,并且使用更加可靠。
反应芯片102可以设置在反应空间的内部,并且可以位于反应容器101的第一端处。换句话说,反应芯片102可以位于管状结构的开口端处,并且在图1中,反应芯片102可以位于管状结构的上端处。
可以合理设置反应芯片102的尺寸及其在反应容器101的第一端处的位置,使得将来注入的反应体系和检测样本能够覆盖反应芯片102的反应表面,并且能够在下面将要描述的热对流的作用下自由地流经反应芯片102的反应表面。
在一个实施例中,反应芯片102可以由硅制作,生产成本低,并且适于大规模生产。
在一个实施例中,反应容器101为用于核酸扩增反应的容器,反应芯片102的反应表面上可以固定有与多个类型的靶分子分别对应的多个类型的核酸探针,核酸探针用于检测在检测装置内经扩增靶分子而形成的核酸分子,并且这些核酸探针可以形成二维探针阵列,从而可以将x-y坐标位置不同类型的核酸探针的标签。作为示例,反应表面上的(1,1)位置处的核酸探针可以预先设定为类型A,并且反应表面上的(1,2)位置处的核酸探针可以预先设定为类型B,以此类推。
核酸探针的分子可以是单链结构分子,并且当某个探针分子与检测样本中的对应类型(即,配对)的靶分子杂交时可以形成双链结构分子,再通过光信号可以区分单链结构分子和双链结构分子。如此,当确定反应表面上的某个位置处的已知核酸探针分子与对应类型的靶分子杂交形成了双链结构分子时,就可以识别检测样本中存在该对应类型的靶分子。在反应表面上固定有与多个类型的靶分子分别对应的多个核酸探针的情况下,就可以识别检测样本中是否存在多个类型的靶分子,从而实现多重检测效果。
这些核酸探针可以以原位合成(即,直接合成并固定)或异位合成(即,先合成再转移固定)的方式固定到反应芯片102的反应表面上,核酸探针的合成方法和表面固定方法已经存在多个已知方法,此处不再赘述。
在一个实施例中,多个核酸探针的数量可以为2、3至10、3至20、3至30、3至300、3至3000或者3至3000000。
在一个实施例中,反应芯片102的反应表面可以朝向管状结构的径向方向(即,反应芯片102可以竖直设置在管状结构中)。在另一个实施例中,反应芯片102的反应表面可以朝向管状结构的长度方向(即,反应芯片102可以水平设置在管状结构中)并且朝向反应容器的第二端。
在一个实施例中,如下面将要详细描述的,外围电路或电源可以连接反应芯片102上的芯片电极201,从而调控与芯片电极201电连接的阵列电极202。
图2是根据本发明的一个实施例的检测装置中的反应芯片的示意图。
如图2所示,反应芯片102的反应表面上可以设置有芯片电极201,并且芯片电极201上可以设置有分别与芯片电极201电连接的多个阵列电极202。
在一个实施例中,一个反应芯片102中可以设置有一个或多个芯片电极201,一个芯片电极201上可以设置有一个或多个阵列电极202。外围电路或电源可以同时调控多个阵列电极202或独立地调控单个阵列电极202。阵列电极202可以通过反应芯片102内的参考电极或反应芯片102外的参考电极形成回路,以使得阵列电极202的表面形成正电位(势)或负电位(势)。阵列电极202的电位(势)可以为0至+1v或0至-1v,或者可以为0至+5v或0至-5v。
在一个实施例中,芯片电极201可以由金、铂、铝和铜中的一个或多个制作。
在一个实施例中,芯片电极201的厚度可以为10nm至10μm。
在一个实施例中,多个阵列电极202中的每个阵列电极可以由金属导体2021和非导体2022相间组成,例如可以形成网状结构。金属导体2021可以用于与芯片电极201电连接,并且非导体2022可以用于与核酸探针耦接,以增加耦接效率。换句话说,反应芯片201的反应表面与多个阵列电极202对应的位点上固定有与多个类型的靶分子分别对应的多个类型的核酸探针,并且多个类型的核酸探针可以以原位合成或异位合成的方式固定到与多个阵列电极202对应的位点上。
在一个实施例中,金属导体2021可以由金、铂、铝和铜中的一个或多个制作,并且非导体2022可以由氧化硅组成。
在一个实施例中,多个阵列电极202中的每个阵列电极的厚度可以为10nm至10μm,并且面积可以为1*10
在一个实施例中,在多个阵列电极202之间可以设置有保护层203。
在一个实施例中,保护层203可以由氮化硅制作,其与阵列电极202中用于耦接的非导体2022的化学特征不同,可以起到绝缘和防止核酸探针耦接的作用。
在一个实施例中,可以采用光刻和原子沉积工艺来制作芯片电极201和多个阵列电极202。
在一个实施例中,反应芯片102的反应表面可以位于反应芯片201的一侧或相对的两侧。换句话说,反应芯片102的单面或双面都可以产生光信号。
图3A至图3B分别是根据本发明的一个实施例的检测装置中的反应芯片的设置方式的示意图。
如图3A所示,反应芯片102可以竖直固定在盖103上,从而可以在由盖103封闭反应空间时随着盖103进入管状结构中。反应芯片102的反应表面可以朝向管状结构的径向方向。
如图3B所示,反应芯片102可以可以水平固定在盖103上,从而可以在由盖103封闭反应空间时随着盖103进入管状结构中。反应芯片102的反应表面可以朝向管状结构的长度方向并且朝向反应容器101的第二端。
检测装置可以进一步包括光信号检测器104,光信号检测器104可以检测反应芯片102上的光信号。将在下面详细描述光信号的产生原理。
在一个实施例中,光信号检测器104可以为CCD相机、EMCCD相机、CMOS相机或者光敏传感器(诸如光电倍增管)等,并且光信号的采集和检测方式可以为光扫描或者拍照等。
在一个实施例中,反应芯片102上的光信号可以通过滤光片105(诸如637nm高通/带通滤光片)再被光信号检测器104接收,以滤掉620nm及以下波长的非特异性荧光。
检测装置可以进一步包括计算和控制组件106,计算和控制组件106可以控制检测装置中的各个组件(诸如光信号检测器104),并且基于光信号检测器104的检测,输出检测装置的检测结果107。
图4A至图4B分别是根据本发明的另一个实施例的检测装置的部分结构主视图和侧视图。
如图4A和图4B所示,检测装置除了包括图1所示的各种组件之外,可以进一步包括第一加热器108和第二加热器109。第一加热器108可以位于反应容器101的第一端处。第二加热器109可以位于反应容器101的第二端处。相比于环形对流室,管状结构的反应容器101与第一加热器108和第二加热器109的接触面积更加小,并且与管状结构相配的加热器占有更小的空间,在相同体积内可以放置更多的反应容器101,从而可以实现高通量的样本检测。
在一个实施例中,第一加热器108和第二加热器109两者能够对反应容器101进行加热,以使得将来注入的反应体系和检测样本能够在热对流的作用下在反应容器101的第一端和第二端之间形成对流以进行流动,并且使得检测样本中的一个或多个待检测的靶分子不仅能够与反应体系中的对应引物杂交实现扩增,而且能够与反应芯片102的反应表面上固定的对应核酸探针分子杂交。
在一个实施例中,第一加热器108和第二加热器109两者的加热可以被分别控制,以使得反应容器101的第一端处的温度可以低于反应容器101的第二端处的温度。可以理解的是,加热温度越高,受热的反应体系和检测样本的密度越低(比重越低),而加热温度越低,受热的反应体系和检测样本的密度越高(比重越高)。如此,位于反应容器101的第一端处的反应体系和检测样本与位于反应容器101的第二端处的反应体系和检测样本可以形成热对流,使得液体不断流动和混合,促进下面将要描述的杂交过程不断进行。
在一个实施例中,第一加热器108的加热可以被控制,以适于检测样本中的自由的靶分子可以与自由的引物及反应芯片102的反应表面上固定的对应核酸探针分子杂交,并且第二加热器109的加热可以被控制,以使得检测样本中的双链靶分子可以变性为单链分子,并且因为第二端的比重低而流向第一端,从而可以实现指数性扩增。
在一个实施例中,第一加热器108的加热可以被控制以使得反应容器101的第一端处的温度可以在30℃至75℃,并且第二加热器109的加热可以被控制以使得反应容器101的第二端处的温度可以在35℃至110℃(110℃或1.5个大气压下不沸腾,即无气泡)。值得注意的是,在已知方法中,高热区的温度均小于100℃,诸如95℃,而由于本申请采用的反应容器能够耐高压,即在大于100℃时液体不会沸腾,而且本申请采用的酶能够耐高温,即在大于100℃不会变性,因此本申请的高热区温度可以大于等于100℃,诸如110℃。
在另一个实施例中,第一加热器108的加热可以被控制以使得反应容器101的第一端处的温度可以在35℃至75℃,并且第二加热器109的加热可以被控制以使得反应容器101的第二端处的温度可以在75℃至110℃。
在又一个实施例中,第一加热器108的加热可以被控制以使得反应容器101的第一端处的温度可以在65℃,并且第二加热器109的加热可以被控制以使得反应容器101的第二端处的温度可以在98℃。
在一个实施例中,第一加热器108和第二加热器109可以均设置在反应空间的外部。在另一个实施例中,第一加热器108和第二加热器109可以均设置在反应空间的内部。在又一个实施例中,第一加热器108和第二加热器109中的一个可以设置在反应空间的外部,并且第一加热器108和第二加热器109中的另一个可以设置在反应空间的内部。如图4A所示,第一加热器108和第二加热器109可以均设置在反应空间的外部。
但是,第一加热器108可以集成到反应芯片102中,从而可以设置在反应空间的内部,而第二加热器109仍然设置在反应空间的外部。
在一个实施例中,第一加热器108和第二加热器109可以为单加热器以分别设置在反应容器101的同一侧或不同侧。在另一个实施例中,第一加热器108和第二加热器109可以为双加热器以分别设置在反应容器101的两侧。在又一个实施例中,第一加热器108和第二加热器109可以为环形加热器以分别围绕反应容器101设置。
在一个实施例中,第一加热器108和第二加热器109中的每个加热器与反应容器101的耦合方式可以包括接触式热传导、辐射式、热对流、电磁感应等。
在一个实施例中,第一加热器108和第二加热器109可以采用电阻加热器、PET加热器、PI加热器或硅胶加热器等形式。作为示例,第一加热器108可以采用电阻加热器的形式并且可以集成到反应芯片102中,从而可以设置在反应空间的内部,而第二加热器109可以采用PET加热器、PI加热器或硅胶加热器的形式,并且可以设置在反应空间的外部。
在一个实施例中,第一加热器108和第二加热器109可以对应于一个反应容器101设置。在另一个实施例中,第一加热器108和第二加热器109可以对应于多个反应容器101设置,从而可以同时控制数个至数十个反应,可以实现高通量的样本检测。
图5A至图5B分别是根据本发明的又一个实施例的检测装置的部分结构主视图和侧视图。
如图5A和图5B所示,检测装置除了包括图4A和图4B所示的各种组件之外,可以进一步包括第三加热器110,第三加热器110可以为一个或多个,并且第三加热器110可以位于反应容器101的第一端和第二端之间。相比于环形对流室,管状结构的反应容器101与第一加热器108、第二加热器109和第三加热器110的接触面积更加小,并且与管状结构相配的加热器占有更小的空间,在相同体积内可以放置更多的反应容器101,从而可以实现高通量的样本检测。
在一个实施例中,第一加热器108和第二加热器109加上第三加热器110能够对反应容器101进行加热,以使得将来注入的反应体系和检测样本能够在热对流的作用下在反应容器101的第一端和第二端之间形成对流以进行流动,并且使得检测样本中的一个或多个待检测的靶分子不仅能够与反应体系中的对应引物杂交实现扩增,而且能够与反应芯片102的反应表面上固定的对应核酸探针分子杂交。
在一个实施例中,第一加热器108、第二加热器109和第三加热器110的加热可以被分别控制,以使得反应容器101的第一端处的温度可以低于反应容器101的第二端处的温度。可以理解的是,加热温度越高,受热的反应体系和检测样本的密度越低(比重越低),而加热温度越低,受热的反应体系和检测样本的密度越高(比重越高)。如此,位于反应容器101的第一端处的反应体系和检测样本与位于反应容器101的第二端处的反应体系和检测样本可以形成热对流,使得液体不断流动和混合,促进下面将要描述的杂交过程不断进行。
在一个实施例中,第一加热器108、第二加热器109和第三加热器110的加热可以被分别控制,以适于检测样本中的自由的靶分子可以与自由的引物及反应芯片102的反应表面上固定的对应核酸探针分子杂交,并且使得检测样本中的双链靶分子可以变性为单链分子,并且因为第二端的比重低而流向第一端,从而可以实现指数性扩增。
在一个实施例中,第一加热器108、第二加热器109和第三加热器110的加热可以被分别控制,以使得反应容器101的第一端处的温度可以在30℃至75℃,并且使得反应容器101的第二端处的温度可以在35℃至110℃(110℃或1.5个大气压下不沸腾,即无气泡)。值得注意的是,在已知方法中,高热区的温度均小于100℃,诸如95℃,而由于本申请采用的反应容器能够耐高压,即在大于100℃时液体不会沸腾,而且本申请采用的酶能够耐高温,即在大于100℃不会变性,因此本申请的高热区温度可以大于等于100℃,诸如110℃。
在另一个实施例中,第一加热器108、第二加热器109和第三加热器110的加热可以被分别控制,以使得反应容器101的第一端处的温度可以在35℃至75℃,并且使得反应容器101的第二端处的温度可以在75℃至110℃。
在又一个实施例中,第一加热器108、第二加热器109和第三加热器110的加热可以被分别控制,以使得反应容器101的第一端处的温度可以在65℃,并且使得反应容器101的第二端处的温度可以在98℃。
在一个实施例中,第一加热器108、第二加热器109和第三加热器110可以均设置在反应空间的外部。在另一个实施例中,第一加热器108、第二加热器109和第三加热器110可以均设置在反应空间的内部。在又一个实施例中,第一加热器108、第二加热器109和第三加热器110中的一部分可以设置在反应空间的外部,并且第一加热器108、第二加热器109和第三加热器110中的另一部分可以设置在反应空间的内部。如图4B所示,第一加热器108、第二加热器109和第三加热器110可以均设置在反应空间的外部。
但是,第一加热器108可以集成到反应芯片102中,从而可以设置在反应空间的内部,而第二加热器109和第三加热器110仍然设置在反应空间的外部。
在一个实施例中,第一加热器108、第二加热器109和第三加热器110可以为单加热器以分别设置在反应容器101的同一侧或不同侧。在另一个实施例中,第一加热器108、第二加热器109和第三加热器110可以为双加热器以分别设置在反应容器101的两侧。在又一个实施例中,第一加热器108、第二加热器109和第三加热器110可以为环形加热器以分别围绕反应容器101设置。
在一个实施例中,第一加热器108、第二加热器109和第三加热器110中的每个加热器与反应容器101的耦合方式可以包括接触式热传导、辐射式、热对流、电磁感应等。
在一个实施例中,第一加热器108、第二加热器109和第三加热器110可以采用电阻加热器、PET加热器、PI加热器或硅胶加热器等形式。作为示例,第一加热器108可以采用电阻加热器的形式并且可以集成到反应芯片102中,从而可以设置在反应空间的内部,而第二加热器109和第三加热器110可以采用PET加热器、PI加热器或硅胶加热器的形式,并且可以设置在反应空间的外部。
在一个实施例中,第一加热器108、第二加热器109和第三加热器110可以对应于一个反应容器101设置。在另一个实施例中,第一加热器108、第二加热器109和第三加热器110可以对应于多个反应容器101设置,从而可以同时控制数个至数十个反应,可以实现高通量的样本检测。
图6A至图6B分别是根据本发明的一个实施例的检测装置中的第一加热器和反应芯片的集成方式的示意图。
如图6A所示,第一加热器108可以包括绝缘层1081和基底层1082以及在两者之间的加热层1083,并且反应表面上固定有核酸探针204的反应芯片102分离式地设置到绝缘层1081上。
如图6B所示,第一加热器108可以包括绝缘层1081和基底层1082以及在两者之间的加热层1083,并且反应表面上固定有核酸探针204的反应芯片102与绝缘层1081一体形成。
在一个实施例中,多个类型的靶分子可以包括RNA分子或DNA分子、RNA基因组中的RNA片段或DNA基因组中的DNA片段以及RNA分子或DNA分子中的变异结构中的一个或多个。
在一个实施例中,变异结构可以包括单碱基多态性(Single NucleotidePolymorphisms,SNP)。
在一个实施例中,多个类型的靶分子可以包括RNA病毒核酸分子和DNA病毒核酸分子中的一个或多个。换句话说,多个类型的靶分子可以仅包括RNA病毒核酸分子,可以仅包括DNA病毒核酸分子,也可以包括RNA病毒核酸分子和DNA病毒核酸分子两者。
RNA病毒可以包括甲型流感病毒InfA、甲型流感病毒H1N1 2009、甲型流感病毒H3N2、人副流感病毒HPIV1、人副流感病毒HPIV2、人副流感病毒HPIV3、人副流感病毒HPIV4、人偏肺病毒hMPV、呼吸道腺病毒AdV、呼吸道合胞病毒RSV、博卡病毒BoV、严重急性呼吸道综合征冠状病毒SARS-CoV、中东呼吸综合症冠状病毒MERS-CoV和严重急性呼吸系统综合征冠状病毒2SARS-CoV-2等14种常见的呼吸道RNA病毒中的一个或多个。
DNA病毒可以包括人类疱疹病毒HSV-1、人类疱疹病毒HSV-2、人类疱疹病毒VZV、人类疱疹病毒CMV、人类疱疹病毒EBV、人类疱疹病毒HHV-6、人类疱疹病毒HHV-7和人类疱疹病毒HHV-8等8种常见的人类疱疹DNA病毒中的一个或多个。
在一个实施例中,多个类型的靶分子可以源于人类、动物、植物、微生物或者由人工或化学合成,其中,微生物可以包括病毒、细菌和真菌中的一个或多个。
第二实施方式
本发明的第二实施方式提供了一种用于检测装置的电化学发光检测方法,该检测装置已经在上面的第一实施方式中进行了描述,并且该电化学发光检测方法可以包括:
可以将反应体系和检测样本注入由反应容器提供的反应空间的内部,检测样本可以包括一个或多个待检测的靶分子;
可以将反应芯片的反应表面上的芯片电极通电,使得在反应容器内经扩增一个或多个靶分子而形成的核酸分子与反应芯片的反应表面与阵列电极对应的位点上固定的对应核酸探针分子杂交之后能够产生光信号;
可以由光信号检测器检测光信号;
可以基于检测到光信号的对应核酸探针的类型,确定与对应核酸探针分子杂交的一个或多个待检测的靶分子的类型。
在本文中,反应体系指的是被注入由反应容器提供的反应空间的内部以用于与检测样本进行混合的液体,换句话说,指的是在检测装置的检测过程中,反应空间内部除了检测样本之外的所有液体。反应体系可以至少具有两个作用,一是提供多重扩增的液态酶促反应环境,二是提供靶分子与核酸探针的分子杂交的条件。
在一个实施例中,反应体系可以包括与多个类型的靶分子分别对应的多对引物,这些引物可以用于与检测样本中的对应靶分子杂交实现扩增,从而在热对流的作用下,经分子扩增提高靶分子的浓度,增加反应芯片的反应表面上固定的核酸探针的分子与靶分子杂交的机会。分子扩增可以包括聚合酶链反应(PCR)、环介导等温扩增(LAMP)、切口内切酶恒温扩增技术(NEAR)、依赖核酸序列扩增(NASBA)、滚环核酸扩增(RCA)、解链酶扩增(HDA)、重组酶聚合酶扩增(RPA)和酶促重组恒温扩增技术(ERA)。
如下面的表1,针对不同类型的靶分子,可以制备相应引物以加入到反应体系中,并且可以制备相应核酸探针以固定到反应芯片的反应表面上。
/>
表1靶分子序列及其对应的引物序列和核酸探针序列在一个实施例中,反应体系可以包括引物和DNA聚合酶。在另一个实施例中,DNA聚合酶具有3’→5’外切酶活性。通过使用具有3’→5’外切酶活性的聚合酶,针对有变异的病毒株可以增加检出率,修补引物的配对碱基,并且可以实现高保真度,降低无效扩增产物,使得检测结果更加可靠。
在一个实施例中,反应体系的体积可以为50μl。
可以理解的是,上面列出的多个类型的靶分子可以仅用于说明性,而非用于限定性。实际上,本领域技术人员可以根据实际需要,设置其它类型的靶分子,并且制备其对应的引物序列和核酸探针序列,调整反应体系,以实现在同一个液相反应体系中同时对多个类型的靶分子进行多重扩增和多重检测的效果。
在一个实施例中,可以通过电化学发光法来产生光信号,其中,实现电化学发光的反应中间体可以被修饰到引物,当一个或多个靶分子在反应容器内被扩增之后,反应中间体可以被附着到经扩增靶分子而形成的核酸分子并与对应核酸探针分子杂交之后,反应中间体可以被引入到对应核酸探针所在位置中,并且在电场和还原剂的作用下可以产生光信号。
具体地,电化学发光(electrochemiluminescent,ECL),是当电化学反应发生在溶液中的一种发光形式。在电化学发光中,高放能反应中产生的反应中间体使其电子跃迁到高位能态,再到低位能态,并且激发出电磁波,而发出的光子波长取决于跃迁状态之间的间隙。电子转移反应可以使电化学发光产生。其中一种/所有反应物在电极上发生电化学反应被激发的光是化学发光的形式。双链DNA分子(探针分子与靶分子的杂交)形成时可以吸引或引入可逆氧化原标记。
与化学发光有所不同,其差异在于氧化反应是通过电极上的电化学反应产生的,而不是氧化剂或发光剂自身内氧化产生,其标记物可以为三联吡啶钌Ru[(bpy)
图7A是根据本发明的一个实施例的用于检测装置的电化学发光检测方法的原理图。
如图7A所示,可以采用三联吡啶钌Ru[(bpy)
在一个实施例中,可以通过电化学发光-荧光共振能量转移法来产生光信号,反应体系可以进一步包括dNTP,其中,实现电化学发光的反应中间体可以被修饰到dNTP,当一个或多个靶分子在反应容器内被扩增之后,反应中间体可以被附着到经扩增靶分子而形成的核酸分子作为供体分子,而受体分子可以被修饰到对应核酸探针分子,当具有供体分子的核酸分子与具有受体分子的对应核酸探针分子杂交之后,供体分子和受体分子可以相互作用,并且在电场和还原剂的作用下可以产生光信号。
具体地,荧光共振能量转移(fluorescence resonance energy transfer,FRET)指的是当一个荧光分子(又被称为供体分子)的荧光光谱与另一个荧光分子(又被称为受体分子)的激发光谱相重叠时,供体分子的激发能够诱发受体分子发出荧光,同时供体分子自身的荧光强度衰减。FRET程度与供、受体分子的空间距离紧密相关,一般为7至10nm时即可发生FRET;随着距离延长,FRET呈显著减弱。将ECL与FRET结合并且应用于靶分子-核酸探针的结合检测,将解决ECL自身存在的需要清洗池、易产生非特异性发光的问题。
图7B是根据本发明的一个实施例的用于检测装置的电化学发光检测方法的原理图。
如图7B所示,可以将三联吡啶钌Ru[(bpy)
在一个实施例中,反应体系可以包括浓度为3mM的MgCl
三联吡啶钌-dNTP可以是四种dNTP中的一种,也可以是同一种dNTP中的部分分子,如0.1%-10%的dATP是三联吡啶钌-dATP,以作为浓度为0.2mM的dNTP的一部分。
在一个实施例中,该电化学发光检测方法可以进一步包括,可以由第一加热器和第二加热器对反应容器进行加热,以使得反应体系和检测样本能够在热对流的作用下在反应容器的第一端和第二端之间形成对流以进行流动,并且使得检测样本中的一个或多个待检测的靶分子不仅能够与反应体系中的对应引物杂交实现扩增,而且能够与反应芯片的反应表面上固定的对应核酸探针分子杂交。
在一个实施例中,第一加热器和第二加热器两者的加热可以被分别控制,以使得反应容器的第一端处的温度可以低于反应容器的第二端处的温度。可以理解的是,加热温度越高,受热的反应体系和检测样本的密度越低(比重越低),而加热温度越低,受热的反应体系和检测样本的密度越高(比重越高)。如此,位于反应容器的第一端处的反应体系和检测样本与位于反应容器的第二端处的反应体系和检测样本可以形成热对流,使得液体不断流动和混合,促进下面将要描述的杂交过程不断进行。
在一个实施例中,第一加热器的加热可以被控制,以适于检测样本中的自由的靶分子可以与自由的引物及反应芯片的反应表面上固定的对应核酸探针分子杂交,并且第二加热器的加热可以被控制,以使得检测样本中的双链靶分子可以变性为单链分子,并且因为第二端的比重低而流向第一端,从而可以实现指数性扩增。
在一个实施例中,第一加热器的加热可以被控制以使得反应容器的第一端处的温度可以在30℃至75℃,并且第二加热器的加热可以被控制以使得反应容器的第二端处的温度可以在35℃至110℃(105℃或1.5个大气压下不沸腾,即无气泡)。值得注意的是,在已知方法中,高热区的温度均小于100℃,诸如95℃,而由于本申请采用的反应容器能够耐高压,即在大于100℃时液体不会沸腾,而且本申请采用的酶能够耐高温,即在大于100℃不会变性,因此本申请的高热区温度可以大于等于100℃,诸如110℃。
在另一个实施例中,第一加热器的加热可以被控制以使得反应容器的第一端处的温度可以在35℃至75℃,并且第二加热器的加热可以被控制以使得反应容器的第二端处的温度可以在75℃至110℃。
在又一个实施例中,第一加热器的加热可以被控制以使得反应容器的第一端处的温度可以在65℃,并且第二加热器的加热可以被控制以使得反应容器的第二端处的温度可以在98℃。
在一个实施例中,该电化学发光检测方法可以进一步包括,可以由一个或多个第三加热器对反应容器进行加热。
在一个实施例中,第一加热器和第二加热器加上第三加热器能够对反应容器进行加热,以使得反应体系和检测样本能够在热对流的作用下在反应容器的第一端和第二端之间形成对流以进行流动,并且使得检测样本中的一个或多个待检测的靶分子不仅能够与反应体系中的对应引物杂交实现扩增,而且能够与反应芯片的反应表面上固定的对应核酸探针分子杂交。
在一个实施例中,第一加热器、第二加热器和第三加热器的加热可以被分别控制,以使得反应容器的第一端处的温度可以低于反应容器的第二端处的温度。可以理解的是,加热温度越高,受热的反应体系和检测样本的密度越低(比重越低),而加热温度越低,受热的反应体系和检测样本的密度越高(比重越高)。如此,位于反应容器的第一端处的反应体系和检测样本与位于反应容器的第二端处的反应体系和检测样本可以形成热对流,使得液体不断流动和混合,促进下面将要描述的杂交过程不断进行。
在一个实施例中,第一加热器、第二加热器和第三加热器的加热可以被分别控制,以适于检测样本中的自由的靶分子可以与自由的引物及反应芯片的反应表面上固定的对应核酸探针分子杂交,并且使得检测样本中的双链靶分子可以变性为单链分子,并且因为第二端的比重低而流向第一端,从而可以实现指数性扩增。
在一个实施例中,第一加热器、第二加热器和第三加热器的加热可以被分别控制,以使得反应容器的第一端处的温度可以在30℃至75℃,并且使得反应容器的第二端处的温度可以在35℃至110℃(110℃或1.5个大气压下不沸腾,即无气泡)。值得注意的是,在已知方法中,高热区的温度均小于100℃,诸如95℃,而由于本申请采用的反应容器能够耐高压,即在大于100℃时液体不会沸腾,而且本申请采用的酶能够耐高温,即在大于100℃不会变性,因此本申请的高热区温度可以大于等于100℃,诸如110℃。
在另一个实施例中,第一加热器、第二加热器和第三加热器的加热可以被分别控制,以使得反应容器的第一端处的温度可以在35℃至75℃,并且使得反应容器的第二端处的温度可以在75℃至110℃。
在又一个实施例中,第一加热器、第二加热器和第三加热器的加热可以被分别控制,以使得反应容器的第一端处的温度可以在65℃,并且使得反应容器的第二端处的温度可以在98℃。
在一个实施例中,反应容器可以为竖直放置,并且在另一个实施例中,反应容器可以为倾斜放置。如图1、图4A和图5A所示,反应容器101可以为竖直放置,并且如图4B和图5B所示,反应容器101可以为倾斜放置。在又一个实施例中,反应容器与竖直方向之间的夹角为0°至45°。
在一个实施例中,可以通过预先设定的核酸探针在反应芯片的反应表面上的位置来识别核酸探针的类型。如已经在上面的第一实施方式中描述的,当确定反应表面上的某个位置处的已知核酸探针的分子与对应类型的靶分子杂交形成了双链结构分子时,就可以识别检测样本中存在该对应类型的靶分子。在反应表面上固定有与多个类型的靶分子分别对应的多个核酸探针的情况下,就可以识别检测样本中是否存在多个类型的靶分子,从而实现多重检测效果。
在一个实施例中,可以通过信号的动力学数据来计算靶分子的量。
第一实施方式是与本实施方式相对应的装置实施方式,本实施方式可以与第一实施方式互相配合实施。第一实施方式中提到的相关技术细节在本实施方式中依然有效,为了减少重复,此处不再赘述。相应地,本实施方式中提到的相关技术细节也可以应用在第一实施方式中。
虽然通过参照某些优选实施例,已经对本发明进行了图示和描述,但本领域的普通技术人员应该明白,可以在形式上和细节上对其作各种改变,而不偏离本发明的精神和范围。
- 一种检测六氟磷酸锂中铅离子含量的电化学发光传感器和电化学发光分析方法
- 一种检测六氟磷酸锂中氟离子的电化学发光传感器和电化学发光分析方法
