一种板栗毛状根转化方法、转基因板栗及其应用
文献发布时间:2024-04-18 19:58:26
技术领域
本发明涉及生物技术领域,具体而言,涉及一种板栗毛状根转化方法、转基因板栗及其应用。
背景技术
板栗(Castanea mollissima)为壳斗科栗属植物,属于坚果类乔木经济植物的一种,具有极高的营养价值,有着“木本粮食”“干果之王”的美称。我国为板栗的原产地,栽培历史悠久,种质资源丰富,分布范围广泛,是世界上名副其实的板栗生产大国及出口大国。板栗树种有着适应性强、抗旱抗涝、耐瘠薄等特点,这些与板栗根系的生物学特性密不可分。然而,目前对于板栗的研究多集中于贮藏、加工及品质等方向,对于板栗根系的研究则相对较少。通过发根农杆菌介导的毛状根转化技术可以快速获得板栗转基因根系,可用于研究板栗根系发育以及外生菌根共生机制等方面。
发根农杆菌(Ri)属于根瘤菌科农杆菌属革兰氏阴性菌的一种,具有极高的侵染性,常被用于植物基因工程领域。发根农杆菌携带的Ri质粒能够从植物的伤口处进入细胞,将其所含的T-DNA片段插入、整合至植物的基因组中并表达,从而诱导被侵染的植物产生转基因毛状根。通过发根农杆菌侵染植物获得的转基因毛状根往往具有遗传稳定性强、生长速度快、操作简单等特点,目前已广泛应用于苜蓿、烟草、大豆及玉米等多种植物。
目前,发根农杆菌介导的板栗毛状根转化体系为固体菌涂抹伤口的方法,该转化方法来源于模式植物苜蓿。与苜蓿不同的是,板栗作为木本植物,该转化体系存在着转化周期长、转化效率低、生根困难等问题。
板栗基因组测序及基因注释工作已经完成,这对挖掘板栗生长发育过程中的功能基因具有重要意义。木本植物往往利用转基因技术定向育种,其中,利用毛状根转化方法可以获得具转基因的板栗毛状根,这对研究板栗根系发育及外生菌根共生机制方面有着巨大的应用价值。但目前板栗毛状根转化效率低,存在着转化周期长、生根困难、转基因苗存活率低等问题,难以满足实验需要。因此,急需一套发根农杆菌介导的高效稳定的转基因技术为板栗遗传改良提供新途径,并为板栗基因功能的验证提供新方法。
有鉴于此,特提出本发明。
发明内容
本发明的在于提供一种板栗毛状根转化方法及其应用,所述的板栗毛状根转化方法具有成活率高、转化周期短、不易发生褐化现象、容易生根等优点。
为了实现本发明的上述目的,特采用以下技术方案:
本发明的一个方面,涉及一种板栗毛状根转化方法,包括以下步骤:
(a)构建含有报告基因的CmNRT3.1pro::GUS表达载体,并将其转化到发根农杆菌中,得到含有表达载体的发根农杆菌;将所述含有表达载体的发根农杆菌制成侵染菌液;
(b)对板栗无菌苗的根部有明显根毛的膨大处切去根尖后进行刻划处理;将所述刻划处理后的所述板栗无菌苗的根部置于所述侵染菌液中进行侵染培养;
(c)所述侵染培养结束后,弃去所述侵染菌液,将所述板栗无菌苗的根部种于EKM培养基上进行共培养;
(d)将所述共培养后的所述板栗无菌苗的根部移至生根培养基上进行光照培养;
(e)将所述光照培养后的所述板栗无菌苗的根部除去侧根后种于育苗盘中进行基质培养。
本发明的另一个方面,还涉及所述的板栗毛状根转化方法转化得到的转基因板栗。
本发明的另一方面,还涉及一种基因定位分析方法,对经过GUS染色后的所述的转基因板栗进行组织学定位分析。
与现有技术相比,本发明的有益效果为:
(1)本发明提供的板栗毛根转化方法,由发根农杆菌介导,明显缩短了转化周期;本发明提供的板栗毛状根的转化方法,液体菌侵染显著减少了板栗外植体褐化的现象。
(2)本发明采用基质培养的技术方案,可以较好的解决板栗在遗传转化过程中生根困难的问题,毛状根的诱导率达到了81.53%,转基因毛根诱导率稳定在15%左右,每棵板栗植株所含转基因根的数量普遍为2-3根。本发明的基质培养过程可以使板栗植株逐步适应外界环境,从而显著提高了含转基因根系的板栗植株的成活率,比固体菌侵染提高了2倍左右。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为本发明提供的发根农杆菌介导的板栗毛状根转化流程图;
图2为本发明提供的板栗CmNRT3.1基因GUS染色结果;
图3为本发明提供的板栗转基因外生菌根植株图;
图4为本发明提供的转基因外生菌根明场图;
图5为本发明提供的转基因外生菌根荧光场;
图6为本发明提供的实施例与对比例的比较分析结果图。
具体实施方式
下面将结合附图和具体实施方式对本发明的技术方案进行清楚、完整地描述,但是本领域技术人员将会理解,下列所描述的实施例是本发明一部分实施例,而不是全部的实施例,仅用于说明本发明,而不应视为限制本发明的范围。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
本发明的一个方面,涉及一种板栗毛状根转化方法,包括以下步骤:
(a)构建含有报告基因的CmNRT3.1pro::GUS表达载体,并将其转化到发根农杆菌中,得到含有表达载体的发根农杆菌;将所述含有表达载体的发根农杆菌制成侵染菌液;
(b)对板栗无菌苗的根部有明显根毛的膨大处切去根尖后进行刻划处理;将所述刻划处理后的所述板栗无菌苗的根部置于所述侵染菌液中进行侵染培养;
(c)所述侵染培养结束后,弃去所述侵染菌液,将所述板栗无菌苗的根部种于EKM培养基上进行共培养;
(d)将所述共培养后的所述板栗无菌苗的根部移至生根培养基上进行光照培养;
(e)将所述光照培养后的所述板栗无菌苗的根部除去侧根后种于育苗盘中进行基质培养。
本发明提供的板栗毛状根转化方法,采用液体菌侵染的技术方案,明显缩短转化周期,减少褐化现象的发生,采用基质培养的技术方案,解决遗传转化过程中生根困难的问题,提升植株的成活率。
板栗硝酸盐转运蛋白基因CmNRT3.1受外生菌根诱导表达,推测该基因参与了板栗外生菌根途径的氮吸收。
木本植物在遗传转化过程中均存在着生根困难的问题,本发明过程中的基质培养可以较好的解决该问题。液体菌侵染的毛根诱导率达到了81.53%,得到了显著提高,且液体菌侵染的转基因诱导率稳定在15%左右,每棵板栗植株所含转基因根的数量普遍为2-3根,是固体菌侵染获得转基因根数量的2倍左右。
固体菌侵染的生根过程为无菌培养,这导致含转基因根系的板栗植株很难适应外界环境,存活率较低。本发明的基质培养过程可以使板栗植株逐步适应外界环境,从而显著提高了含转基因根系的板栗植株的成活率,比固体菌侵染提高了2倍左右。
优选地,将所述含有表达载体的发根农杆菌制成侵染菌液具体包括:
将活化的所述含有表达载体的发根农杆菌接种于LB液体培养基中进行振荡培养,得到第一菌液;对所述第一菌液进行离心,弃去上清,向沉淀液中加入等体积的无菌1/2WPM培养基后重悬菌体,得到所述侵染菌液。
优选地,所述振荡培养的温度为28℃。
优选地,所述振荡培养的频率为220rpm/min。
优选地,所述第一菌液的OD
优选地,所述LB液体培养基中含有50mg/L壮观霉素和80~120μM(例如80μM、90μM、100μM、110μM或120μM)乙酰丁香酮。
优选地,所述1/2WPM缓冲液中含有4~8g/L(例如4g/L、6g/L或8g/L)聚乙烯吡咯烷酮40和80~120μM(例如80μM、90μM、100μM、110μM或120μM)乙酰丁香酮。
优选地,所述侵染培养的温度为28℃。
优选地,所述侵染培养的振荡频率为60~100rpm/min(例如60rpm/min、70rpm/min、80rpm/min、90rpm/min或100rpm/min)。
优选地,所述侵染培养的时间为30~40min(例如30min、35min或40min)。
优选地,所述共培养的温度为21℃。
优选地,所述共培养的时间为4~6天(例如4天、5天或6天)。
优选地,所述光照培养的温度为25℃。
优选地,所述光照培养的时间为4~6天(例如4天、5天或6天)。
优选地,所述基质培养具体包括:
将除去侧根的所述板栗无菌苗种于育苗盘中,用保鲜膜封住育苗盘,在保鲜膜上扎若干个小孔透气,6~8天后揭开保鲜膜,再继续生长6~8天。
优选地,所述育苗盘中铺满灭菌的蛭石,用纯水浇透。
优选地,所述报告基因包括:红色荧光蛋白或绿色荧光蛋白。
优选地,所述板栗无菌苗的制备过程包括以下步骤:
将消毒后的板栗种子切块种于WPM培养基中,25℃暗培养2~4天。
优选地,所述板栗种子切块暴露胚芽长度为2~4mm(例如2mm、3mm或4mm)。
本发明的另一个方面,还涉及所述的板栗毛状根转化方法转化得到的转基因板栗。
本发明的另一个方面,还涉及一种基因定位分析方法,对经过GUS染色后的所述的转基因板栗进行组织学定位分析。
对转化CmNRT3.1::GUS表达载体的板栗转基因根系进行GUS染色。取转基因板栗的根系放入含有GUS染液的离心管中,避光抽真空2h后,放入37℃培养箱避光反应40h左右。随后可通过半薄塑料切片对该基因进行组织学定位分析(图2),确定CmNRT3.1启动子的表达模式和强度,从而为板栗硝酸盐转运的分子机制一定的基础。
本发明的另一个方面,还涉及一种外生菌根共生的方法,将所述的转基因板栗移栽至板栗菌根苗的周围。
将含有转基因根系的、地上部及地下部长势良好的板栗植株移栽到板栗菌根苗附近,两周后板栗转基因根系即可与外生菌根真菌共生形成转基因外生菌根(见图3-图5,图3为板栗转基因外生菌根植株;图4为转基因外生菌根明场;图5为转基因外生菌根荧光场)。
本发明的技术方案所涉及的培养基配方如下:
WPM培养基:WPM 2.4g/L、蔗糖30g/L、琼脂10g/L,调节pH至5.8。
EKM培养基:大量元素10×母液100mL/L、微量元素1000×母液1mL/L、15mM柠檬酸铁1mL/L、二水合硫酸钙0.25g/L、琼脂10g/L,调节pH至6.6。121℃灭菌20min,冷却至室温后添加125μL 1M NH
大量元素10×母液(g/L):KH
微量元素1000×母液(mg/mL):MnSO
EM生根培养基:Schenk&Hildebrandt培养基3.18g/L、Schenk&Hildebrandt维生素混合物1.01g/L、蔗糖10g/L、MES 6.4g/L、琼脂10g/L,调节pH至5.8。121℃灭菌20min,冷却至室温后添加500mg/L噻孢霉素。
下面将结合具体的实施例和对比例对本发明的实施方案进行详细描述。
实施例1
本实施例提供的板栗毛状根转化方法,包括以下步骤:
(1)含有表达载体的发根农杆菌的制备:
从板栗基因组中下载CmNRT3.1启动子片段,通过软件设计F、R引物,并在F引物的5’端加上CACC接头,克隆片段;
随后利用pENTR-TOPO
将测序结果正确的菌落进行质粒小提后与243载体(含有DsRed及GUS双元报告基因)进行LR反应,转化大肠杆菌Trans5a,利用含有Spe抗性的LB固体培养基进行筛选,筛选出阳性单克隆后进行测序以确定最终序列,并提取质粒即为含有DsRed及GUS双元报告基因的CmNRT3.1pro::GUS表达载体;
将上述表达载体转化到发根农杆菌MSU440感受态细胞中,得到了含有表达载体的发根农杆菌;
(2)板栗种子预处理:
选择饱满的板栗种子并将其洗净,去壳,将板栗处理成1×1×1cm的小方块,注意不要切到胚(图1.a);
(3)板栗消毒:将预处理后的种子于超净台中进行消毒,75%乙醇中浸泡2.5min,无菌水洗1次,4%次氯酸钠中浸泡15min,无菌水洗6-8次;切除板栗四周因消毒发白的部分,切除厚度均为1mm左右,暴露胚芽长度约为3mm,种于WPM培养基中,25℃暗培养3天(图1.a);
(4)发根农杆菌活化:板栗消毒处理的当天,将含有表达载体的发根农杆菌在含有50mg/L壮观霉素的LB固体培养基上划线,28℃黑暗倒置培养48h后即可获得单菌落;挑取单菌落于含有50mg/L壮观霉素的LB液体培养基28℃,220rpm过夜培养;
(5)侵染菌液的制备:以1:100的比例取活化的发根农杆菌菌液于新鲜的含有50mg/L壮观霉素及100μM乙酰丁香酮的LB液体培养基中,28℃,220rpm培养至OD
(6)侵染外植体:在板栗根部有明显根毛的膨大处切去根尖,进行刻划处理,用无菌针头轻扎伤口及伤口周围4-5次,随后立即将处理好的板栗外植体置于侵染菌液中进行侵染培养;全部处理完成后,将含有板栗外植体的侵染菌液密封,28℃,80rpm培养35min(图1.c);
(7)共培养:弃去侵染液,用无菌滤纸吸干板栗外植体上的液体,然后将其放在铺有1/2无菌滤纸的EKM培养基上,根部再盖上一层无菌滤纸,Parafilm膜封口2/3,21℃暗培养5天;
(8)生根培养:
转移板栗苗至铺有1/2无菌滤纸的EM(添加有500mg/L Cef)生根培养基上,根部再盖上一层无菌滤纸,Parafilm封口2/3,25℃光照(光周期为16h,暗周期为8h)培养5天;
育苗盘中铺满灭菌的蛭石(121℃高温高压灭菌120min),纯水浇透。将培养皿中的板栗去除所有侧根后种于育苗盘中进行基质培养(图1.e),用保鲜膜封住育苗盘,在保鲜膜上扎几个小孔透气;一周后可揭开保鲜膜,继续生长一周后检测是否生成转基因根系;
(9)荧光检测:利用体式荧光显微镜对共转化植株进行荧光观察,转基因板栗植株根系中含有DsRed报告基因,因此可见整条根均有较强红色荧光;不含转基因根系的板栗植株去除所有侧根,重复基质培养步骤,待板栗苗生出新侧根后可再次进行一次荧光检测(图1.f、图1.g)。
实施例2
本实施例提供的板栗毛状根转化方法,包括以下步骤:
(1)含有表达载体的发根农杆菌的制备:同实施例1;
(2)板栗种子预处理:同实施例1;
(3)板栗消毒:同实施例1;
(4)发根农杆菌活化:同实施例1;
(5)侵染菌液的制备:以1:100的比例取活化的发根农杆菌菌液于新鲜的含有50mg/L壮观霉素及120μM乙酰丁香酮的LB液体培养基中,28℃,220rpm培养至OD
(6)侵染外植体:在板栗根部有明显根毛的膨大处切去根尖,进行刻划处理,用无菌针头轻扎伤口及伤口周围4-5次,随后立即将处理好的板栗外植体置于侵染菌液中进行侵染培养;全部处理完成后,将含有板栗外植体的侵染菌液密封,28℃,100rpm培养40min;
(7)共培养:弃去侵染液,用无菌滤纸吸干板栗外植体上的液体,然后将其放在铺有1/2无菌滤纸的EKM培养基上,根部再盖上一层无菌滤纸,Parafilm膜封口2/3,21℃暗培养6天;
(8)生根培养:
转移板栗苗至铺有1/2无菌滤纸的EM(添加有500mg/L Cef)生根培养基上,根部再盖上一层无菌滤纸,Parafilm封口2/3,25℃光照(光周期为16h,暗周期为8h)培养6天;
育苗盘中铺满灭菌的蛭石(121℃高温高压灭菌120min),纯水浇透。将培养皿中的板栗去除所有侧根后种于育苗盘中进行基质培养,用保鲜膜封住育苗盘,在保鲜膜上扎几个小孔透气;一周后可揭开保鲜膜,继续生长一周后检测是否生成转基因根系;
(9)荧光检测:同实施例1。
实施例3
本实施例提供的板栗毛状根转化方法,包括以下步骤:
(1)含有表达载体的发根农杆菌的制备:同实施例1;
(2)板栗种子预处理:同实施例1;
(3)板栗消毒:同实施例1;
(4)发根农杆菌活化:同实施例1;
(5)侵染菌液的制备:以1:100的比例取活化的发根农杆菌菌液于新鲜的含有50mg/L壮观霉素及80μM乙酰丁香酮的LB液体培养基中,28℃,220rpm培养至OD
(6)侵染外植体:在板栗根部有明显根毛的膨大处切去根尖,进行刻划处理,用无菌刀片轻划3-4个伤口,随后立即将处理好的板栗外植体置于侵染菌液中进行侵染培养;全部处理完成后,将含有板栗外植体的侵染菌液密封,28℃,60rpm培养30min;
(7)共培养:弃去侵染液,用无菌滤纸吸干板栗外植体上的液体,然后将其放在铺有1/2无菌滤纸的EKM培养基上,根部再盖上一层无菌滤纸,Parafilm膜封口2/3,21℃暗培养4天;
(8)生根培养:
转移板栗苗至铺有1/2无菌滤纸的EM(添加有500mg/L Cef)生根培养基上,根部再盖上一层无菌滤纸,Parafilm封口2/3,25℃光照(光周期为16h,暗周期为8h)培养4天;
育苗盘中铺满灭菌的蛭石(121℃高温高压灭菌120min),纯水浇透。将培养皿中的板栗去除所有侧根后种于育苗盘中进行基质培养,用保鲜膜封住育苗盘,在保鲜膜上扎几个小孔透气;一周后可揭开保鲜膜,继续生长一周后检测是否生成转基因根系;
(9)荧光检测:同实施例1。
对比例1
本对比例提供的板栗毛状根转化方法,包括以下步骤:
(1)~(4)同实施例1;
(5)侵染菌液的制备:吸取活化的发根农杆菌MSU440菌液100μL涂布于含有50mg/L壮观霉素的LB固体培养基上,28℃恒温过夜培养2天,每个培养皿中的固体菌可以侵染3-5个板栗外植体;
(6)侵染外植体:在6g/L PVP40液体中切去板栗下胚轴的胚尖,在伤口处涂抹已活化的发根农杆菌MSU440,再用沾有农杆菌的针头戳其伤口及伤口周围(图1.b);
(7)共培养:同实施例1;
(8)生根培养:
转移板栗苗至铺有1/2无菌滤纸的EM(添加有500mg/L Cef)生根培养基上,根部再盖上一层无菌滤纸,Parafilm封口2/3,25℃光照(光周期为16h,暗周期为8h)培养5天;
用高温灭菌的剪刀剪去板栗侧根后,更换EM培养基(图1.d),方法同上,Parafilm全封口,25℃光照(光周期为16h,暗周期为8h)培养。每周更换EM培养基,2-3周后检测是否生成转基因根系;
(9)荧光检测:同实施例1。
对比例2
本对比例提供的板栗毛状根转化方法,包括以下步骤:
(1)~(7)同实施例1;
(8)生根培养:
转移板栗苗至铺有1/2无菌滤纸的EM(添加有500mg/L Cef)生根培养基上,根部再盖上一层无菌滤纸,Parafilm封口2/3,25℃光照(光周期为16h,暗周期为8h)培养5天;
用高温灭菌的剪刀剪去板栗侧根后,更换EM培养基(图1.d),方法同上,Parafilm全封口,25℃光照(光周期为16h,暗周期为8h)培养,每周更换EM培养基。
(9)同实施例1。
由于液体侵染对于无菌操作的要求十分严格,本对比例使用液体侵染方法处理的板栗外植体在EM培养基上生长过程中,极易出现染菌的现象,生根困难,导致绝大部分板栗外植体死亡,很难生成转基因根系。
实验例
对实施例和对比例提供的板栗毛状根转化方法进行比较,从获得转基因根所需时间、褐化率、毛根诱导率、转基因诱导率、转基因根的数量以及存活率几个方面入手。
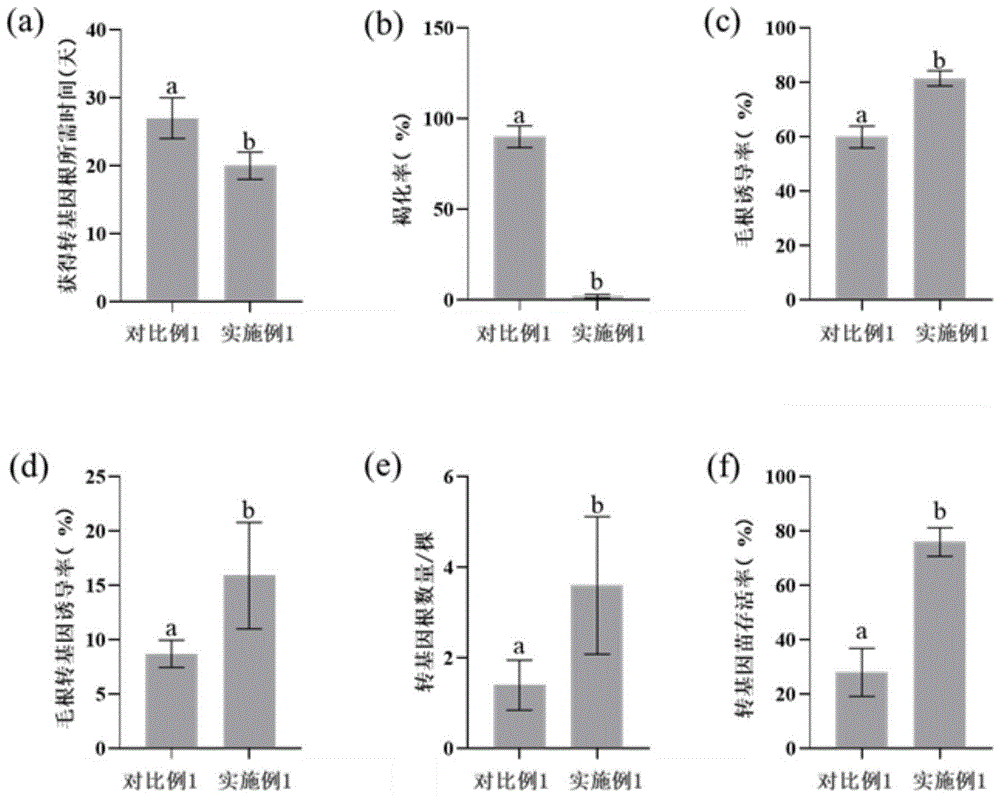
通过实施例1和对比例1的对比可知,本发明提出的发根农杆菌介导的板栗毛根转化方法大大缩短了转化周期,与固体菌侵染相比,液体菌侵染转化周期仅为一个月,时间上缩短了3周。此外,液体菌侵染获得第一条转基因根的时间比固体菌侵染的时间减少了1周(图6.a)。
尽管固体菌侵染在PVP40中切去根尖的方法减轻了板栗外植体的褐化现象,但褐化现象仍然存在,与此相比,本发明提供的液体菌侵染的方法则显著减少了板栗外植体褐化的现象(图6.b)。
木本植物在遗传转化过程中均存在着生根困难的问题,本发明的基质培养可以较好的解决该问题。与之前固体菌侵染毛根诱导率仅为59.94%相比,液体菌侵染的毛根诱导率达到了81.53%,得到了显著提高(图6.c),且液体菌侵染的毛根转基因诱导率稳定在15%左右(图6.d),每棵板栗植株所含转基因毛根的数量普遍为2-3根,是固体菌侵染获得转基因根数量的2倍左右(图6.e)。
固体菌侵染的生根过程为无菌培养,这导致含转基因根系的板栗植株很难适应外界环境,存活率较低。本发明的基质培养过程可以使板栗植株逐步适应外界环境,从而显著提高了含转基因根系的板栗植株的成活率,比固体菌侵染提高了2倍左右(图6.f)。
尽管已用具体实施例来说明和描述了本发明,然而应意识到,以上各实施例仅用以说明本发明的技术方案,而非对其限制;本领域的普通技术人员应当理解:在不背离本发明的精神和范围的情况下,可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围;因此,这意味着在所附权利要求中包括属于本发明范围内的所有这些替换和修改。
- 一种发根农杆菌介导的大白菜转基因毛状根转化方法
- 一种蜘蛛香转基因毛状根遗传转化体系的建立方法
