一种小叶栀子的组织培养方法
文献发布时间:2024-04-18 19:58:26
技术领域
本发明涉及植物组织培养技术领域,具体涉及一种小叶栀子的组织培养方法。
背景技术
栀子属(Gardenia Ellis.)植物分布广泛,在热带、亚热带及温带地区均有栽培或野生植株,具有观赏、药用、饮料、提炼油脂和香料等多种用途,具有较大的开发潜力。小叶栀子(Gardeniajasminoides Ellis.var.radicans)为茜草科栀子属植物中栀子(Gardeniajasminoides Ellis.)的一个栽培变种,为叶小浓密、花白具有浓郁香气的常绿灌木,是优良的园林绿化景观植物,应用前景广泛。前人多利用有性、营养繁殖方式产生小叶栀子幼苗,但总体上成活率较低,难以满足市场需求。
近年来,植物组织培养技术日趋成熟,已广泛应用于农业、园林、园艺、林业、工业和植物化学物质生产等诸多领域。迄今为止,对于栀子属植物再生体系的研究,多见于利用茎段、叶片、果皮、种子或种子团等材料作为外植体进行组织培养以获得再生植株,而利用无菌叶片和顶芽做为外植体进行木本植物组织培养的研究较少。小叶栀子具有较高的研究价值及应用前景,但目前国内外利用组织培养建立再生体系的研究多集中在栀子属其它物种,针对小叶栀子的离体快繁技术鲜见。为此,本发明提供一种小叶栀子的组织培养方法。
发明内容
本发明提供了一种小叶栀子的组织培养方法,建立了小叶栀子的再生体系,为大规模扩繁生产小叶栀子提供了技术支持,也为其广泛的推广应用创造了有利条件,同时提供了一种高效稳定的可快速获得小叶栀子种苗的组织培养方法。
本发明提供了一种小叶栀子的组织培养方法,其特征在于,包括以下步骤:
S1,预处理:获取小叶栀子的顶芽,清洗,纱布包裹所述顶芽,流水冲洗,得到预处理小叶栀子顶芽;
S2,无根苗培养:对S1的预处理小叶栀子顶芽消毒,切去木质化茎段,保留0.5cm顶芽,并浸泡于抑菌液,得到无菌顶芽,将所述无菌顶芽接种于启动培养基,于25℃,1500Lx光照条件下,每日光照16h,黑暗培养8h,30d得到无根苗;
S3,愈伤组织诱导和增殖:选取S2无根苗上的新芽或叶片为外植体,将所述外植体接种于诱导培养基中,于25℃,遮光培养,得到愈伤组织;
S4,愈伤组织分化:将S3的愈伤组织切块,接种于分化培养基,于25℃,1500Lx光照条件下,每日光照16h,黑暗培养8h,30d得到分化组织;
S5,生根培养:将S4分化组织的芽从基部切下,并接种于生根培养基,于25℃,1500Lx光照条件下,每日光照16h,黑暗培养8h,30d后得到小叶栀子生根苗。
优选的,S2中,所述抑菌液由体积比为1:1的氨苄西林钠和硫酸链霉素组成。
优选的,所述氨苄西林钠和硫酸链霉素的浓度均为50mg/L。
优选的,S2中,所述启动培养基为MS培养基,pH值为5.8。
优选的,S3中,每升所述诱导培养基由MS培养基、1~2mg 2,4-D、0.5~1mg6-BA组成。
优选的,S4中,每升所述分化培养基由MS培养基、0.03~0.05mg NAA、1.5mg~1.8mg 6-BA组成。
优选的,S5中,每升所述生根培养基由1/2MS培养基、0.05~0.15mg NAA、0.5mgIBA组成。
优选的,S4中,所述愈伤组织切块的尺寸为5mm×5mm×5mm。
优选的,S2中,所述消毒的具体方法为:将S1的预处理小叶栀子顶芽置于无菌瓶中,于75%的乙醇中浸泡30s,再于0.1%的HgCl
与现有技术相比,本发明的有益效果在于:
(1)本发明以小叶栀子带顶芽的枝条为外植体进行无根苗培养、愈伤组织诱导和增殖、愈伤组织分化和生根苗培养,快速获得了可以直接室外种植的小叶栀子组培苗,建立了小叶栀子的再生体系,为大规模扩繁生产小叶栀子幼苗提供了技术支持,缩短了小叶栀子种苗繁殖周期,较好地保持优良性状;采用本发明抑菌液处理顶芽,污染率低至25%,无菌顶芽愈伤组织的诱导率高达93.3%,而无菌叶片的愈伤组织诱导率也达到90%,愈伤组织分化率高达96.7%。
(2)本发明提供的小叶栀子组织培养方法中启动培养基、诱导培养基、分化培养基和生根培养基能够起到促进发芽与生根、提高存活率的作用,实现小叶栀子的快速繁殖,获得率较高,所得种苗质量稳定,能较好的保持其优良性状,达到快速大量繁殖、大批量生产的要求,便于小叶栀子的大规模推广。
附图说明
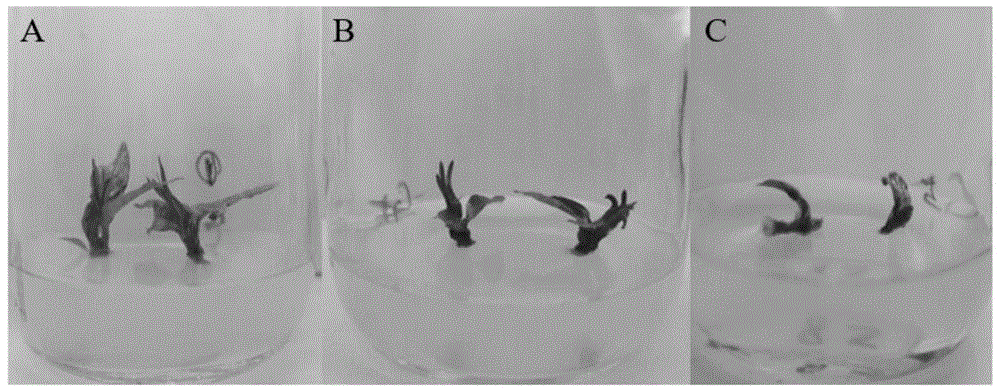
图1是本发明处理1、空白对照组、处理2采用不同抑菌液处理的预处理小叶栀子顶芽生长状态图;其中,A图为处理1,B图为空白对照组,C图为处理2;
图2是本发明分别采用无菌顶芽和无菌叶片诱导产生愈伤组织的状态图;其中,A图为无菌顶芽产生的愈伤组织,B图为无菌叶片产生的愈伤组织;
图3是本发明愈伤组织增殖的状态图;
图4是本发明愈伤组织分化产生不定芽及组织培养获得再生苗的状态图;其中,A图为愈伤组织分化产生不定芽,B图为组织培养获得再生苗;
图5是本发明再生苗产生不定根的状态图;其中,A图为再生苗产生的不定根的早期状态图,B图为再生苗产生的不定根进一步生长发育图。
具体实施方式
为了使本领域技术人员更好地理解本发明的技术方案能予以实施,下面结合具体实施例对本发明作进一步说明,但所举实施例不作为对本发明的限定。下述试验方法和检测方法,如没有特殊说明,均为常规方法;所述试剂和原料,如没有特殊说明,均为市售。
本发明MS培养基的组成如表1所示。
表1MS培养基的组分及含量
本发明1/2MS培养基的组成如表2所示。
表21/2MS培养基的组分及含量
材料与方法
1、外植体获取
于2022年5月中旬天气晴朗的上午10时左右,在淮南师范学院小叶栀子培养基地的向阳面,采集生长健壮且无病虫害的当年生具顶芽的小叶栀子枝条(长3cm左右),放入收纳盒后带回实验室;用剪刀去除枝条上、顶芽外部的叶片,5%洗衣液浸泡30min后,用清水冲洗数遍,直至无泡沫,用纱布包裹去叶顶芽,流水缓慢冲洗1h,将杂质和灰尘清洗干净,放置备用。
2、无菌无根苗培养
于超净工作台(智诚ZHJH-C112B,购自北京创博环球生物科技有限公司)上,将前期处理好的顶芽置于无菌瓶中,75%的乙醇、0.1%的HgCl
表3不同抑菌剂对外植体抑菌效果表
对比三组处理的外植体生长状况,由图1可见,处理1和对照组中的无菌苗生长状况较好,处理2中的无菌苗生长状况相对较差,说明200mg/L的头孢霉素对植物生长有一定的抑制作用。
3、愈伤组织诱导和增殖
以MS为基本培养基,添加不同浓度的2,4-D(1.0mg/L、2.0mg/L、3.0mg/L)和6-BA(0.5mg/L、1.0mg/L、1.5mg/L),两种植物生长调节剂正交,共9个处理(Y1-Y9)。在超净工作台上,将启动培养基上生长的顶芽展开的无菌叶片切成大小约5mm×5mm的小块,将新长出的芽的底端切除一小部分,分别接种到愈伤组织诱导培养基中。每种处理重复15次,每瓶接种2个叶片或2个顶芽。培养条件:25℃,遮光处理。定期观察、统计两种外植体最早出伤时间、愈伤组织状况,并于出伤后2周统计愈伤组织诱导率。在确定愈伤组织最佳诱导条件的基础上,对诱导产生的愈伤组织进行增殖培养。培养条件同上。
由表4可见,去叶无菌顶芽的最快出伤时间在接种后的第10d,而无菌叶片的最快出伤时间在接种后的第18d。对两种外植体的最早出伤时间和愈伤组织诱导率进行综合分析,芽比叶片更适宜进行愈伤组织的诱导,且对于两种外植体而言,2,4-D浓度在3.0mg/L时,愈伤组织诱导率最高只达到60%;2,4-D浓度为2.0mg/L时,各处理组愈伤组织诱导效果较好,2,4-D保持最佳水平,6-BA浓度设置0.5mg/L,愈伤组织诱导效果最好。因此,两种外植体最佳培养基配方组合皆为Y4号处理(MS培养基+2.0mg/L 2,4-D+0.5mg/L 6-BA),去叶无菌顶芽的愈伤组织诱导率可达93.3%,无菌叶片的愈伤组织诱导率亦可达90%,愈伤组织生长状况和增殖状况皆处于良好状态,如图2所示。
表4不同植物生长调节剂组合对小叶栀子愈伤组织诱导影响表
由表5可见,不同2,4-D浓度和不同6-BA浓度对愈伤组织诱导率均有极显著影响(P<0.01)。多重比较结果显示,3种2,4-D浓度和3种6-BA浓度间的愈伤组织诱导率均存在极显著差异(P<0.01)。
表5影响愈伤组织诱导率各因素方差分析结果表
注:a.R Squared=0.996(AdjustedR Squared=0.991)
相关分析的结果如表6,2,4-D与愈伤组织诱导率的偏相关系数为-0.721*(P<0.05),两者具有显著负相关关系;6-BA与愈伤组织诱导率的偏相关系数为-0.547(P>0.05),两者不存在显著相关关系;2,4-D与6-BA的偏相关系数为-0.394(P>0.05),两者不存在显著相关关系。
表6愈伤组织诱导中控制各因素的偏相关分析结果表
注:a.零阶相关矩阵;相关系数肩标*,表示P<0.05。
4、愈伤组织分化成芽
以MS为基本培养基,添加不同浓度的NAA(0.03mg/L、0.05mg/L、0.08mg/L)和6-BA(1.2mg/L、1.5mg/L、1.8mg/L),两种植物生长调节剂正交,共9个处理(F1-F9)。在超净工作台上,将诱导培养基上产生的愈伤组织切成5mm×5mm×5mm的小块,接种至分化培养基上,进行分化培养。每种处理重复15次,每瓶接种2块愈伤组织。培养条件同2。出芽30d后统计愈伤组织分化率。
由表7可见,当NAA浓度为0.08mg/L时,愈伤组织分化率最高只达到43.3%,在此浓度下,6-BA浓度设置为1.2mg/L,愈伤组织分化率低至16.7%,说明6-BA浓度过低,会严重影响NAA作用的发挥;当NAA浓度为0.05mg/L时,愈伤组织分化率普遍较高,在此浓度下,6-BA浓度设置1.8mg/L,愈伤组织分化率最高,达到96.7%。因此,最适宜进行愈伤组织分化的植物生长调节剂组合为F6号处理(MS培养基+0.05mg/LNAA+1.8mg/L 6-BA),且该处理分化的芽及获得的无根再生苗皆处于最佳状态,如图3所示。
表7不同植物生长调节剂组合对小叶栀子愈伤组织分化的影响表
由表8可见,不同NAA浓度和不同6-BA浓度对愈伤组织分化率均有极显著影响(P<0.01)。多重比较结果显示,0.08mg/L的NAA浓度与0.03mg/L、0.05mg/L的NAA浓度的愈伤组织分化率存在极显著差异(P<0.01),0.03mg/L/、0.05mg/L的NAA浓度的愈伤组织分化率差异不显著(P>0.05);1.2mg/L/的6-BA浓度与1.5mg/L的6-BA浓度的愈伤组织分化率存在显著差异(P<0.05),与1.8mg/L的6-BA浓度的愈伤组织分化率存在极显著差异(P<0.01),1.5mg/L的6-BA浓度与1.8mg/L的6-BA浓度的愈伤组织分化率差异不显著(P>0.05)。
表8影响愈伤组织分化率各因素方差分析结果表
注:a.R Squared=0.966(AdjustedR Squared=0.931)。
相关分析的结果如表9所示,NAA与愈伤组织分化率的偏相关系数为-0.692(P>0.05),两者不存在显著相关关系;6-BA愈伤组织分化率的偏相关系数为0.716*(P<0.05),两者具有显著负相关关系;NAA与6-BA的偏相关系数为0.469(P>0.05),两者不存在显著相关关系。
表9愈伤组织分化中控制各因素的偏相关分析结果表
注:a.零阶相关矩阵;相关系数肩标*,表示P<0.05。
5、生根诱导和培养
以1/2MS培养基为基本培养基,添加不同浓度的NAA(0.05mg/L、0.1mg/L、0.15mg/L)和IBA(0mg/L、0.1mg/L、0.5mg/L),两种植物生长调节剂正交,共9个处理(G1-G9)。在超净工作台上,将分化培养基上分化出的芽从基部切下,转接至生根培养基中,进行生根培养。每种处理重复15次,每瓶接种2个不定芽。培养条件同2。从第一瓶苗生根30d后统计再生苗生根率。
由表10可见,在不添加IBA且NAA浓度在0.05mg/L时,再生苗生根率最高仅达到3.33%;在IBA浓度为0.5mg/L时,生根率普遍较高,NAA浓度设置为0.10mg/L时,效果最好,再生苗生根率达到26.67%。因此,最适宜进行再生苗生根的植物生长调节剂组合为G6号处理(1/2MS培养基+0.10mg/L NAA+0.50mg/L IBA),且该处理再生苗产生不定根和再生苗生长情况皆处于最佳状态,如图4。
表10不同植物生长调节剂组合对小叶栀子再生苗生根的影响表
由表11可见,不同NAA浓度对无菌无根苗生根率无显著影响(P>0.05),不同IBA浓度对无菌无根苗生根率有显著影响(P<0.05),因此,只需对IBA浓度的不同水平的均值进行多重比较即可。多重比较的结果显示,0.00mg/L的IBA浓度与0.50mg/L的IBA浓度的无菌无根苗生根率存在显著差异(P<0.05),0.00mg/L的IBA浓度与0.10mg/L的IBA浓度以及0.10mg/L的IBA浓度与0.50mg/L的IBA浓度的无菌无根苗生根率差异不显著(P>0.05)。
表11影响无菌无根苗生根率各因素方差分析结果表
注:a.R Squared=0.833(AdjustedR Squared=0.667)
相关分析的结果如表12所示,NAA与再生苗生根率的偏相关系数为0.248(P>0.05),两者不存在显著相关关系;IBA与再生苗生根率的偏相关系数为0.861**(P<0.01),两者具有极显著的正相关关系;NAA与IBA的偏相关系数为-0.214(P>0.05),两者不存在显著相关关系。
表12再生苗生根中控制各因素的偏相关分析结果表
注:a.零阶相关矩阵;相关系数肩标**,表示P<0.01。
综上所述,本发明利用小叶栀子的无菌叶片、无菌顶芽进行离体培养,针对小叶栀子离体快繁过程中外植体启动、愈伤组织诱导、分化、生根阶段存在的关键问题,对小叶栀子的再生体系进行了优化,成功建立了小叶栀子的离体再生体系,为大规模扩繁生产小叶栀子幼苗奠定了基础,也为其广泛的推广应用创造了有利条件。
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
- 通过组织培养获得栀子苷的方法
- 一种利用建筑垃圾配置小叶栀子种植基质的方法
- 一种小叶栀子无土栽培基及其制备方法
