不同磁共振设备的DCE-MRI测量值一致性的验证方法
文献发布时间:2024-04-18 19:58:53
技术领域
本发明涉及数据分析技术领域,尤其涉及一种不同磁共振设备的DCE-MRI测量值一致性的验证方法。
背景技术
为了促进定量影像技术研发从实验室向临床转化,美国国立癌症机构2008年成立了定量影像网络(Quantitative Imaging Network[QIN]),其中的重点包括动态增强磁共振影像(dynamic contrast-enhanced magnetic resonance imaging[DCE-MRI])。DCE-MRI测量组织微环境特征,被广泛用于肿瘤和关节炎等疾病疗效评价临床实验。但是如何确保不同磁共振设备所测量DCE参数值的一致性是该技术最终临床落地的一个重要前提。
传统的一致性验证方法主要是重复扫描法和水模测试法。重复扫描法是对扫描对象进行重复扫描,相同设备在不同时间进行重复扫描,检测测量值的可重复性。在进行重复扫描实验过程中,扫描条件包括扫描序列、扫描体位、扫描操作流程以及数据处理等操作需要尽可能保持一致,排除客观因素;且重复扫描之间的时间间隔要尽可能短。对于患者而言,因为DCE扫描需要注射造影剂,虽然临床批准使用的造影剂是安全的,但造影剂也存在一定的风险,例如,可能会在脑组织残留而导致潜在的中枢神经系统疾病。因此,重复扫描法在招募患者进行DCE重复扫描会存在伦理批准问题和招募患者困难而造成样本不足的问题。
水模测试法用于DCE-MRI测试的水模通常为液体介质,氯化钠或氯化镍溶液,模拟血管或组织可能的T1值范围,配制成一系列不同浓度的水模。北美定量影像生物标志物联盟(quantitative imaging biomarker alliance[QIBA])可以提供软件DCETool(rsna.org/qidw)用来分析比较设备测量值与水模值。磁共振水模常用于检测磁场空间均匀性、信噪比、T1和T2弛豫时间值等。水模的制备需要符合美国医学物理协会或QIBA推荐的技术要求和有关技术标准(例如YY/T0482-2010)。虽然水模实验可以评估不同设备所测量T1值之间的差异程度,但是实际上的DCE测量数据更复杂,还包括组织和血管造影剂浓度随时间变化的过程,以及对这个过程的指示剂动力学模型解析;实际组织的空间结构也比均匀介质的水模更复杂。因此,采用水模实验的评估结果可能会存在不准确因素。
发明内容
本发明要解决的技术问题是:为了解决现有技术中一致性验证方法过程繁琐、准确性低、不易于临床操作的技术问题。本发明提供一种不同磁共振设备的DCE-MRI测量值一致性的验证方法,无需重复扫描即可分析出测量值之间有无一致性,易于临床操作,且验证结果的可靠性高。
本发明解决其技术问题所采用的技术方案是:一种不同磁共振设备的DCE-MRI测量值一致性的验证方法,包括以下步骤:
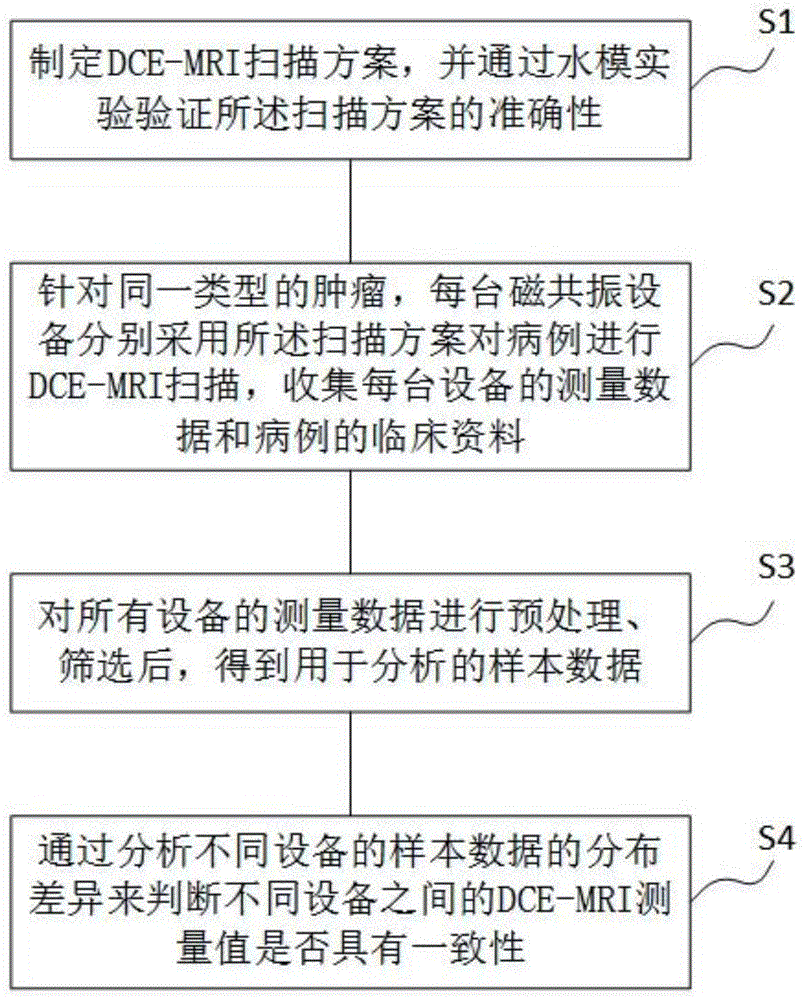
S1、制定DCE-MRI扫描方案,并通过水模实验验证所述扫描方案的准确性;
S2、针对同一类型的肿瘤,每台磁共振设备分别采用所述扫描方案对病例进行DCE-MRI扫描,收集每台设备的测量数据和病例的临床资料;
S3、对所有设备的测量数据进行预处理、筛选后,得到用于分析的样本数据;
S4、通过分析不同设备的样本数据的分布差异来判断不同设备之间的DCE-MRI测量值是否具有一致性。
进一步地,所述DCE-MRI扫描方案包括多个扫描参数,所述扫描参数包含注射造影剂前翻转角、注射造影剂后翻转角、扫描参数TR和TE、扫描视野FOV、矩阵、层厚、层数、注射造影剂前扫描期数、注射造影剂后扫描期数、扫描时间分辨率、至少四期基线以及总扫描时间。
进一步地,所述通过水模实验验证所述扫描方案的准确性包括:
水模内填充有液体,水模液体浓度用于模拟造影剂浓度,将水模放置在磁共振设备内按照所述扫描方案进行扫描,获得影像信号强度S(t);
根据所述影像信号强度S(t),采用多翻转角法得到水模液体浓度的计算值;
将所述水模液体浓度的计算值与水模浓度的真实值进行比较,若两者具有线性关系,则表明所述扫描方案准确。
进一步地,所述多翻转角法的计算公式如下:
R
其中,θ表示翻转角,R
进一步地,步骤S3中,对所有设备的测量数据进行预处理,包括:
去除测量数据中关于病例隐私的数据,标记出测量数据中的肿瘤区域、正常组织的区域以及动脉位置;
采用分布式参数模型对测量数据进行分析,得到血流速F、血管容积分数Vp、细胞间质容积分数Ve和血管壁渗透-表面积乘积PS四个参数。
进一步地,所述分布式参数模型的公式如下:
其中,C
进一步地,步骤S3中,对所有设备的测量数据进行筛选,包括:
所述测量数据包含未手术病例、未化疗病例及免疫治疗病例的测量数据,
比较每台设备的测量数据与其他设备的测量数据在临床资料方面的差异,筛选出具有相同临床资料最多的两组测量数据作为验证的样本数据。
进一步地,步骤S4中,分析不同设备的样本数据的分布差异,包括:
分析两台设备的样本数据的位置分布差异和经验分布差异,若位置分布差异和经验分布差异中的至少一者为分布差异显著,则表明两台设备之间的DCE-MRI测量值无一致性。
进一步地,分析两台设备的样本数据的位置分布差异,包括:
假设磁共振设备的真实测量值服从均值为μ、方差为σ的正态分布,对应的样本空间为Π;而实际测量值服从均值为
记两台设备分别为S
利用Wilcoxon秩和检验方法,对两个独立样本
将独立样本
比较独立样本
当n
进一步地,分析两台设备的样本数据的经验分布差异,包括:
利用Kolmogorov-Smirnov检验方法,对两个独立样本
分别计算独立样本
与现有技术相比,本发明的优点是:
1、无需重复扫描,患者无重复注射造影剂,可以减少安全隐患,更容易得到临床审批;
2、可以减少对患者正常医疗管理流程的干扰,患者更易于入组,数据更易于收集;
3、本发明更易于收集到足够大的样本临床数据,能够更好的反映设备测量值的真实分布,提高验证结果的准确性。
附图说明
下面结合附图和实施例对本发明进一步说明。
图1是本发明的不同磁共振设备的DCE-MRI测量值一致性的验证方法的流程图。
图2是本发明的水模实验的结果图。
图3是本发明的标记肿瘤区域、正常组织的区域以及动脉位置的示意图。
图4是本发明的血流速F、血管容积分数Vp、细胞间质容积分数Ve和血管壁渗透-表面积乘积PS四个参数的测量值示意图。
图5是本发明的动脉输入函数的示意图。
图6是本发明的两台设备测量值一致性比较的示意图。
具体实施方式
现在结合附图对本发明作进一步详细的说明。这些附图均为简化的示意图,仅以示意方式说明本发明的基本结构,因此其仅显示与本发明有关的构成。
在本发明的描述中,需要理解的是,术语“中心”、“纵向”、“横向”、“长度”、“宽度”、“厚度”、“上”、“下”、“前”、“后”、“左”、“右”、“竖直”、“水平”、“顶”、“底”“内”、“外”、“顺时针”、“逆时针”、“轴向”、“径向”、“周向”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明的限制。此外,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。在本发明的描述中,除非另有说明,“多个”的含义是两个或两个以上。
在本发明的描述中,需要说明的是,除非另有明确的规定和限定,术语“安装”、“相连”、“连接”应做广义理解,例如,可以是固定连接,也可以是可拆卸连接,或一体地连接;可以是机械连接,也可以是电连接;可以是直接相连,也可以通过中间媒介间接相连,可以是两个元件内部的连通。对于本领域的普通技术人员而言,可以具体情况理解上述术语在本发明中的具体含义。
如图1所示,本发明的不同磁共振设备的DCE-MRI测量值一致性的验证方法,包括以下步骤:
S1、制定DCE-MRI扫描方案,并通过水模实验验证所述扫描方案的准确性。
需要说明的是,对每一台磁共振设备分别定制DCE-MRI扫描方案,所述DCE-MRI扫描方案可以包括多个扫描参数,所述扫描参数包含注射造影剂前翻转角、注射造影剂后翻转角、扫描参数TR和TE、扫描视野FOV、矩阵、层厚、层数、注射造影剂前扫描期数、注射造影剂后扫描期数、扫描时间分辨率、至少四期基线以及总扫描时间。例如表1所示,LAVA表示肝脏容积采集,VIBE表示屏气容积插值扫描。翻转角是指在射频脉冲的激励下,层面内的宏观磁化矢量偏离静磁场方向的角度,其大小取决于激励射频的强度和作用时间,射频强度越大、作用时间越长,则造成磁化矢量的翻转角度越大。TR是指脉冲序列相邻的两次执行的时间间隔,TR决定了两个脉冲之间纵向磁化矢量的恢复程度。TE表示回波时间,是指从射频脉冲激发到形成最大回波的时间。回波时间TE和重复时间TR是控制扫描序列权重,影响图像对比度最重要的两个扫描参数。扫描视野FOV以能覆盖肿瘤为准。为了测量血管壁渗透性,总扫描时间设定为6分钟。
表1
在本实施例中,可以通过水模实验来验证扫描方案的准确性,具体包括:水模内填充有液体,水模液体浓度用于模拟造影剂浓度,将水模放置在磁共振设备内按照扫描方案进行扫描,获得影像信号强度S(t);根据影像信号强度S(t),采用多翻转角法得到水模液体浓度的计算值;将水模液体浓度的计算值与水模浓度的真实值进行比较,若两者具有线性关系,则表明扫描方案准确。多翻转角法的计算公式如下:
R
其中,θ表示翻转角,R
S2、针对同一类型的肿瘤,每台磁共振设备分别采用所述扫描方案对病例进行DCE-MRI扫描,收集每台设备的测量数据和病例的临床资料。
需要说明的是,验证扫描方案是可行的之后,便可以使用该扫描方案进行测量数据收集。不同的磁共振设备针对同一类型的肿瘤进行扫描,例如均是乳腺癌、大肠癌、宫颈癌等等,病例程度可以是未进行手术的、未进行化疗的或者免疫治疗等。每台磁共振设备分别采用定制好的扫描方案对病例进行DCE-MRI扫描,可以得到不同病例的测量数据,并同步收集病例的临床资料进行统计。需要说明的是,本发明中的测量数据是病人在医院检测时的磁共振扫描数据,不需要额外招募志愿者进行扫描,病例的人口统计资料如表2所示,例如,MRI设备1共扫描了58个病例,对这些病例的病情进行统计分类,便于后续筛选。
表2
S3、对所有设备的测量数据进行预处理、筛选后,得到用于分析的样本数据。
在本实施例中,收集到的所有设备的测量数据是集中进行处理的。其中,预处理包括:去除测量数据中关于病例隐私的数据,标记出测量数据中的肿瘤区域、正常组织的区域以及动脉位置。采用分布式参数模型对测量数据进行分析,得到血流速F、血管容积分数Vp、细胞间质容积分数Ve和血管壁渗透-表面积乘积PS四个参数。例如,如图3所示,可以由影像医师勾画和标记出测量数据中的关于肿瘤的区域、正常组织的区域以及动脉位置,不同类型用不同颜色的线条进行标记,这个步骤可以帮助了解肿瘤所在的位置的大小。分布式参数模型的公式如下:
其中,C
在本实施例中,对测量数据进行筛选包括:测量数据包含未手术病例、未化疗病例及免疫治疗病例的测量数据,比较每台设备的测量数据与其他设备的测量数据在临床资料方面的差异,筛选出具有相同临床资料最多的两组测量数据作为验证的样本数据。
具体的,例如,一共有M台设备,比较每台设备的测量数据与其他设备的测量数据在临床资料方面的差异是指一台设备与其他M-1台设备之间进行临床资料方面进行逐一比较,例如,年龄差异、组织类型的差异、分级的差异、临床分期的差异等等,对于数值变量(例如年龄等),可以采用方差检验差异;对于分类变量(例如组织类型等),可以采用卡方检验差异。方差检验和卡方检验可采用现有的方法进行,检验时,可以获得P值。P值是指当原假设为真时所得到的样本观察结果或更极端结果出现的概率,当P<0.05时,认为两者差异显著。选择具有相同临床资料最多的两组测量数据(即,选择组织类型、分级、临床分期、治疗均相同的病例数量最多的两组测量数据)作为验证的样本数据,这样有利于提高验证结果的准确性和可靠性。例如,经过比较后发现,设备A的测量数据和设备B的测量数据之间具有相同的临床资料最多,则选取设备A和设备B的测量数据作为验证的样本数据。
S4、通过分析不同设备的样本数据的分布差异来判断不同设备之间的DCE-MRI测量值是否具有一致性。
需要说明的是,分析不同设备的样本数据的分布差异包括:分析两台设备的样本数据的位置分布差异和经验分布差异,若位置分布差异和经验分布差异中的至少一者为分布差异显著,则表明两台设备之间的DCE-MRI测量值无一致性。
具体的,分析两台设备的样本数据的位置分布差异,包括:假设磁共振设备的真实测量值服从均值为μ、方差为σ的正态分布,对应的样本空间为Π;而实际测量值服从均值为
在本实施例中,分析两台设备的样本数据的经验分布差异,包括:利用Kolmogorov-Smirnov检验方法,对两个独立样本
如图6所示,本发明采用上述方法比较了一台GE750设备和一台西门子Skyra设备分别收集肿瘤级别为二级的宫颈癌的测量数据,利用分布式参数模型处理得到四个参数的分布以及差异显著水平(P小于0.05表示二者分布存在显著差异),从图上可知,四个参数的P值均大于0.05,表明两台设备的测量数据之间具有一致性。
综上所述,本发明通过定制扫描方案,收集不同设备的测量数据并进行数据处理与筛选,再比较不同设备测量值之间的分布差异来验证设备测量值之间的一致性,本发明无需进行重复扫描,患者也不用重复注射造影剂,可以减少安全隐患,且易于临床审批;可以减少对患者正常医疗管理流程的干扰,患者更易于入组,有利于数据收集;本发明更易于收集到足够大的临床样本数据,更易于反映设备测量值的真实分布。
以上述依据本发明的理想实施例为启示,通过上述的说明内容,相关工作人员完全可以在不偏离本项发明技术思想的范围内,进行多样的变更以及修改。本项发明的技术性范围并不局限于说明书上的内容,必须要如权利要求范围来确定其技术性范围。
- 磁共振设备的不同组件的时间同步的方法和磁共振设备
- 磁共振设备的不同组件的时间同步的方法和磁共振设备
