一种负载促吞噬肽的脂质体及其制备方法和应用
文献发布时间:2024-04-18 19:58:53
技术领域
本发明涉及医药领域,具体涉及一种负载促吞噬肽的脂质体及其制备方法和应用。
背景技术
急性胰腺炎(acute pancreatitis,AP)是非恶性胃肠道疾病住院的最常见的原因,复发率高,20%的急性胰腺炎患者恶化为重症急性胰腺炎(severe acutepancreatitis,SAP),病死率上升到30%-50%,是世界范围性的医疗问题。SAP可以引起全身性炎症反应综合征,对体内的各个脏器组织均产生重要损伤,死亡率较高。
近年来对急性胰腺炎的研究表明,胆道疾病、酒精中毒、胰腺损伤、胰腺缺血、胰管狭窄等是引发急性胰腺炎的重要病因,急性胰腺炎的发病机制和病理过程都非常复杂,除细胞因素、免疫因素、细胞内传导(信号)和感染外,与胰酶、血液循环障碍、细胞凋亡等因素有关。现目前对于急性胰腺炎的药物治疗,主要是通过生长抑素与其类似药物、蛋白酶抑制剂、质子泵抑制剂等药物进行治疗,虽然一定程度上能够改善患者病情,阻止疾病加重,然而,却存在头晕、恶心、腹泻、集中力减退等副作用,影响人体身心健康,减弱了它们实际的临床疗效,尚不能达到预期的治疗效果。因此,探索新的急性胰腺炎治疗方法,是亟待解决的问题。
急性胰腺炎发病相关的机制尚不能完全揭示急性胰腺炎的病因,急性胰腺炎的发生发展是多种病因机制共同作用的结果,现目前大部分药物在急性胰腺炎中的作用机制也尚不明确,有待进一步的研究。因此,仍需进一步探究新药物对SAP受损胰腺的直接作用和机制,寻找参与胰腺炎发病的关键作用分子,以开发出更好的急性胰腺炎治疗手段。
此外,治疗胰腺炎的药物大多数具有半衰期短、生物利用度低、给药方法繁琐、剂量大等特点,严重影响其临床潜力,因此,急需开发一套新型给药系统以提高药物的生物利用度。
发明内容
本发明所要解决的技术问题在于提供一种负载促吞噬肽(Tuftsin,TN)的脂质体,作为治疗胰腺炎的药物,同时提升药物的生物利用率。
本发明提供的基础方案为:一种负载促吞噬肽的脂质体,包括促吞噬肽和包覆于促吞噬肽外周的外壳,所述外壳包括内层和外层,外壳成分为二硬脂酰磷脂酰乙醇胺-聚乙二醇,所述内层和外层之间有硒-硒键。
本发明的工作原理及优点在于:
本申请的发明人发现血清促吞噬肽降低是胰腺炎恶化的迹象,外源性补充促吞噬肽可以通过调节脾脏免疫来改善SAP。然而,促吞噬肽半衰期极短,需多次给药,促吞噬肽的复杂给药也限制了其临床用药的前景,因此,发明人研究了促吞噬肽对SAP受损胰腺的直接作用和机制。嘌呤受体7(Purinergic Receptor P2X7,P2X7)是一种识别特殊的DAMPs的先天免疫受体,发明人发现这是SAP所靶向的免疫检查点,且促吞噬肽可以通过与特定受体相互作用发挥其免疫调节作用。发明人经过大量的实践和研究分析发现,促吞噬肽可以通过P2X7信号通路抑制胰腺腺泡细胞中NLRP3炎性小体的表达和ROS,从而缓解SAP。此外,线粒体功能障碍与SAP中的炎症和ROS密切相关,在炎症性疾病期间,P2X7受体导致单核细胞线粒体损伤并激活NLRP3,因此,促吞噬肽可以通过P2X7介导的线粒体功能调节炎症来缓解SAP。在现有的研究中,未曾报道过促吞噬肽在P2X7信号通路上的相关应用,发明人首次发现促吞噬肽对SAP受损胰腺的直接作用和机制,并且将其直接用于治疗SAP,这也为后续其他科研人员关于治疗SAP的相关研究和开发促吞噬肽的新用途,提供了坚实的研究基础,为胰腺炎的治疗策略提供了新的线索,有助于开发更加有效的治疗药物。
同时,发明人设计了一种稳定的活性氧(reactive oxygen species,ROS)反应脂质体,即DSSM@TN 脂质体,该脂质体具备良好的生物相容性,且能够用于传递促吞噬肽以靶向胰腺炎症部位。本申请的脂质体可以提高亲水性和稳定性,延长促吞噬肽在体内的血液循环时间,有助于到达胰腺的靶部位;此外,在炎症和ROS刺激下,脂质体的硒-硒键会被破坏,能够将药物在目标位点进行释放,对ROS损伤的胰腺部位具有优越的靶向性,大幅度提升了促吞噬肽的生物利用度。同时,硒-硒键的添加,不仅能够使其在炎症和ROS刺激下断裂,将药物进行释放,还可以在改善SAP的线粒体功能后,通过抑制ROS的产生,表现出更理想的抗炎活性。
综上所述,本申请中的发明人首次公开了促吞噬肽对SAP受损胰腺的直接作用和机制,且制备出的DSSM@TN 脂质体可以抑制P2X7诱导的线粒体损伤、ROS的积累和NLRP3的表达,提升促吞噬肽的生物利用度,显著增强促吞噬肽的功效,进一步提升促吞噬肽在临床中预防和治疗SAP的潜力。DSSM@TN脂质体是改善胰腺损伤的理想治疗方法,可以作为治疗胰腺炎的药物,同时也为胰腺炎的治疗研究提供了新方向。(本申请中所述的DSSM,是DSPE-Se-Se-MPEG2000的缩写,DSPE-Se-Se-MPEG2000的中文全称为二硬脂酰基磷脂酰乙醇胺-双硒键-聚乙二醇2000,其中DSPE是二硬脂酰磷脂酰乙醇胺的英文缩写,Se-Se指代的是双硒键,MPEG2000是聚乙二醇2000的缩写;本申请中所述的DSSM@TN,是DSPE-Se-Se-MPEG2000-TN的缩写)
优选的,外壳内部负载有全氟溴辛烷。全氟溴辛烷(perfluorooctyl bromide,PFOB)的添加,可以提高结构稳定性。
本发明还提供了负载促吞噬肽脂质体的制备方法,包括下述步骤:
步骤一:DSSM的制备
将二硬脂酰磷脂酰乙醇胺溶于三氯甲烷中,再加入甲氧基聚乙二醇-双硒键-羧基、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐和4-二甲氨基吡啶,溶解完全后,室温下进行反应,减压旋蒸浓缩反应液,用冰乙醚沉淀,真空干燥即得DSSM;
步骤二:DSSM@TN的制备
(1)在上述制备得到的DSSM中加入氯仿溶液,再加入二棕榈酰磷脂酰胆碱、DSSM、胆固醇和促吞噬肽进行溶解,然后用旋转蒸发器进行旋蒸,直至溶液挥发形成脂质薄膜,然后加入磷酸盐缓冲液到容器中溶解薄膜;
(2)加入全氟溴辛烷的悬浮液,进行超声,然后将乳化溶液进行离心,将收集到的沉淀物悬浮于磷酸盐缓冲液中,得到最终产品DSSM@TN脂质体。
优选的,步骤一中所述甲氧基聚乙二醇-双硒键-羧基、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐和4-二甲氨基吡啶的体积比例为2:2:1。
优选的,步骤二(1)中旋转蒸发器以50-150转/分的转速进行旋蒸。
优选的,步骤二(1)中旋转蒸发器在45-55℃的温度下进行旋蒸。本方案中,旋蒸温度过低或过高,均不利于其成膜性且影响脂质膜的稳定性。当旋蒸温度为45-55℃时,形成的脂质膜非常稳定。
优选的,步骤二(2)中的超声在冰浴条件下进行。本方案中,如若超声没有在冰浴条件下进行,会导致脂质体无法成球结构,不利于包载药物。
优选的,步骤二(2)中的超声时间为5-8分钟。
本发明所述的任一一种负载促吞噬肽的脂质体作为制备治疗具有炎性反应病理特征疾病药物的应用。
优选的,所述具有炎性反应病理特征的疾病为急性胰腺炎或重症急性胰腺炎。
附图说明
图1为载体的制备及其表征,其中(A)为 DSSM的合成示意图;(B)为 DSSM和DM的NMR(1HNMR)谱;(C)为DSSM、DM和Se-Se的FT-IR光谱;(D) TN标准溶液和(E)DSSM@TN样品的HPLC分析。
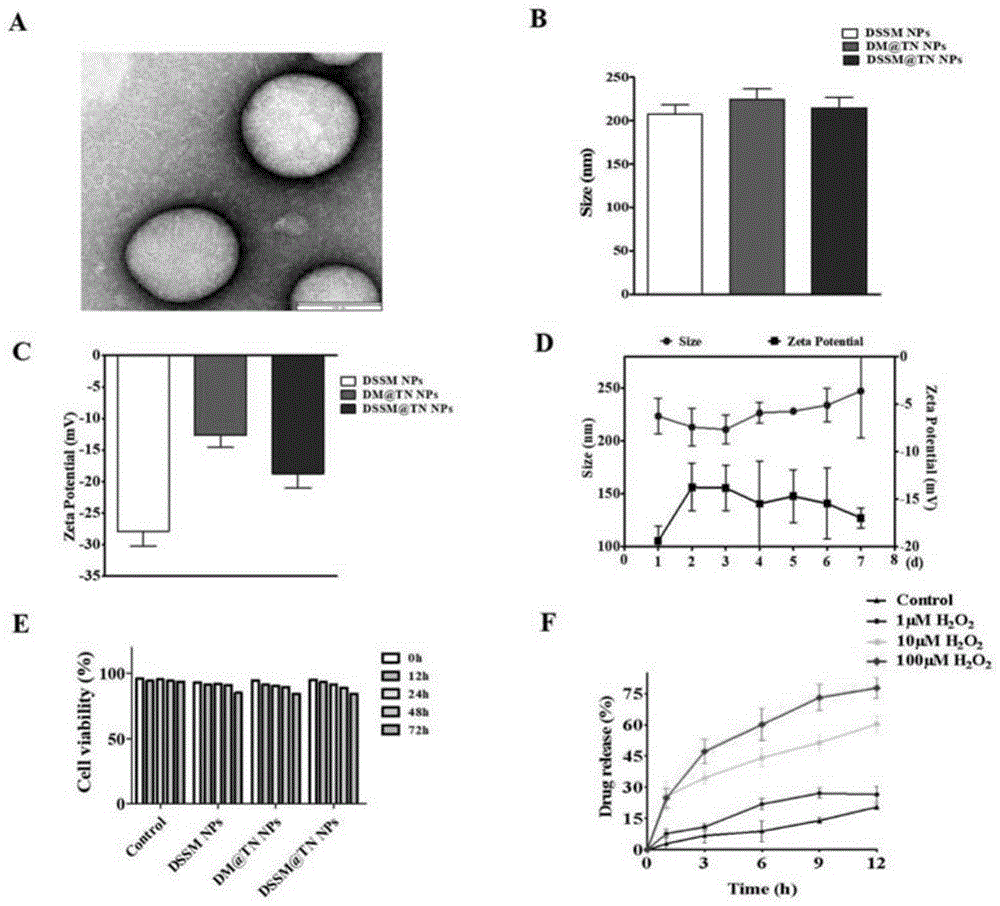
图2所示为DSSM@TN脂质体的表征,其中(A)为 DSSM@TN的代表性TEM图像,比例尺:100nm;(B)为DSSM@TN粒径的平均大小;(C) 为DSSM@TN的平均zeta电位;(D) 为DSSM@TN在7天内的粒径大小和zeta电位;(E) 为DSSM@TN在0h、12h、24h、48h、72h的细胞活力;(F) 为1μm、10μm和100μm H2O2刺激下DSSM@TN在12h内不同时间点的药物释放曲线。数据结果均以平均值 ± 标准误表示,实验至少重复三次;n=5-8只/组。
图3为药物在小鼠体内安全性评价和体外靶向胰腺的能力,其中(A)为DSSM@TN治疗后的肝、脾、肺、肾组织的代表性H&E染色,比例尺:50μm;(B-C)342模型小鼠给予DSSM、DSSM@TN后不同时间点胰腺的体外荧光图像(B)和定量分析(C)。数据结果均以平均值 ±标准误表示,实验至少重复三次;n=5-8只/组。*** p<0.001 vs. DM@TN NPs 组。
图4为DSSM@TN干预SAP的药效考察,其中(A)为实验性SAP方案示意图;(B)为新鲜胰腺组织的典型图像和胰腺具有代表性的H&E染色图像,比例尺:50μm;图(C)为胰腺组织的组织病理学评分;(D)为血清脂肪酶活性;(E)为血清淀粉酶活性;(F)为胰腺IL-6水平;(G)为胰腺IL-1β水平。数据结果均以平均值 ± 标准误表示,实验至少重复三次;n = 5 - 8/组。 * p<0.05 和 ** p<0.01 vs. 空白对照组; # p<0.05 和 ## p<0.01 vs. 模型组;&p<0.05 vs. DM@TN NPs 组。
图5为DSSM@TN改善线粒体功能,抑制实验性SAP中的氧化应激,其中(A)为胰腺组织中的ATP水平;(B)为原代腺泡细胞的TMRM典型荧光图像和荧光定量,比例尺:50μm;(C)为原代腺泡细胞代表性DCFH2DA荧光图像及其定量,比例尺:50μm;(D)为原代腺泡细胞MitoSOX荧光标记的代表性图像及其定量,比例尺:50μm;(E-G)胰腺组织MDA水平(E)、GSH(F)和MPO (G)活性;(H)为Bax、Bcl-2、Nrf2的Western blot分析;(I)为胰腺组织代表性透射电镜图像。数据结果均以平均值 ± 标准误表示,实验至少重复三次;n=5-8只/组。* p<0.05, ** p<0.01 和*** p<0.001 vs. 空白对照组; # p<0.05 和 ## p<0.01 vs. SAP模型组;&p<0.05 和&&p<0.01 vs. DM@TN NPs 组。
图6为DSSM@TN通过抑制P2X7信号改善SAP;其中 (A)为胰腺组织中P2X7的蛋白表达; (B)为P2X7蛋白表达的定量;(C)为胰腺组织中P2X7和NLRP3表达和分布的代表性免疫组化图像,比例尺:50μm;(D)为AZD治疗后胰腺组织的代表性HE染色图,比例尺:50μm; (E)为胰腺损伤评分;(F)为血清脂肪酶水平;(G)为淀粉酶水平。数据结果均以平均值 ± 标准误表示,实验至少重复三次;n=5-8只/组。* p<0.05, ** p<0.01 和*** p<0.001 vs. 空白对照组; # p<0.05 和 ## p<0.01 vs. SAP 模型组;&p<0.05 和 ns,无差异 vs. DM@TNNPs 组。
图7为DSSM@TN通过抑制P2X7信号改善SAP诱导的胰腺线粒体损伤,其中 (A)为腺泡细胞Mitotracker荧光标记的代表性图像,比例尺:50μm;(B)为Mitotracker荧光定量;(C)为腺泡细胞中DCFH2DA荧光标记的代表性图像,比例尺:50μm;(D)为DCFH2DA荧光定量;(E)为胰腺组织中Bax、Bcl-2、Nrf2和HO-1表达的western blot分析;(F) 为Bax、Bcl-2、Nrf2和HO-1表达的定量分析。数据结果均以平均值 ± 标准误表示,实验至少重复三次;n=5-8只/组。* p<0.05, ** p<0.01 和*** p<0.001 vs. 空白对照组; # p<0.05 和 ## p<0.01 vs. SAP 模型组。
图8为DSSM@TN通过抑制P2X7调节的线粒体损伤信号通路来保护SAP的示意图。
以上附图中,“Control”表示空白对照组,“SAP”表示模型组。
具体实施方式
下面通过具体实施方式进一步详细的说明:
实施例:DSSM@TN,一种负载促吞噬肽的脂质体,包括促吞噬肽和包覆于促吞噬肽外周的外壳,所述外壳包括内层和外层,外壳成分为二硬脂酰磷脂酰乙醇胺-聚乙二醇,外壳内部负载有全氟溴辛烷,所述内层和外层之间有硒-硒键。
DSSM@TN的制备方法,包括下述步骤:
步骤一:DSSM的制备
称取50 mg 二硬脂酰磷脂酰乙醇胺溶于10 ml三氯甲烷中,再加入甲氧基聚乙二醇-双硒键-羧基(MPEG2000-Se-Se-COOH)、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(EDC)和4-二甲氨基吡啶(MPEG2000-Se-Se-COOH、EDC和4-二甲氨基吡啶的体积比例为2:2:1,本实施例中MPEG2000-Se-Se-COOH的用量为4 ml,EDC的用量为4 ml,4-二甲氨基吡啶的用量为2 ml),溶解完全后,室温下反应0.5-1 h(本实施例中反应时间为0.5 h),减压旋蒸浓缩反应液,用6 ml冰乙醚沉淀,真空干燥即得DSSM;
步骤二:DSSM@TN的制备
(1)在上述制备得到的DSSM中加入20 ml氯仿溶液,再加入12 mg 二棕榈酰磷脂酰胆碱、4 mgDSSM、4 mg胆固醇和1 mg 促吞噬肽进行溶解,然后用旋转蒸发器在50-150转/分(本实施例中转速为80 转/分)和45-55℃下(本实施例中的温度为50℃)旋蒸0.5-1h(旋蒸到干为止),直至溶液挥发形成脂质薄膜,然后加入3 ml磷酸盐缓冲液(Phosphate-Buffered Solution,PBS)到容器中溶解薄膜;
(2)加入200μl 全氟溴辛烷的悬浮液,在冰浴中使用超声器进行超声(冰浴温度为2-6℃,本实施例采用的冰浴温度为4℃),功率为100W,超声时间为5-8 min(频率为开5 秒关5 秒,本实施例中超声时间为6 min);然后将乳化溶液以5000rpm转/分的转速离心3次,每次5min分钟,将收集到的沉淀物悬浮于1 ml PBS中,得到最终产品DSSM@TN。
对比例:DM@TN(本申请中所述的DM@TN,是DSPE- MPEG2000-TN的缩写)
对比例与实施例的不同之处在于:在步骤一中将MPEG2000-Se-Se-COOH替换为MPEG2000 -COOH。
一、实验仪器和试剂
(1)实验仪器
透射电子显微镜(TEM,日立-7500,日本);激光器Ultra(纳米布鲁克Omni,布鲁克海文仪器有限公司,英国);1H核磁共振(NMR)光谱仪(NEO- 600,Bruker Bios pin,德国);红外光谱仪(Bio-Rad FTS-6000,美国);高速离心机(离心机5804R,埃彭多夫,德国);配备紫外(UV)-可见光检测器的高效液相色谱法(HPLC-20A,日本岛津)。
(2)实验试剂
促吞噬肽和AZD9056购自MedChemExpress (新泽西州, 美国);DSPE 和 PEG2000购自 RuixiBio (西安, 中国);细胞裂解液、蛋白酶抑制剂、磷酸酶抑制剂、细胞计数试剂盒 -8 、ATP 检测试剂盒 和2’,7’-二氯二氢双乙酸荧光素检测试剂盒购自BeyotimeBiotech (上海, 中国);丙二醛、谷胱甘肽过氧化物酶、骨髓过氧化物酶检测试剂盒购自南京建成生物工程研究所 (南京 ,中国);DiR碘化物购自Bioss (北京, 中国);四甲基罗丹明甲酯购自 MolecularProbes (尤金, 美国);抗 Bax 的抗体、Bcl-2 、NLRP3和 P2X7购自Proteintech (武汉, 中国);Nrf2和 HO-1购自Bioss (北京, 中国);免疫组化染色试剂盒购自中山金桥生物技术有限公司 (北京, 中国);如果没有另外说明,其他化学品均来自Sigma-Aldrich (密苏里州圣路易斯,美国) 。
对实施例和对比例进行相应的动物实验,与空白对照组和模型组进行比较。
动物实验的具体操作步骤如下:
所有动物实验和方法均经重庆医科大学第二附属医院动物实验伦理委员会(C3D6CDAE30C9)批准。将小鼠分为每笼4 - 5只,其饲养温度维持在23 ± 2 ℃,将相对湿度设定在40% - 60%,且照明设置为白天/黑夜各12 h循环。每次购进小鼠进行实验之前,将其饲养于以上设定环境中一周,作为其适应期,在此期间,正常喂以常规实验室饮用水和饲料。实验室用水都将进行高压灭菌,每笼小鼠每周换水3-4次,保证用水健康合理,防止瓶塞发生意外。同时,实验室使用的标准鼠笼与混合木屑垫料均是经过高压灭菌的标准饲养笼,其更换频率为每周两次。平时注意观察小鼠饮食、体重变化、活力和健康状况,防止异常小鼠干扰实验结果。
步骤一:小鼠模型的构建方法
采用随机法将Blab/C雄性实验小鼠进行分组(N = 5),以1%戊巴比妥钠(1μL/g)进行腹腔注射麻醉小鼠,后将小鼠固定于无菌手术台,于小鼠手术部位擦拭碘伏进行消毒。于小鼠腹部正中切口入腹,轻轻地将十二指肠牵出开口,置于生理盐水浸润的无菌纱布上,充分暴露胰胆管和十二指肠乳头;使用动脉血管夹把肝脏组织的下方总胆管部位夹紧闭合,小型手术牵引针穿透十二指肠边缘,便于平铺组织,将1 mL 注射器针头穿透十二指肠后,用24 G留置针的软管顺着十二指肠乳头处插入到胰胆管中,将3.5%牛磺胆酸钠生理盐水通过微量注射泵以0.1 mL/min匀速缓慢注入,直至剂量达到0.1 mL/100 g,去除动脉夹和牵引针后,双层关腹。采用同样的方法和同剂量的生理盐水注射处理空白对照组小鼠,其余处理均与模型组相同。
步骤二:药物干预
在SAP模型前1h注射150μg/kg 促吞噬肽,经尾静脉连续注射8次,每小时注射1次。同样,在模型构建前1小时通过尾静脉注射150μg/kg实施例 DSSM@TN或对比例DM@TN,并在SAP模型构建后1小时再次注射。然后用0.2%戊巴比妥钠麻醉小鼠或在SAP模型后24小时使颈部脱位,采集血液和组织。
二、脂质体的特性考察实验
本申请选择DSPE-SE-SE-MPEG2000(DSSM)作为载体材料,图1A展示了DSSM的结构及其合成过程。同时,对DSPE-MPEG2000(DM)和DSSM的结构通过1H-NMR进行了验证。如图1B所示,MPEG2000和DSPE的特征峰分别为~3.6 ppm和~1.3 ppm。
此外,采用傅里叶变换红外光谱(FT-IR)检测DSSM、DM和Se-Se的化学结构和化学键。如图1C所示,可以证实DSPE与MPEG2000之间形成Se-Se键。综上所述,这些数据表明成功制备了DSSM和DM,为制备实施例DSSM@TN和对比例DM@TN奠定了基础。
(一)DSSM@TN的包封率与载药量
实验1
采用HPLC法测定促吞噬肽和脂质体,如图1D所示,紫外检测器波长为227 nm。分别取不同浓度的标准溶液(7.8125、15.625、31.25、62.5、125)制作标准曲线:y = 47927x +112815 (R
(二)脂质体的表征
(1)DSSM@TN的形貌表征
实验2
通过透射电子显微镜观察实施例DSSM@TN的形貌和结构。如图2A所示,透射电子显微镜显示出实施例DSSM@TN为规则的球形形貌,且显示出大小均匀的核壳结构,具备良好的材料体系。
(2)粒径和电位分析
实验3
用Zetasizer Ultra测定对比例DM@TN和实施例DSSM@TN的大小和zeta电位。如图2B所示,DSSM、对比例DM@TN和实施例DSSM@TN的平均尺寸分别为207.2 6.04 nm、224.17.19 nm和214.2 6.84 nm,差异无统计学意义。此外,如图2C所示,DSSM、对比例DM@TN和实施例DSSM@TN的zeta平均电位值分别为-27.87 1.35 mV、-12.67 1.09 mV和-18.751.33mV。这说明在DSSM中包裹的促吞噬肽具有合适的大小、形态、结构和zeta电位,为下一步的研究奠定了基础。
(3)DSSM@TN的稳定性
实验4
考察实施例DSSM@TN脂质体在7天内的粒径大小和电位变化。如图2D所示,7天内未发现DSSM@TN的粒径和Zeta电位有明显变化,说明实施例DSSM@TN脂质体具有良好的稳定性。
(三)DSSM@TN的ROS响应活性
实验5
测定实施例DSSM@TN在不同浓度H
(四)DSSM@TN的体内生物安全性和体外靶向能力
实验6
鉴于实施例DSSM@TN具有良好的理化性质,本申请进一步研究了其在体内的生物安全性和在胰腺组织中的代谢。分别于DSSM@TN给药后0、7、14、21天处死小鼠,对不同组织进行组织病理学染色。
如图3A所示,实施例DSSM@TN对肝、脾、肺、肾等组织无损伤,说明实施例DSSM@TN具有良好的生物安全性。如图3B和3C所示,在SAP损伤的胰腺组织中,含有DIR标记的实施例DSSM@TN的荧光信号在15min至6h期间明显增强,在6h时逐渐减弱,在9h时进一步减弱,直到12h后完全消失,而对比例DM@TN的荧光强度在15min后急剧下降,30min后几乎没有荧光。这些数据表明由于Se-Se键的加入,实施例DSSM@TN能够显著延长促吞噬肽在体内的持续时间,增加受损胰腺组织的靶向浓度。
三、脂质体的效果证明实验
(一)细胞毒性
实验7
毒性对药物的应用前景至关重要,因此,本申请评估了脂质体对原代胰腺腺泡细胞的细胞毒性。如图2E所示,DSSM、对比例DM@TN和实施例DSSM@TN不影响细胞活力。
(二)药效评价
实验8
如图4A所示,分别在SAP模型前1h和后1h给药150μg/kg 对比例DM@TN或实施例DSSM@TN。如图4B所示,注射牛磺胆酸钠(sodium taurocholate,NAT)导致部分胰腺组织损伤严重的部位出现炎症细胞浸润、水肿、坏死;而与对比例DM@TN相比,实施例DSSM@TN减轻了胰腺损伤,并表现出更好的治疗效果。同样,如图4C所示,实施例DSSM@TN应用于SAP后,胰腺的平均损伤评分显著降低。
此外,如图4D和4E所示,与对比例DM@TN治疗相比,实施例DSSM@TN抑制血清脂肪酶和淀粉酶的效果优于对比例DM@TN。如图4F和4G所示,与DM@TN相比,DSSM@TN胰腺中的IL-6和IL-1β也明显下降更多。上述结果均表明,与对比例DM@TN相比,实施例DSSM@TN对SAP具有更好的保护潜力,表现出更理想的抗炎活性,具有更广阔的应用前景,这些均是由于Se-Se键在促吞噬肽改善体内SAP中起着关键作用。
(三)DSSM@TN降低线粒体损伤
实验9
本申请研究了实施例DSSM@TN对SAP中线粒体损伤和炎症的影响。如图5A所示,与对比例DM@TN相比,实施例DSSM@TN在提高ATP含量方面表现出更好的效果。线粒体功能与细胞ATP和炎症密切相关,因此本发明用激光扫描共聚焦显微镜(LSCM)检测线粒体膜电位(Mitochondrial membrane potential,MMP)。如图5B所示,与对比例DM@TN相比,实施例DSSM@TN在更大程度上恢复了耗尽的MMP。
实验10
线粒体损伤直接导致细胞氧化应激,参与SAP的发病机制,因此,本申请进一步检测DCFH2DA荧光检测腺泡细胞中ROS水平。如图5C所示,实施例DSSM@TN处理组中DCFH2DA荧光强度下降,表明实施例DSSM@TN可以抑制SAP诱导的氧化应激;同样,如图5D所示,与对比例DM@TN相比,实施例DSSM@TN中用MitoSOX染料标记的腺泡细胞中的线粒体ROS显著减少,因此,实施例DSSM@TN对氧化应激的抑制作用优于对比例DM@TN。
此外,如图5E和5F所示,与对比例DM@TN相比,实施例DSSM@TN中MDA水平的降低和GSH水平的升高,也表明实施例DSSM@TN在SAP期间减轻胰腺氧化损伤的潜力更好。同时,如图5G所示,实施例DSSM@TN的髓过氧化物酶(Myeloperoxidase,MPO)活性低于对比例DM@TN,实施例DSSM@TN在胰腺组织中也表现出更好的抗炎功能。如图5H所示,实施例DSSM@TN通过降低Bax表达和提高Bcl-2水平来抑制线粒体凋亡性损伤,通过上调Nrf2/HO-1信号来抑制线粒体氧化应激。此外,如图5I所示,实施例DSSM@TN 更有效地恢复了线粒体膜的完整性,改善线粒体脊等内部结构损伤。综上所述,这些结果均表明DSSM@TN可以显著增强促吞噬肽的功效,减轻线粒体损伤。
(四)促吞噬肽在P2X7信号通路上的应用
(1)DSSM@TN抑制P2X7活性改善SAP
实验11
P2X7受体是一种重要的先天免疫受体,在炎症的启动和介导中起着至关重要的作用。如图6A和6B所示,NAT诱导SAP伴随着P2X7活性的显著活化。实施例DSSM@TN对胰腺病理损伤的保护是通过调节与炎症反应密切相关的P2X7活性来介导的,本申请发现实施例DSSM@TN和对比例DM@TN可以抑制胰腺中P2X7的表达。同时,如图6C所示,与对比例DM@TN组相比,实施例DSSM@TN组NLRP3的分布和表达更低,证明其炎症进一步减少。
实验12
为进一步阐明促吞噬肽是通过调节P2X7对胰腺损伤的保护作用,本发明在DSSM@TN处理后给SAP模型小鼠腹腔注射12.5 mg/kg P2X7拮抗剂AZD(AZD9056,AZD9056的化学分子式为C
(2)DSSM@TN抑制P2X7信号通路以减弱线粒体功能障碍
实验13
由于抑制P2X7活性后,减少胰腺损伤,因此抑制与线粒体功能障碍密切相关的细胞内炎症信号以改善胰腺炎。本申请通过Mitotracker染色检测不同处理小鼠原代腺泡细胞的MMP。如图7A和7B所示,给药实施例DSSM@TN后,特别是AZD处理后,SAP引起MMP下降会得到恢复。此外,本发明还检测了腺泡细胞的DCFH2DA荧光,其代表ROS水平以评估线粒体功能,根据图7A和7B显示,AZD的应用,增强了实施例DSSM@TN抑制SAP诱导的ROS生成的有效性。此外,如图7C和7D所示,还检测到 SAP期间实施例DSSM@TN治疗后胰腺中Bax表达下降和Bcl-2表达增强,且AZD进行治疗后会进一步改善。线粒体功能的改善对于抑制SAP的氧化应激至关重要。如图7E和7F所示,本申请发现实施例DSSM@TN通过增加Nrf2和HO-1表达来促进Nrf2/HO-1途径,而在SAP期间,DSSM@TN处理后,AZD进一步通过增加Nrf2和HO-1表达来降低氧化应激。这些结果表明,线粒体功能受损伴随MMP丢失和ROS水平升高是SAP的重要诱因,而实施例DSSM@TN通过阻断P2X7信号通路,改善线粒体功能。因此,如图8所示,实施例DSSM@TN治疗可以通过抑制P2X7介导的线粒体损伤信号通路恢复线粒体功能来保护SAP。
综上所述,本申请首次发现促吞噬肽在P2X7信号通路上的应用,实施例DSSM@TN可以抑制SAP诱导的P2X7表达。本发明用拮抗剂进行的实验表明,AZD(一种特异性的P2X7受体抑制剂),促进了实施例DSSM@TN对SAP的疗效。由实验结果可知,AZD处理可增加DSSM@TN通过促进Nrf2/HO-1信号而抑制线粒体氧化应激,并上调BCL-2表达而减少线粒体凋亡性损伤,从而减轻线粒体损伤、能量耗竭和胰腺组织炎性损伤程度;这表明促吞噬肽或实施例DSSM@TN可以通过抑制P2X7介导的线粒体损伤信号转导而减轻胰腺炎病理表现,这不仅提高了促吞噬肽在未来的临床应用中预防和治疗SAP的潜力,同时还为科研人员提供了坚实的研究基础,为重症胰腺炎的治疗策略提供了新的线索。
以上所述的仅是本发明的实施例,方案中公知的具体技术方案和/或特性等常识在此未作过多描述。应当指出,对于本领域的技术人员来说,在不脱离本发明技术方案的前提下,还可以作出若干变形和改进,这些也应该视为本发明的保护范围,这些都不会影响本发明实施的效果和专利的实用性。本申请要求的保护范围应当以其权利要求的内容为准,说明书中的具体实施方式等记载可以用于解释权利要求的内容。
- 一种安康鱼皮肽的制备方法及所制备的安康鱼皮肽的免疫调节应用
- 一种胶原蛋白肽和弹性蛋白肽的组合物及其制备方法和应用
- 一种包埋月桂精油和纳米银的脂质体/壳聚糖抗菌、抗氧化涂膜液及制备方法与应用
- 一种细菌素CAMT2大豆卵磷脂纳米脂质体及其制备方法和应用
- 载促吞噬肽的碳化MOFs纳米粒和制备方法和在视网膜母细胞瘤的成像和治疗中的应用
- 促吞噬肽修饰阿魏酸生物可降解纳米囊泡的制备方法
