一种用于抗肿瘤的药物组合物
文献发布时间:2024-04-18 19:58:53
技术领域
本发明属于生物医药技术领域,具体涉及一种用于抗肿瘤的药物组合物。
背景技术
免疫检查点抑制剂anti-PD-1/anti-PD-L1是近年来在肿瘤免疫治疗中取得的里程碑式的进展。目前,anti-PD-1/anti-PD-L1可应用于临床多种肿瘤的治疗,包括非小细胞肺癌,胃癌,黑色素瘤及肾细胞癌等。虽然,anti-PD-1/anti-PD-L1很大程度上延长了晚期肿瘤病人的生存期,但是临床上肿瘤患者对anti-PD-1/anti-PD-L1治疗的响应率并不高。根据肿瘤类型的不同,治疗响应率介于10%-30%。此外,一些肿瘤,例如前列腺癌和胰腺癌对anti-PD-1/anti-PD-L1的治疗非常不敏感。因此,如何提高anti-PD-1/anti-PD-L1的治疗效果及扩大其治疗的瘤种是目前临床上亟待解决的关键问题。
外泌体(EVs)是细胞分泌的胞外囊泡之一,直径介于30-150nm。肿瘤细胞来源的胞外囊泡(Tumor derived-Extracellular Vesicles,TEVs)在抑制机体抗肿瘤免疫过程中发挥着重要的作用。有研究证实了TEVs还携带膜PD-L1,并可通过PD-L1抑制机体的抗肿瘤免疫。黑色瘤细胞来源的EVs含有较高水平的膜PD-L1,可抑制抗肿瘤CD8+T细胞反应,而且外周血中EVsPD-L1较高的病人对anti-PD-1的治疗反应性较差。前列腺癌和结肠癌来源的EVs可通过膜PD-L1抑制机体系统性抗肿瘤免疫和免疫记忆的形成。此外,TEVs的PD-L1可抵抗anti-PD-L1的治疗。因此,减少TEVs的PD-L1,是提高机体的抗肿瘤免疫及增强肿瘤患者anti-PD-1/anti-PD-L1治疗反应性的有效策略。
已有研究表明,PD-L1分选至EVs依赖于ESCRT,因为敲除ESCRT-0的亚单位Hrs后,TEVs中的PD-L1水平明显降低。作为ESCRT-0的主要成员,Hrs识别与结合的底物蛋白需要被泛素化修饰。因此,在ESCRT依赖的EVs分选途径中,PD-L1的泛素化修饰是必需的。Cullin3和β-TrCP是已被报道的PD-L1的E3泛素连接酶。虽然,Cullin3和β-TrCP均可显著增强肿瘤细胞PD-L1的泛素化,但两者皆不能增加TEVs的PD-L1含量,可见并非是由Cullin3和β-TrCP导致PD-L1分选至EVs,可能还存在其他酶能诱导PD-L1被Hrs识别及随后的EVs分选。
因此,急需找到诱导PD-L1被分选至EVs的原因,希望依此找到能有效减少TEVs的PD-L1的方法,从而提高anti-PD-1/anti-PD-L1的肿瘤免疫治疗效果。
发明内容
针对现有技术存在的问题,本发明提供了一种用于抗肿瘤的药物组合物,探究了PD-L1分选至EVs上的分子机制,发现肿瘤细胞通过分泌MFGE8促进UBE4A表达,UBE4A能使PD-L1泛素化并促进其分选至TEVs,从而使TEVs膜PD-L1水平升高,抵抗anti-PD-L1的治疗;采用MFGE8抗体可以抑制UBE4A的活性,抑制PD-L1泛素化,从而降低肿瘤细胞分泌的EVs上PD-L1的表达水平。MFGE8抗体与PD-1抗体联用,可提高肿瘤免疫治疗效果,有效解决乳腺癌或黑色素瘤免疫治疗效果差的问题,对多种肿瘤细胞具有良好的抑制作用,具有很好的应用前景,而且能够作为辅助药物,提高PD-L1抗体药物的治疗效果。
一方面,本发明提供了一种用于抗肿瘤的组合物,所述抗肿瘤组合物包括A和B;所述A包括抑制MFGE8(乳脂球表皮生长因子8)蛋白活性的物质,和/或降低MFGE8基因表达的物质;B包括抑制PD-1活性的药物。
进一步地,所述抑制MFGE8蛋白活性的物质包括MFGE8抗体,所述抑制PD-1活性的物质包括PD-1抗体。
分选到TEVs上的PD-L1可抵抗anti-PD-L1的治疗,会导致肿瘤患者对anti-PD-1或anti-PD-L1的治疗不敏感。
本发明探究了PD-L1分选至EVs上的分子机制,并针对筛选出的靶点乳脂球表皮生长因子8(MFGE8)发明一种中和抗体,用于抗肿瘤的药物组合物,通过将MFGE8抗体与PD-1抗体联用,提高PD-1抗体疗效,并对多种肿瘤具有良好的抑制作用。
进一步地,所述PD-1抗体包括帕博利珠单抗、纳武利尤单抗、信迪利单抗、特瑞普利单抗、替雷利珠、卡瑞利珠中的任意一种或多种。
另一方面,本发明提供了一种组合物用于制备提高肿瘤免疫治疗效果的试剂的用途,所述药物组合物包括MFGE8抗体和PD-1抗体。
进一步地,所述肿瘤包括乳腺癌、黑色素细胞瘤、肺癌中的任意一种或多种。
再一方面,本发明提供了一种物质用于制备肿瘤免疫治疗试剂的用途,所述物质包括抑制MFGE8蛋白活性的物质,或降低MFGE8基因表达的物质,或MFGE8抗体,或降低UBE4A基因表达的物质,或抑制UBE4A蛋白活性的物质中的任意一种或多种。
再一方面,本发明提供了一种物质用于制备提高PD-1抗体的肿瘤免疫治疗效果的试剂的用途,所述物质包括抑制MFGE8蛋白活性的物质,或降低MFGE8基因表达的物质,或MFGE8抗体,或降低UBE4A基因表达的物质,或抑制UBE4A蛋白活性的物质中的任意一种或多种。
再一方面,本发明提供了MFGE8抗体用于制备UBE4A蛋白活性的试剂的用途。
再一方面,本发明提供了MFGE8作为抗肿瘤免疫治疗靶点的用途。
在一些方式中,所述MFGE8为鼠源MFGE8基因,具有如SEQ ID NO:1所示的核苷酸序列,或MFGE8为鼠源MFGE8蛋白具有如SEQ ID NO:2所示的氨基酸序列。
在一些方式中,所述MFGE8为人源MFGE8基因,具有如SEQ ID NO:3所示的核苷酸序列,或MFGE8为人源MFGE8蛋白具有如SEQ ID NO:4所示的氨基酸序列。
再一方面,本发明提供了UBE4A作为抗肿瘤免疫治疗靶点的用途,所述UBE4A基因具有如SEQ ID NO:2所示的核苷酸序列。
在一些方式中,所述UBE4A为鼠源UBE4A基因,具有如SEQ ID NO:5所示的核苷酸序列,或UBE4A为鼠源UBE4A蛋白具有如SEQ ID NO:6所示的氨基酸序列。
在一些方式中,所述UBE4A为人源UBE4A基因,具有如SEQ ID NO:7所示的核苷酸序列,或UBE4A为人源UBE4A蛋白具有如SEQ ID NO:8所示的氨基酸序列。
本发明通过免疫沉淀PD-L1并通过质谱分析PD-L1相互作用蛋白,发现PD-L1可与E3泛素连接酶UBE4A结合。UBE4A在促进肿瘤细胞PD-L1泛素化的同时增加TEVs携带PD-L1的水平。此外,我们发现随着肿瘤的进展,肿瘤微环境(TEM)中释放的乳脂球表皮生长因子8(MFGE8)逐渐增加,并增强Ube4a的转录,进一步通过αv整合素信号通路激活c-Fos和c-Jun,从而诱导肿瘤细胞产生具有更多PD-L1和更强免疫抑制能力的TEVs。因此,我们通过开发MFGE8中和单克隆抗体(mAb),并验证了MFGE8的阻断消除了αPD-1治疗耐药性,同时下调了肿瘤组织(TTs)中UBE4A的表达,并降低了TTs-EVs上的PD-L1。
本发明公开了用于肿瘤细胞中UBE4A活性的物质在制备乳腺癌或黑色素瘤治疗药物中的应用。本发明揭示肿瘤细胞中的UBE4A可作为免疫治疗的辅助治疗靶点,通过抑制UBE4A,降低肿瘤细胞分泌的EVs上PD-L1的表达水平,提高免疫治疗的疗效。并且,肿瘤微环境中的MFGE8可使UBE4A的转录水平及蛋白表达水平显著提高,通过使用MFGE8中和抗体,能明显降低肿瘤细胞中UBE4A的表达水平。本发明研究发现MFGE8抗体与PD-1抗体联用对多种肿瘤细胞具有良好的抑制作用,能够用于制备抗肿瘤药物,具有很好的应用前景,而且能够作为辅助药物,提高PD-1抗体药物的治疗效果。
本发明的有益效果为:
1、本发明通过免疫沉淀PD-L1并通过质谱分析PD-L1相互作用蛋白,发现PD-L1可与E3泛素连接酶UBE4A结合,UBE4A在促进肿瘤细胞PD-L1泛素化的同时增加TEVs携带PD-L1的水平,本发明首次揭示肿瘤细胞中的UBE4A可作为免疫治疗的辅助治疗靶点,通过抑制UBE4A,降低肿瘤细胞分泌的EVs上PD-L1的表达水平,提高免疫治疗的疗效;
2、本发明首次发现肿瘤微环境中的MFGE8可使UBE4A的转录水平及蛋白表达水平显著提高,通过使用MFGE8中和抗体,能明显降低肿瘤细胞中UBE4A的表达水平,本发明通过开发MFGE8中和单克隆抗体(mAb),并验证了MFGE8的阻断消除了αPD-1治疗耐药性,同时下调了肿瘤组织(TTs)中UBE4A的表达,并降低了TTs-EVs上的PD-L1;
3、本发明研究发现MFGE8抗体与PD-1抗体联用对多种肿瘤细胞具有良好的抑制作用,能够用于制备抗肿瘤药物,具有很好的应用前景,而且能够作为辅助药物,提高PD-1抗体药物的治疗效果。
附图说明
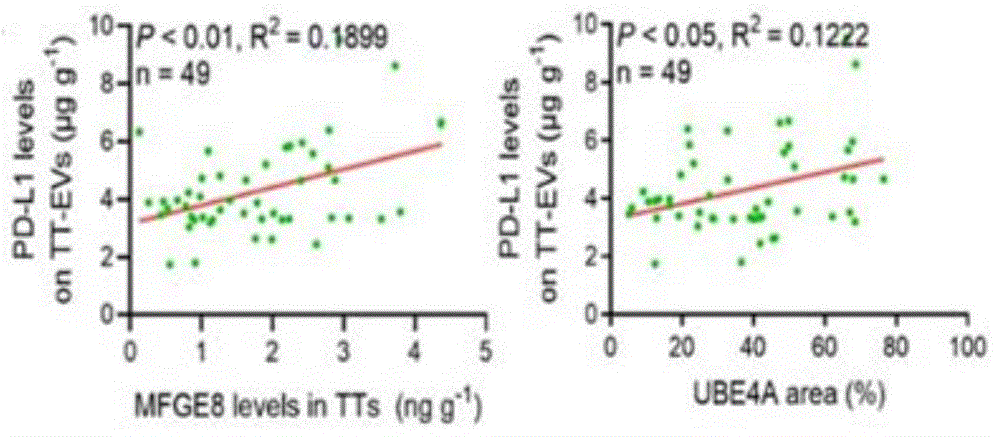
图1:UBE4A和MFGE8相关性分析;
图2:UBE4A和MFGE8与TT-EVs相关性分析;
图3:UBE4A、MFGE8或TT-EVs上PD-L1与肿瘤患者预后相关性分析;
图4:UBE4A、MFGE8或TT-EVs上PD-L1与肿瘤分期相关性分析;
图5:肺癌患者的Circ-MFGE8和Circ-EV上PD-L1水平相关性分析;
图6:外周血EVsPD-L1水平与肿瘤病人对免疫治疗的反应性相关性分析;
图7:外周血EVsPD-L1水平与肿瘤患者预后相关性分析;
图8:流式检测2-、3-和4-WK EVs对CD8+T细胞增殖的免疫抑制能力;
图9:流式检测蛋白酶K消化后2-、3-和4-WK EVs对CD8+T细胞增殖的免疫抑制能力;
图10:流式检测2-、3-和4-WK EV上的PD-L1水平;
图11:流式检测αPD-L1作用下的4-WK EV的免疫抑制功能;
图12:免疫印迹法检测4-WK SN、2-WK SN刺激细胞后EVs携带的PD-L1;
图13:免疫印迹法检测MC38细胞上膜表达的PD-L1;
图14:免疫印迹法检测总PD-L1水平;
图15:PD-L1与CD63的共定位免疫荧光结果;
图16:PD-L1与Hrs的共定位免疫荧光结果;
图17:免疫印迹检测2-WK和4-WK的肿瘤组织中PD-L1的泛素化水平;
图18:免疫印迹检测4-WK SN处理后的细胞中PD-L1的泛素化水平;
图19:免疫印迹检测4T1细胞中过表达泛素促进PD-L1的泛素化水平;
图20:免疫印迹检测4T1细胞中去泛素化酶CNS5抑制PD-L1的泛素化;
图21:免疫印迹检测EVs膜PD-L1水平明显增加;
图22:免疫印迹检测EVs膜PD-L1水平明显被抑制;
图23:免疫共沉淀检测E3泛素连接酶Cullin3或β-TrCP被表达;
图24:流式检测4T1EVs的膜PD-L1水平;
图25:质谱分析PD-L1下调的3种E3连接酶;
图26:免疫印迹检测UBE4A和PD-L1相互作用;
图27:免疫印迹检测过表达UBE4A后也能明显促进4T1细胞泛素化水平;
图28:免疫印迹检测干扰Ube4a基因后进行泛素化检测,发现细胞泛素化明显被抑制;
图29:免疫印迹检测通过逐一构建赖氨酸位点突变为精氨酸的PD-L1突变体明确PD-L1的泛素化位点在K75位点;
图30:免疫印迹检测体外泛素化实验明确UBE4A介导PD-L1泛素化的赖氨酸位点为K75位;
图31:UBE4A敲除的4T1细胞的细胞PD-L1水平;
图32:UBE4A敲除的4T1细胞的细胞活力;
图33:UBE4A敲除的4T1细胞的形态;
图34:UBE4A敲除的4T1细胞的一般标记;
图35:UBE4A敲除的4T1细胞的大小分布;
图36:UBE4A敲除的4T1细胞的CD9+CD63+EV水平;
图37:UBE4A敲除的4T1细胞的膜相关PD-L1水平;
图38:UBE4A敲除的4T1细胞抑制CD8+T细胞增殖的能力受损;
图39:4T1 Ube4a
图40:肿瘤细胞缺乏UBE4A对Foxp3+CD4+调节性T(Treg)细胞的比例;
图41:Pd1
图42:野生型小鼠回输4T1-TT-Evs或回输4T1-Ube4a-/-TT-Evs与4T1肿瘤进展;
图43:Pd1
图44:过滤器确定因子的分子量范围;
图45:MS分析2-和4-WK TTs之间77种不同表达的蛋白质;
图46:筛选结果为玻连蛋白(VTN-N)、MFGE8和凝血因子X;
图47:4T1细胞中UBE4A的mRNA表达;
图48:4T1细胞中UBE4A的蛋白表达;
图49:4T1细胞中4T1-EV上的PD-L1;
图50:4T1荷瘤小鼠中注射RM026后的肿瘤发展;
图51:dLN中活化的CD8+T细胞数量及活性;
图52:4T1-Ube4a-/-肿瘤模型中RM026与肿瘤发展;
图53:αPD-1与RM026与4T1肿瘤的进展;
图54:αPD-1和RM026与B16F10肿瘤进展;
图55:单独使用RM026或与αPD-1联用后UBE4A的表达水平;
图56:单独使用RM026或与αPD-1联用后TTs EV上的PD-L1水平;
图57:Syk抑制剂R406处理4T1细胞后UBE4A的表达水平;
图58:NF-κB(PDTC)、p38(SB203580)、NFAT抑制剂(11R-VIVIT)、ERK(U0126)或JNK(SP600125)的抑制剂与MFGE8诱导的UBE4A蛋白增加;
图59:AP-1抑制剂T-5224与mFGE8诱导的4T1细胞中UBE4A蛋白的增加;
图60:c-Fos或c-Jun沉默显著抑制mFGE8介导的UBE4A上调;
图61:ChIP-seq揭示Ube4a启动子中的c-Fos结合峰;
图62:ChIP-PCR证实了c-Fos和c-Jun在4T1细胞中对该序列的结合,其分别被c-Fos或c-Jun沉默所抑制,而mMFGE8刺激增强了两种结合。
具体实施方式
本发明所列的具体实施方式仅仅说明本发明如何实现,并不能构成对本发明的限制,而本发明的范围以权利要求为准。
1、细胞来源及培养:4T1(TCM32)、B16F10(TCM36)和HEK293(GNHu43)细胞购自中国科学院研究所(中国上海)。4T1、B16F10和HEK293细胞均在DMEM(Thermo)中培养,DMEM含有10%EVs缺失的胎牛血清(Thermo)和1%青霉素/链霉素(Keyi,杭州,浙江,中国)。所有细胞在37℃,在含5%二氧化碳的环境中进行培养。
2、CRISPR-Cas9介导的基因敲除细胞的构建:gRNA及其靶基因序列列于下表中,将gRNA克隆到Lenti-CRISPR-v2载体中。为了删除靶基因,用携带靶gRNA的Lenti-CRISPR-v2质粒瞬时转染B16F10和4T1细胞,并用2.5μg ml-1嘌呤霉素选择3天。然后将细胞转移到不含嘌呤霉素的新鲜培养基中,并以超低密度接种以培养单细胞形成集落。然后挑选并扩增细胞,最后通过Western blot或ELISA进行敲除验证。
3、细胞EVs的提取:首先,由于FBS中原本就含有大量EVs,为排除FBS中EVs对实验结果造成干扰,在本研究中,涉及EVs提取的细胞都使用去除EVs后的FBS进行培养。将FBS在100,000g,90min,4℃条件下进行超速离心,弃沉淀回收血清,并用0.22μm的滤器进行过滤后使用。4T1和B16细胞经传代后待细胞密度生长至接近90%后,收集培养基上清,按以下顺序进行梯度离心:4℃,300×g离心10min,2,000×g离心20min,10,000×g离心30min以此去除细胞碎片和大囊泡。接着,将高速离心后的上清收集后,用0.22μm PVDF过滤器进行过滤,最后将滤液转移至超离管中,4℃,100,000×g超速离心70min,弃上清再用适量的预冷的PBS进行重悬。为了得到纯度更高的EVs,将初次收集的EVs重悬于预冷的PBS中,再次以100,000×g,70min来洗涤样品。最后将沉淀的EVs重悬于适量预冷的PBS中,分装保存于-80℃冰箱。进一步根据试剂盒说明书的方法,使用BCA蛋白检测试剂盒检测所提EVs的蛋白浓度,以备后续实验使用。
4、肿瘤组织EVs的提取及组织裂解液上清的收集:分离或收集的肿瘤组织块先置于无血清的RPMI-1640培养基中,使用灭过菌的剪刀及镊子将肿瘤组织尽可能的剪碎,接着在培养基中加入IV型胶原酶和DNA I酶,将组织悬浊液全部转移至15ml离心管中,放在360°摇床中,置于37℃恒温培养箱中消化2h。消化后的组织悬浊液经细胞筛进行过滤去除未被消化的组织,再将滤液进行室温离心2,000rpm,10min,离心后收集上清。之后将上清按方法1中细胞EVs提取的方法进行高离和超离,最终将得到的EVs重悬于PBS中,分装保存于-80℃冰箱。
5、肿瘤模型:小鼠黑色素瘤细胞B16、小鼠乳腺癌细胞4T1和人乳腺癌细胞MCF7构建方法,在第0天,小鼠皮下注射2×106肿瘤细胞,如下所示:B16F10、B16F10-Rab27a-/-、B16 F10-Ube4a-/-,4T1、4T1 Rab27a/-和4T1 Ube4a-/-细胞。在第7天,将荷瘤小鼠随机分组并接受如下所述的治疗。每2天给小鼠静脉注射100μg anti-PD-1或每3天给小鼠注射100μg MFGE8中和抗体RM026以阻断MFGE8。对于αPD-1治疗,小鼠腹膜内注射100μg的αPD-1。在一些实验中,Rab27a-/-B16F10或4T1 Rab27a/-4T1荷瘤小鼠在肿瘤接种后14天接受αPD-1。小鼠每2天静脉注射Cilengitide(MCE)200μg以阻断αvβ3和αvβ5的功能。在第20天,对小鼠实施安乐死,并收集dLN、肿瘤浸润免疫细胞和血液用于流式细胞术分析。每2天通过测量肿瘤的长度和宽度来监测肿瘤生长。肿瘤体积计算公式为:0.5×长×宽
6、流式细胞分析:将EV与PBS中的4-μm醛/硫酸盐乳胶微珠(赛默飞)在室温下混合后静置30分钟。然后使用不含EVs的胎牛血清(赛默飞)将混合物进行封闭30分钟。之后加入PBS至1ml,在3800×g,4℃条件下离心5分钟,收集EV和乳胶微珠复合物。用PBS洗涤两次后,加入100μl预定抗体浓度的PBS在室温下孵育20分钟。对于需进行流式分析的细胞样本,收集细胞后,用PBS在1500rpm,4℃条件下离心5分钟,重复2次清洗细胞,再加入100μl预定抗体浓度的PBS在室温下孵育20分钟。使用ACEA NovoCyte流式细胞仪分析细胞或珠粒。对于细胞内染色,用PMA(50ngml-1,Sigma-Aldrich)、离子霉素(1μg ml-1,Sigma-Aldrich)和brefeldin A溶液(eBioscience,San Diego,CA,USA),在细胞内染色前先在37℃下保持4小时。使用FlowJo软件(Tree Star,Ashland,OR,USA)分析流式细胞术数据。
7、免疫荧光:细胞用-20℃预冷的甲醇固定10-20分钟,然后用0.1%Triton X-100在室温下透化10分钟。通过用PBS中含有5%牛血清白蛋白和3%山羊血清的封闭缓冲液孵育细胞来封闭非特异性结合位点。然后,将细胞与相应的一抗放置在4℃条件下孵育过夜。第二天,在PBS中洗涤三次后,将细胞与DyLight 488标记的二抗在室温下孵育1小时,再用PBS进行洗涤。最后,用DAPI(Thermo)对细胞核进行染色。使用奥林巴斯IX83-FV3000共聚焦显微镜对染色切片进行成像。使用ImageJ软件分析图像。
8、Western blotting(WB)分析:细胞和EVs样品用预冷的PBS洗涤后,加入含PMSF的高效裂解液中置于冰上裂解30min,离心取上清后加入5×SDS,混匀后100℃煮沸10min即可上样至SDS-PAGE凝胶电泳分离,恒压条件下先用50V,30min,再调至150V,60min。接着在恒流条件下300mA,70min将蛋白转移到0.45μm的PVDF膜上,在室温下用5%脱脂奶粉进行封闭2h,PBST洗膜后,将膜放抗体孵育盒中,加入相应的一抗溶液在4℃冰箱摇床过夜。次日,将膜取出后用PBST洗4次,每次8min,加入相应的二抗,在室温孵育1h,再用PBST洗4次,每次8min。向PVDF膜上滴加ECL曝光液,Tanon4500化学发光成像分析系统曝光成像。
9、泛素化修饰检测:对于PD-L1蛋白泛素化修饰的检测,我们将处理后的细胞进行收集,预冷的PBS清洗两遍,加入IP蛋白裂解液(含蛋白酶磷酸酶抑制剂和1% SDS(v/v)),置于冰上剧烈震荡、刮擦30min,之后置于100℃水浴中煮沸5min,使蛋白变性,以彻底破坏蛋白之间的相互作用。蛋白冷却后加入10×不含SDS的Co-IP蛋白裂解液,12,000×g离心10min,取5-10%体积的上清液作为Input。将剩余蛋白上清加入PD-L1抗体或等量IgG同型对照放于4℃冰箱中,360°摇床缓慢摇动过夜。次日,在样品中加入protein A/G琼脂糖珠子同样置于4℃摇2h。接着使用预冷的Co-IP蛋白裂解液洗三次,加入2×SDS,于100℃水浴中煮沸5min,随后进行上样,通过WB分析目的蛋白条带。
10、Lable free定量蛋白质组学分析:向样品中加入裂解液(1.5% SDS/100mMTris-Cl),充分混合均匀,进行组织匀浆离心取上清。采用丙酮沉淀法对溶液中的蛋白进行沉淀。向得到的蛋白沉淀中加入复溶液(8M Urea/100mM Tris-Cl)复溶后,加入二硫苏糖醇(DTT)37℃孵育1小时;随后,加入碘乙酷胺(IAA),于室温、暗处进行烷基化反应以封闭疏基。采用Bradford法测定蛋白浓度。蛋白质定量后取50g样本用于SDS-PAGE检测,考马斯亮蓝染色后观察蛋白条带。向还原、烷基化后的样品中加入100mM Tris-HCl溶液,将Urea浓度稀释至2M以下,按照酶与蛋白1:50的质量比加入胰蛋白酶,37℃育振荡过夜进行酶切。第二天加入TFA终止酶切,取上清进行Sep-Pak C18脱盐。抽干后-20℃冻存待用。
质谱数据使用Orbitrap Exploris 480质谱仪串联EASY-nLC 1200液相的液质联用系统进行采集肤段样品经过上样缓冲液溶解,由自动进样器吸入后结合至分析柱(75um*25cm,C18,1.9um,100A)进行分离。利用两人流动相(流动相A:0.1%formic acid和流动相B:0.1%formic acid,80%ACN)建立分析梯度。液相的流速设置为300nL/min。质谱以DDA模式采集数据,每个扫描循环中包含一个MS全扫描(R=60K,AGC=300%,max IT=20ms,scanrange=350-1500m/z),以及随后的20个MS/MS扫描(R=15K,AGC=100%,max IT=auto,cycle time=2s)。HCD碰撞能量设置为30。四级杆的筛选窗口设置为1.6Da。离子重复采集的动态排除时间设置为35s。数据检测和分析由武汉迈特维尔生物科技有限公司提供支持。
11、小鼠MFGE8单克隆抗体生产:通过将免疫兔抗体的可变区和小鼠IgG1抗体的恒定区克隆到pcDNA3.1载体中,产生了抗小鼠MFGE8 IgG1嵌合单克隆抗体(SinoBiological,Beijing,China),并选择克隆RM026作为抑制MFGE8诱导的4T1细胞中UBE4A上调的最有效的单克隆抗体。
12、ChIP-seq:使用ChIP测定试剂盒(Cell Signaling Technology)进行检测,收集来自10cm培养皿的细胞用于ChIP-seq测定。细胞内的蛋白质和DNA在37℃下使用1%甲醛交联10分钟。然后,使用非接触式超声破碎仪(Diagenode)将染色质剪切成片段。剪切过程通常经过25个循环以获得大小在200至500个碱基对范围内的染色质片段。将裂解物孵育并用特异性抗体进行免疫沉淀。分离并纯化与靶蛋白相关的免疫沉淀的DNA片段用于实时PCR。
根据试剂盒的方案,经纯化免疫沉淀的DNA使用RK2055(Abclone)进行测序文库制备。使用HaploX生物技术公司的Illumina Novaseq 6000对DNA文库进行测序。通过PE150测序读取50bp。所有读数都参考小鼠基因组的mm10组装。
实施例1:MFGE8、UBE4A与肿瘤患者预后及anti-PD-1治疗效果
本实施例通过实验研究MFGE8、UBE4A与肿瘤患者预后及anti-PD-1治疗效果的关系。
(1)收集处于不同进展阶段病人的肿瘤组织,免疫组化检测UBE4A的蛋白水平,提取肿瘤组织EVs(TT-EVs),并用ELISA检测EVs上PD-L1含量及肿瘤中MFGE8含量,进行两两相关性分析,并对肿瘤病人分期及预后情况进行分析;
结论:如图1所示,UBE4A和MFGE8呈正相关;如图2所示,UBE4A和MFGE8都与TT-EVs的PD-L1水平呈正相关。同时,如图3所示,我们分析发现UBE4A、MFGE8或TT-EVs上PD-L1水平较低的患者(UBE4A
(2)收集肿瘤病人血清,通过流式半定量法检测血清EVs膜PD-L1水平,ELISA检测血清中MFGE8的表达水平。对血清EVs膜PD-L1水平与MFGE8含量水平进行相关性分选并对肿瘤病人预后进行分析;
结论:如图5所示,与肿瘤组织结果类似,肺癌患者的Circ-MFGE8和Circ-EV上PD-L1水平也呈正相关,并且低水平Circ-MPGE8(Circ-MFGE8
(3)收集采用anti-PD-1治疗的肿瘤患者的外周血,流式半定量检测外周血EVsPD-L1水平,对外周血EVsPD-L1水平与肿瘤病人对免疫治疗的反应性进行分析。
结论:我们发现,对αPD-1治疗敏感的患者其Circ EV PD-L1浓度显著低于对αPD-1治疗不敏感的患者,如图6所示。此外,与高水平Circ EV PD-L1(Circ EV PD-L1
(4)各种组合对肿瘤患者预后及anti-PD-1治疗效果(详见实施例5):
1、MFGE8抗体+PD-1抗体:对多种肿瘤细胞具有良好的抑制作用
2、仅MFGE8抗体:能明显降低肿瘤细胞中UBE4A的表达水平
3、仅PD-1抗体:存在PD-1耐药性,治疗效果差
表明MFGE8抗体能够提高PD-1抗体药物的治疗效果。
实施例2:肿瘤通过促进PD-L1泛素化增加TEVs膜PD-L1水平
本实施例通过实验探究PD-L1泛素化与TEVs膜PD-L1水平的关系。
(1)分别于皮下接种小鼠黑色素瘤细胞B16、小鼠乳腺癌细胞4T1和人乳腺癌细胞MCF7 2、3和4周后,分离肿瘤小鼠的肿瘤组织。通过超速离心方式提取肿瘤组织的EVs,体外检测这些EVs对anti-CD3/anti-CD28刺激的CD8
结论:我们检测到并发现肿瘤进展2周、3周和4周(2-、3-和4-WK)提取的肿瘤组织EVs对CD8
(2)用免疫印迹法检测第4周肿瘤组织消化液刺激的4T1细胞膜表面PD-L1表达水平和总蛋白的水平。免疫荧光检测肿瘤组织消化液是否可以促进4T1细胞中PD-L1和Hrs及CD63阳性多囊泡体的共定位;
结论:我们发现4-WK肿瘤组织的消化上清液(4-WK SN)比2-WK SN刺激细胞后,能诱导EVs上携带更多的PD-L1,如图12所示。然而,两种上清液对MC38细胞上膜表达的PD-L1和总PD-L1水平却没有明显的影响,如图13、图14所示。并且免疫荧光结果证明经过4-WK SN刺激后显著增加了细胞中PD-L1与CD63及Hrs的共定位情况,PD-L1与CD63的共定位如图15所示,PD-L1与Hrs的共定位如图16所示。
(3)免疫印迹检测不同时期肿瘤组织及肿瘤组织消化液刺激的4T1细胞中总的和泛素化的PD-L1的情况。在4T1细胞中过表达泛素或去泛素化酶CNS5,分别促进或抑制PD-L1的泛素化,同时流式检测EVs的膜PD-L1水平。
结论:在2-WK和4-WK的肿瘤组织中PD-L1的泛素化水平逐渐增加,如图17所示。进一步我们发现在4-WK SN处理后的细胞中,PD-L1的泛素化水平也同样显著增加,如图18所示。此外,在4T1细胞中过表达泛素或去泛素化酶CNS5,分别促进或抑制PD-L1的泛素化后,分别如图19、图20所示,EVs膜PD-L1水平也同样有明显增加或被抑制,分别如图21、图22所示。
实施例3:UBE4A作为PD-L1的E3泛素连接酶
本实施例通过实验研究UBE4A作为PD-L1的E3泛素连接酶。
(1)在4T1细胞中过表达已知的E3泛素连接酶Cullin3或β-TrCP,免疫共沉淀检测,同时流式检测4T1EVs的膜PD-L1水平;
结论:已知的E3泛素连接酶Cullin3或β-TrCP能促进PD-L1泛素化,但是不能增加TEVs的PD-L1含量,如图23、图24所示。
(2)免疫沉淀PD-L1,进行质谱分析,找出新的与PD-L1存在互作的E3泛素连接酶,从而筛选出UBE4A。免疫共沉淀进一步确定UBE4A与PD-L1的互作。在4T1细胞中过表达或干扰UBE4A,免疫印迹法检测PD-L1的泛素化水平,并通过体外泛素化实验,进一步明确UBE4A是PD-L1的E3泛素化连接酶。构建赖氨酸位点逐一突变为精氨酸的PD-L1突变体,将突变体和UBE4A同时(分别)转染HEK293细胞,免疫印迹法检测PD-L1的泛素化水平,明确PD-L1的泛素化位点,并通过纯化相应位点突变的PD-L1蛋白,利用体外泛素化实验进一步明确UBE4A介导PD-L1泛素化的赖氨酸位点。
结论:为了鉴定负责PD-L1泛素化和之后EV分选的E3连接酶,通过质谱(MS)分析来自PD-L1过表达的HEK293细胞的与PD-L1相互作用的蛋白质,发现PD-L1下调了3种E3连接酶类,包括UBE3C、UBE4A和MID-1,如图25所示。然后,我们又验证了UBE4A和PD-L1相互作用,如图26所示,并且在过表达UBE4A后也能明显促进4T1细胞泛素化水平,如图27所示。相应的,我们通过干扰Ube4a基因后进行泛素化检测,发现细胞泛素化明显被抑制,如图28所示。这些结果表明UBE4A是PD-L1的E3连接酶。进一步,我们通过同源重组的方法逐一构建赖氨酸位点突变为精氨酸的PD-L1突变体,明确了PD-L1的泛素化位点在K75位点,如图29所示,并通过纯化相应PD-L1突变体蛋白,利用体外泛素化实验进一步明确UBE4A介导PD-L1泛素化的赖氨酸位点为K75位,如图30所示。因此,UBE4A能够作为PD-L1的E3泛素连接酶,且通过促进PD-L1泛素化
实施例4:UBE4A通过增加TEV上PD-L1抑制抗肿瘤免疫
本实施例通过实验研究UBE4A通过增加TEV上PD-L1水平,从而抑制抗肿瘤免疫。
(1)构建UBE4A敲除4T1细胞株(4T1-Ube4a
结论:我们构建了UBE4A敲除的4T1(4T1-Ube4a
(2)小鼠皮下接种4T1及4T1-Ube4a
结论:我们的结果证明4T1 Ube4a
实施例5:肿瘤细胞通过分泌MFGE8促进UBE4A的表达
本实施例通过实验研究肿瘤细胞通过分泌MFGE8促进UBE4A的表达。
(1)提取第2和4周4T1肿瘤组织蛋白,进行Lable free定量蛋白质组学分析,在第4周肿瘤组织中表达上调的基因中,剔除编码膜蛋白和胞浆蛋白的基因,在剩余编码分泌性蛋白基因中,确定哪些基因可能参与UBE4A表达的调控。同时将肿瘤组织裂解上清通过不同分子量的蛋白柱进行区分,并用不同分子量的肿瘤裂解上清刺激肿瘤细胞,观察UBE4A水平变化的情况,从而明确影响UBE4A表达的靶点蛋白分子量。结合分子量范围及测序分析结果,最终明确靶点蛋白。
结论:我们首先确定了这些因子的分子量(MW)范围。我们用100、50和30KD的
(2)制备MFGE8蛋白阻断单克隆抗体(RM026),在野生型小鼠中皮下接种4T1或4T1-Ube4a
结论:为了评估MFGE8阻断是否可以增强抗肿瘤免疫,我们产生了一种抗mMFGE8的兔单克隆抗体,当在4T1荷瘤小鼠中注射RM026,用来中和MFGE8后,肿瘤发展受到显著抑制,如图50所示,伴随着耗竭的CD8
实施例6:MFGE8促进肿瘤细胞表达UBE4A的机制
查阅文献,明确整合素受体下游的信号通路及转录因子,MFGE8蛋白刺激B16或4T1细胞后,观察相关信号通路及转录因子的活化情况,通过ChIP和荧光素酶报告基因实验,检测相应的转录因子与Ube4a启动子结合的情况。
结论:Src家族激酶及其下游Syk的激活是整合素在信号传导中的主要信号转导途径之一。由于用Syk抑制剂R406(MCE)处理的4T1细胞中UBE4A的诱导失败,Syk参与被进一步证实,如图57所示。已有文献报道Syk能介导ERK、JNK、p38、NFAT和NF-κB信号通路的激活。为了确定哪种信号级联参与mMFGE8介导的UBE4A上调,我们进一步应用了一系列抑制剂,发现当加入NF-κB(PDTC)、p38(SB203580)或NFAT抑制剂(11R-VIVIT)时并不能抑制MFGE8诱导的UBE4A蛋白增加,而ERK(U0126)或JNK(SP600125)的抑制剂几乎消除了这一点,如图58所示,这表明ERK和JNK途径对这一过程至关重要。由于ERK和JNK抑制剂都消除了mFGE8诱导的4T1细胞中UBE4A的上调,而组成AP-1转录复合体的c-Fos和c-Jun分别主要被ERK和JNK激活。因此,我们发现AP-1抑制剂T-5224几乎消除了mFGE8诱导的4T1细胞中UBE4A蛋白的增加,如图59所示。然后,我们发现c-Fos或c-Jun沉默显著抑制mFGE8介导的UBE4A上调,如图60所示。染色质免疫沉淀测序(ChIP-seq)揭示了Ube4a启动子中的c-Fos结合峰(-3405至-3673),如图61所示。进一步,qPCR实验证实了c-Fos和c-Jun在4T1细胞中对该序列的结合,其分别被c-Fos或c-Jun沉默所抑制,而mMFGE8刺激增强了两种结合,如图62所示。因此,这些数据表明c-Fos和c-Jun的相互作用在调节Ube4a转录中起重要作用。
缺少本文中所具体公开的任何元件、限制的情况下,可以实现本文所示和所述的发明。所采用的术语和表达法被用作说明的术语而非限制,并且不希望在这些术语和表达法的使用中排除所示和所述的特征或其部分的任何等同物,而且应该认识到各种改型在本发明的范围内都是可行的。因此应该理解,尽管通过各种实施例和可选的特征具体公开了本发明,但是本文所述的概念的修改和变型可以被本领域普通技术人员所采用,并且认为这些修改和变型落入所附权利要求书限定的本发明的范围之内。
本文中所述或记载的文章、专利、专利申请以及所有其他文献和以电子方式可得的信息的内容在某种程度上全文包括在此以作参考,就如同每个单独的出版物被具体和单独指出以作参考一样。申请人保留把来自任何这种文章、专利、专利申请或其他文献的任何及所有材料和信息结合入本申请中的权利。
