一种生物样本中外泌体快速分离和分析的方法及应用
文献发布时间:2024-05-31 01:29:11
技术领域
本发明属于生物标志物纯化分析技术领域,具体涉及一种生物样本中外泌体快速分离和分析的方法及应用。
背景技术
外泌体是由细胞内多泡体与细胞膜融合后,释放到细胞外基质中的膜性囊泡,直径为30-150nm。几乎所有类型的细胞,都可以产生并释放外泌体,被分泌出的外泌体会进入血液、尿液等各种体液中,通过循环系统到达其它细胞与组织,可作为细胞间通讯的重要介质。众多研究表明外泌体是多种疾病的可靠预警生物标志物,可通过液体活检技术用于疾病的分析。因此,外泌体的分离纯化和分析技术成为未来疾病筛查诊断分析的一个重要发展方向。
目前,常见的外泌体分离方法包括超速离心法、聚合物沉淀法、免疫吸附分离法等。然而,复杂的样品处理,昂贵的分析设备和大量的样品需求表明,这些方法存在费时费力、回收率低、成本高以及步骤复杂等缺陷。新兴的方法如表面等离子共振平台、表面增强拉曼光谱、电化学方法、集成微流体平台等可以实现高度富集,但后续的捕获释放方法通常使用高浓度盐或超酸性缓冲液洗脱,或者基于抗体-抗原键的破坏进行释放,极易损坏外泌体形态及结构。另外,在后续的分析中,传统的液质联用法因其复杂的样品预处理方法,且通常需要毫升级别的样品量,对微量样品的小分子的快速高效的分析带来了极大困难。因此,本发明针对现有分离纯化方法易损害外泌体、纯度低以及传统液质联用方法样品预处理复杂、需样品量大的问题,构建了一种外泌体快速分离和分析的策略。
发明内容
针对传统方法分离纯化和分析外泌体存在的问题,本发明提供了一种用于外泌体快速分离和分析的策略:本发明的分离纯化方法是基于富集外泌体的探针进行的,用于外泌体快速富集的探针是5’-COOH-Aptamer1-3’-BHQ1、与Aptamer1的3’端互补配对的5’-6FAM-Strand2以及与Aptamer1的5’端互补配对的Strand3互补配对合成双链,并通过酰胺作用连接在MB-NH
为了达到上述目的,本发明采用如下技术方案:
本发明提供了一种用于外泌体富集的探针,所述探针包括核酸适配体Aptamer1,互补链Strand2和Strand3,其中,所述Aptamer1、Strand2和Strand3互补配对并连接在超顺磁性颗粒表面。
在本发明的一种实施方式中,所述核酸适配体Aptamer1的核苷酸序列如SEQ IDNO.1所示。
在本发明的一种实施方式中,所述核酸适配体Aptamer1的5’端连接羧基,3’端连接淬灭基团。
在本发明的一种实施方式中,所述Strand2的核苷酸序列如SEQ ID NO.2所示。
在本发明的一种实施方式中,所述Strand2的5’端连接荧光基团。
在本发明的一种实施方式中,所述Strand3的核苷酸序列如SEQ ID NO.3所示。
在本发明的一种实施方式中,所述超顺磁性颗粒包括氨基磁珠(MB-NH
在本发明的一种实施方式中,所述淬灭基团选自TAMRA、ECLIPSE、DABCYL、BHQ1或BHQ2。
在本发明的一种实施方式中,所述荧光基团选自FAM、FITC、CY5、TET、VIC、JOE或HEX。
所述Aptamer1的序列如下所示:
5’-COOH-AAATTTTTTTTTTTTAAACACCCCACCTCGCTCCCGTGACACTAATG-BHQ1-3’。
所述Strand2与Aptamer1的3’端的部分互补,序列如下所示:
5’-6FAM-CATTAGTGTCA-3’。
所述Strand3与Aptamer1的5’端的部分互补,序列如下所示;
5’-AAAAAAAAAAAA-3’。
本发明提供了一种制备所述探针的方法,具体步骤如下:
(1)将核酸适配体Aptamer1、Strand2、Strand3按照等物质的量混合,然后加入至盐溶液混匀后经热处理,获得Aptamer1/Strand2/Strand3溶液;
(2)稀释步骤(1)合成的Aptamer1/Strand2/Strand3溶液,随后加入NHS溶液和EDC溶液,混合振荡,获得活化后的Aptamer1/Strand2/Strand3溶液;
(3)将超顺磁性颗粒与步骤(2)活化的后Aptamer1/Strand2/Strand3溶液混合,孵育,然后磁分离弃上清,用超纯水洗涤沉淀并重新分散在超纯水中,制备获得探针;
在本发明的一种实施方式中,步骤(1)中,所述盐溶液包括NaCl100mM,MgCl
在本发明的一种实施方式中,步骤(1)中,所述热处理的程序为95℃10min,30℃30min,4℃20min。
在本发明的一种实施方式中,所述超顺磁性颗粒包括氨基磁珠(MB-NH
本发明提供了一种快速富集外泌体的方法,所述方法为利用上述探针富集外泌体,外泌体特异性结合至探针表面。
在本发明的一种实施方式中,所述方法为将上述探针与含有外泌体的样品溶液混合孵育。
在本发明的一种实施方式中,所述外泌体为体液中的外泌体;优选的,所述外泌体为尿液外泌体、血液外泌体或脑脊液外泌体中的一种。
在本发明的一种实施方式中,所述混合孵育为在室温下孵育60min以上。
本发明提供了一种分离纯化外泌体的方法,所述方法为利用上述探针富集外泌体,获得表面结合有外泌体的探针,磁分离弃去上清,洗涤并重悬,加入内切酶,混合孵育,从探针表面释放外泌体,磁分离,收集上清,获得外泌体。
在本发明的一种实施方式中,加入内切酶后于35~38℃孵育20~40min。
在本发明的一种实施方式中,所述内切酶为具有切割DNA双链功能活性的酶。
在本发明的一种实施方式中,所述内切酶包括dsDNaseⅠ或Nt.AlwI。
本发明还提供了所述探针或所述制备探针的方法在制备外泌体富集或外泌体分离纯化产品中的应用。
在本发明的一种实施方式中,所述产品包括试剂或试剂盒。
在本发明的一种实施方式中,所述试剂盒中还含有内切酶。
在本发明的一种实施方式中,所述内切酶为具有切割DNA双链功能活性的酶。
在本发明的一种实施方式中,所述内切酶包括dsDNaseⅠ或Nt.AlwI。
有益效果:
本发明将互补配对的Aptamer1/Strand2/Strand3通过酰胺作用连接在MB-NH
本发明方法利用适配体识别并富集外泌体具有灵敏度高、亲和力强的特点,并通过荧光可实现外泌体定量,灵敏度高,操作简便,无需对待测样本进行复杂的前处理;利用酶切方法释放外泌体条件温和,可以保证外泌体的完整性。
本发明适用于人体体液中外泌体的分离纯化,比如尿液外泌体、血液外泌体、脑脊液外泌体等各种体液中的外泌体,速度快、效率高,具有很好的实用性。
本发明借助内切酶进行外泌体的温和释放,且释放分离率可达91.83%,对比传统外泌体分离方法具有一定的优越性。
本发明方法不仅可以实现外泌体的分离纯化,且联合MALDI-TOF质谱或电喷雾电离质谱技术可以实现成分快速分析,样品前处理简单,所需样品量少,有利于疾病的筛查诊断。
附图说明
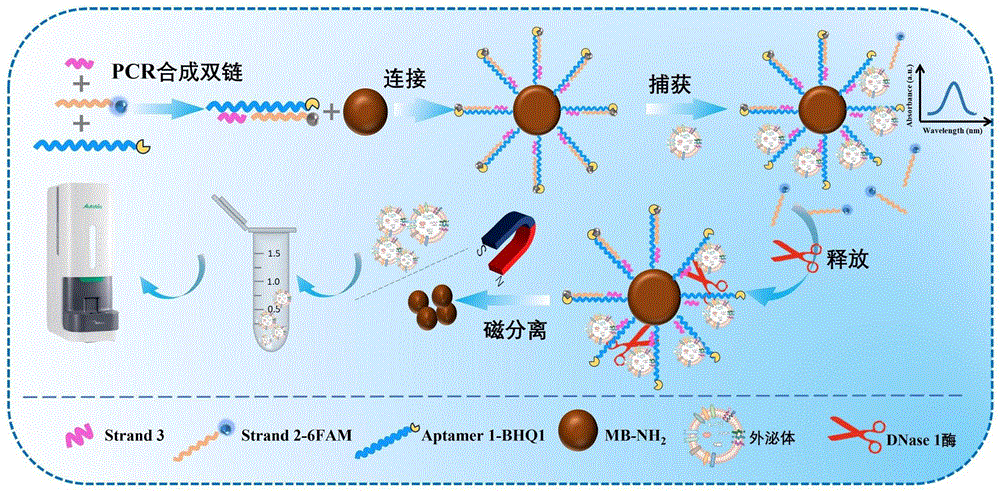
图1是本发明方法的外泌体快速分离纯化及分析的原理示意图;
图2是探针的合成验证电泳图;
图3是外泌体富集时间优化图;
图4是释放的外泌体电镜图;
图5是不同核酸序列捕获外泌体的荧光测定图;
图6是不同浓度外泌体的富集标准曲线图;
图7是外泌体富集量与释放量的对比柱形图;
图8是实际应用中检测外泌体的荧光光谱图。
具体实施方式
在本发明中所使用的术语,除非另有说明,一般具有本领域普通技术人员通常理解的含义。
下面结合具体实施例,并参照数据进一步详细的描述本发明,以下实施例只是为了举例说明本发明,而非以任何方式限制本发明的范围。
本发明用于外泌体分离纯化和分析的工作原理:
参照图1,首先合成Aptamer1/Strand2/Strand3互补序列,此时Strand2的5’端6FAM荧光基团被Aptamer1的3’端BHQ1淬灭基团所淬灭,然后将Aptamer1的5’端COOH活化,将其通过酰胺作用附着在MB-NH
实施例1制备快速富集外泌体的探针
5’-COOH-Aptamer1-3’-BHQ1、与Aptamer1的3’端互补配对的5’-6FAM-Strand2以及与Aptamer1的5’端互补配对的Strand3进行PCR形成双链,并通过酰胺作用连接在MB-NH
Aptamer1为外泌体表面CD63蛋白的特异性核酸,序列如SEQ ID NO.1所示,下划线部分为与Strand2互补的部分,字体倾斜部分为与Strand3互补的部分:
5’-COOH-AAATTTTTTTTTTTTAAACACCCCACCTCGCTCCCGT
Strand2为Aptamer1的3’端的部分互补序列如SEQ ID NO.2所示:
5’-6FAM-CATTAGTGTCA-3’。
Strand3为Aptamer1的5’端的部分互补序列如SEQ ID NO.3所示:
5’-AAAAAAAAAAAA-3’。
上述用于外泌体快速富集的探针的制备方法,步骤如下:
(1)首先将合成的SEQ ID NO.1~3所示的核酸序列粉末进行8000rpm,5min离心,然后加入超纯水配制成10μM的溶液,分别取等体积的Aptamer1(10μM)、Strand2(10μM)、Strand3(10μM)于PCR管中,即按照等物质的量混合,然后按照总体积比10:1的比例加入pH8.0的配对盐溶液(NaCl100mM,MgCl
(2)将步骤(1)制备的Aptamer1/Strand2/Strand3溶液用超纯水稀释为2.5μM,取400μL,2.5μM的Aptamer1/Strand2/Strand3溶液加入3μL100μg/mL的NHS(上海麦克林生化有限公司)和3μL100μg/mL的EDC(SIGMA-ALORICH),混合振荡30min,用于Aptamer1的5’端COOH的活化;
(3)将洗涤后的400μgMB-NH
实施例2应用探针快速分离纯化外泌体
一种用于外泌体的快速分离纯化的探针的使用方法,步骤如下:
(1)富集并测定外泌体的含量
取400μL实施例1制备的用于外泌体快速富集的探针磁分离弃上清,并将其加入到200μL含有外泌体的溶液中,混匀后于室温下轻轻振荡60min(如图3所示,最佳孵育时间为60min),外泌体表面的CD63蛋白会因高亲和力与Aptamer1特异性结合,实现外泌体富集,同时原先互补在适配体上的Strand2会被竞争下来,且Strand2的5’端修饰的6FAM荧光基团会因远离Aptamer1的3’端修饰的BHQ1荧光淬灭基团而显现出绿色荧光,通过测定6FAM的绿色荧光可判断富集的外泌体含量。
(2)酶切释放外泌体
上述探针富集外泌体后,磁分离弃上清,用超纯水洗涤3次,并重悬于200μL超纯水中,加入2μL的dsDNaseⅠ酶,混匀后于37℃孵育30min,使Strand3与Aptamer1的5’端互补配对序列被dsDNaseⅠ酶切割,从而将捕获到的外泌体从探针表面释放出来,然后磁分离留上清即为分离出的外泌体溶液,实现了外泌体的释放。如图4所示,对比超速离心法(左图)易损害外泌体形态,本发明方法获得的外泌体形态良好,证明本发明方法对外泌体形态无损害。经纳米颗粒跟踪分析仪测定,结果如表1所示,对比超速离心法,本发明方法富集的外泌体数量更多,纯度更高。本发明提供的方法可以获得高纯度无损伤的外泌体以及对外泌体数量的精准定量。
实施例3灵敏度富集
配制10
实验组别设置如下:
(1)实验组:使用Aptamer1制备的探针根据实施例2的方法进行外泌体富集。
(2)对照组1~3:实验方法同实验组,区别在于使用不同的核酸适配体,不同对照组采用的核酸适配体如下表1,与核酸适配体的3’端的部分互补序列也相应地进行调整;
表1对照组1~3采用的核酸适配体
结果如图5可知,本发明所选用的Aptamer1在外泌体富集中释放的荧光强度最高,证明其富集外泌体效果最好。
分别配制10,10
实施例4酶切释放率测定
利用实施例2的酶切释放方法将实施例3中探针捕获到的外泌体进行酶切释放,对将探针捕获到的4.3×10
实施例5联合MALDI-TOF质谱或电喷雾电离质谱实现外泌体成分快速分析
(1)对实施例4纯化的外泌体采用MALDI-TOF质谱进行分析:以50%乙腈、49.9%水、0.1%三氟乙酸配制基质溶液(20mg/mL),取1μL实施例4中分离得到的外泌体溶液点在MALDI钢板上,在室温条件下干燥,然后滴加1μL基质溶液,室温干燥后,采用正线性模式进行MALDI-TOF质谱分析。设置参数为:激光强度70%,激光衰减器偏移量35%,距离40%,激光累计500次,探测器增益10.3倍,延迟提取时间150ns。使用细胞色素c(2mg/mL)和肌红蛋白(2mg/mL)的标准校准混合物进行外部质量校准。相比传统的液质联用分析方法的样品预处理方法复杂,且需要毫升级别的样品量,MALDI-TOF质谱具有所需样品量少、预处理简单、速度快、灵敏度较高等优势。
(2)对实施例4纯化的外泌体采用电喷雾电离质谱技术进行分析:取上述纯化到的20μL外泌体溶液于进样瓶中,设置质谱上样量为2μL,电压设置为1.75-2kV。质谱质量范围50-500m/z,最大离子注入时间100ms,微扫描时间:3μs,二级质谱碰撞气体为氦气,最优碰撞诱导解离能(CID)为25-30%。毛细管尖端至质谱入口约8mm,进行外泌体成分分析。相比传统的液质联用分析方法的样品预处理方法复杂,且需要毫升级别的样品量,电喷雾电离质谱技术具有所需样品量少、步骤简单、基质效应弱、分辨率较高等优势。
实施例6外泌体分离纯化应用
取400μL实施例1合成的用于外泌体快速分离纯化的探针磁分离弃上清,与含有外泌体的尿液进行混合,并于室温下轻轻振荡60min,这时5’端带有FAM荧光基团的Strand2会被外泌体竞争下来远离Aptamer1的3’端的BHQ1荧光淬灭基团产生荧光恢复,磁分离测定上清荧光,荧光光谱图如图8所示,通过将荧光值带入标准方程计算得该方法富集到的外泌体为7.2×10
对比超速离心和沉淀法,本发明方法可以得到更加纯化的外泌体溶液;现有研究中磁珠捕获后的释放方法得到的外泌体释放率一般为60-80%,本发明方法可达91.83%,酶切方法显著提高了释放率。
以含有4.6×10
表2超速离心法和本发明方法富集外泌体及其它未知粒子的数量对比。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
- 一种用于捕获血液中外泌体的磁性纳米颗粒的制备方法及其应用
- 一种外泌体分离制备方法
- 生物样品中外泌体分离方法、试剂盒及其应用
- 生物样品中外泌体和细胞的捕获分离装置及捕获分离方法
