非免疫抑制性抗原特异性免疫治疗剂的重复施用
文献发布时间:2023-06-19 11:24:21
本申请是申请号为201480031689.2的中国专利申请的分案申请,原申请是2014年6月4日提交的PCT国际申请PCT/US2014/040938于2015年12月2日进入中国国家阶段的申请。
相关申请
本申请依据35U.S.C.§119要求于2013年6月4日提交的美国临时申请61/831,128的权益,其全部内容通过引用并入本文。
技术领域
本发明涉及使用不诱导免疫抑制的方案(protocol)或其要素(element)重复施用抗原特异性免疫治疗剂。在一些实施方案中,所述方案已先前表明在重复施用后不在对象中诱导免疫抑制。
背景技术
需要蛋白质或酶替代治疗的某些疾病或病症(例如自身免疫病、变态反应或遗传性或获得性缺陷)以及需要生物学治疗的疾病经常引起不期望的免疫应答。此类不期望的免疫应答可通过使用免疫调节剂药物来降低。然而,常规的免疫调节剂药物作用广泛。另外,为了维持免疫抑制,免疫调节剂药物治疗一般是终生问题议题。不幸的是,作用广泛的免疫调节剂的使用与严重副作用的风险相关,所述副作用例如肿瘤、感染、肾毒性和代谢紊乱。因此,新的免疫调节剂治疗将是有益的。
发明内容
在一个方面,提供了一种方法,其包括确定在对象中不引起免疫抑制的用于重复施用抗原特异性免疫治疗剂的方案;以及使用所述方案的一个或更多个要素向另一对象重复施用所述抗原特异性免疫治疗剂。
在另一个方面中,提供了一种方法,其包括确定在对象中不引起免疫抑制的用于重复施用抗原特异性免疫治疗剂的方案,其中所述确定包括向对象重复施用抗原特异性免疫治疗剂。
在另一个方面,一种方法,其包括向对象重复施用包含抗原或免疫调节剂的抗原特异性免疫治疗剂,其中根据在重复施用所述抗原或免疫调节剂后不诱导免疫抑制的方案的一个或更多个要素重复施用所述抗原或免疫调节剂。
在所提供之任一种方法的一个实施方案中,所述方法还包括获得或提供抗原特异性免疫治疗剂。在本文中所提供之任一种方法的另一个实施方案中,所述确定还包括证明所述方案的一个或更多个要素在对象中引起抗原特异性耐受。
在另一个方面,提供了包含抗原特异性免疫治疗剂的组合物,所述抗原特异性免疫治疗剂以先前已在方案中证明在重复施用后不诱导免疫抑制的量包含外源性抗原或外源性免疫调节剂。在本文中所提供之任一种方法的一个实施方案中,所述组合物为药盒(kit)。
在所提供之任一种方法的一个实施方案中,所述抗原特异性免疫治疗剂是如本文中所提供之抗原特异性免疫治疗剂中的任一种。
在本文中所提供之任一种方法或组合物的另一个实施方案中,所述方案是先前已表明不诱导免疫抑制的方案。
在本文中所提供之任一种方法或组合物的另一个实施方案中,所述抗原或免疫调节剂以还表明引起抗原特异性耐受的量存在。
在本文中所提供之任一种方法或组合物的另一个实施方案中,抗原特异性免疫治疗剂包含外源性免疫调节剂。在本文中所提供之任一种方法或组合物的另一个实施方案中,所述外源性免疫调节剂包含:他汀类、mTOR抑制剂、TGF-β信号传导剂(TGF-βsignalingagent)、TGF-β受体激动剂、组蛋白去乙酰化酶抑制剂、皮质类固醇、线粒体功能的抑制剂、P38抑制剂、NF-κβ抑制剂、凝集素受体配体、腺苷受体激动剂、前列腺素E2激动剂、磷酸二酯酶抑制剂、蛋白酶体抑制剂、激酶抑制剂、G蛋白偶联受体激动剂、G蛋白偶联受体拮抗剂、糖皮质激素、类视黄醇、细胞因子抑制剂、细胞因子受体抑制剂、细胞因子受体激活剂、过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor)拮抗剂、过氧化物酶体增殖物激活受体激动剂、组蛋白去乙酰化酶抑制剂、钙调神经磷酸酶抑制剂(calcineurin inhibitor)、磷酸酶抑制剂、氧化的ATP、IDO、维生素D3、环孢素A、芳香烃受体抑制剂、白藜芦醇、硫唑嘌呤、6-巯基嘌呤、阿司匹林、尼氟灭酸(niflumic acid)、雌三醇、雷公藤内酯(tripolide)、白介素、环孢素A或靶向细胞因子或细胞因子受体的siRNA。在本文中所提供之任一种方法或组合物的另一个实施方案中,所述外源性免疫调节剂包含雷帕霉素、麦考酚酸(mycophenolic aicd)或CD22配体。
在本文中所提供之任一种方法或组合物的另一个实施方案中,抗原特异性免疫治疗剂包含外源性抗原。
在本文中所提供之任一种方法或组合物的另一个实施方案中,当抗原特异性免疫治疗剂还包含外源性免疫调节剂时,外源性抗原与外源性免疫调节剂不互相偶联。在本文中所提供之任一种方法或组合物的另一个实施方案中,重复施用包括外源性抗原和外源性免疫调节剂的伴随重复施用。
在本文中所提供之任一种方法或组合物的另一个实施方案中,外源性抗原包含治疗性蛋白质、经修饰的抗原或表达的抗原。在本文中所提供之任一种方法或组合物的另一个实施方案中,表达的抗原由经修饰的信使RNA表达。
在本文中所提供之任一种方法或组合物的另一个实施方案中,抗原特异性免疫治疗剂引起针对内源性抗原的抗原特异性耐受。
在本文中所提供之任一种方法或组合物的另一个实施方案中,内源性抗原包含自身抗原(autoantigen)。
在本文中所提供之任一种方法或组合物的另一个实施方案中,自身抗原包含见于以下中的那些:强直性脊柱炎、大疱性类天疱疮(bulous pemiphigous)、类风湿关节炎、多发性硬化、糖尿病、湿疹、炎性肠病、狼疮或系统性红斑狼疮、多发性硬化、原发性胆汁性肝硬化、银屑病、结节病、系统性硬化、硬皮病、甲状腺炎、自身免疫性甲状腺疾病、桥本甲状腺炎(Hashimoto′s thyroiditis)、甲状腺毒症、斑秃、格雷夫斯病(Grave’s disease)、吉-巴综合征(Guillain-Barré syndrome)、乳糜泻、舍格伦综合征(
在本文中所提供之任一种方法或组合物的另一个实施方案中,抗原特异性免疫治疗剂包含外源性抗原,并且当在内源性免疫调节剂存在下施用时引起抗原特异性耐受。
在本文中所提供之任一种方法或组合物的另一个实施方案中,内源性免疫调节剂包含参与凋亡或相关信号传导的物质和/或物质的组合、参与T细胞生物学或B细胞生物学的物质和/或物质的组合、或参与树突细胞生物学的物质和/或物质的组合。
在本文中所提供之任一种方法或组合物的另一个实施方案中,重复施用发生在抗原特异性免疫治疗剂的初次剂量或先前的重复施用后1周至10年。在本文中所提供之任一种方法或组合物的另一个实施方案中,重复施用发生在抗原特异性免疫治疗剂的初次剂量或先前的重复施用后1周。在本文中所提供之任一种方法或组合物的另一个实施方案中,重复施用发生抗原特异性免疫治疗剂的初次剂量或先前的重复施用后2周。在本文中所提供之任一种方法或组合物的另一个实施方案中,重复施用发生在抗原特异性免疫治疗剂的初次剂量或先前的重复施用后1至12个月。
在本文中所提供之任一种方法或组合物的另一个实施方案中,抗原特异性免疫治疗剂包含外源性抗原和外源性免疫调节剂,通过不同于外源性免疫调节剂的途径重复施用外源性抗原。在本文中所提供之任一种方法或组合物的另一个实施方案中,重复施用包括伴随重复施用。
在本文中所提供之任一种方法或组合物的另一个实施方案中,抗原特异性免疫治疗剂包含多于一种的外源性抗原。
在本文中所提供之任一种方法或组合物的另一个实施方案中,当抗原特异性免疫治疗剂包含外源性抗原和外源性免疫调节剂时,外源性抗原通过不同于外源性免疫调节剂的途径重复施用。在本文中所提供之任一种方法或组合物的另一个实施方案中,重复施用包括伴随重复施用。
在本文中所提供之任一种方法或组合物的另一个实施方案中,外源性抗原与外源性免疫调节剂互相偶联。在本文中所提供之任一种方法或组合物的另一个实施方案中,外源性免疫调节剂包含ERY1肽。
在本文中所提供之任一种方法或组合物的另一个实施方案中,使用所述方案的所有或基本上所有要素向另一对象重复施用抗原特异性免疫治疗剂。
在本文中所提供之任一种方法或组合物的另一个实施方案中,抗原特异性免疫治疗剂包含与外源性免疫调节剂连接的聚合物合成纳米载体。
在本文中所提供之任一种方法或组合物的另一个实施方案中,基于所有聚合物合成纳米载体的平均值,与聚合物合成纳米载体连接之免疫调节剂的载量为0.1%至50%(重量/重量)。在本文中所提供之任一种方法或组合物的另一个实施方案中,所述载量为0.1%至20%(重量/重量)。
在本文中所提供之任一种方法或组合物的另一个实施方案中,外源性免疫调节剂的平均免疫调节剂载量为至少95%、97%、98%或99%(重量/重量)。
在本文中所提供之任一种方法或组合物的另一个实施方案中,当抗原特异性免疫治疗剂包含外源性免疫调节剂和外源性抗原时,聚合物合成纳米载体还与外源性抗原偶联。在本文中所提供之任一种方法或组合物的另一个实施方案中,当抗原特异性免疫治疗剂包含外源性免疫调节剂和外源性抗原时,聚合物合成纳米载体与外源性抗原伴随施用。
在另一个方面,提供了制备本文中所提供之任一种抗原特异性免疫治疗剂的方法。在一个实施方案中,所述方法包括以重复施用后不诱导免疫抑制的量产生或获得外源性抗原或外源性免疫调节剂。在所提供之任一种方法的另一个实施方案中,所述量为先前在方案中证明在重复施用后不诱导免疫抑制的量。在所提供之任一种方法的另一个实施方案中,所述方法还包括确定所述量或所述方案。
在另一个方面,提供了包含外源性免疫调节剂或外源性抗原的抗原特异性免疫治疗剂,其用于制备用于在对象中获得抗原特异性耐受但不诱导免疫抑制的药物。
在另一个方面,提供了用于在对象中获得抗原特异性耐受但不诱导免疫抑制的包含外源性免疫调节剂或外源性抗原的抗原特异性免疫治疗剂。在一个实施方案中,抗原特异性免疫治疗剂用于本文中所提供的任一种方法。
在本文中所提供之任一种方法或组合物的另一个实施方案中,抗原特异性免疫治疗剂是本文中所提供的任一种抗原特异性免疫治疗剂。
附图说明
图1示出了重复施用包含抗原和雷帕霉素的抗原特异性免疫治疗剂的结果。
图2示出了重复施用包含甲氨蝶呤、外源性免疫调节剂的抗原特异性免疫治疗剂的结果。
图3示出了重复施用包含甲氨蝶呤、外源性免疫调节剂的抗原特异性免疫治疗剂的结果。
图4示出在与外源性免疫调节剂(ERY1肽)连接的外源性抗原(OVA)存在下,CD8
具体实施方式
在对本发明进行详细描述之前,应当理解,本发明不限于具体举例说明的材料或工艺参数,因为其当然可以变化。还应理解的是,本文中使用的术语仅是出于对本发明的一些具体实施方案进行描述的目的,并非旨在对描述本发明的替代术语的使用进行限制。
出于所有目的,本文中引用的所有出版物、专利和专利申请(无论上文或下文)均在此通过引用整体并入。
除非所述内容另有明确指出,否则本说明书及所附权利要求书中使用的没有数量词修饰的名词表示一个/种或更多个/种。例如,提及的“聚合物”包括两种或更多种此类分子的混合物或不同分子量的单一聚合物种类的混合物,提及的“合成纳米载体”包括两种或更多种此类合成纳米载体的混合物或多种此类合成纳米载体,提及的“DNA分子”包括两种或更多种此类DNA分子的混合物或多种此类DNA分子,提及的“免疫调节剂”包括两种或更多种此类材料的混合物或多种免疫调节剂分子等。
本文中使用的术语“包含/包括”或其变化形式应理解为指包括引用的任何整体(例如特点、要素、特征、特性、方法/处理步骤或限制)或整体(例如特点、要素、特征、特性、方法/处理步骤或限制)的组,但不排除任何其他整体或整体的组。因此,本文中使用的术语“包含/包括”是包括性的并且不排除另外的未引用整体或方法/处理步骤。
在本文中提供任何组合物和方法的一些实施方案中,可用“基本由...组成”或“由...组成”来替代“包含/包括”。本文中使用的短语“基本由...组成”要求指定的整体或步骤以及不显著影响要求保护之发明的特征或功能的那些。本文中使用的术语“由...组成”仅用于指所引用的整体(例如特点、要素、特征、特性、方法/处理步骤或限制)或整体(例如特点、要素、特征、特性、方法/处理步骤或限制)的组的存在。
A.引言
如先前提到的,当前常规的免疫调节性组合物作用广泛并且通常导致免疫系统的整体系统性下调。本文中所提供的组合物和方法允许更有针对性的免疫效果,特别是当所述的抗原特异性免疫治疗剂用于重复施用时。特别关注重复施用期间的广泛免疫抑制,因为其通常会引起长期的免疫抑制,这种长期的免疫抑制可对接受重复施用常规免疫调节性组合物的对象造成显著的不良事件。相反,本发明人已经发现可提供在重复施用期间不引起长期或广泛免疫抑制的抗原特异性免疫调节性组合物和方法。
本发明人已出乎意料和意外地发现上述的问题和限制可以通过实施本文中所公开的本发明来克服。特别地,本发明人已意外地发现有可提供这样的方法,其包括确定在对象中不引起免疫抑制的用于重复施用抗原特异性免疫治疗剂的方案;以及使用所述方案的一个或更多个要素向另一对象重复施用所述抗原特异性免疫治疗剂。此外,本发明人已意外地发现可提供这样的方法,其包括:向对象重复施用包含抗原或免疫调节剂的抗原特异性免疫治疗剂,其中根据在重复施用抗原或免疫调节剂后不诱导免疫抑制的方案的一个或更多个要素重复施用所述抗原或免疫调节剂。在一些实施方案中,所述方案是先前已表明不在对象中诱导免疫抑制的方案。此外,本发明人已出人意料地发现可提供这样的组合物,其包含:含有当重复施用后不诱导免疫抑制的量的外源性抗原或外源性免疫调节剂的抗原特异性免疫治疗剂。在一些实施方案中,所述量为先前已在方案中证明在重复施用后在对象中不诱导免疫抑制的量。
本文中(例如在实施例中)公开了本发明的多种其他实施方案和方面,包括不同类型的抗原特异性免疫治疗剂、不同类型的外源性和内源性抗原以及不同类型的外源性和内源性免疫调节剂。
现在将在下文中对本发明进行更详细的描述。
B.定义
“施用”意指以在药理学上可用的方式向对象提供物质。在一些实施方案中,该术语旨在包括“引起施用”。“引起施用”意指直接或间接地引起、促使、鼓励、帮助、诱导或指导另一方施用物质。
在用于向对象施用的组合物、剂型或方法的情况中,“先前在方案中证明在重复施用后不诱导免疫抑制的量”是指当按照先前证明显示不诱导免疫抑制的方案施用时在重复施用后不诱导免疫抑制的抗原或免疫调节剂的量。
当然,有效量将取决于所治疗的具体对象;病症、疾病或紊乱的严重程度;个体患者的参数,包括年龄、身体状况、身材和体重;治疗的持续时间;同时治疗(如果有的话)的性质;具体的施用途径以及在健康从业者的知识和经验范围内的类似因素。这些因素是本领域普通技术人员所公知的并且可仅用常规实验就可解决。一般优选使用最大剂量,即根据合理医疗判断的最高安全剂量。然而,本领域普通技术人员将理解,患者可由于医学原因、心理原因或实际上任何其他原因而坚持使用较低剂量或可耐受剂量。
在某些实施方案,本发明组合物中免疫调节剂和/或抗原的剂量或量可以是约10μg/kg至约100,000μg/kg。在一些实施方案中,所述剂量可以是约0.1mg/kg至约100mg/kg。在其他实施方案中,所述剂量可以是约0.1mg/kg至约25mg/kg、约25mg/kg至约50mg/kg、约50mg/kg至约75mg/kg或约75mg/kg至约100mg/kg。或者,可基于合成纳米载体的数量来施用所述剂量或量,所述纳米载体提供期望量的免疫调节剂和/或抗原。例如,有用剂量或量包括大于10
“抗原”是指B细胞抗原或T细胞抗原。“抗原类型”是指共有相同或基本上相同的抗原性特征的分子。在一些实施方案中,抗原可以为蛋白质、多肽、肽、脂蛋白、糖脂、多核苷酸、多糖或者包含在细胞中或由细胞表达。在一些实施方案中,例如当抗原未经充分定义或表征时,抗原可包含在细胞或组织制备物、细胞碎片、细胞外来体、条件化培养基等中。在一些实施方案中,抗原可以是内源性的或外源性的。内源性抗原包括由对象自身产生的抗原,并且与抗原特异性免疫治疗剂(例如包含外源性免疫调节剂的抗原特异性免疫治疗剂)一起通过本文中提供的重复施用后可产生可导致抗原特异性耐受的免疫应答。在一些实施方案中,在重复施用如本文中所提供的外源性免疫调节剂下,内源性抗原引起抗原特异性耐受。内源性抗原的实例包括自身免疫性抗原,其中的一些在本文的其他部分公开。外源性抗原包括作为抗原特异性免疫治疗剂的一部分或作为一些其他治疗性干预的一部分被施用但不是由对象自身产生的抗原。外源性抗原的实例包括环境变应原、治疗性蛋白质或多肽等,其中的一些在本文的其他部分公开。
“抗原特异性的”指由于抗原或其一部分的存在而产生的任何免疫应答或产生特异性识别或结合抗原之分子的任何免疫应答。例如,当免疫应答是抗原特异性抗体的产生时,产生与所述抗原特异性结合的抗体。作为另一个实例,当免疫应答是抗原特异性B细胞或CD4+T细胞或CD8+T细胞的活化、增殖和/或活性时,所述活化、增殖和/或活性产生于抗原或其一部分单独或与MHC分子、B细胞等复合的识别。
“抗原特异性免疫治疗剂”是指能够对对象之针对目标抗原的免疫应答具有致耐受性作用的治疗剂。抗原特异性免疫治疗剂可包含抗原或免疫调节剂。在某些实施方案中,抗原特异性免疫治疗剂可包含抗原和免疫调节剂两者,其中抗原与免疫调节剂偶联或未偶联。在某些实施方案中,抗原特异性免疫治疗剂可包含不互相偶联的抗原和免疫调节剂,并且抗原和免疫调节剂伴随地重复施用。在这样的一些实施方案中,抗原和免疫调节剂可以在相同的组合物中或作为单独的成分被施用,并且包含抗原或免疫调节剂的组合物的整体构成了抗原特异性免疫治疗剂。在一些实施方案中,包含抗原(即外源性抗原)和/或免疫调节剂(即外源性免疫调节剂)的抗原特异性免疫治疗剂可分别与内源性免疫调节剂和/或内源性抗原相互作用,以优选地引起或导致可引起抗原特异性耐受的免疫应答。
“抗原特异性免疫治疗剂效力”意指,对于目标抗原(Agi)而言,在相同Agi剂量下,Agi IgG效价(报道为EC50)由阳性对照的水平变化为至少50%以下的效价(报道为EC50)。一般参见J.R.Crowther,“ELISA:Theory and Practice”(1995Humana出版社)。
除非另有指出,否则本文中使用的术语“平均值”指算术平均值。
“B细胞抗原”是指在B细胞中被识别并引起免疫应答的任何抗原(例如,被B细胞或其上的受体特异性识别的抗原)。在一些实施方案中,抗原是T细胞抗原,同时也是B细胞抗原。在其他的实施方案中,T细胞抗原不同时是B细胞抗原。B细胞抗原包括但不限于蛋白质、肽等。在一些实施方案中,B细胞抗原包括非蛋白质抗原(即,不是蛋白质抗原或肽抗原)。
“引起”是指使作用直接或间接(例如通过第三方)发生。在一些实施方案中,本发明包括使用方案的一个或更多个要素向另一对象重复施用抗原特异性免疫治疗剂。
当应用于两种或更多种材料和/或药剂(在本文中也称为组分)时,“组合”旨在对其中两种或更多种材料/药剂相缔合的材料进行定义。可将组分单独标识,例如第一组分、第二组分、第三组分等。在该情况下的术语“组合的”和“组合”可作相应解释。
两种或更多种材料/药剂以组合相缔合可以是物理的或非物理的。物理缔合的组合材料/药剂的实例包括:
·包含混合的两种或更多种材料/药剂(例如在同一单位剂量内)的组合物(例如单一制剂);
·包含其中两种或更多种材料/药剂经化学/物理化学连接(例如通过交联、分子聚集或与常见的载剂部分结合)的材料的组合物;
·包含其中两种或更多种材料/药剂经化学/物理化学共包装(例如,布置在脂囊泡、颗粒(例如微米颗粒或纳米颗粒)或乳剂微滴之上或之中)的材料的组合物;
·其中两种或更多种材料/药剂经共包装或共存在(作为一组单位剂量的一部分)的药盒、药物组合产品或患者组合产品;
经非物理缔合的组合材料/药剂的实例包括:
·包含两种或更多种材料/药剂中的至少一种的材料(例如非单一制剂),附带有用于使该至少一种化合物/药剂临时缔合以形成这两种或更多种材料/药剂的物理缔合的说明书;
·包含两种或更多种材料/药剂中的至少一种的材料(例如非单一制剂),附带有用于使用这两种或更多种材料/药剂进行联合治疗的说明书;
·包含两种或更多种材料/药剂中的至少一种的材料,附带有用于向患者群施用的说明书,其中已施用(或正在施用)两种或更多种材料
/药剂中的其他材料/药剂;
·以特异性地适合与两种或更多种材料/药剂中的其他材料/药剂组合使用的量或形式包含这两种或更多种材料/药剂中的至少一种的材料。
本文中使用的术语“联合治疗”旨在对治疗进行定义,其包括使用两种或更多种材料/药剂的组合(如本文所定义的)。因此,本申请中提及的材料/药剂的“联合治疗”、“组合”和“组合”使用可以指作为同一总治疗方案的一部分施用的材料/药剂。因此,两种或更多种材料/药剂各自的剂量学可有所不同:每一种可在相同的时间或不同的时间施用。因此,应当理解,可依次(例如之前或之后)或同时(在同一药物制剂(即一起)中或者在不同药物制剂(即独立地)中)施用组合中的材料/药剂。在同一制剂中时,同时是作为单一制剂;而在不同药物制剂中时,同时为非单一的。两种或更多种材料/药剂各自在联合治疗中的剂量学在施用途径方面也可有所不同。
“伴随”意指将两种或更多种材料/药剂以时间上相关、优选时间上足够相关以提供对免疫应答之调节的方式施用于对象,并且甚至更优选地将两种或更多种材料/药剂组合施用。在一些实施方案中,伴随施用可包括在指定时间内,优选在1个月内,更优选在1周内,仍更优选在1天内并且甚至更优选在1小时内施用两种或更多种材料/药剂。在一些实施方案中,可重复地伴随施用所述材料/药剂;即不止一次进行伴随施用。
“偶联”意指使一个实体(例如一部分)与另一个实体在化学上相缔合。在一些实施方案中,偶联是共价的,这意味着偶联在两个实体之间存在共价键的情况下发生。在非共价的一些实施方案中,非共价偶联是通过非共价相互作用介导的,所述非共价相互作用包括但不限于:电荷相互作用、亲和性相互作用、金属配位、物理吸附、主体-客体相互作用、疏水相互作用、TT堆积相互作用、氢键相互作用、范德华相互作用、磁相互作用、静电相互作用、偶极-偶极相互作用和/或其组合。在一些实施方案中,包封是偶联的一种形式。
“确定”或“证明”是指确定实际关系。这些术语意指在一个或更多个输入(例如方案的要素或整个方案)和一个或更多个输出(例如存在或不存在免疫抑制或实现抗原特异性耐受)之间建立联系。在一些实施方案中,本发明包括确定用于重复施用抗原特异性免疫治疗剂而不在对象中引起免疫抑制的方案的一个或更多个要素。
确定等可以通过许多方式来实现,包括但不限于进行实验或作出预测。例如,可以如下确定方案的一个或更多个要素(例如免疫调节剂的剂量):以测试方案的一个或更多个要素(例如测试剂量)开始并使用已知的缩放技术(例如异速缩放(allometric scaling)或等速缩放(isometric scaling))来确定方案(例如施用剂量)。在另一个实施方案中,方案的一个或更多个要素(例如剂量)可以通过在对象中测试一个或更多个要素(例如不同的剂量)的变化来确定,例如通过以经验和指导数据为基础进行直接实验。在一些实施方案中,“确定”或“证明”包括“引起确定”或“引起证明”。“引起确定”或“引起证明”意指引起、促使、鼓励、帮助、诱导或指导实体确知实际关系或者与实体协同作用以使其确知实际关系;包括直接或间接地,或者明确或隐含地。
“剂型”意指在适合向对象施用的介质、载体、载剂或装置中的药理学和/或免疫学活性材料。本文中提供的任一种组合物或剂量可以是剂型。
“包封”意指将至少一部分物质封装在合成纳米载体内。在一些实施方案中,将物质全部封装在合成纳米载体内。在另一些实施方案中,大部分或全部的经包封物质不暴露于合成载体外部的局部环境。在另一些实施方案中,不超过50%、40%、30%、20%、10%或5%(重量/重量)暴露于局部环境。包封与吸附不同,吸附将大部分或全部的物质置于合成载体的表面上并使物质暴露于合成载体外部的局部环境。
“免疫调节剂”是指引起APC(Antigen Presenting Cell,抗原呈递细胞)具有致耐受性作用的化合物或化合物的组合。致耐受性作用一般是指通过APC或APC的基因表达谱的改变(例如共刺激分子表达的改变)产生或表达降低、抑制或预防不期望的抗原特异性免疫应答或促进所期望的抗原特异性致耐受性免疫应答的细胞因子或其他因子。在一些实施方案中,免疫调节剂可以是内源性的或外源性的。内源性免疫调节剂包括由对象自身产生的免疫调节剂,并且用如本文中所提供的抗原特异性免疫治疗剂(例如包含外源性抗原的抗原特异性免疫治疗剂)重复施用后可以引起可导致抗原特异性耐受的免疫应答。在一些实施方案中,当施用如本文中所提供的外源性抗原时,内源性免疫调节剂可以导致抗原特异性耐受性。内源性免疫调节剂的实例包括凋亡细胞和其他凋亡的配体或标记物、致耐受性细胞因子(例如IL-10)以及参与致耐受性应答的细胞表面标记物(例如CD22)。外源性免疫调节剂包括作为抗原特异性免疫治疗剂的一部分或一些其他治疗性干预的一部分被施用但不是由对象自身产生的免疫调节剂。外源性免疫调节剂的实例包括雷帕霉素和本文中公开的其他免疫调节剂。
在一个实施方案中,免疫调节剂引起APC促进一个或更多个免疫效应细胞中的调节性表型。例如,调节性表型的特征可在于:抑制抗原特异性CD4+ T细胞或B细胞的产生、诱导、刺激或募集,抑制抗原特异性抗体的产生,Treg细胞(例如CD4+CD25高FoxP3+ Treg细胞)的产生、诱导、刺激或募集等。这可以是CD4+ T细胞或B细胞转化成调节性表型的结果。这也可以是其他免疫细胞(例如CD8+ T细胞、巨噬细胞和iNKT细胞)中诱导FoxP3的结果。在一个实施方案中,免疫调节剂在其对抗原进行加工之后影响APC的应答。在另一个实施方案中,免疫调节剂不干涉对抗原的加工。在另一个实施方案中,免疫调节剂不是凋亡信号传导分子。在另一个实施方案中,免疫调节剂不是磷脂。
免疫抑制剂包括但不限于:他汀类;mTOR抑制剂,例如雷帕霉素或雷帕霉素类似物;TGF-β信号传导剂;TGF-β受体激动剂;组蛋白去乙酰化酶抑制剂,例如曲古抑菌素A;皮质类固醇;线粒体功能的抑制剂,例如鱼藤酮;P38抑制剂;NF-κB抑制剂,例如6Bio、地塞米松、TCPA-1、IKK VII;腺苷受体激动剂;前列腺素E2激动剂(prostaglandin E2 agonist,PGE2),例如美索前列醇;磷酸二酯酶抑制剂,例如磷酸二酯酶4抑制剂(phosphodiesterase4 inhibitor,PDE4),例如咯利普兰;蛋白酶体抑制剂;激酶抑制剂;G蛋白偶联受体激动剂;G蛋白偶联受体拮抗剂;糖皮质激素;类视黄醇;细胞因子抑制剂;细胞因子受体抑制剂;细胞因子受体激活剂;过氧化物酶体增殖物激活受体拮抗剂;过氧化物酶体增殖物激活受体激动剂;组蛋白去乙酰化酶抑制剂;钙调神经磷酸酶抑制剂;磷酸酶抑制剂;PI3KB抑制剂,例如TGX-221;自噬抑制剂,例如3-甲基腺嘌呤;芳基烃受体抑制剂;蛋白酶体抑制剂I(proteasome inhibitor I,PSI);以及氧化的ATP,例如P2X受体阻断剂。免疫调节剂还包括:IDO、维生素D3、环孢素(例如环孢素A)、芳基烃受体抑制剂、白藜芦醇、硫唑嘌呤(azathiopurine,Aza)、6-巯基嘌呤(6-mercaptopurine,6-MP)、6-硫鸟嘌呤(6-thioguanine,6-TG)、FK506、萨菲菌素A(sanglifehrin A)、沙美特罗、吗替麦考酚酯(mycophenolate mofetil,MMF)、阿司匹林以及其他COX抑制剂、尼氟灭酸、雌三醇和雷公藤内酯。在一些实施方案中,免疫调节剂可包含本文中提供的药剂中的任何一种。
免疫调节剂可以是对APC直接提供致耐受性作用的化合物或者其可以是间接提供致耐受性作用的化合物(即,在于施用后以某种方式进行加工之后)。因此,免疫调节剂包括本文中提供的任何化合物的前药形式。
免疫调节剂还包括本文中所提供的编码引起致耐受性免疫应答的肽、多肽或蛋白质的核酸。因此,在一些实施方案中,所述免疫调节剂是编码引起致耐受性免疫应答的肽、多肽或蛋白质的核酸,并且其为与合成纳米载体偶联的核酸。
核酸可以是DNA或RNA,例如mRNA。在一些实施方案中,本发明的组合物包含补体,例如全长补体或本文中所提供的任何核酸的简并物(由于遗传密码的简并性)。在一些实施方案中,核酸是当转染到细胞系中时可以转录的表达载体。在一些实施方案中,除了其他之外,表达载体还可以包括质粒。核酸可以使用标准的分子生物学方法来分离或合成,例如通过使用聚合酶链式反应来产生核酸片段,然后将其纯化并克隆到表达载体中。用于实施本发明的其他技术可见于:John Wiley and Sons,Inc,Current Protocols in MolecularBiology 2007;Molecular Cloning:A Laboratory Manual(第三版)Joseph Sambrook,Peter MacCallum Cancer Institute,Melbourne,Australia;David Russell,University0f Texas Southwestern Medical Center,Dallas,Cold Spring Harbor。
在一些实施方案中,本文中所提供的免疫调节剂与合成纳米载体偶联。在一些优选的实施方案中,免疫调节剂是除构成合成纳米载体之结构的材料之外的组分。例如,在一个实施方案中,当合成纳米载体由一种或更多种聚合物构成时,免疫调节剂为除所述一种或更多种聚合物之外并与其偶联的化合物。作为另一个实例,在一个实施方案中,当合成纳米载体由一种或更多种脂质构成时,免疫调节剂仍为除所述一种或更多种脂质之外并与其偶联的化合物。在一些实施方案中,例如当合成纳米载体的材料也导致致耐受性作用时,免疫调节剂为除合成纳米载体的材料之外存在的引起致耐受性作用的组分。
其他示例性的免疫调节剂包括但不限于:小分子药物、天然产物、抗体(例如,针对CD20、CD3、CD4的抗体)、基于生物制品的药物、基于碳水化合物的药物、纳米颗粒、脂质体、RNAi、反义核酸、适配体、甲氨蝶呤、NSAID、芬戈莫德、那他珠单抗、阿仑单抗、抗-CD3、他克莫司(FK506)等。另一些免疫调节剂是本领域技术人员已知的并且本发明在此方面不受限制。
在本文中提供的任一种方法或组合物的一些实施方案中,免疫调节剂是如纳米结晶形式的形式,由此免疫调节剂的形式本身是颗粒或颗粒样。在一些实施方案中,这样的形式模拟病毒或其他外来病原体。很多药物是已被纳米化的并且本领域普通技术人员知道用于产生这样的药物形式的合适方法。药物纳米晶体(例如纳米结晶雷帕霉素)是本领域普通技术人员已知的(Katteboinaa,等2009,International Journal of PharmTechResesarch;第1卷,第3期;第682至694页)。本文中使用的“药物纳米晶体”指不包含载体或基质材料的药物(例如免疫调节剂)的形式。在一些实施方案中,药物纳米晶体包含90%、95%、98%或99%或更多药物。用于产生药物纳米晶体的方法包括但不限于:研磨、高压均质化、沉淀、喷雾干燥、超临界溶液的迅速膨胀(rapid expansion of supercriticalsolution,RESS)、
“免疫抑制”意指(1)由重复施用抗原特异性免疫治疗剂引起的免疫应答的非持久的统计学显著的下调,或(2)在至少一次地重复施用抗原特异性免疫治疗剂之后,非人测试对象对KLH攻击T细胞依赖性抗体应答ELISA测定的应答,假设KLH不是目标抗原,其中所述应答的特征为:在相同KLH剂量下,KLH IgG效价(报道为EC50)从阳性对照的水平变化为等于或小于平均阴性对照(“背景”)之上3个标准偏差的效价(报道为EC50)。一般参见J.R.Crowther,“ELISA:Theory and Practice”(1995,Humana出版社)。在一个优选的实施方案中,非持久的统计学显著下调意指,所述下调的统计学显著差异(针对非治疗组测量的治疗组)在最后一次重复施用抗原特异性免疫治疗剂之后不显示超过一周。多种本发明的组合物、方法、方案和剂型不产生或不诱导免疫抑制。
KLH攻击ELISA测定在文献例如J.T.Brisbin等,
测量抗KLH抗体效价的ELISA方法(例如典型的夹心ELISA法)可以由以下步骤组成:(i)制备ELISA板包被材料使得目标抗体靶标与底物聚合物或其他合适的材料偶联;(ii)在水溶液(例如PBS)中制备包被材料,并将包被材料溶液递送至多孔板的孔以使包被物过夜沉积到多孔板上;(iii)用洗涤缓冲液(例如PBS中0.05%Tween-20)彻底洗涤多孔板以除去过量的包被材料;(iv)通过施用稀释剂溶液(例如PBS中10%胎牛血清)封闭板的非特异性结合;(v)用洗涤缓冲液从板中洗涤封闭/稀释剂溶液;(vi)如有需要,用稀释剂稀释包含抗体的血清样品和合适标准物(阳性对照)以获得适当地使ELISA响应饱和的浓度;(vii)在多孔板上对血浆样品进行连续稀释以覆盖适合产生ELISA响应曲线的浓度范围;(viii)孵育所述板以提供抗体靶标结合;(ix)用洗涤缓冲液洗涤所述板以除去未与抗原结合的抗体;(x)添加在相同稀释剂的合适浓度的二级检测抗体,例如能够结合一抗的生物素偶联的检测抗体;(xi)孵育具有施用的检测抗体的板,接着用洗涤缓冲液洗涤;(xii)添加将与生物素化抗体上存在的生物素结合的酶(例如链霉亲和素-HRP(辣根过氧化物酶))并孵育;(xiii)洗涤所述多孔板;(xiv)向所述板中添加底物(例如TMB溶液);(xv)当显色完成时添加终止溶液(例如2N硫酸);(xvi)在底物的特定波长下读取板孔的光密度(450nm下的读数减去570nm下的读数);(xvi)对数据应用合适的多参数曲线拟合并定义半最大有效浓度(EC50)为曲线上达到板标准物的最大OD值的一半的浓度。
“载量”是外源性免疫调节剂组合物的免疫调节剂的量(重量/重量)。例如,当与合成纳米载体连接时,载量是基于整个合成纳米载体中材料的总干配方重量(重量/重量)。通常来说,将这样的载量计算为整个合成纳米载体群的平均值。在一个实施方案中,基于所有合成纳米载体的平均值的载量为0.1%至99%。在另一个实施方案中,所述载量为0.1%至50%。在另一个实施方案中,免疫调节剂的载量为0.1%至20%。在另一个实施方案中,基于整个合成纳米载体群的平均值,免疫调节剂的载量不超过25%。在一些实施方案中,可如实施例中所述或者如本领域中另外已知的那样计算载量。
作为另一个实例,当免疫抑制剂的形式本身是颗粒或颗粒样(例如纳米结晶免疫调节剂)时,免疫调节剂的载量为颗粒等中免疫调节剂的量(重量/重量)。在这样的一些实施方案中,载量可接近90%、95%、97%、98%、99%或更多。
“合成纳米载体的最大尺寸”意指沿合成纳米载体之任意轴测量的该纳米载体的最大尺寸。“合成纳米载体的最小尺寸”意指沿合成纳米载体之任意轴测量的该合成纳米载体的最小尺寸。例如,对于球形合成纳米载体,合成纳米载体的最大尺寸和最小尺寸基本上相同并且是其直径的尺寸。类似地,对于立方形合成纳米载体,合成纳米载体的最小尺寸是其高度、宽度或长度中的最小者,而合成纳米载体的最大尺寸是其高度、宽度或长度中的最大者。在一个实施方案中,基于样品中合成纳米载体的总数,该样品中至少75%,优选至少80%,更优选至少90%的合成纳米载体的最小尺寸等于或大于100nm。在一个实施方案中,基于样品中合成纳米载体的总数,该样品中至少75%,优选至少80%,更优选至少90%的合成纳米载体的最大尺寸等于或小于5μm。优选地,基于样品中合成纳米载体的总数,该样品中至少75%,优选至少80%,更优选至少90%的合成纳米载体的最小尺寸大于110nm,更优选大于120nm,更优选大于130nm,并且更优选还大于150nm。发明的合成纳米载体的最大尺寸和最小尺寸的纵横比(aspect ratio)可根据实施方案而不同。例如,合成纳米载体的最大尺寸:最小尺寸的纵横比可为1∶1至1,000,000∶1,优选1∶1至100,000∶1,更优选1∶1至10,000∶1,更优选1∶1至1000∶1,仍更优选1∶1至100∶1并且还更优选1∶1至10∶1。优选地,基于样品中合成纳米载体的总数,该样品中至少75%,优选至少80%,更优选至少90%的合成纳米载体的最大尺寸等于或小于3μm,更优选等于或小于2μm,更优选等于或小于1μm,更优选等于或小于800nm,更优选等于或小于600nm,并且更优选还等于或小于500nm。在一些优选的实施方案中,基于样品中合成纳米载体的总数,该样品中至少75%,优选至少80%,更优选至少90%的合成纳米载体的最小尺寸等于或大于100nm,更优选地等于或大于120nm,更优选等于或大于130nm,更优选等于或大于140nm,并且更优选还等于或大于150nm。按如下获得合成纳米载体尺寸(例如直径)的测量:使合成纳米载体混悬于液体介质(通常为水性介质)中并使用动态光散射(dynamic light scattering,DLS)(例如使用BrookhavenZetaPALS仪器)。例如,可将合成纳米载体的混悬液从水性缓冲液稀释到纯水中以获得约0.01mg/mL至0.1mg/mL的最终合成纳米载体混悬液浓度。可在用于DLS分析的合适比色皿内直接制备经稀释的混悬液或者可将经稀释的混悬液转移至用于DLS分析的合适比色皿。然后,可将比色皿放置在DLS中,允许平衡至受控温度,随后基于针对介质之黏度和样品之折射指数的合适输入,扫描足够的时间以获取稳定且可重现的分布。然后,报道有效直径或分布的平均值。确定高纵横比或非球形合成纳米载体的有效尺寸可需要放大技术例如电子显微术以获得更准确的测量。合成纳米载体的“尺寸”或“大小”或“直径”意指例如使用动态光散射获得的颗粒大小分布的平均值。
“可药用赋形剂”或“可药用载体”意指与药理学活性材料一起使用以配制组合物的药理学惰性材料。可药用赋形剂包括本领域中已知的多种材料,包括但不限于:糖类(例如葡萄糖、乳糖等)、防腐剂(例如抗微生物剂)、重构助剂(reconstitution aid)、着色剂、盐水(例如磷酸盐缓冲溶液)和缓冲剂。
“方案”意指向对象重复施用抗原特异性免疫治疗剂的模式。方案由要素构成,因此方案包含一个或更多个要素。方案的所述要素可包括给药量、给药频率、施用途径、给药持续时间、给药速率、给药间隔、上述任一项的组合等。在一些实施方案中,方案可用于向一个或更多个测试对象施用本发明的一种或更多种组合物。然后,可对这些测试对象中的免疫应答进行评估以确定该方案是否有效地产生期望的免疫学效果或者期望的免疫学效果水平。可先前在测试对象(例如非人对象)中证明一个或更多个要素,随后将其转化成人的方案。例如,可使用公认的技术(异速缩放或其他缩放方法)将在非人对象中证明的给药量缩放为人方案的要素。不管方案是否具有期望的效果,其均可使用本领域中提供的或本领域中另外已知的任何方法确定。例如,细胞群可获自已经根据特定方案向其重复施用本文中提供的所述组合物和/或抗原特异性免疫治疗剂的对象以确定特定的免疫细胞、细胞因子、抗体等是否得以降低、产生、激活等。可用于检测免疫细胞的存在和/或数量的方法包括但不限于:流式细胞术法(例如FACS)和免疫组织化学法。用于对免疫细胞标志物进行特异性染色的抗体及其他结合剂均是市售可得的。这样的试剂盒通常包含针对多种抗原的染色试剂,其允许从异质细胞群对期望的细胞群进行基于FACS的检测、分离和/或量化。在一些实施方案中,使用所述方案包含的全部或基本全部要素向另一对象重复施用抗原特异性免疫治疗剂。
“先前显示重复施用后不诱导免疫抑制的方案”是指这样的方案,其中这种方案的一个或更多个要素(直至并包括整个方案)在先前的时间被证明在重复施用期间中至少一个点,优选在整个重复施用期间不诱导免疫抑制。
“提供”意指个体进行的供给用于实施本发明的所需项目或项目组或方法的行为或行为集合。所述行为或行为集合可以自身直接或间接采取。
“提供对象”为这样的任何行为或行为集合,其引起临床医生与对象接触并向其施用本文中提供的组合物或者对其进行本文中提供的方法。优选地,所述对象需要如本文中所提供的致耐受性免疫应答。所述行为或行为集合可以是自身直接地或间接地。在本文中提供的任一种方法的一个实施方案中,所述方法还包括提供对象。
“重复施用”意指加强或延长先前建立的免疫耐受的持久性。在当建立的耐受性正在下降或处于下降的风险之中的时候,这些实施方案通常涉及一次施用或短期处理。重复施用开始于在施用初次抗原特异性免疫治疗剂剂量之后施用的下一个或多个抗原特异性免疫治疗剂剂量。所施用的初始的抗原特异性免疫治疗剂可以与重复施用期间施用的抗原特异性免疫治疗剂相同或不同(在组成、剂量等方面)。通常在抗原特异性免疫治疗剂的初始剂量或先前的重复施用后2周至1年,并且优选1至6个月进行加强。本发明还包括涉及定期重复施用的实施方案,其根据每半周一次、每周一次、每两周一次地发生的施用方案或根据任何其他的定期方案。
“对象”意指动物,包括温血哺乳动物,例如人和灵长类动物;禽类;驯养的家养或农场动物,例如猫、狗、绵羊、山羊、牛、马和猪;实验室动物,例如小鼠、大鼠和豚鼠;鱼类;爬行动物;动物园动物和野生动物;等。
“合成纳米载体”意指不存在于自然界中并且至少一个维度的尺寸小于或等于5微米的离散对象。白蛋白纳米颗粒一般作为合成纳米载体包括在内,然而在某些实施方案中,合成纳米载体不包括白蛋白纳米颗粒。在一些实施方案中,本发明的合成纳米载体不包含壳聚糖。在另一些实施方案中,本发明的合成纳米载体不是基于脂质的纳米颗粒。在另一些实施方案中,本发明的合成纳米载体不包含磷脂。
合成纳米载体可以是,但不限于以下中的一种或更多种:基于脂质的纳米颗粒(在本文中也称为脂质纳米颗粒,即,构成其结构的大部分材料为脂质的纳米颗粒)、聚合物纳米颗粒、金属纳米颗粒、基于表面活性剂的乳剂、树状聚体、巴基球、纳米线、病毒样颗粒(即,主要由非感染性或具有低感染性的病毒结构蛋白构成的颗粒)或者基于肽或蛋白质的颗粒(在本文中也称为蛋白质颗粒,即,构成其结构的大部分材料是肽或蛋白质的颗粒)(例如白蛋白纳米颗粒)和/或使用纳米材料之组合开发的纳米颗粒(例如脂质-聚合物纳米颗粒)。合成纳米载体可以是多种不同的形状,包括但不限于:球形、立方形、棱锥形、长方形、圆柱形、环形等。根据本发明的合成纳米载体包含一个或更多个表面。可用于实施本发明的示例性合成纳米载体包括:(1)Gref等的美国专利5,543,158中公开的生物可降解纳米颗粒,(2)Saltzman等的公开的美国专利申请20060002852中公开的聚合物纳米颗粒,(3)DeSimone等的公开的美国专利申请20090028910中以平版印刷方式构建的纳米颗粒,(4)von Andrian等的WO 2009/051837的公开内容,(5)Penades等的公开的美国专利申请2008/0145441中公开的纳米颗粒,(6)de los Rios等的公开的美国专利申请20090226525中公开的蛋白质纳米颗粒,(7)Sebbel等的公开的美国专利申请20060222652中公开的病毒样颗粒,(8)Bachmann等的公开的美国专利申请20060251677中公开的经核酸偶联的病毒样颗粒,(9)WO2010047839A1或WO2009106999A2中公开的病毒样颗粒,(10)P.Paolicelli等,“Surface-modified PLGA-based Nanoparticles that can Efficiently Associate andDeliver Virus-like Particles”Nanomedicine.5(6):843-853(2010)中公开的经纳米沉淀的纳米颗粒,(11)美国公开2002/0086049中公开的凋亡细胞、凋亡体或者合成或半合成模拟物,或者(12)Look等,“Nanogel-based delivery of mycophenolic acidameliorates systemic lupus erythematosus in mice”J.Clinical Investigation.123(4):1741-1749(2013)中的那些。在一些实施方案中,合成纳米载体的纵横比可大于1∶1、1∶1.2、1∶1.5、1∶2、1∶3、1∶5、1∶7,或大于1∶10。
最小尺寸等于或小于约100nm、优选等于或小于100nm之根据本发明的合成纳米载体不包含具有激活补体之羟基的表面,或者作为替代地包含基本由不是激活补体之羟基的部分组成的表面。在一个优选的实施方案中,最小尺寸等于或小于约100nm、优选等于或小于100nm之根据本发明的合成纳米载体不包含显著激活补体的表面,或者作为替代地包含基本由不显著激活补体的部分组成的表面。在一个更优选的实施方案中,最小尺寸等于或小于约100nm、优选等于或小于100nm之根据本发明的合成纳米载体不包含激活补体的表面,或者作为替代地包含基本由不激活补体的部分组成的表面。在一些实施方案中,合成纳米载体不包括病毒样颗粒。在一些实施方案中,合成纳米载体的纵横比可大于1∶1、1∶1.2、1∶1.5、1∶2、1∶3、1∶5、1∶7或大于1∶10。
“T细胞抗原”意指CD4+T细胞抗原或CD8+细胞抗原。“CD4+T细胞抗原”意指被CD4+T细胞识别并且在CD4+T细胞中引起免疫应答的任何抗原,例如通过呈递与II类主要组织相容性复合物分子(major histocompatability complex molecule,MHC)结合的抗原或其一部分而被CD4+T细胞上的T细胞受体特异性识别的抗原。“CD8+T细胞抗原”意指被CD8+T细胞被识别并在CD8+T细胞中引起免疫应答的任何抗原,例如通过呈递与I类主要组织相容性复合物分子(MHC)结合的抗原或其一部分而被CD8+T细胞上的T细胞受体特异性识别的抗原。在一些实施方案中,抗原是T细胞抗原同时也是B细胞抗原。在另一些实施方案中,T细胞抗原并非同时是B细胞抗原。T细胞抗原通常是蛋白质或肽。
“治疗性蛋白质”指可向对象施用并且具有治疗效果的任何蛋白质或基于蛋白质的治疗。这样的治疗包括蛋白质替代治疗或蛋白质补充治疗。这样的治疗还包括施用外源或外来蛋白质、抗体治疗和细胞治疗或基于细胞的治疗。治疗性蛋白质包括酶、酶辅因子、激素、凝血因子、细胞因子、生长因子、单克隆抗体和多克隆抗体。本文中的其他部分还提供了其他治疗性蛋白质的实例。治疗性蛋白质可在细胞中产生、在细胞上产生或者由细胞产生,并且可从这样的细胞获得或者以这样的细胞的形式施用。在一些实施方案中,治疗性蛋白质在哺乳动物细胞、昆虫细胞、酵母细胞、细菌细胞、植物细胞、转基因动物细胞、转基因植物细胞等中产生、在其上产生或者由其产生。治疗性蛋白质可在这样的细胞中重组产生。治疗性蛋白质在自体细胞中产生、在其上产生或者由其产生,所述自体细胞已被转染、转导或以其他方式操纵表达出来。或者,治疗性蛋白质可以作为核酸或通过向脂质体等中引入核酸而施用。或者,治疗性蛋白质可以从这种形式获得并作为所述治疗性蛋白质自身施用。因此,对象包括已经接受、正在接受或将要接受前述任何治疗性蛋白质的任何对象。
“不期望的免疫应答”指这样的任何不期望免疫应答,其由暴露于抗原引起、促进或加重本文中提供疾病、紊乱或病症(或其症状),或者是本文中提供的疾病、紊乱或病症的症状。这样的免疫应答一般对对象的健康具有不良影响或者是对对象之健康的不良影响的症状。不期望的免疫应答包括抗原特异性抗体的产生、抗原特异性B细胞增殖和/或活性或者抗原特异性CD4+T细胞增殖和/或活性。
C.本发明的组合物
合成纳米载体
在一些实施方案中,抗原特异性免疫治疗剂包含含有免疫调节剂和/或抗原的合成纳米载体组合物及相关方法。
根据本发明,可使用多种合成纳米载体。在一些实施方案中,合成纳米载体为球体或球状体。在一些实施方案中,合成纳米载体是平的或板状的。在一些实施方案中,合成纳米载体为立方体物或者是立方体的。在一些实施方案中,合成纳米载体为卵形或椭圆形。在一些实施方案中,合成纳米载体为圆柱体、圆锥体或棱锥体。
在一些实施方案中,期望使用在尺寸、形状和/组成方面相对均一的合成纳米载体群,使得每个合成纳米载体具有类似的特性。例如,基于合成纳米载体的总数,至少80%、至少90%或至少95%的合成纳米载体的最大尺寸或最小尺寸可落入合成纳米载体之平均直径或平均尺寸的5%、10%或20%内。
合成纳米载体可以是实心的或中空的并且可包含一个或更多个层。在一些实施方案中,相对于其他层,每个层具有独特的组成和独特的特性。仅为了给出一个实例,合成纳米载体可具有芯/壳结构,其中芯为一个层(例如聚合物芯)而壳为第二层(例如脂质双层或单层)。合成纳米载体可包含多个不同的层。
在一些实施方案中,合成纳米载体可任选地包含一种或更多种脂质。在一些实施方案中,合成纳米载体可包含脂质体。在一些实施方案中,合成纳米载体可包括脂质双层。在一些实施方案中,合成纳米载体可包含脂质单层。在一些实施方案中,合成纳米载体可包括胶束。在一些实施方案中,合成纳米载体可包含由脂质层(例如脂质双层、脂质单层等)包围的包含聚合物基质的芯。在一些实施方案中,合成纳米载体可包含由脂质层(例如脂质双层、脂质单层等)包围的非聚合物芯(例如金属颗粒、量子点、陶瓷颗粒、骨颗粒、病毒颗粒、蛋白质、核酸、碳水化合物等)。
在另一些实施方案中,合成纳米载体可以包含金属颗粒、量子点、陶瓷颗粒等。在一些实施方案中,非聚合物合成纳米载体是非聚合物组分的聚集体,例如金属原子(例如金原子)的聚集体。
在一些实施方案中,合成纳米载体可任选地包含一种或更多种两亲性实体。在一些实施方案中,两亲性实体可促进产生稳定性提高、均匀性提高或黏度提高的合成纳米载体。在一些实施方案中,两亲性实体可与脂质膜(例如,脂质双层、脂质单层等)的内表面相缔合。本领域中已知的很多两亲性实体均适用于制备根据本发明的合成纳米载体。这样的两亲性实体包括但不限于:磷酸甘油酯;磷脂酰胆碱;二棕榈酰磷脂酰胆碱(DPPC);二油烯基磷脂酰乙醇胺(DOPE);二油烯氧基丙基三乙铵(DOTMA);二油酰磷脂酰胆碱;胆固醇;胆固醇酯;二酰甘油;琥珀酸二酰甘油酯;二磷脂酰甘油(DPPG);十六烷醇(hexanedecanol);脂肪醇,例如聚乙二醇(PEG);聚氧乙烯-9-月桂基醚;表面活性脂肪酸,例如棕榈酸或油酸;脂肪酸;脂肪酸单甘油酯;脂肪酸二甘油酯;脂肪酸酰胺;去水山梨糖醇三油酸酯
在一些实施方案中,合成纳米载体可任选地包含一种或更多种碳水化合物。碳水化合物可以是天然的或合成的。碳水化合物可以是衍生化的天然碳水化合物。在某些实施方案中,碳水化合物包含单糖或二糖,包括但不限于:葡萄糖、果糖、半乳糖、核糖、乳糖、蔗糖、麦芽糖、海藻糖、纤维二糖、甘露糖、木糖、阿拉伯糖、葡萄糖醛酸、半乳糖醛酸、甘露糖醛酸、葡糖胺、半乳糖胺和神经氨酸。在某些实施方案中,碳水化合物是多糖,包括但不限于:普鲁兰多糖、纤维素、微晶纤维素、羟丙基甲基纤维素(HPMC)、羟基纤维素(HC)、甲基纤维素(MC)、葡聚糖、环葡聚糖、糖原、羟乙基淀粉、角叉菜胶、糖苷配糖基(glycon)、直链淀粉、壳聚糖、N,O-羧甲基壳聚糖、藻胶和藻酸、淀粉、甲壳质、菊粉、魔芋、葡甘露聚糖、石耳素(pustulan)、肝素、透明质酸、凝胶多糖(curdlan)和黄原胶。在一些实施方案中,本发明的合成纳米载体不包含(或者特别排除)碳水化合物,例如多糖。在某些实施方案中,碳水化合物可以包括碳水化合物的衍生物,例如糖醇,包括但不限于:甘露醇、山梨醇、木糖醇、赤藓醇、麦芽糖醇和乳糖醇。
在一些实施方案中,合成纳米载体可包含一种或更多种聚合物。在一些实施方案中,合成纳米载体包含一种或更多种这样的聚合物,所述聚合物为非甲氧基封端的普朗尼克(pluronic)聚合物。在一些实施方案中,构成合成纳米载体的至少1%、2%、3%、4%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、97%或99%(重量/重量)聚合物为非甲氧基封端的普朗尼克聚合物。在一些实施方案中,构成合成纳米载体的所有聚合物均为非甲氧基封端的普朗尼克聚合物。在一些实施方案中,合成纳米载体包含一种或更多种这样的聚合物,其为非甲氧基封端的聚合物。在一些实施方案中,构成合成纳米载体的至少1%、2%、3%、4%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、97%或99%(重量/重量)聚合物为非甲氧基封端的聚合物。在一些实施方案中,构成合成纳米载体的所有聚合物均为非甲氧基封端的聚合物。在一些实施方案中,合成纳米载体包含一种或更多种不含普朗尼克聚合物的聚合物。在一些实施方案中,构成合成纳米载体的至少1%、2%、3%、4%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、97%或99%(重量/重量)聚合物不包含普朗尼克聚合物。在一些实施方案中,构成合成纳米载体的所有聚合物均不包含普朗尼克聚合物。在一些实施方案中,这样的聚合物可由包被层(例如,脂质体、脂质单层、胶束等)包围。在一些实施方案中,合成纳米载体中的多种成分可与聚合物偶联。
可通过多种方法中的任一种来使免疫调节剂和/或抗原与合成纳米载体偶联。一般来说,偶联可以是免疫调节剂和/或抗原与合成纳米载体之间键合的结果。这种键合可导致免疫调节剂和/或抗原与合成纳米载体的表面连接和/或包含(包封)在合成纳米载体中。然而,在一些实施方案中,由于合成纳米载体的结构,免疫调节剂和/或抗原被合成纳米载体包封而不是与合成纳米载体键合。在一些优选的实施方案中,合成纳米载体包含本文中提供的聚合物,并且免疫调节剂和/或抗原与聚合物偶联。
当由于免疫调节剂和/或抗原与合成纳米载体之间的键合而发生偶联时,所述偶联可经由偶联部分发生。偶联部分可以是通过其免疫调节剂和/或抗原与合成纳米载体键合的任何部分。这样的部分包括共价键(例如酰胺键或酯键)以及使免疫调节剂和/或抗原与合成纳米载体(共价或非共价)键合的独立分子。这样的分子包括接头或聚合物或其单元。例如,偶联部分可包含与免疫调节剂和/或抗原静电结合的带电聚合物。作为另一个实例,偶联部分可包含与免疫调节剂和/或抗原共价键合的聚合物或其单元。
在一些优选的实施方案中,合成纳米载体包含本文中提供的聚合物。这些合成纳米载体可以是完全聚合物的或者其可以是聚合物和其他材料的混合物。
在一些实施方案中,合成纳米载体中的聚合物缔合以形成聚合物基质。在这些实施方案中的一些中,组分如免疫调节剂或抗原可与聚合物基质中的一种或更多种聚合物共价缔合。在一些实施方案中,共价缔合由接头介导。在一些实施方案中,组分可与聚合物基质中的一种或更多种聚合物非共价缔合。例如,在一些实施方案中,组分可包封在聚合物基质内、由聚合物基质包围和/或分散在聚合物基质中。作为替代或补充,组分与聚合物基质中的一种或更多种聚合物可通过疏水性相互作用、电荷相互作用、范德华力等缔合。多种聚合物以及用于由其形成聚合物基质的方法均是常规已知的。
聚合物可以是天然聚合物或非天然(合成)聚合物。聚合物可以是含有两个或更多个单体的均聚物或共聚物。就序列而言,共聚物可以是随机的、嵌段的,或者包含随机序列和嵌段序列的组合。通常来说,根据本发明的聚合物是有机聚合物。
在一些实施方案中,聚合物包含聚酯、聚碳酸酯、聚酰胺或聚醚或其单元。在另一些实施方案中,聚合物包含聚(乙二醇)(PEG)、聚丙二醇、聚(乳酸)、聚(乙醇酸)、聚乳酸-乙醇酸共聚物或聚己内酯或其单元。在一些实施方案中,优选地,聚合物是生物可降解的。因此,在这些实施方案中,优选地,如果聚合物包含聚醚(例如聚(乙二醇)或聚丙二醇或其单元),则该聚合物包含聚醚和生物可降解聚合物的嵌段共聚物,使得该聚合物是生物可降解的。在另一些实施方案中,聚合物不会仅包含聚醚或其单元,例如聚(乙二醇)或聚丙二醇或其单元。
适用于本发明中的聚合物的其他实例包括但不限于:聚乙烯、聚碳酸酯(例如聚(1,3-二
在一些实施方案中,根据本发明的聚合物包括已由美国食品药品管理局(U.S.Food and Drug Administration,FDA)根据21C.F.R.§177.2600批准用于人的聚合物,包括但不限于:聚酯(例如聚乳酸、聚乳酸-乙醇酸共聚物、聚己内酯、聚戊内酯、聚(1,3-二
在一些实施方案中,聚合物可以是亲水性的。例如,聚合物可包含阴离子基团(例如磷酸根基团、硫酸根基团、羧酸根基团);阳离子基团(例如季胺基团);或极性基团(例如羟基、巯基、胺基)。在一些实施方案中,包含亲水性聚合物基质的合成纳米载体在合成纳米载体内产生亲水性环境。在一些实施方案中,聚合物可以是疏水性的。在一些实施方案中,包含疏水性聚合物基质的合成纳米载体在合成纳米载体内产生疏水性环境。对聚合物之亲水性或疏水性的选择可影响合成纳米载体中掺入(例如偶联)的材料的性质。
在一些实施方案中,可用一个或更多个部分和/或官能团对聚合物进行修饰。根据本发明可使用多种部分或官能团。在一些实施方案中,可用聚乙二醇(PEG)、碳水化合物和/或由多糖衍生的无环聚缩醛(Papisov,2001,ACS Symposium Series,786:301)对聚合物进行修饰。某些实施方案可使用Gref等的美国专利No.5543158或Von Andrian等的WO公开WO2009/051837的一般性教导来进行。
在一些实施方案中,可用脂质或脂肪酸基团来对聚合物进行修饰。在一些实施方案中,脂肪酸基团可以是以下中的一种或更多种:丁酸、己酸、辛酸、癸酸、月桂酸、肉豆蔻酸、棕榈酸、硬脂酸、花生酸、山嵛酸或二十四烷酸。在一些实施方案中,脂肪酸基团可以是以下中的一种或更多种:棕榈油酸、油酸、异油酸、亚油酸、α-亚油酸、γ-亚油酸、花生四烯酸、鳕油酸、花生四烯酸、二十碳五烯酸、二十二碳六烯酸或芥酸。
在一些实施方案中,聚合物可以是聚酯,包含含有乳酸和乙醇酸单元的共聚物,例如聚乳酸-乙醇酸共聚物和聚丙交酯-乙交酯共聚物,在本文中将其统称为“PLGA”;以及含有乙醇酸单元的均聚物(在本文中称为“PGA”)和含有乳酸单元的均聚物,例如聚-L-乳酸、聚-D-乳酸、聚-D,L-乳酸、聚-L-丙交酯、聚-D-丙交酯和聚-D,L-丙交酯(在本文中统称为“PLA”)。在一些实施方案中,示例性的聚酯包括例如:聚羟基酸;PEG共聚物及丙交酯和乙交酯的共聚物(例如PLA-PEG共聚物、PGA-PEG共聚物、PLGA-PEG共聚物,及其衍生物。在一些实施方案中,聚酯包括例如:聚(己内酯)、聚(己内酯)-PEG共聚物、聚L-丙交酯-L-赖氨酸共聚物、聚(丝氨酸酯)、聚(4-羟基-L-脯氨酸酯)、聚[α-(4-氨基丁基)-L-乙醇酸]及其衍生物。
在一些实施方案中,聚合物可以是PLGA。PLGA是乳酸和乙醇酸的生物相容性的生物可降解共聚物,并且多种PLGA形式通过乳酸:乙醇酸之比来表征。乳酸可以是L-乳酸、D-乳酸或D,L-乳酸。可通过改变乳酸:乙醇酸之比来调节PLGA的降解速率。在一些实施方案中,根据本发明使用的PLGA的特征在于:乳酸∶乙醇酸之比为约85∶15、约75∶25、约60∶40、约50∶50、约40∶60、约25∶75或约15∶85。
在一些实施方案中,聚合物可以是一种或更多种丙烯酸类聚合物。在某些实施方案中,丙烯酸类聚合物包括例如:丙烯酸和甲基丙烯酸共聚物、甲基丙烯酸甲酯共聚物、甲基丙烯酸乙氧基乙酯、甲基丙烯酸氰基乙酯、甲基丙烯酸氨基烷酯共聚物、聚(丙烯酸)、聚(甲基丙烯酸)、甲基丙烯酸烷基酰胺共聚物、聚(甲基丙烯酸甲酯)、聚(甲基丙烯酸酐)、甲基丙烯酸甲酯、聚甲基丙烯酸酯、聚(甲基丙烯酸甲酯)共聚物、聚丙烯酰胺、甲基丙烯酸氨基烷酯共聚物、甲基丙烯酸缩水甘油酯共聚物、聚氰基丙烯酸酯、以及包含前述聚合物中一种或更多种的组合。丙烯酸类聚合物可包括丙烯酸酯和甲基丙烯酸酯的具有低含量季铵基团的完全聚合的共聚物。
在一些实施方案中,聚合物可以是阳离子聚合物。一般来说,阳离子聚合物能够缩合和/或保护核酸(例如DNA或其衍生物)的带负电链。含胺的聚合物例如聚(赖氨酸)(Zauner等,1998,Adv.Drug Del.Rev.,30:97;和Kabanov等,1995,Biocon.jugate Chem.,6:7)、聚(乙烯亚胺)(PEI;Boussif等,1995,Proc.Natl.Acad.Sci.,USA,1995,92:7297)和聚(酰胺胺)树状聚体(Kukowska-Latallo等,1996,Proc.Natl.Acad.Sci.,USA,93:4897;Tang等,1996,Bioconjugate Chem.,7:703;和Haensler等,1993,Bioconjugate Chem.,4:372)在生理pH下带正电,与核酸形成离子对并在多种细胞系中介导转染。在一些实施方案中,本发明的合成纳米载体可不包含(或者可排除)阳离子聚合物。
在一些实施方案中,聚合物可以是携带阳离子侧链的可降解聚酯(Putnam等,1999,Macromolecules,32:3658;Barrera等,1993,J.Am.Chem.Soc.,115:11010;Kwon等,1989,Macromolecules,22:3250;Lim等,1999,J.Am.Chem.Soc.,121:5633;和Zhou等,1990,Macromolecules,23:3399)。这些聚酯的实例包括聚L-丙交酯-L-赖氨酸共聚物(Barrera等,1993,J.Am.Chem.Soc.,115:11010)、聚(丝氨酸酯)(Zhou等,1990,Macromolecules,23:3399)、聚(4-羟基-L-脯氨酸酯)(Putnam等,1999,Macromolecules,32:3658;和Lim等,1999,J.Am.Chem.Soc.,121:5633)和聚(4-羟基-L-脯氨酸酯)(Putnam等,1999,Macromolecules,32:3658;和Lim等,1999,J.Am.Chem.Soc.,121:5633)。
这些和其他聚合物的特性及其制备方法在本领域中是公知的(参见,例如,美国专利6,123,727;5,804,178;5,770,417;5,736,372;5,716,404;6,095,148;5,837,752;5,902,599;5,696,175;5,514,378;5,512,600;5,399,665;5,019,379;5,010,167;4,806,621;4,638,045;和4,946,929;Wang等,2001,J.Am.Chem.Soc.,123:9480;Lim等.,2001,J.Am.Chem.Soc.,123:2460;Langer,2000,Acc.Chem.Res.,33:94;Langer,1999,J.Control.Release,62:7;和Uhrich等,1999,Chem.Rev.,99:3181)。更一般地,用于合成某些合适聚合物的多种方法在以下中进行了描述:Concise Encyclopedia of PolymerScience and Polymeric Amines and Ammonium Salts,由Goethals编辑,PergamonPress,1980;Principles of Polymerization,Odian,John Wiley&Sons,第四版,2004;Contemporary Polymer Chemistry,Allcock等,Prentice-Hall,1981;Deming等,1997,Nature,390:386;以及美国专利6,506,577、6,632,922、6,686,446和6,818,732。
在一些实施方案中,聚合物可以是直链聚合物或支化聚合物。在一些实施方案中,聚合物可以是树状聚体。在一些实施方案中,聚合物可彼此基本交联。在一些实施方案中,聚合物可基本无交联。在一些实施方案中,可根据本发明在不经历交联步骤的情况下使用聚合物。还应当理解的是,本发明的合成纳米载体可包含前述及其他聚合物的嵌段共聚物、接枝共聚物、共混物、混合物和/或加合物。本领域技术人员将认识到本文中所列举的聚合物代表可根据本发明使用之聚合物的示例性的非全面性列表。
在一些实施方案中,合成纳米载体不包含聚合物组分。在一些实施方案中,合成纳米载体可包含金属颗粒、量子点、陶瓷颗粒等。在一些实施方案中,非聚合物合成纳米载体为非聚合物组分的聚集体,例如金属原子(例如金原子)的聚集体。
根据本发明的组合物可包含与可药用赋形剂(例如防腐剂、缓冲剂、盐水和磷酸缓冲盐水)组合的合成纳米载体。所述组合物可使用常规的药物制备和配合技术制成以实现可用的剂型。在一个实施方案中,将本发明的合成纳米载体与防腐剂一起混悬于无菌盐水溶液中以用于注射。
在一些实施方案中,当制备合成纳米载体作为载体时,用于使组分与合成纳米载体偶联方法是可用的。如果组分是小分子,有利地可在组装合成纳米载体之前使该组分与聚合物连接。在一些实施方案中,还有利的是,可制备具有表面基团的合成纳米载体,其可用于通过使用这些表面基团来使组分与合成纳米载体偶联,而非使组分与聚合物连接并然后在构建合成纳米载体中使用该聚合物缀合物。
在某些实施方案中,偶联可以是共价接头。在一些实施方案中,根据本发明的肽可与外表面经由1,2,3-三唑接头共价偶联,所述接头通过纳米载体之表面上的叠氮基与含有炔基之抗原或免疫调节剂的1,3-偶极环加成反应形成或者通过纳米载体之表面上的炔与含有叠氮基之抗原或免疫调节剂的1,3-偶极环加成反应形成。优选在Cu(I)催化剂以及合适Cu(I)配体和还原剂存在下进行这样的环加成反应以将Cu(II)化合物还原成催化活性的Cu(I)化合物。还可将这种Cu(I)催化的叠氮化物-炔环加成(CuAAC)称为点击反应。
另外,共价偶联可包含共价接头,其包括酰胺接头、二硫接头、硫醚接头、腙接头、酰肼接头、亚胺或肟接头、脲接头或硫脲接头、脒接头、胺接头和磺酰胺接头。
酰胺接头通过一种组分(例如抗原或免疫调节剂)上的胺与第二组分(例如纳米载体)的羧酸基团之间的酰胺键形成。接头中的酰胺键可使用经适当保护的氨基酸和活化羧酸(例如N-羟基琥珀酰亚胺活化的酯)利用任何常规的酰胺键形成反应形成。
二硫接头通过在形式为例如R1-S-S-R2的两个硫原子之间形成二硫(S-S)键构成。二硫键可通过使含有巯基/硫醇基(-SH)的组分与聚合物或纳米载体上的另一个活化巯基进行巯基交换形成,或者通过使含有巯基/硫醇基的纳米载体与含有活化巯基的组分进行巯基交换形成。
三唑接头,特别是其中R1和R2可以是任何化学实体之
在一些实施方案中,制备聚合物链末端包含叠氮化合物或炔基团的聚合物。然后,使用这种聚合物以使得多个炔或叠氮化物基团位于合成纳米载体之表面的方式制备合成纳米载体。或者,可通过另一途径制备合成纳米载体并随后用炔或叠氮化物进行官能化。在炔(如果聚合物包含叠氮化物)基团或叠氮化物(如果聚合物包含炔)基团存在下制备该组分。然后,在催化剂存在或不存在下使该组分与纳米载体经由1,3-偶极环加成反应而反应,所述催化剂使该组分与颗粒通过1,4-二取代的1,2,3-三唑接头偶联。
硫醚接头通过以例如R1-S-R2的形式形成硫-碳(硫醚)键构成。硫醚可通过一种组分上的巯基/硫醇基(-SH)与第二组分上的烷基化基团(例如卤化物或环氧化物)的烷基化形成。硫醚接头还可通过将一种组分上的巯基/硫醇基Michael加成到含有马来酰亚胺基团或乙烯砜基团作为Michael接受体之第二组分上的缺电子烯基团形成。在另一种方式中,硫醚接头可通过一种组分上的巯基/硫醇基与第二组分上的烯基团的自由基巯基-烯反应制备。
腙接头通过使一种组分上的酰肼基团与第二组分上的醛/酮基团反应形成。
酰肼接头通过使一种组分上的肼基团与第二组分上的羧酸基团反应形成。这样的反应一般使用与其中羧酸经活化试剂激活的酰胺键形成类似的化学来进行。
亚胺接头或肟接头通过使一种组分上的胺或N-烷氧基胺(或氨基氧基)基团与第二组分上的醛或酮基团反应形成。
脲或硫脲接头通过使一种组分上的胺基团与第二组分上的异腈酸酯或硫代异腈酸酯基团反应制备。
脒接头通过使一种组分上的胺基团与第二组分上的亚氨酸酯基团反应制备。
胺接头通过一种组分上的胺基团与第二组分上的烷基化基团(例如卤化物、环氧化物或磺酸酯基团)的烷基化反应形成。或者,胺接头还可通过使一种组分上的胺基团与第二组分上的醛或酮基团在合适还原剂(例如氰基硼氢化钠或三乙酰氧基硼氢化钠)存在下进行还原胺化形成。
磺酰胺接头通过使一种组分上的胺基团与第二组分上的磺酰卤(例如磺酰氯)基团反应形成。
砜接头通过将亲核体Michael加成到乙烯砜形成。乙烯砜或亲核体可以在纳米载体的表面上或者与组分连接。
组分还可通过非共价缀合方法与纳米载体缀合缀合。例如,带负电的抗原或免疫调节剂可与带正电的纳米载体通过静电吸附缀合。含有金属配体的组分可与含有金属复合物的纳米载体经由金属-配体复合物缀合。
在一些实施方案中,可在组装合成纳米载体之前使组分与聚合物(例如聚乳酸-乙二醇嵌段共聚物)连接,或者合成纳米载体可形成为在其表面上具有反应性或可活化基团。在后一种情况下,组分可使用与通过合成纳米载体之表面呈现的连接化学相容的基团制备。在另一些实施方案中,可使用合适的接头使肽组分与VLP或脂质体连接。接头为能够将两个分子偶联在一起的化合物或试剂。在一个实施方案中,接头可以是Hermanson 2008中所述的同双功能试剂或异双功能试剂。例如,可在EDC存在下用同双功能接头己二酸二酰肼(adipic dihydrazide,ADH)处理表面上包含羧基的VLP或脂质体合成纳米载体以形成具有ADH接头的相应合成纳米载体。然后,使所得ADH连接的合成纳米载体经由该NC上ADH接头的另一端与含有酸基团的肽组分缀合以产生相应的VLP或脂质体肽缀合物。
有关可用缀合方法的详细描述,参见Hermanson G T“BioconjugateTechniques”,第2版,由Academic出版社出版,Inc.,2008。除共价连接之外,组分可与预先形成的合成纳米载体通过吸附偶联或者其可在形成合成纳米载体期间通过包封偶联。
经修饰的抗原
在一些实施方案中,任一种所述组合物和/或所述抗原特异性免疫治疗剂均可包含经修饰的抗原,其中所述修饰可以提供多种目的,包括但不限于:提高循环稳定性(例如蛋白质抗原或肽抗原的聚乙二醇化);降低对肽酶降解的敏感性(如用非天然氨基酸替换天然氨基酸),以及提高致耐受性性能(例如附着至红细胞)。
在一个优选的实施方案中,经修饰的抗原包含含有与结合红细胞的结合部分融合的目标抗原的融合蛋白。这样的结合部分的一个实例包括文献中描述的合成12-aa肽(ERY1)如H
经修饰的抗原可以以多种方法来配制以用于使用多种途径进行施用。合适的配制方法和可用的途径在本文中的其他部分公开,并且可应用于根据本发明的组合物和/或抗原特异性免疫治疗剂。
表达的抗原
在一些实施方案中,所述组合物和/或所述的抗原特异性免疫治疗剂可包含表达的抗原,其中所述表达的抗原在遗传构建体优选非高度免疫原性遗传构建体的递送后被表达。此类遗传构建体的实例是本领域已知的,并且包括但不限于:包含DNA或RNA的各种构建体、质粒、或裸DNA或RNA(包括eDNA、信使RNA、经修饰的信使RNA和RNAi的形式)的直接注射、脂质体、阳离子脂质;或浓缩的DNA/RNA颗粒,或基因枪递送。一般参见J.R.Ohlfest等,“Phenotypic correction and long-term expression of factor VIII in hemophilicmice by immunotolerization and nonviral gene transfer using the SleepingBeauty transposon system”Blood 2005;105:2691-2698;A Tautzenberger等,“Nanoparticles and their potential for application in bone”Iht’l.J.ofNanomedicine 2012:7 4545-4557。de Fougerolles等的公开的美国专利申请2013/0115272和Schrum等的公开的美国专利申请2012/0251618中公开了经修饰的信使RNA包括其直接注射。本文中其他部分列出的或在本领域中通常已知的任何蛋白质均可考虑用于在表达的抗原的情况下递送。
表达的抗原可以以多种方式来配制以用于使用多种途径进行施用。合适的配制方法和可用的途径在本文中的其他部分中公开,并且可以应用于根据本发明的组合物和/或抗原特异性免疫治疗剂。
可用于实施本发明的抗原可以选自多种抗原,包括外源性抗原和内源性抗原。
外源性抗原
如本文中的其他部分所指出的,外源性抗原可包含治疗性蛋白质、经修饰的抗原和表达的抗原。
治疗性蛋白质可以包括本文中提供的任何治疗性蛋白质或其片段或其衍生物。治疗性蛋白质包括但不限于:可输注的治疗性蛋白质、酶、酶辅因子、激素、凝血因子、细胞因子和干扰素、生长因子、单克隆抗体和多克隆抗体以及与庞皮病(Pompe’s disease)相关的蛋白质(例如阿葡糖苷酶α(alglucosidase alfa),rhGAA(例如Myozyme和Lumizyme(Genzyme))(例如作为替代治疗向对象施用的那些)。治疗性蛋白质还包括参与凝血级联的蛋白质。治疗性蛋白质包括但不限于:因子VIII、因子VII、因子IX、因子V、冯·维勒布兰德因子(von Willebrand factor)、von Heldebrant因子、组织纤溶酶原激活物、胰岛素、生长激素、红细胞生成素α、VEGF、血小板生成素、溶菌酶、抗凝血酶等。治疗性蛋白质还包括脂肪素(adipokine),例如瘦素和脂联素。治疗性蛋白质的其他实例如下文及本文中的其他部分所述。还包括作为抗原提供的任何治疗性蛋白质的片段或衍生物。
用于患有溶酶体贮积症之对象的酶替代治疗中的治疗性蛋白质的实例包括但不限于:用于治疗戈谢病(Gaucher’s disease)的伊米苷酶(例如CEREZYME
酶的实例包括氧化还原酶、转移酶、水解酶、裂合酶、异构酶和连接酶。
激素的实例包括:褪黑激素(N-乙酰基-5-甲氧基色胺)、血清素、甲状腺素(或四碘甲腺原氨酸)(甲状腺激素)、三碘甲腺原氨酸(甲状腺激素)、肾上腺素(或肾上腺激素)、去甲肾上腺素(或去甲肾上腺激素)、多巴胺(或催乳素抑制激素)、抗米勒管激素(或米勒管抑制因子或激素)、脂连蛋白、促肾上腺皮质激素(或促皮质素)、血管紧张素原和血管紧张素、抗利尿激素(或加压素、精氨酸加压素)、心房钠尿肽(或心钠素)、降钙素、胆囊收缩素、促皮质素释放激素、红细胞生成素、促卵泡激素、胃泌素、生长素释放肽、胰高血糖素、胰高血糖素样肽(GLP-1)、GIP、促性腺素释放激素、生长激素释放激素、人绒毛膜促性腺素、人胎盘催乳素、生长激素、抑制素、胰岛素、胰岛素样生长因子(或生长调节素)、瘦素、黄体化激素、黑素细胞刺激激素、食欲素、催产素、甲状旁腺激素、催乳素、松弛素、分泌素、生长激素抑制素、血小板生成素、甲状腺刺激激素(或促甲状腺素)、促甲状腺素释放激素、皮质醇、醛固酮、睾酮、去氢表雄酮、雄烯二酮、二氢睾酮、雌二醇、雌酮、雌三醇、黄体酮、骨化三醇(1,25-二羟基维生素D3)、骨化二醇(25-羟基维生素D3)、前列腺素类、白三烯类、前列环素、血栓烷类、催乳素释放激素、促脂解素、脑钠尿肽、神经肽Y、组胺、内皮素、胰多肽、肾素和脑啡肽。
血液因子和凝血因子的实例包括:因子I(纤维蛋白原)、因子II(凝血酶原)、组织因子、因子V(前加速素、不稳定因子)、因子VII(稳定因子、前转化素)、因子VIII(抗血友病球蛋白)、因子IX(克雷司马斯因子(Christmas factor)或血浆促凝血酶原激酶组分)、因子X(斯图尔特因子(Stuart-Prower factor))、因子Xa、因子XI、因子XII(哈格曼因子(Hageman factor))、因子XIII(纤维蛋白稳定因子)、冯·维勒布兰德因子、前激肽释放酶(弗莱彻因子(Fletcher factor))、高分子量激肽原(HMWK)(菲兹杰拉尔德因子(Fitzgerald factor))、纤连蛋白、纤维蛋白、凝血酶、抗凝血酶III、肝素辅因子II、蛋白C、蛋白S、蛋白Z、蛋白Z相关蛋白酶抑制剂(ZPI)、纤溶酶原、α2-抗纤溶酶、组织纤溶酶原激活物(tPA)、尿激酶、纤溶酶原激活物抑制剂-1(PAIl)、纤溶酶原激活物抑制剂-2(PAI2)、癌促凝物质或阿法依伯汀(Epogen,Procrit)。
细胞因子的实例包括:淋巴因子、白介素、以及趋化因子、1型细胞因子(例如IFN-γ、TGF-β)和2型细胞因子(例如IL-4、IL-10和IL-13)。
生长因子的实例包括:肾上腺髓质素(AM)、血管生成素(Ang)、自分泌运动因子、骨形态生成蛋白(Bone morphogenetic protein,BMP)、脑源性神经营养因子(Brain-derivedneurotrophic factor,BDNF)、表皮生长因子(Epidermal growth factor,EGF)、红细胞生成素(EPO)、成纤维细胞生长因子(Fibroblast growth factor,FGF)、神经胶质细胞系源性神经营养因子(Glial cell line-derived neurotrophic factor,GDNF)、粒细胞集落刺激因子(Granulocyte colony-stimulating factor,G-CSF)、粒细胞-巨噬细胞集落刺激因子(Granulocyte macrophage colony-stimulating factor,GM-CSF)、生长分化因子-9(Growth differentiation factor-9,GDF9)、肝细胞生长因子(Hepatocyte growthfactor,HGF)、肝癌源性生长因子(Hepatoma-derived growth factor,HDGF)、胰岛素样生长因子(Insulin-Iike growth factor,IGF)、促移行因子、肌生长抑制素(GDF-8)、神经生长因子(Nerve growth factor,NGF)及其他神经营养因子、血小板源性生长因子(Platelet-derived growth factor,PDGF)、血小板生成素(TPO)、转化生长因子α(Transforming growth factor alpha,TGF-α)、转化生长因子β(Trainsforming growthfactor beta,TGF-β)、肿瘤坏死因子α(Tumour_necrosis_factor-alpha,TNF-α)、血管内皮生长因子(Vascular endothelial growth factor,VEGF)、Wnt信号传导途径、胎盘生长因子(placental growth factor,P1GF)、[(胎牛促生长素,Foetal Bovine Somatotrophin)J(FBS)、IL-1、IL-2、IL-3、IL-4、IL-5、IL-6和IL-7。
单克隆抗体的实例包括:阿巴伏单抗、阿昔单抗、阿达木单抗、阿德木单抗、阿非莫单抗、阿夫土珠单抗(Afutuzumab)、培化阿珠单抗、ALD、阿仑单抗、阿妥莫单抗喷替酸盐、麻安莫单抗、安芦珠单抗、抗胸腺细胞珠蛋白、阿泊珠单抗、阿西莫单抗、阿塞珠单抗、Atlizumab(托珠单抗)、阿托木单抗、Bapineuzumab、巴利昔单抗、巴维昔单抗、贝妥莫单抗、贝利木单抗、Benralizumab、柏替木单抗、贝索单抗、贝伐单抗、比西单抗、莫比伐珠单抗、Blinatumomab、布妥昔单抗、贝伐珠单抗、卡那单抗、莫坎妥珠单抗、卡罗单抗喷地肽、卡妥索单抗、西利珠单抗、赛妥珠单抗、西妥昔单抗、泊西他珠单抗、西妥木单抗、克立昔单抗、Clivatuzumab tetraxetan、西他土珠单抗、达西珠单抗、达珠单抗、Daratumumab、狄迪诺塞麦、地莫单抗、阿托度单抗、Dorlixizumab、依美昔单抗、依库珠单抗、埃巴单抗、依决可单抗、依法利珠单抗、依芬古单抗、埃罗妥珠单抗、艾西莫单抗、培戈赖莫单抗、西依匹莫单抗、依帕珠单抗、Erlizumab、厄妥索单抗、Etaracizumab、艾韦单抗、Fanolesomab、法拉莫单抗、Farletuzumab、非维珠单抗、非扎奴单抗、Figitumumab、芳妥珠单抗、Foravirumab、Fresolimumab、加利昔单抗、Gantenerumab、加维莫单抗、吉妥单抗、GC1008、Girentuximab、Glembatumumab vedotin、戈利木单抗、Gomiliximab、Ibalizumab、替伊莫单抗、伊戈伏单抗、英西单抗、英夫利昔单抗、Intetumumab、伊诺莫单抗、奥英妥珠单抗、依匹木单抗、Iratumuma、凯利昔单抗、拉贝珠单抗、Lebrikizumab、来马索单抗、乐地单抗、来沙木单抗、利韦单抗、林妥珠单抗、Lorvotuzumab mertansine、鲁卡木单抗、鲁昔单抗、马帕木单抗、马司莫单抗、马妥珠单抗、美泊利单抗、美替木单抗、Milatuzumab、明瑞莫单抗、米妥莫单抗、莫罗木单抗、莫维珠单抗、鼠单克隆抗体CD3、他那可单抗、那莫单抗、那他珠单抗、奈巴库单抗、Necitumumab、奈瑞莫单抗、尼妥珠单抗、巯诺莫单抗、奥瑞珠单抗、奥度莫单抗、奥法木单抗、Olaratumab、奥马珠单抗、莫奥珠单抗、奥戈伏单抗、奥昔珠单抗、帕吉昔单抗、帕利珠单抗、帕尼单抗、Panobacumab、帕考珠单抗、Pemtumomab、帕妥珠单抗、克珠单抗、平妥莫单抗、普立昔单抗、普托木单抗、雷韦单抗、雷莫芦单抗、雷珠单抗、瑞希巴库、瑞加韦单抗、瑞利珠单抗、Rilotumumab、利妥昔单抗、Robatumumab、Rontalizumab、罗维珠单抗、鲁利单抗、沙妥莫单抗喷地肽、司韦单抗、西罗珠单抗、西法木单抗、Siltuximab、西利珠单抗、Solanezumab、Sonepcizumab、索土珠单抗、司他莫鲁、硫索单抗、替他珠单抗、他度珠单抗、他利珠单抗、尼珠单抗、帕他普莫单抗、替非珠单抗、阿替莫单抗、Tenatumomab、替奈昔单抗、Teplizumab、Ticilimumab(替西木单抗)、替加珠单抗、托珠单抗(atlizumab)、托利珠单抗、托西莫单抗、曲妥珠单抗、替西木单抗、Tucotuzumab celmoleukin、妥韦单抗、乌珠单抗、优斯它单抗、伐利昔单抗、维多珠单抗、维妥珠单抗、维帕莫单抗、维西珠单抗、伏洛昔单抗、伏妥莫单抗、扎鲁目单抗、扎木单抗、齐拉木单抗和阿佐莫单抗。
输注治疗或可注射的治疗性蛋白质的实例包括例如:托珠单抗
根据本发明的一些方面可用的另外的治疗性蛋白质对本领域技术人员来说将是显而易见的,并且本发明不限于这一方面。
另外的外源性抗原可以包含修饰的抗原或表达的抗原。
经修饰的抗原(例如目标抗原和靶向红细胞的部分之间的融合构建体)已在本文中其他部分进行了描述,并且可用于实施本发明。
表达的抗原(例如通过施用非免疫原性或低免疫原性基因载体、质粒DNA、核酸(例如DNA或RNA)或经修饰的核酸)已在本文中其他部分进行了描述,并且可用于实施本发明。
内源性抗原
本发明的一些实施方案包括为内源性抗原的抗原。内源性抗原包括自身抗原,例如见于自身免疫性疾病中的那些。自身抗原包括但不限于见于以下中的那些:强直性脊柱炎;大疱性类天疱疮;类风湿性关节炎;多发性硬化;糖尿病(包括但不限于:胰岛素依赖型糖尿病、糖尿病、幼年型糖尿病、自身免疫性自发糖尿病、免疫介导型糖尿病或I型糖尿病);湿疹;炎性肠病(例如克罗恩病(Crohn’s disease)或溃疡性结肠炎),例如自身免疫性炎性肠病;狼疮或系统性红斑狼疮;多发性硬化;原发性胆汁性肝硬化;银屑病;结节病;系统性硬化;硬皮病;甲状腺炎;自身免疫性甲状腺疾病;桥本甲状腺炎;甲状腺毒症;斑秃;格雷夫斯病;吉-巴综合征;乳糜泻;舍格伦综合征;风湿热;胃炎自身免疫性萎缩性胃炎;自身免疫性肝炎;胰岛炎;卵巢炎;睾丸炎;葡萄膜炎;晶状体源性葡萄膜炎;重症肌无力;原发性黏液水肿;恶性贫血;原发性硬化性胆管炎;自身免疫性溶血性贫血;艾迪生病;硬皮病;古德帕斯丘综合征;肾炎(例如肾小球性肾炎);银屑病;寻常型天疱疮;类天疱疮;交感性眼炎;特发性血小板减少性紫癜;特发性白细胞减少;韦格纳肉芽肿和多肌炎/皮肌炎。
下表1中描述了预期用于本发明中的一些另外的示例性自身免疫性疾病、相关的自身抗原和自身抗体:
内源性抗原还可包括与所移植组织(例如实体器官移植物或骨髓移植物)相关联的那些。移植物抗宿主病(Graft versus host disease,GVHD)是一种并发症,其可以发生在新移植的材料对移植接受者身体造成攻击的多能细胞(例如干细胞)或骨髓移植后。在一些情况下,GVHD发生在输血后。
其他的内源性抗原包括与炎性疾病相关的抗原。这样的抗原包括但不限于与以下相关的那些:阿尔茨海默病(Alzheimer′)、关节炎、哮喘、动脉粥样硬化、克罗恩氏病(Crohn′s disease)、结肠炎、囊性纤维化、皮炎、憩室炎、肝炎、肠易激综合征(irritablebowel syndrome,IBS)、红斑狼疮、肌营养不良、肾炎、帕金森病(Parkinson′s)、带状疱疹和溃疡性结肠炎。与炎性疾病相关的抗原还包括例如:与心血管疾病、慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)、支气管扩张、慢性胆囊炎、结核、桥本甲状腺炎、结节病、硅肺病相关的那些。
在一些实施方案中,内源性抗原可以是与以下相关的那些:非自身免疫性炎性肠病、术后黏连、冠状动脉疾病、肝纤维化、急性呼吸窘迫综合征、急性炎性胰腺炎、内镜逆行胰胆管诱发性胰腺炎、烧伤、冠状动脉粥样硬化形成、脑和外周动脉、阑尾炎、胆囊炎、憩室炎、内脏纤维化疾病、伤口愈合、皮肤瘢痕形成障碍(瘢痕瘤、化脓性汗腺炎)、肉芽肿性疾病(结节病、原发性胆汁性肝硬化)、哮喘、坏疽性脓皮病(pyoderma gandrenosum)、斯威特综合征(Sweet’s syndrome)、白塞病(Behcet’s disease)或原发性硬化性胆管炎。
外源性免疫调节剂
可用于实施本发明的外源性免疫调节剂包括但不限于:他汀类;mTOR抑制剂(例如雷帕霉素或雷帕霉素类似物)、TGF-β信号传导剂;TGF-β受体激动剂、组蛋白去乙酰化酶(HDAC)抑制剂、皮质激素类、线粒体功能的抑制剂(例如鱼藤酮)、P38抑制剂、NF-κβ抑制剂、凝集素受体(例如CD22)配体、腺苷受体激动剂、前列腺素E2激动剂;磷酸二酯酶抑制剂,如磷酸二酯酶4抑制剂、蛋白酶体抑制剂、激酶抑制剂、G蛋白偶联受体激动剂、G蛋白偶联受体拮抗剂、糖皮质激素类、类视黄醇、细胞因子抑制剂、细胞因子受体抑制剂、细胞因子受体激活剂、过氧化物酶体增殖物激活受体拮抗剂、过氧化物酶体增殖物激活受体激动剂、组蛋白去乙酰化酶抑制剂、钙调神经磷酸酶抑制剂、磷酸酶抑制剂和氧化的ATP。免疫调节剂还包括:IDO;维生素D3;环孢素A;芳基烃受体抑制剂;白藜芦醇;硫唑嘌呤;6-巯基嘌呤;阿司匹林;尼氟灭酸;雌三醇;雷公藤内酯(tripolide);白介素(例如IL-1、IL-10);环孢素A;靶向细胞因子或细胞因子受体的siRNA等。
他汀类的实例包括:阿托伐他汀
mTOR抑制剂的实例包括:雷帕霉素及其类似物(例如CCL-779、RAD001、AP23573、C20-甲基烯丙基雷帕霉素(C20-Marap)、C16-(S)-丁基磺酰胺基雷帕霉素(C16-Bsrap)、C16-(S)-3-甲基吲哚雷帕霉素(C16-iRap)(Bayle等Chemistry&Biology 2006,13:99-107));AZD8055;BEZ235(NVP-BEZ235);大黄根酸(大黄酚);地磷莫司(deforolimus,MK-8669);依维莫司(RAD0001);KU-0063794;PI-103;PP242;坦罗莫司和WYE-354(可获自Selleck,Houston,TX,USA)。
TGF-β信号传导剂的实例包括:TGF-β配体(例如活化素A、GDF1、GDF11、骨形态生成蛋白、nodal、TGF-β)及其受体(例如ACVR1B、ACVR1C、ACVR2A、ACVR2B、BMPR2、BMPR1A、BMPR1B、TGFβRI、TGFβRII);R-SMADS/co-SMADS(例如SMAD1、SMAD2、SMAD3、SMAD4、SMAD5、SMAD8)和配体抑制剂(例如,卵泡抑素、头蛋白(noggin)、脊索蛋白(chordin)、DAN、lefty、LTBP1、THBS1、核心蛋白聚糖)。
线粒体功能的抑制剂的实例包括:苍术苷(二钾盐)、米醇菌酸(三铵盐)、羰基氰化物间氯苯腙、羧基苍术苷(例如,来自欧苍术(Atractylis gummifera))、CGP-37157、(-)-鱼藤素(例如来自绢毛萌豆(Mundulea sericea))、F16、己糖激酶II VDAC结合结构域肽、寡霉素、鱼藤酮、Ru360、SFK1和缬氨霉素(例如,来自极暗黄链霉菌(Streptomycesfulvissimus)(EMD4Biosciences,USA)。
P38抑制剂的实例包括:SB-203580(4-(4-氟苯基)-2-(4-甲基亚磺酰基苯基)-5-(4-吡啶基)1H-咪唑)、SB-239063(反式-1-(4羟基环己基)-4-(氟苯基)-5-(2-甲氧基-嘧啶-4-基)咪唑)、SB-220025(5-(2氨基-4-嘧啶基)-4-(4-氟苯基)-1-(4-哌啶基)咪唑))和ARRY-797。
NF(例如NK-κβ)抑制剂的实例包括:FRD1、2-(1,8-萘啶-2-基)苯酚、5-氨基水杨酸、BAY 11-7082、BAY 11-7085、CAPE(咖啡酸苯乙酯)、马来酸二乙酯、IKK-2抑制剂Ⅳ、IMD0354、乳胞素、MG-132[Z-Leu-Leu-Leu-CHO]、NFκB激活抑制剂III、NF-κB激活抑制剂II、JSH-23、小白菊内酯、氧化苯胂(PAO)、PPM-18、吡咯烷二硫代氨基甲酸铵盐、QNZ、RO 106-9920、楝酰胺、楝酰胺AL、楝酰胺C、楝酰胺I、楝酰胺J、洛克米兰醇、(R)-MG-132、水杨酸钠、雷公藤内酯(PG490)和蟛蜞菊内酯(wedelolactone)。
凝集素受体配体的实例包括CD22配体,例如9-叠氮基-9-脱氧-唾液酸基寡糖和其他的CD22配体(在B.E.Collins等“High-Affinity Ligand Probes of CD22 Overcome theThreshold Set by cis Ligands to Allow for Binding,Endocytosis,and Killing ofB Cells”J.Immunol September 1,2006第177卷第5期2994-3003中公开)以及G-J Boons“Liposomes Modified by Carbohydrate Ligands can Target B cells for theTreatment 0f B-Cell Lymphomas”Expert Rev Vaccines.2010November;9(11):1251-1256中公开的配体。
腺苷受体激动剂的实例包括CGS-21680和ATL-146e。
前列腺素E2激动剂的实例包括E-前列腺素类2和E-前列腺素类4。
磷酸二酯酶抑制剂(非选择性和选择性抑制剂)的实例包括:咖啡因、氨茶碱、IBMX(3-异丁基-1-甲基黄嘌呤)、副黄嘌呤、己酮可可碱、可可碱、茶碱、甲基化黄嘌呤、长春西汀、EHNA(赤型-9-(2-羟基-3-壬基)腺嘌呤)、阿那格雷、依诺昔酮(PERFAN
蛋白酶体抑制剂的实例包括:硼替佐米、双硫仑、表没食子儿茶素-3-没食子酸酯和salinosporamide A。
激酶抑制剂的实例包括:贝伐单抗、BIBW 2992、西妥昔单抗
糖皮质激素的实例包括:氢化可的松(皮质醇)、醋酸可的松、泼尼松、泼尼松龙、甲泼尼龙、地塞米松、倍他米松、曲安西龙、倍氯米松、醋酸氟氢可的松、醋酸脱氧皮质酮(DOCA)和醛固酮。
类视黄醇的实例包括:视黄醇、视黄醛、维A酸(视黄酸、
细胞因子抑制剂的实例包:IL1ra、IL1受体拮抗剂、IGFBP、TNF-BF、尿调节素、α-2-巨球蛋白、环孢素A、喷他眯和己酮可可豆碱
过氧化物酶体增殖物激活受体拮抗剂的实例包括:GW9662、PPARγ拮抗剂III、G335和T0070907(EMD4Biosciences,USA)。
过氧化物酶体增殖物激活受体激动剂的实例包括:吡格列酮、环格列酮、氯贝丁酯、GW1929、GW7647、L-165,041、LY 171883、PPARγ激活剂、Fmoc-Leu、曲格列酮和WY-14643(EMD4Biosciences,USA)。
组蛋白去乙酰化酶抑制剂的实例包括:异羟肟酸(或氧肟酸盐)(例如曲古抑菌素A、环四肽(例如trapoxin B)和缩酚酸肽);苯甲酰胺;亲电性酮;脂族酸化合物(例如苯丁酸和丙戊酸);异羟肟酸(例如伏立诺他(SAHA)、贝利司他(PXDI01)、LAQ824和帕比司他(LBH589);苯甲酰胺(例如恩替诺特(MS-275)、CI994和mocetinostat(MGCD0103))、烟酰胺、NAD的衍生物、二氢香豆素类、萘并吡喃酮和2-羟基萘醛。
钙调神经磷酸酶抑制剂的实例包括环孢素、吡美莫司、伏环孢素(voclosporin)和他克莫司。
磷酸酶抑制剂的实例包括:BN82002盐酸盐、CP-91149、花萼海绵体诱癌素A(calyculin A)、斑蝥酸、斑蝥素、氯氰菊酯、乙基-3,4-迪磷他汀、福司曲星钠盐、MAZ51、甲基-3,4-迪磷他汀、NSC 95397、去甲斑蟊素、来自凹形原甲藻(prorocentrum concavum)的冈田酸铵盐、冈田酸、冈田酸钾盐、冈田酸钠盐、氧化苯胂、多种磷酸酶抑制剂混合物、蛋白质磷酸酶1C、蛋白质磷酸酶2A抑制剂蛋白、蛋白质磷酸酶2A1、蛋白质磷酸酶2A2和正钒酸钠。
内源性免疫调节剂
在某些实施方案中,免疫调节剂是内源性可得的。内源性免疫调节剂是由对象自身产生但不作为抗原特异性免疫治疗剂的一部分或作为一些其他治疗性干预的一部分重复施用。内源性免疫调节剂的实例包括:参与凋亡或相关信号传导的物质和/或物质的组合、参与T细胞或B细胞生物学的物质和/或物质的组合以及参与树突状细胞生物学的物质和/或物质的组合。在这样的一些实施方案中,通过重复施用抗原特异性免疫治疗剂来供给抗原可以引发或维持目标抗原特异性的致耐受性过程。
内源性免疫调节剂的具体实例包括凋亡红细胞(在S.Kontos等,“Engineeringantigens for in situ erythrocyte binding induces T-cell deletion”Proc NatlAcad Sci U S A.2013年1月2日;110(1):E60-8中公开);在不另外提供参与免疫细胞刺激的分子(例如MHC I/II或共刺激分子)或者不使免疫细胞(例如T细胞,特别是幼稚T细胞)获得效应功能的情况下呈递抗原时所产生的特定细胞因子组合(在Miller等的公开的美国专利申请2012/0076831中公开);以及以诱导致耐受性抗原特异性T细胞增殖的MHC-抗原复合物呈递抗原时所产生的细胞因子组合(在Santamaria等的公开的美国专利申请2009/0155292中公开)。
在一些实施方案中,抗原特异性免疫治疗剂的组分(例如抗原或免疫调节剂)可以是经分离的。分离是指成分从其天然环境中被分离并以足够的量存在允许其鉴别或使用。这意味着例如该组分可以(i)通过表达克隆选择性地产生或者(ii)通过色谱法或电泳纯化。分离的组分可以是但不必是基本上纯的。由于经分离的成分可与可药用赋形剂一起混合在药物制剂中,因此所述组分可仅占制剂的小重量百分比。组分仍是经分离的,只要其已与在活系统中与其相关的物质分离,即与其他脂质或蛋白质分离。本文中所提供的任何组分可以是经分离的并且以经分离的形式包含在组合物和/或抗原特异性免疫治疗剂中。
D.制备和使用本发明组合物的方法及相关方法
基于组合物的性质,可以以多种方式来制备本发明的抗原特异性免疫治疗剂。此类制剂的具体组分可以是本领域中已知的。下面介绍了所述抗原特异性免疫治疗剂的某些优选实施方案的制备方法。对于另一些实施方案的其他制备方法可以在相关文献中找到。
可使用本领域中已知的多种方法来制备在本发明的多个实施方案中可用的合成纳米载体。例如,可通过以下方法及本领域普通技术人员公知的其他方法来形成合成纳米载体:例如纳米沉淀、使用流体通道的流聚焦、喷雾干燥、单乳化溶剂蒸发和双乳化溶剂蒸发、溶剂萃取、相分离、研磨、微乳化法、微制造、纳米制造、牺牲层、简单凝聚和复合凝聚。作为替代或补充,用于单分散半导体纳米材料、电导性纳米材料、磁性纳米材料、有机纳米材料及其他纳米材料的水性溶剂和有机溶剂合成已有描述(Pellegrino等,2005,Small,1:48;Murray等,2000,Ann.Rev.Mat.Sci.,30:545;和Trindade等,2001,Chem.Mat.,13:3843)。另外的方法已在以下文献中进行了描述(例如参见Doubrow,编辑,“Microcapsulesand Nanoparticles in Medicine and Pharmacy,”CRC Press,Boca Raton,1992;Mathiowitz等,1987,J.Control.Release,5:13;Mathiowitz等,1987,Reactive Polymers,6:275;和Mathiowitz等,1988,J.Appl.Polymer Sci.,35:755;美国专利5578325和6007845;P.Paolicelli等,“Surface-modified PLGA-based Nanoparticles that canEfficiently Associate and Deliver Virus-like Particles”Nanomedicine.5(6):843-853(2010))。
如果期望的话,可使用多种方法将多种材料包封在合成纳米载体内,所述方法包括但不限于C.Astete等,“Synthesis and characterization of PLGA nanoparticles”J.Biomater.Sci.Polymer Edn,第17卷,第3期,第247至289页(2006);K.Avgoustakis“PegylatedPoly(Lactide)and Poly(Lactide-Co-Glycolide)Nanoparticles:Preparation,Properties and Possible Applications in Drug Delivery”CurrentDrug Delivery 1:321-333(2004);C.Reis等,“Nanoencapsulation I.Methods forpreparation of drug-loaded polymeric nanoparticles”Nanomedicine 2:8-21(2006);P.Paolicelli等,“Surface-modified PLGA-based Nanoparticles that canEfficiently Associate and Deliver Virus-like Particles”Nanomedicine.5(6):843-853(2010)。也可使用适合将材料包封在合成纳米载体内的其他方法,包括但不限于2003年10月14日之Unger的美国专利6,632,671中所述的方法。
在某些实施方案中,通过纳米沉淀法或喷雾干燥来制备合成纳米载体。可对用于制备合成纳米载体的条件进行改变以产生具有期望尺寸或特性(例如亲水性、疏水性、外部形态、“黏性”、形状等)的颗粒。用于制备合成纳米载体的方法及所使用的条件(例如溶剂、温度、浓度、空气流速等)可取决于待与合成纳米载体偶联的材料和/或聚合物基质的组成。
如果通过上述任一种方法制备的颗粒的尺寸范围在期望范围之外,则可例如使用筛对此类颗粒进行尺寸选择。
本发明的合成纳米载体的成分(即组分)(例如包含免疫特征表面的部分、靶向部分、聚合物基质、抗原、免疫调节剂等)可与整个合成纳米载体例如通过一种或更多种共价键偶联,或者可借助一种或更多种接头偶联。官能化合成纳米载体的另外方法可改编自Saltzman等的公开的美国专利申请2006/0002852、DeSimone等的公开的美国专利申请2009/0028910或Murthy等的公开的国际专利申请WO/2008/127532 A1。
作为替代或补充,合成纳米载体可直接地或间接地经由非共价相互作用偶联至组分(例如免疫调节剂或抗原)。在一些非共价实施方案中,非共价偶联由非共价相互作用介导,所述非共价相互作用包括但不限于:电荷相互作用、亲和性相互作用、金属配位、物理吸附、主体-客体相互作用、疏水性相互作用、TT堆积相互作用、氢键合相互作用、范德华相互作用、磁性相互作用、静电相互作用、偶极-偶极相互作用和/或其组合。这样的偶联可布置成在本发明的合成纳米载体的外表面或内表面上。在一些实施方案中,包封和/或吸附是偶联的一种形式。在一些实施方案中,可将本发明的合成纳米载体与抗原通过混合在同一载剂或递送系统中而组合。合成纳米载体的药物剂型可根据本发明使用传统的制药方法来生产。
可以根据本文其他部分引用的参考文献来制备修饰或表达的抗原。特别地,可以使用如Kontos中公开的常规的蛋白质的生产方法来制备用于修饰的抗原的融合构建体。取决于将作为用于蛋白质表达的模板的核苷酸材料如何被递送,可以使用多种技术来制备表达的抗原。例如,依赖于材料的递送/剂型(例如裸露的DNA/RNA、脂质体递送、基因枪等),可以找到核苷酸材料的递送技术。
典型的本发明的组合物和/或抗原特异性免疫治疗剂可包含:无机或有机缓冲液(例如,磷酸、碳酸、乙酸或柠檬酸的钠盐或钾盐)和pH调节剂(例如,盐酸、氢氧化钠或氢氧化钾盐、柠檬酸盐或乙酸盐、氨基酸和其盐);抗氧化剂(例如,抗坏血酸、α-生育酚);表面活性剂(例如,聚山梨醇酯20、聚山梨醇酯80、聚氧化乙烯9-10壬基苯酚、脱氧胆酸钠),溶液和/或冷冻/冻干稳定剂(例如,蔗糖、乳糖、甘露醇、海藻糖);渗透压调节剂(例如,盐或糖);抗菌剂(例如,苯甲酸、苯酚、庆大霉素);消泡剂(例如,聚二甲基硅酮);防腐剂(例如,硫柳汞、2-苯氧基乙醇、EDTA);聚合物稳定剂和黏度调节剂(例如,聚乙烯吡咯烷酮、泊洛沙姆488、羧甲基纤维素)和潜溶剂(例如,甘油、聚乙二醇、乙醇)。
可将根据本发明的组合物和/或抗原特异性免疫治疗剂配制成包含可药用赋形剂。所述组合物和/或抗原特异性免疫治疗剂可使用常规的药物制备和配合技术制成以实现可用的剂型。适用于实施本发明的技术可见于Handbook of Industrial Mixing:Science and Practice,由Edward L.Paul,Victor A.Atiemo-Obeng和Suzanne M.Kresta编辑,2004John Wiley&Sons,Inc.;和Pharmaceutics:The Science of Dosage FormDesign,第2版,由M.E.Auten编辑,2001,Churchill Livingstone。在一个实施方案中,可将本发明的合成纳米载体与防腐剂一起混悬于无菌盐水溶液中以用于注射。
应当理解的是,本发明的组合物和/或抗原特异性免疫治疗剂可以以任何合适的方式制备,并且本发明不以任何方式局限于可使用本文中所述的方法制备的组合物和/或抗原特异性免疫治疗剂。对合适方法的选择可需要注意所缔合的具体部分的特性。
在一些实施方案中,本发明的组合物和/或抗原特异性免疫治疗剂是在无菌条件下制备的或者是经最终灭菌的。这可确保所得的组合物和/或抗原特异性免疫治疗剂是无菌的和非感染性的,从而当与非无菌组合物和/或抗原特异性免疫治疗剂相比时提高了安全性。这提供了有价值的安全措施,尤其是当接受本发明的组合物和/或抗原特异性免疫治疗剂的对象具有免疫缺陷,患有感染和/或易受感染时。在一些实施方案中,可将本发明的组合物和/或抗原特异性免疫治疗剂冷冻干燥并储存在混悬液中或者作为冻干粉末储存,这取决于不丧失活性的长期配制策略。
可通过多种途径来施用本发明的组合物,包括抗原特异性免疫治疗剂(适当时),所述途径包括但不限于:皮下、鼻内、经口、静脉内、腹膜内、肌内、经黏膜、经黏膜、舌下、经直肠、经眼、经肺、皮内、经皮、经皮肤或皮内或通过这些途径的组合。施用途径还包括通过吸入或肺部气雾剂施用。用于制备气雾剂递送系统的技术对本领域技术人员来说是公知的(参见例如,Sciarra和Cutie,“Aerosols,”in Remington’s Pharmaceutical Sciences,第18版,1990,第1694至1712页;其通过引用并入本文)。
可以以有效量(例如本文中其他部分所述的有效量)施用本发明的组合物和/或抗原特异性免疫治疗剂。本发明的组合物和/或抗原特异性免疫治疗剂的剂量可包含不同量的免疫调节剂和/或抗原。本发明的组合物和/或抗原特异性免疫治疗剂中存在的免疫调节剂和/或抗原的量可根据抗原和/或免疫调节剂的性质、需达到的治疗益处和其他这样的参数而变化。在一些实施方案中,可进行剂量范围研究以建立本发明的组合物和/或抗原特异性免疫治疗剂中存在之免疫调节剂和/或抗原的最佳治疗量。在一些实施方案中,免疫调节剂和/或抗原以在施用于对象后有效地产生针对目标抗原的致耐受性免疫应答的量存在于本发明的组合物和/或抗原特异性免疫治疗剂中。
本文中所述的组合物和方法可用于诱导或增强致耐受性免疫应答和/或抑制、调节、定向或重定向不期望的免疫应答。
“重复施用”意指增强或延长先前建立的免疫耐受性或特征为耐受性的效应的持久性。当所建立的耐受性正在下降或处于下降的风险之中时,重复施用的实施方案可包括一次施用或短期疗程。重复施用开始于在施用初次抗原特异性免疫治疗剂剂量之后施用的下一个或多个抗原特异性免疫治疗剂剂量。施用的最初的抗原特异性免疫治疗剂可以与重复施用期间施用的抗原特异性免疫治疗剂相同或不同(在组成、剂量等方面)。优选在抗原特异性治疗剂的初次剂量或先前的重复施用后1周至10年,并且更优选1至12个月进行重复给药。本发明还包括涉及定期重复施用的实施方案,其根据每半周一次、每周一次、每两周一次地发生的施用方案或者根据任何其他的定期方案。
本发明的组合物和/或抗原特异性免疫治疗剂可以以多种频率施用。在一个优选的实施方案中,在重复施用中至少一次地施用本发明组合物和/或抗原特异性免疫治疗剂就足以产生药理学上相关的应答。在一些更优选的实施方案中,利用至少两次地施用、至少三次地施用或至少四次地施用本发明组合物和/或抗原特异性免疫治疗剂以在整个重复施用中确保药理学上相关的应答。
可以在疾病、障碍或病症发作之前开始本发明组合物和/或抗原特异性免疫治疗剂的预防性重复施用,或者可以在确立疾病、障碍或病症之后开始治疗性重复施用。
在一些实施方案中,例如在外源性抗原的施用之前进行免疫调节剂的施用。在一些示例性实施方案中,在以下一个或更多个时间施用免疫调节剂,包括但不限于:在施用外源性抗原前30、25、20、15、14、13、12、11、10、9、8、7、6、5、4、3、2、1或0天。作为替代或补充,可以在外源性抗原施用之后向对象施用免疫调节剂。在一些示例性实施方案中,在以下一个或更多个时间施用免疫调节剂,包括但不限于:在施用外源性抗原后1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、20、25、30天等。
可以在人或非人对象中证明方案和构成方案的要素。在其中于非人对象中证明方案的实施方案中,可将这样的方案或其要素转化为人方案。例如,来自在啮齿类动物或非人灵长类动物中进行的方案的测试结果可以建议方案要素,例如重复给药的频率、抗原特异性免疫治疗剂剂量的量、在每个重复给药的实例中抗原特异性免疫治疗剂的施用次数、施用途径以及在每个方案中上述要素的变化。在一个实施方案中,啮齿类动物和/或非人灵长类动物的方案结果可以建议剂量的量(包括定义治疗窗的最大和最小剂量),然后根据常规的缩放技术(例如异速缩放)对剂量进行缩放用于人方案。非人方案要素也可以建议可转化为人方案的重复给药的最佳频率,其中在某些实施方案中,具有大致相同的频率,而在另一些实施方案中,具有基于非人物种和人之间的差异进行了频率调整。
基于在重复施用后显示非免疫抑制诱导的结果,可以选择这样的非人方案或方案要素用于本发明。当重复施用组合物和/或抗原特异性免疫治疗剂时,可将此类非人方案或其元素转化为用于人以在人中提供预期的安全性(以及可能的效力)益处。可使用上文、本文中其他部分、以及本领域中常规的技术和考虑将非人方案或其要素转化为人方案。
本公开内容的另一个方面涉及药盒。在一些实施方案中,所述药盒包含一个剂量或多于一个剂量的本文中所提供的抗原特异性免疫治疗剂。在这样的一些实施方案中,所述药盒包含多于一个剂量的免疫调节剂。所述药盒还包含或进一步包含多于一个剂量的抗原。免疫调节剂和/或抗原可包含在药盒中的独立容器中或包含在药盒中的同一容器中。在一些实施方案中,所述容器为小瓶或安瓿。在一些实施方案中,免疫调节剂和/或抗原的剂量包含在与容器分开的溶液中,使得可随后将所述剂量添加至容器。在一些实施方案中,免疫调节剂和/或抗原的剂量以冻干形式各自存在于独立容器中或同一容器中,使得它们可随后重构。在一些实施方案中,所述药盒还包含用于重构、混合、施用等的说明书。在一些实施方案中,所述说明书包含对本文中所述的方法的说明。说明书可以是任何合适的形式,例如,作为印刷插入物或标签。在一些实施方案中,所述药盒还包含一个或更多个注射器。
实施例
合成纳米载体的材料
雷帕霉素购自TSZ CHEM(185Wilson Street,Framingham,MA 01702;产品目录#R1017)。大约25,000Da的PLGA购自Lakeshore Biochemicals(756Tom Martin DrBirmingham,AL 35211)。产品代码5050DLG2.5A。甲基醚封端PEG嵌段为约5000Da的并且PLA嵌段为约48,000Da的PLA-PEG-OMe嵌段共聚物购自Lakeshore Biochemicals(756TomMartin Drive,Birmingham,AL 35211)。产品代码100DL mPEG 5000 5CE。OPII.323购自BACHEM(3132Kashiwa Street,Torrance,CA 90505;批号#B06481)。
合成纳米载体的方法
如下制备溶液:溶液1:二氯甲烷中100mg/mL的PLGA。该溶液通过将PLGA溶解在纯二氯甲烷中来制备。溶液2:二氯甲烷中100mg/mL的PLA-PEG。该溶液通过将PLA-PEG溶解在纯二氯甲烷中来制备。溶液3:二氯甲烷中50mg/mL的雷帕霉素。该溶液通过将雷帕霉素溶解在纯二氯甲烷中来制备。溶液4:0.13M HCl中20mg/mL的OPII.323。该溶液通过将OPII.323溶解在0.13M HCI中来制备。溶液5:100mM pH 8磷酸盐缓冲液中的50mg/mL聚乙烯醇。溶液6∶70mM磷酸盐缓冲液,pH8。首先通过混合溶液1至溶液4制备初级(W1/O)乳剂。将溶液1(0.75mL)、溶液2(0.25mL)、溶液3(0.20mL)和溶液4(0.2mL)合并在小玻璃压力管中并使用Branson Digital Sonifier 250以50%振幅进行超声处理40秒。
然后,如下制备次级乳剂(W1/O/W2):通过将溶液5(3.0mL)添加到初级乳剂中,涡旋以制备粗分散体,然后使用Branson Digital Sonifier 250以30%振幅进行超声处理60秒。将次级乳剂添加到含有溶液6(30mL)的50mL敞口烧杯中,并在室温下搅拌2小时以使二氯甲烷蒸发并悬浮形成纳米载体。然后将一部分的悬浮纳米载体经如下洗涤:将纳米载体混悬液转移至离心管,在75,600rcf下旋转35分钟,除去上清液并将沉淀物重悬于磷酸缓冲盐水中。重复该洗涤操作并将沉淀物重悬于PBS 1X中以获得按聚合物计标称浓度为10mg/mL的纳米载体混悬液。将该混悬液在-20℃时冷冻保存直至使用。
通过动态光散射确定纳米载体的尺寸。通过HPLC分析测定纳米载体中雷帕霉素的量。通过HPLC分析确定纳米载体中的OPII.323的量。通过重量法确定总干纳米载体质量/mL混悬液。
ELISA:抗-OVA IgG的测量
测量IgG抗体的水平。使用PBS中的封闭剂酪蛋白(Thermo Fisher,目录#37528)作为稀释剂。使用PBS中的0.05%Tween-20作为洗涤缓冲液,其通过将10mL Tween-20(Sigma,目录#P9416-100mL)添加至2升10x PBS贮存液(PBS:
使用贮存液浓度为5mg/mL的OVA蛋白质作为包被材料。使用5μg/mL的1∶1000稀释度作为工作浓度。用100μl经稀释OVA/孔包被测定板的每个孔,将板用密封膜(VWR目录#60941-120)密封并在4℃下孵育过夜。使用Costar 901796-孔平底板作为测定板(Costar9017)。
使用低结合聚丙烯96-孔板或管作为在转移至测定板之前在其中制备样品的制备板(set-up plate)。制备板不含任何抗原,因此在制备样品期间血清抗体不与该板结合。如果使用经抗原包被的板来制备样品,使用制备板进行样品制备以最小化在制备或用移液管吸移样品期间可发生的结合。在制备板中制备样品之前,将孔用稀释剂覆盖以封闭任何非特异性结合,将板密封并在4℃下孵育过夜。
将测定板用洗涤缓冲液洗涤三次,并在最后一次洗涤之后完全吸出孔中的洗涤缓冲液。在洗涤之后,向测定板的每个孔添加300μl稀释剂以封闭非特异性结合并将板在室温下孵育至少2小时。以合适的起始稀释度在制备板中制备血清样品。有时也使用稀释剂在1.5mL管中制备起始稀释。在可用时,基于先前的数据来确定合适的起始稀释度。当先前的数据不可用时,最低起始稀释度为1∶40。一旦被稀释,将200μl起始稀释度的血清样品转移至制备板的合适孔中。
一个示例性制备板的布局描述如下:列2和11包含稀释至1μg/mL(1∶4000稀释度)的抗卵清蛋白单克隆IgG2b同种型(AbCam,ab17291)标准物。列3至10包含血清样品(适当稀释度)。列1和12不用于样品或标准物以避免由于边缘效应而引起的任何测量偏差。作为替代,列1和12包含200μl的稀释剂。使用经1∶40稀释的正常小鼠血清作为阴性对照。使用由0.5mg/mL贮存液(BD Bioscience)经1:500稀释的抗小鼠IgG2a作为同种型对照。
一旦在制备板中制备完所有的样品,将板密封并储存在4℃下,直至测定板的封闭完成。将测定板用洗涤缓冲液洗涤三次,并在最后一次洗涤之后完全吸出洗涤缓冲液。在洗涤之后,向测定板B至H排中的所有孔中添加100μL稀释剂。使用12-道的移液器将样品从制备板转移至测定板。在转移之前通过将150μl经稀释的血清用移液管上下吸移3次来混合样品。在混合之后,将每份样品中的150μl从制备板转移并添加至各测定板的A排。
一旦将起始稀释度的每份样品从制备板转移至测定板的A排,如下在测定板上用移液管吸移连续稀释液:使用12-道移液器从A排取出每份血清样品中的50μl并将其与先前添加至B排每个孔中的100μl稀释剂混合。在整个板中向下重复该步骤。在吸移最后一排的稀释物之后,从最后一排的孔中取出50μl流体并弃掉以在测定板的每个孔中产生100μl的终体积。一旦在测定板中制备完样品稀释物,将板在室温下孵育至少2小时。
在孵育之后,将板用洗涤缓冲液洗涤三次。在稀释剂中以1∶1500(0.33μg/mL)稀释检测抗体(山羊抗小鼠抗-IgG、HRP缀合的、AbCam ab98717)并向每个孔添加100μl经稀释的抗体。将板在室温下孵育1小时并随后用洗涤缓冲液洗涤三次,其中每个洗涤步骤包括至少30秒的浸泡时间。
在洗涤之后,向孔中添加检测底物。在添加至测定板之前,立即将等份的底物A和底物B(BD Biosciences TMB Substrate Reagent Set,目录#555214)合并,向每个孔添加100μl的经混合底物溶液并在暗处孵育10分钟。10分钟后,通过向每个孔添加50山终止溶液(2N H
在添加终止溶液之后,立即通过450nm下的板读数与570nm下的板读数相减评估孔的光密度(OD)。使用Molecular Device软件SoftMax Pro v5.4进行数据分析。在一些情况下,以稀释度为x轴(log刻度)并以OD值为y轴(线性刻度)制作四参数逻辑曲线拟合图,并确定每份样品的半最大值(EC50)。调整布局顶部的板模板以反映每份样品的稀释度(1/列)。
ELISA:抗-KLH IgG的测量
测量IgG抗体的水平。使用PBS中的封闭剂酪蛋白(Thermo Fisher,目录#37528)作为稀释剂。使用PBS中的0.05%Tween-20作为洗涤缓冲液,其通过将10mL Tween-20(Sigma,目录#P9416-100mL)添加至2升10x PBS贮存液(PBS:
使用贮存液浓度为10mg/mL的KLH蛋白质(Sigma,目录#H7127)作为包被材料。使用5μg/mL的1∶2000稀释度作为工作浓度。用100μl经稀释KLH/孔包被测定板的每个孔,将板用密封膜(VWR目录#60941-120)密封并在4℃下孵育过夜。使用Costar 901796-孔平底板作为测定板(Costar 9017)。
使用低结合聚丙烯96-孔板或管作为在转移至测定板之前在其中制备样品的制备板。制备板不含任何抗原,因此在制备样品期间血清抗体不与该板结合。如果使用经抗原包被的板来制备样品,使用制备板进行样品制备以最小化在制备或用移液管吸移样品期间可发生的结合。在于制备板中制备样品之前,将孔用稀释剂覆盖以封闭任何非特异性结合,将板密封并在4℃下孵育过夜。
将测定板用洗涤缓冲液洗涤三次,并在最后一次洗涤之后完全吸出孔中的洗涤缓冲液。在洗涤之后,向测定板的每个孔添加300μl稀释剂以封闭非特异性结合并将板在室温下孵育至少2小时。以合适的起始稀释度在制备板中制备血清样品。有时也使用稀释剂在1.5mL管中制备起始稀释液。在可用时,基于先前的数据来确定合适的起始稀释度。当先前的数据不可用时,最低起始稀释度为1∶40。一旦被稀释,将200μl起始稀释度的血清样品转移至制备板中的合适孔。
一个示例性制备板的布局描述如下:列2和3含有稀释至0.2μg/mL(由1mg/mL储存液按1∶5000稀释)抗-KLH小鼠单克隆IgG1同种型(AbCam,ab34607)标准物。列4至12含有血清样品(在适当的稀释度)。列1不用于样品或标准物,因此可以评估稀释剂单独对包被材料的影响。作为替代,列1含有200μl稀释剂。使用经1∶40稀释的正常小鼠血清作为阴性对照。使用由0.5mg/mL的贮存液(BD Bioscience)经1∶500稀释的抗小鼠IgG2a作为同种型对照。
一旦在制备板中制备完所有的样品,将板密封并储存在4℃下,直至测定板的封闭完成。将测定板用洗涤缓冲液洗涤三次,并在最后一次洗涤之后完全吸出洗涤缓冲液。在洗涤之后,向测定板的B至H排中的所有孔中添加100μL稀释剂。使用12-道的移液管将样品从制备板转移至测定板。在转移之前通过将150μl经稀释的血清用移液管上下吸移3次来混合样品。在混合之后,将每份样品中的150μl从制备板转移并添加至各测定板的A排。
一旦将起始稀释度的每份样品从制备板转移至测定板的A排,如下在测定板上用移液管吸移连续稀释物:使用12-道的移液管从A排取出每份血清样品中的50μl并将其与先前添加至B排每个孔中的100μl稀释剂混合。在整个板中向下重复该步骤。在用移液管吸移最后一排的稀释液之后,从最后一排的孔中取出50山流体并弃掉以在测定板的每个孔中产生100μl的终体积。一旦在测定板中制备完样品稀释物,将板在室温下孵育至少2小时。
在孵育之后,将板用洗涤缓冲液洗涤三次。在稀释剂中以1∶1500(0.33μg/mL)稀释检测抗体(山羊抗小鼠抗-IgG、HRP缀合的、AbCam ab98717),并向每个孔添加100μl经稀释的抗体。将板在室温下孵育1小时并随后用洗涤缓冲液洗涤三次,其中每个洗涤步骤包括至少30秒的浸泡时间。
在洗涤之后,向孔添加检测底物。在添加至测定板之前,立即将等份的底物A和底物B(BD Biosciences TMB Substrate Reagent Set,目录#555214)合并,向每个孔添加100μl的经混合的底物溶液并在暗处孵育10分钟。10分钟后,通过向每个孔添加50μl终止溶液(2N H
抗原特异性免疫治疗剂在重复施用下的抗原特异性致耐受性活性
本实验的目的是通过测定抗原特异性免疫球蛋白来评估重复施用抗原特异性免疫治疗剂的方案对新生抗体应答的免疫抑制的潜力。使一组动物保持未免疫作为对照。如下使所有组的动物免疫:在右前和后足垫内使用鸡卵清蛋白(OVA)和CpG进行3次注射(在d0、d14和d28的初始处理)以及在左前和后足垫注射钥孔林普贝血蓝蛋白(KLH)。在第0天注射包含OPII的抗原特异性免疫治疗剂(按照上述方法制备的合成纳米载体,标记为“t
非免疫抑制性的抗原特异性免疫治疗剂重复施用方案(预示性的)
在本发明的实施中,该方案或其要素将用于产生用于其他对象的非免疫抑制性方案。将通过使用异速缩放技术提高剂量来在例如人中对剂量要素进行缩放以仍保持上述确定的基本方案的非免疫抑制。
根据Miller等(“Miller”)的公开的美国专利申请2012/0076831的实施例21中所示的方法制备PLP-偶联的合成纳米载体。在第0天,以10mg纳米载体/千克体重的剂量向SJL小鼠初次静脉内施用合成纳米载体,然后在初次施用之后每两周一次地静脉内重复施用6周。在第0天、在每次临重复施用之前以及在最后重复施用之后一周采集血样。
使用如上述实施例1中一般地阐述的KLH IgG ELISA方法对血样进行分析以建立KLH IgG效价。可以注意到不存在免疫抑制,如KLH IgG效价高于在重复施用合成纳米载体之后采集的一个或更多个样品中的背景所证明的。
在10mg/kg的初次剂量之后,然后以根据10mg kg的相同剂量并基于小鼠和人之间的相对质量缩放的剂量向人对象静脉内重复施用合成纳米载体。在初次施用之后重复给药频率为每周一次施用3周,并且此后为每月一次。监测人对象的受抑制免疫系统的机会性感染或其他症状的临床体征。
根据M.Look等“Nanogel-based delivery of mycophenolic acid amelioratessystemic lupus erythematosus in mice”J Clin Invest.doi:10.1172/JCI65907(2013)中公开的方法制备包含麦考酚酸的纳米凝胶型合成纳米载体。以0.625mg MPA/千克动物体重的剂量(“mpk”)初始向C57BL/6小鼠每日静脉内施用合成纳米载体,持续4天,然后在初始施用之后每月一次地静脉内重复施用6个月。在第0天、在每次临重复施用之前、以及在最后重复施用之后一周采集血样。
使用如上述实施例1中一般地阐述的KLH IgG ELISA方法对血样进行分析以建立KLH IgG效价。可以注意到不存在免疫抑制,如通过KLH IgG效价高于在重复施用合成纳米载体之后采集的一个或更多个样品中的背景上所证明的。
然后,以基于小鼠和人之间的相对质量缩放的剂量(即0.625mpk)向人对象静脉内重复施用合成纳米载体。初始剂量是每日一次,持续两天。在初始施用之后,重复给药频率为以0.625mpk每月一次,持续6个月。监测人对象的受抑制免疫系统的机会性感染或其他症状的临床体征。
使用本文其他部分讨论的Kontos等的公开内容,产生将促红细胞生成素与鼠红细胞特异性单链Fv(scFv)抗体片段组合的融合蛋白。然后以计算每剂量包含10μg融合蛋白的剂量向12周龄雌性C57BL/6小鼠初始每日静脉内施用所述融合蛋白,持续3天,然后在初始施用之后两周一次地静脉内重复施用6个月。在第0天、在每次临重复施用之前、以及在最后重复施用之后一周采集血样。
使用如上述实施例1中一般地阐述的KLH IgG ELISA方法对血样进行分析以建立KLH IgG效价。可以注意到不存在免疫抑制,如KLH IgG效价高于在重复施用合成纳米载体之后采集的一个或更多个样品中的背景所证明的。
然后,产生包含人红细胞生成素和人红细胞特异性的scFV片段的人融合蛋白。然后,以基于小鼠10μg的剂量并根据小鼠和人之间的相对血容量缩放的剂量向人对象初始每日静脉内施用所述融合蛋白,持续三天。重复剂量与初始剂量相同。在初始施用之后,重复给药频率为以一半的初始剂量每月一次,持续6个月。监测人对象的受抑制免疫系统的机会性感染或其他症状的临床体征。
根据Su等,“In vitro and in vivo mRNA delivery using lipid-enveloped pHresponsive polymer nanoparticles”Mol Pharm.20116月6日;8(3):774-787(“Su”)的公开内容制备由pH-响应性聚(β-氨基酯)(PBAE)芯和磷脂壳构成的可降解合成纳米载体系统。执行双乳剂配制策略,并将以MPA浓度为100mg/mL的溶液存在的麦考酚酸包封在初级乳剂中,并随后包封在合成纳米载体中。对于还可使用的其他包封策略,还参见Moon等,“Interbilayer-Crosslinked Multilamellar Vesicles as Synthetic Vaccines forPotent Humoral and Cellular Immune Responses”Nat Mater.2011年3月;10(3):243-251。然后,根据由Su一般公开的方法,将EPO的mRNA与合成纳米载体偶联。或者,也可以使用如Su中所示的编码其他治疗性蛋白质(例如基于mRNA的疫苗或蛋白质替代物)的mRNA。
然后,以经计算含有7mg/kg的合成纳米载体的剂量通过静脉内输注向恒河猴初次施用合成纳米载体,然后在初次施用之后以两月一次静脉内重复施用6个月。在第0天、在每次临重复施用之前、以及在最后重复施用之后一周采集血样。
使用如上述实施例1中一般地阐述的KLH IgG ELISA方法对血样进行分析以建立KLH IgG效价。可以注意到不存在免疫抑制,如KLH IgG效价高于在重复施用合成纳米载体之后采集的一个或更多个样品中的背景所证明的。
然后,以基于猴和人之间的相对质量缩放的基于双倍初始7mg/kg剂量的剂量(即14mg/kg)向人对象静脉内重复施用合成纳米载体。在初次施用之后,重复给药频率为每月一次,持续6个月。监测人对象的受抑制免疫系统的机会性感染或其他症状的临床体征。
制备基因球形式的合成纳米载体。如下将雷帕霉素包封在合成纳米载体中:将雷帕霉素溶解在乙醇中,并且将雷帕霉素溶液与脂质溶液组合以达到基于添加至纳米载体制剂之干组分的重量的4%w/w的经计算雷帕霉素载量。使用可在人和非人灵长类动物两者中转化的常规质粒技术,使DNA相包含引入有编码红细胞生成素(“EPO”)的cDNA的质粒。
然后,以经计算含有12mg/kg合成纳米载体的剂量初始每日通过静脉内输注向猕猴(Macaque monkey)施用合成纳米载体,持续两天,然后在初始施用后开始以两倍的初始剂量(即24mg/kg)开始每月一次静脉内重复施用,持续6个月,接着此后每两个月按25%递减(18mg/kg、12mg/kg、6mg/kg)。在第0天、在每次临重复施用之前、以及在最后重复施用之后一周采集血样。
使用如上述实施例1中一般地阐述的KLH IgG ELISA方法对血样进行分析以建立KLH IgG效价。可以注意到不存在免疫抑制,如KLH IgG效价高于在重复施用合成纳米载体之后采集的一个或更多个样品中的背景所证明的。
然后以基于在猴中重复施用的递减24mg/kg猴剂量(例如24mg/kg、18mg/kg、12mg/kg和6mg/kg,其中递减以2个月的时间间隔发生)并基于猴和人之间的相对质量缩放的剂量向人对象静脉内重复施用合成纳米载体。在初次施用之后,重复给药频率为每月一次,持续6个月。监测人对象的受抑制免疫系统的机会性感染或其他症状的临床体征。
材料
雷帕霉素购自TSZ CHEM(185Wilson Street,Framingham,MA01702,产品目录#R1017)。大约25,000Da的PLGA购自Lakeshore Biomaterials(756Tom Martin Dr,Birmingham,AL 35211),产品代码5050DLG 2.5A。甲基醚封端PEG嵌段为约5,000Da并且PLA嵌段为48,000Da的PLA-PEG-OMe嵌段共聚物购自Lakeshore Biomaterials(756Tom MartinDrive,Birmingham,AL 35211),产品代码100DL mPEG 5000 5CE。
根据de.Fougerolles等的公开的美国专利申请2013/0115272的公开内容制备重组人粒细胞集落刺激因子(Recombinant human Granulocyte-Colony StimulatingFactor,rhuG-CSF)修饰的mRNA。
方法
如下制备溶液:溶液1:二氯甲烷中100mg/mL的PLGA。该溶液通过将PLGA溶解在纯二氯甲烷中来制备。溶液2:二氯甲烷中100mg/mL的PLA-PEG。该溶液通过将PLA-PEG溶解在纯二氯甲烷中来制备。溶液3:二氯甲烷中50mg/mL的雷帕霉素。该溶液通过将雷帕霉素溶解在纯二氯甲烷中来制备。溶液4∶0.13M HCl中20mg/mL rhuG-CSF修饰的mRNA。该溶液通过将mmRNA溶解在0.13M HCI中来制备。溶液5:100mM pH8磷酸盐缓冲液中的50mg/mL聚乙烯醇。溶液6:70mM磷酸盐缓冲液,pH8。首先通过混合溶液1至溶液4来制备初级(W1/O)乳剂。
将溶液1(0.75mL)、溶液2(0.25mL)、溶液3(0.20mL)和溶液4(0.2mL)合并在小玻璃压力管中并使用Branson Digital Sonifier 250以50%振幅进行超声处理40秒。然后,如下制备次级乳剂(W1/O/W2):将溶液5(3.0mL)添加到初级乳剂中,涡旋以制备粗分散体,然后使用Branson Digital Sonifier 250以30%振幅进行超声处理60秒。将次级乳剂添加到包含溶液6(30mL)的50mL敞口烧杯中,并在室温下搅拌2小时以使二氯甲烷蒸发并悬浮形成纳米载体。然后将一部分的悬浮纳米载体经如下洗涤:将纳米载体混悬液转移至离心管并在75,600rcf下离心分离35分钟,除去上清液并将沉淀物重悬于磷酸缓冲盐水中。重复该洗涤操作并将沉淀物重悬于PBS 1X中以获得具有按聚合物计标称浓度为10mg/mL的纳米载体混悬液。将该混悬液在-20℃下冷冻保存直至使用。
然后,以经计算含有12mg/kg合成纳米载体的剂量通过静脉内输注向猕猴初始每日施用合成纳米载体,持续两天,随后在初始施用后开始以相同的剂量(即12mg/kg)每月一次静脉内重复施用,持续6个月。在第0天、在每次临重复施用之前、以及在最后重复施用之后一周采集血样。
使用如上述实施例1中一般地阐述的KLH IgG ELISA方法对血样进行分析以建立KLH IgG效价。可以注意到不存在免疫抑制,如KLH IgG效价高于在重复施用合成纳米载体之后采集的一个或更多个样品中的背景所证明的。
然后,以基于在猴中重复施用的12mg/kg剂量并基于猴和人之间的相对质量缩放的剂量向人对象静脉内重复施用合成纳米载体。在初次施用之后,重复给药频率为每月一次,持续6个月。监测人对象的受抑制免疫系统的机会性感染或其他症状的临床体征。
重复实施例7的操作,不同之处在于用重组人红细胞生成素(huEPO)修饰的mRNA代替重组人粒细胞集落刺激因子(rhuG-CSF)修饰的mRNA。根据de Fougerolles等的公开的美国专利申请2013/0115272的公开内容制备人红细胞生成素(rHuEPO)修饰的mRNA。
通过溶胶-凝胶法制备介孔SiO
然后使用(3-氨基丙基)-三乙氧基硅烷(APTMS)用氨基官能化SiO
在单独的反应中,制备1至4nm直径的金籽晶(gold seed)。首先,对在该反应中使用的所有水进行去离子,然后从玻璃蒸馏。将水(45.5mL)添加到100mL的圆底烧瓶中。在搅拌的同时,添加0.2M NaOH水溶液(1.5mL),随后添加1%四(羟甲基)氯化
为了形成芯-壳纳米载体,首先将上述形成的氨基官能化SiO
使用薄膜水化形成脂质体。将1,2-二棕榈酰基-sn-甘油-3-磷酸胆碱(DPPC)(32μmol)、胆固醇(32μmol)和环孢素A(6.4μmol)溶解在纯氯仿(3mL)中。将这种脂质溶液添加到50mL的圆底烧瓶中,并且使溶剂在60℃的温度下在旋转蒸发器上蒸发。然后,用氮气冲洗烧瓶以除去剩余的溶剂。向烧瓶添加磷酸缓冲盐水(2mL)和五个玻璃珠,并通过在60℃下振荡1小时使脂质膜水化以形成混悬液。将所述混悬液转移至小压力管中并且在60℃下超声处理4个30秒脉冲的周期,每个脉冲之间有30秒延迟。然后将混悬液在室温下静置2小时以使得完全水化。通过离心洗涤脂质体,随后将其重悬于新鲜的磷酸缓冲盐水中。
PLGA-雷帕霉素缀合物的制备:
将具有酸端基的PLGA聚合物(7525DLG1A,酸值为0.46mmol/g,LakeshoreBiomaterials;5g,2.3mmol,1.0当量)溶解于30mL二氯甲烷(DCM)中。添加N,N-二环己基碳二亚胺(1.2当量,2.8mmol,0.57g),随后添加雷帕霉素(1.0当量,2.3mmol,2.1g)和4-二甲基氨基吡啶(DMAP)(2.0当量,4.6mmol,0.56g)。将混合物在室温下搅拌2天。然后将混合物过滤以除去不溶的二环己基脲。将滤液浓缩至约10mL的体积,并将其添加到100mL异丙醇(IPA)中以沉淀出PLGA雷帕霉素缀合物。除去IPA层,然后用50mL IPA和50mL甲基叔丁基醚(MTBE)洗涤聚合物。然后,将聚合物在35℃下真空干燥2天以得到作为白色固体的PLGA-雷帕霉素(约6.5g)。
包含PLGA-雷帕霉素缀合物和卵清蛋白肽(323-339)的纳米载体的制备:
根据实施例1中描述的方法如下制备包含PLGA-雷帕霉素的纳米载体:
如下制备用于形成纳米载体的溶液:
溶液1:稀盐酸水溶液中的20mg/mL卵清蛋白肽323-339。该溶液通过在室温下将卵清蛋白肽溶解于0.13M盐酸溶液中制备。溶液2:二氯甲烷中的100mg/mLPLGA-雷帕霉素。该溶液通过将PLGA-雷帕霉素溶解在纯二氯甲烷中制备。溶液3:二氯甲烷中的100mg/mL PLA-PEG。该溶液通过将PLA-PEG溶解在纯二氯甲烷中制备。溶液4:100mM pH8磷酸盐缓冲液中的50mg/mL聚乙烯醇。
首先制备初级油包水乳剂。如下制备W1/O1:通过将溶液1(0.2mL)、溶液2(0.75mL)和溶液3(0.25mL)合并在小压力管中,并使用Branson Digital Sonifier 250以50%振幅进行超声处理40秒。如下制备次级乳剂(W1/O1/W2):使溶液4(3.0mL)与初级W1/O1乳剂组合,涡旋10秒,并使用Branson Digital Sonifier 250以30%振幅进行超声处理60秒。将W1/O1/W2乳剂添加到含有70mM pH 8磷酸盐缓冲溶液的烧杯中并在室温下搅拌2小时以使二氯甲烷蒸发并形成合成纳米载体。将一部分的合成纳米载体经如下洗涤:将合成纳米载体混悬液转移至离心管并在75,600×g和4℃下离心35分钟,除去上清液并将沉淀物重悬于磷酸缓冲盐水中。重复洗涤操作,并将沉淀物重悬于磷酸缓冲盐水中以获得约10mg/mL的最终合成纳米载体分散体。
HS-PEG-雷帕霉素的制备:
将PEG酸二硫化物(1.0当量)、雷帕霉素(2.0至2.5当量)、DCC(2.5当量)和DMAP(3.0当量)在无水DMF中的溶液在室温下搅拌过夜。通过过滤除去不溶的二环己基脲,并将滤液添加到异丙醇(IPA)中以沉淀出PEG-二硫化物-二-雷帕霉素酯,用IPA洗涤并干燥。然后,用DMF中的三(2-羧乙基)膦盐酸盐处理聚合物以将PEG二硫化物还原为巯基PEG雷帕霉素酯(HS-PEG-雷帕霉素)。将所得到的聚合物通过从IPA沉淀回收并如前所述干燥,通过HNMR和GPC分析。
金NC(AuNC)的形成:
在剧烈搅拌下,将500mL 1mM HAuCl4的水溶液在配备有冷凝器的1L圆底瓶中加热回流10分钟。然后将50mL 40mM柠檬酸三钠的溶液迅速添加到搅拌溶液中。将所得的深酒红色溶液在回流下保持25分钟至30分钟并且撤出加热,将溶液冷却至室温。然后,通过0.8μm膜过滤器过滤所述溶液以得到AuNC溶液。使用可见光谱学和透射电子显微术对AuNC进行表征。经柠檬酸盐包被的AuNC的直径为约20nm,并且在520nm处有峰值吸收。
具有HS-PEG-雷帕霉素的AuNC缀合物:
将150μl HS-PEG-雷帕霉素(在10mM pH 9.0碳酸盐缓冲液中10μM)的溶液添加到1mL 20nm直径的经柠檬酸盐包被的金纳米载体(1.16nm)中以产生巯基∶金为2500∶1的摩尔比。将混合物在氩气下在室温下搅拌1小时以使巯基与金纳米载体上的柠檬酸盐完全交换。然后通过在12,000g下离心30分钟对表面上具有PEG-雷帕霉素的AuNC进行纯化。将上清液倒出,并随后用1x PBS缓冲液洗涤包含AuNC-S-PEG-雷帕霉素的沉淀物。然后,将经纯化的金-PEG-雷帕霉素纳米载体重悬于合适的缓冲液中以进行进一步的分析和生物测定。
通过薄膜水化形成脂质体。将1,2-二棕榈酰基-sn-甘油-3-磷酸胆碱(DPPC)(32μmol)、胆固醇(32μmo1)和环孢素A(6.4μmol)溶解在纯氯仿(3mL)中。将这种脂质溶液添加到10mL玻璃管中,在氮气流下除去溶剂并在真空下干燥6小时。通过用2.0ml包含过量卵清蛋白的25mM MOPS缓冲液pH8.5水合膜得到多层囊泡。使管涡旋直至脂质膜从管表面剥离。为了将多层囊泡分解成单层囊泡,应用了10个冷冻(液氮)和解冻(30℃水浴)的循环。然后,在25mM MOPS缓冲液pH 8.5中将样品稀释至1mla通过使10倍的样品通过200nm孔聚碳酸酯过滤器挤出来使所得脂质体的尺寸均质化。然后将所得的脂质体用于进一步的分析和生物测定。
以每剂提供30μg免疫调节剂的合成纳米载体剂量,初始每日向C57BL/6小鼠静脉内施用实施例9、10和12中公开的合成纳米载体,持续4天,然后在初始施用之后每月一次静脉内重复施用,持续6个月。在第0天、在每次临重复施用之前、以及在最后重复施用之后一周采集血样。
使用如上述实施例1中一般地阐述的KLH IgG ELISA方法对血样进行分析以建立KLH IgG效价。可以注意到不存在免疫抑制,如KLH IgG效价高于在重复施用合成纳米载体之后采集的一个或更多个样品中的背景所证明的。
然后,以基于小鼠和人之间的相对血容量缩放的剂量向人对象静脉内重复施用合成纳米载体。初始剂量是每日一次,持续三天。在初始施用之后,重复给药频率为以与初次剂量相同的剂量每月一次,持续6个月。监测人对象的受抑制免疫系统的机会性感染或其他症状的临床体征。
以经计算包含25mg/kg合成纳米载体的剂量,通过静脉内输注初始每日向雌性比格犬施用实施例11和13的合成纳米载体,持续两天,然后在初始施用之后以相同的剂量每月一次静脉内重复施用,持续6个月。在第0天、在每次临重复施用之前、以及在最后重复施用之后一周采集血样。
使用如上述实施例1中一般地阐述的KLH IgG ELISA方法对血样进行分析以建立KI,H IgG效价。可以注意到不存在免疫抑制,如KLH IgG效价高于在重复施用合成纳米载体之后采集的一个或更多个样品中的背景所证明的。
然后,以基于25mg/kg的重复施用比格犬剂量并基于比格犬和人之间的相对质量缩放的剂量将合成纳米载体静脉内重复施用于人对象。在初始施用之后,重复给药频率为每月一次,持续6个月。监测人对象的受抑制免疫系统的机会性感染或其他症状的临床体征。
以每剂提供30μg免疫调节剂的合成纳米载体剂量,初始每日向C57BL/6小鼠静脉内施用实施例9、10和12中公开的合成纳米载体,持续4天,然后在初始施用之后每月一次静脉内重复施用,持续6个月。将实施例7的重组人红细胞生成素(rHuEPO)修饰的mRNA与合成纳米载体伴随施用,特别是在每剂合成纳米载体的24小时内。施用充足的mmRNA以获得每毫升huEPO 10毫单位。在第0天、在每次临重复施用之前、以及在最后重复施用之后一周采集血样。
使用如上述实施例1中一般地阐述的KLH IgG ELISA方法对血样进行分析以建立KLH IgG效价。可以注意到不存在免疫抑制,如KLH IgG效价高于在重复施用合成纳米载体之后采集的一个或更多个样品中的背景所证明的。
然后,以基于小鼠和人之间的相对血容量缩放的剂量将合成纳米载体静脉内重复施用于人对象。以在人对象中获得每毫升huEPO 10至20毫单位的施用量伴随给药(在此实施方案中,在24小时内)编码rHuEPO(如上所述)的经修饰mRNA。初始剂量是每日一次,持续三天。在持续施用之后,重复给药频率为以与初始剂量相同的剂量每月一次,持续6个月。监测人对象的受抑制免疫系统的机会性感染或其他症状的临床体征。
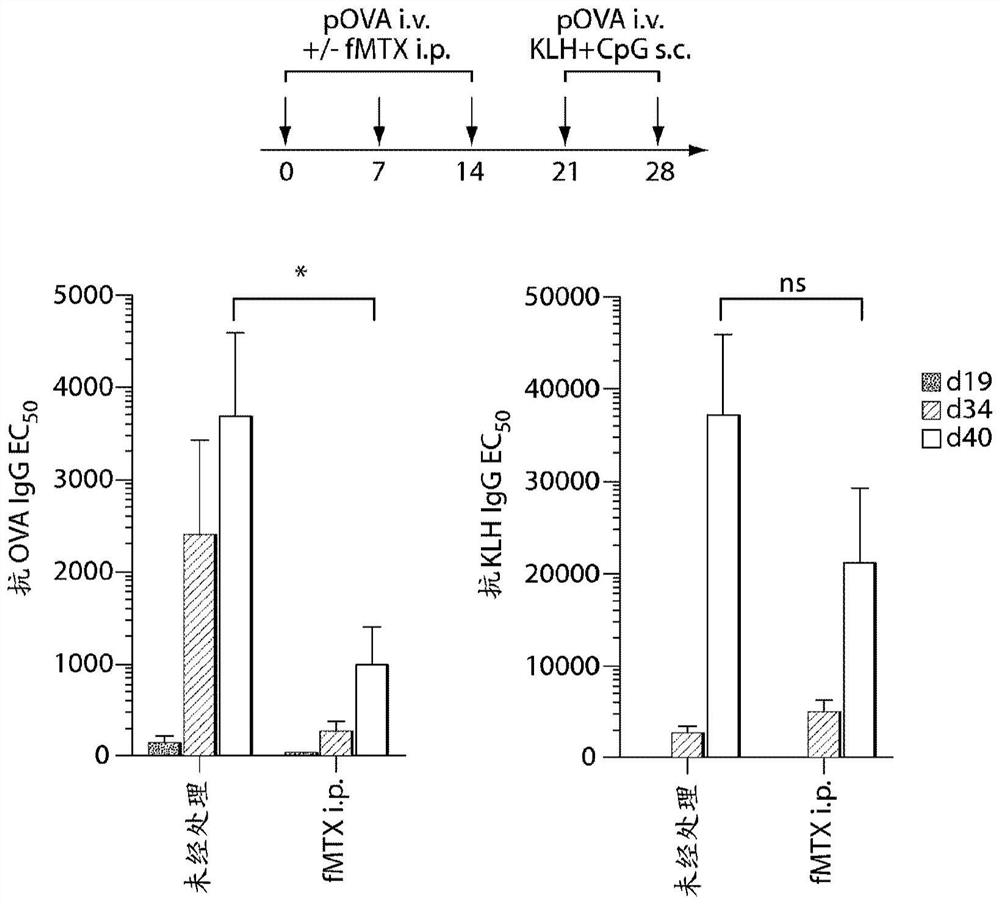
在尾静脉内,对年龄匹配的(5周至6周)雌性C57BL/6小鼠每周静脉内注射5次25μg免疫原性之鸡卵清蛋白的颗粒形式(pOVA)。在同一天以及随后的2天,使一组动物接受3次200μg MTX的腹膜内注射以及3次第一抗原注射。使未处理的组仅接受抗原而使处理组总计接受9次的MTX i.p.注射(第1至3天、第7至9天、第14至16天)。除了静脉内注射pOVA之外,在第4和第5注射日,在后肢内使所有动物皮下接受与2μg CpG混合的20μg钥孔林普贝血蓝蛋白(KLH)。
在不同的时间点,在这些动物的血液中监测抗-KLH和抗-OVA抗体应答。如图2所示,在不存在任何处理的情况下,动物发生针对OVA的稳健免疫应答。相比之下,MTX的施用封闭了抗体应答,并且甚至在5次抗原注射之后只检测到最小的效价。当在MTX处理后(从d21)注射KLH和CpG时,在所有组中可检测到稳健的抗-KLH应答。这些结果表明,MTX的免疫抑制作用在第21天之后提高,并且MTX注射的致耐受性作用局限于伴随施用的抗原(OVA)(而非在MTX处理期之后提供的抗原)。
因此,这些结果表明重复施用MTX和抗原的伴随注射可预防抗原特异性抗体的形成而不会导致免疫抑制。因此,证明该方案在重复施用后不诱导免疫抑制。
为了测试多次注射MTX是否可导致免疫耐受的建立,如下对年龄匹配的(5周至6周)雌性C57BL/6小鼠进行注射:在尾静脉内每周静脉内注射200μg钥孔林普贝血蓝蛋白(KLH),并在后肢内皮下注射与2μg CpG寡脱氧核苷酸(ODN)混合的25μg鸡卵清蛋白的颗粒形式(pOVA)。在最初的3次抗原注射下,使一组动物在同一天和随后的2天接受3次MTX的腹膜内注射。使所有动物接受5次抗原注射(d0、7、14、21和28),并使一组接受9次另外的MTXi.p.注射(第1至3天、第7至9天、第14至16天)。
在不同的时间点,在这些动物的血液中监测抗KLH和抗OVA应答。如图3所示,在不存在任何处理的情况下,动物发生针对KLH和OVA的稳健免疫应答,其可通过抗-KLH和抗-OVA IgG抗体效价进行测量。相比之下,MTX的施用封闭了者两种应答,并且甚至在5次抗原注射之后动物仍显示出低的效价。
因此,这些结果表明,重复施用MTX和抗原的伴随注射可预防抗原特异性抗体的形成而不会导致免疫抑制。在使用多于一种抗原并通过不同的途径进行施用均发现了这一结论。因此,证明该方案在重复施用后不诱导免疫抑制。
材料:
获得Im.iet马来酰亚胺激活的卵清蛋白(Thermoscientific,产品#77126,批次#OF185798,10mg)和ERY1肽(序列:Trp-Met-Val-Leu-Pro-Trp-Leu-Pro-Gly-Thr-Leu-Asp-Gly-Gly-Ser-Gly-Cys-Arg-Gly-NH2)(SEQ ID NO:1)(CSBio,产品#CSI1662,批号#M613,MW2001),TFA盐(6mg),超纯水和1x PBS缓冲液。
方法
将Imjet马来酰亚胺激活的OVA(10mg)溶解在2mL超纯水中。向该溶液中添加ERY1肽(6mg)在0.6mL超纯水中的溶液。将所得溶液在环境温度下搅拌1小时,然后在8℃下过夜。将稍微混浊的溶液用3mL 1xPBS稀释,并通过0.45微米的过滤器过滤。然后,用超纯水在10KD MWCO Amicon-15渗滤管中对滤液洗涤以除去过量的ERY1肽。然后,将浓缩物用超纯水稀释至1mg/mL浓度(约9mL)。最后,通过0.2微米的过滤器过滤溶液以得到ERY1-OVA缀合物溶液(1mg/mL,约9mL)。HPLC分析确定该材料为ERY1-OVA缀合物。
使用红细胞结合肽诱导CD8
通过特异性地与小鼠血型糖蛋白-A结合的经噬菌体展示发现的合成12-aa肽(ERY1)({Kontos,2013#8387})仅存在于红细胞上,并且可以与抗原缀合以靶向红细胞并诱导免疫耐受。不受任何特定的理论的限制,认为与红细胞的结合导致在红细胞再循环和更新期间将抗原作为自身抗原进行处理。
为了在施用与卵清蛋白(OVA)缀合的ERY1之后观察CD8
如图4所示,保持原初的动物在其淋巴结中具有约0.7×10
以下内容对应于母案申请中的原始权利要求书,现作为说明书的一部分并入此处:
1.一种方法,其包括:
确定在对象中不引起免疫抑制的用于重复施用抗原特异性免疫治疗剂的方案;以及
使用所述方案的一个或更多个要素向另一对象重复施用所述抗原特异性免疫治疗剂。
2.项1所述的方法,其中所述确定还包括证明所述方案的一个或更多个要素在所述对象中引起抗原特异性耐受。
3.项1或2所述的方法,其中所述抗原特异性免疫治疗剂包含外源性免疫调节剂。
4.项3所述的方法,其中所述外源性免疫调节剂包含:他汀类、mTOR抑制剂、TGF-β信号传导剂、TGF-β受体激动剂、组蛋白去乙酰化酶抑制剂、皮质类固醇、线粒体功能的抑制剂、P38抑制剂、NF-κβ抑制剂、凝集素受体配体、腺苷受体激动剂、前列腺素E2激动剂、磷酸二酯酶抑制剂、蛋白酶体抑制剂、激酶抑制剂、G蛋白偶联受体激动剂、G蛋白偶联受体拮抗剂、糖皮质激素、类视黄醇、细胞因子抑制剂、细胞因子受体抑制剂、细胞因子受体激活剂、过氧化物酶体增殖物激活受体拮抗剂、过氧化物酶体增殖物激活受体激动剂、组蛋白去乙酰化酶抑制剂、钙调神经磷酸酶抑制剂、磷酸酶抑制剂、氧化的ATP、IDO、维生素D3、环孢素A、芳香烃受体抑制剂、白藜芦醇、硫唑嘌呤、6-巯基嘌呤、阿司匹林、尼氟灭酸、雌三醇、雷公藤内酯、白介素、环孢素A或靶向细胞因子或细胞因子受体的siRNA。
5.项4所述的方法,其中所述外源性免疫调节剂包含雷帕霉素、麦考酚酸或CD22配体。
6.项1至5中任一项所述的方法,其中所述抗原特异性免疫治疗剂包含外源性抗原。
7.项6所述的方法,其中当所述抗原特异性免疫治疗剂还包含外源性免疫调节剂时,所述外源性抗原与外源性免疫调节剂不互相偶联,并且所述重复施用包括所述外源性抗原与外源性免疫调节剂的伴随重复施用。
8.项6或7所述的方法,其中所述外源性抗原包含治疗性蛋白质、经修饰的抗原或表达的抗原。
9.项8所述的方法,其中所述表达的抗原由经修饰的信使RNA表达。
10.项1至5中任一项所述的方法,其中所述抗原特异性免疫治疗剂产生针对内源性抗原的抗原特异性耐受。
11.项10所述的方法,其中所述内源性抗原包含自身抗原。
12.项11所述的方法,其中所述自身抗原包含见于以下中的那些:强直性脊柱炎、大疱性类天疱疮、类风湿关节炎、多发性硬化、糖尿病、湿疹、炎性肠病、狼疮或系统性红斑狼疮、多发性硬化、原发性胆汁性肝硬化、银屑病、结节病、系统性硬化、硬皮病、甲状腺炎、自身免疫性甲状腺疾病、桥本甲状腺炎、甲状腺毒症、斑秃、格雷夫斯病、吉-巴综合征、乳糜泻、舍格伦综合征、风湿热、胃炎自身免疫性萎缩性胃炎、自身免疫性肝炎、胰岛炎、卵巢炎、睾丸炎、葡萄膜炎、晶状体源性葡萄膜炎、重症肌无力、原发性黏液水肿、恶性贫血、原发性硬化性胆管炎、自身免疫性溶血性贫血、艾迪生病、硬皮病、古德帕斯丘综合征、肾炎、银屑病、寻常型天疱疮、类天疱疮、交感性眼炎、特发性血小板减少性紫癜、特发性白细胞减少、韦格纳肉芽肿病或多肌炎/皮肌炎。
13.项1或2所述的方法,其中所述抗原特异性免疫治疗剂包含外源性抗原,并且当在内源性免疫调节剂存在下施用时引起抗原特异性耐受。
14.项13所述的方法,其中所述内源性免疫调节剂包含参与凋亡或相关信号传导的物质和/或物质的组合、参与T细胞生物学或B细胞生物学的物质和/或物质的组合,或参与树突细胞生物学的物质和/或物质的组合。
15.项1至7中任一项所述的方法,其中所述重复施用发生在所述抗原特异性免疫治疗剂的初次剂量或先前的重复施用后1周至10年。
16.项15所述的方法,其中所述重复施用发生在所述抗原特异性免疫治疗剂的初次剂量或先前的重复施用后1周。
17.项15所述的方法,其中所述重复施用发生在所述抗原特异性免疫治疗剂的初次剂量或先前的重复施用后2周。
18.项14所述的方法,其中所述重复施用发生在所述抗原特异性免疫治疗剂的初次剂量或先前的重复施用后1至12个月。
19.项6、7和15至18中任一项所述的方法,其中当所述抗原特异性免疫治疗剂包含外源性抗原和外源性免疫调节剂时,所述外源性抗原通过不同于所述外源性免疫调节剂的途径重复施用。
20.项19所述的方法,其中所述重复施用包括伴随重复施用。
21.项6、7和15至18中任一项所述的方法,其中所述抗原特异性免疫治疗剂包含多于一种的外源性抗原。
22.项21所述的方法,其中当所述抗原特异性免疫治疗剂包含外源性抗原和外源性免疫调节剂时,所述外源性抗原通过不同于所述外源性免疫调节剂的途径重复施用。
23.项22所述的方法,其中所述重复施用包括伴随重复施用。
24.项1至6中任一项所述的方法,其中所述外源性抗原与外源性免疫调节剂互相偶联,并且其中所述外源性免疫调节剂包含ERY1肽。
25.项1至24中任一项所述的方法,其中所述抗原特异性免疫治疗剂使用所述方案的所有或基本上所有要素向另一对象重复施用。
26.项1至25中任一项所述的方法,其中所述抗原特异性免疫治疗剂包含与外源性免疫调节剂偶联的聚合物合成纳米载体。
27.项26所述的方法,其中基于所有所述聚合物合成纳米载体的平均值,与所述聚合物合成纳米载体连接的免疫调节剂的载量为0.1%至50%(重量/重量)。
28.项27所述的方法,其中所述载量为0.1%至20%(重量/重量)。
29.项26至28中任一项所述的方法,其中当所述抗原特异性免疫治疗剂包含外源性免疫调节剂和外源性抗原时,所述聚合物合成纳米载体还与所述外源性抗原偶联。
30.项26至28中任一项所述的方法,其中当所述抗原特异性免疫治疗剂包含外源性免疫调节剂和外源性抗原时,所述聚合物合成纳米载体与外源性抗原伴随施用。
31.项3至7中任一项所述的方法,其中所述外源性免疫调节剂的平均免疫调节剂载量为至少95%、97%、98%或99%(重量/重量)。
32.一种方法,其包括:
向对象重复施用包含抗原或免疫调节剂的抗原特异性免疫治疗剂,
其中根据方案的一个或更多个要素重复施用所述抗原或免疫调节剂,所述方案先前已表明在重复施用所述抗原或免疫调节剂后不诱导免疫抑制。
33.项32所述的方法,其中所述确定还包括证明所述方案的一个或更多个要素在所述对象中引起抗原特异性耐受。
34.项32或33所述的方法,其中所述抗原特异性免疫治疗剂包含外源性免疫调节剂。
35.项34所述的方法,其中所述外源性免疫调节剂包含:他汀类、mTOR抑制剂、TGF-β信号传导剂、TGF-β受体激动剂、组蛋白去乙酰化酶抑制剂、皮质类固醇、线粒体功能的抑制剂、P38抑制剂、NF-hβ抑制剂、凝集素受体配体、腺苷受体激动剂、前列腺素E2激动剂、磷酸二酯酶抑制剂、蛋白酶体抑制剂、激酶抑制剂、G蛋白偶联受体激动剂、G蛋白偶联受体拮抗剂、糖皮质激素、类视黄醇、细胞因子抑制剂、细胞因子受体抑制剂、细胞因子受体激活剂、过氧化物酶体增殖物激活受体拮抗剂、过氧化物酶体增殖物激活受体激动剂、组蛋白去乙酰化酶抑制剂、钙调神经磷酸酶抑制剂、磷酸酶抑制剂、氧化的ATP、IDO、维生素D3、环孢素A、芳香烃受体抑制剂、白藜芦醇、硫唑嘌呤、6-巯基嘌呤、阿司匹林、尼氟灭酸、雌三醇、雷公藤内酯、白介素、环孢素A或靶向细胞因子或细胞因子受体的siRNA。
36.项35所述的方法,其中所述外源性免疫调节剂包含雷帕霉素、麦考酚酸或CD22配体。
37.项32至36中任一项所述的方法,其中所述抗原特异性免疫治疗剂包含外源性抗原。
38.项37所述的方法,其中当所述抗原特异性免疫治疗剂还包含外源性免疫调节剂时,所述外源性抗原与外源性免疫调节剂不互相偶联,并且所述重复施用包括所述外源性抗原与外源性免疫调节剂的伴随重复施用。
39.项37或38所述的方法,其中所述外源性抗原包含治疗性蛋白质、经修饰的抗原或表达的抗原。
40.项39所述的方法,其中所述表达的抗原由经修饰的信使RNA表达。
41.项32至36中任一项所述的方法,其中所述抗原特异性免疫治疗剂引起针对内源性抗原的抗原特异性耐受。
42.项41所述的方法,其中所述内源性抗原包含自身抗原。
43.项42所述的方法,其中所述自身抗原包含见于以下中的那些:强直性脊柱炎、大疱性类天疱疮、类风湿关节炎、多发性硬化、糖尿病、湿疹、炎性肠病、狼疮或系统性红斑狼疮、多发性硬化、原发性胆汁性肝硬化、银屑病、结节病、系统性硬化、硬皮病、甲状腺炎、自身免疫性甲状腺疾病、桥本甲状腺炎、甲状腺毒症、斑秃、格雷夫斯病、吉-巴综合征、乳糜泻、舍格伦综合征、风湿热、胃炎自身免疫性萎缩性胃炎、自身免疫性肝炎、胰岛炎、卵巢炎、睾丸炎、葡萄膜炎、晶状体源性葡萄膜炎、重症肌无力、原发性黏液水肿、恶性贫血、原发性硬化性胆管炎、自身免疫性溶血性贫血、艾迪生病、硬皮病、古德帕斯丘综合征、肾炎、银屑病、寻常型天疱疮、类天疱疮、交感性眼炎、特发性血小板减少性紫癜、特发性白细胞减少、韦格纳肉芽肿病或多肌炎/皮肌炎。
44.项32或33所述的方法,其中所述抗原特异性免疫治疗剂包含外源性抗原,并且当在内源性免疫调节剂存在下施用时引起抗原特异性耐受。
45.项44所述的方法,其中所述内源免疫调节剂包含参与凋亡或相关信号传导的物质和/或物质的组合、参与T细胞生物学或B细胞生物学的物质和/或物质的组合、或参与树突细胞生物学的物质和/或物质的组合。
46.项32至38中任一项所述的方法,其中所述重复施用发生在所述抗原特异性免疫治疗剂的初次剂量或先前的重复施用后1周至10年。
47.项46所述的方法,其中所述重复施用发生在所述抗原特异性免疫治疗剂的初次剂量或先前的重复施用后1周。
48.项46所述的方法,其中所述重复施用发生在所述抗原特异性免疫治疗剂的初次剂量或先前的重复施用后2周。
49.项45所述的方法,其中所述重复施用发生在所述抗原特异性免疫治疗剂的初次剂量或先前的重复施用后1至12个月。
50.项37、38和46至49中任一项所述的方法,其中当所述抗原特异性免疫治疗剂包含外源性抗原和外源性免疫调节剂时,所述外源性抗原通过不同于所述外源性免疫调节剂的途径重复施用。
51.项50所述的方法,其中所述重复施用包括伴随重复施用。
52.项37、38和46至49中任一项所述的方法,其中所述抗原特异性免疫治疗剂包含多于一种的外源性抗原。
53.项52所述的方法,其中当所述抗原特异性免疫治疗剂包含外源性抗原和外源性免疫调节剂时,所述外源性抗原通过不同于所述外源性免疫调节剂的途径重复施用。
54.项53所述的方法,其中所述重复施用包括伴随重复施用。
55.项32至37中任一项所述的方法,其中所述外源性抗原与外源性免疫调节剂互相偶联,并且其中所述外源性免疫调节剂包含ERY1肽。
56.项32至55中任一项所述的方法,其中所述抗原特异性免疫治疗剂使用所述方案的所有或基本上所有要素向另一对象重复施用。
57.项32至56中任一项所述的方法,其中所述抗原特异性免疫治疗剂包含与外源性免疫调节剂偶联的聚合物合成纳米载体。
58.项57所述的方法,其中基于所有所述聚合物合成纳米载体的平均值,与所述聚合物合成纳米载体连接的免疫调节剂的载量为0.1%至50%(重量/重量)。
59.项58所述的方法,其中所述载量为0.1%至20%(重量/重量)。
60.项57至59中任一项所述的方法,其中当所述抗原特异性免疫治疗剂包含外源性免疫调节剂和外源性抗原时,所述聚合物合成纳米载体还与所述外源性抗原偶联。
61.项57至59中任一项所述的方法,其中当所述抗原特异性免疫治疗剂包含外源性免疫调节剂和外源性抗原时,所述聚合物合成纳米载体与外源性抗原伴随施用。
62.项34至38中任一项所述的方法,其中所述外源性免疫调节剂的平均免疫调节剂载量为至少95%、97%、98%或99%(重量/重量)。
63.一种组合物,其包含:
含有先前已在方案中证明在重复施用后不诱导免疫抑制的量的外源性抗原或外源性免疫调节剂的抗原特异性免疫治疗剂。
64.项63所述的组合物,其中所述抗原或免疫调节剂以还显示引起抗原特异性耐受的量存在。
65.项63或64所述的组合物,其中所述外源性免疫调节剂包含:他汀类、mTOR抑制剂、TGF-β信号传导剂、TGF-β受体激动剂、组蛋白去乙酰化酶抑制剂、皮质类固醇、线粒体功能的抑制剂、P38抑制剂、NF-κβ抑制剂、凝集素受体配体、腺苷受体激动剂、前列腺素E2激动剂、磷酸二酯酶抑制剂、蛋白酶体抑制剂、激酶抑制剂、G蛋白偶联受体激动剂、G蛋白偶联受体拮抗剂、糖皮质激素、类视黄醇、细胞因子抑制剂、细胞因子受体抑制剂、细胞因子受体激活剂、过氧化物酶体增殖物激活受体拮抗剂、过氧化物酶体增殖物激活受体激动剂、组蛋白去乙酰化酶抑制剂、钙调神经磷酸酶抑制剂、磷酸酶抑制剂、氧化的ATP、IDO、维生素D3、环孢素A、芳香烃受体抑制剂、白藜芦醇、硫唑嘌呤、6-巯基嘌呤、阿司匹林、尼氟灭酸、雌三醇、雷公藤内酯、白介素、环孢素A或靶向细胞因子或细胞因子受体的siRNA。
66.项65所述的组合物,其中所述外源性免疫调节剂包含雷帕霉素、麦考酚酸或CD22配体。
67.项63或64所述的组合物,其中所述外源性抗原包含治疗性蛋白质、经修饰的抗原或表达的抗原。
68.项67所述的组合物,其中所述表达的抗原由经修饰的信使RNA表达。
69.根据项63至68中任一项所述的组合物,其中所述抗原特异性免疫治疗剂包含聚合物合成纳米载体。
70.项63至69中任一项所述的组合物,其中所述抗原特异性免疫治疗剂还包含多于一种的外源性抗原。
71.项63至70中任一项所述的组合物,其中所述组合物为药盒。
72.一种制备抗原特异性免疫治疗剂的方法,其中所述方法包括以先前在方案中证明在重复施用后不诱导免疫抑制的量产生或获得外源性抗原或外源性免疫调节剂。
73.项72所述的方法,其中所述抗原特异性免疫治疗剂如前述项中任一项所限定。
74.项72或73所述的方法,其中所述方法还包括确定所述方案。
75.一种包含外源性免疫调节剂或外源性抗原的抗原特异性免疫治疗剂,其用于制备用于在对象中实现抗原特异性耐受但不诱导免疫抑制的药物。
76.项75所述的抗原特异性免疫治疗剂,其中所述抗原特异性免疫治疗剂如前述项中任一项所限定。
77.一种包含外源性免疫调节剂或外源性抗原的抗原特异性免疫治疗剂,其用于在对象中实现抗原特异性耐受但不诱导免疫抑制。
78.项77所述的抗原特异性免疫治疗剂,其中所述抗原特异性免疫治疗剂如前述项中任一项所限定。
79.一种抗原特异性免疫治疗剂,其用于项1至62中任一项所述的方法。
80.项79所述的抗原特异性免疫治疗剂,其中所述抗原特异性免疫治疗剂如前述项中任一项所限定。
- 非免疫抑制性抗原特异性免疫治疗剂的重复施用
- 非免疫抑制性抗原特异性免疫治疗剂的重复施用
