一株产具有抗氧化作用胞外多糖的德式乳杆菌、多糖、方法及其应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于微生物技术领域,涉及微生物学中的多糖,尤其是一株产具有抗氧化作用胞外多糖的德式乳杆菌、多糖、方法及其应用。
背景技术
乳酸菌(lactic acidbacteria,LAB)能在可利用的碳水化合物发酵过程中产生大量的乳酸。其代谢产物在食品、医药领域具有潜在的应用价值。乳酸菌主要代谢产物,诸如酸性代谢产物、胞外多糖、乳酸菌素、γ-氨基丁酸的特性及在调节机体免疫力、抗肿瘤、抗菌防腐等方面的作用引起了众多学者的关注。
乳酸菌胞外多糖(exopolysaccharide,EPS)是乳酸菌在生长代谢过程中分泌的一类糖类化合物。EPS广泛存在于动植物和微生物中,作为生命物质的重要组成成分,广泛参与细胞的各种生命现象及生理过程的调节。不断积累的证据表明,这些多糖及其缀合物既是通讯的信息分子,如抗原决定簇受体分子上的接受者;又是细胞间的识别分子,如病原体与寄主的作用;同时多糖类化合物又是一种免疫调节剂,能提高机体免疫功能,用于癌症的辅助治疗。已有研究证实,多糖类化合物可通过抗肿瘤、抗溃疡和降低血脂胆固醇等活性而对人类健康具有促进作用。
微生物来源的多糖具有抗衰老的活性,这类多糖可以提高机体对自由基的清除能力和抗氧化能力。多糖类物质具有阻止活性氧损伤细胞的功能,降低脂质过氧化物生成,提高超氧化物歧化酶、谷胱甘肽过氧化物酶活力。相对于合成抗氧化剂的安全隐患,乳酸菌EPS作为天然来源抗氧化剂有着得天独厚的优势。因此,寻找并提取一种具有抗氧化作用的EPS,具有非常广泛的应用前景。
目前,我国已有一些关于EPS抗氧化方面的专利公开文献,如CN 108330086 A公开了植物乳杆菌(Lactobacillus plantarum)Fullarton-H-SS18-33,能够显著提高生物抗氧化活性。但是,目前对于德式乳杆菌的胞外多糖在抗氧化方面的研究并未见到相关报道。
发明内容
本发明的目的在于克服现有技术的不足之处,提供一株产具有抗氧化作用胞外多糖的德式乳杆菌、多糖、方法及其应用。
本发明解决其技术问题所采用的技术方案是:
一株产具有抗氧化作用胞外多糖的德式乳杆菌(Lactobacillus Delbrueckii),所述德式乳杆菌的名称为:KY20,分类名称为:德式乳杆菌保加利亚亚种(Lactobacillusdelbrueckii subsp. bulgaricus),保藏编号为:CGMCC No.20084,保藏日期:2020年6月15日,北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,保藏单位为:中国微生物菌种保藏管理委员会普通微生物中心。
进一步地,所述德式乳杆菌在固体平板上菌落较小、呈圆形、乳白色、边缘整齐。
进一步地,所述德式乳杆菌来源于河套地区自制酸奶。
进一步地,所述德式乳杆菌具有较强的耐胆汁盐和耐酸能力。
进一步地,所述德式乳杆菌产生的胞外多糖是酸性多糖。
进一步地,所述德式乳杆菌胞外多糖经DEAE-FF离子交换柱进行不同浓度NaCl溶液分离后,所得多糖以0.1mol/LNaCl为洗脱剂时为主;
所述德式乳杆菌胞外多糖纯化后不存在或存在非常少量的核酸和蛋白质;
所述德式乳杆菌胞外多糖含有葡萄糖、羧基和存在分子间和分子内氢键;
所述德式乳杆菌胞外多糖具有抗氧化能力,通过对其总抗氧化能力的测定,其胞外多糖拥有显著的总抗氧化能力;且随着胞外多糖浓度的增强,所述德式乳杆菌的总抗氧化能力也随之增强。
进一步地,所述德式乳杆菌的基因序列为SEQ ID No.1。
如上所述的德式乳杆菌在制备具有抗氧化作用的药物和/或食品和/或保健品和/或化妆品和/或微生态制剂方面中的应用。
如上所述的德式乳杆菌产生的具有抗氧化作用胞外多糖。
如上所述的胞外多糖的提取纯化方法,包括如下步骤:
(1)德式乳杆菌KY20胞外多糖的提取
将活化好的德式乳杆菌KY20按3%-5%接种量接种到MRS液体培养基中,于37℃静置培养过夜;将发酵液于8000r/min,4℃离心20min,收集上清液,蒸发浓缩;向上清液中加入80%的三氯乙酸溶液至终浓度为4%,4℃静置24h,调pH至中性,8000r/min,4℃离心20min,收集上清;向上清液中加入3倍体积的预冷乙醇,4℃静置24h,8000r/min,4℃离心20min收集沉淀;将沉淀以少量蒸馏水溶解,再以预处理的透析袋于4℃透析48h,透析袋的截留分子量8000~14000Da,每8h换一次水,透析液真空冷冻后即为胞外多糖粗品;
(2)德式乳杆菌KY20胞外多糖的纯化
将色谱层析柱中装入DEAE-FF阴离子交换柱,用蒸馏水平衡过夜;胞外多糖粗品用蒸馏水溶解,上样,质量浓度为10mg/mL,分别用蒸馏水及0~0.5mol/LNaCl进行线性梯度洗脱,3mL/管分部收集,洗脱速率为1mL/min,逐管使用苯酚-硫酸法及紫外A280nm波长处检测多糖含量和蛋白质含量;按多糖含量值收集并合并单一峰组分,去离子水透析至无Cl
如上所述的胞外多糖在制备具有抗氧化作用的药物和/或食品和/或保健品和/或化妆品和/或微生态制剂方面中的应用。
本发明取得的优点和积极效果为:
1、本发明德式乳杆菌具有良好的酸和胆盐耐受能力,该菌产生的胞外多糖含有葡萄糖、羧基和存在分子间和分子内氢键,具有抗氧化的功能。所述的德式乳杆菌用于制备抗氧化的微生态制剂,具有非常广泛的应用前景。
2、本发明德氏乳杆菌具有高产胞外多糖的特性,产生的胞外多糖以酸性多糖为主,纯化后不存在或存在很少的核酸和蛋白质。
3、本发明德式乳杆菌,与植物乳杆菌SS18-33相比,其胞外多糖的总抗氧化能力更强;且随着胞外多糖浓度的增强,所述德式乳杆菌的总抗氧化能力也会更强。本发明德式乳杆菌产生的胞外多糖能够应用在药物、食品、保健品、化妆品的制备方面中,具有非常广泛的应用前景。
4、与专利公开文献CN 108330086A相比,本发明所提取的德式乳杆菌胞外多糖在达到上述植物乳杆菌菌株胞外多糖相同的总还原力吸光度值(A
附图说明
图1为本发明中德式乳杆菌KY20的生长曲线图;
图2为本发明中德式乳杆菌KY20的耐酸能力图;
图3为本发明中德式乳杆菌KY20的耐胆盐能力图;
图4为本发明中德式乳杆菌KY20粗多糖的DEAE-FF洗脱曲线图;
图5为本发明中德式乳杆菌KY20胞外多糖的紫外光谱扫描图;
图6为本发明中德式乳杆菌KY20纯多糖红外光谱图;
图7为本发明中德式乳杆菌KY20胞外多糖总还原能力图;
图8为本发明中德式乳杆菌KY20胞外多糖清除DPPH自由基能力图;
图9为本发明中德式乳杆菌KY20胞外多糖清除羟基自由基能力图;
图10为本发明中德式乳杆菌KY20胞外多糖总抗氧化能力图;
图11为本发明中德式乳杆菌KY20的菌落形态图。
具体实施方式
下面结合实施例,对本发明进一步说明,下属实施例是叙述性的,不是限定性的,不能以下述实施例来限定本发明的保护范围。
本发明中所使用的原料,如无特殊说明,均为常规市售产品,本发明中所使用的方法,如无特殊说明,均为本领域常规方法,本发明所用各物质质量均为常规使用质量。
一株产具有抗氧化作用胞外多糖的德式乳杆菌(Lactobacillus Delbrueckii),所述德式乳杆菌的名称为:KY20,分类名称为:德式乳杆菌保加利亚亚种(Lactobacillusdelbrueckii subsp. bulgaricus),保藏编号为:CGMCC No.20084,保藏日期:2020年6月15日,北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,保藏单位为:中国微生物菌种保藏管理委员会普通微生物中心。
较优地,所述德式乳杆菌在固体平板上菌落较小、呈圆形、乳白色、边缘整齐。
较优地,所述德式乳杆菌来源于河套地区自制酸奶。
较优地,所述德式乳杆菌具有较强的耐胆汁盐和耐酸能力。
较优地,所述德式乳杆菌产生的胞外多糖是酸性多糖。
较优地,所述德式乳杆菌胞外多糖经DEAE-FF离子交换柱进行不同浓度NaCl溶液分离后,所得多糖以0.1mol/LNaCl为洗脱剂时为主;
所述德式乳杆菌胞外多糖纯化后不存在或存在非常少量的核酸和蛋白质;
所述德式乳杆菌胞外多糖含有葡萄糖、羧基和存在分子间和分子内氢键;
所述德式乳杆菌胞外多糖具有抗氧化能力,通过对其总抗氧化能力的测定,其胞外多糖拥有显著的总抗氧化能力;且随着胞外多糖浓度的增强,所述德式乳杆菌的总抗氧化能力也随之增强。
较优地,所述德式乳杆菌的基因序列为SEQ ID No.1:
TGGGCATTGCAGACTTCCATGGTGTGACGGGCGGTGTGTACAAGGCCCGGGAACGTATTCACCGCGGCGTGCTGATCCGCGATTACTAGCGATTCCAGCTTCGTGCAGGCGAGTTGCAGCCTGCAGTCCGAACTGAGAACAGCTTTAAGAGATCCGCTTACCCTCGCGGGTTCGCTTCTCGTTGTACTGCCCATTGTAGCACGTGTGTAGCCCAGGTCATAAGGGGCATGATGACTTGACGTCATCCCCACCTTCCTCCGGTTTGTCACCGGCAGTCTCTTTAGAGTGCCCAACTTAATGATGGCAACTAAAGACAAGGGTTGCGCTCGTTGCGGGACTTAACCCAACATCTCACGACACGAGCTGACGACAGCCATGCACCACCTGTCTCTGCGTCCCCGAAGGGAACCACCTATCTCTAGGTGTAGCGCAGGATGTCAAGACCTGGTAAGGTTCTTCGCGTTGCTTCGAATTAAACCACATGCTCCACCGCTTGTGCGGGCCCCCGTCAATTCCTTTGAGTTTCAACCTTGCGGTCGTACTCCCCAGGCGGAGCGCTTAATGCGTTTGCTGCGGCACTGAGAACCGGAAAGTCCCCAACACCTAGCGCTCATCGTTTACGGCATGGACTACCAGGGTATCTAATCCTGTTCGCTACCCATGCTTTCGAGCCTCAGCGTCAGTTGCAGACCAGAGAGCCGCCTTCGCCACTGGTGTTCTTCCATATATCTACGCATTCCACCGCTACACATGGAATTCCACTCTCCTCTTCTGCACTCAAGAATGACAGTTTCCGATGCAGTTCCACGGTTGAGCCGTGGGCTTTCACATCAGACTTATCATTCCGCCTGCGCTCGCTTTACGCCCAATAAATCCGGACAACGCTTGCCACCTACGTATTACCGCGGCTGCTGGCACGTAGTTAGCCGTGACTTTCTGGTTGATTACCGTCAAATAAAGACCAGTTACTGCCTCTATCCTTCTTCACCAACAACAGAGCTTTACGATCCGAAAACCTTCTTCACTCACGCGGCGTTGCTCCATCAGACTTGCGTCCATTGTGGAAGATTCCCTACTGCTGCCTCCCGTAGGAGTTTGGGCCGTGTCTCAGTCCCAATGTGGCCGATCAGTCTCTCAACTCGGCTACGCATCATTGCCTTGGTAGGCCTTTACCCCACCAACTAGCTAATGCGCCGCGGGCTCATCCTAAAGTGACAGCTTACGCCGCCTTTCAAACTTGAATCATGCGATTCATGTTGTTATCCGGTATTAGCACCTGTTTCCAAGTGGTATCCCAGTCTTTAGGGCAGATTGCCCACGTGTTACTCACCCATCCGCCGCTAGCGTCCAACAAATCACCCCGAAGGGATC
如上所述的德式乳杆菌在制备具有抗氧化作用的药物和/或食品和/或保健品和/或化妆品和/或微生态制剂方面中的应用。
如上所述的德式乳杆菌产生的具有抗氧化作用胞外多糖。
如上所述的胞外多糖的提取纯化方法,包括如下步骤:
(1)德式乳杆菌KY20胞外多糖的提取
将活化好的德式乳杆菌KY20按3%-5%接种量接种到MRS液体培养基中,于37℃静置培养过夜;将发酵液于8000r/min,4℃离心20min,收集上清液,蒸发浓缩;向上清液中加入80%的三氯乙酸溶液至终浓度为4%,4℃静置24h,调pH至中性,8000r/min,4℃离心20min,收集上清;向上清液中加入3倍体积的预冷乙醇,4℃静置24h,8000r/min,4℃离心20min收集沉淀;将沉淀以少量蒸馏水溶解,再以预处理的透析袋于4℃透析48h,透析袋的截留分子量8000~14000Da,每8h换一次水,透析液真空冷冻后即为胞外多糖粗品;
(2)德式乳杆菌KY20胞外多糖的纯化
将色谱层析柱中装入DEAE-FF阴离子交换柱,用蒸馏水平衡过夜;胞外多糖粗品用蒸馏水溶解,上样,质量浓度为10mg/mL,分别用蒸馏水及0~0.5mol/LNaCl进行线性梯度洗脱,3mL/管分部收集,洗脱速率为1mL/min,逐管使用苯酚-硫酸法及紫外A 280nm波长处检测多糖含量和蛋白质含量;按多糖含量值收集并合并单一峰组分,去离子水透析至无Cl-检出,冷冻干燥得纯多糖。
如上所述的胞外多糖在制备具有抗氧化作用的药物和/或食品和/或保健品和/或化妆品和/或微生态制剂方面中的应用。
具体地,相关制备及检测如下:
实施例1:菌株的分离、纯化与鉴定
(1)菌株的分离纯化
以来源于河套地区的酸奶为样本,用无菌生理盐水10倍梯度稀释至10-6,取10-4、10-5、10-6三个梯度的稀释液100μl分别涂布于MRS固体平板上,37℃培养48h,挑选不同形态的菌落进行划线分离,直至得到菌落形态一致的纯的单菌落,挑取单菌落接种于5ml MRS液体培养基中,培养过夜,取800μl菌液加入200μl 60%甘油于-80℃保存。
(2)菌株的鉴定
将分离得到的菌株进行PCR扩增16S rDNA,PCR产物送到金唯智进行测序,将测序结果在EzBioCloud中进行核酸序列比对,得到德式乳杆菌1株,命名为德式乳杆菌KY20。
(3)培养
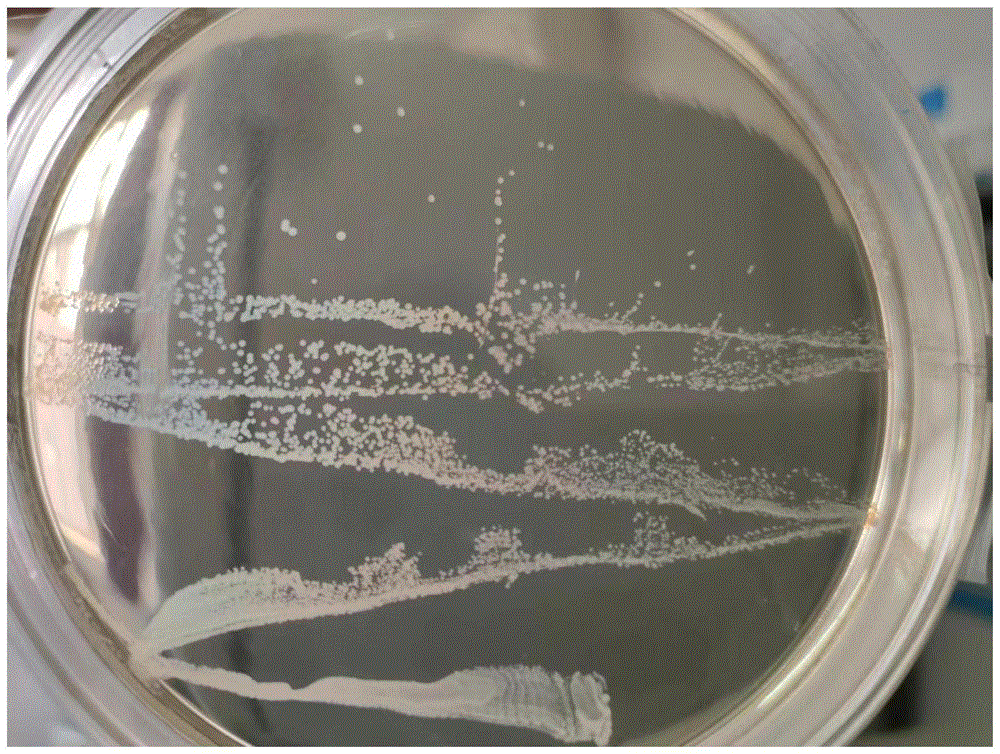
将德式乳杆菌接入MRS固体培养基上于37℃厌氧培养48h后,观察菌落形态较小、呈圆形、乳白色、边缘整齐。如图11所示。
实施例2:菌株的生长曲线
将实施例1中的德式乳杆菌接入MRS固体培养基上于37℃厌氧培养48h。挑取生长状态良好的单菌落接种至MRS液体培养基中进行活化,再以1%的接种量接种于MRS液体培养基中,静置培养24h,每小时取菌悬液测定OD600,并绘制德式乳杆菌的生长曲线。图1为德式乳杆菌KY20的生长曲线。4-9小时为该菌对数生长期,9小时后进入平稳期。
实施例3:德式乳杆菌KY20耐酸能力测定
将乳酸菌进行3次活化,放置37℃厌氧培养箱,过夜培养;将其菌体的浓度稀释到5×108CFU/mL,换置不同pH值的MRS培养基中,pH分别为2.0、3.0、4.0;将不同pH的菌液放置96孔板里,每一个实验组设置6个平行孔,需要设置阴性对照,其阴性对照为pH值为7的MRS,置于37℃厌氧培养箱中,培养时间为4h。将加入20μL的MTT(5mg/mL),放置厌氧培养箱4h。在酶联免疫检测仪测量490nm处各孔的吸光值(A实验组),并与阴性对照组吸光值(A对照组)对比,测定存活率。存活率计算公式如下:
存活率(%)=(A实验组)/(A对照组)×100式(1)
结果如图2所示,德式乳杆菌KY20在pH4条件下存活率为81.3±1.75%,具有较好的耐酸性。
实施例4:德式乳杆菌KY20耐胆盐能力测定
将乳酸菌进行3次活化,放置37℃厌氧培养箱,过夜培养;将其菌体的浓度稀释到5×108CFU/mL,换置不同胆盐浓度的MRS培养基中,胆盐的浓度为0.1%(w/v)、0.2%(w/v)、0.3%(w/v);采用实施例1中的方法测定存活率。上述百分数均为质量浓度。
结果如图所示,结果如图3所示,德式乳杆菌KY20在0.3%胆盐条件下存活率为51.6%±1.18,具有较好的胆盐耐受能力。
实施例5:德式乳杆菌KY20胞外多糖的提取与纯化
(1)德式乳杆菌KY20胞外多糖的提取
将活化好的德式乳杆菌KY20按3%-5%接种量接种到MRS液体培养基中,于37℃静置培养过夜。将发酵液于8000r/min,4℃离心20min,收集上清液,蒸发浓缩;向上清液中加入80%的三氯乙酸溶液至终浓度为4%,4℃静置24h,调pH至中性,8000r/min,4℃离心20min,收集上清;向上清液中加入3倍体积的预冷乙醇,4℃静置24h,8000r/min,4℃离心20min收集沉淀;将沉淀以少量蒸馏水溶解,再以预处理的透析袋(截留分子量8000~14000Da)于4℃透析48h,每8h换一次水,透析液真空冷冻后即为胞外多糖粗品。
(2)德式乳杆菌KY20胞外多糖的纯化
将规格为2.6cm×50cm色谱层析柱中装入DEAE-FF阴离子交换柱中,用蒸馏水平衡过夜。粗多糖用蒸馏水溶解,上样(质量浓度为10mg/mL,上样量80mg),分别用蒸馏水及0~0.5mol/LNaCl进行线性梯度洗脱,3mL/管分部收集,洗脱速率为1mL/min,逐管使用苯酚-硫酸法及紫外A280nm波长处检测多糖含量和蛋白质含量。按多糖含量值收集并合并单一峰组分,去离子水透析至无Cl-检出,冷冻干燥得纯多糖。图4为粗多糖的DEAE-FF洗脱曲线。
由图可知,经DEAE-FF离子交换树脂进行不同浓度NaCl溶液分离后,得到以0.1mol/L NaCl为洗脱剂时的单一峰,说明德式乳杆菌粗多糖中以酸性多糖为主。
实施例6:德式乳杆菌KY20胞外多糖总含量测定
采用苯酚-硫酸法测定多糖的含量。称取葡萄糖50mg于100mL容量瓶中,加水溶解;在新的100mL容量瓶中分别吸取0、0.2、0.4、0.6、0.8、1.0、1.2mL溶解的葡萄糖溶液,加蒸馏水至2mL,加入6%苯酚1mL和浓硫酸5mL,振荡摇匀,沸水浴中加热15min显色,冷却后用紫外分光光度计测OD 490nm处的吸光值,用水作为空白对照,制得标准曲线,横坐标为多糖微克数,纵坐标为OD 490nm处的吸光值。测定样品的OD 490nm值,根据标准曲线获得多糖的含量。
将活化好的德氏乳杆菌KY20按3%-5%接种量接种到MRS液体培养基中,于37℃静置培养。分别于4h、8h、12h、18h、24h取发酵液上清测定多糖的含量。相关检测结果如下:
实施例7:德式乳杆菌KY20胞外多糖结构分析
(1)紫外光谱分析
多糖用双蒸水配制成0.5mg/mL的溶液,用0.22μl滤膜过滤后进行紫外光谱扫描(波长190~400nm),样品流速为0.5ml/min。
结果如图5所示,可以看出,纯化后的多糖在220nm-400nm波长范围内,没有出现核酸(260nm)和蛋白质(280nm)的明显特征吸收峰,说明不存在或存在非常少量的核酸和蛋白质。
(2)红外光谱分析
取EPS纯品干粉1mg,KBr压片,400~4000cm
实施例8:德式乳杆菌KY20的总还原能力测定
采用Fe3+还原能力测定的方法。制备不同浓度的样液,分别取1mL于试管中,加入25mLpH=6.6的磷酸盐缓冲液(PBS),摇匀后加入25mL1%铁氰化钾溶液,充分混匀后于50℃反应2min。再加入2.5mL10%三氯乙酸溶液,3000r/min离心10min。取上清液5mL,并加入5mL蒸馏水和1mL0.1%三氯化铁溶液,反应30min后,于700nm处测吸光值(A
总氧化能力:(A
还原能力:A
还原能力%:(A
表1
表2
表1为CN 108330086 A公开的植物乳杆菌(Lactobacillusplantarum)Fullarton-H-SS18-33胞外多糖总还原力,表2为本发明提取的德式乳杆菌KY20胞外多糖总还原力;结果显示:对于植物乳杆菌S18-33胞外多糖,当A
结果如图7所示,所述德式乳杆菌KY20菌,随着胞外多糖浓度的增强,所述德式乳杆菌的总还原能力也会更强。
实施例9:DPPH自由基清除能力测定
配制不同浓度的样液,分别取4mL于试管中,加入4mL 0.15mmol/L的DPPH乙醇溶液,混匀后避光静置30min,于517nm处测其吸光值(A1);以无水乙醇作为参比液测其吸光值(A0);取样品与等体积无水乙醇混合(不加入其它试剂),测其吸光值(A2)。每个样品试验3次,取平均值。
DPPH自由基清除率=[A
A
如图8所示,结果显示,所述德式乳杆菌DPPH自由基清除能力随胞外多糖浓度增大随之增强。说明抗氧化能力随浓度增大随之增强。
实施例10:水杨酸法羟基自由基清除能力测定
配制不同浓度的样液,分别取2mL于试管中,加入6mmol/LFeSO
羟基自由基清除率=[A
A
如图9所示,结果显示,所述德式乳杆菌羟基自由基清除能力随浓度增大随之增强。说明抗氧化能力随浓度增大随之增强
实施例11:总抗氧化能力测定
使用总抗氧化能力(T-AOC)检测试剂盒。操作如下:
1、分光光度计预热30min以上,调节波长至593nm,蒸馏水调零。
2、标准溶液的制备:将40μmol/mL标准溶液用蒸馏水稀释为0.1、0.05、0.025、0.0125、0.0625、0.003125μmol/mL标准溶液备用。
3、分别取500μL标准溶液(蒸馏水作空白)加入500μL试剂二,充分混匀,反应10min,测定593nnm下的吸光度,计算ΔA标准=A标准-A空白,此时Fe2+终浓度为0.05、0.025、0.0125、0.00625、0.003125、0.00156μmol/mL。标准曲线只需做1-2次。
4、配制不同浓度的样液,分别取30μL于试管中,加入900μL的混合液,再加入90μL的蒸馏水,充分混匀,室温准确反应10min,取1mL于1mL玻璃比色皿中测定593nm下的吸光度,计算ΔA测定=A测定-A空白,空白管只需测1-2次。蒸馏水做空白对照。
总抗氧化能力(μmol/mL)=x×V反总÷V样=34×x
V样总:加入提取液体积,1mL;V反总:反应总体积,1.02mL;V样:反应中样本体积,0.03mL。
如图10所示,结果显示,所述德式乳杆菌总过氧化能力随浓度增大随之增强。与其他抗氧化指标一致。
尽管为说明目的公开了本发明的实施例,但是本领域的技术人员可以理解:在不脱离本发明及所附权利要求的精神和范围内,各种替换、变化和修改都是可能的,因此,本发明的范围不局限于实施例所公开的内容。
