一种直接利用空气快速培养微藻的方法
文献发布时间:2024-04-18 19:44:28
技术领域
本发明属于微藻培养技术领域,具体涉及一种直接利用空气快速培养微藻的方法。
背景技术
微藻是一类光合自养的微生物,能够利用太阳能,固定二氧化碳合成一系列的有机物,进而可开发为生物能源、食品或化工原料等。当前,微藻培养的方式有两种类型:一种是开放式跑道池模式,一种为封闭式反应器模式。在使用开放式跑道池大规模培养微藻时,碳源的补充一般采取高纯度二氧化碳池底原位补充或在微藻采收时离线补充的方式;在使用封闭式反应器大规模培养微藻时,碳源一般在气液交换单元以高纯度二氧化碳或者以与空气混合后的一定浓度比例的二氧化碳的形式补充。由于微藻培养过程中,高纯度二氧化碳成本高、同时气液传质时气态二氧化碳吸收率低,导致微藻培养的成本高,不利于微藻生物质的商业化推广和应用。
专利CN201210138598.1从延长气液接触时间和增加气液接触面积的角度出发,发明了在开放池中原位补充二氧化碳的阱式补碳技术,该技术强化了气液传质过程,大幅度提高了二氧化碳的吸收率。专利201510208119.2和文献(Garam Kim,WookjinChoi,Chang-HeeLee,KisayLee,Enhancementofdissolvedinorganic carbonandcaronfixationbygreenalgaScenedesmussp.inthepresenceof alkanolamineCO
在微藻固定二氧化碳的过程中,经历了气液交换和生物转化两个过程。前者为化学吸收过程。后者是碳源进入细胞的生物过程,主要有两种方式:其一是溶解态二氧化碳靠藻细胞内外浓度差被动吸收跨膜进入细胞;其二是溶解态二氧化碳在胞外碳酸酐酶的作用下水解为碳酸氢根,由膜蛋白主动运输进入细胞。在大多数经济微藻适宜生长的近中性pH值条件下,胞外碳酸酐酶活性低,碳源的生物转化主要靠被动吸收,此时微藻固定二氧化碳的全过程的限制步骤在气液交换环节,也即气体二氧化碳供应越充分,微藻生长的越快。基于此,现有技术中采用以二氧化碳作为微藻培养的碳源,导致生产成本较高且培养过程中二氧化碳的利用率较低。
因此,如何实现以空气作为微藻培养的碳源,如何提高胞外碳酸酐酶在近中性pH值条件下的酶活量,进而可加快碳源的跨膜转运过程,提高气液两相的二氧化碳浓度差,以此加快微藻培养过程中的碳源化学吸收和生物转化过程的相关研究是很有必要的。
发明内容
本发明的目的是为了克服当前微藻生成过程中碳源消耗量大、成本高的问题,提供一种直接利用空气快速培养微藻的方法。
为实现上述目的,本发明采用以下技术方案:一种直接利用空气快速培养微藻的方法,包括以下具体步骤:
(1)培养短小芽孢杆菌:配置培养基并调节pH值,对培养基进行高压灭菌,然后将其冷却,并接种短小芽孢杆菌进行培养;
(2)获取细菌细胞:对步骤(1)中培养的菌液进行离心作业,弃掉上清液,取出下方的细菌沉淀,并用灭菌水洗涤多次,获取细菌细胞待用;
(3)制备包埋固定化菌球:将海藻酸钠和液体石蜡用加热后的灭菌水进行溶解,充分混合均匀,温度降低至室温时加入缓冲液,混合均匀得到包埋液;在包埋液中加入细菌细胞,混合均匀得到固定菌液;将制备好的固定菌液滴入预冷过的氯化钙溶液中,制成固定化菌球;固定化结束后,将菌球过滤取出,再用灭菌水冲洗多次,得到形状稳定的固定化菌球备用;
(4)微藻培养:采用封闭式微藻反应器进行微藻培养,在反应器中添加培养基并进行消毒,将微藻藻种接种至培养基中,为反应器提供光源,并向反应器内通入空气与培养液混合开始进行微藻培养;在进行培养过程中向反应器内添加固定化菌球;每天检测微藻细胞的密度,并检测添加固定化菌球前后的胞外碳酸酐酶的活性,培养完成后收集微藻。
进一步地,步骤(1)中采用的培养基为LB培养基,调节pH值至7.0;高压灭菌时温度为121℃,灭菌时间为20min;接种短小芽孢杆菌时,细菌浓度为1-5v/v,短小芽孢杆菌的培养条件为26℃在恒温条件下、50-150转/分钟振荡培养,培养时长为12-24h。
进一步地,步骤(2)中离心作业时离心机转速为5000-7000转/分钟,离心时间为5min。
进一步地,步骤(3)中溶解海藻酸钠和液体石蜡的灭菌水温度为90℃;加入细菌细胞时,所述包埋液的温度为26℃;所述缓冲液为50mMTris缓冲液;所述氯化钙溶液的质量分数为5%,预冷后的氯化钙溶液温度为5℃;固定化菌球的固定化时间为4-24h。
进一步地,步骤(4)中所述微藻藻种的个数与所述固定化菌球固定的细菌个数的比为1:(0.1-10)。
进一步地,步骤(4)中箱反应器内添加固定化菌球的时间为开始进行微藻培养后的第三天。
本发明的有益效果:本发明将能够大量分泌胞外碳酸酐酶的短小芽孢杆菌固定化,添加到微藻培养液中,细菌利用微藻生长产生的胞外分泌物作为营养物质进行繁殖,同时产生胞外碳酸酐酶,能够提高微藻培养液中的酶活性,加快碳源的跨膜转运过程,加快微藻的生长;且本发明中添加短小芽孢杆菌固定化菌球,当碳源的跨膜转运速度加快后,同时降低培养液中溶解态二氧化碳的浓度,形成气液两相的二氧化碳浓度差,进而促进空气中二氧化碳向微藻培养液中传质的速率,当培养液中溶解态二氧化碳的浓度小于空气中二氧化碳的液态平衡浓度时,则可实现直接以空气为碳源,大规模培养微藻。
附图说明
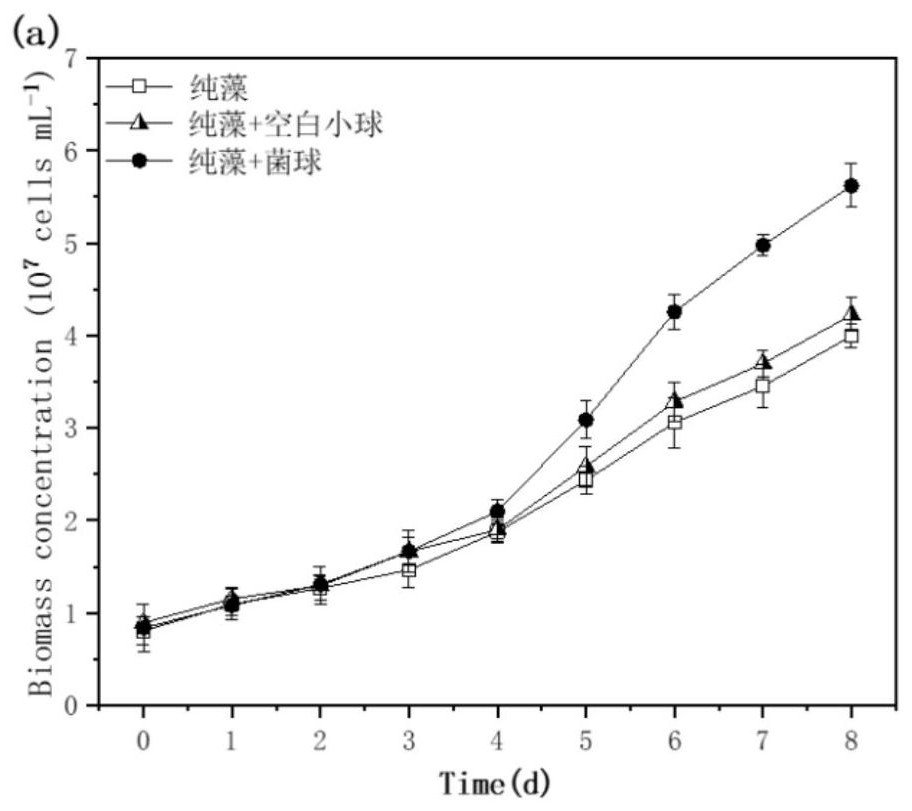
图1为实施例1和对比例1的胞外胞外碳酸酐酶活性、微藻细胞浓度;
图2为实施例2和对比例2的胞外胞外碳酸酐酶活性、微藻细胞浓度;
具体实施方式
以下将结合实施例对本发明的技术方案进行进一步地说明,以期本领域技术人员能够更清楚地理解本技术方案的内容。
实施例1:
本实施例中采用LB培养基培养短小芽孢杆菌,首先配置培养基后调节pH值至7.0左右;然后培养基进行121℃、20min的高压灭菌,培养基冷却至室温后,按照1v/v的细菌浓度接种;26℃在恒温条件下、50-150转/分钟振荡培养至胞外碳酸酐酶活性最高,一般培养12-24h。
将培养得到的菌液在5000-7000转/分钟的条件下离心5分钟,弃掉上清,留下细菌沉淀用灭菌水洗涤2-3次,获得细菌细胞待用,按照以下固定化包埋菌球的配方准备材料。
具体的包埋步骤是:将海藻酸钠和液体石蜡用90℃的灭菌水进行溶解,充分混合均匀,温度降至室温时加入Tris缓冲液,混合均匀;用水浴控制包埋液温度为26℃,加入30mg细菌细胞,混合均匀;用注射器将制备好的固定菌液滴入预冷至5℃的浓度为5wt%的氯化钙溶液中,制成固定化菌球,固定化时间为4-24小时,优选12小时;固定化结束后,将菌球用无菌纱布过滤取出,再用灭菌水冲洗2-3次,得到形状稳定的固定化菌球备用。
在室内采用柱状玻璃光生物反应器(高50cm,内径6cm)进行微藻的培养,使用本领域常见的曝气石(孔径为30-60μm),由8只灯管提供光强为100光量子密度的光照。藻种为二形栅藻,以BG11为培养基培养,培养体积为1L。使用空调控制室温为26℃,24小时持续通入空气驱动培养液混合,空气流量为180mL/min;培养至第三天时,按照反应器内的微藻藻种的个数与固定化菌球固定的细菌个数的1:(0.1-10)的比例添加固定化菌球。
微藻初始接种浓度为8.0×10
本实施例中培养二形栅藻时,培养第2天,反应器内培养液中的胞外碳酸酐酶活性为3.0U/mL;而培养第7天,培养液的胞外碳酸酐酶活性为4.3U/mL。培养至第8天后,采收微藻,本实施例中的微藻细胞浓度为5.62×10
对比例1:
对比例1为实施例1的空白对照组,也即微藻培养条件相同,只是对比例1中在反应器内添加空白小球,而非固定化菌球。
空白小球的制备步骤为:将海藻酸钠和液体石蜡用90℃的灭菌水进行溶解,充分混合均匀,温度降至室温时加入Tris缓冲液,混合均匀;用注射器将混合液体滴入预冷至5℃的浓度为5wt%的氯化钙溶液中,制成空白小球,固定化时间为4-24小时,优选12小时;固定化结束后,将菌球用无菌纱布过滤取出,再用灭菌水冲洗2-3次,得到形状稳定的空白小球备用。本步骤中的各组分的量与实施例1的相同。
按照实施例1中微藻培养方法在柱状玻璃光生物反应器进行二形栅藻的培养。同样地测定胞外碳酸酐酶的活性及细胞的生物量和油脂含量。
对比例1中,培养第二天测定反应器中培养液的胞外碳酸酐酶活性与实施例1一致,为3.0U/mL。而培养第7天,反应器中培养液的胞外碳酸酐酶活性为3.2U/mL。培养至第8天后,采收微藻,微藻细胞浓度为4.00×10
根据上述结果可以得出如下结论:实施例1与对比例1相比,实施例1中固定化菌球的添加促使胞外碳酸酐酶的活性提高了34.4%,生物量浓度提高了40.5%。此结果说明,固定化菌球的添加提高了胞外碳酸酐酶的活性,进而促进了二形栅藻的生长,由于在此过程中没有额外碳源的添加,仅仅是吸收空气中的二氧化碳作为碳源,说明在通过共培养细菌加富表达胞外碳酸酐酶时,可以直接以空气作为碳源培养二形栅藻。
实施例2:
本实施例与实施例1相比,将藻种改为小球藻,其他的条件和步骤均与实施例1相同。本实施例中培养第2天,反应器内培养液的胞外碳酸酐酶活性均为2.9U/mL;而培养第7天,培养液的胞外碳酸酐酶活性为3.9U/mL。培养至第8天后,采收微藻,本实施例中培养液的微藻细胞浓度为5.39×10
对比例2:
对比例2为实施例2的空白对照组,也即微藻培养条件相同,只是对比例2中在反应器内添加空白小球,而非固定化菌球。具体的空白小球的制备步骤与对比例1相同。按照实施例2中微藻培养方法在柱状玻璃光生物反应器进行小球藻的培养。同样地测定胞外碳酸酐酶的活性及细胞的生物量和油脂含量。
对比例2中,培养第二天测定反应器中培养液的胞外碳酸酐酶活性与实施例2一致,为2.9U/mL。而培养第7天,反应器中培养液的胞外碳酸酐酶活性为3.1U/mL。培养至第8天后,采收微藻,微藻细胞浓度为4.10×10
根据上述结果可以得出如下结论:实施例2与对比例2相比,实施例2中固定化菌球的添加促使胞外碳酸酐酶的活性提高了25.8%,生物量浓度提高了31.5%。
此结果说明,固定化菌球的添加提高了胞外碳酸酐酶的活性,进而促进了小球藻的生长,由于在此过程中没有额外碳源的添加,仅仅是吸收空气中的二氧化碳作为碳源,说明在通过共培养细菌加富表达胞外碳酸酐酶时,可以直接以空气作为碳源培养小球藻。
- 利用自絮凝微藻收获城市污水培养系统中产油微藻的方法
- 一种促进微藻藻体快速积累油脂的方法
- 用于微藻高密度培养的灭菌培养基,和空气压缩机、空气冷却器、二氧化碳自动供应装置、密封垂直光生物反应器、收获装置、干燥装置,且其特征在于提供二氧化碳生物质转化和固定及利用其进行空气和水的净化方法
- 一种利用污泥提取液耦合CO2定向培养富集高价值微藻生物质的方法及定向培养微藻装置
