一种N-芳基-N-芳炔丙基-芳乙酰胺类化合物及制药用途
文献发布时间:2024-04-18 19:52:40
技术领域
本发明涉及化学医药领域,具体涉及一种N-芳基-N-芳炔丙基-芳乙酰胺类化合物及制药用途,是作为POLQ共价抑制剂的芳乙酸酰胺类化合物以及所述化合物的制备方法和用途。
背景技术
DNA双链损伤修复(DSBs)对基因组稳定和细胞存活至关重要。DSBs修复途径主要有三种:同源重组(HR)、非同源末端连接(NHEJ)和微同源介导末端连接(MMEJ)。HR修复是一种高保真、无差错的DSBs修复途径,HR功能失调会造成细胞基因组不稳定并导致肿瘤发生。HR缺失在妇科肿瘤中尤为常见,约占所有妇科肿瘤的10%。在HR缺失背景下,DNA聚合酶theta(POLQ/Pol theta/POLθ)介导的微同源介导末端连接(MMEJ)修复途径是重要的备份修复途径。多项研究证明,抑制Pol theta与HR缺失存在合成致死效应。因此,POLQ是治疗HR缺失肿瘤的潜在DNA损伤修复靶点。
目前,已经有多个靶向POLQ聚合酶结构域的小分子抑制剂被报道。其中,ART4215是唯一一个进入临床开发阶段的口服特异性小分子POLQ抑制剂,但结构尚未公开。截止目前,所有已报道的Pol theta抑制剂均为非共价可逆抑制剂(Maria Chiara Pismataro,Andrea Astolfi,et.Small Molecules Targeting DNA Polymerase Theta(POLθ)asPromising Synthetic Lethal Agents for Precision CancerTherapy.J.Med.Chem.2023).,尚无共价抑制剂被发明报道。共价抑制剂在与靶标蛋白结合的同时,能够与结合位点附近靶标蛋白上的亲电性氨基酸残基生成共价键,相比于非共价抑制剂,共价抑制剂具有药效强、作用时间长、特异性强等一系列优点。而POLQ聚合酶结构域变构口袋内就存在具有亲电性质的半胱氨酸残基(Cys2411),满足开发共价抑制剂的条件。
基于此,设计开发一种具有药效强、成药性优良的POLQ共价抑制剂有重要的研究意义和应用价值。
发明内容
本发明的目的在于克服POLQ共价抑制剂的缺乏,提供一种N-芳基-N-芳炔丙基-芳乙酰胺类化合物,是一种作为POLQ共价抑制剂的具有芳乙酸酰胺类结构的化合物。
本发明提供的N-芳基-N-芳炔丙基-芳乙酰胺类化合物,或其前药、互变异构体、立体异构体、溶剂化物、同位素衍生物或其药学上可接受的盐,其结构通式如式Ⅰ所示:
其中,X选自CH或N;
R
R
Ar为苯环或芳杂环,包括噻唑环、吡唑环、吡啶环、嘧啶环、哒嗪环、吡嗪环;
R
n选自0,1,2,3;
R
L选自但不限于
进一步地,通式I所述的化合物、或其前药、互变异构体、立体异构体、溶剂化物、同位素衍生物或其药学上可接受的盐;
其中:X优选自CH或N;
R
R
Ar优选自苯环、吡啶环、嘧啶环、哒嗪环、吡嗪环;
n优选自0,1;
R
L优选自
进一步地,所述化合物选自如下结构:
本发明所示的式I化合物的制备方法通过以下步骤实现,所述化合物包括其前药、互变异构体、立体异构体、溶剂化物、同位素衍生物或其药学上可接受的盐的制备方法。
所述化合物通过下述步骤制备:
步骤1:化合物A与溴丙炔在强碱作用下发生亲核取代反应,得到化合物B;
步骤2:化合物B与化合物C发生酸胺缩合反应,得到化合物D;
步骤3:化合物D和化合物E发生Sonogashira偶联反应,得到化合物F;
步骤4:化合物F与酸在缩合剂、有机碱的条件下发生缩合反应,即得式I所示结构的化合物。
其中,R
本发明还提供一种药用组合物,其包含本发明所示式I所示的化合物,或其前药、互变异构体、溶剂化物、同位素衍生物或其药学上可接受的盐。
本发明还提供一种药用组合物,其包含本发明所示式I所示的化合物,或其前药、互变异构体、溶剂化物、同位素衍生物或其药学上可接受的盐,以及药学上可接受的辅料。
本发明的第二个目的是提供本发明所示式I所示的化合物,或其前药、互变异构体、立体异构体、溶剂化物、同位素衍生物或其药学上可接受的盐在制备治疗由POLQ介导的疾病的药物中的用途。
体外酶活抑制活性研究显示,本发明化合物对POLQ酶具有较强的抑制作用,可作为治疗POLQ介导的疾病的前景化合物。进一步研究表明,典型化合物I-1、I-13、I-25对POLQ酶具有相当持久的抑制活性和良好的细胞活性。
本发明化合物或其药学上可接受的盐的给药可以以纯的形式或适宜的药物组合物的形式通过提供类似用途的药物的任何可接受的给药方式来进行。本发明的药物组合物可通过将本发明的化合物与适宜的药学上可接受的辅料相组合而制备。本发明的药物组合物可配制成固态、半固态、液态或气态制剂。
在一些实施例中,所述POLQ介导的疾病为癌症或肿瘤相关疾病。
进一步地,本发明提供的用途,其中所述癌症或肿瘤包含实体瘤和血液瘤:所述实体瘤包含乳腺癌、结直肠癌、宫颈癌、卵巢癌、前列腺癌、胃癌(包含胃肠结合部癌症)、食管癌、头颈部癌、肺癌:所述血液瘤包含淋巴瘤和白血病。
本发明的目的还包括提供一种预防和/或治疗由POLQ介导的疾病的方法,其包括向患者施用治疗有效剂量的通式I所示的化合物,或其前药、互变异构体、立体异构体、溶剂化物、同位素行生物或其药学上可接受的盐或本发明所述药物组合物:进一步地,所述POLQ介导的疾病为癌症或肿瘤相关疾病:进一步地,本发明提供的用途,其中所述癌症或肿瘤包含实体瘤和血液瘤:所述实体瘤包含乳腺癌、结直肠癌、宫颈癌、卵巢癌、前列腺癌、、胃癌(包含胃肠结合部癌症)、食管癌、头颈部癌、肺癌:所述血液瘤包含淋巴瘤和白血病。
本发明的通式I所示的化合物,或其前药、互变异构体、立体异构体、溶剂化物、同位素衍生物或其药学上可接受的盐可与另外的一种、两种或多种用于治疗癌症或肿瘤的抗癌剂或免疫检查点调节剂组合施用。
进一步地,所述另外的用于治疗癌症或肿瘤的抗癌剂或免疫检查点调节剂包含PARP抑制剂、ATR抑制剂、ATM抑制剂、WEEI抑制剂、拓扑异构酶抑制剂以及DNA损伤类化疗药。
进一步地,所述DNA损伤类化疗药包含顺铂、博莱霉素、吉西他滨、多西他赛:所述拓扑异构酶抑制剂包含依托泊苷、伊立替康。
本发明的通式I所示的化合物,或其前药、互变异构体、立体异构体、溶剂化物、同位素衍生物或其药学上可接受的盐可与另外的一种、两种或多种用于治疗癌症或肿瘤的治疗手段(如放疗)联合使用。
当将本发明化合物,或其前药、互变异构体、立体异构体、溶剂化物、同位素衍生物或其药学上可接受的盐与另外的用于治疗癌症或肿瘤的抗癌剂或免疫检查点抑制剂组合施用时,本发明化合物或其可药用盐可提供增强的抗癌作用。
关于本发明的使用术语的定义:除非另有说明,本文中基团或者术语提供的初始定义适用于整篇说明书的该基团或者术语;对于本文没有具体定义的术语,应该根据公开内容和上下文,给出本领域技术人员能够给予它们的含义。
本发明提供的化合物和衍生物可以根据IUPAC(国际纯粹与应用化学联合会)或者CAS(化学文摘服务社,Columbus,OH)命名系统命名。
术语“烷基”是直链或支链的饱和烃基的基团。碳氢基团中碳原子含量的最小值和最大值通过前缀表示,例如,前缀C
术语“环烷基”是指饱和或不饱和的环状经取代基。例如,“3-8元饱和环烷基”指环碳原子数为3-8的饱和的环烷基。
术语“杂环基”指饱和或不饱和的环状烃取代基,且环状烃携带至少一个环杂原子(包括但不限于O、S或N)。例如,“3-8元饱和杂环基”指环原子数为3-8的饱和的杂环基。
术语“卤素”指氟、氯、溴或碘。
术语“药学上可接受的”指某载体、运载物、稀释剂、辅料,和/或所形成的盐通常在化学上或物理上与构成某药物剂型的其它成分相兼容,并在生理上与受体相兼容。
术语“药学上可接受的盐”指通过常规的方法制备,包括但不限于有机酸盐、无机酸盐、有机碱盐、无机碱盐。所述的有机酸盐包括但不限于草酸盐、乳酸盐、对甲苯磺酸盐、苹果酸盐、枸掾酸盐、富马酸盐、樟脑磺酸盐、甲磺酸盐等;所述的无机酸盐包括但不限于硝酸盐、硫酸盐、氢卤酸盐、磷酸盐等。所述的有机碱盐包括但不限于甲醇钠、甲醇钾、乙醇钠、乙醇钾、三乙胺、叔丁胺等。所述的无机碱盐包括但不限于氢氧化钠、氢氧化钾、氢氧化锂等。
术语“同位素标记化合物”指化合物中的一个或两个以上的原子被其对应的同位素替换后得到的化合物。比如化合物中的一个或两个以上的氢(H)被氘(D)或氚(T)替换后得到的化合物:比如化合物中的一个或两个以上的碳
本发明化合物或药物组合物的施用方式没有特别限制,代表性的施用方式包括但并不限于:口服、肠胃外(静脉内、肌肉内或皮下)和局部给药。
本发明有益效果为:
本发明设计了一类N-芳基-N-芳炔丙基-芳乙酰胺类化合物,可作为首个POLQ共价抑制剂。体外酶活抑制活性研究显示,本发明化合物对POLQ酶具有较强的抑制作用,可作为治疗POLQ介导的疾病的前景化合物。进一步研究表明,典型化合物I-1、I-13、I-25对POLQ酶具有相当持久的抑制活性和良好的细胞活性。此外,本发明研究了特定的合成方法,该合成方法工艺简单,操作便捷,利于规模化工业生产和应用。
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
附图说明
图1为化合物I-1对POLQ的IC
具体实施方式
以下结合附图和具体实施例,对本发明的上述内容再作进一步的详细说明。以下特定实施例是为了举例说明,但不应将此理解为本发明上述主题的范围仅限于以下的实例。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
除非特别说明,本发明所用试剂和材料均为市购。
中间体的制备:
中间体A:5-溴吡啶-3-甲胺(中间体A)的制备
步骤1:3-溴-5-氯甲基吡啶(化合物A1)的制备
将5-溴吡啶-3-甲醇(I-1,9g,48.0mmol)溶于60mL DCM中,冷却至0℃,滴加氯化亚砜(22.8g,191.4mmol),室温搅拌过夜,将反应液倒入20mL冰水中,用1N NaOH水溶液碱化,乙酸乙酯提取,合并有机层,饱和NaCl溶液洗涤,无水Na
步骤2:5-溴吡啶-3-甲胺(中间体A)的制备
将3-溴-5-氯甲基吡啶(I-2,7g,34.0mmol)溶于150mL 7N氨甲醇溶液中,升温至60℃搅拌过夜,反应液减压浓缩,经硅胶柱层析纯化得淡黄色固体。收率31%;ESI-MS:m/z=187.1、189.1[M+H]
中间体B:N-(3-(5-氨甲基)吡啶-3-基)丙基-2-炔-1-基)-2-(2,4-双三氟甲基苯基)-N-(4-氟苯基)乙酰胺(中间体B)的制备
步骤1:4-氟-N-丙基-2-炔基苯胺(化合物B1)的制备
将对氟苯胺(10g,107.3mmol,9.80mL)溶于50mL DMF中,加入氢化钠(4.89g,112.7mmol,60%purity),室温搅拌30min,缓慢滴加3-溴-1-丙炔(16.77g,112.7mmol,19.2mL),继续搅拌2h。将反应液用饱和NaHCO
步骤2:2-(2,4-双三氟甲基)苯基-N-(4-氟苯基)-N-丙-2-炔-1-基乙酰胺(化合物B2)的制备
将化合物B1(500.0mg,3.33mmol)和2,4-双(三氟甲基)苯乙酸(905.7mg,3.33mmol)溶于25mL THF中,加入N,N-二异丙基乙胺(865.8mg,6.66mmol)和T3P(4.23g,6.66mmol,50%purity),80℃反应2h,冷却至室温,加入水,用乙酸乙酯提取,合并有机层,饱和NaCl溶液洗涤,无水Na
步骤3:N-(3-(5-氨甲基)吡啶-3-基)丙基-2-炔-1-基)-2-(2,4-双三氟甲基苯基)-N-(4-氟苯基)乙酰胺(中间体B)的制备
将化合物B2(100.0mg,0.25mmol)和化合物A(56.1mg,0.30mmol)溶于5mL DMF中,然后加入三乙胺(150mg,1.50mmol)、PdCl
中间体C:2-(2,4-双(三氟甲基)苯基)-N-(4-氟苯基)-N-(3-(5-((甲氨基)甲基)吡啶-3-基)丙-2-炔-1-基)乙酰胺(中间体C)的制备
步骤1:1-(5-溴吡啶-3-基)-N-甲基甲胺(化合物C1)的制备
将5-溴吡啶-3-甲醛(930mg,5.0mmol)加入到反应瓶中,加入MeOH溶剂使其溶解,加入甲胺溶液(155mg,5.0mmol),加入几滴醋酸调反应液pH至3-4,室温搅拌30min,之后加入氰基硼氢化钠(465mg,7.5mmol),室温搅拌3h反应结束,TLC检测反应进程,加水稀释,乙酸乙酯萃取,有机层用盐水洗涤,合并有机相,无水Na
步骤2:2-(2,4-双(三氟甲基)苯基)-N-(4-氟苯基)-N-(3-(5-((甲氨基)甲基)吡啶-3-基)丙-2-炔-1-基)乙酰胺(中间体C)的制备
中间体C的制备参考中间体B的合成。将中间体A换成等摩尔量的1-(5-溴吡啶-3-基)-N-甲基甲胺(C1),其余原料、试剂以及制备方法同中间体B的制备,得黄色油状液体。收率为42%;ESI-MS:m/z=524.0[M+H]
中间体D:N-(3-(3-(氨基甲基)苯基)丙-2-炔-1-基)-2-(2,4-双(三氟甲基)苯基)-N-(4-氟苯基)乙酰胺(中间体D)的制备
中间体D的制备参考化合物B的合成。将中间体A换成等摩尔量的3-碘苄胺,其余原料、试剂以及制备方法同中间体B的制备,得黄色油状液体。收率为53%;ESI-MS:m/z=509.0[M+H]
中间体E:N-(3-(4-(氨基甲基)苯基)丙-2-炔-1-基)-2-(2,4-双(三氟甲基)苯基)-N-(4-氟苯基)乙酰胺(中间体E)的制备
中间体E的制备参考化合物B的合成。将中间体A换成等摩尔量的对碘苄胺,其余原料、试剂以及制备方法同中间体B的制备,得黄色油状液体。收率为56%;ESI-MS:m/z=509.0[M+H]
中间体F:N-(3-(3-(2-氨基乙基)苯基)丙-2-炔-1-基)-2-(2,4-双(三氟甲基)苯基)-N-(4-氟苯基)乙酰胺(化合物F)的制备
中间体F的制备参考化合物B的合成。将中间体A换成等摩尔量的2-(3-碘苯基)乙-1-胺,其余原料、试剂以及制备方法同中间体B的制备,得黄色油状液体。收率为51%;ESI-MS:m/z=523.1[M+H]
中间体G:N-(3-(3-氨基苯基)丙-2-炔-1-基)-2-(2,4-双(三氟甲基)苯基)-N-(4-氟苯基)乙酰胺(化合物G)的制备
中间体G的制备参考化合物B的合成。将中间体A换成等摩尔量的间碘苯胺,其余原料、试剂以及制备方法同中间体B的制备,得棕色油状液体。收率为41%;ESI-MS:m/z=495.1[M+H]
中间体H:N-(3-(5-氨基吡啶-3-基)丙-2-炔-1-基)-2-(2,4-双(三氟甲基)苯基)-N-(4-氟苯基)乙酰胺(化合物H)的制备
中间体H的制备参考化合物B的合成。将中间体A换成等摩尔量的5-溴吡啶-3-胺,其余原料、试剂以及制备方法同中间体B的制备,得棕色油状液体。收率为64%;ESI-MS:m/z=496.1[M+H]
中间体J:N-(3-(6-氨基吡啶-3-基)丙-2-炔-1-基)-2-(2,4-双(三氟甲基)苯基)-N-(4-氟苯基)乙酰胺(化合物J)的制备
中间体J的制备参考化合物B的合成。将中间体A换成等摩尔量的5-溴吡啶-2-胺,其余原料、试剂以及制备方法同中间体B的制备,得棕色油状液体。收率为47%;ESI-MS:m/z=496.1[M+H]
中间体K:N-(3-(6-氨基哒嗪-3-基)丙-2-炔-1-基)-2-(2,4-双(三氟甲基)苯基)-N-(4-氟苯基)乙酰胺(化合物K)的制备
中间体K的制备参考化合物B的合成。将中间体A换成等摩尔量的6-溴哒嗪-3-胺,其余原料、试剂以及制备方法同中间体B的制备,得棕色油状液体。收率为38%;ESI-MS:m/z=497.1[M+H]
中间体L:N-(3-(5-(氨基甲基)吡啶-3-基)丙-2-炔-1-基)-2-(3,5-双(三氟甲基)吡啶-2-基)-N-(4-氟苯基)乙酰胺(化合物L)的制备
步骤1:2-(3,5-双(三氟甲基)吡啶-2-基)-N-(4-氟苯基)-N-(丙-2-炔-1-基)乙酰胺(化合物L2)的制备
将化合物B1(500.0mg,3.33mmol)和2-(3,5-双三氟甲基吡啶-2-基)乙酸(909.1mg,3.33mmol)溶于25mL THF中,加入N,N-二异丙基乙胺(865.8mg,6.66mmol)和T3P(4.25g,6.66mmol,50%purity),80℃反应2h,冷却至室温,加入水,用乙酸乙酯提取,合并有机层,饱和NaCl溶液洗涤,无水Na
步骤2:N-(3-(5-(氨基甲基)吡啶-3-基)丙-2-炔-1-基)-2-(3,5-双(三氟甲基)吡啶-2-基)-N-(4-氟苯基)乙酰胺(化合物L)的制备
将化合物L2(100.0mg,0.25mmol)和化合物A(56.1mg,0.30mmol)溶于5mL DMF中,然后加入三乙胺(150mg,1.50mmol)、PdCl
中间体M:N-(3-(5-氨基吡啶-3-基)丙-2-炔-1-基)-2-(3,5-双(三氟甲基)吡啶-2-基)-N-(4-氟苯基)乙酰胺(化合物M)的制备
中间体M的制备参考化合物L的合成。将中间体A换成等摩尔量的3-碘苄胺,其余原料、试剂以及制备方法同L,得棕色油状液体。收率为51%;ESI-MS:m/z=497.1[M+H]
中间体N:N-(3-(5-(氨基甲基)吡啶-3-基)丙-2-炔-1-基)-2-(3,5-双(三氟甲基)吡啶-2-基)-N-(4-氟苯基)乙酰胺(化合物N)的制备
中间体N的制备参考化合物L的合成。将中间体A换成等摩尔量的5-溴吡啶-3-胺,其余原料、试剂以及制备方法同L,得棕色油状液体。收率为41%;ESI-MS:m/z=511.0[M+H]
中间体O:2-(3,5-双三氟甲基吡啶-2-基)-N-(4-氟苯基)-N-(3-(5-((甲胺基)甲基)吡啶-3-基)丙-2-炔-1-基)乙酰胺(化合物O)的制备
中间体O的制备参考化合物L的合成。将中间体A换成等摩尔量的1-(5-溴吡啶-3-基)-N-甲基甲胺(C1),其余原料、试剂以及制备方法同L,得淡黄色油状液体。收率为52%;ESI-MS:m/z=525.1[M+H]
该系列中间体结构式如下表1所示
表1该系列中间体结构式
/>
实施例1:N-(5-(3-(2,4-双(三氟甲基)苯基)-N-(4-氟苯基)乙酰胺基)丙-1-炔基)吡啶-3-甲基)丙烯酰胺(化合物I-1)的制备
将中间体B(100.0mg,0.20mmol)溶于5ml DCM中,然后加入三乙胺(60mg,0.60mmol),冷却至0℃,滴加丙烯酰氯(20.0mg,0.20mmol),室温反应1h,加入饱和NaHCO
实施例2:2-(2,4-双三氟甲基)苯基-N-(3-(5-(2-氯乙酰氨基)甲基吡啶-3-基)丙-2-炔基-1-基)-N-(4-氟苯基)乙酰胺(化合物I-2)的制备
目标化合物I-2的制备参考化合物I-1的合成。将丙烯酰氯替换成等摩尔量的氯乙酰氯,其余原料、试剂以及制备方法同实施例1,得白色固体。收率为27%;ESI-MS:m/z=586.1[M+H]
实施例3:2-(2,4-双三氟甲基)苯基-N-(4-氟苯基)-N-(3-(5-乙烯基磺酰胺甲基)吡啶-3-基)丙基-2-炔-1-基)乙酰胺(化合物I-3)的制备
目标化合物I-3的制备参考化合物I-1的合成。将丙烯酰氯替换成等摩尔量的乙烯基磺酰氯,其余原料、试剂以及制备方法同实施例1,得白色固体。收率为35%;ESI-MS:m/z=600.1[M+H]
实施例4:5-(3-(2-(2,4-双(三氟甲基)苯基)-N-(4-氟苯基)乙酰氨基)丙-1-炔-1-基)吡啶-3-基)甲基)氨基磺酰氟(化合物I-4)的制备
目标化合物I-4的制备参考化合物I-1的合成。将丙烯酰氯换成等摩尔量的氟磺酰氯,其余原料、试剂以及制备方法同实施例1,得黄色固体。收率为42%;ESI-MS:m/z=592.0[M+H]
实施例5:N-(5-(3-(2-(2,4-双三氟甲基苯基)-N-(4-氟苯基)乙酰氨基)丙基-1-炔基吡啶-3-基)甲基)-3-氯丙酰胺(化合物I-5)的制备
目标化合物I-5的制备参考化合物I-1的合成。将丙烯酰氯换成等摩尔量的3-氯乙酰氯,其余原料、试剂以及制备方法同实施例1,得白色固体。收率为42%;ESI-MS:m/z=600.1[M+H]
实施例6:N-(5-(3-(2-(2,4-双三氟甲基苯基)-N-(4-氟苯基)乙酰氨基)丙基-1-炔基)吡啶-3-基)甲基)丁-2-炔(化合物I-6)的制备
将中间体B(100.0mg,0.20mmol)溶于5ml超干DCM中,室温下加入2-丁炔酸(16.8mg,0.20mmol),DCC(41.0mg,0.20mmol),DMAP(41.0mg,0.02mmol),之后室温搅拌,TLC监测反应进程,2h反应结束,乙酸乙酯萃取,合并有机相,使用无水硫酸钠干燥,之后过滤并旋干溶剂,粗品柱层析分离纯化,得到目标化合物I-6,白色固体。收率为31%;ESI-MS:m/z=576.1[M+H]
实施例7:N-(5-(3-(2-(2,4-双三氟甲基)苯基)-N-(4-氟苯基)乙酰氨基)丙基-1-炔基吡啶-3-基)甲基)-2-氧代丙酰胺(化合物I-7)的制备
目标化合物I-7的制备参考化合物I-6的合成。将2-丁炔酸换成等摩尔量的丙酮酸,其余原料、试剂以及制备方法同实施例6,得白色固体。收率为53%;ESI-MS:m/z=580.1[M+H]
实施例8:2-(2,4-双三氟甲基)苯基-N-(3-(5-((2,2-二氯乙酰氨基)甲基)吡啶-3-基)丙基-2-炔基)-N-(4-氟苯基)乙酰胺(化合物I-8)的制备
目标化合物I-8的制备参考化合物I-6的合成。将2-丁炔酸换成等摩尔量的二氯乙酸,其余原料、试剂以及制备方法同实施例6,得白色固体。收率为37%;ESI-MS:m/z=620.0[M+H]
实施例9:5-(3-(2,4-双三氟甲基苯基)-N-(4-氟苯基)乙酰氨基)丙-1-炔基-1-基)吡啶-3-基)甲基)-4-二甲氨基丁-2-烯酰胺(化合物I-9)的制备
目标化合物I-9的制备参考化合物I-6的合成。将2-丁炔酸换成等摩尔量的(E)-4-(二甲氨基)丁-2-烯酸,其余原料、试剂以及制备方法同实施例6,得白色固体。收率为49%;ESI-MS:m/z=621.2[M+H]
实施例10:2-(2,4-双三氟甲基)苯基-N-(3-(5-((2-氰基乙酰氨基)甲基)吡啶-3-基)丙-2-炔-1-基)-N-(4-氟苯基)乙酰胺(化合物I-10)的制备
目标化合物I-10的制备参考化合物I-6的合成。将2-丁炔酸换成等摩尔量的氰乙酸,其余原料、试剂以及制备方法同实施例6,得白色固体。收率为32%;ESI-MS:m/z=577.1[M+H]
实施例11:N-((5-(3-(2-(2,4-双(三氟甲基)苯基)-N-(4-氟苯基)乙酰氨基)丙-1-炔-1-基)吡啶-3-基)甲基)丙酰胺(化合物I-11)的制备
目标化合物I-11的制备参考化合物I-6的合成。将2-丁炔酸换成等摩尔量的丙炔酸,其余原料、试剂以及制备方法同实施例6,得淡白色固体。收率为53%;ESI-MS:m/z=562.1[M+H]
实施例12:N-((5-(3-(2-(2,4-双(三氟甲基)苯基)-N-(4-氟苯基)乙酰氨基)丙-1-炔-1-基)吡啶-3-基甲基)-N-甲基丙烯酰胺(化合物I-12)的制备
将中间体C(105.0mg,0.20mmol)溶于5ml DCM中,然后加入三乙胺(60mg,0.60mmol),冷却至0℃,滴加丙烯酰氯(20.0mg,0.20mmol),室温反应1h,加入饱和NaHCO
实施例13:N-(3-(3-(2-(2,4-双(三氟甲基)苯基))-N-(4-氟苯基)乙酰氨基)丙-1-炔-1-基)苄基)丙烯酰胺(化合物I-13)的制备
将中间体D(101.0mg,0.20mmol)溶于5ml DCM中,然后加入三乙胺(60mg,0.60mmol),冷却至0℃,滴加丙烯酰氯(20.0mg,0.20mmol),室温反应1h,加入饱和NaHCO
实施例14:N-(3-(6-(2,4-双(三氟甲基)苯基)-4-(4-氟苯基)-5-乙酰氨基-1-炔-1-基)苄基)-2-氯乙酰胺(化合物I-14)的制备
目标化合物I-14的制备参考化合物I-13的合成。将丙烯酰氯替换成等摩尔量的氯乙酰氯,其余原料、试剂以及制备方法同实施例13,得白色固体。收率为37%;ESI-MS:m/z=584.1[M+H]
实施例15:N-(3-(3-(2-(2,4-双(三氟甲基)苯基))-N-(4-氟苯基)乙酰氨基)丙-1-炔-1-基)苄基)丙醇酰胺(化合物I-15)的制备
将中间体D(110.0mg,0.20mmol)溶于5ml超干DCM中,室温下加入丙炔酸(15.8mg,0.20mmol),DCC(41.0mg,0.20mmol),DMAP(41.0mg,0.02mmol),之后室温搅拌,TLC监测反应进程,2h反应结束,乙酸乙酯萃取,合并有机相,使用无水硫酸钠干燥,之后过滤并旋干溶剂,粗品柱层析分离纯化,得到目标化合物I-15,白色固体。收率为46%;ESI-MS:m/z=561.1[M+H]
实施例16:N-(3-(3-(2-(2,4-双(三氟甲基)苯基)-N-(4-氟苯基)乙酰氨基)丙-1-炔-1-基)苄基)丁-2-炔酰胺(化合物I-16)的制备
目标化合物I-16的制备参考化合物I-15的合成。将丙炔酸替换成等摩尔量的2-丁炔酸,其余原料、试剂以及制备方法同实施例15,得白色固体。收率为34%;ESI-MS:m/z=575.1[M+H]
实施例17:2-(2,4-双(三氟甲基)苯基)-N-(4-氟苯基)-N-(3-(3-(乙烯基磺酰氨基甲基)苯基)丙-2-炔-1-基)乙酰胺(化合物I-17)的制备
目标化合物I-17的制备参考化合物I-13的合成。将丙烯酰氯替换成等摩尔量的乙烯基磺酰氯,其余原料、试剂以及制备方法同实施例13,得白色固体。收率为44%;ESI-MS:m/z=599.1[M+H]
实施例18:3-(3-(2-(2,4-双(三氟甲基)苯基)-N-(4-氟苯基)乙酰氨基)丙-1-炔-1-基)苄基)氨磺酰氟(化合物I-18)的制备
目标化合物I-18的制备参考化合物I-13的合成。将丙烯酰氯替换成等摩尔量的氟磺酰氯,其余原料、试剂以及制备方法同实施例13,得黄色固体。收率为53%;ESI-MS:m/z=591.1[M+H]
实施例19:N-(4-(3-(2-(2,4-双(三氟甲基)苯基))-N-(4-氟苯基)乙酰氨基)丙-1-炔-1-基)苄基)丙烯酰胺(化合物I-19)的制备
目标化合物I-19的制备参考化合物I-13的合成。将中间体D替换为等摩尔量的中间体E,其余原料、试剂以及制备方法同实施例13,得棕色油状液体。收率为85%;ESI-MS:m/z=563.1[M+H]
实施例20:N-(3-(3-(2-(2,4-双(三氟甲基)苯基)-N-(4-氟苯基)乙酰氨基)丙-1-炔-1-基)苯乙基)丙烯酰胺(化合物I-20)的制备
目标化合物I-20的制备参考化合物I-13的合成。将中间体D替换为等摩尔量的中间体F,其余原料、试剂以及制备方法同实施例13,得棕色油状液体。收率为69%;ESI-MS:m/z=577.1[M+H]
实施例21:N-(3-(3-(2-(2,4-双(三氟甲基)苯基)-N-(4-氟苯基)乙酰氨基)丙-1-炔-1-基)苯基)丙烯酰胺(化合物I-21)的制备
目标化合物I-21的制备参考化合物I-13的合成。将中间体D替换为等摩尔量的中间体G,其余原料、试剂以及制备方法同实施例13,得棕色油状液体。收率为63%;ESI-MS:m/z=549.1[M+H]
实施例22:N-(5-(3-(2-(2,4-双(三氟甲基)苯基))-N-(4-氟苯基)乙酰氨基)丙-1-炔-1-基)吡啶-3-基)丙烯酰胺(化合物I-22)的制备
目标化合物I-21的制备参考化合物I-13的合成。将中间体D替换为等摩尔量的中间体H,其余原料、试剂以及制备方法同实施例13,得黄色固体。收率为54%;ESI-MS:m/z=550.1[M+H]
实施例23:N-(5-(3-(2-(2,4-双(三氟甲基)苯基))-N-(4-氟苯基)乙酰氨基)丙-1-炔-1-基)吡啶-2-基)丙烯酰胺(化合物I-23)的制备
目标化合物I-23的制备参考化合物I-13的合成。将中间体D替换为等摩尔量的中间体J,其余原料、试剂以及制备方法同实施例13,得白色固体。收率为75%;ESI-MS:m/z=550.1[M+H]
实施例24:N-(6-(3-(2-(2,4-双(三氟甲基)苯基)-N-(4-氟苯基)乙酰氨基)丙-1-炔-1-基)哒嗪-3-基)丙烯酰胺(化合物I-24)的制备
目标化合物I-24的制备参考化合物I-13的合成。将中间体D替换为等摩尔量的中间体K,其余原料、试剂以及制备方法同实施例13,得白色固体。收率为33%;ESI-MS:m/z=551.1[M+H]
实施例25:N-((5-(3-(2-(3,5-双(三氟甲基)吡啶-2-基)-N-(4-氟苯基)乙酰氨基)丙-1-炔-1-基)吡啶-3-基)甲基)丙烯酰胺(I-25)的制备
目标化合物I-25的制备参考化合物I-1的合成。将中间体D替换为等摩尔量的中间体L,其余原料、试剂以及制备方法同实施例13,得白色固体。收率为42%;ESI-MS:m/z=565.1[M+H]
实施例26:N-(5-(3-(2-(3,5-双(三氟甲基)吡啶-2-基)-N-(4氟苯基)乙酰氨基)丙-1-炔-1-基)吡啶-3-基)丙烯酰胺(化合物I-26)的制备
目标化合物I-26的制备参考化合物I-13的合成。将中间体D替换为等摩尔量的中间体M,其余原料、试剂以及制备方法同实施例13,得白色固体。收率为37%;ESI-MS:m/z=551.1[M+H]
实施例27:N-(3-(3-(2-(3,5-双(三氟甲基)吡啶-2-基)-N-(4-氟苯基)乙酰氨基)丙-1-炔-1-基)苄基)丙烯酰胺(I-27)的制备
目标化合物I-27的制备参考化合物I-13的合成。将中间体D替换为等摩尔量的中间体N,其余原料、试剂以及制备方法同实施例13,得白色固体。收率为85%;ESI-MS:m/z=564.1[M+H]
实施例28:(E)-N-((5-(3-(2-(3,5-双(三氟甲基)吡啶-2-基)-N-(4-氟苯基)乙酰氨基)丙-1-炔-1-基)吡啶-3-基)甲基)丁-2-烯酰胺(I-28)的制备
将中间体L(102.0mg,0.20mmol)溶于5ml超干DCM中,室温下加入(E)-4-(二甲胺基)丁-2-烯酸(25.8mg,0.20mmol),DCC(41.0mg,0.20mmol),DMAP(41.0mg,0.02mmol),之后室温搅拌,TLC监测反应进程,2h反应结束,乙酸乙酯萃取,合并有机相,使用无水硫酸钠干燥,之后过滤并旋干溶剂,粗品柱层析分离纯化,得到目标化合物I-28,白色固体。收率为31%;ESI-MS:m/z=622.1[M+H]
实施例29:(E)-N-((5-(3-(2-(3,5-双(三氟甲基)吡啶-2-基)-N-(4-氟苯基)乙酰氨基)丙-1-炔-1-基)吡啶-3-基)甲基)-3-氰基丙烯酰胺(I-29)的制备
目标化合物I-29的制备参考化合物I-28的合成。将(E)-4-(二甲氨基)丁-2-烯酸替换成等摩尔量的(E)-3-氰基丙烯酸,其余原料、试剂以及制备方法同实施例28,得白色固体。收率为47%;ESI-MS:m/z=590.1[M+H]
实施例30:(E)-N-((5-(3-(2-(3,5-双(三氟甲基)吡啶-2-基)-N-(4-氟苯基)乙酰氨基)丙-1-炔-1-基)吡啶-3-基)甲基)-3-氟丙烯酰胺(化合物I-30)的制备
目标化合物I-30的制备参考化合物I-28的合成。将(E)-4-(二甲氨基)丁-2-烯酸替换成等摩尔量的(E)-3-氟丙烯酸,其余原料、试剂以及制备方法同实施例28,得白色固体。收率为43%;ESI-MS:m/z=583.1[M+H]
实施例31:(E)-N-((5-(3-(2-(2,4-双(三氟甲基)苯基)-N-(4-氟苯基)乙酰氨基)丙-1-炔-1-基)吡啶-3-基)甲基)-2-氰基丙烯酰胺(I-31)的制备
目标化合物I-31的制备参考化合物I-15的合成。将丙炔酸替换成等摩尔量的(E)-3-氰基丙烯酸,其余原料、试剂以及制备方法同实施例15,得白色固体。收率为46%;ESI-MS:m/z=589.1[M+H]
实施例32:N-((5-(3-(2-(2,4-双(三氟甲基)苯基)-N-(4-氟苯基)乙酰氨基)丙-1-炔-1-基)吡啶-3-基)甲基)-2-氟丙烯酰胺(I-32)的制备
目标化合物I-32的制备参考化合物I-15的合成。将丙炔酸替换成等摩尔量的(E)-3-氟丙烯酸,其余原料、试剂以及制备方法同实施例15,得白色固体。收率为53%;ESI-MS:m/z=582.1[M+H]
实施例33:N-((5-(3-(2-(3,5-双三氟甲基吡啶-2-基)-N-(4-氟苯基)乙酰胺基)丙-1-炔-1-基)吡啶-3-基)甲基)丙炔酰胺(I-33)的制备
目标化合物I-33的制备参考化合物I-28的合成。将(E)-4-(二甲氨基)丁-2-烯酸替换成等摩尔量的丙炔酸,其余原料、试剂以及制备方法同实施例28,得淡黄色固体。收率为41%;ESI-MS:m/z=563.1[M+H]
实施例34:N-((5-(3-(2-(3,5-双三氟甲基吡啶-2-基)-N-(4-氟苯基)乙酰胺基)丙-1-炔-1-基)吡啶-3-基)甲基)磺酰氟(I-34)的制备
将中间体L(100.0 mg,0.20 mmol)溶于5 ml DCM中,然后加入三乙胺(60mg,0.60mmol),冷却至0℃,滴加氟磺酰氯(22.0 mg,0.20 mmol),室温反应1 h,加入饱和NaHCO
实施例35:N-((5-(3-(2-(3,5-双三氟甲基吡啶-2-基)-N-(4-氟苯基)乙酰胺基)丙-1-炔-1-基)吡啶-3-基)甲基)-N-甲基丙烯酰胺(I-35)的制备
目标化合物I-35的制备参考化合物I-12的合成。将中间体B替换为等摩尔量的中间体O,其余原料、试剂以及制备方法同实施例12,得灰白色固体。收率为33%;ESI-MS:m/z=579.1[M+H]
实施例36:2-(3,5-双三氟甲基吡啶-2-基)-N-(4-氟苯基)-N-(3-(5-(乙烯磺酰胺甲基)吡啶-3-基)丙-2-炔-1-基)乙酰胺(I-36)的制备
目标化合物I-36的制备参考化合物I-34的合成。将氟磺酰氯替换为等摩尔量的乙烯基磺酰氯,其余原料、试剂以及制备方法同实施例34,得白色固体。收率为61%;ESI-MS:m/z=601.1[M+H]
实施例37:部分化合物对体外POLQ活性的抑制作用
1.实验方法
采用Picogreen assay测试化合物在体外结合和抑制POLQ活性的能力。在1X的测试缓冲液中分别配置POLQ酶、引物-模板双链(PTD)溶液和dNTP工作溶液。向384孔板中加入5μL的Polθ酶和引物-模板双链(PTD)溶液和1X的反应缓冲液,离心后室温孵育30min,每孔中加入5μL 2X dNTP工作溶液,离心,再室温孵育1小时,最后加入1:80稀释Picogreen终止反应,1小时后用酶标仪(激发波长485nm,发射波长520nM)测定发光强度,抑制率(%)=(Max-Signal)/(Max-Min)*100%,Max表示不加化合物的阳性对照孔的发光信号强度;Min表示不加酶的阴性对照孔的发光信号强度,Signal表示待测化合物的发光信号强度。将最终结果输入Graphpad Prism作图,得到曲线及IC
2.实验结果:具体结果见表2。
表2部分化合物对POLQ活性抑制作用
/>
其中,“++++”表示IC
从表1可以看出,本发明多数化合物在低纳摩尔浓度下能够有效抑制POLQ体外酶活性,多数化合物的半数抑制浓度低于5nM,这说明本发明化合物对POLQ具有强烈的抑制活性。
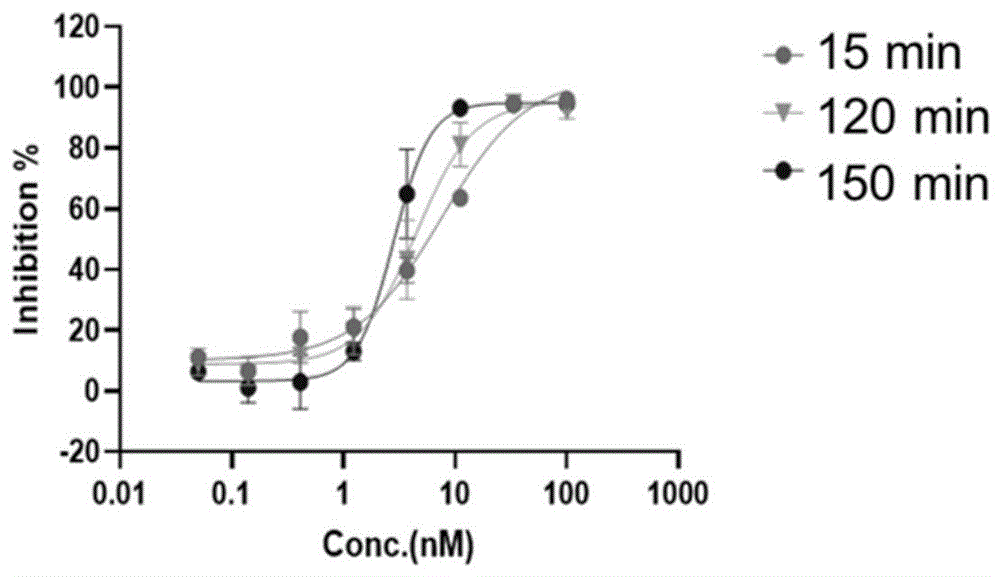
实施例38:化合物I-1共价机制验证
1.实验方法
蛋白质和共价抑制剂孵育不同时间,相对于非共价抑制剂,随孵育时间的延长,越来越多的结合位点将被共价抑制剂占据,半抑制浓度IC
2.实验结果:具体结果见表3、图1。
表3共价机制验证结果
化合物I-1酶学验证表明,随着孵育时间的延长,化合物I-1的IC
实施例39:化合物I-13、I-25对POLQ的IC
1.实验方法
鉴于化合物I-1显示出共价抑制剂典型特征,进一步评估化合物I-13、I-25对POLQ抑制活性IC
2.实验结果:具体结果见表4。
表4化合物I-13、I-25对POLQ的IC
化合物I-13、I-25对POLQ的IC
实施例40:部分化合物对MDA-MB-436细胞和DLD-1BRCA2(-/-)细胞的克隆形成抑制能力
1.实验方法
为了证明形成共价键在化合物发挥分子活性的关键作用,将分子I-1、I-13、I-25中的丙烯酰胺基团替换为丙酰胺,或去除丙烯酰胺基团,观察分子生物活性的变化,分别合成Ⅱ-1、Ⅱ-2和Ⅱ-3,具体结构见下表4。
表4Ⅱ-1、Ⅱ-2和Ⅱ-3的化学结构
分子Ⅱ-1的制备分别参考化合物I-1的合成,以丙酸为原料,其他合成方法分别同I-1,得淡黄色固体。收率为30%;ESI-MS:m/z=566.1[M+H]
分子Ⅱ-2的制备分别参考化合物I-23的合成,以丙酸为原料,其他合成方法分别同I-23,得淡黄色粉末。收率为43%;ESI-MS:m/z=567.1[M+H]
分子Ⅱ-3的制备参考中间体B的合成,以哒嗪胺为原料,替代5-溴吡啶-3-甲胺,其他合成方法同中间体B,得白色固体。收率35%;ESI-MS:m/z=497.1[M+H]
本实验的目的是为了检测发明化合物对MDA-MB-436细胞和DLD-1BRCA2(-/-)细胞克隆形成抑制的能力。培养MDA-MB-436和DLD-1BRCA2(-/-)细胞,然后以1000细胞/孔的密度铺板,将培养板在37℃,5%CO
2.实验结果:具体结果见表5。
表5部分化合物对MDA-MB-436细胞和DLD-1BRCA2(-/-)细胞克隆形成抑制活性
MDA-MB-436细胞株和DLD-1BRCA2(-/-)细胞株克隆形成抑制结果表明,I-1、I-25中丙烯酰胺基团双键还原后,分子活性下降大约2-3倍;移除丙烯酰胺基团(Ⅱ-3),分子活性几乎完全丧失。双键还原前后细胞活性的显著差异充分说明共价结合在细胞活性中的关键作用。
