一种二维异质结隧穿场效应管免疫传感器及其制备方法
文献发布时间:2023-06-19 09:26:02
技术领域
本发明涉及生物传感技术领域,具体涉及一种二维异质结隧穿场效应管免疫传感器及其制备方法。
背景技术
基于场效应管的生物传感器近年来收到了广泛关注,其优点在于可以实施无标记的电学测量。器件体积小、质量轻,传感器与测量系统的芯片集成度高,便于低成本的大规模生产。生物分子对半导体的栅控效应,可以通过电流、电导等性质的变化直接检测。免疫传感器作为生物传感器的一种,非常适合通过场效应管结构获得显著优于传统探测手段的性能。为了达到对特定分子的检测目的,半导体上的栅氧层被功能化,表面带有检测蛋白的特异性抗体,用于捕获所需的目标蛋白分子。目前,器件灵敏度上的需求不断提高,PPb量级的超高灵敏度检测甚至单分子检测是目前免疫传感器领域的热点方向。然而,传统的MOS场效应管的亚阈值斜率比较平稳,存在极限值60mV/dec,因此基于传统场效应管的免疫传感器对沟道表面电荷变化不灵敏,在最大可达灵敏度和最小检测时间方面存在理论局限性。
隧穿场效应管采用完全不同的电流注入机制,利用带间隧穿的原理,器件具有较好的亚阈值斜率以及开关电流比。在目标分子被吸附前,隧穿势垒较大,器件中电流较低,处于关态;目标分子与蛋白特异性结合后,由于生物分子中存在的电荷,沟道能带弯曲,隧穿势垒减小,从而导致隧穿电流增加,处于开态。隧穿场效应管可以克服亚阈值斜率在60mV/dec的限制,因此,基于隧穿场效应管的免疫传感器可以在保持传统场效应管传感器的所有其他优点的同时,大大提高灵敏度,为生物分子的超高灵敏度检测乃至单分子检测提供可能,因而具有广阔的应用发展前景。
以过渡金属二硫族化合物为代表的二维材料由于具有较高的迁移率、可调的带隙、高开关比等性质,被广泛应用在场效应管器件中。不同的二维材料具有不同的能带结构,堆叠形成异质结时,通过选择带隙合适的材料,载流子可以在范德瓦尔斯异质结处实现带间隧穿。此外,二维材料异质结依赖范德瓦尔斯力形成,界面质量高,缺陷较少,有助于降低关态电流;同时,单层直接带隙的二维材料异质结的带间隧穿过程中无需声子参与,可以实现电子的直接隧穿,这有助于提高开态电流。因此,二维材料异质结应用在隧穿场效应管中具有广阔的前景。
随着对生物传感器的灵敏度要求的不断提高,场效应管尺寸的小型化是不可避免的趋势,这需要不同的结构设计,以克服各种短通道效应,如漏极诱导的势垒降低、迁移率降低、速度饱和和通道长度调制,避免对器件传感性能产生负面影响。在隧穿场效应管为基础的免疫传感器中采用埋栅金属电极的底栅结构,可以使器件在高灵敏度要求场景下具有更好的器件稳定性,同时借助各种不同的电学参量作为检测参数,包括表面电势、开关电流比、跨导、电导等,可根据目标分子及环境的不同,选择合适的电学参量作为传感参数,提高整体的稳定性和准确性。
发明内容
为解决现有技术中存在的上述缺陷,本发明的目的在于提供一种二维异质结隧穿场效应管免疫传感器及其制备方法,采用埋栅金属电极的底栅结构,用于解决现有场效应管免疫传感器中灵敏度的限制以及器件小型化过程中出现短沟道效应的问题。
本发明是通过下述技术方案来实现的。
一种二维异质结隧穿场效应管免疫传感器,包括一个具有埋栅结构的衬底,衬底上设有的隧穿场效应管的沟道和源、漏极,以及沟道表面的特异性蛋白抗体层。所述埋栅结构的衬底包括一个绝缘衬底和嵌入于所述绝缘衬底中的一对埋栅金属电极,以及设于嵌入结构上的高K栅氧层;通过在两个埋栅金属电极上施加不同栅压实现对隧穿场效应管的调控。
所述衬底上设有的隧穿场效应管的沟道和源、漏极包括纵向堆垛的二维材料层,重叠部分构成异质结沟道,在所述二维材料层的两侧分别设有源、漏极的金属电极;通过施加不同栅压使得二维材料异质结能带排列模式发生改变,实现隧穿场效应。
所述沟道表面的特异性蛋白抗体层位于构成异质结沟道的二维材料层的表面。所述二维材料异质结和特异性蛋白抗体层均位于埋栅结构调节区域内,埋栅结构调节区域即为位于绝缘衬底中嵌入的埋栅金属电极之间的垂直向上的区域。通过特异性蛋白抗体层结合附目标蛋白分子,实现对目标蛋白分子地特异性识别与检测。
作为优选,所述二维材料层包括第一二维材料层和第二二维材料层,第一二维材料层与第二二维材料层均设在高K栅氧层上,位于埋栅结构调节区域内部分的第二二维材料叠放在第一二维材料层上方,构成异质结沟道。
作为优选,位于埋栅结构调节区域内部分的第一二维材料层和第二二维材料层的厚度均为纳米级别。
作为优选,通过对两个埋栅金属电极施加不同的栅压,使得器件在关态和开态时二维材料异质结能带排列模式分别为II型交错式排列和III型破隙式排列,实现关态下低电流,开态下因带间隧穿获得大电流。
作为优选,隧穿场效应管工作在关态条件时,第一二维材料层和第二二维材料层形成的异质结能带排列模式为II型交错式排列;隧穿场效应管工作在开态条件时,第一二维材料层和第二二维材料层形成的异质结能带排列模式为III型破隙式排列。
作为优选,所述异质结能II型交错式排列为其中一种二维材料的导带位于另一种二维材料导带与价带上方,不存在隧穿窗口,可以实现低的关态电流;所述异质结能带III型破隙式排列为其中一种二维材料的导带位于另一种二维材料的价带下方,隧穿窗口打开,可以实现大的开态电流。
作为优选,埋栅结构与异质结表面的特异性蛋白抗体层共同构成底栅介电调控生物探测结构,通过对左侧埋栅和右侧埋栅分别施加不同栅压对异质结的能带排列进行调控,实现隧穿场效应;异质结表面的特异性蛋白抗体层以高度特异性地结合目标蛋白分子,而不与其他蛋白分子相结合,实现特异性分子识别。
作为优选,源、漏极的金属电极均经过钝化处理。
进而,本发明给出了一种二维异质结隧穿场效应管免疫传感器的制备方法,包括以下步骤:
步骤一:制备埋栅结构:
11)绝缘衬底清洗;
12)利用干法刻蚀在衬底表面刻蚀出两个凹槽;
13)通过光刻或掩膜辅助热蒸镀法在凹槽中蒸镀金属栅极,填满凹槽,并在衬底表面引出导线;
14)利用化学机械抛光使表面平整化;
15)利用原子层沉积在衬底表面制备栅氧层,形成两个埋栅;
步骤二:制备异质结沟道以及源、漏极结构:
21)利用化学气相沉积或机械剥离的方法制备特定带隙的两种二维材料半导体薄膜;
22)利用干式或湿式转移法将二维材料薄膜转移到栅氧层上,堆垛形成异质结沟道,使异质结的位置在两个埋栅之间;
23)通过光刻或掩膜辅助热蒸镀方法制备源极和漏极的金属电极;
步骤三:对源、漏极金属电极表面进行钝化,对栅极腔体内异质结沟道表面进行修饰:
31)对源极、漏极金属电极表面进行防止目标物吸附的钝化处理;
32)对栅极腔体内异质结沟道表面进行蛋白分子修饰,使其吸附上针对待检测目标分子的特异性蛋白分子。
本发明由于采取以上技术方案,其具有以下有益效果:
该隧穿场效应管选取特定带隙的二维材料堆垛成垂直异质结作为沟道层,通过栅压控制使得器件在开态和关态时的能带结构分别为错层式排列和交错式排列,实现关态下低电流,开态下因带间隧穿获得大电流。该器件使用埋栅结构,在受栅压调制的异质结表面上用特异性抗体蛋白分子进行表面修饰。异质结作为有效检测区域,遵循介电调控机制,具备获得理想的栅控能力。该器件利用多个电学参量随检测样本对检测区域的介电调控实现检测。本发明工艺简单,基于二维材料异质结的隧穿场效应管免疫传感器具有更加陡峭的亚阈值斜率,可以实现对生物分子的超高灵敏度检测,同时,由于二维材料厚度超薄,器件在尺寸缩小上具有较大优势,便于能带调控。
附图说明
此处所说明的附图用来提供对本发明的进一步理解,构成本申请的一部分,并不构成对本发明的不当限定,在附图中:
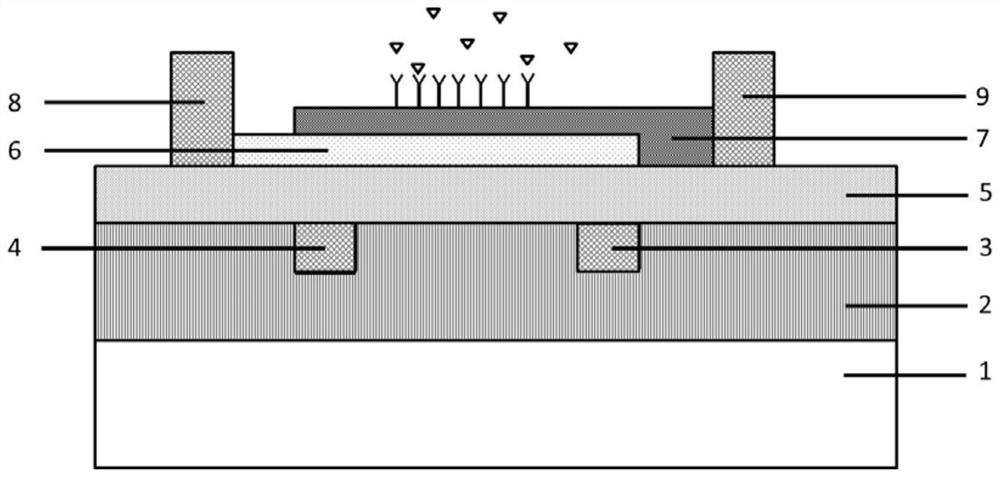
图1是本发明的二维半导体异质结隧穿场效应管免疫传感器的剖面示意图;
图2式本发明的二维半导体异质结能带排列模式的示意图;
图3是对半导体衬底进行刻蚀后的剖面示意图;
图4是制备埋栅金属电极并进行化学机械抛光后的剖面示意图;
图5是制备高K栅氧层后的剖面示意图;
图6是将二维材料转移到高K栅氧层上堆垛形成异质结的剖面示意图;
图7是在二维材料两侧的栅氧层上制备源、漏极金属电极后的剖面示意图;
图8是在异质结表面结合特异性抗体蛋白分子后的剖面示意图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合说明书附图和具体实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
如图1所示,本发明实施例提供了一种基于二维半导体垂直异质结的隧穿场效应管免疫传感器,包括:绝缘衬底1、2,埋栅金属电极3、4,高K栅氧层5,第一二维材料层6,第二二维材料层7,源、漏极金属电极8,9以及特异性蛋白抗体层;绝缘衬底1、2置于最底层,绝缘衬底1、2为SiO
其中,第一二维材料层6与第二二维材料7均设在高K栅氧层5上,位于埋栅结构调节区域内部分的第二二维材料7叠放在第一二维材料层6上方。位于埋栅结构调节区域内部分的第一二维材料层6的厚度稍大于第二二维材料层7的厚度。位于埋栅结构调节区域内部分的第一二维材料层和第二二维材料层的厚度均为纳米级别。源、漏极的金属电极均经过钝化处理。
参照图2(a)、(b)至图8,下面给出两种二维半导体垂直异质结隧穿场效应管免疫传感器的制备方法的具体实施例。
实施例1:
步骤一,提供一绝缘衬底,并进行清洗,具体步骤如下:
1)将SiO
2)将Si衬底放在比例为1:1:6的盐酸、双氧水、去离子水的混合溶液中清洗,去除Si衬底上的活泼金属、金属氧化物和氢氧化物等杂质;
3)将Si衬底放在比例为1:50的氢氟酸、去离子水混合溶液中清洗30秒,然后放入去离子水中静置1分钟,重复该步骤5次,去除Si衬底表面的自然氧化物和悬挂键;
4)用氮气枪将清洗后的Si衬底吹干,得到洁净的SiO
步骤二,在衬底表面制备图案化抗蚀掩膜层,利用等离子体刻蚀在衬底表面刻蚀出两个凹槽,凹槽深度100nm。刻蚀后的衬底剖面图如图3所示。
步骤三,利用掩膜辅助热蒸镀在凹槽内蒸镀金属栅极,在本实施例中,选择Au的厚度为100nm。
步骤四,利用化学机械抛光使表面平整化,并在衬底表面从金属栅极引出金导线。平整化后的衬底剖面图如图4所示。
步骤五,利用原子层沉积在衬底表面制备HfO
1)选取臭氧作为氧源,选取四乙基甲基氨基铪(TEMAHf)作为铪源。腔体温度设为360℃,铪源的温度设为80℃;
2)对反应腔体抽真空,然后充入一个大气压的氮气,以此重复3到5次;
3)将清洗后的衬底放入反应腔体,关闭腔室后将反应腔体抽真空,打开氧源和铪源的气体阀门,向反应腔体冲入臭氧前驱体和铪前驱体,脉冲时间为1秒,载气流量为60sccm,待反应后向反应腔体充入流量为60sccm的氮气冲洗反应腔体,冲洗时间为15秒;
4)步骤3)生成的HfO
步骤六,利用化学气相沉积法制备特定带隙的两种二维材料半导体薄膜,具体步骤如下:
1)将100mg硫粉放置在第一石英舟中,将0.2mg过MoO
2)将100mg碲粉放置在第一石英舟中,将0.2mgMoO
步骤七,利用无胶水转移法将二维材料薄膜转移到清洗好的衬底上,堆垛形成异质结沟道,具体步骤如下:
1)取制备好的具有埋栅结构的绝缘衬底和去离子水,在衬底表面两个埋栅中间的区域滴加去离子水,将生长有MoS
2)取已经转移上MoS
本实施例中,第一二维材料层MoS
步骤八,通过光刻方法制备源极和漏极的Ti/Au金属电极,Ti厚度为20nm,Au的厚度为100nm,如图7所示。
步骤九,对源、漏极的金属电极表面进行钝化处理,源极和漏极接点用介电层钝化,以保护它们不受电解液的影响。
步骤十,对栅极腔体内异质结沟道表面进行蛋白分子修饰,使其吸附上针对待检测目标分子(白细胞介素-17,IL-17)的特异性蛋白抗体分子(抗白细胞介素-17抗体,anti-IL-17抗体),具体步骤如下:
1)采用3-氨丙基三乙氧基硅烷(APTES)作为异质结沟道的表面修饰剂,通过化学键合的方式形成APTES膜层,在120℃下干燥30min;
2)将已经过APTES修饰的异质结沟道浸泡在戊二醛溶液中2h,戊二醛作为中间连接分子,一端与APTES相连,另一端悬空;
3)将以经过APTES与戊二醛修饰的异质结沟道浸泡在抗人白细胞介素-17抗体(anti-IL-17抗体)的溶液中10h,通过化学键和,anti-IL-17抗体与戊二醛悬空的一段相结合,成功附着在沟道表面,形成栅介电调控探测结构,如图8所示。此传感器可用于检测溶液如器官移植术后病人血清中的白细胞介素-17(IL-17)的含量,该水平可提示异体器官移植免疫排斥反应的程度。
实施例2:
步骤一,提供一绝缘衬底,并进行清洗,具体步骤如下:
1)将SiO
2)将Si衬底放在比例为1:1:6的盐酸、双氧水、去离子水的混合溶液中清洗,去除Si衬底上的活泼金属、金属氧化物和氢氧化物等杂质;
3)将Si衬底放在比例为1:50的氢氟酸、去离子水混合溶液中清洗30秒,然后放入去离子水中静置1分钟,重复该步骤5次,去除Si衬底表面的自然氧化物和悬挂键;
4)用氮气枪将清洗后的Si衬底吹干,得到洁净的SiO
步骤二,在衬底表面制备图案化抗蚀掩膜层,利用等离子体刻蚀在衬底表面刻蚀出两个凹槽,凹槽深度100nm。刻蚀后的衬底剖面图如图3所示。
步骤三,利用光刻在凹槽内蒸镀金属栅极,在本实施例中,选择Au的厚度为100nm。
步骤四,利用化学机械抛光使表面平整化,并在衬底表面从金属栅极引出金导线。平整化后的衬底剖面图如图4所示。
步骤五,利用原子层沉积在衬底表面制备HfO
1)选取臭氧作为氧源,选取四乙基甲基氨基铪(TEMAHf)作为铪源。腔体温度设为360℃,铪源的温度设为80℃;
2)对反应腔体抽真空,然后充入一个大气压的氮气,以此重复3到5次;
3)将清洗后的衬底放入反应腔体,关闭腔室后将反应腔体抽真空,打开氧源和铪源的气体阀门,向反应腔体冲入臭氧前驱体和铪前驱体,脉冲时间为1秒,载气流量为60sccm,待反应后向反应腔体充入流量为60sccm的氮气冲洗反应腔体,冲洗时间为10秒;
4)步骤3)生成的HfO
步骤六,利用机械剥离法制备特定带隙的两种二维材料半导体薄膜,具体步骤如下:
1)采用机械剥离的方法,用3M胶带从MoS
2)采用机械剥离的方法,用3M胶带从MoTe
步骤七,利用干法转移将二维材料薄膜转移到清洗好的衬底上,堆垛形成异质结沟道,具体步骤如下:
1)将聚二甲基硅氧烷(PDMS)作为中介层,采用干法转移的方法将3M胶带撕取的MoS
2)将PDMS安装在玻璃板上,借助长焦镜头的对准,将PDMS按压在步骤5制备好的具有埋栅结构的绝缘衬底表面。此步骤需仔细对准,要求部分MoS2占据整个高K栅氧层表面的埋栅调控区域,得到转移上第一二维材料层的衬底。
3)将聚二甲基硅氧烷(PDMS)作为中介层,采用干法转移的方法将3M胶带撕取的MoTe
4)将PDMS安装在玻璃板上,借助长焦镜头的对准,将PDMS按压在步骤2)中制备好的转移上第一二维材料层的衬底表面。此步骤需仔细对准,将MoTe2转移到高K栅氧层表面的埋栅调控区域内,让MoTe
步骤八,通过光刻方法制备源极和漏极的Ti/Au金属电极,Ti厚度为20nm,Au的厚度为100,如图7所示。
步骤九,对源、漏极的金属电极表面进行钝化处理,源极和漏极接点用介电层钝化,以保护它们不受电解液的影响。
步骤十,对栅极腔体内异质结沟道表面进行蛋白分子修饰,使其吸附上针对待检测目标分子(白细胞介素10,IL-10)的特异性蛋白抗体分子(抗白细胞介素10抗体,anti-IL10抗体),具体步骤如下:
1)采用3-氨丙基三乙氧基硅烷(APTES)作为异质结沟道的表面修饰剂,通过化学键合的方式形成APTES膜层,在120℃下干燥30min;
2)将已经过APTES修饰的异质结沟道浸泡在戊二醛溶液中2h,戊二醛作为中间连接分子,一端与APTES相连,另一端悬空;
3)将以经过APTES与戊二醛修饰的异质结沟道浸泡在抗白细胞介素10抗体(anti-IL10抗体)的溶液中10h,通过化学键和,抗白细胞介素10抗体与戊二醛悬空的一段相结合,成功附着在沟道表面,形成栅介电调控探测结构,如图8所示。此传感器可用于检测溶液如器官移植病人血清中的白细胞介素10的含量,该指标可反映移植受体对供体器官的免疫耐受状态。
本发明制备的二维半导体垂直异质结隧穿场效应管免疫传感器具有埋栅结构的衬底对隧穿场效应有效调控;通过施加不同栅压使得二维材料异质结能带排列模式发生改变,实现隧穿场效应;通过特异性蛋白抗体层结合附目标蛋白分子,实现对目标蛋白分子地特异性识别与检测。
通过对具有埋栅结构的衬底栅压控制,使得器件在开态和关态时能带结构分别为II型错层式排列和III型破隙式排列,实现关态下低电流,开态下因带间隧穿获得大电流。
隧穿场效应管工作在关态条件时,第一二维材料层和第二二维材料层形成的异质结能带为交错式;隧穿场效应管工作在开态条件时,第一二维材料层和第二二维材料层形成的异质结能带为错层式。异质结能带II型交错式排列为其中一种二维材料的导带位于另一种二维材料导带与价带上方,不存在隧穿窗口,可以实现低的关态电流,如图2(a);异质结能带III型破隙式排列为其中一种二维材料的导带位于另一种二维材料的价带下方,隧穿窗口打开,可以实现大的开态电流,如图2(b)。
埋栅结构与异质结表面的特异性蛋白抗体层共同构成底栅介电调控生物探测结构,通过对左侧埋栅和右侧埋栅分别施加不同栅压对异质结的能带排列进行调控,实现隧穿场效应;异质结表面的特异性蛋白抗体层以高度特异性地结合目标蛋白分子,而不与其他蛋白分子相结合,实现特异性分子识别。
基于二维材料异质结的隧穿场效应管免疫传感器具有更加陡峭的亚阈值斜率,可以实现对生物分子的超高灵敏度检测。
本发明并不局限于上述实施例,在本发明公开的技术方案的基础上,本领域的技术人员根据所公开的技术内容,不需要创造性的劳动就可以对其中的一些技术特征作出一些替换和变形,这些替换和变形均在本发明的保护范围内。
- 一种二维异质结隧穿场效应管免疫传感器及其制备方法
- 一种二维材料/半导体异质结隧穿晶体管及制备方法
