特异性结合CLAUDIN 3的ECL-2的抗体,其片段及其用途
文献发布时间:2023-06-19 09:29:07
技术领域
本申请要求2018年3月28日提交的韩国专利申请No.10-2018-0036190(其全部内容以引用的方式并入本文)的优先权。
本发明涉及特异性结合claudin 3的胞外第二环(ECL-2)的抗体、其片段及其用途,并且更具体而言,涉及特异性结合claudin 3的ECL-2的抗体及其功能性片段在癌细胞检测、诊断、成像中的用途以及在癌症治疗中的应用(抗体本身的抗癌用途以及在ADC和CAR表达细胞(特别是免疫细胞)中的应用),包含在此类用途中发挥显著作用的特征性CDR序列的抗体及其功能性片段。
背景技术
Claudin是细胞之间的紧密连接(TJ)的主要和必需的膜蛋白,并且在哺乳动物中存在27个家族。人类具有哺乳动物中的除claudin 13外的claudin家族。Claudin家族具有类似的结构,可穿透细胞壁并嵌入其中,并且多数具有带2个细胞外环的结构。已知Claudin在控制细胞间分子的流动中发挥作用,但最近的研究报道其与结肠癌、胃癌、乳腺癌、食管癌和卵巢癌等癌症的发病密切相关。约90%的恶性肿瘤起源于上皮。在正常的上皮细胞中,细胞平行于上皮平面定位。因此,在正常上皮组织之间构成TJ的claudin难于在组织或器官的表面上被检测到,但在上皮肿瘤发展的早期阶段,有丝分裂纺锤体的控制被释放并且细胞通过平面外分裂而增殖,使claudin暴露于组织表面
特别地,据报道在卵巢癌中claudin家族中claudin 3和claudin 4过表达,卵巢癌由于没有明显症状且除手术和化学疗法外没有合适的治疗方法而预后较差(ClaudinProteins in Human Cancer:Promising New Targets for Diagnosis and Therapy,PJMorin,Cancer Res.65:9604-9006(2005)。此外,作为通过Kaplan-Meier技术的生存曲线确认84例患者的卵巢浆液性腺癌的生存率以及claudin 3的表达率的结果,研究报告了claudin 3的表达率与患者寿命的缩短密切相关(Expression profile of tightjunction protein claudin 3and claudin 4in ovarian serous adenocarcinoma withprognostic,Choi等,Histol.Histopathol.22:1185~1195(2005))。如上所述,在癌症组织中具有高特异性的claudin表达的增加或减少可用作癌症发生的预测指标。此外,claudin已成为癌症的诊断和治疗的有用的生物标记,并且多个组正尝试开发靶向claudin的治疗剂。
同时,抗体-药物-缀合物(ADC)是单克隆抗体的靶标特异性与药物功效的特性(例如细胞毒性)的组合。ADC由三个组分(包括药物、单克隆抗体和将抗体连接至药物的接头)组成。ADC技术主要使用特异性结合癌细胞的表面上表达的特定抗原的抗体。其用作将药物输送至肿瘤细胞的方法。然而,并非所有简单地靶向特定癌症抗原的抗体都可应用于ADC。
现有抗体由于其较大的尺寸和亲水性而不能直接穿透进活细胞中。因此,多数现有抗体特异性地靶向分泌至细胞外部的蛋白质或细胞膜蛋白质。通用的抗体和聚合物生物药物具有局限性,因为它们不能通过疏水性细胞膜,因此不能结合并抑制细胞质内部的多种疾病相关物质。通常,用于例如细胞生长和特异性抑制等机制研究的实验中的特异性结合细胞内物质的商业抗体不能在活细胞上直接处理,并且为与细胞内物质结合,通过使用皂苷(两亲性糖苷)的细胞膜穿透过程在细胞膜中形成穿孔的预处理过程是必需的。在低分子物质、核酸或纳米颗粒的情况下,可通过使用多种试剂、电穿孔或热休克将其运输进活细胞中,但在蛋白质和抗体的情况下,上述多数试剂和实验条件可能对固有的三级结构产生不利影响,从而导致活性丧失。正在开发特异性结合并抑制细胞内蛋白质活性的细胞内抗体(胞内抗体),但其也不具有穿透活细胞的细胞膜的活性,因此仅能应用于基因治疗目的。因此,未来的应用可能性非常有限(Manikandan J等,Protein i:interference atprotein level by intrabodies,Front Biosci,2007Jan 1;12:1344-52)。
包括抗体-药物缀合物(ADC)、免疫毒素和靶向核酸在内的一些治疗方法需要不仅结合至受体,而且在结合后内化至细胞中的抗体。已知ADC需要进入细胞(内化)以使ADC表现出优异的功效。然而,取决于抗体,不存在进入细胞的能力或因为其误差很大,可开发实际ADC的抗体及其作用受到限制。
发明详述
技术问题
因此,尽管本发明的发明人正在研究开发具有适于用作ADC(抗体-药物缀合物)的多种特性的抗体,他们在确认了特异性结合claudin 3ECL-2以用于癌细胞检测、诊断、成像以及应用于癌症治疗(例如应用于ADC和CAR表达细胞(尤其是免疫细胞))的抗体和功能性片段的价值后完成了本发明。作为其特定实例,他们确认了包含本发明提供的独特CDR序列的抗体不仅自身具有抗癌能力,而且还具有优异的癌细胞靶向能力,而与其它claudin家族无交叉反应性,并且他们确认了与现有的已知claudin 3抗体相比,其表现出非常优异的结合强度(亲和力),并且由于具有例如细胞内化的特性而在上述应用中显示出显著的效果。
因此,本发明的方面是提供抗体或其功能性片段,所述抗体或其功能性片段包含:
重链可变区,所述重链可变区包含重链互补决定区1(VH-CDR1)、重链互补决定区2(VH-CDR2)以及重链互补决定区3(VH-CDR3),所述重链互补决定区1包含由SEQ ID NO:3限定的氨基酸序列,所述重链互补决定区2包含由SEQ ID NO:4限定的氨基酸序列,所述重链互补决定区3包含由SEQ ID NO:5限定的氨基酸序列;以及
轻链可变区,所述轻链可变区包含轻链互补决定区1(VL-CDR1)、轻链互补决定区2(VL-CDR2)以及轻链互补决定区3(VL-CDR3),所述轻链互补决定区1包含由SEQ ID NO:6限定的氨基酸序列,所述轻链互补性决定区2包含由SEQ ID NO:7限定的氨基酸序列,所述轻链互补决定区3包含由SEQ ID NO:8限定的氨基酸序列。
本发明的另一方面是提供编码所述抗体或其功能性片段的多核苷酸、含有所述多核苷酸的载体、含有所述载体的细胞以及使用其生产抗体或其功能性片段的方法。
本发明的另一方面是提供了用于检测claudin 3的组合物,所述组合物包含所述抗体或其功能性片段作为活性成分;以及使用所述组合物检测claudin 3的方法。
此外,提供了由所述抗体或其功能性片段组成的用于检测claudin 3的组合物,以及使用所述组合物检测claudin 3的方法。
此外,提供了主要由所述抗体或其功能性片段组成的用于检测claudin 3的组合物,以及使用所述组合物检测claudin 3的方法。
本发明的另一方面是提供了用于诊断癌症或对癌症进行成像的组合物,所述组合物包含作为活性成分的所述抗体或其功能性片段。
进一步,提供了用于诊断癌症或对癌症进行成像的组合物,所述组合物由所述抗体或其功能性片段组成。
此外,提供了用于诊断癌症或对癌症进行成像的组合物,所述组合物主要由所述抗体或其功能性片段组成。
本发明的另一方面是提供了用于预防和治疗癌症的组合物,所述组合物包含作为活性成分的所述抗体或其功能性片段。
此外,提供了由所述抗体或其功能性片段组成的用于预防和治疗癌症的组合物。
此外,提供了主要由所述抗体或其功能性片段组成的用于预防和治疗癌症的组合物。
本发明的另一方面是提供了用于对癌细胞特异的药物递送的组合物,所述组合物特别包含作为活性成分的所述抗体或其功能性片段。
还提供了用于对癌细胞特异的药物递送的组合物,所述组合物由作为活性成分的所述抗体或其功能性片段组成。
此外,提供了用于对癌细胞特异的药物递送的组合物,所述组合物主要由所述抗体或其功能性片段组成。
本发明的又一方面是提供了用于细胞内药物递送的组合物,所述组合物包含作为活性成分的特异性结合claudin 3的细胞外第二环(ECL-2)的抗体或其功能性片段。
此外,提供了用于细胞内药物递送的组合物,所述组合物由特异性结合claudin 3的细胞外第二环(ECL-2)的抗体或其功能性片段组成。
此外,提供了用于细胞内药物递送的组合物,所述组合物主要由特异性结合claudin3的细胞外第二环(ECL-2)的抗体或其功能性片段组成。
本发明的又一方面是提供了用于预防和治疗癌症的组合物,所述组合物包含作为活性成分的抗体-药物缀合物,在所述抗体-药物缀合物中所述抗体或功能性片段结合至药物。
此外,提供了由作为活性成分的抗体-药物缀合物组成的用于预防和治疗癌症的组合物,在所述抗体-药物缀合物中所述抗体或功能性片段结合至药物。
此外,提供了主要由作为活性成分的抗体-药物缀合物组成的用于预防和治疗癌症的组合物,在所述抗体-药物缀合物中所述抗体或功能性片段结合至药物。
本发明的又一方面是提供了用于预防和治疗癌症的包含细胞内药物递送的组合物,所述组合物包含作为活性成分的抗体-药物缀合物,在所述抗体-药物缀合物中药物结合至特异性结合claudin 3的细胞外第二环(ECL-2)的抗体或其功能性片段。
此外,提供了用于预防和治疗癌症的包含细胞内药物递送的组合物,所述组合物由作为活性成分的抗体-药物缀合物组成,在所述抗体-药物缀合物中药物结合至特异性结合claudin 3的细胞外第二环(ECL-2)的抗体或其功能性片段。
此外,提供了用于预防和治疗癌症的包含细胞内药物递送的组合物,所述组合物主要由作为活性成分的抗体-药物缀合物组成,在所述抗体-药物缀合物中药物结合至特异性结合claudin 3的细胞外第二环(ECL-2)的抗体或其功能性片段。
本发明的又一方面是提供了嵌合抗原受体(CAR)蛋白,所述CAR蛋白包含:i)本发明的抗体或其功能性片段、ii)跨膜结构域以及iii)细胞内信号转导结构域。
此外,提供了嵌合抗原受体(CAR)蛋白,所述CAR蛋白包含:i)特异性结合claudin3的细胞外第二环(ECL-2)的抗体或其功能性片段、ii)跨膜结构域以及iii)细胞内信号转导结构域。
本发明的又一方面是提供了编码嵌合抗原受体(CAR)蛋白的多核苷酸,包含所述多核苷酸的重组载体以及用所述载体转化的细胞(特别是免疫细胞)。
本发明的再一方面是提供了所述抗体或其功能性片段在制备用于claudin 3检测的试剂、用于癌症诊断的试剂、用于对癌症进行成像的试剂以及用于对癌细胞特异的药物递送的试剂中的用途。
本发明的再一方面是提供了用于claudin 3的特异性检测的方法、用于诊断癌症的方法、用于癌症成像的方法以及用于对癌细胞特异的药物递送的方法,所述方法包括给有需要的对象施用有效量的组合物,所述组合物包含作为活性成分的所述抗体或其功能性片段。
本发明的再一方面是提供了抗体-药物缀合物在制备用于预防和治疗癌症的试剂中的用途,其中所述抗体或其功能性片段结合至药物。
本发明的再一方面是提供了用于预防和治疗癌症的方法,所述方法包括给有需要的对象施用有效量的包含作为活性成分的抗体-药物缀合物的组合物,其中所述抗体或其功能性片段结合至药物。
本发明的再一方面是提供了抗体或其功能性片段在制备细胞内药物递送试剂中的用途,所述抗体或其功能性片段特异性结合claudin 3的细胞外第二环(ECL-2)。
本发明的再一方面是提供了用于细胞内药物递送的方法,所述方法包括给有需要的对象施用有效量的组合物,所述组合物包含作为活性成分的特异性结合claudin 3的细胞外第二环(ECL-2)的抗体或其功能性片段。
本发明的再一方面是提供了特异性结合claudin 3的细胞外第二环(ECL-2)的抗体或其功能性片段以及结合至所述抗体或其功能性片段的药物在制备用于预防和治疗癌症的试剂中的用途。
本发明的再一方面是提供了用于预防和治疗癌症的方法,所述方法包括给有需要的对象施用有效量的组合物,所述组合物包含作为活性成分的特异性结合claudin 3的细胞外第二环(ECL-2)的抗体或其功能性片段以及与其结合的药物。
发明详述
根据本发明的方面的实施方式提供了抗体或其功能性片段,所述抗体或其功能性片段包含:
重链可变区,所述重链可变区包含重链互补决定区1(VH-CDR1)、重链互补决定区2(VH-CDR2)以及重链互补决定区3(VH-CDR3),所述重链互补决定区1包含由SEQ ID NO:3限定的氨基酸序列,所述重链互补决定区2包含由SEQ ID NO:4限定的氨基酸序列,所述重链互补决定区3包含由SEQ ID NO:5限定的氨基酸序列;以及
轻链可变区,所述轻链可变区包含轻链互补决定区1(VL-CDR1)、轻链互补决定区2(VL-CDR2)以及轻链互补决定区3(VL-CDR3),所述轻链互补决定区1包含由SEQ ID NO:6限定的氨基酸序列,所述轻链互补性决定区2包含由SEQ ID NO:7限定的氨基酸序列,所述轻链互补决定区3包含由SEQ ID NO:8限定的氨基酸序列。
根据本发明的另一方面的实施方式提供了编码所述抗体或其功能性片段的多核苷酸、含有所述多核苷酸的载体、含有所述载体的细胞以及使用其生产抗体或其功能性片段的方法。
根据本发明的另一方面的实施方式提供了用于检测claudin 3的组合物,所述组合物包含作为活性成分的所述抗体或其功能性片段;以及使用所述组合物检测claudin 3的方法。
此外,本发明提供了由所述抗体或其功能性片段组成的用于检测claudin 3的组合物,以及使用所述组合物检测claudin 3的方法。
此外,本发明提供了主要由所述抗体或其功能性片段组成的用于检测claudin 3的组合物,以及使用所述组合物检测claudin 3的方法。
根据本发明的另一方面的实施方式提供了用于诊断癌症或对癌症进行成像的组合物,所述组合物包含为活性成分的所述抗体或其功能性片段作。
此外,本发明提供了用于诊断癌症或对癌症进行成像的组合物,所述组合物由所述抗体或其功能性片段组成。
此外,本发明提供了用于诊断癌症或对癌症进行成像的组合物,所述组合物主要由所述抗体或其功能性片段组成。
根据本发明另一方面的实施方式提供了用于预防和治疗癌症的组合物,所述组合物包含作为活性成分的所述抗体或其功能性片段。
此外,本发明提供了由所述抗体或其功能性片段组成的用于预防和治疗癌症的组合物。
此外,本发明提供了主要由所述抗体或其功能性片段组成的用于预防和治疗癌症的组合物。
根据本发明的另一方面的实施方式提供了用于对癌细胞特异的药物递送的组合物,所述组合物特别包含作为活性成分的所述抗体或其功能性片段。
此外,本发明提供了用于对癌细胞特异的药物递送的组合物,所述组合物由所述抗体或其功能性片段组成。
此外,本发明提供了用于对癌细胞特异的药物递送的组合物,所述组合物主要由所述抗体或其功能性片段组成。
此外,根据本发明的又一方面提供了用于细胞内药物递送的组合物,所述组合物包含作为活性成分的特异性结合claudin 3的细胞外第二环(ECL-2)的抗体或其功能性片段。
此外,本发明提供了用于细胞内药物递送的组合物,所述组合物由特异性结合claudin 3的细胞外第二环(ECL-2)的抗体或其功能性片段组成。
此外,本发明提供了用于细胞内药物递送的组合物,所述组合物主要由特异性结合claudin 3的细胞外第二环(ECL-2)的抗体或其功能性片段组成。
根据本发明的又一方面的实施方式提供了用于预防和治疗癌症的组合物,所述组合物包含作为活性成分的抗体-药物缀合物,在所述抗体-药物缀合物中所述抗体或功能性片段结合至药物。
此外,本发明提供了由作为活性成分的抗体-药物缀合物组成的用于预防和治疗癌症的组合物,在所述抗体-药物缀合物中所述抗体或功能性片段结合至药物。
此外,本发明提供了主要由作为活性成分的抗体-药物缀合物组成的用于预防和治疗癌症的组合物,在所述抗体-药物缀合物中所述抗体或功能性片段结合至药物。
此外,根据本发明的又一方面的实施方式提供了抗体-药物缀合物,所述抗体-药物缀合物包含特异性结合claudin 3的细胞外第二环(ECL-2)的抗体或其功能性片段,以及结合至所述抗体或其功能性片段的药物;以及用于预防和治疗癌症的组合物,所述组合物包含作为活性成分的所述抗体-药物缀合物。
此外,本发明提供了抗体-药物缀合物,所述抗体-药物缀合物包含特异性结合claudin3的细胞外第二环(ECL-2)的抗体或其功能性片段,以及结合至所述抗体或其功能性片段的药物;以及用于预防和治疗癌症的组合物,所述组合物由作为活性成分的所述抗体-药物缀合物组成。
此外,本发明提供了抗体-药物缀合物,所述抗体-药物缀合物包含特异性结合claudin3的细胞外第二环(ECL-2)的抗体或其功能性片段,以及结合至所述抗体或其功能性片段的药物;以及用于预防和治疗癌症的组合物,所述组合物主要由作为活性成分的所述抗体-药物缀合物组成。
根据本发明又一方面的实施方式提供了一种嵌合抗原受体(CAR)蛋白,所述CAR蛋白包含:i)本发明的抗体或其功能性片段、ii)跨膜结构域以及iii)细胞内信号转导结构域。此外,提供了嵌合抗原受体(CAR)蛋白,所述CAR蛋白包含:i)特异性结合claudin3的细胞外第二环(ECL-2)的抗体或其功能性片段、ii)跨膜结构域以及iii)细胞内信号转导结构域。
根据本发明的另一方面,提供了编码所述嵌合抗原受体(CAR)蛋白的多核苷酸,包含所述多核苷酸的重组载体以及用所述载体转化的细胞(特别是免疫细胞)。
根据本发明的再一方面的实施方式分别提供了所述抗体或其功能性片段在制备用于claudin 3检测的试剂、用于癌症诊断的试剂、用于对癌症进行成像的试剂以及用于对癌细胞特异的药物递送的试剂中的用途。
根据本发明的再一方面,分别提供了用于claudin 3的特异性检测的方法、用于诊断癌症的方法、用于癌症成像的方法以及用于对癌细胞特异的药物递送的方法,所述方法包括给有需要的对象施用有效量的组合物,所述组合物包含作为活性成分的所述抗体或其功能性片段。
根据本发明的再一方面的实施方式分别提供了所述抗体-药物缀合物在制备用于预防和治疗癌症的试剂中的用途,在所述抗体-药物缀合物中所述抗体或其功能性片段结合至药物。
根据本发明的再一方面的实施方式提供了用于预防和治疗癌症的方法,所述方法包括给有需要的对象施用有效量的包含作为活性成分的所述抗体-药物缀合物的组合物,在所述抗体-药物缀合物中所述抗体或其功能性片段结合至药物。
根据本发明的再一方面的实施方式提供了所述抗体或其功能性片段在制备细胞内药物递送试剂中的用途,所述抗体或其功能性片段特异性结合claudin 3的细胞外第二环(ECL-2)。
根据本发明的再一方面,提供了用于细胞内药物递送的方法,所述方法包括给有需要的对象施用有效量的组合物,所述组合物包含作为活性成分的特异性结合claudin 3的细胞外第二环(ECL-2)的抗体或其功能性片段。
根据本发明再一方面的实施方式提供了特异性结合claudin 3的细胞外第二环(ECL-2)的抗体的功能性片段在制备预防和治疗癌症的试剂中的用途;以及结合至药物的抗体-药物聚合物。
根据本发明的再一方面的实施方式提供了用于治疗癌症的方法,所述方法包括给有需要的对象施用有效量的组合物,所述组合物包含作为活性成分的特异性结合claudin3的细胞外第二环(ECL-2)的抗体或其功能性片段以及结合至所述抗体或其功能性片段的药物。
在下文中,将更详细地描述本发明。
在本发明中,“抗体”也称为免疫球蛋白(Ig),并且是选择性结合抗原并参与生物免疫的蛋白质的通用术语。自然界中发现的所有抗体通常由两对轻链(LCs)和重链(HCs)(其为数个结构域的多肽)组成或基于两对HC/LC。存在5种类型的构成哺乳动物抗体的重链,由希腊字母α、δ、ε、γ和μ定义,并且取决于重链的类型分别构造出不同类型的抗体(例如IgA、IgD、IgE、IgG和IgM)。存在2种构成哺乳动物抗体的轻链,由λ和κ定义。
根据氨基酸序列变异性,抗体的重链和轻链在结构上分为可变区和恒定区。具体取决于抗体的类型,重链的恒定区由3个或4个重链恒定区组成,例如CH1、CH2和CH3(IgA、IgD和IgG抗体)和CH4(IgE和IgM抗体),并且轻链由CL(一个恒定区)组成。重链可变区和轻链可变区分别由重链可变区(VH)或轻链可变区(VL)的一个结构域组成。轻链和重链并排排列,每个可变区和恒定区通过一个共价二硫键连接,并且与轻链连接的2个分子的重链通过2个共价二硫键连接以形成整个抗体。整个抗体通过重链和轻链的可变区特异性结合抗原,并且由于整个抗体由2个重链和轻链对(HC/LC)组成,一个分子的整个抗体通过2个可变区具有与相同的2个抗原结合的二价单特异性。
包括抗体结合抗原的位点的可变区被细分为具有低的序列变异性的框架区(FR)以及作为具有高的序列变异性的高变区的互补决定区(CDR)。VH和VL分别具有3个CDR和4个FR,从N端到C端以FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4的顺序排列。在抗体的可变区内具有最高的序列变异性的CDR直接结合抗原,这对抗体的抗原特异性最为重要。
在本发明中,术语“亲和力”是指分子(例如抗体)的单个结合位点与其结合伴侣(例如抗原)之间的非共价相互作用的总和的强度。
除非另有说明,如本文所使用的“结合亲和力”是指反映结合对的成员(例如抗体和抗原)之间1∶1相互作用的固有结合亲和力。分子X对其伴侣Y的亲和力通常可表示为解离常数(Kd)。在本发明中,抗体的“亲和力”表示为Kd,其意为如上所述的抗体-抗原相互作用的平衡解离常数。抗体结合抗原的Kd值越大,与特定抗原的结合亲和力越弱。可通过本领域已知的常规方法来测量Kd或亲和力,并且例如可使用如表面等离振子共振或LigandTracer Green的测量装置。
在本发明中,“Claudin 3(也称为CLDN3)”是属于claudin家族的蛋白质,并且存在于紧密连接出现的部分,并且其存在于紧密连接存在的区域并在紧密连接中去除细胞之间的空间中发挥独特作用。
紧密连接是连接生物体(例如动物)的组织中相邻细胞膜的刚性结构。Claudin 3为调节小的溶质(如离子)的细胞间渗透性的结构蛋白。Claudin 3为具有4个跨膜区域的蛋白质,并且具有使2个肽环暴露于细胞外部的结构。在2个肽环中,比在claudin3的整个蛋白质序列中更靠近N端的氨基酸区域的环被称为第一细胞外环(在本发明中称为ECL-1或EL1),并且另一环在本发明中称为细胞外第二环(在本发明中称为ECL-2或EL2)。优选地,细胞外第一环为含有claudin 3蛋白质氨基酸序列的氨基酸27-80的区域,第二细胞外环为含有claudin 3蛋白质氨基酸序列的氨基酸144-159的区域(SEQ ID NO:2)。
Claudin 3已知可作为产气荚膜梭菌(Clostridium perfringens)肠毒素(CPE)的毒素受体。CPE结合至Claudin 3和Claudin 4,然后形成导致细胞坏死的大的复合物,造成细胞膜上的空隙。
另一方面,claudin蛋白的细胞外结构域参与了TJ(紧密连接)的形成。在正常的融合上皮细胞单层中,claudin 3被认为存在于外侧膜尖端部位的TJ链中。推测上皮肿瘤形成过程中有丝分裂纺锤体的调节异常和肿瘤细胞的平面外分化诱导TJ成分在细胞表面的异常定位(Saeki R等,Potency of claudin-targeting as antitumor therapy Mol CellPharmacol.2010;2:47-51)。就此而言,据报道Claudin 3蛋白在许多癌性组织(例如卵巢癌、前列腺癌、乳腺癌、子宫癌、肝癌、肺癌、胰腺癌、胃癌、膀胱癌和结肠癌)中增加了暴露的程度。可获得瑞典人类蛋白质地图(HPA)网站(http://www.proteinatlas.org/)作为Claudin 3疾病表达谱的参考。Claudin 3和Claudin 4的表达在化疗耐药和/或复发性子宫癌(其已知在美国的妇科癌症中具有最高的死亡率)中特别高。然而,特异性检测在肿瘤状态下暴露的claudin 3仍然存在限制。
在本发明中,如果claudin 3在本领域中被称为claudin 3,其特定生物学起源和序列可不受特别限制。例如,本发明的claudin 3包括:来源于小鼠(小家鼠,Mus musculus)并且已知为NCBI(Genbank)登记号No.Q9Z0G9等的序列;来源于大鼠(褐家鼠,Rattusnorvegicus)并且已知为NCBI(Genbank)登记号No.Q63400等的序列;来源于鸡(原鸡,Gallus gallus)并且已知为NCBI(Genbank)登记号No.Q98SR2等的序列;来源于犬(灰狼,Canis lupus domesticis)并且已知为NCBI(Genbank)登记号No.Q95KM5等的序列;来源于猴(恒河猴,Macaca mulatta)并且已知为UniProtKB Entry.F6RQF6等的序列以及来源于人(智人,homo sapiens)并且已知为NCBI(Genbank)登录号No.O15551等的序列(参见SEQ IDNO:1)。
并且,作为此类抗体及其功能性片段的实例,本发明提供的具有独特的CDR序列的抗体对表达claudin 3的细胞具有显著的ADCC(抗体依赖性细胞毒性)作用,并且自身具有抗癌作用。此外,与已知的claudin 3抗体相比,其特异性地仅靶向claudin 3而不与其它claudin家族发生交叉反应的能力优异,表现出非常优异的结合能力(亲和力)。还确认了其内化细胞的能力,因此其具有作为癌症的诊断、成像和药物递送系统的优异的功能。特别地,本发明的抗体及其功能性片段特异性地粘附至claudin 3的ECL-2区域,因此使得claudin 3形成不完全连接,这与不暴露于表面的正常组织不同。本发明的抗体(或其功能性片段)是选择性可接近的,并且该能力显著降低了抗癌药对正常细胞的毒性问题,并且具有更大的技术意义。
具体而言,本发明提供了包含重链可变区和轻链可变区的抗体或其功能性片段,所述抗体或其功能性片段包含以下CDR序列:
重链可变区,所述重链可变区包含重链互补决定区1(VH-CDR1)、重链互补决定区2(VH-CDR2)以及重链互补决定区3(VH-CDR3),所述重链互补决定区1包含由SEQ ID NO:3限定的氨基酸序列,所述重链互补决定区2包含由SEQ ID NO:4限定的氨基酸序列,所述重链互补决定区3包含由SEQ ID NO:5限定的氨基酸序列;以及
轻链可变区,所述轻链可变区包含轻链互补决定区1(VL-CDR1)、轻链互补决定区2(VL-CDR2)以及轻链互补决定区3(VL-CDR3),所述轻链互补决定区1包含由SEQ ID NO:6限定的氨基酸序列,所述轻链互补性决定区2包含由SEQ ID NO:7限定的氨基酸序列,所述轻链互补决定区3包含由SEQ ID NO:8限定的氨基酸序列。
本发明还提供了包含重链可变区和轻链可变区的抗体或其功能性片段,所述抗体或其功能性片段包含以下CDR序列:
重链互补决定区1(VH-CDR1),所述重链互补决定区1包含由SEQ ID NO:18限定的氨基酸序列;重链互补决定区2(VH-CDR2),所述重链互补决定区2包含由SEQ ID NO:19限定的氨基酸序列;以及重链可变区,所述重链可变区包含重链互补决定区3(VH-CDR3),所述重链互补决定区3包含由SEQ ID NO 20限定的氨基酸序列;以及
轻链互补决定区1(VL-CDR1),所述轻链互补决定区1包含由SEQ ID NO:21限定的氨基酸序列;轻链互补决定区2(VL-CDR2),所述轻链互补决定区2包含由SEQ ID NO:22限定的氨基酸序列;以及轻链可变区,所述轻链可变区包含轻链互补决定区3(VL-CDR3),所述轻链互补决定区3包含由SEQ ID NO:23限定的氨基酸序列。
本发明的抗体的种类未特别限定,只要其具有上述CDR的组合即可。具体而言,其可选自由IgG、IgA、IgM、IgE和IgD所组成的组,并且特别优选IgG抗体。IgG其亚型包括但不限于IgG1、IgG2、IgG3、IgG4等。此外,其可为来源于一个B细胞的单克隆抗体或来源于多个B细胞的多克隆抗体,但优选抗体为单克隆抗体,单克隆抗体是其重链和轻链氨基酸序列基本上相同的一组抗体。此外,本发明的抗体或其片段可缀合至酶、荧光物质、放射性物质和蛋白质,但不限于此。
本发明的抗体可衍生自任何动物,包括哺乳动物(包括人、鸟)等,优选衍生自人,或不同于人源抗体的物种。其可为包含衍生自动物的抗体的一部分的嵌合抗体。
在本发明中,抗体的功能性片段是指维持整个抗体的抗原特异性结合能力的片段,并且具体而言,其可为Fab、F(ab')、F(ab')
Fab(片段抗原结合)是抗体的抗原结合片段,并且由每个重链和轻链的一个可变结构域和一个恒定结构域组成。F(ab')
本发明的抗体或其功能性片段特异性结合claudin 3,并且特别地,其特征在于通过以非常高的亲和力特异性附着至claudin 3的细胞外环2(ECL-2)而被内化至细胞内。
对claudin 3的具体生物学来源没有特别限制,只要其在本领域中已知为claudin3即可,并且其包括例如如上所述的来源于小鼠、人、大鼠、鸡、犬或猴的claudin 3。优选地,其可意为来源于人的claudin 3,并且人claudin 3的ECL-2优选包括由SEQ ID NO:2限定的氨基酸序列。
在本发明的实施方式中,确认了本发明的抗体与其它claudin家族无交叉反应,所述其它claudin家族与claudin 3具有高的系统发生关系,因此证明了本发明的抗体的结合特异性非常优异。此种高水平的结合特异性非常有意义,因为可通过检测claudin 3(尤其是人claudin 3)并将其用于特定疾病(尤其是特征在于claudin 3的异常表达(过表达)的疾病)的诊断和成像来提供高准确度的信息。
因此,本发明提供了用于检测claudin 3的组合物和试剂盒,所述组合物和试剂盒包含作为活性成分的所述抗体或其功能性片段。此外,本发明提供了特异性检测claudin 3的方法,所述方法包括:(1)使本发明的抗体或其功能性片段与样品接触;以及(2)检测所述抗体或其功能性片段。
此外,本发明提供了用于检测claudin 3的组合物和试剂盒,所述组合物和试剂盒由所述抗体或其功能性片段组成。
此外,本发明提供了用于检测claudin 3的组合物和试剂盒,所述组合物和试剂盒主要由所述抗体或其功能性片段组成。
可以以标记状态提供本发明的抗体或其功能性片段,以便于鉴定与claudin 3的结合、claudin 3的检测和定量。即,可通过连接至可检测标记(例如共价结合或交联)来提供。可检测标记包括但不限于发色酶(例如过氧化物酶、碱性磷酸酶)、放射性同位素(例如
本发明的抗体或其功能性片段可作为用于进行诊断分析的检测试剂盒或诊断试剂盒提供,并且在此情况下,以预定量包装的试剂与说明手册一起提供。当抗体用酶标记时,试剂盒可含有酶所需的辅因子作为提供底物的底物前体,以及发色团或荧光团。此外,可包括其它添加剂,例如稳定剂和缓冲剂(例如封闭缓冲剂或裂解缓冲剂)。多种试剂的相对量可广泛变化以提供试剂溶液的充分优化测定的灵敏度的浓度。
通常可以以含有赋形剂的冻干的干粉提供试剂,所述试剂将在溶解时提供具有适当浓度的试剂溶液。
试剂盒包括Western印迹分析、ELISA(酶联免疫吸附测定)、放射免疫测定、放射性免疫扩散法、octeroni免疫扩散法、火箭免疫电泳、组织免疫染色、免疫沉淀测定、补体结合测定、流式细胞术(FACS)和蛋白质芯片分析,并且根据每种分析方法一起提供的试剂、辅助物质、容器和固体支持物是本领域众所周知的。
根据claudin 3特异性检测方法,本领域普通技术人员可测量样品中存在(或包含)的claudin 3蛋白的存在与否和浓度。如本文所使用的检测包括定量和/或定性分析,并且包括存在与否的检测以及浓度测量,并且此类方法在本领域中是已知的,并且本领域技术人员能够选择用于本申请的实践的合适方法。
在步骤(1)之前,本领域技术人员可适当地选择使用抗体或其功能性片段来检测蛋白质的已知方法,并制备适合所选择的方法的样品。
此外,样品可为通过从被诊断为特征在于claudin3的异常(过度)表达的疾病(例如癌症)的对象收集的活组织检查中获得的细胞或组织、全血(血液)、血清、血浆、唾液、脑脊髓液等,但不限于此。
使用抗体检测蛋白质的方法包括例如Western印迹、免疫印迹、斑点杂交、免疫组织化学染色、酶免疫测定(ELISA)、放射免疫测定、竞争性结合分析、免疫沉淀等,但不限于此。例如,对于免疫组织化学染色,可进行预处理(例如固定和封闭细胞或组织的切片)。
接下来,在步骤(1)中,使根据本发明的抗体或其功能性片段与如上所述制备的样品接触。通过接触形成抗原(claudin 3)-抗体复合物。
在步骤(2)中,通过检测样品中生成的抗原-抗体复合物来测量样品中claudin 3蛋白的存在与否及其水平。如上所述,可以以标记状态提供用于检测的本发明的抗体或其功能性片段,并且在此情况下可立即检测标记。否则,可使用单独标记的二抗。二抗是结合至一抗(在此情况下为本发明的抗体或其功能性片段)的Fc区的抗体,并且此类二抗的用途在本领域中是众所周知的。
根据标签的检测方法在本领域中是众所周知的,但可例如通过以下方法来进行。如果将荧光物质用作可检测标记,可使用免疫荧光染色。例如,在使本发明的被荧光物质标记的肽与样品反应并去除未结合或非特异性结合产物后,可在荧光显微镜下观察肽的荧光。此外,当使用酶(例如荧光素酶、过氧化物酶、半乳糖苷酶等)作为可检测标记时,通过酶反应由底物的显色反应来测量吸光度,并且在放射性物质的情况下,可通过测量发出的辐射量(例如闪烁计数测量)来进行。此外,本发明的抗体或其片段以缀合至生物素的形式制备,并且可通过与适当标记的链霉亲和素反应来检测。此外,可根据检测标签根据已知的成像方法对检测结果进行成像。
因此,本发明的抗体或其功能性片段可用于特征在于claudin 3的(过)表达的疾病的诊断和成像。作为可能通过本发明中的诊断和成像检测的疾病,只要其在现有技术中已知伴有claudin 3异常表达(特别是过表达)即可,类型无特别限制,但可优选靶向癌症。因此,本发明提供了包含本发明的抗体或其功能性片段作为活性成分的用于癌症诊断的组合物以及用于对癌症进行成像的组合物。
还提供了由本发明的抗体或其功能性片段组成的用于癌症诊断的组合物以及用于对癌症进行成像的组合物。
此外,提供了主要由本发明的抗体或其功能性片段组成的用于癌症诊断的组合物以及用于对癌症进行成像的组合物。
在本申请中,对癌症(肿瘤)的类型没有特别限制,但可优选为与正常状态相比过表达claudin 3的癌症类型,更优选上皮癌,并且具体实例包括但不限于卵巢癌、结肠癌、膀胱癌、肺癌、肝癌、胃癌、食道癌、乳腺癌、前列腺癌、胰腺癌、子宫癌、宫颈癌或黑色素瘤。
此外,如上所述,本发明的抗体或其片段对claudin 3具有非常高的结合特异性,并且特征在于结合至claudin 3(特别是ECL-2)后被内化至细胞中。此种进入细胞的能力在抗体-药物缀合物(ADC)的开发中提供了极大的优势,并且众所周知,为使ADC表现出优异的药物功效,ADC需要进入细胞(内化)。
在本发明中,内化意为进入(渗透)细胞内部,并且对内化的类型或种类没有特别限制,但例如其可为胞吞作用。
因此,本发明提供了用于对癌细胞特异的药物递送的组合物,所述组合物包含以上所述的本发明的抗体或其功能性片段作为活性成分。
此外,提供了用于对癌细胞特异的药物递送的组合物,所述组合物由以上所述的本发明的抗体或其功能性片段组成。
此外,本发明提供了用于对癌细胞特异的药物递送的组合物,所述组合物主要由以上所述的本发明的抗体或其功能性片段组成。
具体而言,本发明提供了抗体-药物缀合物,其中药物结合至上述抗体或其功能性片段。此外,提供了用于预防和治疗癌症的组合物,所述组合物包含作为活性成分的抗体或其功能性片段以及结合至所述抗体或其功能性片段的药物。
在本发明中,术语“抗体-药物缀合物(ADC)”是指其中本发明的抗体(或其功能性片段)与药物连接的缀合物,也可称为免疫缀合物。可使用本领域已知的各种方法来制备抗体-药物缀合物。
抗体-药物缀合物可为其中2个分子直接结合,或2个分子通过任何手段(例如接头)间接地结合的抗体-药物缀合物。接头可为不可裂解的接头或可裂解的接头。通常,已知将ADC理想地设计为通过例如接头的手段间接结合,然后药物可在靶细胞内裂解。接头可被细胞内环境中存在的裂解剂(例如溶酶体或内体)裂解,并且可为被裂解剂例如细胞内肽酶或蛋白酶(例如溶酶体或内体的蛋白酶)裂解的肽接头。通常,肽接头具有至少2个以上氨基酸的长度。例如,可裂解的接头为pH敏感的,并且在特定的pH值下可能对水解敏感。通常,表明了pH敏感的接头可在酸性条件下被水解。例如,可在溶酶体中被水解的酸不稳定接头可为例如腙、缩胺基脲、缩氨基硫脲、顺式乌头酰胺、原酸酯、乙缩醛和缩酮。作为另一实例,可在还原条件下切割接头,例如,二硫键可与其对应。可使用SATA(N-琥珀酰亚胺基-S-乙酰基硫代乙酸酯)、SPDP(N-琥珀酰亚胺基-3-(2-吡啶基二硫代)丙酸酯)、SPDB(N-琥珀酰亚胺基-3-(2-吡啶基二硫代)丁酸酯)和SMPT(N-琥珀酰亚胺基-氧羰基-α-甲基-α-(2-吡啶基-二硫代)甲苯)。
药物和/或药物接头可通过抗体的赖氨酸随机缀合,或可通过二硫键链被还原时暴露的半胱氨酸缀合。在某些情况下,接头-药物可通过基因工程化标签(例如肽或蛋白质中存在的半胱氨酸)结合。所述肽或蛋白质在肽或蛋白质的羧基末端具有缺失,或在肽或蛋白质的羧基(C)末端具有通过间隔物单元的共价键进行的添加。
在本发明中,术语“药物”可通过结合至本发明的抗体而增加治疗性抗体本身的效率,或增加抗体在血液中的半衰期,或到达抗体靶向的位置,并且包括但不限于可通过到达抗体的靶标位置并杀灭靶标中的癌症而用于治疗疾病的物质。实例包括细胞毒性药物、毒素、细胞因子、趋化因子、抗生素、酶(例如核酸酶)、放射性核素、光敏剂、光热纳米材料、纳米颗粒和胶束,但不限于此。
在本发明中,药物可直接连接(结合)至抗体,或通过已知方法间接连接。此外,可以以药物的特定支持形式(例如在胶束、纳米颗粒、脂质体或树状聚合物上支持的所有形式)给予结合至抗体的药物。
细胞毒性药物是指可用于疾病治疗的药物。例如,具有抗癌活性的药物(抗癌剂)有微管蛋白结构形成抑制剂、减数分裂抑制剂、拓扑异构酶抑制剂或DNA嵌入剂。细胞毒性药物包括美登醇、奥利斯他汀、尾海兔素、单端胞霉烯、CC-1065药物(NSC 298223)、卡奇霉素、烯二炔类、紫杉烷、蒽环霉素、甲氨蝶呤、阿霉素、长春地辛、长春花碱、多柔比星、美法仑、丝裂霉素C、苯丁酸氮芥、柔红霉素、道诺霉素、依托泊苷、替尼泊苷、洋红霉素、氨蝶呤、放线菌素、博来霉素、埃斯培拉霉素、5-氟尿嘧啶、美法仑、氮芥(二氯甲基二乙胺HCL)、顺铂及其类似物、顺铂、CPT-11、多西他赛、单甲基奥利斯他汀E、单甲基奥利斯他汀F或美坦新,DM,但不限于此。
在本发明中,术语“毒素”是指具有由生物体产生的具有毒性的药物,并且其类型没有特别限制,但包括植物毒素、动物毒素、细菌外毒素或细菌毒素。
如上所述,本发明的抗体不仅对claudin 3具有非常高的结合特异性,而且在抗体自身结合至claudin 3后通过ADCC(抗体依赖性细胞细胞毒性)具有显著的细胞毒性作用。
这在本发明的说明书的一个实施方式中很好地示出。因此,本发明提供了用于预防和治疗癌症的组合物,所述组合物包含本发明的抗体作为活性成分。
此外,提供了由本发明的抗体组成的用于预防和治疗癌症的组合物。
此外,提供了基本上由本发明的抗体组成的用于预防和治疗癌症的组合物。
抗体依赖性的细胞介导的细胞毒性(ADCC)是通过自然杀伤细胞使癌细胞死亡的机制之一。
NK细胞表达CD16,免疫球蛋白G(IgG)的Fc受体,并且通过该受体可进行其它形式的MHC非限制性杀灭。即,NK细胞的ADCC依赖于识别靶细胞的抗体的存在。当抗体结合至抗原,抗体的Fc区暴露,并且当暴露的Fc区结合至NK细胞的受体以形成桥时,通过由于受体结合导致的信号转导从NK细胞释放细胞毒性物质,引起对靶细胞的伤害。
如上所述,由于本发明的抗体本身具有抗癌作用,当将抗体与抗癌活性药物(特别是以ADC形式)一起提供时,其表现出显著的协同作用。
本发明还提供了编码抗体或其功能性片段的多核苷酸。
编码抗体或其功能性片段的多核苷酸的碱基组合没有特别限制,只要其可编码具有上述CDR构型的抗体或其片段即可。
当鉴定出氨基酸序列时,基于本领域已知的密码子信息产生编码该氨基酸序列的多核苷酸的技术是本领域众所周知的。
可以以包含所有DNA、cDNA和RNA序列的单链或双链核酸分子提供所述多核苷酸。
此外,本发明提供了重组表达载体,所述重组表达载体包含编码根据本发明的抗体或其片段的多核苷酸。
在本发明中,“重组”可与“遗传操纵”可互换使用,并且是指通过使用分子克隆实验技术(例如修饰、切割和连接基因)以天然状态中不存在的形式制造基因。
在本发明中,“表达”意为在细胞中产生蛋白质或核酸。
在本发明中,“重组表达载体”是能够在合适的宿主细胞中表达感兴趣的蛋白质或核酸(RNA)的载体,并且是指包含可操作地连接使得可表达多核苷酸(基因)插入的必要调节元件。“可操作地连接”是指核酸表达控制序列和编码感兴趣的蛋白质或RNA以执行一般功能的核酸序列之间的功能性连接,并且意为基因被表达控制序列连接而被表达。可使用本领域众所周知的基因重组技术来制备与重组载体的可操作连接,并且使用本领域通常已知的酶进行位点特异性DNA切割和连接。“表达控制序列”是指控制在特定宿主细胞中可操作连接的多核苷酸序列的表达的DNA序列。此类调节序列包括用于进行转录的启动子、用于调节转录的任何操纵子序列、编码合适的mRNA核糖体结合位点的序列、调节转录和翻译的终止的序列、起始密码子、终止密码子、聚腺苷酸化信号和增强子。载体的启动子可为组成型或诱导型。可操作地连接的基因序列和表达控制序列可包含在单个表达载体中,所述单个表达载体包含用于选择含有该载体的宿主细胞的选择标记和/或复制起点。此外,表达载体根据需要包含用于膜靶向或分泌的信号序列或前导序列,并且可根据目的以多种方式制备。
当宿主为埃希氏菌属(Escherichia)细菌时,信号序列可使用PhoA信号序列和OmpA信号序列;当宿主为芽孢杆菌属(Bacillus)细菌时,可使用α-淀粉酶信号序列和枯草杆菌蛋白酶信号序列;当宿主为酵母时,可使用MFα信号序列和SUC2信号序列。当宿主为动物细胞时,可使用胰岛素信号序列、α-干扰素信号序列、抗体分子信号序列,但不限于此。
对本发明的重组表达载体的类型没有特别限制,只要其为克隆领域中常用的载体即可,并且其实例包括但不限于质粒载体、粘粒载体、噬菌体载体和病毒载体。质粒包括大肠杆菌(E.coli)来源的质粒(pBR322、pBR325、pUC118和pUC119、pET-22b(+)),枯草芽孢杆菌(Bacillus subtilis)来源的质粒(pUB110和pTP5)以及酵母来源的质粒(YEp13、YEp24和YCp50)。作为病毒,可使用动物病毒,例如逆转录病毒、腺病毒或牛痘病毒,以及昆虫病毒,例如杆状病毒,并且可使用pcDNA。
在本发明中,重组载体包含编码抗体的轻链或其功能性片段的多核苷酸;编码重链或其功能性片段的多核苷酸可以以同时包含(插入)在一个载体中的形式提供,或可通过各自分别包含(插入)在2个(包括不同类型)载体中来提供。
此外,本发明提供了具有重组表达载体的转化细胞,所述重组表达载体包含编码根据本发明的抗体或其功能性片段的多核苷酸。
在本发明中,术语宿主细胞是指包含通过任何方式(例如电击法、钙磷酸酶沉淀法、显微注射法、转化法、病毒感染等)导入细胞中的异源DNA的原核或真核细胞。
对本发明的(宿主)细胞的类型没有特别限制,只要其可用于表达本发明的重组表达载体中含有的编码抗体或其片段的多核苷酸即可。具有根据本发明的重组表达载体的转化细胞(宿主细胞)可为原核生物(例如大肠杆菌)、真核生物(例如酵母或其它真菌)、植物细胞(例如烟草或番茄植物细胞)、动物细胞(例如人细胞、猴细胞、仓鼠细胞、大鼠细胞和小鼠细胞),昆虫细胞或由此衍生的杂交瘤。优选地,其可为来源于哺乳动物(包括人)的细胞。
作为更具体的实例,原核生物为革兰氏阴性或革兰氏阳性生物体,包括例如肠杆菌科(Enterobacteriaceae)、例如埃希氏菌属(Escherichia)例如大肠杆菌(E.Coli)、肠杆菌属(Enterobacter)、欧文氏菌属(Erwinia)、克雷伯氏菌属(Klebsiella)、变形杆菌属(Proteus)、沙门氏菌属(Salmonella)例如鼠伤寒沙门氏菌(Salmonella typhimurium)、沙雷氏菌属(Serratia)例如粘质沙雷氏菌(Serratia marcescans)、以及志贺氏菌属(Shigella)、以及枯草芽孢杆菌(B.subtilis)和地衣芽孢杆菌(B.licheniformis)、假单胞菌属(Pseudomonas)例如铜绿假单胞菌(P.aeruginosa)、以及链霉菌属(Streptomyces)。对本发明的细胞没有特别限制,只要它们能够表达本发明的载体即可,优选大肠杆菌,但不限于此,例如大肠杆菌ER2537、大肠杆菌B、大肠杆菌X1776(ATCC 31,537)、大肠杆菌W3110(ATCC 27,325)或表达LacZ的大肠杆菌,并且更优选大肠杆菌ER2537。作为本发明的细胞,酿酒酵母(Saccharomyces cerevisiae)最常用于真核生物中。然而,还可获得许多其它属、种和菌株,但不限于此,例如粟酒裂殖酵母(Schizosaccharomyces pombe);克鲁维酵母属(Kluyveromyces)宿主,例如乳酸克鲁维酵母(K.lactis)、脆壁克鲁维酵母(K.fragilis)(ATCC12,424)、保加利亚克鲁维酵母(K.bulgaricus)(ATCC 16,045)、K.ickeramii(ATCC24,178)、K.waltii(ATCC 56,500)、K.drosophi larum(ATCC 36,906)、耐热克鲁维酵母(K.thermotolerans)和马克斯克鲁维酵母(K.marxianus);耶氏酵母属(yarrowia)(EP402,226);巴斯德毕赤酵母(Pichia pastoris)(EP 183,070);念珠菌属(Candida);里氏木霉(Trichoderma reesia)(EP 244,234);粗糙脉孢菌(Neurospora crassa);许旺酵母属(Schwanniomyces)例如西方许旺酵母(Schwanniomyces occidentalis);以及丝状真菌,例如粗糙脉孢菌(Neurospora crassa)、青霉菌属(Penicillium)、弯颈霉属(Tolypocladium)以及曲霉属(Aspergillus)宿主,例如构巢曲霉(A.nidulans)和黑曲霉(A.niger)。
同时,本发明的细胞可为动物细胞,特别是脊椎动物细胞。培养物(组织培养物)中脊椎动物细胞的增殖已成为常规方法,并且技术可广泛获得。有用的哺乳动物宿主细胞的实例,但不限于此,可为通过SV40转化的猴肾CV1系(COS-7、ATCC CRL 1651)、人胚胎肾系(从悬浮培养物中亚克隆的293或293细胞)[Graham等,1977,J Gen Virol.36:59])、幼仓鼠肾细胞(BHK,ATCC CCL10)、中国仓鼠卵巢细胞/-DHFR(CHO,Urlaub等,1980,Proc.Natl.Acad.Sci.USA 77:4216;例如DG44)、小鼠Sertoli细胞(TM4,Mather,1980,Biol.eprod.23:243-251)、猴肾细胞(CV1 ATCC CCL 70)、非洲绿猴肾细胞(VERO-76,ATCCCRL-1587)、人宫颈癌细胞(HELA,ATCC CCL 2)、狗肾细胞(MDCK,ATCC CCL34)、水牛大鼠肝细胞(BRL 3A,ATCC CRL 1442)、人肺细胞(W138,ATCC CCL 75)、人肝细胞(Hep G2,HB8065)、小鼠乳腺肿瘤(MMT 060562,ATCC CCL51)、TRI细胞(Mather等,1982,AnnalsNY.Acad.Sci.383:44-68)、MRC 5细胞、FS4细胞、人肝癌细胞系(Hep G2)-HEK 293细胞(人胚胎肾细胞)和Expi293F
转化包括将核酸(编码本发明的抗体或其功能性片段的多核苷酸)导入生物体、细胞、组织或器官的任何方法。如本领域已知的,可通过根据宿主细胞选择合适的标准技术来进行。这些方法包括电穿孔、原生质融合、磷酸钙(CaPO
细胞包含编码抗体的轻链或其功能性片段的多核苷酸;并且可将以编码重链或其功能性片段的多核苷酸同时包含(插入)在一个载体中的形式提供的重组载体导入,或可将以多核苷酸分别包含(插入)在2个载体中的每个中的形式提供的多个重组载体导入一个或多个细胞中。用根据本发明的重组表达载体转化的细胞产生根据本发明的抗体的重链、轻链或其功能性片段。
本发明还提供了用于制备特异性结合claudin 3蛋白的抗体或其功能性片段的方法,所述方法包括:
(a)通过转化的细胞(在表达多核苷酸的条件下)制备包含轻链可变区和重链可变区的多肽;以及
(b)从细胞或培养细胞的培养基中回收多肽。
步骤(a)是通过培养转化的宿主细胞,从导入宿主细胞的重组表达载体制备根据本发明的抗体的重链、轻链或功能性片段的多肽。可根据本领域通常使用的方法适当选择用于培养宿主细胞的培养基的组成、培养条件和培养时间。例如,可商购获得的培养基,例如Ham's F10(Sigma-Aldrich Co.,St.Louis,M0)、最低必需培养基(MEM,Sigma-AldrichCo.)、RPMI-1640(Sigma-Aldrich Co.)和Dulbecco改良的Eagle培养基(DMEM,Sigma-Aldrich Co.)可能适合培养细胞,但不限于此。如有必要,可将激素和/或其它生长因子、盐、缓冲液、核苷酸、抗生素、微量元素和葡萄糖或等效能量源添加至介质中。
宿主细胞中产生的抗体分子可积累在细胞的细胞质中,通过适当的信号序列分泌至细胞或培养基外,或靶向周质。参考前述内容可理解。
此外,优选使用本领域已知的方法将根据本发明的抗体重折叠为蛋白质并具有功能结构(构象),以便维持对claudin 3(特别是ECL-2)的结合特异性。此外,当生产IgG型抗体时,重链和轻链可在不同的细胞中表达,并且重链和轻链可在不同的步骤中接触以形成完整的抗体,并且也可使重链和轻链在同一细胞中表达以在细胞内部形成完整的抗体。
步骤(b)为获得在宿主细胞中产生的抗体或其片段。
考虑到宿主细胞中产生的抗体或功能性片段多肽的特征、宿主细胞的特征、表达方法或多肽是否被靶向,本领域技术人员可适当地选择和调整获得方法。例如,可通过例如获得在其中培养宿主细胞的培养基并离心以去除杂质的方法来回收分泌至培养基中的抗体或其片段。如果需要,可在不影响抗体或其功能性片段的功能性结构的范围内裂解细胞,以释放和回收细胞内特定细胞器或细胞质中存在的抗体。此外,可对获得的抗体进一步进行通过例如色谱、过滤或渗析的方法除去并浓缩杂质的处理。
根据本发明的药物组合物可含有本发明的抗体、功能性片段或含有本发明的抗体和功能性片段的ADC,或可以以合适的形式与一种或多种药学上可接受的载体一起配制,并且其可进一步含有赋形剂或稀释剂。如本文所使用的术语“药学上可接受的”是指生理上可接受的并且当给人施用时不会引起过敏反应或类似反应(例如胃肠道疾病和头晕)的非毒性组合物。
药学上可接受的载体可进一步包括例如用于口服施用的载体或用于肠胃外施用的载体。
药学上可接受的载体可进一步包括例如用于口服施用的载体或用于肠胃外施用的载体。用于口服的载体可包括乳糖、淀粉、纤维素衍生物、硬脂酸镁和硬脂酸。此外,其可包括用于口服施用肽试剂的多种药物递送材料。此外,用于肠胃外施用的载体可包括水、合适的油、盐水、水性葡萄糖和二醇,并且进一步包括稳定剂和防腐剂。合适的稳定剂包括抗氧化剂,例如亚硫酸氢钠、亚硫酸钠或抗坏血酸。合适的防腐剂包括苯甲烃铵,对羟基苯甲酸甲酯或对羟基苯甲酸丙酯、以及氯丁醇。
除上述成分外,本发明的药物组合物可进一步包含润滑剂、湿润剂、甜味剂、调味剂、乳化剂和悬浮剂。
其它药学上可接受的载体和制剂可指本领域已知的所有类型。
本发明的组合物可通过任何方法给哺乳动物(包括人)施用。例如,其可为口服或肠胃外施用。
具体而言,本发明的组合物的施用途径可为已知的抗体施用方法,例如通过静脉内、腹膜内、颅内、皮下、肌内、眼内、动脉内、脑脊髓或病灶内途径的注射或输注,或通过下述持续释放系统进行注射或输注。例如,可全身或局部施用本发明的抗体。
本发明的药物组合物可根据上述给施用径配制为用于口服或肠胃外施用的试剂。
在根据本发明的药物组合物中,可在临床施用时以多种口服和肠胃外制剂施用抗体、其功能性片段或含有其的ADC。当配制时,其可使用通常使用的稀释剂或赋形剂,例如填充剂、稀释剂、粘合剂、润湿剂、崩解剂或表面活性剂来制备。用于口服施用的固体制剂包括片剂、丸剂、粉剂、颗粒剂、胶囊剂、锭剂等。这些固体制剂可通过混合至少一种赋形剂例如淀粉、碳酸钙、蔗糖或乳糖或明胶来制备。此外,除简单的赋形剂外,还可使用润滑剂,例如硬脂酸镁和滑石粉。用于口服施用的液体制剂包括混悬剂、内用溶液、乳剂和糖浆。除常用的简单稀释剂(例如水和液体石蜡)外,液体制剂中可含有数种赋形剂,例如润湿剂、甜味剂、香味剂和防腐剂。
用于肠胃外施用的试剂包括无菌水性溶液、非水溶剂、混悬剂、乳剂、冻干剂和栓剂。
在将任何生理上可接受的载体、赋形剂或稳定剂与具有期望的纯度的抗体混合之后,本发明的治疗组合物可以以冻干饼或水性溶液的形式制备以用于储存。可接受的载体、赋形剂或稳定剂在采用的剂量和浓度下对接受者是非毒性的,并且包括完全溶液,例如磷酸、柠檬酸和其它有机酸;抗氧化剂,包括抗坏血酸;低分子量(少于约10个残基)多肽;蛋白质,例如血清白蛋白,明胶或免疫球蛋白;亲水性聚合物,例如聚乙烯基吡啶酮;氨基酸,例如甘氨酸、谷氨酰胺、天冬酰胺、精氨酸或赖氨酸;单糖、二糖和其它碳水化合物,包括葡萄糖、甘露糖或糊精;螯合剂,例如EDTA;糖醇,例如甘露醇或失水山梨醇;成盐抗衡离子,例如钠;和(或)非离子表面活性剂,例如吐温、普朗尼克或聚乙二醇(PEG)。
可通过本领域已知的方法以注射剂、乳剂、洗剂、外用制剂、油、保湿剂,凝胶、气溶胶和鼻吸入剂的形式配制用于肠胃外施用的试剂。这些制剂描述于所有药物化学领域通常已知的制剂中。
在某些实施方式中,可通过鼻内喷雾、吸入和/或其它气溶胶递送载体来递送药物组合物。通过鼻内气溶胶喷雾将基因、多核苷酸和肽组合物直接递送至肺部的方法可参考例如在美国专利No.5,756,353和美国专利No.5,804,212中描述的方法。
本发明的抗体或其功能性片段的总有效量可以以单剂量施用,或可通过长时间施用多个剂量的分级治疗方案来施用。当作为ADC给出时,其剂量也可变化。本发明的药物组合物可根据疾病的程度和/或目的改变活性成分(本发明的抗体或其功能性片段)的含量,但可以以通常0.01mg/kg/天-1000mg/kg/天,优选0.1mg/kg/天-100mg/kg/天,更优选1mg/kg/天-20mg/kg/天的有效剂量以规则的间隔重复多次施用。然而,药物组合物的剂量是根据多种因素(例如配制方法、施用途径和治疗的频率,以及多种因素例如患者的年龄、体重、健康状况、性别、疾病的严重程度、饮食和排泄率)确定的。鉴于此,本领域普通技术人员能够确定本发明的组合物的适当的有效剂量。只要显示出本发明的效果,根据本发明的药物组合物不特别限于其制剂、施用途径和施用方法。
如上所述,本发明的抗体或其功能性片段的特征在于具有如上所述的独特CDR构型,并且因此具有针对claudin 3靶标优异的特异性和亲和力。
因此,本发明的抗体或其功能性片段可用于赋予细胞(特别是免疫细胞)靶向claudin-3的能力。
因此,本发明提供了包含本发明的抗体或功能性片段的CAR(嵌合抗原受体)。
具体而言,本发明提供了嵌合抗原受体(CAR)蛋白,所述CAR蛋白包含:
i)包含以上所述的本发明的抗体或其功能性片段的细胞外结构域;
ii)跨膜结构域;以及
iii)细胞内信号转导结构域。
在本发明中,术语“嵌合抗原受体(CAR)”是指天然不存在的受体,其可具有免疫效应细胞对特定抗原的特异性。
通常,CAR是指用于将单克隆抗体的特异性移植至T细胞中的受体。CAR通常由细胞外结构域(胞外结构域)、跨膜结构域和细胞内结构域(胞内结构域)组成。
所述(i)细胞外结构域包含以上所述的本发明的抗体或其功能性片段,并且其含有抗原结合区。用于CAR的抗体优选处于抗体片段的形式,更优选处于Fab或scFv的形式,但不特别限于此。
此外,所述(ii)CAR的跨膜结构域为连接至细胞外结构域的形式,并且可衍生自天然或合成的跨膜结构域。当来源于天然发生时,其可来源于膜结合蛋白或膜可渗透蛋白,其可为来源于多种蛋白(例如T细胞受体的α、β或θ链、CD28、CD3ε、CD45、CD4、CD5、CDS、CD9、CD16、CD22、CD33、CD37、CD64、CD80、CD86、CD134、CD137、CD154或CD8,但不限于此)的膜可渗透区的一部分。可从本领域已知的文献(关于膜可渗透蛋白的膜可渗透区部分是已知的)中获得此类跨膜结构域的序列。
在所述CAR中,(iii)细胞内信号转导结构域以连接至跨膜结构域的形式存在于细胞内。本发明的细胞内信号转导结构域是当抗原结合至CAR的抗原结合位点(即本发明的抗体或其功能性片段)时生成或/和传递主要引起细胞活化的信号的区域。
“细胞”的种类没有特别限制,但可优选为免疫细胞(免疫效应细胞)。免疫细胞的类型没有特别限制,只要其为本领域已知参与人体免疫功能的细胞即可。例如,其包括T细胞、NK(自然杀伤T)细胞、NKT(自然杀伤T)细胞、单核细胞、巨噬细胞或树突细胞,并且其意为包括其祖细胞。
术语“细胞活化”是指细胞的活性增加,并且此类活性的类型不受特别限制,但例如可促进细胞的免疫应答。特别地,当细胞为免疫细胞时,活化可理解为包括免疫细胞数量的增加以及促进细胞自身的免疫应答的作用两者。
细胞内信号转导结构域不特别限于其类型,只要当抗原结合至位于细胞外部的抗原结合位点(本发明的抗体或其功能性片段)时其可传递能引起细胞(特别是免疫细胞)活化的信号即可。
可使用多种类型的细胞内信号转导结构域,例如基于免疫受体酪氨酸的活化基序或ITAM,并且ITAM可包括CD3θ(ξ、θ)、TCRθ、FcRγ、FcRβ、CD3γ、CD3δ、CD3ε、CDS、CD22、CD79a、CD79b、CD278、CD66d、DAP10、DAP12、FcεRI(特别是γ)以及它们的组合(一个或2个以上),但不限于此。
此外,根据细胞类型,本发明的CAR可优选进一步包含和细胞内信号转导结构域一起的共刺激结构域,但不限于此。
共刺激结构域是本发明的CAR中包含的一部分,并且发挥通过细胞内信号转导结构域将除初级信号外的最大活化信号传递至相应细胞的作用。其是指包含共刺激分子的细胞内结构域CAR的细胞内部分。即,一些免疫细胞(例如T淋巴细胞和NK细胞)需要2个信号(即初级活化信号和共刺激信号)以实现最大活化。CAR还可任选地包含共刺激结构域,使得抗原与细胞外结构域的结合引起初级激活信号和共刺激信号的传递。
共刺激分子为细胞表面分子,其意为引起免疫细胞对抗原的充分应答所必需的分子,并且其种类没有特别限制,只要其在本领域中已知即可。例如,其可选自由以下所组成的组:特异性结合I类MHC分子的配体、TNF受体蛋白、免疫球蛋白样蛋白和细胞因子受体、整合素、SLAM蛋白(信号转导淋巴细胞活化分子)、NK细胞活化受体、BTLA、Toll配体受体、OX40、CD2、CD7、CD27、CD28、CD30、CD40、CDS、ICAM-1、LFA-1(CD11a/CD18、淋巴细胞功能相关抗原-1)、4-1BB(CD137)、B7-H3、CDS、ICAM-1、ICOS(CD278)、GITR、BAFFR、LIGHT、HVEM(LIGHTR)、KIRDS2、SLAMF7、NKp80(KLRF1)、NKp44、NKp30、NKp46、CD19、CD4、CD8α、CD8β、IL2Rβ、IL2Rγ、IL7Rα、ITGA4、VLA1、CD49a、ITGA4、IA4、CD49D、ITGA6、VLA-6、CD49f、ITGAD、CD11d、ITGAE、CD103、ITGAL、CD11a、LFA-1、ITGAM、CD11b、ITGAX、CD11c、ITGB1、CD29、ITGB2、CD18、LFA-1、ITGB7、NKG2D、NKG2C、TNFR2、TRANCE/RANKL、DNAM1(CD226)、SLAMF4(CD244、2B4)、CD84、CD96(触觉)、CEACAM1、CRTAM、Ly9(CD229)、CD160(BY55)、PSGL1、CD100(SEMA4D)、CD69、SLAMF6(NTB-A、Ly108)、SLAM(SLAMF1、CD150、IPO-3)、BLAME(SLAMF8)、SELPLG(CD162)、LTBR、LAT、GADS、SLP-76、PAG/Cbp、CD19a、CD83、PD-1以及它们的组合。共刺激结构域可为选自由此类共刺激分子以及它们的组合(一个或2个以上)所组成的组的分子的细胞内部分。
共刺激结构域可连接至信号转导结构域的N端或C端,并且可包含在多个信号转导结构域中。
构成CAR的每个结构域可直接连接,并且可选地,短寡肽或多肽接头可连接CAR的细胞内结构域和膜可渗透结构域。即使本发明的CAR中包含接头,若其为当抗原结合至位于细胞外的抗体时能够通过细胞内结构域诱导T细胞活化的接头,其长度不受特别限制。例如,可使用(G4S)3接头GGGGSGGGGSGGGGS(SEQ ID NO:17)。
此外,本发明提供了编码所述嵌合抗原受体(CAR)蛋白的多核苷酸以及包含所述多核苷酸的重组载体。多核苷酸的碱基组合没有特别限制,只要其编码包含抗体或其功能性片段的CAR蛋白即可,并且可通过本领域已知的多核苷酸合成技术生产。此外,载体包含编码CAR蛋白的多核苷酸,并且是指可用于将多核苷酸递送至细胞中的材料,并且参考重组载体的以上描述。
本发明还提供了带有载体的转化的细胞,所述载体含有编码CAR蛋白的多核苷酸。即,提供了经修饰以表达包含本发明的抗体或其功能性片段的CAR蛋白的细胞(表达CAR的细胞)。
细胞类型没有特别限制,并且取决于构成CAR的结构域的来源,可使用有利于信号转导的细胞类型。
在本发明中,修饰以表达CAR蛋白的细胞可优选为免疫细胞。
免疫细胞的种类没有特别限制,只要是本领域已知参与人体免疫功能的细胞即可,例如包括T细胞、NK(自然杀伤)细胞、NKT(自然杀伤细胞T细胞)、单核细胞、巨噬细胞、树突状细胞以及它们的祖细胞。最优选地,其可为T细胞。
在本发明中,术语“T细胞”是指来源于胸腺并且在细胞的免疫中起主要作用的淋巴细胞。T细胞包括CD4
例如,抗原特异性CD8
作为此类免疫细胞治疗剂,与正常细胞相比,经修饰以表达本发明的CAR的免疫细胞特异性识别并结合暴露于癌细胞的claudin 3(特别是ECL-2区域)。因此可看出,根据免疫细胞的活化,其可具有癌细胞治疗作用。考虑到现有的主要聚焦于血液癌的CAR修饰的免疫细胞治疗技术已构成了许多技术,并且也考虑到现有的CAR技术极有可能靶向正常细胞,因此与正常细胞相比本发明可仅特异性地靶向实体癌,以使副作用(特别是对正常细胞的副作用)小且可获得优异的实体癌治疗效果。因此,本发明可提供用于预防或治疗癌症的药物组合物,所述药物组合物包含本发明的CAR表达细胞作为活性成分。
此外,类似于上述抗体、ADC、CAR和CAR表达细胞(特别是免疫细胞)技术,本发明人提供了特异性结合claudin 3的胞外第二环的抗体或其功能性片段的上述药物递送用途。可通过借鉴前述内容来理解。
本发明提供了所述抗体或其功能性片段在制备用于claudin 3检测的试剂、用于诊断癌症的试剂、用于癌症进行成像的试剂以及用于对癌细胞特异的药物递送的试剂中的用途。
本发明提供了用于claudin 3的特异性检测的方法、用于诊断癌症的方法、用于对癌症进行成像的方法以及用于对癌细胞特异的药物递送的方法,所述方法包括给有需要的对象施用有效量的组合物,所述组合物包含作为活性成分的所述抗体或其功能性片段。
本发明提供了所述抗体或抗体或其功能性片段在制备用于预防和治疗癌症的药物中的用途,以及与药物结合的抗体-药物聚合物。
本发明提供了用于预防和治疗癌症的方法,所述方法包括给有需要的对象施用有效量的包含作为活性成分的所述抗体的组合物,或所述抗体或其功能性片段;以及与作为活性成分的药物结合的抗体-药物聚合物。
本发明提供了特异性结合claudin 3的细胞外第二环(ECL-2)的抗体或其功能性片段在制备细胞内药物递送试剂中的用途。
本发明提供了一种用于细胞内药物递送的方法,所述方法包括给有需要的对象施用有效量的组合物,所述组合物包含作为活性成分的特异性结合claudin 3的细胞外第二环(ECL-2)的抗体或其功能性片段。
本发明提供了特异性结合claudin 3的细胞外第二环(ECL-2)的抗体或其功能性片段在制备用于预防和治疗癌症的试剂中的用途;以及与药物结合的抗体-药物聚合物。
本发明提供了用于预防和治疗癌症的方法,所述方法包括给有需要的对象施用有效量的组合物,所述组合物包含作为活性成分的特异性结合claudin 3的细胞外第二环(ECL-2)的抗体或其功能性片段,以及与药物结合的抗体-药物聚合物。
本发明的“有效量”是指当给个体施用时显示出对癌症的改善、治疗、预防、检测、诊断或抑制作用的量,并且“对象”可为动物,优选哺乳动物,特别是包括人在内的动物,或可为来源于动物的细胞、组织、器官等。对象可为需要治疗的患者。
本发明的“治疗”通常是指改善癌症或癌症的症状,其可包括治愈,基本上预防或改善此类疾病的病症。其包括但不限于减轻、治愈或预防癌症引起的一种或多数症状。
本发明的术语“包含”以与“含有”或“特征在于”相同的方式使用,并且在组合物或方法中,不排除未提及的其它组成要素或方法。术语“由……组成”意为排除未单独描述的其它要素、步骤或成分。在组合物或方法的范围内,术语“主要由……组成”意为包括除所述组成要素或步骤外基本上不影响其基本特性的组成要素或步骤。
有益效果
特异性结合claudin 3的ECL-2的抗体及其功能性片段比靶向claudin 3的ECL-1的常规抗体或其它癌症抗原在癌细胞的检测、诊断、成像和对癌症治疗的应用(在ADC和CAR表达细胞(尤其是免疫细胞)中的应用)中更有效。特别地,作为其特定实例,包含本发明提供的独特CDR序列的抗体不仅自身具有抗癌能力,而且与已知的claudin 3抗体相比还表现出优异的癌细胞靶向能力而与其它claudin家族无交叉反应。其表现出优异的结合强度(亲和力),并且具有例如细胞内化的特性,因此在对上述用途的应用中显示出显著的效果。
附图简述
图1是关于选自使用生物淘选得到的CHO-CLDN3细胞系的scFv和使用ELISA得到的L-Claudin 3细胞系的scFv结合至CHO-K1细胞(阴性细胞系,对照)的流式细胞术的结果。
图2是关于选自使用生物淘选得到的CHO-CLDN3细胞系的scFv和使用ELISA得到的L-Claudin 3细胞系的scFv结合至CHO-CLDN3细胞的流式细胞术的结果。
图3作为分别在还原和非还原条件下产生的4G3 IgG抗体蛋白的SDS-PAGE实验结果,确认了每种抗体的轻链和重链均以预期的分子量表达良好。
图4a示出了claudin家族内的系统发生分析的关系。
图4b示出了在系统发生学上接近CLDN3的小鼠CLDN3和CLDN1以及CLDN4、CLDN5、CLDN6、CLDN8、CLDN9、CLDN17的细胞外第一环(EL1,细胞外第一环)和细胞外第二环区域(EL2,细胞外第二环)的序列同源性。
图5a和图5b示出了通过用本发明的4G3抗体处理经转化为表达每种人claudin家族蛋白的HEK293细胞并且进行流式细胞术来确认对CLDN3表达细胞的特异性结合能力的结果。
图5c示出了通过用本发明的4G3抗体处理经转化为表达小鼠CLDN3的HEK293细胞并且进行流式细胞术来确认对CLDN3表达细胞的结合能力的结果。
图6示出了通过用本发明的4G3抗体处理经转化以过表达CLDN3的hCLDN3/TOV-112D细胞、OVCAR-3和Caov-3(其为过表达claudin 3的卵巢癌细胞系)以及TOV-112D(其为具有非常低的claudin 3表达的细胞系),并且进行流式细胞术,从而对比地确认了4G3抗体的结合特异性的结果。
图7示出了使用本发明的4G3抗体的OVCAR-3、Caov-3、TOV-112D和hCLDN3/TOV-112D细胞的免疫沉淀分析的结果(输入∶细胞裂解物)。
图8a示出了使用对照抗体(对照IgG)的OVCAR-3、Caov-3、TOV-112D和hCLDN3/TOV-112D细胞的免疫荧光染色的结果。
图8b示出了使用4G3抗体的OVCAR-3、Caov-3、TOV-112D和hCLDN3/TOV-112D细胞的免疫荧光染色的结果。
图9a是本发明的抗体(4G3 IgG)结合至CHO-K1细胞(阴性细胞系,对照)的流式细胞术的结果。
图9b是本发明的抗体(4G3 IgG)结合至CHO-CLDN3细胞(阳性细胞系,对照)的流式细胞术的结果。
图9c是通过LigandTracer Green(ridgeview)测量本发明的抗体(4G3 IgG)在CLDN3表达细胞(hCLDN3/HEK293和hCLDN3/TOV-112D)中的结合亲和力(解离常数(K
图10a是表达融合蛋白的细胞hCLDN1-3/HEK293(所述融合蛋白包含作为胞外第一环的CLDN1的氨基酸1-104的区域以及作为细胞外第二环的CLDN3的氨基酸104-220的区域)和表达融合蛋白的细胞hCLDN3-1/HEK293(所述融合蛋白含有作为EL1的CLDN3的氨基酸1-103的区域以及作为EL2的CLDN1的氨基酸105-211的区域)中每种融合蛋白的表达(结构)模式的示意图。
图10b示出了在对针对hCLDN1-3/HEK293或hCLDN3-1/HEK293细胞的4G3抗体进行加工后的流式细胞术结果(上部)以及确认期望的融合蛋白是否在细胞中正确表达的蛋白免疫印迹结果(下部)。
图11a示出了使用免疫荧光染色观察随时间经过本发明的抗体结合至claudin 3,然后通过内吞作用进入卵巢癌细胞系OVCAR-3和Caov-3细胞的结果。
图11b示出了与已知附着至claudin 3(KM3907)的其它抗体对照的本发明的抗体的内化作用。
图12a-图12e示出了通过用本发明的4G3抗体处理并进行流式细胞术来对比地证实claudin 3在多种癌细胞中的表达水平的结果。
图13a-图13e示出了通过用4G3抗体处理细胞来浓度依赖性地证实抗体依赖性细胞介导的细胞毒性(ADCC)作用的结果。
图14a示出了确认了本发明的4G3抗体在肿瘤异种移植物的动物模型中的体内肿瘤靶向能力的结果。
图14b示出了在动物模型中进行器官提取后对荧光强度进行定量的结果。
实施例
下文将详细描述本发明。
然而,以下实施例仅仅是描述本发明,而本发明的内容并不限于以下实施例。
实施例1:特异性结合claudin 3(CLDN3)的ScFv的筛选
1-1.抗原
作为抗原,在筛选过程中,以表达claudin 3的细胞系和claudin 3脂质颗粒的形式分别提供claudin 3。使用CHO-K1细胞系制造表达claudin 3(NCBI参考号_O15551(参见SEQ ID NO:1))的细胞系。为构建claudin 3表达载体,使用限制酶HindIII和BamH1将claudin 3基因插入pcDNA3.1(invitrogen)。转染制备的claudin 3表达载体,并用400μg/ml遗传霉素(g418)处理以选择转化体。由Integralmolecular订购并使用使claudin 3暴露在表面上的脂质颗粒(以下称为claudin 3脂质颗粒)(目录号RR-0733A)。
1-2.scFv噬菌体筛选
为筛选特异性结合claudin 3的抗体,使用了噬菌体文库展示。
该文库为合成的人scFv文库,并且有关该文库的具体信息请参见A Novel HumanscFv Library with Non-Combinatorial Synthetic CDR Diversity(Bai X.等,PLoSONE.,10(10):e0141045(2015))。
scFv文库中表达的scFv用HA标签标记,以便可被抗HA FITC抗体(Genscript,A01621)检测到。
使用scFv文库如下进行生物淘选。
首先,使用实施例1-1中制备的表达claudin 3的CHO-K1细胞系(以下称为CHO-CLDN3)进行生物淘选。在室温下,用3%FBS/PBS封闭scFv库储备液。使用胰蛋白酶制备CHO-CLDN3细胞和CHO-K1细胞(阴性细胞系)各1×10
将大肠杆菌TG1细胞转移至SB/氨苄青霉素培养基中并培养直至OD600值达到0.5,然后加入1×10
将沉淀溶解在PBS中后,获得通过离心获得的上清液作为scFv文库溶液。重复该过程4次以获得特异性结合至claudin 3抗原的scFv候选组。
在第二种方法中,使用脂质颗粒进行生物淘选。将scFv库储备液与空脂质颗粒(不含Claudin 3的脂质颗粒)混合,并在室温下用4%脱脂牛奶同时进行封闭和消耗1小时。将1ml含有claudin 3脂质颗粒的PBS添加至免疫试管中,并在4℃下反应16小时,以覆盖试管的内表面。倒出抗原溶液并清洗1次以去除未包被的抗原。在室温下,用4%脱脂牛奶封闭免疫试管上包被的抗原(Cludin 3脂质颗粒)1小时。封闭完成后,除去脱脂牛奶,与scFv库储备液混合,并在室温下反应1小时。用PBS清洗后,将其与100mM TEA在室温下反应5分钟以使仅特异性结合的scFv-噬菌体被洗脱,并用pH 8.5Tris中和以制备scFv-抗原缀合物形式。将制备的scFv-抗原缀合物(凝集物)添加至大肠杆菌TG1细胞中进行感染,然后在37℃下在LB/氨苄青霉素/葡萄糖琼脂培养基中孵育过夜。将大肠杆菌TG1细胞转移至SB/氨苄青霉素培养基中培养直至OD600值达到0.5,然后添加1×10
1-3.筛选特异性结合claudin 3(CLDN3)的scFv抗体
为从实施例1-2中获得的scFv候选组中选择具有优异结合能力的scFv,对表达claudin 3的细胞系进行了ELISA分析。
用实施例1-1中制备的claudin 3表达载体将表达claudin 3的细胞系转染为L细胞(以下称为L-claudin 3细胞),然后使用600μg/ml的遗传霉素(g418)选择转化子。在实施例1-2的每个步骤中选择的每种文库储备液(分别使用用表达claudin 3的细胞系或claudin 3脂质体的筛选结果)在SB/氨苄青霉素/葡萄糖琼脂培养基中培养过夜,然后将各单个菌落接种至200μl SB/氨苄西林培养基中。在37℃下孵育3小时后,将其混合以使IPTG浓度变为1mM,然后在30℃下再次培养过夜。当培养完成时,将培养溶液离心以仅分离细胞,然后使用TES缓冲液裂解细胞以获得scFv。在分配有1×10
对于通过ELISA选择的scFv候选物,使用流式细胞术确认了与CHO-CLDN3细胞的结合。作为对照,使用天然CHO-K1细胞。使用胰蛋白酶将传代培养的细胞分离为单个细胞单元,并在3%FBS/PBS溶液中制备。将选择的scFv候选物接种至5ml SB/氨苄青霉素培养基中,在37℃下孵育3小时,混合以使IPTG浓度变为1mM,然后在30℃下再次培养过夜。当培养完成时,将培养溶液离心以仅分离细胞,然后使用TES缓冲液裂解细胞以获得scFv。将每组CHO-K1细胞(阴性细胞系,对照)和CHO-CLDN3细胞(实验组)制备为在3%FBS/PBS溶液中2×10
接下来,将使用claudin 3脂质颗粒进行的最终生物淘选结果(数据未显示)与在上述实验步骤中选择的scFv候选组的结果进行比较。在选择的scFv上进行测序,并在针对claudin 3脂质颗粒和表达claudin 3的细胞系(CHO-CLDN3细胞系或/和L-claudin 3细胞系)的实验中获得了2个2B4和4G3克隆。下表1中显示了2B4和4G3 scFv的氨基酸序列的分析结果。
[表1]
实施例2:4G3 scFv抗体向IgG的转换和表达
2-1.整个IgG表达载体的构建
将先前选择的4G3 scFv转换为IgG形式,其为更常用的抗体。基于scFv的CDR区构建了能够表达整个IgG形式的表达载体。首先,通过PCR分别获得scFv的轻链可变区和重链可变区,并将下表2示出的引物用于4G3。分别将轻链可变区序列克隆至pOptiVec(Invitrogen)(轻链恒定区序列插入其中的表达载体)中,并且将重链可变区序列克隆至pcDNA 3.3(Invitrogen)(重链恒定区序列插入其中的表达载体)中。轻链恒定区和重链恒定区与从载体克隆的scFv的轻链可变区和重链可变区一起表达,结果产生了包含scFv的CDR区的完整IgG抗体。
[表2]
2-2.表达整个IgG抗体的CHO-S细胞系(池)的构建
CHO-S细胞(Life Technologies Inc.)分别用于制备表达4G3 IgG抗体的细胞系。对于实施例2-1中获得的编码重链和轻链的基因序列,用灰仓鼠(Cricetulus griseus)物种进行密码子优化,并将这些序列克隆至
2-3.总IgG抗体生产和纯化
将2-2中制备的每种产生抗体的细胞系在CD FortiCHO
通过常规的SDS-PAGE技术分别确认了在还原和非还原条件下产生的IgG抗体蛋白,并证实了每种抗体的轻链和重链均以预期分子量表达良好。图3示出了4G3 IgG抗体的SDS-PAGE确认结果。
实施例3:本发明的抗体对claudin 3的结合特异性和结合能力的评价
3-1.多种claudin的CLDN/HEK293细胞系的构建
为确认实施例2-3中产生的抗体的抗原特异性,比较并评价了结合至在系统发生学上位于人CLDN3附近的claudin特别是人CLDN4(NCBI登录号:O14493)、CLDN5(O00501)、CLDN6(P56747)、CLDN8(P56748)、CLDN9(O95484)和CLDN17(P56750)(见图4A和图4B)的可能性。此外,在本实验中将典型的claudin CLDN1(O95832)用作对照组,尽管对其比上述claudin类型进行了更系统地分析。此外,检查了开发的抗体是否也结合至小鼠CLDN3(Q9Z0G9)(参见4b)。将编码上述claudin的每个基因克隆至pcDNA3.1(+)(Invitrogen)中。使用Fugene HD(E231A,Promega)转染试剂将由此制备的每种claudin表达载体转导至HEK293(KCLB)中,然后用G418选择抗性细胞系。
对于如此制备的可持续表达人claudin的细胞系(hCLDN/HEK293),使用市售的抗CLDN1(FAB4618G,R&D systems)、抗CLDN3(FAB4620F,R&D systems)、抗CLDN4(FAB4219F,R&D systems)、抗CLDN5(ab131259,Abcam)、抗CLDN6(ABIN1720916,Antibodies-online)、抗CLDN8(MAB5275,R&D systems)、抗CLDN9(ab187116,Abcam)和抗CLDN17(MAB4619,R&Dsystems)抗体确认每种claudin是否表达良好。
3-2.本发明的抗体在CLDN/HEK293细胞系中的交叉反应性的评价
在实施例3-1中制备的用于多种claudin的mCLDN3/HEK293s和hCLDNs/HEK293细胞系中证实了实施例2-3中制备的抗体的交叉反应性。原始HEK293细胞用作阴性对照。首先,使用细胞解离缓冲液(Gibco,13151-014)将细胞分离为单个细胞,然后接种2.5×10
反应后,将其用1%BSA/PBS清洗,用1∶100稀释度的山羊抗人IgG-FITC(109-095-098,Jackson Immunoresearch)作为二抗处理,并在冰上反应1小时。反应后,将其用1%BSA/PBS清洗,并使用BD FACSCalibur进行流式细胞术分析。
图5a和图5b是流式细胞术的结果,并且对比地显示了4G3抗体对claudin 3的结合特异性。在任何实验组中使用系统发生学上接近CLDN3的CLDN4、CLDN5、CLDN6、CLDN8、CLDN9和CLDN17均未观察到峰漂移。图5c中示出了使用小鼠CLDN3的实验结果,证实了本发明的抗体还结合至与人CLDN3具有高度同源性的小鼠CLDN3。
因此,证实了本发明的每种抗体不结合至除人CLDN3和小鼠CLDN3外的其它claudin家族。即,本发明的每种抗体仅特异性结合CLDN3,而与具有高水平同源性的其它claudin类型没有交叉反应。
3-3.体外癌细胞检测能力的确认_流式细胞术
确认了实施例2-3中制备的抗体与癌细胞的结合能力。在卵巢癌的情况下,使用过表达claudin 3的细胞系OVCAR-3(ATCC)和Caov-3(ATCC)、具有非常低的claudin 3表达的细胞系TOV-112D(ATCC)和转化为过表达CLDN3的hCLDN3/TOV-112D细胞。以与实施例3-1中所述相同的方式制备hCLDN3/TOV-112D细胞。以与实施例3-2相同的方式进行细胞的抗体处理和流式细胞术。
作为实验的结果,在表达claudin 3的细胞OVCAR-3、Caov-3和hCLDN3/TOV-112D中观察到峰漂移,而在阴性细胞系TOV-112D中未观察到峰漂移。代表性地,图6比较地示出了4G3抗体对癌细胞的结合特异性。
3-4.Claudin 3的特异性结合的再次确认_免疫沉淀
通过免疫沉淀再次确认了本发明的抗体结合癌细胞中的claudin 3。作为抗体阴性对照(对照IgG),使用可商购的全人抗体(009-000-003,Jackson Immunoresearch)。
用添加有蛋白酶抑制剂(11697498001,Roche)的PBS释放OVCAR-3(ATCC)、Caov-3(ATCC)、TOV-112D(ATCC)、hCLDN3/TOV-112D的各细胞,然后用超声波研磨机开启2秒后关闭5秒并重复10次,以15000rpm,4℃离心15分钟以获得上清液。通过BCA定量法测定各细胞裂解液(上清液)的蛋白质浓度,然后取1mg蛋白质,添加1μg各抗体,并且在4℃下旋转反应1小时。蛋白A珠(11719408001,Roche)用PBS平衡,并将珠用5%BSA/PBS封闭,同时在4℃下旋转1小时。将50μl珠添加至完成抗体反应的样品中,并在4℃下旋转1小时的同时进行反应。当抗体和珠之间的反应完成时,用PBS清洗3次后,添加30μl 2×SDS上样缓冲液,在100℃下煮沸10分钟,以12000rpm离心3分钟,并进行上清液处理以进行15%SDS凝胶电泳。
通过常规方法进行蛋白质印迹,并且此时将抗CLDN3(341700,Invitrogen)用作一抗。
作为分析的结果,在对照IgG处理组中未观察到条带,使用本发明的抗体的OVCAR-3、Caov-3和hCLDN3/TOV-112D细胞仅在实验组中观察到条带。图7示出了4G3抗体结合至细胞表达的claudin 3的程度。这确认了本发明的每种抗体均结合癌细胞的claudin 3蛋白。
3-5.Claudin 3的特异性结合的确认_免疫荧光
通过免疫荧光再次证实了本发明的抗体特异性靶向癌细胞中的claudin 3。将OVCAR-3(ATCC)、Caov-3(ATCC)、TOV-112D(ATCC)和hCLDN3/TOV-112D的各细胞以2×10
用Fluoromount
作为分析的结果,在对照抗体(对照IgG)处理组的所有细胞系中均未观察到荧光(参见图8A),而在本发明的抗体处理组中,在所有表达CLDN3的Caov-3、hCLDN3/TOV-112D和OVCAR-3细胞系的细胞表面均观察到荧光,并且在不表达CLDN3的TOV-112D细胞系中未观察到荧光。图8b代表性地示出了4G3抗体的实验结果。
3-6.与claudin 3的结合力的比较和结合动力学的确认
关于在实施例2-3中制备的4G3 IgG抗体,确认了它们结合至claudin 3的能力。使用CHO-CLDN3细胞进行流式细胞术,并且以与实施例1-3中相同的方式进行特定实验方法。原始的CHO-K1细胞用作对照,并且市售的抗CLDN3(FAB4620F,R&D系统)抗体用作对照组。
此外,使用LigandTracer Green(ridgeview)测量抗体对claudin 3的结合亲和力的确认。LignadTrcer Green(ridgeview)是基于细胞的测量设备,其可实时测量与FITC偶联的抗体是否结合至表达抗原的细胞上的抗原。使用FITC抗体标记试剂盒(53027,Pierce),将FITC偶联至与开发的抗体。3×10
[表3]
如图9a和图9b所示,确认了所有4G3 IgG抗体均表现出峰漂移并结合至claudin3。此时,在4G3 IgG抗体处理组中,峰漂移的差异更大,并且结果证实了4G3 IgG抗体比传统的市售抗体具有更好的对claudin 3的特异性结合能力。
此外,作为结合亲和力分析的结果,如图9c和表3所示,在2个细胞系中表达claudin3的细胞的4G3的动力学值(KD)分别为4.03nM(hCLDN3/HEK293)和2.35nM(hCLDN3/TOV-112D),并确认了4G3对于claudin3的高亲和力。这些结果表明,本发明的4G3 IgG抗体比现有的抗claudin3抗体具有更好的亲和力。例如,亲和力比“Chiara Romani等,Oncotarget.2015”的现有的IgGH6抗体高5倍以上。
实施例4:抗原结合位点的鉴定
具体而言,尝试在其中细胞中天然表达的CLDN3暴露于细胞外部的区域内确认本发明的抗体结合的抗原结合位点。因此,为证实这一点,制备了融合蛋白,其中对应于CLDN3的细胞外第一环和细胞外第二环的区域被替换为CLDN1中的对应区域。将表达CLDN1的氨基酸1-104和CLDN3的氨基酸104-220(hCLDN1-3)的基因或表达CLDN1氨基酸105-211和CLDN3氨基酸1-103的氨基酸(hCLDN3-1)的基因分别克隆至pcDNA3.1(+)(Invitrogen)中。将各基因转导至HEK293(KCLB)中后,用G418选择抗性细胞系以制备连续表达hCLDN1-3或hCLDN3-1的融合蛋白的细胞系。这些分别称为hCLDN1-3/HEK293和hCLDN3-1/HEK293(见图10a)。通过使用抗CLDN3(341700,Invitrogen)、抗CLDN1(sc-137121,Santa Cruz Biotechnology,Inc.)的常规蛋白质印迹法确认了期望的融合蛋白是否在各细胞系中表达(见图10b下部)。以与实施例3-2相同的方式进行hCLDN1-3/HEK293或hCLDN3-1/HEK293细胞的4G3抗体的处理以及流式细胞术。
作为分析的结果,如图10b所示,在hCLDN1-3/HEK293的实验中观察到峰漂移,而在hCLDN3-1/HEK293的实验中未观察到峰位移。
结果,确认了4G3抗体结合hCLDN3的细胞外第二环区。
实施例5:IgG 4G3抗体的胞吞作用的确认
为确认本发明的抗体在细胞中的内化能力,将过表达claudin 3的卵巢癌细胞系OVCAR-3(ATCC)和Caov-3(ATCC)以每片2×10
图11a中作为观察结果证实了4G3抗体进入细胞并且位于溶酶体上。此外,如图11b所示,在已知的抗claudin 3抗体KM3907的情况下未观察到细胞内化。
实施例6:针对癌细胞的抗体依赖性细胞毒性的确认
为确认本发明的抗体的抗体依赖性的细胞介导的细胞毒性(ADCC),使用在NK-92MI中连续表达Fc受体CD16基因的细胞系(以下称为NK-92MI-CD16)。为制备NK-92MI-CD16细胞系,使用Nhe1和EcoR1限制酶将CD16基因插入pcDNA3.1(+)(Invitrogen),并通过电穿孔将CD16表达载体转染至NK-92MI细胞中。
用G418化合物选择抗性细胞系后,用FACS Aria设备分离出过表达的细胞系。为确认claudin 3的表达在多种癌细胞中的作用,首先用该抗体通过流式细胞术来确认各细胞的claudin 3的表达水平,然后比较MFI(参见图12a-图12e)。以与实施例3-2相同的方式进行细胞的抗体处理和流式细胞术。为观察抗体依赖性细胞毒性,将各细胞以2×10
作为图13a-图13e中的分析的结果,在对照抗体(对照IgG)处理组中未观察到细胞毒性,而在4G3抗体处理组中,在表达claudin 3的细胞中观察到细胞毒性。
当根据claudin 3表达的量比较ADCC作用时,随着claudin 3表达的MFI值增加,细胞毒性EC
在上述实验中,连续表达CD16(FcγRIIIa)的NK-92MI-CD16细胞表现出对claudin3抗原的细胞毒性作用,表明可通过类似于CAR-NK技术原理的机制杀灭癌细胞。实际上,ADCC功效评价显示取决于claudin 3的表达,功效趋势是一致的,这表明所开发抗体可应用于CAR-NK细胞的制备。
实施例7:体内肿瘤靶向能力的确认
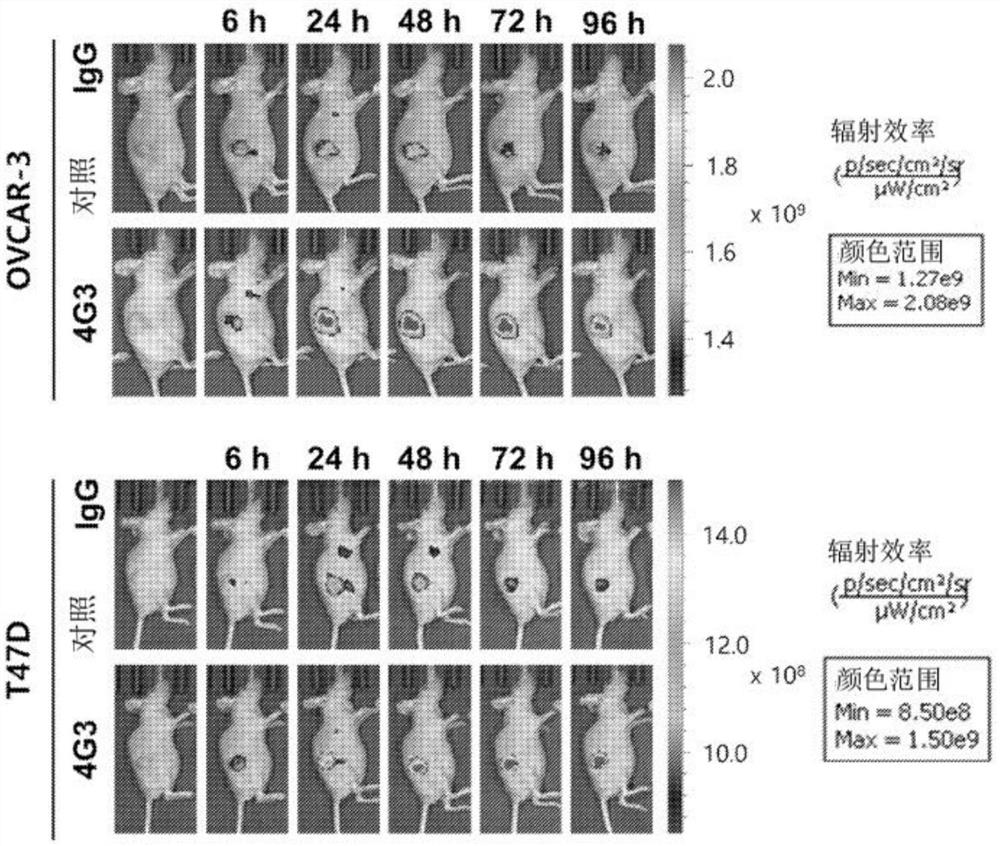
通过将5×10
为确认本发明抗体的体内肿瘤靶向能力,使用VivoBrite
在动物模型中植入肿瘤后的第60天,以100μg/100μl的剂量静脉内注射用CF750荧光标记的4G3抗体或对照抗体。使用小动物生物成像系统在6小时、24小时、48小时、72小时和96小时检测从小鼠发出的荧光信号,并切除肝、肾、肺、脾、小肠和肿瘤以确认在最后时间点组织的抗体分布的荧光信号。使用制造商提供的活体成像软件分析荧光信号。
如图14a和图14b所示,确认了与对照抗体相比,本发明的4G3抗体随时间特异性地靶向移植的肿瘤,并且与其它组织相比,其在肿瘤中积累。
工业实用性
本申请的发明涉及特异性结合claudin 3的ECL-2的抗体及其功能性片段在癌细胞检测、诊断、成像中的用途以及对癌症治疗中的应用(抗体本身的抗癌用途以及对ADC和CAR表达细胞(特别是免疫细胞)的应用),包含在此类用途中发挥显著作用的特征性CDR序列的抗体及其功能性片段。
特异性结合claudin 3的ECL-2的抗体及其功能性片段比靶向claudin 3的ECL-1的常规抗体或其它癌症抗原在癌细胞的检测、诊断、成像和对癌症治疗的应用(对ADC和CAR表达细胞(尤其是免疫细胞)的应用)中更有效。特别地,作为其特定实例,包含本发明提供的独特CDR序列的抗体不仅自身拥有抗癌能力,而且还表现出优异的癌细胞靶向能力而与其它claudin家族无交叉反应。由于结合小鼠claudin 3,显示出优异的结合强度(亲和力),拥有诸如细胞内化的特性,因此对于毒性和功效评估的非临床实验也是有益的,并且因此在对上述用途的应用中显示出显著的效果。因此,其在诊断和制药工业中具有高的工业实用性。
序列表
<110> 瑷备恩有限公司
<120> 特异性结合至CLAUDIN 3的ECL-2的抗体,其片段及其用途
<130> OP20-0066/PCT/CN
<150> PCT/KR2019/003594
<151> 2019/03/27
<150> KR 10-2018-0036190
<151> 2018-03-28
<160> 23
<170> KoPatentIn 3.0
<210> 1
<211> 220
<212> PRT
<213> 人工序列
<220>
<223> CLDN3(智人)
<400> 1
Met Ser Met Gly Leu Glu Ile Thr Gly Thr Ala Leu Ala Val Leu Gly
1 5 10 15
Trp Leu Gly Thr Ile Val Cys Cys Ala Leu Pro Met Trp Arg Val Ser
20 25 30
Ala Phe Ile Gly Ser Asn Ile Ile Thr Ser Gln Asn Ile Trp Glu Gly
35 40 45
Leu Trp Met Asn Cys Val Val Gln Ser Thr Gly Gln Met Gln Cys Lys
50 55 60
Val Tyr Asp Ser Leu Leu Ala Leu Pro Gln Asp Leu Gln Ala Ala Arg
65 70 75 80
Ala Leu Ile Val Val Ala Ile Leu Leu Ala Ala Phe Gly Leu Leu Val
85 90 95
Ala Leu Val Gly Ala Gln Cys Thr Asn Cys Val Gln Asp Asp Thr Ala
100 105 110
Lys Ala Lys Ile Thr Ile Val Ala Gly Val Leu Phe Leu Leu Ala Ala
115 120 125
Leu Leu Thr Leu Val Pro Val Ser Trp Ser Ala Asn Thr Ile Ile Arg
130 135 140
Asp Phe Tyr Asn Pro Val Val Pro Glu Ala Gln Lys Arg Glu Met Gly
145 150 155 160
Ala Gly Leu Tyr Val Gly Trp Ala Ala Ala Ala Leu Gln Leu Leu Gly
165 170 175
Gly Ala Leu Leu Cys Cys Ser Cys Pro Pro Arg Glu Lys Lys Tyr Thr
180 185 190
Ala Thr Lys Val Val Tyr Ser Ala Pro Arg Ser Thr Gly Pro Gly Ala
195 200 205
Ser Leu Gly Thr Gly Tyr Asp Arg Lys Asp Tyr Val
210 215 220
<210> 2
<211> 16
<212> PRT
<213> 人工序列
<220>
<223> CLDN3的细胞外第二环序列
<400> 2
Arg Asp Phe Tyr Asn Pro Val Val Pro Glu Ala Gln Lys Arg Glu Met
1 5 10 15
<210> 3
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 4G3的VH-CDR1
<400> 3
Ser Tyr Ala Met Ser
1 5
<210> 4
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 4G3的VH-CDR2
<400> 4
Ile Ile Asn Pro Ser Gly Ala Ser Thr Ser His Ala Gln Arg Phe Gln
1 5 10 15
Gly
<210> 5
<211> 10
<212> PRT
<213> 人工序列
<220>
<223> 4G3的VH-CDR3
<400> 5
Arg Tyr Gly Arg Tyr Gly Ser Phe Asp Ile
1 5 10
<210> 6
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> 4G3的VL-CDR1
<400> 6
Ser Gly Ser Thr Ser Asn Ile Gly Arg Asn Tyr Val Ser
1 5 10
<210> 7
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 4G3的VL-CDR2
<400> 7
Asp Thr Ser Asn Lys His Phe
1 5
<210> 8
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 4G3的VL-CDR3
<400> 8
Gln Ser Tyr Asp Ser Ser Lys Val Val
1 5
<210> 9
<211> 92
<212> DNA
<213> 人工序列
<220>
<223> 用于4G3的轻链的正向引物
<400> 9
attcgatcga tatggagaca gacacactcc tgctatgggt actgctgctc tgggttccag 60
gttccacgtg gcagagcgtg ctgacccagc ct 92
<210> 10
<211> 33
<212> DNA
<213> 人工序列
<220>
<223> 用于4G3的轻链的反向引物
<400> 10
agccaccgta cgcagcacgg tcagcttggt acc 33
<210> 11
<211> 92
<212> DNA
<213> 人工序列
<220>
<223> 用于4G3的重链的正向引物
<400> 11
attcgatcga tatggagaca gacacactcc tgctatgggt actgctgctc tgggttccag 60
gttccacgtg ggaagtgcag ctgctggaaa gt 92
<210> 12
<211> 33
<212> DNA
<213> 人工序列
<220>
<223> 用于4G3的重链的反向引物
<400> 12
cttggtgcta gcgctgctca cggtcaccag agt 33
<210> 13
<211> 119
<212> PRT
<213> 人工序列
<220>
<223> KM3907的VH(参考专利EP2138576A1)
<400> 13
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ala Ile Ser Thr Ser
20 25 30
Trp Met Asn Trp Val Lys Gln Arg Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asn Pro Gly Asp Gly Asn Thr Asn Tyr Asn Gly Lys Phe
50 55 60
Met Ala Lys Ala Thr Leu Thr Ala Asp Lys Pro Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Thr Arg Gly Asp Arg Trp Ser Gly Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Ser Val Thr Val Ser Ser
115
<210> 14
<211> 108
<212> PRT
<213> 人工序列
<220>
<223> KM3907的VL(参考专利EP2138576A1)
<400> 14
Gly Asn Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Arg Ala Ser Ser Ser Val Ser Ser Ser
20 25 30
Tyr Leu His Trp Tyr Gln Gln Lys Ser Gly Ala Ser Pro Lys Leu Trp
35 40 45
Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly Val Pro Val Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Val Glu
65 70 75 80
Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Gly Phe Pro
85 90 95
Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 15
<211> 468
<212> PRT
<213> 人工序列
<220>
<223> KM3907的重链
<400> 15
Met Glu Trp Pro Cys Ile Phe Leu Phe Leu Leu Ser Val Thr Glu Gly
1 5 10 15
Val His Ser Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys
20 25 30
Pro Gly Ala Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ala Ile
35 40 45
Ser Thr Ser Trp Met Asn Trp Val Lys Gln Arg Pro Gly Lys Gly Leu
50 55 60
Glu Trp Ile Gly Arg Ile Asn Pro Gly Asp Gly Asn Thr Asn Tyr Asn
65 70 75 80
Gly Lys Phe Met Ala Lys Ala Thr Leu Thr Ala Asp Lys Pro Ser Ser
85 90 95
Thr Ala Tyr Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val
100 105 110
Tyr Phe Cys Thr Arg Gly Asp Arg Trp Ser Gly Ala Met Asp Tyr Trp
115 120 125
Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
130 135 140
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
145 150 155 160
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
165 170 175
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
180 185 190
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
195 200 205
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
210 215 220
His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser
225 230 235 240
Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu
245 250 255
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
260 265 270
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
275 280 285
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
290 295 300
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
305 310 315 320
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
325 330 335
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro
340 345 350
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
355 360 365
Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val
370 375 380
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
385 390 395 400
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
405 410 415
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr
420 425 430
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
435 440 445
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
450 455 460
Ser Pro Gly Lys
465
<210> 16
<211> 237
<212> PRT
<213> 人工序列
<220>
<223> KM3907的轻链
<400> 16
Met Asp Phe Leu Val Gln Ile Phe Ser Phe Leu Leu Ile Ser Ala Ser
1 5 10 15
Val Ala Met Ser Arg Gly Gly Asn Val Leu Thr Gln Ser Pro Ala Ile
20 25 30
Met Ser Ala Ser Pro Gly Glu Lys Val Thr Met Thr Cys Arg Ala Ser
35 40 45
Ser Ser Val Ser Ser Ser Tyr Leu His Trp Tyr Gln Gln Lys Ser Gly
50 55 60
Ala Ser Pro Lys Leu Trp Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly
65 70 75 80
Val Pro Val Arg Phe Ser Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu
85 90 95
Thr Ile Ser Ser Val Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln
100 105 110
Gln Tyr Ser Gly Phe Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu
115 120 125
Leu Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
130 135 140
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
145 150 155 160
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
165 170 175
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
180 185 190
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
195 200 205
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
210 215 220
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 17
<211> 15
<212> DNA
<213> 人工序列
<220>
<223> 接头
<400> 17
ggggsggggs ggggs 15
<210> 18
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 2B4的VH-CDR1
<400> 18
Gly Tyr Tyr Trp Ser
1 5
<210> 19
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 2B4的VH-CDR2
<400> 19
Thr Ile His Pro Gly Asp Ser Asp Thr Arg Tyr Asn Pro Ser Leu Gln
1 5 10 15
Gly
<210> 20
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 2B4的VH-CDR3
<400> 20
Arg Gln Gly Tyr Ser Leu Phe Asp Ile
1 5
<210> 21
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 2B4的VL-CDR1
<400> 21
Arg Ala Ser Gln Ser Val Ala Ser Asp Leu Ala
1 5 10
<210> 22
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 2B4的VL-CDR2
<400> 22
Ala Ala Ser Arg Leu Gln Ser
1 5
<210> 23
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 2B4的VL-CDR3
<400> 23
Gln Gln Tyr Asn Ser Tyr Pro Pro Thr
1 5
- 特异性结合CLAUDIN 3的ECL-2的抗体,其片段及其用途
- 特异性结合CD154的包括抗体、抗体衍生物和抗体片段在内的结合蛋白及其用途
