抗Tim3的抗体、嵌合抗原受体及其应用
文献发布时间:2023-06-19 09:49:27
技术领域
本发明涉及免疫治疗领域,涉及一种抗Tim3的抗体、嵌合抗原受体及其应用。
背景技术
免疫疗法正在成为一种非常有前景的癌症治疗方法。T细胞或T淋巴细胞是我们免疫系统的武装力量,其不断寻找外来抗原并区分异常(癌症或感染细胞)与正常细胞。用CAR遗传修饰T细胞是设计肿瘤特异性T细胞的常用方法。靶向肿瘤相关抗原的CAR-T细胞可以输注到患者体内(称为过继性T细胞疗法),代表了一种有效的免疫治疗方法。与化学疗法或抗体相比,CAR-T技术的优势在于重编程的工程化T细胞可以增殖并持续存在于患者体内,像活的药物一样起作用。
肿瘤免疫治疗的CAR-T疗法,CAR-T,全称Chimeric Antigen Receptor T-CellImmunotherapy,即嵌合抗原受体T细胞免疫疗法;原理在于经嵌合抗原受体修饰的T细胞,可以特异性地识别肿瘤相关抗原,使效应T细胞的靶向性、杀伤活性和持久性均较常规应用的免疫细胞高,并可克服肿瘤局部免疫抑制微环境并打破宿主免疫耐受状态。嵌合抗原受体(CAR)是CAR-T的核心部件,赋予T细胞HLA非依赖的方式识别肿瘤抗原能力,这使得经过CAR改造的T细胞相较于天然T细胞表面受体TCR能够识别更广泛的目标。CAR(ChimericAntigen Receptor)主要由三个功能域构成,分别是胞外结构域、跨膜结构域和胞内结构域。胞外结构域由负责识别并结合抗原的单克隆抗体的单链可变片段(single-chainvariable fragment,scFv)及一段起连接作用的铰链区(Hinge)构成。胞内结构域由共刺激结构域(Costimulatory Domain)和信号转导结构域(Signaling Domain)构成。在晚期CLL和ALL患者中采用靶向CD19的CAR-T时取得了成功(Porter等人,2011,N Engl J Med,365:725-33;Kalos等人,2011,Science Transl Med,3:
95ra73;Grupp和Kalos,2013,N Engl J Med,368:1509-18)显示,这些细胞可以在单次输注后根除巨大肿瘤负荷,缓解作用迄今持续长达3年,从而强调了CAR T细胞疗法的巨大潜力。
迄今为止,还未见靶向Tim3的CAR-T及在治疗恶性肿瘤中的应用的报道。
发明内容
本发明的目的之一在于提供一种抗Tim3的抗体。
本发明的目的之二在于提供抗Tim3的抗体或其抗原结合片段在制备靶向Tim3的嵌合抗原受体中的应用。
本发明的目的之三在于提供一种靶向Tim3的嵌合抗原受体或包含其的CAR-T。
本发明的目的之四在于提供靶向Tim3的嵌合抗原受体或包含其的CAR-T的应用。
为了实现上述目的,本发明采用了如下技术方案:
本发明提供了一种抗Tim3的抗体或其抗原结合部分,所述抗体或其抗原结合部分包括重链可变区的CDR1-3以及轻链可变区的CDR1-3。
重链可变区CDR1的氨基酸序列选自SEQ ID NO.1-3或其同源序列;所述同源序列与原序列的同源性优选为70%或以上、80%或以上、90%或以上、95%或以上、97%或以上、98%或以上、99%或以上、99.1%或以上、99.2%或以上、99.3%或以上、99.4%或以上、99.5%或以上、99.6%或以上、99.7%或以上、99.8%或以上、或99.9%或以上。进一步,重链可变区CDR1的氨基酸序列选自SEQ ID NO.1-3。
重链可变区CDR2的氨基酸序列选自SEQ ID NO.4-6或其同源序列;所述同源序列与原序列的同源性优选为70%或以上、80%或以上、90%或以上、95%或以上、97%或以上、98%或以上、99%或以上、99.1%或以上、99.2%或以上、99.3%或以上、99.4%或以上、99.5%或以上、99.6%或以上、99.7%或以上、99.8%或以上、或99.9%或以上。进一步,重链可变区CDR2的氨基酸序列选自SEQ ID NO.4-6。
重链可变区CDR3的氨基酸序列选自SEQ ID NO.7-9或其同源序列;所述同源序列与原序列的同源性优选为70%或以上、80%或以上、90%或以上、95%或以上、97%或以上、98%或以上、99%或以上、99.1%或以上、99.2%或以上、99.3%或以上、99.4%或以上、99.5%或以上、99.6%或以上、99.7%或以上、99.8%或以上、或99.9%或以上。进一步,重链可变区CDR3的氨基酸序列选自SEQ ID NO.7-9。
轻链可变区CDR1的氨基酸序列选自SEQ ID NO.11-13或其同源序列;所述同源序列与原序列的同源性优选为70%或以上、80%或以上、90%或以上、95%或以上、97%或以上、98%或以上、99%或以上、99.1%或以上、99.2%或以上、99.3%或以上、99.4%或以上、99.5%或以上、99.6%或以上、99.7%或以上、99.8%或以上、或99.9%或以上。进一步,轻链可变区CDR1的氨基酸序列选自SEQ ID NO.11-13。
轻链可变区CDR2的氨基酸序列选自SEQ ID NO.14-16所示或其同源序列;所述同源序列与原序列的同源性优选为70%或以上、80%或以上、90%或以上、95%或以上、97%或以上、98%或以上、99%或以上、99.1%或以上、99.2%或以上、99.3%或以上、99.4%或以上、99.5%或以上、99.6%或以上、99.7%或以上、99.8%或以上、或99.9%或以上。进一步,轻链可变区CDR2的氨基酸序列选自SEQ ID NO.14-16。
轻链可变区CDR3的氨基酸序列选自SEQ ID NO.17-19或其同源序列;所述同源序列与原序列的同源性优选为70%或以上、80%或以上、90%或以上、95%或以上、97%或以上、98%或以上、99%或以上、99.1%或以上、99.2%或以上、99.3%或以上、99.4%或以上、99.5%或以上、99.6%或以上、99.7%或以上、99.8%或以上、或99.9%或以上。进一步,轻链可变区CDR3的氨基酸序列选自SEQ ID NO.17-19。
进一步,本发明的重链可变区可以包含SEQ ID NO.10的氨基酸序列或其同源序列。轻链可变区可以包含SEQ ID NO.20的氨基酸序列或其同源序列。因此,所述同源序列与原序列的同源性优选为70%或以上、80%或以上、90%或以上、95%或以上、97%或以上、98%或以上、99%或以上、99.1%或以上、99.2%或以上、99.3%或以上、99.4%或以上、99.5%或以上、99.6%或以上、99.7%或以上、99.8%或以上、或99.9%或以上。
优选地,所述抗体或其抗原结合部分包括重链可变区和轻链可变区,重链可变区序列如SEQ ID NO.10所示,轻链可变区序列如SEQ ID NO.20所示。
抗原结合片段可以是Fab片段(Fab)、F(ab’)
本发明还提供了编码前面所述的抗体或其抗原结合部分的核酸分子。
本发明还提供了包含前面所述的核酸分子的载体。
本发明还提供了包含所述的载体的宿主细胞。
本发明还提供了一种靶向Tim3的嵌合抗原受体,所述嵌合抗原受体包括Tim3结合结构域。
进一步,所述嵌合抗原受体从N端到C端包括:Tim3结合结构域、铰链区、跨膜结构域、信号传导结构域。
可选择地,所述嵌合抗原受体从N端到C端包括:Tim3结合结构域、铰链区、跨膜结构域、共刺激结构域、信号传导结构域。
在本发明的具体实施方案中,所述嵌合抗原受体从N端到C端包括:Tim3结合结构域、铰链区、跨膜结构域、共刺激结构域、信号传导结构域。
Tim3结合结构域可以包含Tim3抗体的任何抗原结合部分。例如,Tim3结合结构域可以是Fab片段(Fab)、F(ab’)
Tim3结合结构域可以包含前面所述的抗体的轻链可变区的CDR1-3和/或重链可变区的CDR1-3。
轻链可变区的CDR1-3的限定同前面所述。
重链可变区的CDR1-3的限定同前面所述。
轻链可变区的限定同前面所述。
重链可变区的限定同前面所述。
在本发明的实施方案中,轻链可变区和重链可变区可以通过接头(Linker)连接。接头可以包含任何合适的氨基酸序列。在本发明的实施方案中,接头可以包含SEQ IDNO.21或其同源序列。所述同源序列与原序列的同源性优选为70%或以上、80%或以上、90%或以上、95%或以上、97%或以上、98%或以上、99%或以上、99.1%或以上、99.2%或以上、99.3%或以上、99.4%或以上、99.5%或以上、99.6%或以上、99.7%或以上、99.8%或以上、或99.9%或以上。
在本发明的实施方案中,Tim3结合结构域包含含有SEQ ID NO.22的氨基酸序列的scFv。
在本发明的实施方案中,Tim3结合结构域还可以包含前导序列,或称为信号肽序列。前导序列可以位于轻链可变区或重链可变区的氨基末端。优选地,前导序列位于重链可变区的氨基末端。前导序列可以包含任何合适的前导序列。例如,Tim3结合结构域可以包含这样的前导序列,其含有SEQ ID NO.23或其同源序列。所述同源序列与原序列的同源性优选为70%或以上、80%或以上、90%或以上、95%或以上、97%或以上、98%或以上、99%或以上、99.1%或以上、99.2%或以上、99.3%或以上、99.4%或以上、99.5%或以上、99.6%或以上、99.7%或以上、99.8%或以上、或99.9%或以上。在本发明的实施方案中,虽然前导序列可以促进CAR在细胞表面上的表达,但是在表达的CAR中存在前导序列可以不是CAR发挥功能所必需的。在本发明的实施方案中,CAR在细胞表面上表达后,前导序列的全部或部分可以从CAR上切除。
在本发明的实施方案中,包含前导序列的Tim3结合结构域的氨基酸序列如SEQ IDNO.24所示。
铰链区作用是促进抗原受体与抗原结合;跨膜结构域用来固定CAR。在本发明的实施方案中,铰链区为人铰链区,并且跨膜结构域为人跨膜结构域。铰链区和跨膜结构域可以包含以下任一种或多种分子的铰链区和跨膜结构域:CD28、CD3ε、CD45、CD4、CD5、CD8、CD9、CD16、CD22、CD33、CD37、CD134、CD137、ICOS和CD154。在本发明的具体实施方案中,选择的铰链区和跨膜结构域可以包含SEQ ID NO.25的氨基酸序列或其同源序列。所述同源序列与原序列的同源性优选为70%或以上、80%或以上、90%或以上、95%或以上、97%或以上、98%或以上、99%或以上、99.1%或以上、99.2%或以上、99.3%或以上、99.4%或以上、99.5%或以上、99.6%或以上、99.7%或以上、99.8%或以上、或99.9%或以上。
信号传导结构域又可称为T细胞激活结构域,提供T细胞活化的第一信号,最常用的信号传导结构域是CD3ζ胞内结构域。在本发明的实施方案中,CD3ζ胞内结构域可以包含SEQ ID NO.26的氨基酸序列或其同源序列。所述同源序列与原序列的同源性优选为70%或以上、80%或以上、90%或以上、95%或以上、97%或以上、98%或以上、99%或以上、99.1%或以上、99.2%或以上、99.3%或以上、99.4%或以上、99.5%或以上、99.6%或以上、99.7%或以上、99.8%或以上、或99.9%或以上。
共刺激结构域提供T细胞活化的第二信号,包含共刺激因子的细胞内结构域,所述共刺激因子包括CD27、CD28、4-1BB、OX40、CD30、CD40、ICOS、NKG2C、B7-H3。在本发明的实施方案中,共刺激结构域可以包含含SEQ ID NO.27的氨基酸序列或其同源序列。所述同源序列与原序列的同源性优选为70%或以上、80%或以上、90%或以上、95%或以上、97%或以上、98%或以上、99%或以上、99.1%或以上、99.2%或以上、99.3%或以上、99.4%或以上、99.5%或以上、99.6%或以上、99.7%或以上、99.8%或以上、或99.9%或以上。
本发明的实施方案提供包含SEQ ID NO.28所示的氨基酸序列的CAR。
本发明的实施方案的CAR可以通过本领域已知的方法获得。可以通过制备多肽或蛋白质的任何合适的方法制得CAR。从头合成多肽和蛋白质的合适方法为本领域已知的。另外,可以使用例如Green and Sambrook,Molecular Cloning:A Laboratory Manual(第4版),Cold Spring Harbor Laboratory Press(2012)中所述的标准重组方法,使用本文所述的核酸重组产生CAR。可选地,本文所述的CAR可以通过公司商业合成。在这方面,本发明的CAR可以是合成的和/或重组的。
本发明还提供了编码前面所述的嵌合抗原受体或其组成部分的核酸分子。
本发明的核酸分子可以包含编码本文所述的前导序列、Tim3结合结构域、铰链区和跨膜结构域、信号传导结构域、共刺激结构域、嵌合抗原受体中一种或多种的核苷酸序列。
核酸可以基本上由本文所述的一条或多条指定的核苷酸序列组成,以使其它组分(例如其它核苷酸)不实质性改变编码的CAR的生物活性。
在本发明的实施方案中,核酸包含编码CAR的密码子优化的核苷酸序列。不受特定理论或机制的束缚,认为核苷酸序列的密码子优化增加mRNA转录本的翻译效率。核苷酸序列的密码子优化可以涉及将天然密码子置换为编码相同氨基酸,但可以由细胞内更容易获得的tRNA翻译的另一密码子,从而提高翻译效率。核苷酸序列的优化还可以降低会干扰翻译的二级mRNA结构,从而提高翻译效率。
本发明还提供这样的核酸,其包含与本文所述的任何核酸的核苷酸序列具有至少约70%或者更多,例如约80%、约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%或约99%同一性的核苷酸序列。
本发明还提供了包含前面所述的核酸分子的重组表达载体。在实施方案中,可以将本发明的核酸并入重组表达载体中。就这点而言,本发明的实施方案提供包含本发明的任何核酸的重组表达载体。出于本文的目的,术语“重组表达载体”意为遗传修饰的寡核苷酸或多核苷酸构建体,当构建体包含编码mRNA、蛋白、多肽或肽的核苷酸序列,并且在足以使mRNA、蛋白、多肽或肽在宿主细胞内表达的条件下将载体与细胞接触时,其允许细胞表达mRNA、蛋白、多肽或肽。本发明的载体作为整体不是天然存在的。
在实施方案中,本发明的重组表达载体可以是任何合适的重组表达载体,并且可以被用于转化或转染任何合适的宿主细胞。合适的载体包括设计以用于增殖和扩增或者用于表达或者用于这两种的那些载体,如质粒和病毒。载体可以选自:pUC系列(FermentasLife Sciences,Glen Burnie,MD)、pBluescript系列(Stratagene,LaJolla,CA)、pET系列(Novagen,Madison,WI)、pGEX系列(Pharmacia Biotech,Uppsala,Sweden)以及pEX系列(Clontech,Palo Alto,CA)。也可使用诸如λGT10、λGT11、λZapII(Stratagene)、λEMBL4和λNM1149的噬菌体载体。植物表达载体的实例包括pBI01、pBI101.2、pBI101.3、pBI121和
pBIN19(Clontech)。动物表达载体的实例包括pEUK-Cl、pMAM和pMAMneo(Clontech)。重组表达载体可以是病毒载体,例如逆转录病毒载体。在本发明的实施方案中,载体为γ逆转录病毒载体、慢病毒载体或转座子。
本发明还提供了一种宿主细胞,所述宿主细胞包含前面所述的嵌合抗原受体、前面所述的核酸分子、或前面所述的重组表达载体。
在本发明的实施方案中还提供包含本文所述的任何重组表达载体的宿主细胞。本文使用的术语“宿主细胞”指可以含有本发明的重组表达载体的任何类型的细胞。宿主细胞可以是真核细胞,例如植物、动物、真菌或藻类;或者可以是原核细胞,例如细菌或原生动物。宿主细胞可以是培养的细胞或原代细胞,即直接由生物体如人分离到的细胞。宿主细胞可以是贴壁细胞或悬浮细胞,即悬浮生长的细胞。合适的宿主细胞为本领域已知的,并且包括,例如DH5α大肠杆菌细胞、中国仓鼠卵巢细胞、猴VERO细胞、COS细胞、HEK293细胞等。出于扩增或复制重组表达载体的目的,宿主细胞可以是原核细胞,例如DH5α细胞。出于产生CAR的目的,宿主细胞可以是哺乳动物细胞。宿主细胞可以是人细胞。尽管宿主细胞可以是任何类型的细胞、可以来源于任何类型的组织,并且可以处于任何发育阶段,但是宿主细胞可以是外周血淋巴细胞(PBL)或外周血单核细胞(PBMC)。宿主细胞可以是B细胞、自然杀伤(NK)细胞或T细胞。
出于本文的目的,T细胞可以是任何T细胞,如培养的T细胞,例如原代T细胞;或者是来自培养的T细胞系的T细胞,例如Jurkat、SupT1等;或者是获自哺乳动物的T细胞。如果获自哺乳动物,T细胞可以获自多种来源,包括但不限于血液、骨髓、淋巴结、胸腺或者其它组织或液体。T细胞也可以是富集的或纯化的。T细胞可以是人T细胞。T细胞可以是分离自人的T细胞。T细胞可以是任何类型的T细胞,并且可以处于任何发育阶段,包括但不限于CD4+/CD8+双阳性T细胞、CD4+辅助T细胞(例如Th 1和Th 2细胞)、CD8+ T细胞(例如细胞毒性T细胞)、肿瘤浸润细胞、记忆T细胞、初始T细胞等。T细胞可以是CD8+ T细胞或CD4+ T细胞。
本发明提供了一种制备前面所述的宿主细胞的方法,所述方法包括将前面所述的核酸分子或前面所述的重组表达载体导入宿主细胞,并在适合细胞表达所述核酸分子或载体的条件下培养宿主细胞。
CAR、核酸、重组表达载体和宿主细胞(包括其群体)在下文中统称为“CAR材料”。
本发明提供了一种药物组合物,所述药物组合物包括前面所述的的核酸分子、前面所述的重组表达载体、或前面所述的宿主细胞。
进一步,所述药物组合物包括药学上可接受的载体。就药物组合物而言,载体可以是常规用于所考虑的具体的本发明的CAR材料的那些载体中的任何载体。制备可施用组合物的方法为本领域技术人员已知的或显而易见的,并且更详细地描述于,例如,Remington:The Science and Practice ofPharmacy,第22版,Pharmaceutical Press(2012)。优选地,药学上可接受的载体是在使用条件下,无有害副作用或毒性的载体。
载体的选择将部分由具体的本发明的CAR材料以及由用于施用本发明的CAR材料的具体方法决定。因此,存在多种合适的本发明的药物组合物的制剂。合适的制剂可以包括用于肠胃外、皮下、静脉内、肌肉内、动脉内、鞘内、瘤内或腹膜内施用的那些制剂中的任何制剂。可以使用多于一种途径来施用本发明的CAR材料,并且在某些情况下,特定途径可以比另一途径提供更直接以及更有效的应答。
优选地,通过注射,例如静脉内施用本发明的CAR材料。当本发明的CAR材料为表达本发明的CAR的宿主细胞(或其群体)时,用于注射的细胞的药学可接受的载体可以包括任何等张载体,如例如生理盐水(含约0.90%w/v NaCl的水,含约300mOsm/L NaCl的水,或者每升水约9.0g NaCl)、NORMOSOL R电解质溶液(Abbott,Chicago,IL)、PLASMA-LYTE A(Baxter,Deerfield,IL)、含约5%葡萄糖的水或者乳酸林格氏液。在实施方案中,用人血清白蛋白补充药学可接受的载体。
本发明的药物组合物还可包括与本发明的CAR材料联合施用的其它药学活性剂或药物,所述其它药学活性剂或药物如化疗剂,例如天冬酰胺酶、白消安、卡铂、顺铂、道诺霉素、多柔比星、氟尿嘧啶、吉西他滨、羟基脲、甲氨蝶呤、紫杉酚、利妥昔单抗、长春花碱、长春新碱等。
当将本发明的CAR材料与一种或多种另外的治疗剂一起施用时,一种或多种另外的治疗剂可以共施用至哺乳动物。“共施用”意为在时间上足够接近地施用一种或多种另外的治疗剂和本发明的CAR材料,以使本发明的CAR材料可以增强一种或多种另外的治疗剂的作用,反之亦然。就这点而言,可以首先施用本发明的CAR材料,之后施用一种或多种另外的治疗剂,反之亦然。可选地,可以同时施用本发明的CAR材料和一种或多种另外的治疗剂。可以增强表达CAR的细胞功能的另外的治疗剂可以包括,例如,一种或多种细胞因子或者一种或多种抗体(例如,抑制PD-1功能的抗体)。
考虑可以将本发明的CAR材料和药物组合物用于治疗或预防哺乳动物中的病况的方法中。不受特定理论或机制的束缚,本发明的CAR材料具有生物活性,例如识别Tim3的能力,以使当由细胞表达时,CAR能够介导针对表达Tim3的细胞的免疫应答。就这点而言,本发明的实施方案提供治疗或预防哺乳动物中的病况的方法,其包括向哺乳动物施用有效治疗或预防哺乳动物中的病况的量的本发明的CAR、核酸、重组表达载体、宿主细胞、细胞群和/或药物组合物中的任一种。病况可以为以Tim3的表达或过表达为特征的任何病况。在优选的实施方案中,病况为肿瘤。
出于施用宿主细胞或细胞群的本发明的方法的目的,细胞可以是与哺乳动物同种异体的细胞或是其自体的细胞。在“自体的”施用方法中,将细胞从哺乳动物中取出,储存(并任选地进行修饰),并返回至同一哺乳动物中。在“同种异体的”施用方法中,哺乳动物接受来自基因相似但不同供体的细胞。优选地,细胞为哺乳动物自体的。在本发明的实施方案中,向哺乳动物施用的细胞已经经历了基因编辑。
本文提及的哺乳动物可以是任何哺乳动物。本文使用的术语“哺乳动物”指任何哺乳动物,包括但不限于啮齿目的哺乳动物,如小鼠和仓鼠;以及兔形目的哺乳动物,如兔。哺乳动物可以来自食肉目,包括猫科(猫)和犬科(狗)。哺乳动物可以来自偶蹄目,包括牛科(牛)和猪科(猪);或者来自奇蹄目,包括马科(马)。哺乳动物可以来自灵长目、猿(Ceboids)目或猴(Simoids)目(猴),或者来自类人猿目(人和类人猿)。优选地,哺乳动物为人。
就本发明的方法而言,肿瘤可以为任何肿瘤。肿瘤的特征在于Tim3的表达或过表达。优选地,肿瘤为急性髓系白血病。在本发明的具体实施方案中,所述肿瘤是急性髓系白血病。
本文使用的术语“治疗”和“预防”以及由其衍生的词语不一定意指100%或完全的治疗或预防。而是,存在本领域普通技术人员认为具有潜在益处或治疗效果的不同程度的治疗或预防。在这方面,本发明的方法可以提供任何量任何水平的哺乳动物中病况的治疗或预防。此外,本发明的方法提供的治疗或预防可以包括被治疗或预防的疾病(例如肿瘤)的一种或多种病况或症状的治疗或预防。另外,出于本文的目的,“预防”可以涵盖延迟疾病,例如肿瘤或其症状或病况的发作。可选地或另外,“预防”可以涵盖延迟疾病,例如肿瘤或其症状或病况的复发。
本发明提供了一种试剂盒,所述试剂盒包含前面所述的核酸分子、前面所述的重组表达载体、前面所述的宿主细胞、或前面所述的药物组合物。
本发明提供了前面所述的Tim3抗体或其抗原结合部分在制备嵌合抗原受体中的应用。
本发明提供了前面所述的Tim3抗体或其抗原结合部分在制备CAR-T中的应用。
本发明提供了前面所述的Tim3抗体或其抗原结合部分在制备抗肿瘤药物中的应用。
本发明提供了前面所述的核酸分子、或前面所述的重组表达载体在制备前面所述的宿主细胞中的应用。
本发明提供了前面所述的核酸分子、或前面所述的重组表达载体在制备CAR或CAR-T中的应用。
本发明提供了前面所述的核酸分子、前面所述的重组表达载体或前面所述的宿主细胞在制备抗肿瘤药物中的应用。
本发明提供了前面所述的核酸分子、前面所述的重组表达载体、前面所述的宿主细胞、前面所述的药物组合物在在制备免疫治疗用的药物中的应用。
进一步,肿瘤可以为任何肿瘤。肿瘤的特征在于Tim3的表达或过表达。优选地,肿瘤为急性髓系白血病。
附图说明
图1显示抗Tim3抗体的纯化图;
图2显示利用ELISA检测抗体结合活性的结果图;
图3显示本发明的Tim3抗体的亲和活性测定结果图;
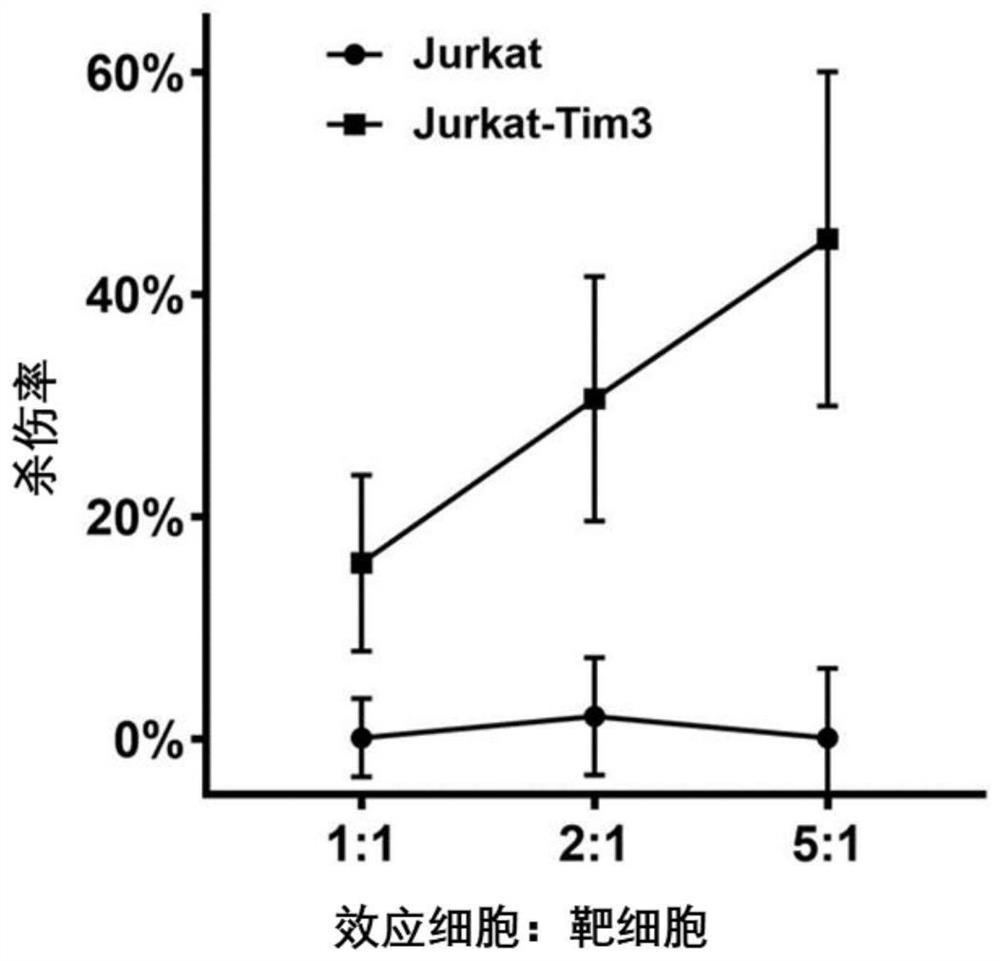
图4显示利用体外细胞杀伤实验检测本发明的CAR-T细胞的杀伤能力的结果图。
具体实施方式
以下结合附图和实施例进一步说明本发明。下述实施例只是为了说明本发明,而不应被解释为是限制性的。
实施例1制备抗Tim3抗体
1、杂交瘤单克隆抗体制备
1)乳化:500μl/只小鼠免疫=250μl弗氏完全佐剂+200μl抗原+50μl生理盐水,混合后乳化。
2)免疫小鼠:乳化后,多点皮下注射,每个位置100μl。
3)2-3周换用弗氏不完全佐剂加强免疫,方法同上。
4)2-3周仍然使用弗氏不完全佐剂加强免疫,方法同上。
5)2-3周后鼠尾取血,测定抗体效价(直接ELISA法),选择效价高的小鼠,腹腔注射抗原500μl。
2、细胞融合
1)制备滋养细胞:提前24h,取正常Balb/c小鼠,取腹腔灌洗液细胞,计数后使用HAT培养基调整细胞密度至2x10
2)取已免疫的Balb/c小鼠,眼球取血后处死。
3)使用已高压灭菌过的剪子、镊子将皮肤剪开,取脾细胞,尽量将脾细胞上黏带物去除,在培养皿中加入1640无血清培养基,使用镊子将脾细胞捏碎,再使用1640无血清培养基冲洗培养皿,将脾细胞悬液转移至50ml离心管中,1200rpm 4min离心。
4)取处于生长对数期的骨髓瘤细胞,重悬后1200rpm 4min离心。
5)将已离心的脾细胞和骨髓瘤细胞,使用1640无血清的培养基清洗一遍,然后重悬计数,调细胞密度为:骨髓瘤细胞:脾细胞=1:5左右,混匀两种细胞,1200rpm 4min离心。
6)离心之后,弃去上清,弹匀管底,将离心管放入37℃的烧杯中,缓慢加入PEG(提前37℃预热),1min之内加完,之后再缓慢加入5ml 1640无血清培养基,1min后再缓慢加入5ml 1640无血清培养基,2min后再缓慢加入10ml 1640无血清培养基,2min后再缓慢加入10ml 1640无血清培养基,共30ml培养基,800rpm 5min离心。
7)离心后使用HAT培养基调整细胞密度至2-3x 10
8)换液:五天后使用半换液方法换液,取出100μl/孔,再加入100μl/孔。
9)三天后同样方法换液。
10)第二天同样方法再次换液。
11)间接ELISA方法检测融合效率,具体方法见间接ELISA操作。
3、杂交瘤细胞克隆化(亚克隆)
1)制备滋养细胞,可在克隆当天或前一天制备,制备同融合实验。
2)将待做克隆化的杂交瘤细胞混匀后,准确计数。
3)计数后调整细胞密度为5个细胞/孔和1个细胞/孔,接种于96孔板中,100μl/孔,将培养板置于5%二氧化碳,37℃孵箱中培养。
4)5天之后显微镜下观察细胞克隆,标记出单个克隆细胞株,并换液。
5)7-10天视情况进行换液,检测前一天进行换液,间接ELISA方法检测筛选阳性单克隆细胞株。
6)将筛选出来的阳性单克隆细胞株转移至24孔板中,直接换做HT培养基重悬,并进行扩大培养并冻存。
4、单克隆抗体纯化
步骤:1、抗原免疫小鼠:3~4次免疫,间隔两周,最后一次免疫之后取尾血检测抗体滴度;
2、融合:尾血检测抗体滴度高的小鼠取脾脏与骨髓瘤细胞(SP2/0)融合,利用HAT筛选,得到能无限增殖并能稳定表达抗体的杂交瘤细胞;
3、抗体制备与纯化:将获得的杂交瘤细胞注射入小鼠腹腔,7-10天后抽取腹水进行纯化,纯化利用protein A的预装柱,使用AKTA的纯化仪进行纯化。
结果:Tim-3抗体的亲和纯化结果如图1所示。
经测序,本发明的Tim-3抗体的重链可变区序列为:EVKLVESGGGLVQPGGSLRLSCATSGTFFSDYYMSWVRQPPGKALEWLGFIRNAKNGYTTEYSASVKGRFTIYRDNSQSILYLQMNTLRAEDSATYYCARAYQYW;
本发明的Tim-3抗体的轻链可变区序列为ELVMTQSPSSLAVSAGEKVTMSCKSSQSLFNTRKNFLAWYQQRPGQSPKLLIYAWSTRESGVPDRFTGSGSGTDFTLTISSVQAEDLAVYYCKQSIYLW。
实施例2抗体结合活性检测
1、ELISA检测抗体结合
1)1×包被液+250×Tim-3一抗Capture包被孔板,50μl/孔,4℃过夜或37℃>4h。
2)PBST洗板3次。
3)1×assay封闭液封闭,200μl/孔,37℃1h。
4)PBST洗板3次。
5)加入h Tim-3-Trx蛋白。37℃>1h,或室温3-4h。
6)PBST洗板3次。加入筛选抗体,室温40min
7)PBST洗板3次。加入酶标抗Fc抗体50μl/孔,室温40min。
8)PBST洗板3次。
9)加1×assay+250×HRP 50μl/孔37℃30min。
10)PBST洗板3次。
11)加1×TMB显色液50μl/孔,避光5-10min。
12)加终止液50μl/孔,上机测OD450。
结果:
结果如图2所示,Tim-3抗体对Tim-3蛋白具有亲和力。
2、抗体亲和力检测
利用表面脂质团共振技术(SPR)检测:将抗人Tim-3-his抗体偶联到Anti-Penta-His chip(GE)芯片上,将抗体样品稀释到1-2μg/ml并以30μl/min流速进样60-150秒。将Tim-3抗体进行梯度稀释至浓度为3.125,6.25,12.5,25,50,100nM并以30μL/min流速进样抗原结合120秒,解离1200S。实验结束后用10mM Glycine-HCl pH2.1进行再生60秒。利用Biacore T200分析软件分析结果。
结果:抗体亲和力结果如图3所示,抗体亲和力参数如表1所示。
表1抗体亲和力参数
实施例3靶向Tim3的CAR表达及其CAR-T构建
1、合成相关序列,通过XbaI/SalI限制内切酶切点,连接到pCDH载体中,重组表达载体可以表达SEQ ID NO.28所示的CAR。
2、CAR-T细胞制备
采集健康人外周血,在Ficoll中缓慢加入外周血,离心2000rpm,15min。吸取中间白膜层,加入0.9%生理盐水,计数单个核细胞数量,离心1000rpm,5min。磁珠分选T细胞。同时加入CD3/CD28抗体偶联磁珠刺激,24h及48h后加入病毒感染2次,病毒感染时加入IL-2,培养3-20天,获得TCR-T细胞。
实施例4CAR-T杀伤功能检测
步骤:
计数靶细胞(Jurkat-Tim3)和阴性参照靶细胞(Jurkat),分别标记Celltrace farred和CFSE染色。计数CAR-T细胞作为效应细胞。按照计划效靶比,重悬效应细胞和靶细胞至相应浓度。圆底96孔板中每个效靶比分别铺入铺入:组1-效应细胞、组2-靶细胞、组3-效应细胞+靶细胞,每组4个复孔。培养2-24h,收细胞样本,分别收管A:组1-效应细胞+组2-靶细胞,管B:组3-效应细胞+靶细胞,多聚甲醛液固定,流式上机。作Killing Rate与E:T Ratio曲线图。其中,Killing Rate=(1-(管B celltrace far red阳性%)/(管A celltrace farred阳性%))×100%。
结果如图4所示,Tim-3 Car-T对表达Tim-3细胞具有杀伤作用。
本文描述了本发明的优选实施方案,包括发明人已知的实施本发明的最佳方式。经阅读前述描述,那些优选实施方案的改变对于本领域普通技术人员而言可以变得显而易见。发明人期望本领域技术人员视情况应用此类改变,并且发明人意图以与本文具体所述的不同的方式实践本发明。因此,如适用的法律所允许的,本发明包括在此所附的权利要求中所述的主题的所有修饰和等同物。此外,本发明涵盖以上所述元素的所有可能的改变的任何组合,除非本文另外指明或者在其它方面与上下文明显矛盾。
序列表
<110> 王智鼎
任宪尊
李葛
<120> 抗Tim3的抗体、嵌合抗原受体及其应用
<141> 2020-11-06
<160> 28
<170> SIPOSequenceListing 1.0
<210> 1
<211> 15
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 1
Ala Thr Ser Gly Thr Phe Phe Ser Asp Tyr Tyr Ser Met Ser Trp
1 5 10 15
<210> 2
<211> 14
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 2
Ala Thr Ser Gly Thr Phe Phe Ser Asp Tyr Tyr Met Ser Trp
1 5 10
<210> 3
<211> 14
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 3
Ala Thr Ser Gly Phe Thr Phe Ser Asp Tyr Tyr Met Ser Trp
1 5 10
<210> 4
<211> 19
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 4
Leu Gly Phe Ile Arg Asn Lys Ala Asn Gly Tyr Thr Thr Glu Tyr Ser
1 5 10 15
Ala Ser Val
<210> 5
<211> 19
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 5
Leu Gly Phe Ile Arg Asn Ala Lys Asn Gly Tyr Thr Glu Glu Tyr Ser
1 5 10 15
Ala Ser Val
<210> 6
<211> 19
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 6
Leu Gly Phe Ile Arg Asn Ala Lys Asn Gly Tyr Thr Thr Glu Tyr Ser
1 5 10 15
Ala Ser Val
<210> 7
<211> 10
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 7
Tyr Tyr Cys Ala Arg Ala Tyr Gln Tyr Trp
1 5 10
<210> 8
<211> 10
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 8
Tyr Tyr Cys Ala Arg Asp Trp Asp Tyr Trp
1 5 10
<210> 9
<211> 10
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 9
Tyr Tyr Cys Ala Arg Lys Gln Ser Tyr Trp
1 5 10
<210> 10
<211> 105
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 10
Glu Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Thr Ser Gly Thr Phe Phe Ser Asp Tyr
20 25 30
Tyr Met Ser Trp Val Arg Gln Pro Pro Gly Lys Ala Leu Glu Trp Leu
35 40 45
Gly Phe Ile Arg Asn Ala Lys Asn Gly Tyr Thr Thr Glu Tyr Ser Ala
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Tyr Arg Asp Asn Ser Gln Ser Ile
65 70 75 80
Leu Tyr Leu Gln Met Asn Thr Leu Arg Ala Glu Asp Ser Ala Thr Tyr
85 90 95
Tyr Cys Ala Arg Ala Tyr Gln Tyr Trp
100 105
<210> 11
<211> 16
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 11
Lys Ser Ser Gln Ser Leu Phe Asn Thr Arg Lys Asn Phe Leu Ala Trp
1 5 10 15
<210> 12
<211> 18
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 12
Lys Ser Ser Gln Ser Leu Phe Asn Ser Arg Thr Arg Lys Asn Phe Leu
1 5 10 15
Ala Trp
<210> 13
<211> 18
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 13
Lys Ser Ser Gln Ser Leu Phe Asn Thr Ser Thr Arg Lys Asn Phe Leu
1 5 10 15
Ala Trp
<210> 14
<211> 12
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 14
Leu Leu Ile Tyr Ala Trp Ser Thr Arg Glu Ser Gly
1 5 10
<210> 15
<211> 12
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 15
Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly
1 5 10
<210> 16
<211> 12
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 16
Leu Leu Ile Ala Tyr Trp Ser Thr Arg Glu Ser Gly
1 5 10
<210> 17
<211> 10
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 17
Tyr Tyr Cys Lys Gln Ser Ile Tyr Leu Trp
1 5 10
<210> 18
<211> 10
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 18
Tyr Tyr Cys Lys Gln Ser Tyr Ile Leu Trp
1 5 10
<210> 19
<211> 10
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 19
Tyr Tyr Cys Lys Ser Gln Ile Tyr Leu Trp
1 5 10
<210> 20
<211> 99
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 20
Glu Leu Val Met Thr Gln Ser Pro Ser Ser Leu Ala Val Ser Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Phe Asn Thr
20 25 30
Arg Lys Asn Phe Leu Ala Trp Tyr Gln Gln Arg Pro Gly Gln Ser Pro
35 40 45
Lys Leu Leu Ile Tyr Ala Trp Ser Thr Arg Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Lys Gln Ser Ile
85 90 95
Tyr Leu Trp
<210> 21
<211> 18
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 21
Gly Ser Thr Ser Gly Ser Gly Lys Pro Gly Ser Gly Glu Gly Ser Thr
1 5 10 15
Lys Gly
<210> 22
<211> 222
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 22
Glu Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Thr Ser Gly Thr Phe Phe Ser Asp Tyr
20 25 30
Tyr Met Ser Trp Val Arg Gln Pro Pro Gly Lys Ala Leu Glu Trp Leu
35 40 45
Gly Phe Ile Arg Asn Ala Lys Asn Gly Tyr Thr Thr Glu Tyr Ser Ala
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Tyr Arg Asp Asn Ser Gln Ser Ile
65 70 75 80
Leu Tyr Leu Gln Met Asn Thr Leu Arg Ala Glu Asp Ser Ala Thr Tyr
85 90 95
Tyr Cys Ala Arg Ala Tyr Gln Tyr Trp Gly Ser Thr Ser Gly Ser Gly
100 105 110
Lys Pro Gly Ser Gly Glu Gly Ser Thr Lys Gly Glu Leu Val Met Thr
115 120 125
Gln Ser Pro Ser Ser Leu Ala Val Ser Ala Gly Glu Lys Val Thr Met
130 135 140
Ser Cys Lys Ser Ser Gln Ser Leu Phe Asn Thr Arg Lys Asn Phe Leu
145 150 155 160
Ala Trp Tyr Gln Gln Arg Pro Gly Gln Ser Pro Lys Leu Leu Ile Tyr
165 170 175
Ala Trp Ser Thr Arg Glu Ser Gly Val Pro Asp Arg Phe Thr Gly Ser
180 185 190
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Val Gln Ala Glu
195 200 205
Asp Leu Ala Val Tyr Tyr Cys Lys Gln Ser Ile Tyr Leu Trp
210 215 220
<210> 23
<211> 22
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 23
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro
20
<210> 24
<211> 244
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 24
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Glu Val Lys Leu Val Glu Ser Gly Gly Gly
20 25 30
Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Thr Ser Gly
35 40 45
Thr Phe Phe Ser Asp Tyr Tyr Met Ser Trp Val Arg Gln Pro Pro Gly
50 55 60
Lys Ala Leu Glu Trp Leu Gly Phe Ile Arg Asn Ala Lys Asn Gly Tyr
65 70 75 80
Thr Thr Glu Tyr Ser Ala Ser Val Lys Gly Arg Phe Thr Ile Tyr Arg
85 90 95
Asp Asn Ser Gln Ser Ile Leu Tyr Leu Gln Met Asn Thr Leu Arg Ala
100 105 110
Glu Asp Ser Ala Thr Tyr Tyr Cys Ala Arg Ala Tyr Gln Tyr Trp Gly
115 120 125
Ser Thr Ser Gly Ser Gly Lys Pro Gly Ser Gly Glu Gly Ser Thr Lys
130 135 140
Gly Glu Leu Val Met Thr Gln Ser Pro Ser Ser Leu Ala Val Ser Ala
145 150 155 160
Gly Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Phe Asn
165 170 175
Thr Arg Lys Asn Phe Leu Ala Trp Tyr Gln Gln Arg Pro Gly Gln Ser
180 185 190
Pro Lys Leu Leu Ile Tyr Ala Trp Ser Thr Arg Glu Ser Gly Val Pro
195 200 205
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
210 215 220
Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Lys Gln Ser
225 230 235 240
Ile Tyr Leu Trp
<210> 25
<211> 86
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 25
Ala Ala Ala Phe Val Pro Val Phe Leu Pro Ala Lys Pro Thr Thr Thr
1 5 10 15
Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro
20 25 30
Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val
35 40 45
His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro
50 55 60
Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu
65 70 75 80
Tyr Cys Asn His Arg Asn
85
<210> 26
<211> 113
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 26
Leu Arg Val Lys Phe Ser Arg Ser Ala Glu Pro Pro Ala Tyr Gln Gln
1 5 10 15
Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu
20 25 30
Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly
35 40 45
Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln
50 55 60
Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu
65 70 75 80
Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr
85 90 95
Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro
100 105 110
Arg
<210> 27
<211> 41
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 27
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
1 5 10 15
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
20 25 30
Pro Glu Glu Glu Glu Gly Gly Cys Glu
35 40
<210> 28
<211> 484
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 28
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Glu Val Lys Leu Val Glu Ser Gly Gly Gly
20 25 30
Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Thr Ser Gly
35 40 45
Thr Phe Phe Ser Asp Tyr Tyr Met Ser Trp Val Arg Gln Pro Pro Gly
50 55 60
Lys Ala Leu Glu Trp Leu Gly Phe Ile Arg Asn Ala Lys Asn Gly Tyr
65 70 75 80
Thr Thr Glu Tyr Ser Ala Ser Val Lys Gly Arg Phe Thr Ile Tyr Arg
85 90 95
Asp Asn Ser Gln Ser Ile Leu Tyr Leu Gln Met Asn Thr Leu Arg Ala
100 105 110
Glu Asp Ser Ala Thr Tyr Tyr Cys Ala Arg Ala Tyr Gln Tyr Trp Gly
115 120 125
Ser Thr Ser Gly Ser Gly Lys Pro Gly Ser Gly Glu Gly Ser Thr Lys
130 135 140
Gly Glu Leu Val Met Thr Gln Ser Pro Ser Ser Leu Ala Val Ser Ala
145 150 155 160
Gly Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Phe Asn
165 170 175
Thr Arg Lys Asn Phe Leu Ala Trp Tyr Gln Gln Arg Pro Gly Gln Ser
180 185 190
Pro Lys Leu Leu Ile Tyr Ala Trp Ser Thr Arg Glu Ser Gly Val Pro
195 200 205
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
210 215 220
Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Lys Gln Ser
225 230 235 240
Ile Tyr Leu Trp Ala Ala Ala Phe Val Pro Val Phe Leu Pro Ala Lys
245 250 255
Pro Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile
260 265 270
Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala
275 280 285
Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr
290 295 300
Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu
305 310 315 320
Val Ile Thr Leu Tyr Cys Asn His Arg Asn Lys Arg Gly Arg Lys Lys
325 330 335
Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr
340 345 350
Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly
355 360 365
Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Glu Pro Pro Ala
370 375 380
Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg
385 390 395 400
Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu
405 410 415
Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn
420 425 430
Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met
435 440 445
Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly
450 455 460
Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala
465 470 475 480
Leu Pro Pro Arg
- 抗Tim3的抗体、嵌合抗原受体及其应用
- 一种靶向FGFR4的单链抗体、嵌合抗原受体、嵌合抗原受体T细胞及其制备方法和应用
