微流控芯片、细胞筛选系统与控制方法
文献发布时间:2023-06-19 09:52:39
技术领域
本公开涉及生物检测领域,尤其涉及一种微流控芯片、细胞筛选系统与控制方法。
背景技术
在各种生物检测场景中,需要利用细胞筛选装置从试样溶液中将目标细胞分离出来,以对目标细胞进行进一步的操作。其中的目标细胞可例如循环肿瘤细胞(CTC,Circulating Tumor Cells)。以CTC技术为代表的液体活检技术已经在肿瘤筛查、预后检测、药效评价等多方面开展应用。
现有的相关技术中,可采用微流控芯片实现细胞的筛选,具体的,可以从导入通道灌入试样溶液,经过筛选部筛选过滤后,试样溶液中尺寸较小的非目标细胞可通过筛选部进入导出通道,而尺寸较大的目标细胞则被筛选部拦截,筛选部最终实现以CTC为例的目标细胞在微流控芯片中的富集。
然而,在实际检测过程中,需要先将稀释液送入芯片的流体通道,对其中的气泡进行排除,然后将血液样本送入充满稀释液的芯片的流体通道。由于芯片通道尺寸较小,试样溶液流速有限,细胞筛选的时长通常较长,导致检测过程时长较长。
发明内容
本公开提供一种微流控芯片、细胞筛选系统系统与控制方法,以解决预先稀释的过程比较耗费时间,将导致检测过程时长过长的问题。
根据本公开的第一方面,提供了一种微流控芯片,包括:芯片主体,所述芯片主体内设有导入通道、筛选部与导出通道,所述筛选部设于所述导入通道与所述导出通道之间,所述筛选部中设有用于在所述导入通道与所述导出通道之间提供液体流通通道的多个筛选单元,所述芯片主体内还设有第一进口与第二进口,所述导入通道的通道空间分别连接至第一进口与第二进口。
根据本公开的第二方面,提供了一种细胞筛选系统,包括第一方面及其可选方案涉及的微流控芯片,以及液体输入装置、废液收集装置,所述液体输入装置分别连接所述第一进口与所述第二进口,所述微流控芯片的导出通道与所述废液收集装置连接。
根据本公开的第三方面,提供了一种细胞筛选方法,用于控制第二方面及其可选方案涉及的细胞筛选系统,包括:
在需要向所述微流控芯片输入试样溶液时,控制所述液体输入装置将稀释液与血样同时送入所述导入通道,其中,所述血样与所述稀释液分别经所述第一进口与所述第二进口被送入所述导入通道。
本公开提供的微流控芯片、细胞筛选系统与控制方法中,由于导入通道的入口端分别连接至用于第一进口与第二进口,本公开提供了一种稀释液与血样可被同时送入的微流控芯片,进而,在使用该构造的微流控芯片时,可同时将稀释液与血样送入,无需在通入导入通道之前将稀释液与血液样本混合稀释,从而避免预先混合稀释的过程而导致的时间耗费,有效提高了检测效率,减少了检测过程的时长。
同时,由于稀释液与血样是经不同进口进入到导入通道的,在稀释液与血样完全混合之前,稀释液与血样之间可形成分层,互相之间还可发生对冲,进而,分层与对冲会使得血样受到来自稀释液的侧向压力,若在该分层下,血样处于稀释液与筛选部之间时,侧向压力可驱使血样进入到筛选部,提升血样中目标细胞进入到筛选部的可能性,从而提高血样中目标细胞的截留率,可见,本公开为提高截留率提供了构造基础。
附图说明
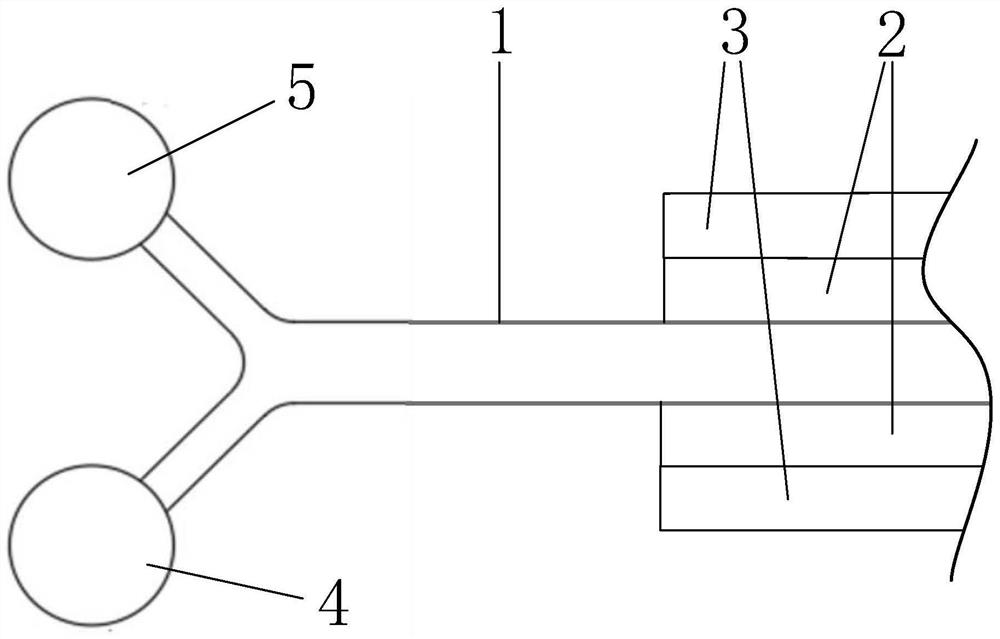
图1是本公开一实施例中微流控芯片的局部构造示意图一;
图2是本公开一实施例中微流控芯片的局部构造示意图二;
图3是本公开一实施例中微流控芯片的局部构造示意图三;
图4是本公开一实施例中微流控芯片的局部构造示意图四;
图5是本公开一实施例中微流控芯片的局部构造示意图五;
图6是本公开一实施例中微流控芯片的局部构造示意图六;
图7是本公开一实施例中微流控芯片的局部构造示意图七;
图8是本公开一实施例中微流控芯片的结构示意图一;
图9是本公开一实施例中微流控芯片的结构示意图二;
图10是本公开一实施例中微流控芯片的局部构造示意图八;
图11是本公开一实施例中微流控芯片的局部构造示意图九;
图12是本公开一实施例中微流控芯片的局部构造示意图十;
图13是本公开一实施例中微流控芯片的局部构造示意图十一;
图14是本公开一实施例中微流控芯片的局部构造示意图十二;
图15是本公开一实施例中微流控芯片的局部构造示意图十三;
图16是本公开一实施例中微流控芯片的局部构造示意图十四;
图17是本公开一实施例中微流控芯片的局部构造示意图十五;
图18是本公开一实施例中微流控芯片的局部构造示意图十六;
图19是本公开一实施例中微流控芯片的局部构造示意图十七;
图20是本公开一实施例中微流控芯片的局部构造示意图二十;
图21是本公开一实施例中检测系统的构造示意图一;
图22是本公开一实施例中检测系统的构造示意图一。
附图标记说明:
1-导入通道;101-第一通道空间;102-第二通道空间;103-曲线通道段;104-直线通道段;1041-目标直线通道段;2-筛选部;21-筛选通道;22-容置腔;221-第一连通口;222-第二连通口;23-凹槽;24-凸起限位块;25-筛选间隙;26-间隙隔断部;27-凸起限位块;3-导出通道;4-第一进口;5-第二进口;6-芯片出口;7-主体层;8-封装层;9-分流管道组件;10-汇流管道组件;
100-细胞筛选系统;1001-微流控芯片;1002-液体输入装置;1003-废液收集装置;1004-光源;1005-图像采集装置;1006-数据处理装置。
具体实施方式
下面将结合本公开实施例中的附图,对本公开实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本公开一部分实施例,而不是全部的实施例。基于本公开中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本公开保护的范围。
本公开的说明书和权利要求书及上述附图中的术语“第一”、“第二”、“第三”“第四”等(如果存在)是用于区别类似的对象,而不必用于描述特定的顺序或先后次序。应该理解这样使用的数据在适当情况下可以互换,以便这里描述的本公开的实施例能够以除了在这里图示或描述的那些以外的顺序实施。此外,术语“包括”和“具有”以及他们的任何变形,意图在于覆盖不排他的包含,例如,包含了一系列步骤或单元的过程、方法、系统、产品或设备不必限于清楚地列出的那些步骤或单元,而是可包括没有清楚地列出的或对于这些过程、方法、产品或设备固有的其它步骤或单元。
下面以具体地实施例对本公开的技术方案进行详细说明。下面这几个具体的实施例可以相互结合,对于相同或相似的概念或过程可能在某些实施例不再赘述。
为了分离试样溶液中的目标细胞以便于后续观测或者检验,本实施例提供一种微流控芯片,微流控芯片的材质可以为透明材料,以便用于后续对目标细胞进行筛选。
请参考图1至图4,微流控芯片,包括:芯片主体,所述芯片主体内设有导入通道1、筛选部2与导出通道3,所述筛选部2中设有用于在所述导入通道1与所述导出通道2之间提供液体流通通道的多个筛选单元,所述芯片主体内还设有第一进口4与第二进口5。其中,筛选部2可理解为是设于导入通道侧壁的(也可理解为其是设于导出通道侧壁的),该侧壁的两侧分别为导入通道的通道内空间与导出通道的通道内空间。
所述导入通道1的通道空间分别连接至第一进口4与第二进口5。具体可理解为:液体进入导入通道1的方式为:经自第一进口4与第二进口5进入,只要实现了该方式,则不脱离本公开实施例的范围。此外,导入通道1的远离第一进口4与第二进口5的通道段是封闭的,对应可形成导入通道1的封闭端。
一种举例中,请参考图1与图2,第一进口4与第二进口5可分别经不同的通道连接导入通道1的入口端,另一种举例中,请参考图3与图4,第一进口4与第二进口5可设于导入通道1的侧壁,该举例下,第一进口4与第二进口5可沿导入通道的中心线错位分布(如图4所示),也可以沿导入通道的中心线非错位分布(如图3所示),第一进口4与第二进口5可设于导入通道1的相对的两个侧壁。
其中的第一进口4,可理解为在至少部分时间可用于接入稀释液或血样的进口,在其他时间,该第一进口4也可能用于接入其他液体。
其中的第二进口5,可理解为在至少部分时间可用于接入血样或稀释液的进口,在其他时间,该第二进口5也可能用于接入其他液体。
不论该第一进口4与第二进口5是何种形状、尺寸,均不脱离本公开实施例的范围。
其中一种实施方式中,所述第一进口4与所述第二进口5用于:在部分时间被同时接入血样与稀释液。
其中的稀释液可理解为能够实现血样稀释的任意液体,例如可以为PBC,该PBC具体为Phosphate Buffered Saline,也可理解为磷酸盐缓冲液。
可见,以上方案中,提供了一种稀释液与血样可被同时送入的导入通道,进而,在使用该构造的微流控芯片时,可同时将稀释液与血样送入,无需在通入导入通道之前将稀释液与血液样本混合稀释,从而避免预先混合稀释的过程而导致的时间耗费,有效提高了检测效率,减少了检测过程的时长。
其中的导入通道1可以为能够自第一进口与第二进口接入液体,并将液体引导至筛选部的任意结构,其中的筛选部2可以为具有筛选单元的任意结构,同时,筛选部2中各筛选单元阵列排布的形状、导出通道3的形状与导入通道1的形状是互相匹配的。
部分举例中,请参考图2与图3,所述筛选部2可设于所述导入通道1沿参考方向的一侧。所述参考方向垂直于所述导入通道的导流方向。
其中导入通道的导流方向,可理解为:试样溶液在导入通道引导下的整体流向,也可理解为沿导入通道中心线的方向。针对于曲线的导入通道部分,参考方向例如平行于对应曲线的法线,针对于直线的导入通道部分,参考方向例如垂直于对应该直线。
另部分举例中,请参考图1,所述导入通道1沿所述参考方向的两侧均设有所述筛选部2。不论是单侧设置筛选部还是双侧设置筛选部,均不脱离本公开实施例的范围,同时,在结合具体的导入通道形状后还可进一步起到有助于截留目标细胞的积极效果。
请参考图2与图3,在单侧设置筛选部的情况下,所述第一进口4连接至所述导入通道1内的第一通道空间101,所述第二进口5连接至所述导入通道内的第二通道空间102,所述第二通道空间102与所述第一通道空间101沿所述参考方向依次分布。
其中第一通道空间101与第二通道空间102的尺寸可以是相同的,也可以是不同的,任意沿所述参考方向依次分布,从而划分导入通道1的通道空间的方案,均不脱离以上描述的范围。
一种举例中,第一进口可用于接入血样,故而该第一进口也可理解为血样进口,第二进口可用于接入稀释液,故而该第二进口也可理解为稀释液进口,对应的,以上方案的手段也可理解为:血样进口设置在导入通道靠近筛选部的一侧,而稀释液进口设置在导入通道远离筛选部的一侧。
进而,通过以上方案,可在导入通道及其入口端形成入液层流,此时,可有助于利用稀释液将血样压向筛选部。具体的,在稀释液与血样完全混合之前,稀释液与血样之间可形成分层,互相之间还可发生对冲,进而,分层与对冲会使得血样受到来自稀释液的侧向压力,侧向压力可驱使血样进入到筛选部,提升血样中目标细胞进入到筛选部的可能性,从而提高血样中目标细胞的截留率。
其中一种实施方式中,请参考图5、图6与图7,所述导入通道包括依次直接或间接连接的多个曲线通道段103,其中的曲线通道段也可理解为呈圆弧形的圆弧通道段,对应的,导出通道3亦即为与之匹配的圆弧形。其中的圆弧形可以是固定半径的圆弧形(即曲率半径保持不变的曲线),也可以是变径的圆弧形(即曲率半径发生变化的曲线)。
以上方案中,通过将导入通道的至少部分通道段配置为曲线通道段,可避免因较长长度的导入通道而形成较长长度的微流控芯片,有效降低了微流控芯片的长度。
同时,导入通道的导流路径长度可不受限于微流控芯片的长度,进而,在芯片长度不变的情况下,可形成较长的导流路径长度,从而有利于提高细胞截留效果。
部分举例中,导入通道1可被配置为:曲线通道段103的侧壁设有筛选单元,此时,曲线通道段103可起到导入通道的导流作用,并且,在对应通道段,还可在导入通道与导出通道之间流通试样溶液,进而,该举例下,可在曲线通道段11进行目标细胞的截留。
另部分举例中,导入通道1也可被配置为:曲线通道段103之外其他通道段的侧壁设有筛选单元,曲线通道段103的侧壁未设置筛选单元,此时,曲线通道段103仅起到导流的作用,在曲线通道段,导入通道与导出通道之间可不流通试样溶液,进而,该举例下,可在非曲线的通道段(例如直线通道段)进行目标细胞的截留。
再部分举例中,导入通道1还可被配置为:曲线通道段103与其他通道段的侧壁均设有筛选单元(即部分筛选单元设置于曲线通道段11的侧壁,部分筛选单元设置于导入通道中非曲线通道段的通道段的侧壁)。进而,该举例下,既可在非曲线的通道段(例如直线通道段)进行目标细胞的截留,也可在曲线通道段103进行目标细胞的截留。
其中,若采用直线通道段进行截留,目标细胞易于集中于通道段的头部和尾部,不利于通道段的中间部位对目标细胞的截留,处于该中间部位的筛选单元的利用率较低,限制了截留能力,相较而言,在利用曲线通道段截留细胞的情况下,由于试样溶液流动过程中离心力的作用,可提高中间部位筛选单元的捕获效率,进而可有效提高筛选单元的利用率。
请参考图7,所述多个曲线通道段103可以包括第一曲线通道段与第二曲线通道段,所述第一曲线通道段的曲率中心处于所述导入通道的第一侧,所述第二曲线通道段的圆心处于所述导入通道的第二侧。
在图7所示的举例中,由于导入通道、导出通道与筛选部的形状是相匹配的,故而,图7虽然示意了导入通道、导出通道与筛选部的整体形状,但其实际可体现出导入通道的形状。在图7中,每个曲线段可参照与一个圆弧形理解,第1、3、5、7、9、11个圆弧形开口朝下,其中,导入通道的对应通道段均可理解为第一曲线通道段,对应的,其曲率中心处于导入通道的下侧,第2、4、6、8、10个圆弧形开口朝上,其中,导入通道的对应通道段均可理解为第二曲线通道段,对应的,其曲率中心处于导入通道的上侧。
在图7所示的举例中,所述导入通道1沿参考方向的两侧可均设有所述筛选部2,其可参照于图5所示的结构形式理解。
基于此,图7所示的方案中,通过第一曲线通道段与第二曲线通道段的交替连接,可形成全程采用曲线通道段的S形导入通道,同时,该S形导入通道可全通道段均配置筛选单元,进而,可以使得目标细胞能够均衡截留在不同筛选部中。
此外,S形导入通道可以是半圆形拼接的形状,也可以是正弦曲线等波浪线形状,可见,圆弧形通道段的弧度、半径等可以任意配置。
请参考图8与图9,所述多个曲线通道段103的曲率中心均处于所述导入通道1的同一侧,具体的,由于筛选部设于导入通道沿参考方向的第一侧,所述多个曲线通道段103的曲率中心可均处于所述导入通道1的第二侧。即:所述筛选部2位于所述导入通道1的与所述曲率中心相背的一侧(也可理解为:在曲线通道段中,筛选部处于导入通道的转弯区外侧),则:细胞流过时,由于惯性的作用,细胞受到远离旋转中心的离心力影响,导致细胞在转弯区会聚集到外侧的筛选部,此时,转弯区外侧的筛选部将截留到更多的目标细胞。由此,在转弯区能实现较佳的细胞捕获效果。
进一步的,所述导入通道1可以呈一个或多个螺旋线型。所述多个曲线通道段301可依次直接或间接连接形成一个或多个螺旋线型。
其中一种实施方式中,请参考图8与图9,所述导入通道包括至少一个呈螺旋线形的子通道,所述子通道为至少部分所述曲线通道段103直接或间接连接而形成的。
其中,单个子通道对应呈现出单个螺旋线形,在单个螺旋线形的子通道中,子通道的第一端是设于或接近于螺旋中心的,第二端是远离螺旋中心的,子通道各部位相对于该第一端的间隔通道长度,与各部位相对于螺旋中心的直线距离(或可理解为螺旋的半径)是匹配变化的,具体可理解为:在子通道各部位中,随着该间隔通道长度的逐渐变大,螺旋的半径也会变大,其中螺旋半径的变大,可以是逐渐变大的,也可以是非逐渐变大的,其中的逐渐变大可以是均匀变大,也可以是非均匀变大。
在图8与图9所举例的螺旋线形的子通道中,在子通道的各部位中,随着该间隔通道长度的逐渐变大,该螺旋的半径是均匀变化的,或可理解为:在图8与图9所举例的螺旋线形的子通道中,单个子通道中曲率的变化率是相同的,还可理解为:螺旋线形是基于圆形的螺旋线形。
在其他举例中,螺旋线形的子通道也可以包含直线通道段,例如可形成基于跑道型的螺旋线形。
在部分方案中,请参考图3与图4,所述子通道的数量为一个,此时,该子通道的进口可设于螺旋线形的螺旋中心(其中包含准确处于螺旋中心的情形,也可包含临近于螺旋中心的情形),此时,子通道的进口可作为导入通道的进口,或经其他通道段连接至导入通道的进口。同时,子通道中离螺旋中心最远的通道段封闭,从而形成导入通道的封闭端。
实际工作过程中,导入通道的进口需对外连接连接管,在以上方案中,由于导入通道的进口处于螺旋中心的位置或其附近位置,连接管将会横向遮挡到芯片本体的其他部位(例如筛选部),进而,在对目标细胞进行筛选后进行光学检测时,连接管的遮挡将会对光学检测造成影响或阻碍。为了避免该影响、阻碍,以图9为例的方案中,可将导入通道的进口与封闭端均设计为远离螺旋中心的位置。
具体的,请参考图9,所述子通道的数量为两个,分别为依次连接的第一子通道与第二子通道。
请参考图9,所述第一子通道的螺旋中心与所述第二子通道的螺旋中心重合,且所述第一子通道的出口与所述第二子通道的进口连接于所述螺旋中心。
所述第一子通道的进口设于所述第一子通道中离对应螺旋中心最远的通道段,其也可理解为:第一子通道的进口设于第一子通道的远离对应螺旋中心的一端(或其附近位置)。所述第二子通道中离对应螺旋中心最远的通道段封闭;进而,第一子通道的进口可作为导入通道的进口,或经其他通道段连接至导入通道的进口,第二子通道最远离螺旋中心的至少部分部位可形成导入通道的封闭端。
由于螺旋线型的结构可以为在其中流动的试样溶液提供离心力,试样溶液中细胞在试样溶液流动过程中受到向外侧的合力,细胞可贴靠螺旋线形导入通道的外侧侧壁(即外侧的筛选部)流动,从而使得细胞趋向于筛选部,有利于捕捉细胞。同时,试样溶液在沿着导入通道流动的过程中受离心力影响会被甩向相对外侧的筛选部,相较于采用直线通道段的方案,可提高中间段筛选部中筛选单元的捕获效率,进而可有效提高筛选单元的利用率。
其中一种实施方式中,请参考图10、图11与图12,所述导入通道1包括N个直线通道段104,其中的N为大于或等于1的整数,所述直线通道段104的导流路径呈直线形,所述N个直线通道段104包括以下至少之一:
连接第一个曲线通道段103首端的首端直线通道段;
连接最后一个曲线通道段103尾端的尾端直线通道段;
连接于其中两个曲线通道段103之间的中间直线通道段,以及:
未与其他曲线通道段连接的直线通道段。
部分方案中,直线通道段104的侧壁未设有筛选单元(如图11所示),另部分方案中,直线通道段104的侧壁对应设有的筛选单元(如图10所示)。
进一步的举例中,请参考图12,其中至少之一直线通道段为目标直线通道段1041,目标直线通道段1041的两侧侧壁均设有筛选部2,并经两侧侧壁的筛选部2连接导出通道3。
以图12为例,所述目标直流通道段1041两侧的筛选部2的间距满足:所述间距沿所述目标直流通道的导流路径先变小再变大。
其中,由于试样溶液倾向于走流速快的通道部分(即中间相对窄的区域),以上方案中,由于间距呈现为两头间距大于中间间距的结构形式,可增加中间位置的通道压力,迫使试样溶液经中间段的两侧筛选单元流动,提高中间段筛选单元的截留率,减少尾部堆积。
请参考图13至图20,所述筛选单元包括一个容置腔22与至少一条筛选通道21。可见,在一个筛选单元中,不论是采用一个筛选通道(如图13所示)还是多个筛选通道(如图14所示的两个,以及图15所示的三个),也不论具体数量为多少,均不脱离本公开实施例的范围。
其中一种实施方式中,每个所述筛选单元包括一个容置腔22和分别与所述容置腔连通的多个筛选通道21。所述导入通道1与所述容置腔22连通,所述容置腔22与所述筛选通道21入口端连通,所述筛选通道21的出口段与所述导出通道3连通;所述容置腔22的宽度大于目标细胞的直径,所述筛选通道21的宽度小于所述目标细胞的直径。
其中,由于多个筛选通道分别与容置腔连通,进入容置腔的液体将分流至多个筛选通道,不同筛选通道的流体(即试样溶液)流动均会对容置腔中的目标细胞产生驱动作用,且不同筛选通道的驱动作用是将目标细胞驱动至不同筛选通道的,此时,由于一个目标细胞一次仅可能挤入一个筛选通道,任意之一筛选通道的驱动作用均会对其他筛选通道的驱动作用产生阻碍,相较而言,在将目标细胞引导至同一筛选通道的方案中,流体所产生的驱动作用不会受到该阻碍,可见,通过多个筛选通道,可阻碍容置腔中的目标细胞轻易进入任意之一筛选通道,有效提高了筛选通道对目标细胞的截留能力,从而有助于降低目标细胞挤入筛选通道的可能性,提高截留率。
同时,相较于仅采用一个筛选通道的方案,多个筛选通道的分流可提升试样溶液的流通截面积,从而提高试样溶液流速的上限,进而,可适用于更快的液体泵入速度,有助于提高检测效率,降低检测时间。
在图13至图16所示的微流控芯片中,导入通道1的中心线整体呈直线,在其他举例中,即便是采用多筛选通道的方案,依旧适用于前文各种可选方案所提及的导入通道1形状。
其中一种实施方式中,所述多个筛选通道分别具有不同的导流方向。其他部分举例中,所述多个筛选通道中两个或多个筛选通道的导流方向也可以是相同(或可理解为平行)的。
其中筛选通道的导流方向,可理解为:试样溶液在筛选通道引导下的流向,也可理解为沿筛选通道中心线,且自导入通道至导出通道的方向,由于筛选通道通常是不发生弯曲的,故而,筛选通道的导流方向还可理解为;沿筛选通道两端中心的连线,且自导入通道至导出通道的方向。
此外,筛选通道的形状并不限于图中所示的长条形的,还可能是呈三角形或其他规则或不规则形状。不论采用何种形状,均不脱离本公开实施例的范围
通过不同导流方向的筛选通道,可使得不同方向流动的流体(即试样溶液)对容置腔中的目标细胞产生不同方向、角度的驱动作用,进一步提高了单个筛选通道的驱动作用对其他筛选通道驱动作用的阻碍强度,从而进一步提高了筛选单元对目标细胞的截留能力,从而有助于进一步降低目标细胞挤入筛选通道的可能性,提高截留率。
其中一种实施方式中,请参考图14与图15,在所述导入通道1用于与所述容置腔22连通的一段中,所述导入通道1的导流方向与所述容置腔22的导流方向之夹角为锐角,且所述容置腔22的导流方向与对应的所述多个筛选通道21之一的导流方向一致。
其中导入通道的导流方向,可理解为:试样溶液在导入通道引导下的整体流向,也可理解为沿导入通道中心线,且远离导入通道入口的方向。
其中容置腔的导流方向,可理解为试样溶液在容置腔引导下的整体流向,也可理解为沿容置腔的内壁,且远离导入通道的方向。
以上方案中,通过锐角夹角的设计,可避免试剂溶液离开导入通道1进入容置腔22时发生较大转向,使得细胞易于到达容置腔,从而更易于被截留。
其中一种实施方式中,请参考图15与图16,所述多个筛选通道中至少一个筛选通道为第一通道;
在所述导出通道用于与所述第一通道连通的一段中,所述导出通道的导流方向与所述第一通道的导流方向之夹角为锐角。
通过以上配置,可减小筛选通道送出的试样溶液与导出通道中流通的试样溶液之间形成相互阻碍的作用力,以及不同筛选通道间送出液体之间相互阻碍的作用力,导出通道中试样溶液的流动可带走筛选通道出来的试样溶液,进而,该方案可有效提高流速。
反之,如果筛选通道的导流方向与导出通道的导流方向大于90度,会形成逆向冲击,从而影响流速,不利于筛选通道内试样溶液流出,进一步的,导出通道中试样溶液易对容置腔中捕获的目标细胞(例如CTC细胞)造成反向冲击,导致目标细胞脱离容置腔。
此外,一种举例中,针对于同一多通道筛选单元中任意的第一筛选通道与第二筛选通道,且所述第一筛选通道的出口端与所述第二筛选通道的出口端沿所述导出通道的导流方向依次分布,所述第一筛选通道的导流方向与导出通道的导流方向的夹角大于所述第二筛选通道的导流方向与导出通道的导流方向的夹角。
以上方案中,可避免沿导出通道3导流方向上靠后筛选通道的出液对靠前筛选通道的出液造成逆向冲刷,进一步保障了试样溶液的流速。
其中一种实施方式中,请参考图13至图15,所述筛选通道21的出口端形成有缓冲凹槽23,以垂直于所述筛选通道的中心线的平面为投影面,所述缓冲凹槽在所述投影面的投影区域覆盖并超出所述筛选通道在所述投影面的投影区域。
其中的缓冲凹槽23,可理解为下凹于导出通道3侧壁且处于筛选通道21端面处的凹槽,且该缓冲凹槽23的宽度大于筛选通道21的宽度。其中,缓冲凹槽23与筛选通道21的宽度(即沿宽度方向的尺寸),可理解为:对应的宽度方向同时垂直于对应筛选通道21的导流方向与所述筛选部2的厚度方向,该厚度方向既是筛选通道21的厚度方向,也是筛选单元的厚度方向,可理解为同时垂直于所述筛选通道21的导流方向与所述导入通道1的中心线的方向,还可理解为芯片主体的厚度方向。
具体举例中,该缓冲凹槽23的厚度(即厚度方向的尺寸)可以与筛选通道21的厚度相同或相近,缓冲凹槽23的导流方向可以与对应筛选通道21相同。
以上方案中,由于筛选通道21和/或容置腔22被配置为倾斜后,通道长度变长了,这导致试样溶液中细胞流经狭窄且长的筛选通道时容易发生拥堵的问题,影响流速。因此,通过增加宽度较大的缓冲凹槽,可有利于缩短筛选通道长度,避免非目标细胞在过长的筛选通道中堵塞淤积,提高流速、提高检测效率。同时,通过缓冲凹槽23,也可以缓冲导出通道中液体的反冲压力,避免筛选通道处的淤积。
其中一种实施方式中,请参考图16,所述多个筛选单元包括多个第一筛选单元与多个第二筛选单元,所述多个第一筛选单元与所述多个第二筛选单元分别设于所述导入通道相对的两侧,其中,所述导入通道中的液体(即试样溶液)能够分别进入其两侧的第一筛选单元与第二筛选单元(例如图16所示的上下两侧的筛选单元);
所述第一筛选单元中容置腔与导入通道的连通口为第一连通口221,所述第二筛选单元中容置腔与导入通道的连通口为第二连通口222;所述第一连通口与所述第二连通口在所述导入通道的中心线的方向错位分布。
同时,其中的多个第一筛选单元的多个第一连通口221是沿导入通道1的中心线依次分布的。进而,其中的错位,可理解为:除了首个或末尾一个第一连通口221,针对于任意一个第一连通口221,其关于导入通道1中心线对称的部位处于相邻的两个第二连通口之间。
另部分举例中,各第一连通口与各第二连通口可以是关于导入通道1的中心线对称分布的。
相比于现有技术中对称设置或单侧设置筛选部的方案,以图16为例的方案中,通过错位分布,可错开分流位置,导入通道全程可实现分流,避免了对称结构中间隔出现两侧相对壁的问题,提高了分流效率,同时,通过均衡的分压,最终可提高对目标细胞的截留率,减少了漏出的目标细胞(例如CTC)。
另外,在管道中,流体的流动通常为层流,靠近管道中心的流体的流速更大,靠近管壁的流体的流速更小,左右两侧筛选部中筛选通道从侧向分流提供了侧向流速,因此,通过设置非对称通道可以降低流体中细胞错过两侧容置腔的概率。
其中一种实施方式中,同一筛选部中,至少部分容置腔22的连通口的宽度是不同的,其中连通口的宽度指对应容置腔22的入口端的沿所述导入通道1中心线方向的尺寸(即图16中左右方向的尺寸)。
进一步的,在同一筛选部中,连通口宽度的不同尺寸可以仅具有两种不同尺寸,也可具有三种或三种以上不同尺寸。
进一步举例中,连通口宽度的尺寸变化可例如是沿导入通道1的导流方向自小变大而渐变的,也可以是先变大再变小的(也可理解为入口宽度被配置为两端位置的连通口宽度较窄,中间位置的连通口宽度较款)的变化趋势。
以上方案中,由于目标细胞的大小在一定范围内也会存在差异,例如CTC大小在10-20μm的范围内也存在差异,通过设置多种尺寸的入口宽度,有利于捕获不同尺寸的目标细胞。
同时,经试验分析,目标细胞(例如CTC)主要集中卡在筛选部的沿导入通道1导流方向的开头和尾部,那么为了避免多个细胞在同一个容置腔中堆叠,将宽度配置为两端位置的入口宽度较窄,中间位置的入口宽度较宽,可以提高单个容置腔的单个细胞捕获效果。
此外,其中容置腔、导流通道的截面形状可以是任意变化的,本领域任意已有或改进的变化均不脱离本公开实施例的范围。
其中一种实施方式中,请参考图17至图19,所述筛选部2还包括筛选间隙25,所述筛选间隙25位于所述筛选单元(例如筛选通道21、容置腔22)沿厚度方向的一侧,所述筛选间隙25连接所述导入通道1与所述导出通道3,所述筛选间隙25沿厚度方向的间隙距离小于或等于对应筛选通道21的宽度。其中,筛选缝隙25可以设置在顶部,也可以设置在底部。
现有相关技术中,导入通道1中的试样溶液只能通过筛选通道21进入导出通道3,但在以上方案中,在筛选部的一侧还增加了筛选间隙25,进而,导入通道1中的试样多了一条流入导出通道的路径,从而大大提高了芯片中试样溶液的流速,缩短检测时长。
具体实施过程中,请参考图18,所述筛选间隙包括沿所述导入通道的中心线方向(即导入通道的导流方向)分布的至少两个间隙段,相邻的两个间隙段之间通过间隙隔断部26隔断,每个间隙段连接至少一个筛选通道21。
在不采用隔断部的情况下,图17所示结构可能发生形变(制造或使用过程中而产生的形变),进而,有可能导致筛选间隙变大漏出目标细胞,对应的,在以上方案中,通过间隙隔断部26的隔断,可通过支撑作用避免或降低形变的发生可能性,避免因此而导致的目标细胞漏出。
进一步可选方案中,请参考图17,所述筛选间隙25中连接所述筛选通道的部分为第一间隙部分(即图15所示的对应筛选通道21下侧的间隙部分),所述筛选间隙中未连接所述筛选通道的部分为第二间隙部分,所述第一间隙部分的间隙距离小于所述第二间隙部分的间隙距离。为了实现该间隙距离,由于筛选部2设于主体层7(前文所涉及的导入通道、导出通道、第一进口4、第二进口5、芯片出口6也均设于主体层7),所述筛选间隙25可设于所述封装层8,所述封装层8还设有用于形成所述第一间隙部分的凸起限位块24。
进一步举例中,其中的凸起限位块24的厚度(即沿筛选单元厚度方向的尺寸)可以例如为该间隙距离的一半。
通过以上方案,通过凸起限位块24的设置,可避免在筛选间隙25于筛选通道21的连通区域形成大口径,从而避免或降低细胞漏出的可能性。此外,当筛选间隙25大于筛选通道宽度的一半且小于筛选通道的宽度时,凸起限位块24避免或降低细胞漏出可能性的作用将更为明显。
进一步可选方案中,筛选间隙25的厚度方向的尺寸可以设置为比筛选通道21宽度小(例如小于8um),进一步的,筛选间隙25的厚度方向的尺寸可以优选为小于筛选通道21宽度的一半(例如小于4μm),通过该方案,也可避免在筛选通道和间隙连通区域出现大口径,从而避免或降低细胞漏出的可能性。
其中一种实施方式中,请参考图20,所述芯片结构中还设有分流管道组件9,所述导入通道1的数量为多个;所述分流管道组件9的入口端连接第一进口4与第二进口5;所述分流管道组件分别连接多个导入通道1的入口端;所述分流管道组件9用于通过至少一次分流将所述第一进口4与所述第二进口5进入的液体送至所述多个导入通道1的入口端。
其中一种实施方式中,请参考图20,所述芯片结构中还设有汇流管道组件10,所述导出通道3的数量为多个;所述汇流管道组件10的出口端连接芯片出口6;所述汇流管道组件10分别连接多个导出通道3的出口端;所述汇流管道组件10用于通过至少一次汇流将所述导出通道3送出的液体送至所述芯片出口6。
以上方案中,通过分流与汇流,可提高各入口/出口管道的流体均匀性、压力均衡性,避免某个管道压力过大导致爆裂。
进一步的,每级分流(即每次分流)都设置为1分2,且管道尺寸减半,其作用是为了均衡各入口通道的流量。提高均匀性,提高芯片进口初始速度。
以CTC作为目标细胞为例,携带CTC的血液样本可流入导入通道,尺寸较小的普通正常血细胞从两侧或一侧的筛选流入导出通道,其中携带的CTC无法通过狭窄的筛选通道而被截留在筛选单元的容置腔中。
试样溶液可以从芯片进口进入微流控芯片,由入液分流管道均匀分流至各入口通道。其中导入通道一端开口,用于导入试样溶液,另一端闭合,导入通道通过筛选部中的容置腔、筛选通道与导出通道连通,且筛选通道的宽度小于CTC的最小宽度,例如可优选为8μm,容置腔的宽度大于8μm,通常是单个CTC的直径。试样溶液中液体和尺寸较小的血细胞从导入通道“挤进”或“漏进”导出通道,尺寸较大的目标细胞(CTC)则因无法通过筛选通道,而被截留于导入通道和筛选部的容置器中。导出通道的血液样本经过出液分流管道汇聚于出样口(即芯片出口),从而排出。
请参考图21,本公开实施例还提供了一种细胞筛选系统100,包括以上可选方案涉及的微流控芯片1001,以及液体输入装置1002、废液收集装置1003,所述液体输入装置1002分别连接所述第一进口与所述第二进口,所述微流控芯片1001的导出通道与所述废液收集装置1003连接。
其中的液体输入装置,可理解为能够受控使得相应液体(例如稀释液、血样)自相应进口送入微流控芯片的任意组件,例如可以包括相应的管路,以及进样泵,其中的进样泵可例如包括稀释液进样泵与血样进样泵,稀释液进样泵可通过相应管路连接第二进口,血样进样泵可通过相应管路连接第一进口。
进一步举例中,其中的管路可例如包括第一管路、第二管路、第三管路与第四管路,第一管路的进口端连接稀释液进样泵,第二管路的进口端连接血样进样泵,第三管路的出口端连接所述第二进口,第四管路的出口端连接第二进口,同时,第一管路的出口端可直接或间接连接第三管路的进口端,第二管路的出口端可直接或间接连接第四管路的进口端。在部分方案中,为了便于兼顾其他工艺过程中液体的泵入,第一管路的出口端、第三管路的进口端、第二管路的出口端与第四管路的进口端可接于换向阀,进而,通过对换向阀的控制,可实现所需的液体(除了以上稀释液、血样,还可例如固定液、染色液等)的泵入。
其中一种实施方式中,请参考图22,所述的细胞筛选系统100,还包括光源1004、图像采集装置1005和数据处理装置1006;所述数据处理装置1006电连接所述图像采集装置1005,同时,还可电连接光源1004;
所述光源1004用于照射所述微流控芯片;
所述图像采集装置1005信号连接所述数据处理装置,所述图像采集装置用于在所述光源照射所述微流控芯片时采集所述微流控芯片的图像并传输给所述数据处理装置;
所述数据处理装置1006根据所述图像进行目标细胞的识别。
本公开实施例还提供了一种检测方法,用于控制以上可选方案涉及的细胞筛选系统,该方法可应用于以上所涉及的数据处理装置,也可用于其他设备,包括:
在需要向所述微流控芯片1001输入试样溶液时,控制所述液体输入装置1002将稀释液与血样同时送入所述导入通道,其中,所述血样与所述稀释液分别经所述第一进口与所述第二进口被送入所述导入通道。
其中,液体输入装置1002的控制可以是数据处理装置1006实施的,也可以是其他控制设备实施的。进一步的,数据处理装置(或其他控制设备)可连接以上所提及的各进样泵,还可连接以上所涉及的换向阀,进而,可通过控制以上进样泵与换向阀实现以上控制过程。
其中,由于微流控芯片为透明的,在提供光源之后,图像采集装置可采集到相应图像,在图像中,目标细胞(例如CTC)可因为染色而形成对应颜色的像素部分。其中的图像采集装置可例如采用CCD进行图像的采集,具体指Charge-couple Device,其可理解为电荷耦合元件。
在稀释液和血样被同时送入之后,可以通过所述液体输入装置1002将固定液送入所述微流控芯片,具体可送至各导入通道、导出通道、容置腔与筛选通道;
然后,通过所述液体输入装置1002将染色液被送入所述微流控芯片,进而,可对富集的目标细胞进行染色。
在完成染色后,还可通过控制光源1004照射微流控芯片,通过图像采集装置1005采集微流控芯片的图像,并从中检测确定目标细胞的数量。
此外,在送入以上固定液、染色液之前与之后,还可通过所述液体输入装置1002将稀释液被送入微流控芯片,从而对其进行清洗。
其中的固定液,可例如4%的多聚甲醛,也可描述为PFA,具体指Paraformaldehyde。注入固定液之后,可将目标细胞(例如CTC)锁在容置腔内,防止其脱离,从而有利于后续的定位。
其中的染色液,可例如荧光染色剂,其可以是单一的染色剂,也可以是染色剂的混合液,一种举例中,以目标细胞为CPC为例,染色剂可以包括带荧光素的CD45(CD45是一种可携带荧光素的蛋白,用于对白细胞染色)、DAPI(用作染色剂)、带另一种荧光素的EPCAM(EPCAM是另一种可携带荧光素的蛋白,用于对CTC的细胞膜染色)。其中如果部分尺寸较大的白细胞也被截留,但会被染成与CTC不同的颜色。
最后应说明的是:以上各实施例仅用以说明本公开的技术方案,而非对其限制;尽管参照前述各实施例对本公开进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本公开各实施例技术方案的范围。
- 微流控芯片、细胞筛选系统与控制方法
- 用于对特异性细胞进行筛选的微流控芯片及细胞筛选方法
