ERβ1双荧光素酶报告基因检测系统及应用
文献发布时间:2023-06-19 09:55:50
技术领域
本发明涉及生物工程技术领域,特别涉及建立一种雌激素受体ERβ1介导的双荧光素酶报告基因检测细胞模型并筛选大血藤提取物中的激动剂。
背景技术
雌激素受体(estrogen receptor,ER)是核受体超家族中的一员。ER主要有两种亚型,ERα和ERβ。虽然ERα和ERβ具有相同的配体结合域、DNA结合域和两个激活功能域,但是它们却呈现不同的组织分布和生物学功能,且往往相反。ERα主要存在于乳腺、子宫、卵巢(卵泡膜细胞)、骨骼、男性生殖器官(睾丸和附睾)、前列腺(间质)、肝脏和脂肪组织。ERβ主要存在于前列腺(上皮)、膀胱、卵巢(颗粒细胞)、结肠、脂肪组织和免疫系统。这两种亚型在心血管和中枢神经系统都有明显的表达,对卵巢发育和功能,以及心血管系统的保护有一些共同的生理作用。但是,ERα在乳腺和子宫以及维持骨骼内环境平衡和调节新陈代谢方面的作用更为突出。ERβ对中枢神经和免疫系统有着更深远的影响。通常,ERβ还可以抑制ERα促进的乳腺和子宫等组织细胞过度增殖。由于雌二醇和激素替代疗法同时靶向ERα和ERβ,通常会增加乳腺癌和子宫内膜癌以及血栓栓塞的风险。另外,同时靶向ERα和ERβ的选择性雌激素受体调节剂虽然具有组织选择性激动剂/拮抗剂活性,但是不同于ER亚型选择性结合或激活的机制。一个理想的选择性雌激素受体调节剂应该在乳腺和子宫中具有拮抗活性,在其他靶组织如心血管、骨骼和中枢神经系统中具有激动剂活性,受益于雌激素样作用。因此,根据上述两种ER亚型在不同靶组织中的不同分布和相对水平,亚型选择性配体可用于激发有益的雌激素样活性并减少副作用。在这方面,ERβ选择性调节剂的应用显得尤为重要。
ERβ调节人体多种生理功能,具有不同异构体。通过分子模拟,已经确定只有ERβ1具有全长螺旋11和螺旋12,其呈激动剂导向位置。在ERβ2中,C端缩短导致螺旋12方向紊乱,明显减小辅助激活结合间隙。ERβ4和ERβ5完全缺乏螺旋12。研究进一步证明,ERβ1是唯一功能齐全的亚型。然而,ERβ2、ERβ4和ERβ5不能形成同型二聚体,也没有自身固有的活性,只能与ERβ1形成异二聚,并以配体依赖的方式增强其反式激活。总的来说,ERβ1是ERβ二聚体形成所必需的,而其他异构体可以作为具有增强子活性的可变二聚体之一。迄今为止,有关人类ERβ功能和信号转导的已发表数据均来自于对ERβ1的研究。只有全面了解ERβ1的功能独特性,才能完整了解ERβ信号转导的生物学意义,为ERβ治疗方法提供认可的方向。另外,ERβ1在雌激素的刺激下容易与其它异构体形成异二聚体,但是,植物雌激素则不能刺激其形成异二聚体。因此,体外筛选植物雌激素样成分要基于ERβ1介导的信号通路。
发明内容
本发明的目的之一在于提供一种ERβ1介导双荧光素酶报告基因检测系统,以解决现有技术中存在的基于报告基因的雌激素受体ERβ1激动剂细胞筛选模型缺乏的问题,筛选出有效抑制肿瘤细胞生长或者促进细胞凋亡的中药药物成分。
本发明的目的之二在于提供一种雌激素受体ERβ1介导双荧光素酶报告基因检测细胞模型。
本发明的目的之三在于提供建立所述雌激素受体ERβ1介导双荧光素酶报告基因检测细胞模型的方法。
本发明的目的之四在于提供所述雌激素受体ERβ1介导的双荧光素酶报告基因检测细胞模型的在筛选中草药提取物中与ERβ1结合的成分的应用。
本发明的目的之五在于提供大血藤提取物在制备雌激素受体ERβ1激动剂中的应用。
为实现上述目的之一,本发明采取的技术方案如下:
ERβ1介导双荧光素酶报告基因检测系统,包括如序列1所示ERβ1编码序列克隆到空载体pcDNA3.1(+)的多克隆位点上,构建出的pcDNA3.1(+)-ERβ1表达载体;以及如序列2所示ERβ1雌激素反应元件5×ERE碱基序列克隆到空载体pGL3-Enhancer的多克隆位点上,构建出的pGL3-enhancer-5×ERE荧光素酶报告载体。
为实现上述目的之二,本发明采取的技术方案如下:
一种雌激素受体ERβ1介导双荧光素酶报告基因检测细胞模型,将上述ERβ1介导双荧光素酶报告基因检测系统共同转染至293T细胞中,通过检测不同药物对ERβ1编码序列转录活性的影响,来筛选出与ERβ1结合的成分。
为实现上述目的之三、四和五,本发明采取的技术方案如下:
建立上述细胞模型,并应用于筛选中草药提取物中与ERβ1结合的成分的方法:
步骤1.获取目的片段:
ERβ1编码序列如序列1所示,长度1593bp,化学合成两端添加酶切位点的ERβ1编码序列。
5×ERE基因序列如序列2所示,长度75bp,化学合成两端添加酶切位点的5×ERE基因序列。
步骤2.构建pcDNA3.1(+)-ERβ1表达载体:
将化学合成的ERβ1编码序列与pcDNA3.1(+)分别进行双酶切后,经过连接、转化、提取步骤得到重组质粒后,通过测序确定pcDNA3.1(+)-ERβ表达载体构建正确。
步骤3.构建pGL3-Enhancer-5×ERE荧光素酶报告载体:
将化学合成的5×ERE基因序列和pGL3-Enhancer分别进行双酶切后,经过连接、转化、培养,得到pGL3-enhancer-5×ERE重组克隆后,测序鉴定。将测序正确的菌液提取质粒。
步骤4.293T细胞培养与转染:
从液氮罐中取出293T细胞,37℃水浴锅中迅速融化,并将细胞接种至100mm培养皿,置于5%CO
步骤5.药物筛选的应用
对中草药进行提取,溶解各提取成分配制浓储液,将各浓储液分别作用于共转染293T细胞,用于双荧光素酶检测。
利用上述雌激素受体ERβ1介导的双荧光素酶报告基因检测细胞模型或根据上述方法建立所述雌激素受体ERβ1介导的双荧光素酶报告基因检测细胞模型在筛选中草药提取物中与ERβ1结合的成分应用。
具体地,所述中草药包括大血藤、车前草、当归、连翘、茯苓等。
根据本发明的一些实施例,对大血藤干燥藤茎进行提取,滤液低温减压浓缩,真空干燥后,制备成干粉。使用DMSO溶解各大血藤提取相,配制浓储液。以不经成分或药物处理的共转染细胞为对照组,将各浓储液分别作用于共转染293T细胞,用于双荧光素酶检测。
根据本发明的一些实施例,大血藤正丁醇精提相、大血藤乙酸乙酯提取相、或大血藤75%乙醇水相中的任意一种用于制备雌激素受体ERβ1激动剂。
本发明提供的技术方案带来的有益效果至少包括:
(1)本发明提供的ERβ1介导双荧光素酶报告基因的重组表达载体系统、雌激素受体ERβ1介导的双荧光素酶报告基因检测细胞模型及其建立方法,不仅可以从大血藤提取物中筛选出与ERβ1结合的成分,确定其激动作用,鉴定激动剂,同时也适用于其他中草药的未知成分筛选。
(2)利用本发明所述的雌激素受体ERβ1介导的双荧光素酶报告基因检测细胞模型,可以进行药物治疗机制研究,也可以用于药物的进一步成分提取和优化。
(3)本发明从大血藤提取物中鉴定出的激动剂可以在细胞水平探究ERβ1介导的雌激素转录调控机制及对细胞生物学功能的影响,也可以进行动物实验探究药物作用和治疗效果。
附图说明
为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
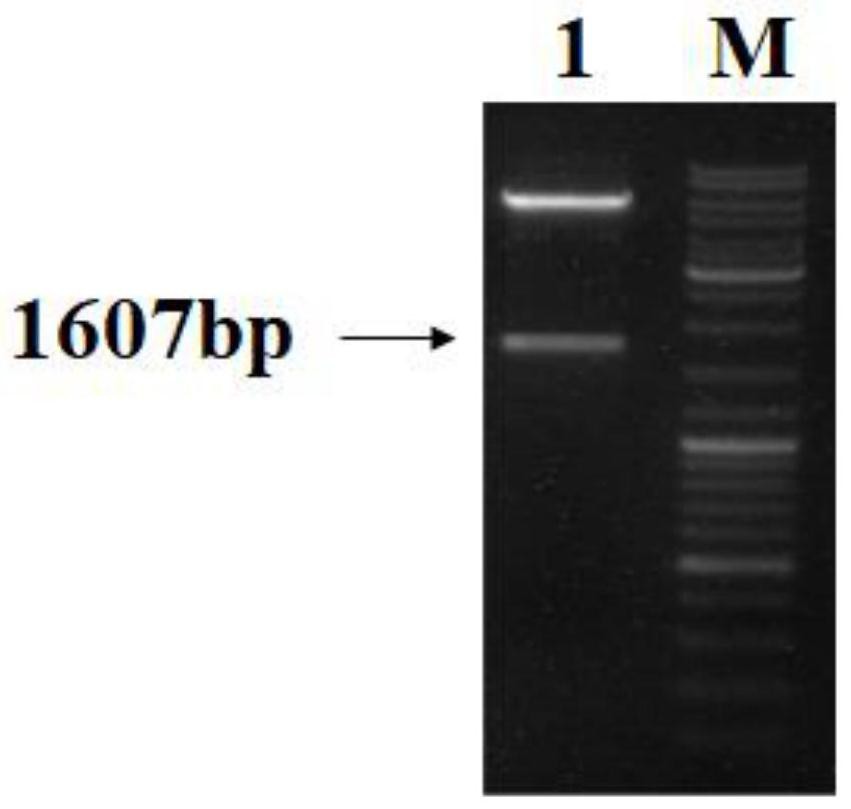
图1是本发明实施例1提供的ERβ1双酶切后电泳图,图中,M表示DNA LadderMarker,1表示ERβ1酶切产物电泳。
图2是本发明实施例1提供的重组克隆pcDNA3.1(+)-ERβ1质粒的测序结果。
图3是本发明实施例1提供的5xERE酶切产物电泳图,图中,M表示DL5000Marker,1表示酶切产物电泳。
图4是本发明实施例1提供的重组克隆pGL3-enhancer-5×ERE菌液测序结果。
图5是本发明实施例2提供的共转染前后的细胞培养图,图中,A代表细胞转染前,B代表细胞转染后。
图6是本发明实施例3提供的筛选大血藤不同提取物中的ERβ1激动剂所得到的相对荧光素酶比值的对比。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明实施方式作进一步地详细描述。
实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购途径获得的常规产品。实验材料和仪器包括:
1.序列1和序列2由上海生工生物工程股份有限公司合成。
2.质粒pcDNA3.1(+)和pGL3-enhancer购自美国Clonetech公司。
3.质粒小提试剂盒(OMEGA D6943-02美国)
4.胶回收试剂盒(Axygen AP-GX-250美国)
5.DH5α感受态细胞(全式金CD201中国北京)
6.工具酶BamHI、MluI和XhoI购自Thermo公司。
7.二氧化碳培养箱(Heal force HF-90中国)
8.倒置显微镜(Leica DMi8德国)
9.双荧光素酶检测试剂盒(Promega E1910美国)
10.GeneRuler DNA Ladder Mix(Thermo SM0331美国)
【实施例1】pcDNA3.1(+)-ERβ1表达载体和pGL3-enhancer-5×ERE荧光素酶报告载体的构建
(1)获取目的片段
从NCBI数据库中检索ERβ1编码基因转录本NM_001437.3,其编码序列为430..2022,共1593bp,如序列1所示。在其5'端添加NotI酶切位点gcggccgc,3'端添加XhoI酶切位点ctcgag,进行化学合成。
(2)将pcDNA3.1(+)表达质粒载体和目的基因片段ERβ1使用XhoI和BamHI分别进行酶切。
酶切体系具体为:
37℃酶切1.5h后,1%琼脂糖凝胶电泳分离酶切片段,切胶回收pcDNA3.1(+)表达质粒载体酶切产物片段和ERβ1酶切产物片段。如图1所示,为ERβ1酶切电泳图,从图中可以看出,ERβ1经过XhoI和BamHI双酶切后得到两条清晰的条带,其中指示大小为1607bp的条带是酶切后需要回收的条带。
(3)使用T4 DNA ligase将切胶回收后的pcDNA3.1(+)表达质粒载体酶切产物片段和ERβ1酶切产物片段进行连接,记为“pcDNA3.1(+)-ERβ1”。
连接体系具体为:
(4)将10μL连接产物转化至DH5α感受态细胞,涂布于含氨苄抗性的LB平板上,37℃培养过夜至长出单菌落。次日,挑取单菌落摇菌培养,抽提pcDNA3.1(+)-ERβ1质粒并送测序。如图2所示,为重组克隆pcDNA3.1(+)-ERβ1质粒的测序结果。
本实施例中,将5×ERE基因序列构建到pGL3-Enhancer荧光素酶报告载体。
(1)获取目的片段
典型的ERE为回文结构元件,根据序列2化学合成5×ERE。在合成的5xERE基因的5'端添加MluI酶切位点,3'端添加XhoI酶切位点。
(2)针对5×ERE基因序列设计并合成oligo引物5xERE-MluI-F和5xERE-XhoI-R,其中5xERE-MluI-F如序列3所示,5xERE-XhoI-R如序列4所示。
(3)将合成好的oligo用ddH
(4)将5xERE基因PCR产物和pGL3-Enhancer荧光素酶报告系统载体用XhoI和MluI分别进行酶切,酶切体系具体为:
37℃酶切1h后,1%琼脂糖凝胶电泳分离酶切片段,切胶回收5xERE酶切产物片段。如图3所示,为5xERE酶切产物电泳图,从图中可以明显看出,5xERE酶切产物为一条清晰的条带,大小为75bp,与预期大小一致。
(5)使用T4 DNA ligase连接上述酶切后的5xERE产物及pGL3-Enhancer双荧光素酶载体,记为“pGL3-enhancer-5×ERE”。连接体系具体为:
将10μL连接产物转化DH5α感受态细胞,涂布于含氨苄抗性的LB平板,37℃培养过夜。次日摇菌培养并送测序鉴定。如图4所示,为重组克隆pGL3-enhancer-5×ERE菌液的测序结果。最后,将测序正确的菌液抽提质粒。
【实施例2】细胞培养和转染
(1)细胞复苏
从液氮罐中取出293T细胞,37℃水浴锅中迅速融化,并将细胞接种至100mm培养皿,置于5%CO
(2)细胞传代和接种
待细胞生长至80-90%融合度时,利用胰蛋白酶消化293T细胞,以5×10
(3)细胞转染
次日,从细胞中移除培养基,换上新鲜的不含抗生素和血清的基本培养基,37℃孵育。
以pRL报告基因质粒作为内参,配制共转染试剂混合物:A管取质粒总量0.5μg,其中pcDNA3.1-ERβ1质粒:pGL3-enhancer-5×ERE质粒:pRL质粒的质量比为5:5:1,将上述质粒与50μL基本培养基混匀。B管中将POLO3000转染试剂与50μL基本培养基混匀。室温静置5min后,将B管溶液加入A组管中,混匀,室温孵育20min。
取上述转染混合物分别均匀滴加到培养板的细胞中,轻轻摇匀细胞培养板,37℃培养箱中孵育。转染6h后,换上新鲜的完全培养基并加入大血藤提取相进行处理,放回培养箱继续培养。转染48h后,倒置显微镜观察细胞,拍照记录。如图5所示,为共转染前后的细胞照片,从图中可以明显看出,以5×10
【实施例3】药物筛选的应用
以大血藤提取相处理上述共转染细胞。对大血藤干燥藤茎进行提取,滤液低温减压浓缩,真空干燥后,制备成干粉。使用DMSO溶解大血藤的各提取相,由于不同成分的作用浓度不同,因此配制得到不同浓度的浓储液,详见表1。以未经成分或药物处理的共转染细胞为对照组,以10
表1
荧光检测的具体具体步骤为:
将上述24孔板中培养基弃掉,使用PBS对24孔板清洗3遍;再对24孔板中每孔加入100μL 1X裂解液,冰上裂解20min后对孔板内的裂解液进行收集;其中,1X裂解液为双荧光素酶检测试剂盒中的试剂。
按照双荧光素酶检测试剂盒说明,用双荧光素酶报告基因检测系统分别测定细胞中的萤火虫荧光素酶和海肾荧光素酶(内参)活性。计算出每组萤火虫荧光素酶荧光值与海肾荧光素酶荧光值的比值,再以对照组的比值为单位1,即可得到不同处理组的相对荧光素酶活性,进而获知该处理组基因转录的调控活性。
具体的相对荧光素酶活性对比如附图6所示,其中以未经大血藤提取相成分或药物处理的共转染细胞为对照组。从图6中可以看出,激动剂β-雌二醇处理组的荧光值显著增强;抑制剂三苯氧氨处理组的荧光值显著减弱;而大血藤正丁醇精提相、乙酸乙酯提取相、75%乙醇水相处理组的荧光值显著增强。上述结果表明,大血藤正丁醇精提相、乙酸乙酯提取相、75%乙醇水相为ERβ1激动剂。
本发明根据体内的雌激素信号转导原理,将体外构建的受体ERβ1表达载体和5×ERE报告基因载体共转染至293T细胞中,建立雌激素受体ERβ1介导的双荧光素酶报告基因检测细胞模型。大血藤提取相作用于细胞模型,提取相与293T细胞内过表达的雌激素受体ERβ1结合,激活雌激素受体反应元件ERE,并启动荧光素酶表达。通过检测荧光素酶活性可以灵敏地反应大血藤提取相对雌激素受体的作用效果,最终筛选出大血藤中对ERβ1有作用的提取相,并鉴定激动剂。
此外,还可以使用其他中草药的提取相作用于所述细胞模型,筛选出能与ERβ1结合,并激活双荧光素酶的中草药成分。采用模型筛选出的激活成分可以用于药物治疗机制研究,也便于进一步提取和优化中草药功能成分。
本申请所述化学合成基因片段、大血藤各相提取的操作均为本领域常规操作,在此不做赘述。
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
序列表
<110> 夏瑶宾
<120> ERβ1双荧光素酶报告基因检测系统及应用
<160> 4
<170> SIPOSequenceListing 1.0
<210> 1
<211> 1593
<212> DNA
<213> 人工合成()
<400> 1
atggatataa aaaactcacc atctagcctt aattctcctt cctcctacaa ctgcagtcaa 60
tccatcttac ccctggagca cggctccata tacatacctt cctcctatgt agacagccac 120
catgaatatc cagccatgac attctatagc cctgctgtga tgaattacag cattcccagc 180
aatgtcacta acttggaagg tgggcctggt cggcagacca caagcccaaa tgtgttgtgg 240
ccaacacctg ggcacctttc tcctttagtg gtccatcgcc agttatcaca tctgtatgcg 300
gaacctcaaa agagtccctg gtgtgaagca agatcgctag aacacacctt acctgtaaac 360
agagagacac tgaaaaggaa ggttagtggg aaccgttgcg ccagccctgt tactggtcca 420
ggttcaaaga gggatgctca cttctgcgct gtctgcagcg attacgcatc gggatatcac 480
tatggagtct ggtcgtgtga aggatgtaag gcctttttta aaagaagcat tcaaggacat 540
aatgattata tttgtccagc tacaaatcag tgtacaatcg ataaaaaccg gcgcaagagc 600
tgccaggcct gccgacttcg gaagtgttac gaagtgggaa tggtgaagtg tggctcccgg 660
agagagagat gtgggtaccg ccttgtgcgg agacagagaa gtgccgacga gcagctgcac 720
tgtgccggca aggccaagag aagtggcggc cacgcgcccc gagtgcggga gctgctgctg 780
gacgccctga gccccgagca gctagtgctc accctcctgg aggctgagcc gccccatgtg 840
ctgatcagcc gccccagtgc gcccttcacc gaggcctcca tgatgatgtc cctgaccaag 900
ttggccgaca aggagttggt acacatgatc agctgggcca agaagattcc cggctttgtg 960
gagctcagcc tgttcgacca agtgcggctc ttggagagct gttggatgga ggtgttaatg 1020
atggggctga tgtggcgctc aattgaccac cccggcaagc tcatctttgc tccagatctt 1080
gttctggaca gggatgaggg gaaatgcgta gaaggaattc tggaaatctt tgacatgctc 1140
ctggcaacta cttcaaggtt tcgagagtta aaactccaac acaaagaata tctctgtgtc 1200
aaggccatga tcctgctcaa ttccagtatg taccctctgg tcacagcgac ccaggatgct 1260
gacagcagcc ggaagctggc tcacttgctg aacgccgtga ccgatgcttt ggtttgggtg 1320
attgccaaga gcggcatctc ctcccagcag caatccatgc gcctggctaa cctcctgatg 1380
ctcctgtccc acgtcaggca tgcgagtaac aagggcatgg aacatctgct caacatgaag 1440
tgcaaaaatg tggtcccagt gtatgacctg ctgctggaga tgctgaatgc ccacgtgctt 1500
cgcgggtgca agtcctccat cacggggtcc gagtgcagcc cggcagagga cagtaaaagc 1560
aaagagggct cccagaaccc acagtctcag tga 1593
<210> 2
<211> 75
<212> DNA
<213> 人工合成()
<400> 2
aggtcagagt gacctaggtc agagtgacct aggtcagagt gacctaggtc agagtgacct 60
aggtcagagt gacct 75
<210> 3
<211> 85
<212> DNA
<213> 人工合成()
<400> 3
acttaacgcg taggtcagag tgacctaggt cagagtgacc taggtcagag tgacctaggc 60
agagtgacct aggtcagagt gacct 85
<210> 4
<211> 85
<212> DNA
<213> 人工合成()
<400> 4
tcagctcgag aggtcactct gacctaggtc actctgacct aggtcactct gacctaggtc 60
actctgacct aggtcactct gacct 85
- ERβ介导双荧光素酶报告基因检测系统及在药物筛选的应用
- ERβ1双荧光素酶报告基因检测系统及应用
