用于可持续产生氢气的连续方法
文献发布时间:2023-06-19 10:00:31
本发明涉及一种产生氢气的方法。在本发明的特定实施例中,所述方法可以是可持续循环过程。本发明还扩展到一种用于产生氢气的设备。
氢气是重要的能源载体并且具有替代烃类燃料以实现可持续发展的潜力。当前与烃燃料相关的能源问题,例如空气污染、气候变化和资源稀缺是探索氢气的重要动力。作为替代性燃料源,氢气具有所有燃料的最高的比能含量,并且可以用于具有有限的净大气排放或无净大气排放的燃料电池中的清洁发电,并且便于有效的能量储存。氢气可以直接用作产生更高能量效率的运输燃料,其作为技术和政治问题正受到非常有利的关注。
当前,存在若干种氢气产生的工业方法,并且这些方法是重整、光转化和电解,其已经获得突出的关注。已经讨论了所述方法的优缺点。水电解提供了用于氢气产生的最清洁的解决方案。所述水电解的优点是:(i)其产生零碳排放;(ii)其产生纯氢气,这影响燃料电池技术,所述燃料电池技术受到氢气进料中杂质的严重影响;(iii)其独立于烃资源;(iv)其可以在小型工厂中操作;以及(v)可再生能源(如光伏太阳能、风能、水力发电等)可以容易地与水电解池(water electrolysis cell)相关联以产生氢气。
水分解的电解过程在技术上是简单的,并且存在涉及水电解过程的许多技术,如碱性电解、聚合物电解质膜(PEM)和固体氧化物电解池(SOEC)。涉及电解过程的日益增长的问题是高能量需求、安装成本以及低安全性、耐久性和能量效率。一些电解槽,尤其是PEM对水的纯度是高度敏感的,在电解之前必须应用另外的水处理。因此,大量的研究努力致力于改善操作条件,包含电极和电解质的电化学活性方面,以及降低电解池的总电阻。
本发明源于发明人尝试克服与现有技术相关联的问题的工作。
根据本发明的第一方面,提供了一种产生氢气的方法,所述方法包括:
-通过使金属或其合金与蒸汽接触来进行热化学反应,以产生金属氧化物和/或金属氢氧化物和氢气;
-使在所述热化学反应中产生的所述金属氧化物和/或所述金属氢氧化物与水或碱性水溶液接触,以产生包括金属离子的溶液;以及
-通过在阳极和阴极两端施加电压来进行电化学反应,由此所述阴极的至少一部分接触包括所述金属离子的所述溶液,以产生氢气、氧气和所述金属或所述其合金。
有利地,热化学反应和电化学反应两者均产生氢气。
可以理解,电化学反应可以在热化学反应之前进行。
因此,根据第二方面,提供了一种产生氢气的方法,所述方法包括:
-使金属氧化物和/或金属氢氧化物与水或碱性水溶液接触,以产生包括金属离子的溶液;
-通过在阳极和阴极两端施加电压来进行电化学反应,由此所述阴极的至少一部分接触包括所述金属离子的所述溶液,以产生氢气、氧气和金属或其合金;以及
-通过使在所述电化学反应中产生的所述金属或所述其合金与蒸汽接触来进行热化学反应,以产生所述金属氧化物和/或所述金属氢氧化物和氢气。
所述电化学反应可以是连续或重复进行的。所述热化学反应可以是连续或重复进行的。使金属氧化物和/或金属氢氧化物与水或碱性水溶液接触以产生包括金属离子的溶液可以是连续或重复进行的。
在优选的实施例中,电化学反应是连续进行的。因此,可以在进行电化学反应时收集在电化学反应中产生的金属或其合金。热化学反应优选地是连续进行的。因此,从电化学反应收集的金属或其合金可以在进行热化学反应时被进料到热化学反应中。此外,可以在进行热化学反应时收集在热化学反应中产生的金属氧化物和/或金属氢氧化物。
可以使从热化学反应收集的金属氧化物和/或金属氢氧化物与水或碱性水溶液接触,以产生包括金属离子的溶液。可以在进行电化学反应时将包括金属离子的溶液进料到包括阴极的电化学电池中。可替代地,可以在进行电化学反应时将从热化学反应收集的金属氧化物和/或金属氢氧化物进料到包括阴极的电化学电池中。因此,金属氧化物和/或金属氢氧化物将增加在包括金属离子的溶液中的金属离子的浓度。
在优选的实施例中,重复第一和第二方面的方法。有利地,可以在不需要提供任何另外的金属、其合金、金属氧化物或金属氢氧化物的情况下产生另外的氢气。
因此,通过举例的方式,所述方法可以包括:
-通过使金属或其合金与蒸汽接触来进行第一热化学反应,以产生金属氧化物和/或金属氢氧化物和氢气;
-使在所述第一热化学反应中产生的所述金属氧化物和/或所述金属氢氧化物与水或碱性水溶液接触,以产生包括金属离子的溶液;
-通过在阳极和阴极两端施加电压来进行第一电化学反应,由此所述阴极的至少一部分接触包括所述金属离子的所述溶液,以产生氢气、氧气和所述金属或所述其合金;
-通过使在所述第一电化学反应中产生的所述金属或所述其合金与蒸汽接触来进行第二热化学反应,以产生所述金属氧化物和/或所述金属氢氧化物和氢气;
-使在所述第二热化学反应中产生的所述金属氧化物和/或所述金属氢氧化物与水或碱性水溶液接触,以产生包括金属离子的溶液;以及
-通过在阳极和阴极两端施加电压来进行第二电化学反应,由此所述阴极的至少一部分接触包括所述金属离子的所述溶液,以产生氢气、氧气和所述金属或所述其合金。
可以理解,第二方面的方法可以类似地重复。
优选地,第一方面和第二方面的方法重复多次。
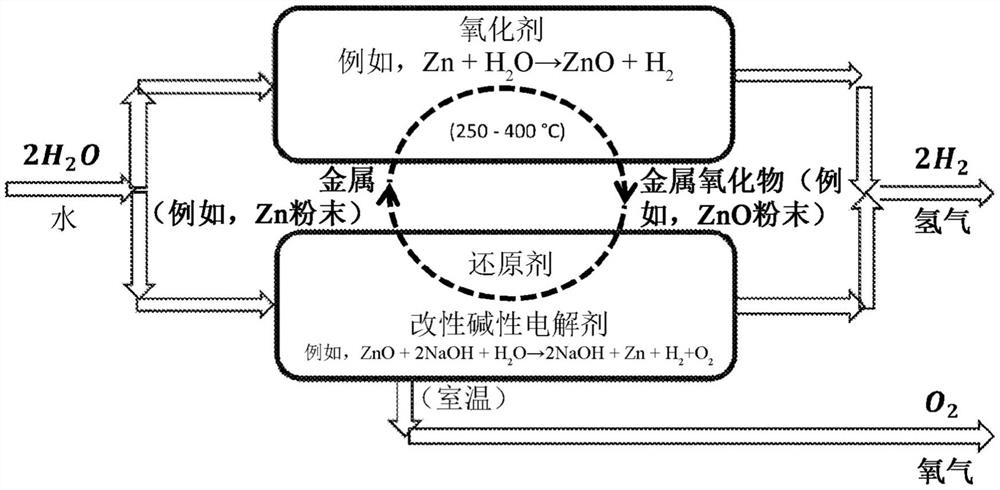
因此,第一和第二方面的方法可以包括重复多次的不连续步骤,或并行进行的连续反应。无论哪种方式,产生氢气的方法可以被视为热化学/电化学循环。如图14所示,连续产生氢气所需的唯一原料是水。因此,一旦已经供应了初始量的金属、其合金、金属氧化物和/或金属氢氧化物,就可以在热化学/电化学循环中连续地对其进行再循环。因此,将不需要另外的金属/金属氧化物/金属氢氧化物。类似地,在使用碱溶液的实施例中,其可以通过添加水并使其与在热化学反应中产生的金属氧化物和/或金属氢氧化物接触来补充。然而,不需要另外的碱。
金属或其合金可以是s嵌段金属、p嵌段金属、过渡金属(即,d嵌段金属)、f嵌段金属或其合金。优选地,金属或其合金是过渡金属、p嵌段金属或其合金。s嵌段金属或其合金可以是碱土金属或其合金。碱土金属或其合金可以选自由以下组成的组:铍、镁、钙、锶和钡。p嵌段金属或其合金可以选自由以下组成的组:锡、铅、铊、硒和铋。优选地,p嵌段金属是铅或锡。在最优选的实施例中,p嵌段金属或其合金是锡。过渡金属或其合金可以选自由以下组成的组:锌、铜、铁、镍、钴、锰、钛、钼、镉、铬、钒、银、铑、铂、钯、铱、锇、铼、钌、镧和锆。优选地,过渡金属或其合金选自由以下组成的组:锌、铜、铁、镍、钴、锰、铬和钒。更优选地,过渡金属或其合金选自由以下组成的组:锌、铁、镍、铬和钒。在最优选的实施例中,过渡金属或其合金是锌。f嵌段金属或其合金可以选自由以下组成的组:铈、钆、钇、钬、钐和铽。
可以理解,金属氧化物和/或金属氢氧化物可以是以上列出的金属之一的氧化物和/或氢氧化物。例如,如果金属是过渡金属或其合金,则金属氧化物和/或金属氢氧化物可以是过渡金属氧化物和/或过渡金属氢氧化物。类似地,过渡金属氧化物和/或过渡金属氢氧化物可以选自由以下组成的组:氧化锌(例如,ZnO)、氢氧化锌、氧化铜、氢氧化铜、氧化铁、氢氧化铁、氧化镍、氢氧化镍、氧化钴、氢氧化钴、氧化锰、氢氧化锰、氧化钛、氢氧化钛、氧化钼、氢氧化钼、氧化镉、氢氧化镉、氧化铬、氢氧化铬、氧化钒、氢氧化钒、氧化银、氢氧化银、氧化铑、氢氧化铑、氧化铂、氢氧化铂、氧化钯、氢氧化钯、氧化铱、氢氧化铱、氧化锇、氢氧化锇、氧化铼、氢氧化铼、氧化钌、氢氧化钌、氧化镧、氢氧化镧、氧化锆和氢氧化锆。
可替代地,如果金属是p嵌段金属或其合金,则金属氧化物和/或金属氢氧化物可以是p嵌段金属氧化物和/或p嵌段金属氢氧化物。类似地,p嵌段金属氧化物和/或p嵌段金属氢氧化物可以选自由以下组成的组:氧化锡(例如,二氧化锡(SnO
进一步可替代地,如果金属是f嵌段金属或其合金,则金属氧化物和/或金属氢氧化物可以是f嵌段金属氧化物和/或f嵌段金属氢氧化物。类似地,f嵌段金属氧化物和/或f嵌段金属氢氧化物可以选自由以下组成的组:氧化铈、氢氧化铈、氧化钆、氢氧化钆、氧化钇、氢氧化钇、氧化钬、氢氧化钬、氧化钐、氢氧化钐、氧化铽和氢氧化铽。
在其中金属氧化物和/或金属氢氧化物包括阴离子(例如,锡酸根)的实施例中,阴离子可以提供有抗衡离子。抗衡离子可以是碱金属离子或碱土金属离子,例如抗衡离子可以是锂离子、钠离子、钾离子、铷离子、铍离子、镁离子、钙离子或锶离子。在一些实施例中,离子是钠离子。因此,金属氧化物和/或金属氢氧化物可以是锡酸钠(Na
可以使金属或其合金与蒸汽接触,其中蒸汽以至少0.01标准立方米每小时的速率流过氢气,更优选地其中蒸汽以至少0.05、至少0.1、至少0.15、至少0.2或至少0.25标准立方米每小时的速率流过氢气并且最优选地其中蒸汽以至少0.3或至少0.31标准立方米每小时的速率流过氢气。可以使金属或其合金与蒸汽接触,其中蒸汽以小于5标准立方米每小时的速率流过氢气,更优选地其中蒸汽以小于2、小于1.75、小于1.5、小于1.25或小于1标准立方米每小时的速率流过氢气并且最优选其中蒸汽以小于0.8或小于0.78标准立方米每小时的速率流过氢气。可以使金属或其合金与蒸汽接触,其中蒸汽以介于0.01与5标准立方米每小时之间的速率流过氢气,更优选地其中蒸汽以介于0.05与2标准立方米每小时之间、介于0.1与1.75标准立方米每小时之间、介于0.15与1.5标准立方米每小时之间、介于0.2与1.25标准立方米每小时之间或介于0.25与1标准立方米每小时之间的速率流过氢气并且最优选地其中蒸汽以介于0.3与0.8标准立方米每小时之间或介于0.31与0,78标准立方米每小时之间的速率流过氢气。
优选地,使金属或其合金与蒸汽在至少100℃的温度下,更优选地在至少150℃、至少200℃或至少250℃的温度下并且最优选地在至少300℃或至少350℃的温度下接触。优选地,使金属或其合金与蒸汽在小于700℃的温度下,更优选地在小于650℃、小于600℃或小于550℃的温度下并且最优选地在小于500℃或小于450℃的温度下接触。优选地,使金属或其合金与蒸汽在介于100℃与700℃之间的温度下,更优选地在介于150℃与650℃之间、介于200℃与600℃之间或介于250℃与550℃之间的温度下并且最优选在介于300℃与500℃之间或介于350℃与450℃之间的温度下接触。有利地,在更高的温度下,氢气更快地产生。
优选地,使金属或其合金与蒸汽在至少10kPa的压力下,更优选地在至少50kPa、至少75kPa或至少100kPa的温度下并且最优选地在至少500kPa、至少1,000kPa或至少20,000kPa的温度下接触。优选地,使金属或其合金与蒸汽在小于500,000kPa的压力下,更优选地在小于300,000kPa、小于200,000kPa或小于100,000kPa的压力下并且最优选地在小于50,000kPa、小于40,000kPa或小于30,000KPa的温度下接触。优选地,使金属或其合金与蒸汽在介于10与500,000kPa之间的压力下,更优选地在介于50与300,000kPa之间、介于75与200,000kPa之间或介于100与100,000kPa之间的压力下并且最优选地在介于500与50,000kPa之间、介于1,000与40,000kPa之间或介于2,000与30,000kPa之间的压力下接触。
金属或其合金可以包括粉末、团粒或薄片。
所述方法可以包括在使金属或其合金与蒸汽接触之前将金属或其合金放置在热化学反应器中。所述方法可以包括在进行热化学反应时将金属或其合金连续地进料到热化学反应器中。将金属或其合金连续地进料到热化学反应器中的方法对于技术人员来说将是已知的。例如,热化学反应器可以包括第一旋转阀,所述第一旋转阀被配置成将金属或其合金进料到热化学反应器中。第一旋转阀可以是机动旋转阀。
所述方法可以包括在热化学反应结束时从热化学反应器中去除金属氧化物和/或金属氢氧化物。可替代地,所述方法可以包括在进行热化学反应时从热化学反应器中去除金属氧化物和/或金属氢氧化物。连续去除金属氧化物和/或金属氢氧化物的方法对于技术人员来说将是已知的。例如,热化学反应器可以包括第二旋转阀,所述第二旋转阀被配置成从其中去除金属氧化物和/或金属氢氧化物。第二旋转阀可以是机动旋转阀。
所述方法可以包括在金属或其合金与蒸汽接触时搅动所述金属或所述其合金。因此,所述方法可以包括在自搅动热化学反应器中进行热化学反应。自搅动反应器可以是喷射床反应器、流化床反应器或气动输送床反应器。有利地,搅动金属或其合金增加了接触蒸汽的表面积并且提高了热化学反应的效率。
可以理解,在热化学反应中产生的氢气将存在于进v一步包括未反应的蒸汽的气态混合物中。因此,所述方法可以包括使来自气态混合物的未反应的蒸汽冷凝,所述气态混合物是从所述热化学反应获得的。有利地,如果在反应中不使用载气,则冷凝步骤将允许用户获得氢气。
在一些实施例中,用于接触金属或其合金的蒸汽可以与载气一起提供。载气可以是惰性气体,如氮气或氩气。因此,气态混合物可以进一步包括载气。因此,所述方法可以包括将氢气与惰性气体分离。所述方法可以包括使用变压吸收单元或低温系统,以将氢气与惰性气体分离。
所述方法可以包括:
-在第一容器中使金属氧化物和/或金属氢氧化物与水或碱性水溶液接触,以产生包括金属离子的溶液;以及
-将包括所述金属离子的所述溶液安置在包括阳极和阴极的电化学电池中,使得所述阴极的至少一部分接触包括所述金属离子的所述溶液,
其中所述第一容器与所述电化学电池分开。
可替代地,所述方法可以包括使热化学反应中产生的金属氧化物和/或金属氢氧化物与水或碱性水溶液接触,以在电化学电池中产生包括金属离子的溶液,使得阴极的至少一部分接触包括金属离子的所得溶液。
在一些实施例中,所述方法包括使金属氧化物与碱性水溶液接触。在一些实施例中,所述方法包括使金属氢氧化物与碱性水溶液接触。在一些实施例中,所述方法包括使金属氧化物与水接触。在一些实施例中,所述方法包括使金属氢氧化物与水接触。
可以理解,碱性水溶液包括碱。碱可以是有机碱或无机碱。碱可以是阿瑞尼斯碱(Arrhenius base)、路易斯碱(Lewis base)和/或布朗斯特-劳瑞碱(Bronsted-Lowrybase),更优选地强阿瑞尼斯碱碱和/或路易斯超强碱。阿瑞尼斯碱可以包括碱金属或碱土金属氢氧化物。阿瑞尼斯碱可以包括氢氧化钾、氢氧化钠、氢氧化钡、氢氧化铯、氢氧化锶、氢氧化钙、氢氧化锂和/或氢氧化铷。因此,碱性水溶液可以包括碱性水溶液(aqueousalkaline solution)。
路易斯碱可以包括氨(NH
布朗斯特-劳瑞碱可以包括氢氧化铵、脂肪族胺或芳香族胺。脂肪族胺可以包括甲胺、乙胺或二甲胺。芳香族胺可以包括苯胺、苯二胺或邻甲苯胺。
在优选的实施例中,碱性水溶液包括阿瑞尼斯碱。
碱性水溶液可以包括至少0.5M、至少1M或至少1.5M浓度的碱,更优选地至少2M、至少2.5M或至少3M浓度的碱并且最优选地至少3.5M或至少4M浓度的碱。碱性水溶液可以包括小于8.5M、小于8M或小于7.5M浓度的碱,更优选地小于7M、小于6.5M或小于6M浓度的碱并且最优选地小于5.5M或小于5M浓度的碱。碱性水溶液可以包括介于0.5与8.5M之间、介于1与8M之间或介于1.5与7.5M之间的浓度的碱,更优选地介于2与7M之间、介于2.5与6.5M之间或介于3与6M之间的浓度的碱并且最优选地介于3.5与5.5M之间或介于4与5M之间的浓度的碱。有利地,发明人已经发现包括约4.5M氢氧化钠的溶液表现出最大的电导率。
可以使金属氧化物和/或金属氢氧化物与足够量的水或碱性水溶液接触,以产生包括金属离子的溶液,其中所述金属离子以至少0.001M或至少0.005M,更优选地至少0.01M、至少0.02M或至少0.06M并且最优选地至少0.08M或至少0.1M的浓度存在。在一些实施例中,金属离子以至少0.2M或至少0.6M并且最优选地至少0.8M或至少1M的浓度存在。可以使金属氧化物和/或金属氢氧化物与足够量的水或碱性水溶液接触,以产生包括金属离子的溶液,其中所述金属离子以小于5M、小于4M、小于3M、小于2M、小于1.5M、小于1M或小于0.5M,更优选地小于0.3M、小于0.25M或小于0.2M并且最优选地小于0.17M或小于0.14M的浓度存在。可以使金属氧化物和/或金属氢氧化物与足够量的水或碱性水溶液接触,以产生包括金属离子的溶液,其中所述金属离子以介于0.001与5M之间或介于0.005与4M之间,更优选地介于0.02与3M之间、介于0.06与2M之间或介于0.1与1.5M之间的浓度存在。
在一个实施例中,使金属氧化物和/或金属氢氧化物与足够量的与水或碱性水溶液接触,以产生包括金属离子的溶液,其中所述金属离子以介于0.001与1M之间或介于0.005与0.5M之间,更优选地介于0.01与0.3M之间、介于0.02与0.25M之间或介于0.06与0.2M之间并且最优选地介于0.08与1.7M之间或介于0.1与0.14M之间的浓度存在。优选地,在此实施例中,使金属氧化物和/或金属氢氧化物与碱性水溶液接触。
在替代性实施例中,使金属氧化物和/或金属氢氧化物与足够量的水或碱性水溶液接触,以产生包括金属离子的溶液,其中所述金属离子以介于0.2与5M之间或介于0.4与4M之间,更优选地介于0.6与3M之间或介于1与1.5M之间的浓度存在。优选地,在此实施例中,使金属氧化物和/或金属氢氧化物与水接触。
阳极和阴极可以安置在电化学电池中。电化学电池可以是未分隔的电池。因此,在此实施例中,将包括金属离子的溶液安置在电化学电池中将使阳极的至少一部分与包括金属离子的溶液接触。在使金属氧化物和/或金属氢氧化物与水接触的实施例中,可以使用未分隔的电池。
在替代性实施例中,电化学电池包括分隔电池。因此,电池可以包括安置在阳极与阴极之间的将电池分成两个部分的膜。优选地,膜是阴离子交换膜,更优选地碱性阴离子交换膜(AAEM)。合适的AAEM对于技术人员来说将是已知的,但可以包含氯甲基化聚砜的聚合物阴离子交换基膜,或氯甲基苯乙烯和二乙烯苯(divinylvenzene)与聚乙烯织物的共聚物。在使金属氧化物和/或金属氢氧化物与碱性水溶液接触的实施例中,可以使用未分隔的电池。
在此实施例中,所述方法可以包括将包括金属离子的溶液安置在电池的阴极部分中,使得所述阴极的至少一部分接触包括金属合金的溶液。所述方法还可以包括将另外的电解质安置在电池的阳极部分中,使得所述阳极的至少一部分接触另外的电解质。另外的电解质优选地包括水溶液,并且更优选地碱性水溶液。碱性水溶液可以如上所定义。
可以理解,随着电化学反应的进行,水将反应产生氢气和氧气。因此,包括金属合金的溶液中的碱的浓度将增加。类似地,在其中电池包括分隔电池的实施例中,另外的电解质中的碱的浓度也将增加。
因此,所述方法可以包括使包括金属合金的溶液与足够量的水接触,以使包括金属合金的溶液具有期望浓度的碱。所述方法可以包括监测包括金属合金的溶液的pH,并且使包括金属合金的溶液与足够量的水接触,以使得包括金属合金的溶液在pH升高到高于预定最大值时具有期望的碱浓度。
在其中电池包括分隔电池的实施例中,所述方法可以包括使另外的电解质与足够量的水接触,以使得所述另外的电解质具有期望的碱浓度。所述方法可以包括监测另外的电解质的pH,并且使所述另外的电解质与足够量的水接触,以使得所述另外的电解质在pH升高到高于预定最大值时具有期望的碱浓度。
碱的期望浓度可以是碱的至少0.5M、至少1M或至少1.5M,更优选地碱的至少2M、至少2.5M或至少3M并且最优选地碱的至少3.5M或至少4M。碱的期望浓度可以是碱的小于8.5M、小于8M或小于7.5M,更优选地碱的小于7M、小于6.5M或小于6M并且最优选地碱的小于5.5M或小于5M。碱的期望浓度可以是碱的0.5和8.5M、介于1与8M之间或介于1.5与7.5M之间,更优选地碱的介于2与7M之间、介于2.5与6.5M之间或介于3与6M之间并且最优选地碱的介于3.5与5.5M之间或介于4与5M之间。
预定最大pH可以对应于至少8.5M、至少8M或至少7.5M的碱浓度,更优选地至少7M、至少6.5M或至少6M的碱浓度并且最优选地至少5.5M或至少5M的碱浓度。
所述方法可以包括在进行电化学反应时将包括金属离子的溶液连续地进料到电化学电池中。所述方法可以进一步包括在进行电化学反应时从所述电池中去除包括金属离子的溶液。有利地,这个步骤连续地更新包括金属离子的溶液。
在其中所述电池是分隔电池的实施例中,所述方法可以包括在进行电化学反应时将包括金属离子的溶液进料到电化学电池的阴极部分中。所述方法可以进一步包括在进行电化学反应时从所述电池的阴极部分去除包括金属离子的溶液。所述方法可以包括在进行电化学反应时将另外的电解质进料到电化学电池的阳极部分中和/或在进行电化学反应时从所述电池的阴极部分中去除另外的电解质。
阳极和阴极可以独立地包括碳基电极或金属基电极。碳基电极或每个碳基电极可以包括石墨。金属基电极或每个金属基电极可以包括铬、镍、锌、镉、铜、锡、铅、铑、铂、金、钯、铱、锇、铼、钌、锗、铍和/或银。可替代地,金属基电极或每个金属基电极可以包括合金,如黄铜、青铜或钢。钢可以是不锈钢。在优选的实施例中,电极包括石墨或钢。在替代性优选的实施例中,电极包括与金属或其合金相同的金属。例如,如果电化学反应产生锌,则电极可以包括锌。
所述方法可以包括在阳极和阴极两端施加至少1V、至少1.5V、至少1.75V或至少2V的电压,更优选地所述方法包括在阳极和阴极两端施加至少2.5V、至少3V或至少3.5V的电压并且最优选地所述方法包括在阳极和阴极两端施加至少4V或至少4.5V的电压。所述方法可以包括在阳极和阴极两端施加小于8V或小于7.5V的电压,更优选地所述方法包括在阳极和阴极两端施加小于7V、小于6.5V或小于6V的电压并且最优选地所述方法包括在阳极和阴极两端施加小于5.5V或小于5V的电压。在一些实施例中,所述方法包括施加小于4V、小于3V或小于2.5V的电压。所述方法可以包括在阳极和阴极两端施加介于1与8V之间或2与7.5V之间的电压。在一些实施例中,所述方法包括在阳极和阴极两端施加介于2.5与7V之间、介于3与6.5V之间或介于3.5与6V之间的电压并且最优选地所述方法包括在阳极和阴极两端施加介于4与5.5V之间或介于4.5与5V之间的电压。在替代性实施例中,所述方法包括在阳极和阴极两端施加介于1与4V之间、介于1.5与3V之间或介于1.75与2.5V之间的电压。
所述方法可以包括使至少0.5A、至少1A或至少1.5A的电流流过阳极、阴极和包括金属离子的溶液,更优选地使至少2A、至少2.5A或至少3A的电流流过阳极、阴极和包括金属离子的溶液并且最优选地使至少3.5A的电流流过阳极、阴极和包括金属离子的溶液。所述方法可以包括使小于10A、小于8A或小于6A的电流流过阳极、阴极和包括金属离子的溶液,更优选地使小于5.5A、小于5A或小于4.5A的电流流过阳极、阴极和包括金属离子的溶液并且最优选地使小于4A的电流流过阳极、阴极和包括金属离子的溶液。所述方法可以包括使介于0.5与10A之间、介于1与8A之间或介于1.5与6A之间的电流流过阳极、阴极和包括金属离子的溶液,更优选地使介于2与5.5A之间、介于2.5与5A之间或介于3与4.5A之间的电流流过阳极、阴极和包括金属离子的溶液并且最优选地使介于3.5与4A之间的电流流过阳极、阴极和包括金属离子的溶液。
优选地,电化学反应是在至少0℃的温度下,更优选地在至少10℃、至少12.5℃、至少15℃、至少17.5℃或至少20℃的温度下进行的。在一些实施例中,电化学反应是在至少25℃的温度下并且最优选地在至少30℃或至少55℃的温度下进行的。优选地,电化学反应是在小于95℃的温度下,更优选地在小于90℃、小于85℃或小于80℃的温度下并且最优选地在小于70℃或小于65℃的温度下进行的。在一些实施例中,电化学反应是在小于50℃、小于40℃、小于30℃或小于25℃的温度下进行的。优选地,电化学反应是在介于0℃与95℃之间的温度下,更优选地在介于10℃与90℃之间的温度下进行的。在一些实施例中,电化学反应是在介于20℃与85℃之间或介于25℃与80℃之间的温度下并且最优选地在介于30℃与70℃之间或介于55℃与65℃之间的温度下进行的。有利地,在更高的温度下,氢气更快地产生。在一些实施例中,电化学反应是在介于10℃与50℃之间、介于12.5与40℃之间、介于15℃与30℃之间或介于17.5℃与25℃之间的温度下进行的。
优选地,所述方法包括回收在电化学反应中产生的金属或其合金。回收在电化学反应中产生的金属或其合金可以包括从阴极去除在电化学反应中产生的金属或其合金。可以在电化学反应已经完成之后去除金属或其合金。可替代地,可以在进行电化学反应时连续地去除金属或其合金。例如,电化学电池可以包括叶片,所述叶片被配置成从阴极去除金属或其合金。叶片可以被配置成跨阴极移动,并且由此从阴极的表面去除金属或其合金。可以使用磁力或电动机来移动叶片。电化学电池可以包括收集器皿,所述收集器皿被配置成一旦金属或其合金已经从阴极去除就收容金属或其合金,并且将所述金属或其合金从电池去除。在其中电池是分隔电池的实施例中,收集器皿可以安置在电池的阴极部分中。收集器皿可以包括旋转阀,所述旋转阀被配置成一旦金属或其合金已经从阴极去除就收容金属或其合金,并且将所述金属或其合金从电池去除。旋转阀可以是机动的。
发明人相信,用于进行第一和第二方面的方法的设备本身是新颖的和创造性的。
因此,根据第三方面,提供了一种用于产生氢气的设备,所述设备包括:
-热化学反应器,所述热化学反应器被配置成在其中容纳金属或其合金,所述热化学反应器包括进料装置,所述进料装置被配置成将蒸汽进料到所述热化学反应器中,并且由此将所述金属或所述其合金转化成金属氧化物和/或金属氢氧化物;以及
-电化学电池,所述电化学电池包括阳极和阴极,并且被配置成收容包括金属离子的溶液,使得所述阴极的至少一部分接触包括所述金属离子的所述溶液。
优选地,所述设备被配置成当在所述热化学反应器中进行热化学反应时,防止所述金属、所述其合金或所述金属氧化物和/或所述金属氢氧化物从所述热化学反应器中逸出。因此,所述设备可以包括容器,所述容器被配置成将所述金属或所述其合金容纳在其中并且被放置在所述热化学反应器中。所述进料装置可以被配置成将蒸汽直接进料到容器中。所述容器可以包括网格,所述网格被配置成允许气体流出所述容器,同时被进一步配置成防止所述金属、所述其合金或所述金属氧化物和/或所述金属氢氧化物从所述容器中去除。所述网格的孔径可以介于0.1与1000μm之间,更优选地介于1与750μm之间、介于2与500μm之间或介于3与250μm之间并且最优选地介于5与100μm之间、介于10与50μm之间、介于15与40μm之间或介于20与30μm之间。所述网格可以夹置在两个或更多个另外的网格之间。所述另外的网格的孔径可以介于0.1与1000μm之间,更优选地介于10与900μm之间、介于25与850μm之间或介于50与800μm之间并且最优选地介于75与750μm之间、介于100与700μm之间、介于125与650μm之间或介于150与600μm之间。有利地,另外的网格确保所得网格结构具有足够的强度来容纳金属、其合金和/或金属氧化物和/或金属氢氧化物的重量。
所述设备可以包括搅动装置,所述搅动装置被配置成在热化学反应器中搅动金属或其合金。因此,热化学反应器可以包括自搅动热化学反应器。自搅动热化学反应器可以是喷射床反应器、流化床反应器或气动输送床反应器。
优选地,热化学反应器被配置成将金属或其合金容纳在至少100℃的温度下,更优选地在至少150℃、至少200℃或至少250℃的温度下并且最优选地在至少300℃或至少350℃的温度下。优选地,热化学反应器被配置成将金属或其合金容纳在小于700℃的温度下,更优选地在小于650℃、小于600℃或小于550℃的温度下并且最优选地在小于500℃或小于450℃的温度下。优选地,热化学反应器被配置成将金属或其合金容纳在介于100℃与700℃之间的温度下,更优选地在介于150℃与650℃之间、介于200℃与600℃之间或介于250℃与550℃之间的温度下并且最优选地在介于300℃与500℃之间或介于350℃与450℃之间的温度下。
能够将蒸汽进料到热化学反应器中的设备是技术人员众所周知的。例如,进料装置可以被配置成使安置在其中的水蒸发,并且由此形成蒸汽。因此,进料装置可以包括安置在热化学反应器中的盘绕区段。设备可以包括泵,所述泵被配置成将水或蒸汽,优选地水泵送到进料装置中。泵可以包括注射泵。
设备可以包括进料装置,所述进料装置被配置成将金属或其合金进料到热化学反应器中。进料装置可以包括第一旋转阀。第一旋转阀可以是机动旋转阀。
设备可以包括进料装置,所述进料装置被配置成将金属氧化物和/或金属氢氧化物从反应器中进料出来。进料装置可以包括第二旋转阀。第二旋转阀可以是机动旋转阀。
设备可以包括冷凝器,所述冷凝器被配置成从气态混合物中去除蒸汽。优选地,设备包括在热化学反应器与冷凝器之间延伸的导管。因此,冷凝器可以使未反应的蒸汽冷凝以获得氢气。
设备可以包括被配置成将氢气与载气分离的变压吸收单元或低温系统。
设备可以包括氢气收集器皿,所述氢气收集器皿被配置成收容在热化学反应器中产生的氢气。设备可以包括在冷凝器与氢气收集器皿之间延伸的导管。
电化学电池可以是未分隔的电池。
可替代地,电化学电池可以包括分隔电池。因此,电池可以包括安置在阳极与阴极之间的将电池分成两个部分的膜。优选地,膜是如关于第一和第二方面所定义的。
在此实施例中,电池的阴极部分可以被配置成收容包括金属离子的溶液,使得所述阴极的至少一部分接触包括金属离子的溶液。电池的阳极部分可以被配置成收容另外的电解质,使得所述阳极的至少一部分接触所述电解质。另外的电解质可以如关于第一和第二方面所定义的。
设备可以包括被配置成容纳包括金属离子的溶液的储液器。设备可以包括在储液器与电化学电池之间延伸的第一导管,以及被配置成使包括金属离子的溶液从储液器沿着第一导管流动并进入第一电化学电池中的泵。设备可以包括在电化学电池与储液器之间延伸的第二导管,以及被配置为使包括金属离子的溶液从电化学电池沿着第二导管流动并进入储液器中的泵。同一泵可以被配置成使包括金属离子的溶液从储液器沿着第一导管流动并进入电化学电池中,并且还使包括金属离子的溶液从电化学电池沿着第二导管流动并进入储液器中。泵或每个泵可以是蠕动泵。
设备可以包括pH计,其被配置成监测包括金属离子的溶液的pH。pH计可以安置在储液器或电化学电池中。优选地,pH计安置在储液器中。设备可以包括进料装置,所述进料装置被配置成将水进料到储液器或电化学电池中。优选地,进料装置被配置成将水进料到储液器中。设备可以被配置成当pH计感测到高于预定最大pH的pH时将水进料到储液器或电化学电池中。
设备可以包括进料装置,所述进料装置被配置成将金属氧化物和/或金属氢氧化物进料到储液器或电化学电池中。优选地,进料装置被配置成将金属氧化物和/或金属氢氧化物进料到储液器中。进料装置可以包括旋转阀。旋转阀可以是机动旋转阀。
在其中电池是分隔电池的实施例中,设备可以包括第一储液器,所述第一储液器被配置成容纳包括金属离子的溶液。所述设备可以包括:在储液器与电化学电池的阴极部分之间延伸的第一导管,以及被配置成使包括金属离子的溶液从第一储液器沿着第一导管流动并进入电化学电池的阴极部分中的泵。设备可以包括在电化学电池的阴极部分与第一储液器之间延伸的第二导管,以及被配置成使包括金属离子的溶液从电化学电池的阴极部分沿着第二导管流动并进入第一储液器中的泵。同一泵可以被配置成使包括金属离子的溶液从第一储液器沿着第一导管流动并进入电化学电池的阳极部分中,并且还使包括金属离子的溶液从电化学电池的阳极部分沿着第二导管流动并进入第一储液器中。泵或每个泵可以是蠕动泵。
设备可以包括第二储液器,所述第二储液器被配置成容纳另外的电解质。设备可以包括:在第二储液器与电化学电池的阳极部分之间延伸的第三导管,以及被配置成使另外的电解质从第二储液器沿着第三导管流动并进入电化学电池的阳极部分中的泵。设备可以包括在电化学电池的阳极部分与第二储液器之间延伸的第四导管,以及被配置成使另外的电解质从电化学电池的阳极部分沿着第四导管流动并进入第二储液器中的泵。同一泵可以被配置成使另外的电解质从第二储液器沿着第三导管流动并进入电化学电池的阳极部分中,并且还使另外的电解质从电化学电池的阳极部分沿着第四导管流动并进入第二储液器中。泵或每个泵可以是蠕动泵。
设备可以包括第一pH计,其被配置成监测包括金属离子的溶液的pH。第一pH计可以安置在第一储液器或电化学电池的阴极部分中。优选地,第一pH计安置在第一储液器中。设备可以包括进料装置,所述进料装置被配置成将水进料到第一储液器或电化学电池的阴极部分中。优选地,进料装置被配置成将水进料到第一储液器中。设备可以被配置成当第一pH计感测到高于预定最大pH的pH时将水进料到第一储液器或电化学电池的阴极部分中。
设备可以包括第二pH计,其被配置成监测另外的分析物的pH。第二pH计可以安置在第二储液器或电化学电池的阳极部分中。优选地,第二pH计安置在第二储液器中。设备可以包括进料装置,所述进料装置被配置成将水进料到第二储液器或电化学电池的阳极部分中。优选地,进料装置被配置成将水进料到第二储液器中。设备可以被配置成当第二pH计感测到高于预定最大pH的pH时将水进料到第二储液器或电化学电池的阳极部分中。
设备可以包括进料装置,所述进料装置被配置成将金属氧化物和/或金属氢氧化物进料到第一储液器或电化学电池的阴极部分中。优选地,进料装置被配置成将金属氧化物和/或金属氢氧化物进料到第一储液器中。进料装置可以包括旋转阀。旋转阀可以是机动旋转阀。
阳极和阴极可以如关于第一和第二方面所定义的。
设备可以包括去除装置,所述去除装置被配置成从电化学电池中去除金属或其合金。去除装置可以包括用于从阴极去除金属或其合金的装置。去除装置可以包括被配置成从阴极去除金属或其合金的叶片。叶片可以被配置成跨阴极移动,并且由此从阴极的表面去除金属或其合金。设备可以被配置成使用磁力或电动机来移动刀片。去除装置可以包括收集器皿,所述收集器皿被配置成一旦金属或其合金已经从阴极去除就收容金属或其合金,并且将所述金属或其合金从电池去除。在其中电池是分隔电池的实施例中,收集器皿可以安置在电池的阴极部分中。收集器皿可以包括旋转阀,所述旋转阀被配置成一旦金属或其合金已经从阴极去除就收容金属或其合金,并且将所述金属或其合金从电池去除。旋转阀可以是机动的。
设备可以包括电源,所述电源被配置成在阳极和阴极两端施加电压。电源可以包括电池、发电机、可再生电源或所述电源可以包括国家电网。可再生电源可以包括太阳能发电机、风力或水力发电机。电源可以被配置成向阳极和阴极供应直流电。
电源可以被配置成在阳极和阴极两端施加至少1V或至少2V的电压,更优选地在阳极和阴极两端施加至少2.5V、至少3V或至少3.5V的电压并且最优选地在阳极和阴极两端施加至少4V或至少4.5V的电压。电源可以被配置成在阳极和阴极两端施加小于8V或小于7.5V的电压,更优选地在阳极和阴极两端施加小于7V、小于6.5V或小于6V的电压并且最优选地在阳极和阴极两端施加小于5.5V或小于5V的电压。电源可以被配置成在阳极和阴极两端施加介于1与8V之间或介于2与7.5V之间的电压,更优选地在阳极和阴极两端施加介于2.5与7V之间、介于3与6.5V之间或介于3.5与6V之间的电压并且最优选地在阳极和阴极两端施加介于4与5.5V之间或介于4.5与5V之间的电压。
电源可以被配置成使至少0.5A、至少1A或至少1.5A的电流流过阳极、阴极和包括金属离子的溶液,更优选地使至少2A、至少2.5A或至少3A的电流流过阳极、阴极和包括金属离子的溶液并且最优选地使至少3.5A的电流流过阳极、阴极和包括金属离子的溶液。电源可以被配置成使小于10A、小于8A或小于6A的电流流过阳极、阴极和包括金属离子的溶液,更优选地使小于5.5A、小于5A或小于4.5A的电流流过阳极、阴极和包括金属离子的溶液并且最优选地使小于4A的电流流过阳极、阴极和包括金属离子的溶液。电源可以被配置成使介于0.5与10A之间、介于1与8A之间或介于1.5与6A之间的电流流过阳极、阴极和包括金属离子的溶液,更优选地使介于2与5.5A之间、介于2.5与5A之间或介于3与4.5A之间的电流流过阳极、阴极和包括金属离子的溶液并且最优选地使介于3.5与4A之间的电流流过阳极、阴极和包括金属离子的溶液。
设备可以包括氢气收集器皿,所述氢气收集器皿被配置成收容在电化学电池中产生的氢气。设备可以包括在电化学电池与氢气收集器皿之间延伸的导管。在其中电池是分隔电池的实施例中,导管可以在电化学电池的阴极部分与氢气收集器皿之间延伸。
被配置成收容在热化学反应器中产生的氢气的氢气收集器皿还可以是被配置成收容在电化学电池中产生的氢气的氢气收集器皿。可替代地,设备可以包括两个分开的氢气收集器皿。
根据另外的方面,提供了一种产生氢气的方法,所述方法包括:
-通过使金属或其合金与蒸汽接触来进行热化学反应,以产生金属氧化物和氢气;
-使在所述热化学反应中产生的金属氧化物与碱性水溶液接触,以产生包括金属离子的溶液;以及
-通过在阳极和阴极两端施加电压来进行电化学反应,由此所述阴极的至少一部分接触包括所述金属离子的所述溶液,以产生氢气、氧气和所述金属或所述其合金。
根据仍另外的方面,提供了一种产生氢气的方法,所述方法包括:
-使金属氧化物与碱性水溶液接触,以产生包括金属离子的溶液;
-通过在阳极和阴极两端施加电压来进行电化学反应,由此所述阴极的至少一部分接触包括所述金属离子的所述溶液,以产生氢气、氧气和金属或其合金;以及
-通过使在所述电化学反应中产生的所述金属或所述其合金与蒸汽接触来进行热化学反应,以产生所述金属氧化物和氢气。
根据最后一个方面,提供了一种用于产生氢气的设备,所述设备包括:
-热化学反应器,所述热化学反应器被配置成在其中容纳金属或其合金,所述热化学反应器包括进料装置,所述进料装置被配置成将蒸汽进料到所述热化学反应器中,并且由此将所述金属或所述其合金转化成金属氧化物;以及
-电化学电池,所述电化学电池包括阳极和阴极,并且被配置成收容包括金属离子的溶液,使得所述阴极的至少一部分接触包括所述金属离子的所述溶液。
设备可以包括氧气收集器皿,所述氧气收集器皿被配置成收容在电化学电池中产生的氧气。设备可以包括在电化学电池和氧气收集器皿之间延伸的导管。在其中电池是分隔电池的实施例中,导管可以在电化学电池的阳极部分与氧气收集器皿之间延伸。
本文(包含任何随附权利要求、摘要以及附图)描述的所有特征和/或如此公开的任何方法或过程的所有步骤可以以任何组合形式与任何上述方面组合,除了其中此类特征和/或步骤中的至少一些特征和/或步骤相互排斥的组合之外。
为了更好地理解本发明并且示出可以如何实施本发明的实施例,现在将通过举例的方式参考附图,在附图中:
图1是用于进行热化学反应的设备的示意图;
图2是示出了温度对热化学反应中产生的氢气的体积的影响的曲线图;
图3是示出了蒸汽流速对热化学反应中产生的氢气的体积的影响的曲线图;
图4是示出了锌的形式对热化学反应中产生的氢气的体积的影响的曲线图;
图5是示出了混合锌对热化学反应中产生的氢气的体积的影响的曲线图;
图6是示出了在进行到完成的实验中的实验氢气产生的曲线图;
图7是用于电解反应的实验设置的示意图;
图8示出了在图7的实验设置中使用的电解池;
图9是示出了氧化锌(ZnO)在包括不同浓度的氢氧化钠(NaOH)的水溶液中的最大溶解度的曲线图;
图10是示出了锌酸钠溶液的电导率随锌酸钠和氢氧化钠的浓度而变化的曲线图;
图11是示出了氢氧化钠溶液的电导率如何随氢氧化钠的浓度而变化的曲线图;
图12是示出了跨电极施加的电压如何影响所产生的氢气的体积的曲线图;
图13是示出了跨电极施加的电压如何影响电流的曲线图;
图14是示出了整个过程的循环性质的示意图;
图15是示出了三水锡酸钠溶液的电导率和电阻如何随三水锡酸钠的浓度而变化的曲线图;
图16是示出了在所施加电压为2V的情况下,对于不同浓度的三水锡酸钠,氢气产生对时间的曲线图;并且
图17是示出了在所施加电压改变的情况下,1.2M电解质的氢气产生对时间的曲线图。
进行的第一个实验涉及使锌与蒸汽反应以形成氧化锌和氢气。
方法
使用图1所示的设备1进行热化学实验。设备1包括管式炉2,所述管式炉具有坩埚4以及安置在其中的温度传感器5。坩埚4包括网罩6。
注射泵8安置在炉2的外部,并且导管10在注射泵8与坩埚4之间延伸。导管10包括安置在炉2的内部的盘绕区段12。
冷凝器16、测量圆筒18、水浴20和真空泵22也安置在炉2的外部。圆筒18在水浴20中倒置,并且导管24在圆筒18的基部26与真空泵22之间延伸。导管28在炉2与冷凝器16之间延伸,并且另外的导管30在冷凝器与圆筒18之间延伸。
当用户希望进行实验时,用户将预先称重的量的锌32放置在坩埚4中。在下文描述的实验中,每个实验使用10g的锌。
用户用去离子水34填充注射泵8。用户还用水36填充水浴20并且启动真空泵22。真空泵22从圆筒18中去除气体,并且使其被水36替代。然后,用户用氮气冲洗系统,并且然后启动烘箱2并等待所述烘箱达到期望温度。
在进行实验之前,用户将再次启动真空泵22以去除由于烘箱2加热引起的气体膨胀而已经进入圆筒18的任何气体。然后,用户将启动注射泵8。这将沿着导管10馈送去离子水34。当去离子水34穿过盘绕区段12时,所述去离子水将蒸发,从而确保蒸汽被馈送到坩埚4并接触锌粉32。蒸汽将根据下式与锌32反应:
Zn
所述网将防止锌32和氧化锌从坩埚中逸出,同时允许气体从所述坩埚中流出。气体然后将沿着导管28流动并流过冷凝器16,所述冷凝器将蒸汽冷凝成水并将其去除。氢气38将继续沿着导管30流动并进入圆筒38中,从而置换水36。用户由此可以测量所产生的氢气38的体积。在下文描述的实验中,每五分钟进行一次读数。
结果
通过测量在四个不同温度(即,250℃、300℃、350℃和400℃)下的氢气产生来研究温度的影响。使用锌粉在150毫升/分钟的蒸汽流速下进行所有实验。来自温度实验的结果显示,反应温度增加会导致反应中产生的氢气的体积增加,参见图2。所有不同的温度均遵循氢气的初始快速增加的类似形状,随后是生产速率降低。生产速率遵循一般模式:温度越高,氢气产生的速率越大。进一步观察到:温度越高,在将水注入到系统中之后氢气产生的延迟越小。
通过测量在50毫升/分钟、100毫升/分钟和150毫升/分钟的三种不同速率下的氢气产生来研究蒸汽体积流速的影响。使用锌粉在350℃的恒定温度下进行所有实验。结果显示,蒸汽体积流量的增加导致所产生的氢气的体积的增加,参见图3。结果遵循氢气产生速率快速增加,随后逐渐降低的模式。当与温度的影响相比时,所产生的速率和体积的差异较小。在将水注入到系统中之后,在反应开始之前存在10分钟的一致延迟。
通过比较当锌呈团粒形式提供时产生的氢气的体积与呈粉末形式提供时产生的氢气的体积,研究锌的形式的影响。所有实验均使用350℃的恒定温度和150毫升/分钟的蒸汽体积流速进行。结果显示,呈粉末形式的锌比呈团粒形式的锌产生更多的氢气,参见图4。在实验结束时,将锌样品从坩埚中去除。当去除时,发现团粒轻微破碎,并且存在被已经破裂的锌粉包围的锌团块。
在上述实验期间,在坩埚中观察到沟流(channelling),由此蒸汽将在特定区域中绕过大量锌而从坩埚流出。因此,锌样品的某些区域暴露于蒸汽中,而其它区域则没有。为了评估此沟流如何影响反应速率,进行了涉及去除锌样品并将其在实验中途混合的实验。使用锌粉在400℃的恒定温度和150毫升/分钟的蒸汽体积流速下进行实验。如将预期的,两个实验的初始反应均是类似的,但是产生的氢气的体积在混合锌的点处跳跃,参见图5。
为了确定反应需要多长时间完成,进行两个实验直到氢气产生停止。第一个实验是使用锌粉在350℃和100毫升/分钟的蒸汽体积流量下进行的并且进行直到生产趋于稳定,这在大约8小时之后发生,参见图6。第二个实验是使用锌粉在400℃和150毫升/分钟的蒸汽体积流量下进行的。与第一个实验类似,氢气产生需要大约8小时才能开始平稳化,参见图6。
方法
进行的第二个实验是使用图7所示的设备100进行的电化学反应。设备100包括由萨里大学工场制造的电解池102。如图8所示,池102包括设置在两个分开的部分106、108中的Perspex
橡胶O形环114安置在壳体104的第一部分106中并且围绕阴极。在使用之前,将阴离子交换膜116放置在阴极110和O形环114上,使得膜116的边缘在O形环114上延伸。然后,将壳体104的第二部分108放置在膜116上,并且壳体的第一部分106和第二部分108将通过将螺栓拧入安置在壳体的第一部分106和第二部分108中的对应螺栓孔118中而被固定在一起。
在整个实验中,使用蠕动泵(未示出),锌酸钠120循环穿过池102的阴极110侧,并且氢氧化钠122循环穿过池102的阳极112侧。下文提供了描述锌酸钠120的制备的细节。
使用常规DC电源124向电极110、112施加电力。
两个测量圆筒126a、126b倒置在包括水130的浴128中。尼龙管132连接到圆筒126的顶部,从而允许所述圆筒在实验开始之前使用真空泵134填充废物130。然后,可以关闭阀136。在池102的阴极110侧与测量圆筒126a之一之间延伸的尼龙管138被配置成将在实验中产生的氢气140运送到测量圆筒126a。类似地,在池102的阳极112侧与测量圆筒126b之一之间延伸的尼龙管142被配置成将在实验中产生的氧气144运送到测量圆筒126b。
结果
溶解度实验结果
在可以进行任何电解池实验之前,必须确定要使用的最佳电解质溶液。
氧化锌不溶于水。然而,氧化锌将根据下式与氢氧化钠反应:
ZnO
然后氧化钠与水反应,如下所示:
Na2O
溶液中可用的过量NaOH用于溶解Zn(OH)
Zn(OH)
为了发现可以制备的锌酸钠溶液的摩尔浓度的范围,首先必须测定氢氧化钠(NaOH)在水中的溶解度。进行实验以发现氢氧化钠在室温下在水中的最大溶解度。这是通过周期性地向通过磁力搅拌器连续混合的100ml去离子水添加氢氧化钠来实现的。当溶液开始变浑浊时,注意到溶解已经停止。
由于氢氧化钠在水中的溶解是放热的,所以使用冰浴来保持溶液冷却。最初,以10g间隔向水中添加氢氧化钠团粒,从而允许溶液在添加之间冷却。一旦发现最大溶解度的范围(处于80g–90g的范围内),就可以重新制备溶液,并且在室温下更接近饱和点添加更小的氢氧化钠增量。
发现最大质量的82g NaOH可以溶于100ml水中。所发现的最大值小于文献(O'Neil,2006)中的最大值,所述文献陈述了109g可以在20℃下溶于100ml水中。为了保持溶液被容纳并且阻止任何水蒸汽逸出,在添加氢氧化钠团粒之间使用Parafilm覆盖烧杯的顶部。然而,在膜的下侧上确实形成了一些水滴,这可能促成与文献的这种差异,因为氢氧化钠溶解较少水。
为了发现氧化锌在氢氧化钠溶液中的最大溶解度,首先使用100ml的水和4g NaOH来产生1M NaOH溶液。然后添加0.5g的ZnO并且使其混合持续大约5分钟。如果其溶解,则添加另外的0.5g的ZnO,如果其未溶解,则向溶液添加另外4克的NaOH。进行此方法直到不再溶解ZnO,尽管向溶液添加更多的NaOH,并且结果示出于图9中。发现氧化锌在含有100ml水和64g NaOH的溶液中的最大溶解度是14g(以产生1.78M锌酸钠溶液)。曲线图显示,随着向溶液添加更多的NaOH,更多的氧化锌可以反应,并且锌酸钠可以溶于溶液中。然而,如图9所示,当溶液达到30wt%NaOH时,反应和溶解的氧化锌的百分比更缓慢地增加并且然后在刚好低于8w%ZnO下趋平。
电导率实验结果
通过向100ml去离子水中添加12g、16g、20g或24g的NaOH和所需数量的ZnO来制备锌酸钠溶液。将溶液溶解持续5-10分钟之间直到澄清,并且然后通过使用梅特勒托利多(Mettler Toledo)电导率探针测量电导率。将所有读数校准到20℃以保持结果一致并且直接可比较。在读数完成之后,用去离子水冲洗电导率探针以去除任何锌酸钠溶液,并且在读数之间留在去离子水中,以避免污染。
如图10所示,随着锌酸钠的摩尔浓度降低,电导率增加。此外,增加NaOH的浓度增加了溶液的电导率。基于这些结果,选择含有100ml水、16g NaOH和1g ZnO(0.12M)的溶液按比例放大成升溶液(litre solution)以用作池的阴极侧的电解质。可以理解的是,如果期望具有更高电导率的溶液,则可以使用更高浓度的NaOH。
还需要测量氢氧化钠的电导率以决定哪种氢氧化钠溶液具有最佳电导率,并且因此将为池提供最佳性能。制备介于0.5M与7M之间的氢氧化钠溶液并且测量电导率。如图11所示,发明人观察到电导率随着摩尔浓度的增加而增加,直到当电导率开始下降时在4.5M处达到峰值。因此,将用于阳极侧的电解质中的氢氧化钠的浓度选择为4.5M,因为其给出了最高电导率。
池实验结果
锌酸钠(Na
Na
使用2.5V、3.0V和3.5V的电压研究了电压对氢气产生的影响。如图12所示,随着电压的增加,产生的氢气的量也随之增加。从2.5V到3V,仅发生氢气产生的少量增加。
针对三个不同电压:2.5V、3.0V和3.5V,研究了电压对池中的电流的影响,并且结果示出于图13中。结果显示,随着电压增加,电流也增加。2.5V实验的模式显示电流随时间最初减小,其然后稳定下来,从而得出0.25A的平均电流。3V实验中的电流最初保持水平但然后缓慢增加到将近1.5A,其中关于实验的平均电流记录为1.22A。3.5V实验最初具有快速上升,然后相对于时间继续缓慢上升,从而得出3.51A的平均电流。
从电极表面回收在上述实验中产生的锌。改变各种实验参数,进行另外的实验,并且结果示出于表1中。
如表1所示,电压越高,并且因此电流越大,锌回收的量越大。比较实验8和9,注意到增加锌酸钠溶液的浓度增加了所回收锌的质量。注意到,电流在实验9中以更快的速率增加并且达到比在实验8中更高的总体电流。认为这是由于电解质的电导率增加,并且导致锌的质量增加。
计算实验1到3的池效率,以便可以比较所述池的性能,并且结果示出于表2中。
趋势显示,随着电压增加并且产生更多的氢气,池效率增加。
为了显示所述方法适用于与除了锌之外的金属一起使用,发明人还研究了锡酸钠的电化学反应。
方法
使用未分隔的电解池以进行批次实验。所述池由矩形顶部开放的有机玻璃丙烯酸器皿构成,所述器皿具有两个圆柱形石墨电极,所述石墨电极被布置成分开6cm并且连接到器皿的底部。器皿的高度为25cm,长度为20cm,并且宽度为12cm。保留在器皿内部的电极部分的长度为3cm并且直径为1cm。电线将电极连接到电源。电源在每个实验之前设定电压(和电流)。每个电极都有圆筒(500ml),其中装配阀放置在其上。使用管将一个圆筒连接到真空泵,在开始实验之前,所述真空泵用于用电解质溶液填充圆筒。然后在实验开始之前关闭阀。
通过将55.4g的锡酸钠(以42-45%SnO
使用电导率测量装置来测量电解质的电导率。然后,通过添加蒸馏水将溶液稀释到期望浓度。在每个间隔下,这些浓度的范围为1.3-0.1M,减少0.1M。在每个浓度下测量电导率。使用电导率,使用以下等式计算电阻:
R=L/σ.S 5
其中R是电阻(Ω),σ是电导率(mS/cm),L是电极之间的距离(cm),并且S是电极表面积(cm
一旦产生具有如上所述的期望浓度的电解质,就将其充分混合以确保恒定的浓度梯度。然后将其小心地倒入反应器皿中,并且开启电源。所有实验的电流均固定在1A。
进行两种不同的实验程序。第一种实验程序涉及在最佳浓度值附近的三种不同电解质浓度下,随时间推移测量氢气产生速率。根据电导率测量结果测定最佳浓度。第二种实验程序涉及在三个不同电压:2、2.5和3V下,随时间推移测量氢气产生速率。每个实验持续三个小时,其中以五分钟间隔测量氢气产生速率。
所期望的电解是三水锡酸钠的电解。然而,其可以与氢氧化锡(IV)和NaOH平衡存在,如下所示:
所述方法在室温下进行,这是有利的,因为所述方法倾向于在平衡时有利于形成三水锡酸钠。即使在这个方法中水的解离相对较小,仍然是可能的。这将导致在阴极处产生氢气。然而,同时发生的更突出的反应是氢氧化锡(IV)还原成锡。金属沉积在阴极的表面上。这些反应可以分别视为:
阳极处的反应涉及氧气的产生:
等式6到9的求和简化为:
然后可以氧化沉积在阴极上的锡以产生氢氧化锡(IV)和氢气。应当理解,可以使用实例1中描述的设备来执行此方法。此反应的等式是:
所产生的氢氧化锡(IV)可以用于替代已经根据等式6反应的三水锡酸钠。通过对等式10和11进行求和,用于表示过程的整体等式可以简化为:
基于从实验获得的测量值和用于进行实验的参数的组合来计算池效率。用于确定池效率的等式是:
n=q/(U.I.t) 13
其中n是基于氢气产生速率的池效率[m
项(kWh)
在这些实验期间,电压随着固定的电解质浓度、电流和指定的时间而变化(2、2.5和3V)。
结果与讨论
如上文所解释的,在各个浓度下测量电解质的电导率。如图15所示,电解质浓度的降低导致电导率的降低。这是因为每单位体积的离子数随着浓度降低而减少。因此,每单位体积携带电荷的离子较少,这导致电导率降低。基于这一事实,预期的是,实验中使用的1.3M的电解质浓度(最大浓度)将具有最高的电导率。然而,情况并非如此。最佳电导率是在浓度为1.2M下的电导率。出乎意料的结果可以通过电解质处于其溶解度极限来解释。
另外,电阻和电导率之间的关系是倒数的。
基于具有最高电导率的这些电解质,选择1.1M、1.2M和1.3M三水锡酸钠的浓度。然后测量这些电解质的氢气产量。
测量1.2M电解质的最大氢气产量,参见图16。因此,具有最高电导率的电解质在给定时间内产生最多的氢气。
图17中考虑的三个电压是基于水电解中用于氢气产生的最小电池电压(其是2V)选择的。然后测量氢气产量。
累积的氢气的最多量是当电压处于其最高(即,3V)时。这是预期的,因为更大的电压会加速电解发生的速度,这导致更多的离子流向电极。因此,随着时间的推移累积更多的氢气。将这与图16进行比较,可以看出电压对氢气产生具有比浓度更显著的影响。介于2V与2.5V之间的氢气产生速率的差异为大约150m
基于1.2M电解质溶液计算池效率,并且将结果提供在表3中。
进行的第一个观察是电压的增加导致池效率的降低。即使其产生更大量的氢气,池效率也较低,这是不期望的。基于这些结果,使用锌酸钠的电池(在实例2中讨论的)被认为是更有效的。然而,由于电解实验期间消耗的电功率的量不同,因此难以进行直接比较。因此,这将导致结果的一些差异。
与2.5-3V相比,似乎在2-2.5V范围内存在效率的显著下降。由于这个原因,使用较小的电压将是更有效的,因为这是电池最有效的时候。然而,在较低电压(即,2V)下,显然电池比水电解糟更有效,这可能是电解质溶液中的离子活化剂的结果。
发明人已经表明,可以通过在热化学反应中将锌转化成氧化锌来生成氢气,并且可以通过在电化学反应中将氧化锌转化成锌来生成另外的氢气。因此,一旦提供了初始量的锌/氧化锌,就可以在循环中进行这些反应,如图14所示,以生成大量氢气,其中所需的唯一原料是水。
发明人已经表明,此系统也可以应用于其它金属,如锡。具体地,发明人已经在电解反应中从锡酸钠产生锡。
- 用于可持续产生氢气的连续方法
- 用于产生连续的高浓物质流的高浓物质泵以及用于运行用于产生连续的高浓物质流的高浓物质泵的方法
