三聚体多肽复合物及其用途
文献发布时间:2023-06-19 10:22:47
发明领域
本发明涉及癌症治疗领域,且更特别地,涉及为由胶原蛋白同三聚化(homotrimerization)结构域形成的三聚体多肽复合物的治疗剂。
发明背景
使用单克隆抗体(mAb)调节免疫应答是一种有前途的癌症治疗方法。针对检查点抑制剂诸如CTLA-4和PD-1/PD-L1的拮抗性mAb已得到临床批准,并且靶向共刺激受体的激动性mAb正在进行临床试验。TNF受体超家族(TNFRSF)的共刺激受体诸如CD40、OX40和4-1BB特别令人感兴趣。其中,4-1BB不是在静息的初始T细胞上组成性表达,而是在激活后获得的。这限制了治疗的潜在有害副作用。
4-1BB(CD137,TNFRSF9)仅具有一种已确认的配体[4-1BB-配体(4-1BBL),TNFSF9],其在巨噬细胞、活化的B细胞和树突状细胞上表达。4-1BB与其配体或激动性抗体的结合促进T细胞增殖、细胞因子生成和溶细胞效应物功能,并保护淋巴细胞免受程序性细胞死亡。此外,4-1BB在NK细胞上的结合增强了细胞因子的释放(包括IFNγ)和抗体依赖性细胞毒性(ADCC)。事实上,早在1997年就发现使用4-1BB激动性mAb治疗小鼠诱导了建立的且免疫原性差的肿瘤的肿瘤消退。此后,大量积累的临床前数据支持作为单一药剂以及以联合疗法二者在癌症免疫治疗中诱导4-1BB信号传导。
4-1BB激动性mAb的作用在空间上不受限于肿瘤,并因此外周毒性可减少4-1BB靶向疗法的治疗窗口。在小鼠中,已表明4-1BB mAb会引起免疫相关异常,尤其是CD8
另一种策略是使用抗4-1BB寡核苷酸适体(aptamer)代替4-1BBL。在动物模型中,与基于IgG的4-1BB激动性抗体相比,与前列腺特异性膜抗原(PSMA)适体缀合的4-1BB激动性适体的全身递送产生了优异的治疗效果。最近还报道了将抗4-1BB F(ab')2片段和IL-2锚定在脂质体表面诱导了有效的抗肿瘤免疫力,而没有全身毒性。
就目前而言,通过4-1BB-激动性mAb共刺激是另一种可行的治疗方法,其受到肿瘤外毒性的阻碍。这使得有必要为肿瘤靶向治疗设计允许有效的免疫刺激而没有严重副作用的新策略。
发明内容
本发明的作者已经将4-1BB激动性IgG修改为双特异性肿瘤靶向的三聚体形式。这种工程化的抗体形式是基于抗体衍生的结合结构域与来自胶原蛋白XV或XVIII的小同三聚化区域的融合,从而产生了三聚体抗体,称为三聚体。相对于单特异性非靶向抗体,这种工程化的抗体表现出更有效的体外共刺激活性,并且在体内显示出增强的肿瘤归巢/靶向以及抗肿瘤活性。此外,当用基于IgG的抗4-1BB激动性抗体治疗初始免疫功能正常的小鼠会导致严重的毒性,如由脾脏和肝脏肿大发炎,肝脏、脾脏和胰腺中严重炎症和纤维化,以及全身性炎性细胞因子的产生所评估的,用靶向EGFR或CEA的4-1BB激动性三聚体进行治疗不存在这些免疫相关的副作用,并因此其本身构成一种有效的治疗方法。
因此,在第一方面,本发明涉及三聚体多肽复合物,包含三种单体多肽,其中每种单体包含:
i.同三聚化结构域,选自由胶原蛋白XVIII同三聚化结构域(TIE
ii.TNFR家族共刺激受体的激动剂
并且其中至少一种单体多肽还包含能够与肿瘤相关抗原特异性结合的区域。
在第二方面,本发明涉及编码形成根据本发明所限定的三聚体多肽的一部分的至少一种单体多肽的多核苷酸。
在第三方面,本发明涉及包含根据本发明的多核苷酸的载体。
在第四方面,本发明涉及包含本发明的载体的宿主细胞。
在第五方面,本发明涉及用于产生根据本发明的三聚体多肽复合物的方法,其包括从包含携带并表达根据本发明的多核苷酸的宿主细胞的培养物中分离所述三聚体多肽,并且任选地使所述三聚体多肽进行进一步加工。
在第六方面,本发明涉及包含根据本发明的三聚体多肽的药物组合物。
在第八方面,本发明涉及本发明的三聚体多肽复合物在治疗癌症中的用途。
附图说明
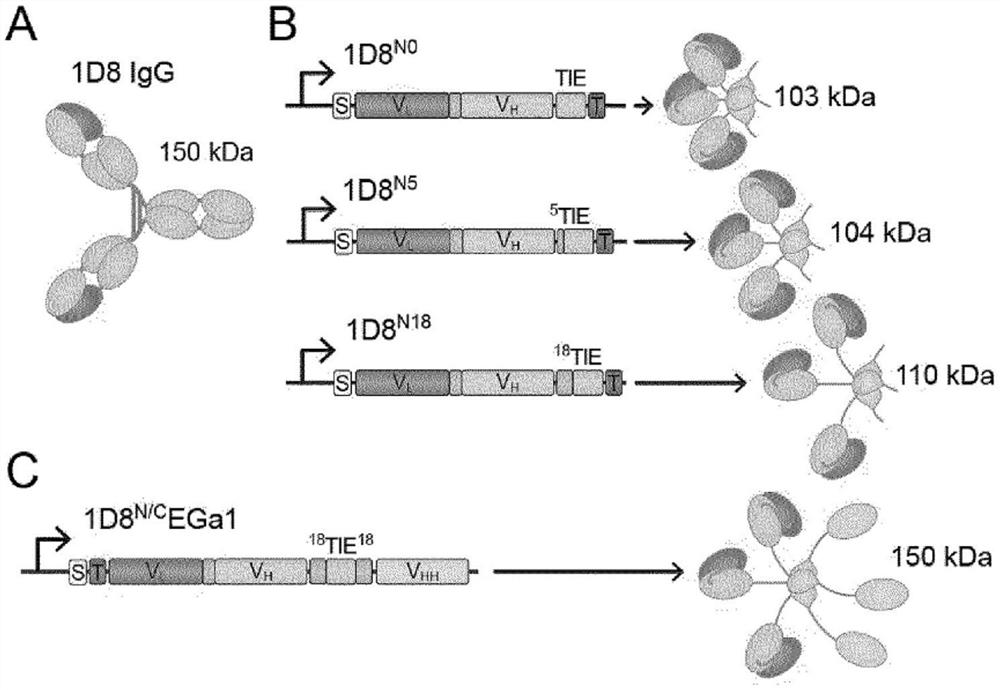
图1.示出了抗4-1BB IgG的结构域结构(A),以及单特异性(B)和双特异性三聚体(C)的遗传结构(左)和结构域结构(右)的示意图。在所有情况下,源自1D8抗体的可变区均表示为深灰色和浅灰色(由V
图2.抗4-1BB三聚体的表征。(A)通过生物膜层干涉技术获得的1D8抗体的传感图(黑色曲线)和拟合曲线。用m4-1BB固定生物传感器,并与2nM和4nM分析物抗体结合。重复的生物传感器(未显示)显示出非常相似的应答并有助于拟合曲线。(B)通过FACS测量与刺激的小鼠CD8a
图3.靶向EGFR的4-1BB激动剂三聚体的表征。(A)对于1D8
图4.靶向EGFR的4-1BB激动性三聚体的药代动力学特性和肿瘤成像。(A)CD1-小鼠中单次静脉注射给药1D8
图5.用1D8
图6.用1D8
图7.(A)通过western印迹分析证明了在条件培养基中存在从转染的HEK-293细胞分泌的1D8
图8.(A)纯化的1D8
图9.(A)在还原和非还原二种条件下纯化的重组小鼠4-1BBL的考马斯(coomassie)染色的SDS-PAGE。(B)通过FACS对m4-1BBL的功能表征。使用1D8
图10.CF488A标记的抗体的表征。(A)在还原条件下CF488A标记的1D8 IgG、1D8N
图11.表达m4-1BB的HEK-293细胞的FACS分析。原始HEK293
图12.通过1D8
图13.1D8
图15.通过FACS对1D8
图16.1D8
图17.纯化的1D8
图18.用于肿瘤定位研究的1D8
图19.1D8
图20.全身注射3H3 IgG或1D8
图21.1D8
图22.1D8
图23.示出了双特异性1D8
图24.分泌的1D8
图25.纯化的1D8
图26.纯化的1D8
图27.1D8
发明的具体实施方式
本发明人已经开发了三聚体多肽复合物以刺激抗肿瘤免疫应答。
在第一方面,本发明涉及三聚体多肽复合物,其包含三种单体多肽,其中每种单体包含:
i.同三聚化结构域,选自由胶原蛋白XVIII同三聚化结构域(TIE
ii.TNFR家族共刺激受体的激动剂
以及其中至少一种单体多肽还包含能够与肿瘤相关抗原特异性结合的区域。
如本文使用的,术语“三聚体多肽复合物”或“TPC”是指非共价结合的三种单体多肽的复合物。每种单体多肽可以彼此相同或不同。在优选的实施方式中,TPC是同三聚体,意为复合物的三种单体或亚基是相同的。在另一优选的实施方式中,TPC是异三聚体,意为复合物的三种单体或亚基中的至少一种与其他两种不同。在更优选的实施方式中,TPC是同三聚体。
同三聚化结构域
如本文使用的,术语“同三聚化结构域”是指负责单体之间非共价三聚化的区域。在优选的实施方式中,同三聚化结构域选自由胶原蛋白XVIII同三聚化结构域(TIE
如本文中公开的,胶原蛋白XVIII或胶原蛋白XV的单体可以彼此相同或不同,只要保持了相对于天然胶原蛋白分子的三聚化特性。在特定的实施方式中,至少一种单体与其他两种不同。在优选的实施方式中,三种单体彼此相同,优选胶原蛋白XVIII或胶原蛋白XV的三种单体。
在一种实施方式中,胶原蛋白XVIII同三聚化结构域由SEQ ID NO:1组成或包含SEQ ID NO:1。在另一实施方式中,胶原蛋白XV同三聚化结构域由SEQ ID NO:2组成或包含SEQ ID NO:12。在另一实施方式中,胶原蛋白XVIII同三聚化结构域由SEQ ID NO:12组成或包含SEQ ID NO:12。
如本文使用的,“其功能等效变体”旨在包括天然存在的胶原蛋白XVIII或胶原蛋白XV的TIE
优选地,TIE
本领域技术人员将认识到,通过考虑密码子简并、保守氨基酸取代和阅读框定位,可以适当地调整核苷酸序列的同一性值以便确定编码本发明多肽的两个核苷酸序列的对应序列同一性。
在本发明的上下文中,“保守氨基酸变化”和“保守氨基酸取代”在本发明中同义地使用。“保守氨基酸取代”是指具有相似侧链的残基的互换性,并意为天然氨基酸序列中一个或多个氨基酸被具有相似侧链的其他一个或多个氨基酸取代,导致不改变蛋白质功能的沉默变化。天然氨基酸序列中氨基酸的保守取代物可以选自天然存在的氨基酸所属的组的其他成员。例如,具有脂族侧链的一组氨基酸包括甘氨酸、丙氨酸、缬氨酸、亮氨酸和异亮氨酸;具有脂肪族羟基侧链的一组氨基酸包括丝氨酸和苏氨酸;具有含酰胺侧链的一组氨基酸包括天冬酰胺和谷氨酰胺;具有芳族侧链的一组氨基酸包括苯丙氨酸、酪氨酸和色氨酸;具有碱性侧链的一组氨基酸包括赖氨酸、精氨酸和组氨酸;具有含硫侧链的一组氨基酸包括半胱氨酸和甲硫氨酸。在本发明的一些实施方式中,优选的保守氨基酸取代是:缬氨酸-亮氨酸、缬氨酸-异亮氨酸、苯丙氨酸-酪氨酸、赖氨酸-精氨酸、丙氨酸-缬氨酸、天冬氨酸-谷氨酸和天冬酰胺-谷氨酰胺。因此,本发明涉及TIE
“密码子简并”是指遗传密码中的差异使得核苷酸序列改变而不影响所编码多肽的氨基酸序列。本领域技术人员清楚地知道,特定宿主细胞在使用核苷酸密码子来指定给定氨基酸残基时表现出的密码子偏好。因此,对于基因在宿主细胞中的异位表达,期望以使其密码子使用频率接近密码子使用表中所描述的宿主细胞的密码子使用频率的方式来设计或合成该基因。
在两个或多个氨基酸或核苷酸序列的上下文中,术语“同一性”、“相同”或“同一性百分比”是指,当进行比较和比对(如果需要,引入缺口)以得出最大的对应性而不将任何保守氨基酸取代视为序列同一性的一部分时,两个或多个序列或子序列是相同的或具有相同的指定百分比的氨基酸或核苷酸残基。可以使用序列比较软件或算法或通过目测来测量同一性百分比。本领域已知可以用于获得氨基酸或核苷酸序列的比对的各种算法和软件。
序列同一性的百分比可以通过在比较窗口上比较两个最佳比对的序列来确定。比对的序列可以是多核苷酸序列或多肽序列。对于两个序列的最佳比对,与参考序列(不包含插入或删除)相比,比较窗口中的多核苷酸或氨基酸序列的部分可以包含插入或删除(即缺口)。序列同一性百分比是通过确定两个比较序列中出现相同核苷酸残基或相同氨基酸残基的位置数目以得出匹配位置的数目,然后将匹配位置的数目除以比较窗口中的位置总数,并将结果乘以100以得出序列同一性的百分比。可以通过以下确定两个多肽序列或两个多核苷酸序列之间的序列同一性,例如,使用来自Genetics Computer Group,Inc.的WISCONSIN PACKAGE版本10.0-UNIX中的Gap程序,其基于Needleman和Wunsch的方法(J.Mol.Biol.48:443-453,1970),使用成对比较的默认参数组(对于氨基酸序列比较:缺口产生罚分=8,缺口延伸罚分=2;对于核苷酸序列比较:缺口产生罚分=50;缺口延伸罚分=3),或者使用BLAST2.2.1软件套件中的TBLASTN程序(Altschul et al.,Nucleic AcidsRes.25:3389-3402),其使用BLOSUM62矩阵(Henikoff and Henikoff,Proc.Natl.Acad.Sci.U.S.A.89:10915-10919,1992)以及用于成对比较的默认参数组(缺口产生成本=11,缺口延伸成本=1)。
可以使用例如多种可用于将查询序列与蛋白质数据库进行比较的基于同源性的搜索算法,包括例如BLAST、FASTA和Smith-Waterman,来确定多肽之间的序列同一性百分比及其相应功能。BLASTX和BLASTP算法可用于提供蛋白质功能信息。为了评估功能指定的置信度,检验了许多值。有用的测量值包括“E值”(也显示为“hit_p”)、“同一性百分比”、“查询覆盖率百分比”和“命中覆盖率百分比”。在BLAST中,E值或期望值表示得分等于或优于原始比对得分S的不同比对的数目,其预计是在数据库搜索中偶然出现的。因此,E值越低,匹配越显著。由于数据库大小是E值计算中的一个元素,因此通过对公共数据库诸如GenBank进行BLAST搜索获得的E值对于任何给定的查询/条目匹配通常随着时间的推移而增加。因此,在设置多肽功能预测的置信度的标准时,“高”BLASTX匹配被认为对于最高BLASTX命中具有小于1E-30的E值;中等BLASTX被认为具有1E-30至1E-8的E值;以及低BLASTX被认为具有大于1E-8的E值。同一性百分比是指沿通过BLAST算法比对的序列的该部分的长度存在的相同匹配的氨基酸残基的百分比。在设置多肽功能预测的置信度标准时,“高”BLAST匹配被认为对于最高BLAST命中具有至少70%的同一性百分比;中等同一性百分比值被认为是35%至70%;以及低同一性百分比被认为低于35%。蛋白质功能指定中特别令人感兴趣的是使用E值、同一性百分比、查询覆盖率和命中覆盖率的组合。查询覆盖率是指以BLAST比对表示的查询序列的百分比,而命中覆盖率是指以BLAST比对表示的数据库条目的百分比。为了定义本发明功能上覆盖的多肽,从蛋白质同源物诸如SEQ ID NO:1、SEQ ID NO:2或SEQ ID NO:12的功能来推导多肽的功能,其中本发明的多肽是这样的多肽:(1)导致hit_p<1e-30或同一性%>35%并且查询_覆盖率>50%并且命中_覆盖率>50%,或(2)导致hit_p<1e-8并且查询_覆盖率>70%并且命中_覆盖率>70%。
TIE
TIE
可以通过本领域技术人员已知的常规方法来确定功能等效变体形成三聚体的能力。例如,以简单举例的方式,可以通过使用标准色谱技术来确定功能等效变体形成三聚体的能力。因此,将待评估的变体置于合适的三聚条件下,并在非变性条件下对该复合物进行标准色谱分析,以使最终形成的复合物(三聚体)不发生改变。如果变体正确地三聚化,则复合物的分子大小将是变体的单个分子的分子大小的三倍重。可以通过使用标准方法诸如分析离心法、质谱法、尺寸排阻色谱法、沉降速度法等来揭示复合物的分子大小。
TIE
在三聚体多肽复合物(TPC)中,TIE
TNFR家族共刺激受体的激动剂
如本文使用的,术语“TNFR家族共刺激受体的激动剂”是指能够与所得TNFR家族的共刺激受体特异性结合并诱导其刺激的任何化学实体或分子。
“特异性结合”或“特异性地结合”或“结合”是指分子以大于对于其他抗原的亲和力与TNFR家族成员或特定TNFR家族成员内的表位结合。通常,当用于结合的平衡解离常数(K
形成本发明的TPC的一部分的TNFR家族共刺激受体的激动剂能够诱导抗体结合的TNFR家族成员的至少一种生物学活性,该生物学活性是由TNFR家族成员的天然配体诱导的。示例性激动活性包括在体外测定中诱导在NFκB诱导型启动子的控制下表达的分泌性胚胎碱性磷酸酶(SEAP)的产生,通过DC上CD80、CD83、CD86和HLA-DR表面表达的增加所评估的树突细胞(DC)分化的诱导,通过B细胞增殖的增加或B细胞上CD23、CD80、CD83、CD86和HLA-DR表面表达的增加所评估的B细胞的活化,通过从先前暴露于抗原的患者中分离出的PBMC产生干扰素γ(IFN-γ)所评估的抗原特异性T细胞回忆应答的诱导,以及CD4
如本文使用的,关于活化的免疫细胞的术语“共刺激”包括共刺激分子提供诱导增殖或效应子功能的第二非活化受体介导的信号或共刺激信号的能力。例如,共刺激信号可以导致例如在已经接受T细胞受体介导的信号的T细胞中细胞因子分泌。
“TNFR家族成员”包括属于TNFR家族的受体。TNFR家族成员及其相应配体的典型实例在表1中示出。
表1:使用根据本发明的TPC可靶向的TNFR家族成员的合适成员的列表。右栏示出了每个TNFR家族成员的配体。
该术语包括表1所示出的受体,包括TNFR的天然存在的变体。TNFR通常表达为I型跨膜蛋白,并且在其细胞外结构域中包含1至6个富含半胱氨酸的结构域。信号传导以TNFR三聚体出现。
TNFR家族共刺激受体的激动剂可以存在于TPC的一种单体多肽、两种单体多肽或三种单体多肽中。在优选的实施方式中,三种单体多肽包含共刺激受体的激动剂。
在优选的实施方式中,一种单体多肽包含与其他两种不同的共刺激受体的激动剂。在另一优选的实施方式中,三种单体多肽包含相同共刺激受体的不同激动剂。在更优选的实施方式中,三种单体多肽包含共刺激受体的相同激动剂。
在一种实施方式中,TNFR家族成员的激动剂是激动性抗体。
“抗体”是指广义上的,并且包括免疫球蛋白分子,其包括单克隆抗体(包括鼠、人、人源化和嵌合的单克隆抗体)、抗体片段、双特异性抗体或多特异性抗体、二聚体、四聚体或多聚体抗体、单链抗体、单结构域抗体、抗体模拟物以及包含所需特异性的抗原结合位点的免疫球蛋白分子的任何其他修饰构型。“全长抗体分子”包括通过二硫键相互连接的两条重链(HC)和两条轻链(LC)以及其多聚体(例如IgM)。每条重链包括重链可变区(VH)和重链恒定区(包括结构域CH1、铰链、CH2和CH3)。每条轻链包括轻链可变区(VL)和轻链恒定区(CL)。VH和VL区域可进一步细分为高变异性区域,称为互补决定区(CDR),其间穿插有框架区(FR)。每个VH和VL包括三个CDR和四个FR片段,从氨基到羧基末端按以下顺序排列:FR1、CDR1、FR2、CDR2、FR3、CDR3和FR4。
“互补决定区(CDR)”是抗体中的“抗原结合位点”。可以使用多种术语定义CDR:(i)互补决定区(CDR),VH中的三个(HCDR1,HCDR2,HCDR3)和VL中的三个(LCDR1,LCDR2,LCDR3)基于序列变异性(Wu et al.(1970)J Exp Med 132:211-50)(Kabat et al.,Sequences ofProteins of Immunological Interest,5th Ed.Public Health Service,NationalInstitutes of Health,Bethesda,Md.,1991)。(ii)“高变区”、“HVR”或“HV”,VH中的三个(H1,H2,H3)和VL中的三个(L1,L2,L3)是指抗体可变结构域的结构高变的区域,如Chothia和Lesk所定义的(Chothia et al.(1987)J Mol Biol196:901-17)。国际免疫遗传学(IMGT)数据库(http://www_imgt_org)提供了抗原结合位点的标准化编号和定义。在(Lefranc etal.(2003)Dev Comp Immunol 27:55-77)中描述了CDR、HV和IMGT描述之间的对应关系。除非在本说明书中另有明确说明,否则如本文中使用的术语“CDR”、“HCDR1”、“HCDR2”、“HCDR3”、“LCDR1”、“LCDR2”和“LCDR3”包括通过上文Kabat、Chothia或IMGT所述的任何方法定义的CDR。
根据重链恒定区氨基酸序列,免疫球蛋白可分为五个主要类别:IgA、IgD、IgE、IgG和IgM。IgA和IgG进一步细分为同种型IgA1、IgA2、IgG1、IgG2、IgG3和IgG4。基于其恒定区的氨基酸序列,任何脊椎动物物种的抗体轻链都可以分为两种明显不同的类型之一,即kappa(κ)和lambda(λ)。
“抗体片段”是指保留重链和/或轻链抗原结合位点的免疫球蛋白分子的一部分,诸如重链互补决定区(HCDR)1、2和3,轻链互补决定区(LCDR)1、2和3,重链可变区(VH)或轻链可变区(VL)。抗体片段包括熟知的Fab、F(ab')2、Fd和Fv片段以及由一个VH结构域或一个VL结构域组成的单结构域抗体(dAb)。VH和VL结构域可以通过合成接头连接在一起以形成各种类型的单链抗体设计,其中在当VH和VL结构域由单独的单链抗体构建体表达时的情况下,VH/VL结构域可以分子内或分子间配对,以形成单价抗原结合位点,诸如单链Fv(scFv)或双抗体。
“单克隆抗体”是指在每条重链和每条轻链中具有单一氨基酸组成的抗体群,除了可能的熟知的改变诸如从抗体重链上去除C末端赖氨酸,或由于氨基酸的翻译后修饰引起的改变诸如甲硫氨酸氧化或天冬酰胺或谷氨酰胺脱酰胺。单克隆抗体通常特异性结合一种抗原表位,除了双特异性或多特异性单克隆抗体特异性结合两种或多种不同的抗原表位。单克隆抗体在抗体群中可能具有异质性糖基化。单克隆抗体可以是单特异性或多特异性的,或单价、二价或多价的。双特异性抗体包含在术语单克隆抗体中。
“人源化抗体”是指其中抗原结合位点源自非人物种而可变区框架源自人类免疫球蛋白序列的抗体。人源化抗体可以在框架中包括取代,使得框架可以不是所表达的人免疫球蛋白或人免疫球蛋白种系基因序列的精确拷贝。
“人抗体”是指具有重链和轻链可变区的抗体,其中框架和抗原结合位点二者均源自人源序列,并且经优化以在施用于人受试者时具有最小的免疫应答。如果抗体包含恒定区或恒定区的一部分,则恒定区也源自人源序列。
如果抗体的可变区是从使用人种系免疫球蛋白或重排的免疫球蛋白基因的系统中获得的,则人抗体包含“源自”人源序列的重链或轻链可变区。这样的示例性系统是在噬菌体上展示的人免疫球蛋白基因文库,以及如本文所述的携带人免疫球蛋白基因座的转基因非人动物诸如小鼠或大鼠。当与人种系免疫球蛋白或重排的免疫球蛋白基因相比时,“人抗体”可包含氨基酸差异,这是由于用于获得抗体和人类免疫球蛋白基因座的系统之间存在差异,引入体细胞突变或有意引入取代到框架或抗原结合位点中,或两者兼有。通常,“人抗体”的氨基酸序列与由人种系免疫球蛋白或重排的免疫球蛋白基因编码的氨基酸序列至少有约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的同一性。在一些情况下,“人抗体”可包含源自人框架序列分析的共有框架序列或并入展示在噬菌体上的人免疫球蛋白基因文库中的合成HCDR3。
根据本发明,共刺激受体是TNF-受体(TNFR)家族的受体。在特定的实施方式中,共刺激受体是不在静息初始T细胞上组成性表达而是在激活后获得的受体。这样的非限制性实例包括:CD40、OX40、CD27、CD30、GITR和4-1BB。在优选的实施方式中,每个单体多肽中的共刺激受体选自:CD40、OX40、CD27、CD30、GITR和4-1BB。在更优选的实施方式中,共刺激受体是4-1BB。
在实施方式中,TNFR家族共刺激受体的激动剂是激动性抗体。如本文中使用的,术语“抗体”是指包括至少一个免疫球蛋白可变区的蛋白质,例如,提供免疫球蛋白可变结构域的氨基酸序列或免疫球蛋白可变结构域的序列。抗体可包括例如可变重链(H)区(在此缩写为VH)和可变轻链(L)区(在此缩写为VL)。通常,抗体包括两个可变重链区和两个可变轻链区。术语“抗体”涵盖结合抗原的抗体片段(例如,单链抗体、纳米抗体(V
如本文中使用的,术语“重链”或“HC”涵盖全长重链及其片段二者。全长重链包括可变区结构域VH和三个恒定区结构域CH1、CH2和CH3。VH结构域在多肽的氨基末端,而CH3结构域在羧基末端。
如本文中使用的,术语“轻链”涵盖全长轻链及其片段。全长轻链包括可变区结构域VL和恒定区结构域CL。像重链一样,可变轻链区结构域在多肽的氨基末端。
如本文中使用的,术语“单链抗体”是指通过遗传工程修饰的分子,其包含通过合适的肽接头结合的可变轻链区和可变重链区,形成为遗传融合的单链分子。
如本文中使用的,术语“纳米抗体”是指单结构域抗体(sdAb),其是由单个单体可变抗体结构域组成的抗体片段。像完整抗体一样,它能够选择性地与特定抗原结合。
如本文中使用的,术语“抗体模拟物”是指像抗体一样可以特异性结合抗原,但是不一定在结构上与抗体相关的任何化合物。化合物的“模拟物”包括其中功能活性所必需的化合物的化学结构已被模拟该化合物构象的其他化学结构替代的化合物。模拟物的实例包括其中肽主链被一个或多个苯并二氮
如本文中使用的,术语抗体还指“非免疫球蛋白剂”作为除免疫球蛋白之外的基于不同分子性质、拓扑或支架的结合剂。术语支架意在描述一种可以携带改变的氨基酸或序列插入物的蛋白质框架,其赋予蛋白质变体不同的功能,通常用于结合特定靶标。这样的非免疫球蛋白剂的实例是本领域众所周知的,并且包括但不限于肽适体、核酸适体、Affibody分子、Affilins、Affimers、Affitins、Alphabodies、Anticalins、Avimers、DARPins、Fynomers、Kunitz结构域肽、单抗体(Monobodies)等,以及在Binz et al.,2005(Nat.Biotech.23:1257-68)中综述了其他蛋白支架,并通过引用并入本文。术语“肽适体”是指短的可变肽结构域,其在两端均附接至蛋白质支架,并与特定的靶分子结合。可变的环长度通常包括十至二十个氨基酸,并且支架可以是具有良好溶解性和相容性(compacity)的任何蛋白质。如本文中使用的,术语“核酸适体”或“DNA适体”是指已经通过重复的多轮选择工程化以结合至特定分子靶标的DNA的短链。
根据本发明,抗体可被“人源化”以降低人类个体中的免疫原性。人源化抗体提高单克隆抗体治疗的安全性和有效性。一种常见的人源化方法是在任何合适的动物(例如小鼠、大鼠、仓鼠)中产生单克隆抗体,并将恒定区替换为人恒定区,以这种方式工程化的抗体称为“嵌合的”。另一种常见的方法是“CDR移植”,其用人V-FR代替非人V-FR。在CDR移植方法中,除CDR区外的所有残基都是人源的。在某些实施方式中,本文所述的抗体是人源化的。在某些实施方式中,本文所述的抗体是嵌合的。在某些实施方式中,本文所述的抗体是CDR移植的。人源化可能降低或几乎不影响抗体的整体亲和力,或者也可改善人源化后对其靶标的亲和力。在某些实施方式中,人源化使对抗体的亲和力增加了10%。在某些实施方式中,人源化使对抗体的亲和力增加了25%。在某些实施方式中,人源化使对抗体的亲和力增加了35%。在某些实施方式中,人源化使对抗体的亲和力增加了50%。在某些实施方式中,人源化使对抗体的亲和力增加了60%。在某些实施方式中,人源化使对抗体的亲和力增加了75%。在某些实施方式中,人源化使对抗体的亲和力增加了100%。合适地,使用表面等离振子共振(SPR)测量亲和力。
在优选的实施方式中,共刺激受体的激动性抗体是scFv、纳米抗体或抗体模拟物。
能够与肿瘤相关抗原特异性结合的区域
根据本发明的TPC可以是单特异性的,即它们含有TNFR家族共刺激受体的结合位点,但是,优选地,它们还可以含有能够与肿瘤细胞表面存在的肿瘤相关抗原结合的一种或多种分子。这将产生双特异性抗体,其包含与TNFR家族共刺激受体结合并对其产生激动性作用的区域和与肿瘤相关抗原结合的区域。应理解的是,含有能够与肿瘤相关抗原特异性结合的区域的TPC中单体的数目可以是1、2或3个。在优选的实施方式中,单体多肽中的一种包含能够与肿瘤相关抗原特异性结合的分子。在另一优选的实施方式中,单体多肽中的两种包含能够与肿瘤相关抗原特异性结合的分子。在另一优选的实施方式中,单体多肽中的三种包含能够与肿瘤相关抗原特异性结合的分子。
术语“特异性结合”已经在上文关于TNFR家族成员的激动剂进行了详细定义,并且同样适用于能够与肿瘤相关抗原特异性结合的区域。
如本文中使用的,术语“肿瘤相关抗原”或“TAA”意为可以允许将患者的癌症状况或类型与适当的免疫治疗产品或方案相匹配的任何抗原。TAA可能由癌细胞本身表达,或者它们可能与肿瘤的非癌性成分诸如肿瘤相关的新生血管或其他间质相关。在由肿瘤细胞表达并能够充当免疫效应机制蛋白质的靶标的肿瘤抗原中,通常包括糖蛋白、肽、碳水化合物和糖脂。肿瘤相关抗原的非限制性实例包括:AFP(甲胎蛋白(α-胎蛋白))、AIM-2(黑色素瘤中缺乏的干扰素诱导蛋白2)、ART-4(T细胞识别的腺癌抗原4)、BAGE(B抗原)、BCMA,CAMEL(黑色素瘤上CTL识别的抗原)、CD19、CD20、CD22、CD30、CD33、CD123、CEA(癌胚抗原)、DAM(分化抗原黑色素瘤)、Ep-CAM(上皮细胞粘附分子)、ErB3、FAP、gpA33、Her2、IGF-1R、MAGE(黑色素瘤抗原)、MART-1/Melan-A(T细胞识别的黑色素瘤抗原-1/黑色素瘤抗原A)、MC1R(黑皮质素1受体)、MET、MUC-1、NY-ESO-1(纽约食管鳞状细胞癌1)、OA1(眼白化病1型蛋白)、P-Cacherin、PD-L1、PSMA(前列腺特异性膜抗原)、SART-1、-2、-3(鳞状抗原排斥肿瘤1、2、3)、存活素-2B(内含子2保留存活蛋白)、TRP(酪氨酸酶相关蛋白)。抗原可以在肿瘤细胞的表面表达或它们可以被分泌。在优选的实施方式中,抗原是细胞表面抗原。本领域技术人员可以使用例如SEREX(通过重组表达克隆对抗原的血清学鉴定)来确定患者中针对潜在的肿瘤抗原的血清抗体的存在,从而通过使血清与源自肿瘤细胞的cDNA文库反应来鉴定靶抗原。
在一种实施方式中,TAA是EGFR。
在另一实施方式中,TAA是CEA。
在一种实施方式中,能够与TAA特异性结合的区域在所述TAA上不具有激动剂能力。
在一种实施方式中,能够与TAA特异性结合的区域是抗体,更优选地是“单链抗体”、纳米抗体或“非免疫球蛋白剂”。该术语已经在上文TNFR家族共刺激受体的激动剂的上下文中定义,并且同样适用于能够与肿瘤相关抗原特异性结合的区域。
在优选的实施方式中,能够与TAA特异性结合的分子相对于同三聚化结构域定位于N-末端或C-末端。
在优选的实施方式中,如果能够与TNFR家族共刺激受体特异性结合的分子相对于同三聚化结构域定位于N-末端,则能够与肿瘤相关抗原特异性结合的分子相对于同三聚化结构域定位于C-末端。在另一优选的实施方式中,如果能够与肿瘤相关抗原特异性结合的分子相对于同三聚化结构域定位于C-末端,则能够与抗原TNFR家族共刺激受体特异性结合的分子相对于同三聚化结构域定位于N-末端。
在优选的实施方式中,肿瘤相关抗原是表皮生长因子受体(EGFR)。如本文中使用的,术语“表皮生长因子受体”或“EGFR”是跨膜蛋白,其为细胞外蛋白配体的表皮生长因子家族(EGF家族)的成员的受体。它是指调节信号传导途径以及细胞的生长和存活,并显示出对EGF分子的亲和力的酪氨酸激酶。ErbB受体家族由四个密切相关的亚型组成:ErbB1(表皮生长因子受体[EGFR])、ErbB2(HER2/neu)、ErbB3(HER3)和ErbB4(HER4)及其变体(例如Humphrey等(Proc.Natl.Acad.Sci.USA,1990,87:4207-4211)中的缺失突变体EGFR)。能够与EGFR结合的分子的非限制性实例包括:天然配体表皮生长因子(EGF)、β纤维素(BTC)、结合肝素的EGF样生长因子(HB-EGF)、双调蛋白(AR)、表皮调节素(EPR)、转化生长因子-α(TGF-α)和epigen(EPG)。在一种实施方式中,能够与EGFR特异性结合的分子没有激动剂能力。在优选的实施方式中,EGFR是人的。
在优选的实施方式中,抗EGFR抗体是scFv、纳米抗体或抗体模拟物。
在另一优选的实施方式中,抗EGFR抗体是EGA1纳米抗体。在更优选的实施方式中,Ega1(VHH)核苷酸序列是SEQ ID NO 3。在更优选的实施方式中,Ega1(VHH)氨基酸序列是SEQ ID NO 4。在更优选的实施方式中,Ega1 CDR序列是CDR1(SEQIDID 5)、CDR2(SEQ ID NO6)和CDR3(SEQ ID NO 7)。
在另一优选的实施方式中,肿瘤相关抗原是癌胚抗原(CEA)。如本文中使用的,术语“癌胚抗原”或“CEA”,也称为CEACAM1、BGP1、BGPI、CD66a、BGP,是指癌胚抗原相关的细胞粘附分子1。编码所述蛋白质的人基因在Ensembl数据库中以登录号ENSG00000079385显示。
同三聚化结构域、TNFR家族共刺激受体的激动剂和能够与肿瘤相关抗原特异性结合的可选区域之间的接头区域。
形成根据本发明的TPC的单体多肽的不同元件可以彼此直接连接或可以通过氨基酸间隔物或接头连接。
在一种实施方式中,TNFR家族共刺激受体的激动剂和同三聚化直接连接。在一种实施方式中,同三聚化和能够与肿瘤相关抗原特异性结合的区域直接连接。在另一实施方式中,TNFR家族共刺激受体的激动剂和同三聚化直接连接,并且同三聚化结构域和能够与肿瘤相关抗原特异性结合的区域直接连接。
在另一实施方式中,TNFR家族共刺激受体的激动剂和同三聚化结构域通过氨基酸接头或间隔物连接。在一种实施方式中,同三聚化结构域和能够与肿瘤相关抗原特异性结合的区域通过氨基酸接头或间隔物连接。在另一实施方式中,TNFR家族共刺激受体的激动剂和同三聚化结构域通过氨基酸接头连接,并且同三聚化结构域和能够与肿瘤相关抗原特异性结合的区域通过氨基酸间隔物连接。
如本文中公开的,间隔物是连接或联接具有适当长度和特征的肽的插入物。通常,所述间隔物充当所述结构域之间的铰链区,允许它们彼此独立地移动,同时保持各个结构域的三维形式。在这个意义上,优选的间隔物将是铰链区域,其特征在于允许这种移动的结构延性或柔性。间隔物的长度可以变化;通常,间隔物中的氨基酸数目是100个或更少的氨基酸,优选50个或更少的氨基酸,更优选40个或更少的氨基酸,再更优选30个或更少的氨基酸,或甚至更优选20个或更少的氨基酸。
替代地,合适的间隔物可以基于小鼠IgG3上游铰链区的10个氨基酸残基的序列;该序列已用于通过卷曲螺旋产生二聚抗体(Pack P.and Pluckthun,A.,1992,Biochemistry 31:1579-1584),并且可用作根据本发明的间隔物肽。它也可以是人IgG3或其他人Ig亚类(IgG1、IgG2、IgG4、IgM和IgA)的上游铰链区的相应序列。预期人Ig的序列在人类中不具有免疫原性。可用于本发明的另外的间隔物包括氨基酸序列GAP、AAA的肽。
在特定的实施方式中,所述间隔物是具有结构柔性的肽(即,柔性连接肽或“柔性接头”),并且包含选自由甘氨酸、丝氨酸、丙氨酸和苏氨酸组成的组的2个或更多个氨基酸。在另一特定的实施方式中,间隔物是包含氨基酸残基(特别是Gly和Ser)重复序列,或任何其他合适的氨基酸残基重复的肽。实际上,任何柔性接头都可以用作根据本发明的间隔物。
在优选的实施方式中,间隔物是柔性接头。在更优选的实施方式中,柔性接头为1至18个残基。在另一更优选的实施方式中,柔性接头为5、17或18个残基,优选为18个残基。
在优选的实施方式中,同三聚化结构域和TNFR家族共刺激受体的激动剂直接连接。在另一优选的实施方式中,同三聚化结构域和TNFR家族共刺激受体的激动剂通过柔性接头连接。在更优选的实施方式中,柔性接头为至少1、至少2、至少3、至少4、至少5、至少6、至少7、至少8、至少9、至少10、至少11、至少12、至少13、至少14、至少15、至少16、至少17或至少18个残基。在另一更优选的实施方式中,柔性接头为18个残基长。
在优选的实施方式中,同三聚化结构域和能够与肿瘤相关抗原特异性结合的区域直接连接。在另一优选的实施方式中,同三聚化结构域和能够与肿瘤相关抗原特异性结合的区域通过柔性接头连接。在更优选的实施方式中,柔性接头为至少1、至少2、至少3、至少4、至少5、至少6、至少7、至少8、至少9、至少10、至少11、至少12、至少13、至少14、至少15、至少16、至少17或至少18个残基。在另一更优选的实施方式中,柔性接头为16个残基长。
在优选的实施方式中,同三聚化结构域和TNFR家族共刺激受体的激动剂或能够与肿瘤相关抗原特异性结合的区域直接连接。在另一优选的实施方式中,同三聚化结构域和TNFR家族共刺激受体的激动剂以及和能够与肿瘤相关抗原特异性结合的区域直接连接。在优选的实施方式中,同三聚化结构域和TNFR家族共刺激受体的激动剂或和能够与肿瘤相关抗原特异性结合的区域通过柔性接头直接连接。在另一优选的实施方式中,同三聚化结构域和TNFR家族共刺激受体的激动剂以及和能够与肿瘤相关抗原特异性结合的区域通过柔性接头直接连接。
在更优选的实施方式中,柔性接头为至少1、至少2、至少3、至少4、至少5、至少6、至少7、至少8、至少9、至少10、至少11、至少12、至少13、至少14、至少15、至少16、至少17或至少18个残基。在更优选的实施方式中,柔性接头为17和/或18个残基长。在另一更优选的实施方式中,TNFR家族共刺激受体的激动剂和同三聚化结构域通过18个残基长的接头连接,和/或能够与肿瘤相关抗原特异性结合的区域和同三聚化结构域通过16个残基长的接头连接。
在优选的实施方式中,18个残基长的接头是SEQ ID NO:10。在另一优选的实施方式中,16个残基长的接头是SEQ ID NO:11。
在优选的实施方式中,TPC的至少一种单体还包含适合于检测和/或纯化三聚体多肽的标签。标签的非限制性实例包括亲和纯化标签诸如标签肽;所述标签的说明性、非限制性实例包括多组氨酸[poly(His)]序列、能够被抗体识别的肽序列,其可用于通过免疫亲和层析纯化所得融合蛋白,例如衍生自发热病毒的血细胞凝集素的表位、c-myc标签、Strep标签等。在另一优选的实施方式中,TPC的单体还包含适合于检测和/或纯化三聚体多肽的标签。
在特定的实施方式中,如果三种单体多肽中的每种包含一个亲和纯化标签,则所述标签彼此不同(例如,亲和纯化标签“a”、“b”和“c”,其中标签“a”被结合物A识别,标签“b”被结合物B识别,以及标签“c”被结合物C识别),并且对其进行三步亲和纯化程序,该三步亲和纯化程序被设计为仅允许选择性回收对相应物质(A、B和C)表现出亲和力的这样的本发明TPC。所述亲和纯化标签可直接在线融合,或替代地,通过可切割接头与单体多肽融合,所述可切割接头即包含可通过酶或化学方式(即,识别/切割位点)特异性切割的氨基酸序列的肽段。在特定的实施方式中,所述可切割接头包含可被蛋白酶诸如肠激酶、Arg C内切蛋白酶、Glu C内切蛋白酶、Lys C内切蛋白酶、因子Xa等切割的氨基酸序列;替代地,在另一特定的实施方式中,所述可切割接头包含可被化学试剂诸如例如切割甲硫氨酸残基的溴化氰或任何其他合适的化学试剂切割的氨基酸序列。如果需要随后去除亲和纯化标签,则可切割接头是有用的。
在优选的实施方式中,三种单体多肽包含相同的亲和纯化标签。标签可以位于单体的任何位置,特别是在同三聚化结构域的C末端或N末端。在更优选的实施方式中,标签在TNFR家族共刺激受体的激动剂的N-末端。在更优选的实施方式中,标签是His6-myc标签或strep-Flag标签。在更优选的实施方式中,标签是flap标签SEQ ID NO:8和/或StrepII标签SEQ ID NO:9。
在另一优选的实施方式中,单体还包含增加三聚体多肽循环半衰期的部分。根据本发明,“半衰期”是将体内化合物的浓度或量减少到给定浓度或量的一半所需的时间段。给定浓度或量不必是在观察时间内观察到的最大值,也不必是施用开始时存在的浓度或量,因为半衰期完全独立于被选为“起点”的浓度或量。
增加对于治疗性给药不是最佳的半衰期曲线的非限制性策略是本领域技术人员已知的并且包括:药理活性肽或蛋白质与天然长半衰期蛋白质或蛋白质结构域的遗传融合(例如Fc融合、转铁蛋白融合或白蛋白融合);药理活性肽或蛋白质与惰性多肽的遗传融合,所述惰性多肽例如XTEN(也称为重组PEG或“rPEG”)、同型氨基酸聚合物(HAP;HAPylation)、脯氨酸-丙氨酸-丝氨酸聚合物(PAS;PASylation)或弹性蛋白样肽(ELP;ELPylation);通过将药理活性肽或蛋白质化学缀合至重复化学部分,例如至PEG(PEGylation)或透明质酸,来增加流体动力学半径;通过聚唾液酸化作用显著增加融合药理活性肽或蛋白质的负电荷;或者,替代地,将已知延长天然蛋白质的半衰期的带负电的高度唾液酸化肽诸如人CGβ亚基(例如羧基末端肽[CTP;绒毛膜促性腺激素(CG)β链])与感兴趣的分子融合;通过将肽或蛋白质结合结构域与生物活性蛋白质附接而与通常长半衰期蛋白质诸如HSA、人IgG或转铁蛋白非共价结合;将肽或小分子与长半衰期蛋白质诸如人IgG、Fc部分或HSA化学缀合。
在优选的实施方式中,相对于没有增加TPC循环半衰期的任何部分的三聚体多肽,半衰期可以增加至少1%、至少2%、至少3%、至少4%、至少5%、至少6%、至少7%、至少8%、至少9%、至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%或至少100%。
作用于增加TPC循环半衰期的部分可存在于TPC中的一种单体、TPC中的两种单体或三种TPC单体中。此外,作用于增加TPC循环半衰期的部分可存在于单体的N-末端、单体的C-末端、相对于同三聚化结构域的N-末端或相对于同三聚化结构域的C-末端。
在另一优选实施方式中,增加三聚体多肽循环半衰期的部分是白蛋白片段或白蛋白结合部分。
术语“结合部分”是指特异性结合独立于不同的表位或抗原结合结构域之外的抗原或表位的结构域。结合部分可以是结构域抗体(dAb)或者可以是为非免疫球蛋白蛋白质支架(例如,选自由CTLA-4、脂质运载蛋白(lipocalin)、SpA、adnectin、affibody、avimer、GroEl、转铁蛋白、GroES和纤维连接蛋白组成的组的支架)的衍生物的结构域,其结合至除天然配体以外的配体。在优选实施方式中,该部分结合血清白蛋白。
在第二方面,本发明涉及编码形成根据本发明的三聚体多肽的一部分的至少一种单体多肽的多核苷酸。
如本文使用的,术语“多核苷酸”是指具有脱氧核糖核苷酸或核糖核苷酸碱基的单链或双链聚合物。在特定的实施方式中,多核苷酸具有核糖核苷酸碱基。在优选的实施方式中,多核苷酸具有脱氧核糖核苷酸碱基。在更优选的实施方式中,多核苷酸编码形成根据本发明的三聚体多肽的一部分的至少一种、至少两种、至少三种单体多肽。
在优选的实施方式中,多核苷酸还包含编码信号序列的序列,该编码信号序列的序列相对于编码多肽的序列位于5',并且与所述序列在相同的开放阅读框中。如本文中使用的,术语“信号序列”或“信号肽”是指长度相对短的肽,通常在5至30个氨基酸残基之间,其将细胞中合成的蛋白质导向分泌途径。信号肽通常包含一系列具有二级α螺旋结构的疏水氨基酸。另外,许多肽包括一系列带正电荷的氨基酸,这些氨基酸可以促使蛋白质采用合适的拓扑结构进行其转位。信号肽倾向于在其羧基端具有用于被肽酶识别的基序,该肽酶能够水解信号肽,从而产生游离的信号肽和成熟的蛋白质。一旦目的蛋白到达合适的位置,就可以切割信号肽。在本发明中可以使用任何信号肽。在优选的实施方式中,信号序列是抑瘤素M的信号序列。
先前描述的所有术语和实施方式同样适用于本发明的该方面。
在第三方面,本发明涉及包含根据本发明的多核苷酸的载体。
如本文中使用的,术语“载体”或“表达载体”是指用于在细胞优选真核细胞中表达至少一种多核苷酸的复制性DNA构建体。表达载体的选择将取决于宿主的选择。可以使用多种表达宿主/载体组合。用于真核宿主的有用的表达载体包括,例如,包含来自SV40、牛乳头瘤病毒、腺病毒和巨细胞病毒的表达控制序列的载体。用于细菌宿主的有用的表达载体包括已知的细菌质粒,诸如来自大肠杆菌(Escherichia coli)的质粒,包括pCR1、pBR322、pMB9及其衍生物,更广泛的宿主范围质粒,诸如M13和丝状单链DNA噬菌体。这些载体可包含另外的独立盒以表达选择标记,所述选择标记将用于最初选择在转化方案期间已并入外源DNA的克隆。表达载体优选包含复制起点。表达载体还可以包含一个或多个多克隆位点。
表达载体还可包含原核生物中的复制起点,这是载体在细菌中增殖必需的。另外,表达载体还可包含细菌的选择基因,例如编码赋予对抗生素(例如氨苄青霉素、卡那霉素、氯霉素等)的抗性的蛋白质的基因。表达载体还可包含一个或多个多克隆位点。多克隆位点是包含一个或多个独特限制位点的多核苷酸序列。限制位点的非限制性实例包括EcoRI、SacI、KpnI、SmaI、XmaI、BamHI、XbaI、HincII、PstI、SphI、HindIII、AvaI或其任何组合。
在本发明的载体中表达的一种或多种多核苷酸以及用于制备本发明的表达载体所必需的RNA或DNA构建体可以通过一般实验室手册中包括的常规分子生物学方法来获得,例如在“分子克隆:实验室手册(Molecular cloning:a laboratory manual)”(JosephSambrook,David W.Russel编辑,2001,第3版,冷泉港实验室,纽约)或“分子生物学实验指南(Current protocols in molecular biology)”(F.M.Ausubel,R.Brent,R.E.Kingston,D.D.Moore,J.A.Smith,J.G.Seidman和K.Struhl编辑,第2卷,格林出版协会和威利交叉科学(Greene Publishing Associates and Wiley Interscience),纽约,2006年9月更新)中的。
先前描述的所有术语和实施方式同样适用于本发明的该方面。
在另一方面,本发明涉及包含如前所述的载体的宿主细胞。
使用术语“宿主细胞”使得其不仅指特定的受试者细胞,而且也指这种细胞的子代或潜在子代。因为由于突变或环境影响,某些修饰可以在后代中发生,所以这类子代实际上可以与亲本细胞不同,但仍包括在本文所用术语的范围内。宿主细胞可以是任何原核(例如,大肠杆菌)或真核细胞(例如,酵母、昆虫或植物细胞),其可以通过传统遗传工程技术制备,所述传统遗传工程技术包括将本发明的核酸插入合适的表达载体中,用载体转化合适的宿主细胞,以及在允许表达构成本发明TPC的单体多肽的多肽部分的条件下培养宿主细胞。可将本发明的核酸置于合适的启动子的控制下,所述启动子可以是诱导型或组成型启动子。根据表达系统,可以从宿主细胞的细胞外相、周质或从细胞质中回收多肽。
合适的载体系统和宿主细胞是本领域众所周知的,如技术人员可获得的大量文献和材料所证明的。由于本发明还涉及本发明的核酸在载体的构建和在宿主细胞中的用途,因此以下提供了关于这种用途的一般性讨论以及在实践本发明这一方面时的具体考虑。
一般来说,原核生物优选用于本发明核酸的初始克隆和构建本发明的载体。例如,除了在下面更具体的公开中提到的特定菌株之外,还可以作为示例提及菌株诸如大肠杆菌K12菌株294(ATCC No.31446)、大肠杆菌B和大肠杆菌X 1776(ATCC No.31537)。当然,这些实例是旨在为了说明而不是限制。
原核生物也可用于表达,因为有效的纯化和蛋白质折叠策略是可用的。可以使用上述菌株以及大肠杆菌W3110(F-、λ-、原养型、ATCC No.273325)、杆菌诸如枯草杆菌(Bacillus subtilis)或其他肠杆菌科(enterobacteriaceae)诸如鼠伤寒沙门氏菌(Salmonella typhimurium)或粘质沙雷氏菌(Serratia marcesans)以及各种假单胞菌(Pseudomonas)属。
一般来说,将含有源自与宿主细胞相容的物种的复制子和控制序列的质粒载体与这些宿主关联使用。载体通常携带复制位点以及能够在转化细胞中提供表型选择的标记序列。例如,通常使用源自大肠杆菌物种的质粒pBR322转化大肠杆菌。pBR322质粒含有氨苄青霉素和四环素抗性基因,并因此为鉴定转化细胞提供了简便的方法。pBR322质粒或其他微生物质粒或噬菌体也必须含有或经修饰以含有可被微生物用于表达的启动子。
在重组DNA构建中最常用的那些启动子包括B-内酰胺酶(青霉素酶)和乳糖启动子系统以及色氨酸(trp)启动子系统(EP36776)。尽管这些是最常用的,但已经发现并利用了其他微生物启动子,并且已经公开了有关其核苷酸序列的详细信息,从而使技术人员能够用质粒载体将它们功能性连接。来自原核生物的某些基因可以由其自身的启动子序列在大肠杆菌中有效表达,从而无需通过人工方式添加其他启动子。
除了原核生物之外,还可以使用真核微生物,诸如酵母培养物。在真核微生物中最常用的是酿酒酵母(Saccharomyces cerevisiase)或普通的面包酵母,尽管许多其他菌株也普遍可用。对于在酵母属中的表达,通常使用例如质粒YRp7。该质粒已经含有trp1基因,其为缺乏在色氨酸中生长的能力的酵母突变菌株例如ATCC No.44076或PEP4-1提供选择标记(Jones,1977,Genetics,85:23-33).。然后,作为酵母宿主细胞基因组的特征的trpl损伤的存在为在缺乏色氨酸的情况下检测生长转化提供了有效的环境。
酵母载体中合适的启动序列包括3-磷酸甘油酸激酶或其他糖酵解酶诸如烯醇化酶、甘油醛-3-磷酸脱氢酶、己糖激酶、丙酮酸脱羧酶、磷酸果糖激酶、葡萄糖-6-磷酸异构酶、3-磷酸甘油酸变位酶、丙酮酸激酶、磷酸丙糖异构酶、磷酸葡萄糖异构酶和葡萄糖激酶的启动子。在构建合适的表达质粒时,与这些基因相关的终止序列也被连接到期望被表达的序列的表达载体3’中,以提供mRNA的聚腺苷酸化和终止。
具有由生长条件控制的转录的额外优势的其他启动子是醇脱氢酶-2、异细胞色素C、酸性磷酸酶、与氮代谢相关的降解酶以及上述甘油醛-3-磷酸脱氢酶以及负责麦芽糖和半乳糖利用的酶的启动子区域。任何包含酵母相容性启动子、复制起点和终止序列的质粒载体都是合适的。
除微生物外,来源于多细胞生物的细胞培养物也可用作宿主。原则上,任何这样的细胞培养物都是可行的,无论是来自脊椎动物还是无脊椎动物培养物。但是,对脊椎动物细胞的兴趣最大,并且近年来,培养(组织培养)中脊椎动物的增殖已成为常规程序。这种有用的宿主细胞系的实例是VERO和HeLa细胞、中国仓鼠卵巢(CHO)细胞系以及W138、BHK、COS-7、人胚肾(HEK)293和MDCK细胞系。另外,杆状病毒-昆虫细胞表达系统被广泛用于生产重组蛋白和抗体。
这些细胞的表达载体通常包括(如果需要的话)复制起点、位于要表达的基因的前面的启动子,以及任何必要的核糖体结合位点、RNA剪接位点、聚腺苷酸化位点和转录终止子序列。
为了在哺乳动物细胞中使用,表达载体上的控制功能通常由病毒材料提供;例如,常用的启动子来源于多瘤病毒、腺病毒2、巨细胞病毒(CMV)和最常见的猿猴病毒40(SV40)。SV40病毒的早期和晚期启动子特别有用,因为两者作为也含有SV40病毒复制起点的片段容易从病毒获得。也可使用较小或较大的SV40片段,只要其中包含从HindIII位点向位于病毒复制起点的BglI位点延伸的约250bp序列即可。此外,利用通常与所需基因序列相关的启动子或控制序列也是可能的,并且通常是合乎需要的,条件是这样的控制序列与宿主细胞系统相容。
复制起点可以通过构建载体以包括外源起点诸如可以源自SV40或其他病毒(例如,多瘤病毒、腺病毒等)来提供,也可以由宿主细胞染色体复制机制来提供。如果载体整合到宿主细胞染色体中,则后者通常就足够了。
在产生构成本发明的TPC的单体多肽时,可能有必要进一步加工多肽,例如,通过在多肽中引入非蛋白质功能,通过使材料经受合适的重折叠条件(例如,通过使用WO 94/18227中建议的普遍适用的策略),或通过切除单体的不希望的肽部分(例如,在终产物中不需要的表达增强肽片段)。
鉴于以上讨论,用于重组产生本发明的所述TPC或构成本发明的TPC的所述单体多肽的方法也是本发明的一部分,携带和/或能够在宿主细胞或细胞系中复制本发明的核酸的载体也是本发明的一部分。根据本发明,表达载体可以是例如病毒、质粒、粘粒、微小染色体或噬菌体。
本发明的另一方面是在上述方法中有用的携带并能够复制本发明的核酸的转化细胞(即,本发明的宿主细胞);宿主细胞可以是微生物,诸如细菌、酵母或原生动物,或衍生自多细胞生物的细胞,诸如真菌、昆虫细胞、植物细胞或哺乳动物细胞。细胞也可以被转染。
本发明的又一方面涉及产生构成本发明的TPC或其多肽部分的单体多肽的稳定细胞系,并且优选地该细胞系携带并表达本发明的核酸。衍生自哺乳动物细胞系HEK和CHO的细胞尤其令人感兴趣。
先前描述的所有术语和实施方式同样适用于本发明的该方面。
在另一方面,本发明涉及用于产生根据本发明的三聚体多肽的方法,其包括从包含携带并表达根据本发明的多核苷酸的宿主细胞的培养物中分离所述三聚体多肽,并且任选地使所述三聚体多肽进行进一步加工。
本发明的TPC可以通过本领域通常已知的方法,例如基于重组蛋白生产的技术来制备。因此,本发明还涉及制备本发明的TPC的方法,该方法包括从包含携带并表达编码本发明的TPC的至少一种单体多肽的核酸片段的宿主细胞的培养物中分离本发明的TPC,以及任选地,对本发明的TPC进行进一步处理。
当本发明的TPC是同三聚体时,用于重组产生所述同三聚体的方法包括将本发明的核酸插入合适的表达载体中,用该载体转化合适的宿主细胞,并在允许根据本发明的单体多肽的表达及其三聚化的条件下培养宿主细胞。当本发明的TPC是异三聚体时,所述异三聚体可包含(i)仅一种单体多肽与其他两种单体多肽(这两种单体多肽彼此相同)不同,或(ii)三种不同的单体多肽。
先前描述的所有术语和实施方式同样适用于本发明的该方面。
在另一方面,本发明涉及包含根据本发明的三聚体多肽的药物组合物。
根据本发明的TPC可以是包含适合于向受试者施用的负载体的药物组合物的一部分,使得TPC将以适合于该目的的药物剂型向受试者施用,并且将包括至少一种药学上可接受的负载体。因此,在特定的实施方式中,TPC将是除了包含TPC作为活性成分外还包含至少一种负载体优选药学上可接受的负载体的药物组合物的一部分。术语“负载体”通常包括与活性成分一起施用的任何稀释剂或赋形剂。优选地,所述负载体是用于将其向受试者施用的药学上可接受的负载体,即,它是由监管机构(例如,欧洲药品管理局(EMA)、美国食品&药品管理局(FDA)等)批准的负载体(例如,赋形剂),或包括在用于动物且特别是人的通常公认的药典(例如,欧洲药典、美国药典等)中的负载体。
TPC可溶解在任何合适的介质中进行施用。活性成分可以溶解、悬浮于其中或与其形成乳剂的介质的非限制性说明性实例包括:水、乙醇、水-乙醇或水-丙二醇混合物等;油,包括衍生自石油的油、动物油、植物油或合成油,诸如花生油、大豆油、矿物油、芝麻油等;有机溶剂,诸如:丙酮、甲醇、乙醇、乙二醇、丙二醇、甘油、二乙酯、氯仿、苯、甲苯、二甲苯、乙苯、戊烷、己烷、环己烷、四氢呋喃、四氯化碳、氯仿、二氯甲烷、三氯乙烯、全氯乙烯、二甲基亚砜(DMSO)。
同样地,还包括旨在于使用前即时转化为用于口服或肠胃外施用的液体形式制剂的药物组合物的固体形式制剂。这类液体形式包括溶液剂、混悬剂和乳剂。关于活性成分的不同药物剂型、要使用的负载体及其制造方法的综述,可参见例如Tratado de FarmaciaGalénica,C.Faulíi Trillo,Luzán 5,S.A.de Ediciones,1993以及《雷明顿药学大全(Remington′s Pharmaceutical Sciences)》(A.R.Gennaro编辑)第20版,Williams&Wilkins PA,美国(2000)。
以非限制性的方式,TPC的施用途径包括非侵入性药理施用途径诸如口服、胃肠道、鼻或舌下途径,以及侵入性施用途径诸如肠胃外途径等。在特定的实施方式中,TPC以药物剂型通过肠胃外途径(例如,皮内、肌内、腹膜内、静脉内、皮下、鞘内等)的方式施用。“通过肠胃外途径的方式施用”应理解为由通过注射的方式施用目的化合物组成的施用途径,因此需要使用注射器和针头。根据针到达的组织有不同类型的肠胃外穿刺:肌内(将化合物注射到肌肉组织中)、静脉内(将化合物注射到静脉中)、皮下(皮肤下注射)和皮内(在皮肤层间注射)。鞘内途径用于将不能很好地穿透血脑屏障的药物施用于中枢神经系统中,使得药物被施用于脊髓周围的空间(鞘内空间)。在优选的实施方式中,施用是皮内、肌内、腹膜内、静脉内、皮下或鞘内施用。
在另一方面,根据本发明的TPC用于治疗癌症。如本文中使用的,术语“治疗”是指具有终止、改善或降低患癌症的易感性的目的的任何类型的治疗。因此,“治疗”、“治疗”及其等同术语是指获得药理或生理上期望的效果,涵盖哺乳动物包括人中的任何癌症治疗。就提供对疾患和/或归因于其的副作用的完全或部分预防而言,该作用可以是预防性的。换言之,“治疗”包括(1)抑制疾病,例如停止其发展,(2)中断或终止疾患或至少与之相关的症状,因此患者将不再患有该疾患或其症状,例如,通过恢复或修复丧失的、缺失的或有缺陷的功能,或刺激无效的过程,导致疾患或其症状的消退,或(3)减轻、缓解或改善疾病或与之相关的症状,其中减轻在广义上用于指至少减轻参数或症状诸如炎症、疼痛、呼吸困难或无法独立活动的程度。
如本文公开的,术语“癌症”和“肿瘤”涉及以不受调节的细胞生长为特征的哺乳动物的生理状况。癌症的实例包括但不限于肾上腺、骨、脑、乳腺、支气管、结肠和/或直肠、胆囊、胃肠道、头和颈、肾、喉、肝、肺、神经组织、胰腺、前列腺、甲状旁腺、皮肤、胃和甲状腺的癌症。癌症的其他实例包括腺癌、腺瘤、基底细胞癌、宫颈非典型增生和原位癌、尤因氏(Ewing's)肉瘤、表皮样癌、巨细胞瘤、多形性胶质母细胞瘤、毛细胞瘤、肠神经节神经瘤、增生性角膜神经瘤、胰岛细胞癌、卡波济氏(Kaposi's)肉瘤、平滑肌瘤、白血病、淋巴瘤、恶性类癌、恶性黑色素瘤、恶性高钙血症、类马方氏肿瘤(marfanoid habitus tumor)、髓样癌、转移性皮肤癌、粘膜神经瘤、骨髓增生异常综合征、骨髓瘤、蕈样肉芽肿、神经母细胞瘤、骨肉瘤、成骨肉瘤和其他肉瘤、卵巢肿瘤、嗜铬细胞瘤、真性红细胞增多症、原发性脑肿瘤、小细胞肺肿瘤、溃疡性和乳头型鳞状细胞癌、精原细胞瘤、软组织肉瘤、视网膜母细胞瘤、横纹肌肉瘤、肾细胞瘤或肾细胞癌、veticulum细胞肉瘤和威尔姆氏(Wilm's)瘤。癌症的实例还包括星形细胞瘤、胃肠道间质瘤(GIST)、神经胶质瘤或胶质母细胞瘤、肾细胞癌(RCC)、肝细胞癌(HCC)和胰腺神经内分泌癌。
根据本发明的三聚体多肽复合物可用于治疗任何癌症或肿瘤,诸如但不限于乳腺、心脏、肺、小肠、结肠、脾、肾、膀胱、头、颈、卵巢、前列腺、脑、胰腺、皮肤、骨、骨髓、血液、胸腺、子宫、睾丸和肝脏肿瘤。
在多种实施方式中,所治疗的患者的癌症是转移性癌症或一线、二线或三线治疗难以治愈的难治性和/或复发性癌症。另一实施方式中,治疗是一线、二线或三线治疗。如本文中使用的,短语“一线”或“二线”或“三线”是指患者接受的治疗的顺序。一线治疗方案是首先给予的治疗,而二线或三线治疗分别在一线治疗后或二线治疗后给予。因此,一线治疗是疾病或病症的第一治疗。在患有癌症的患者中,初级治疗可以是手术、化学疗法、放射疗法或这些疗法的组合。一线治疗也被本领域技术人员称为初级疗法或初级治疗。通常,对患者给予后续的化学疗法方案是因为患者对一线治疗未显示积极的临床反应或仅显示亚临床反应,或者一线治疗已停止。在本文中,“化学疗法”以其最广泛的意义使用,以不仅包括经典的细胞毒性化学疗法,还包括分子靶向疗法和免疫疗法。
在优选的实施方式中,癌症对于肿瘤相关抗原呈阳性,该肿瘤相关抗原被能够特异性结合三聚体多肽中存在的肿瘤相关抗原的分子特异性识别。在更优选的实施方式中,癌症是EGFR阳性的。
如本文中使用的,术语“阳性”是指TAA,表示肿瘤或癌症中TAA的“量”或“水平”高于在非阳性肿瘤或正常细胞中所观察到的量或水平。表达水平可以通过本领域技术人员已知并且也在本文中公开的方法来测量。术语“表达的水平”或“表达水平”通常是指生物样品中生物标志物的量。“表达”通常是指将信息(例如,基因编码和/或表观遗传信息)转化为细胞中存在并起作用的结构的过程。因此,如本文中使用的,“表达”可指转录成多核苷酸、翻译成多肽,或者甚至是多核苷酸和/或多肽修饰(例如,多肽的翻译后修饰)。转录的多核苷酸、翻译的多肽或多核苷酸和/或多肽修饰(例如,多肽的翻译后修饰)的片段也应视为是被表达的,无论它们来源于通过可变剪接产生的转录物或降解的转录物,还是来源于多肽的翻译后加工,例如通过蛋白水解。“表达的基因”包括转录成作为mRNA的多核苷酸并然后翻译成多肽的那些基因,以及被转录成RNA但未被翻译成多肽的那些基因(例如,转运RNA和核糖体RNA)。
“表达增加”、“表达水平增加”、“水平增加”、“表达升高”、“表达水平升高”或“水平升高”可互换使用,是指相对于对照(诸如没有疾病或病症(例如癌症)的一个或多个个体)、内部对照(例如管家生物标志物)或一组/一群患者的样本中生物标志物的中位表达水平,个体中生物标志物的表达增加或水平增加。
在更优选的实施方式中,癌症是结肠直肠癌、肺癌、乳腺癌、胰腺癌、肾癌、头颈癌、胃癌、食道癌、妇科癌、前列腺癌、尿路上皮癌、神经系统癌和血液系统癌。在另一优选的实施方式中,妇科癌是卵巢癌、子宫颈癌和/或子宫内膜癌;神经系统癌是多形性胶质母细胞瘤;血液系统癌是急性骨髓性白血病。
先前描述的所有术语和实施方式同样适用于本发明的该方面。
***
将通过以下实施例描述本发明,这些实施例应被认为仅仅是说明性的,而不是对本发明范围的限制。
实施例
抗体和试剂
使用的单克隆抗体(mAb)包括:小鼠IgG
细胞和培养条件
在补充了10%热灭活的胎牛血清(FBS)(Sigma-Aldrich)、2mM L-谷氨酰胺、100U/ml青霉素和100μg/ml链霉素(Thermo Fisher Scientific)的Dulbecco’s改良的Eagle's培养基(DMEM)(Lonza,美国马里兰州沃克斯维尔),称为DMEM完全培养基(DCM)中培养HEK293(人类胚胎肾上皮细胞,CRL-157)、NIH/3T3(小鼠胚成纤维细胞,CRL-1658)和A431(人表皮样癌,CRL-1555)细胞。所有细胞系均获自美国典型培养物保藏中心(美国马里兰州罗克维尔)。将表达m4-1BB的HEK293细胞(HEK239
小鼠
C57BL/6、BALB/c、Hsd:ICR(CD-1)和Hsd:无胸腺裸-Foxn1 nu雌性小鼠购自HarlanIberica(Envigo,西班牙巴塞罗那)。在每天光照/黑暗循环(12小时)下,在20-22℃的恒定温度和相对湿度(45-65%)下,当必要时在无菌条件下饲养动物。当必要时在层流通风橱中进行操作,并随意提供无菌水和食物。动物实验方案已得到参与机构的各自的动物实验伦理委员会的批准:Instituto Investigación Sanitaria Puerta de Hierro-Segovia deArana(Hospital Universitario Puerta de Hierro Majadahonda,西班牙马德里)、Intituto de Investigaciones Biomédicas"Alberto Sols"(IIBm)(CSIC-UAM,马德里)以及实验动物应用研究平台(Parc Científic,西班牙巴塞罗那)。马德里自治政府环境事务委员会动物福利部(PROEX编号66/14、430/15、264/16)和加泰罗尼亚政府的伦理委员会(程序编号9912)另外批准了该程序。
表达载体的构建
用引物SfiI-1D8-Fw和NotI-1D8-Rv对编码1D8 scFv
为了构建质粒pCR3.1-1D8
重组抗体的表达和纯化
通过磷酸钙沉淀法用合适的表达载体转染HEK293细胞,并且在具有500μg/mLG418的DCM中进行选择,以生成稳定的细胞系HEK293-1D8
Western印迹
在还原条件下,将蛋白质样品在10-20%的Tris-甘氨酸凝胶上分离,并转移到硝酸纤维素膜(Thermo Fisher Scientific)上,并用抗c-myc或抗FLAG mAb进行探测,然后与DyLight800缀合的山羊抗小鼠IgG孵育。用
ELISA
将m4-1BB(3μg/ml)或hEGFR(5μg/ml)二者固定在Maxisorp ELISA平板(NUNC品牌产品,丹麦罗斯基勒)上,在4℃下过夜。在用200μl PBS-5%BSA洗涤并阻断后,添加100μl的条件培养基或1μg/ml的纯化的蛋白溶液,并在室温下孵育1小时。将孔用PBS0.05%吐温20洗涤3次,然后添加100μl的抗c-myc mAb或抗FLAG mAb,在室温下孵育1小时。如上所述洗涤平板,并向每个孔中添加100μl的HRP缀合的山羊抗小鼠IgG。然后,洗涤平板并使用OPD(Sigma-Aldrich)显影。对于竞争性ELISA,将m4-1BB(3μg/ml)在4℃下固定过夜。洗涤并阻断后,将重组m4-1BBL以所需浓度添加至孔中保持1小时。然后,将纯化的抗体溶液在阻断缓冲液中连续稀释,添加到孔中,并在室温下孵育1小时。按照标准的洗涤步骤,添加抗FLAGmAb溶液1小时。洗涤后,添加HRP缀合的山羊抗小鼠IgG,并使用OPD显影。
流式细胞术
通过流式细胞术分析了m4-1BBL、1D8
质谱
使用
尺寸排阻色谱-多角度激光光散射(SEC-MALS)
在室温下使用在线连接到DAWN-HELEOS光散射检测器和Optilab rEX差示折光率检测器(Wyatt Technology,美国加利福尼亚州圣巴巴拉)的Superdex 200Increase 10/300GL柱(GE Healthcare)进行静态光散射实验。该柱具有的排阻体积为8.6mL,并且在任何注射中均未观察到吸光度(无聚集的蛋白质)。用运行缓冲液(PBS+150mM NaCl,0.1μm过滤的)平衡柱,并用在相同缓冲液中1g/L的BSA的样品校准SEC-MALS系统。然后以0.5mL/分钟的流速,将运行缓冲液中1g/L的两种抗体1D8
圆二色性
用Jasco J-810分光偏振计(JASCO,日本东京)进行圆二色性测量。在25℃下,使用0.2cm路径长度的石英比色皿在以0.2g/L于PBS中的蛋白质样品上记录光谱。在相同的蛋白质样品和比色皿中,通过以1℃/分钟的速度升高温度并测量218nm的椭圆率变化,记录从10至95℃的热变性曲线。
小角X射线散射(SAXS)
在Diamond Light Source(Didcot,英国)的光束线B21上进行SAXS实验。在收集数据之前,在4℃下浓缩并制备蛋白质。在Shodex Kw-403柱中通过在线Agilent 1200HPLC系统,使用由50mM Tris pH 7.5+150mM NaCl组成的运行缓冲液,在4℃下递送40μl的浓度为3和6mg/mL的1D8
使用生物膜层干涉技术的动力学测量
在Octet RED96系统(Fortebio,美国加利福尼亚州门洛帕克)上研究了固定化的m4-1BB与分析物1D8 IgG、1D8
在Octet RED96系统(Fortebio,美国加利福尼亚州门洛帕克)上使用生物膜层干涉技术(BLI)研究了1D8
细胞粘附测定
用(2μg/孔)hCEA或从Engelbreth-Holm-Swarm小鼠肿瘤(Sigma-Aldrich)提取的(1μg/孔)层粘连蛋白-111(Lm111)在4℃下过夜包被96孔微量滴定板(Corning Costar,美国马萨诸塞州剑桥)。在洗涤并在37℃下用200μl 3%BSA-DMEM阻断1小时之后,在4℃下添加纯化的1D8N18或1D8N/CCEA.1的适当稀释液1小时。在洗涤后,在无血清培养基中每孔上样5×104HEK293或HEK239m4-1BB细胞,并在湿润的5%CO
血清稳定性
将纯化的1D8
T细胞共刺激测定
将山羊抗仓鼠IgG在96孔板(5μg/ml)中预包被过夜,并在用200μl的补充有热灭活的10%FBS、2mM L-谷氨酰胺、100U/ml青霉素、100μg/ml链霉素和50μM 2-巯基乙醇(ThermoFisher Scientific)的RPMI(Lonza)(称为RPMI完全培养基(RCM))中阻断后,添加抗小鼠CD3 mAb(1μg/ml),并在37℃下孵育1小时。然后添加RCM中的纯化的小鼠CD8a
抗原特异性T细胞共刺激测定
对于用纯化的hEGFR的研究,用山羊抗仓鼠IgG(5μg/ml)和hEGFR(5μg/孔)在4℃下过夜预包被96孔板。在用200μl的RCM阻断后,添加抗小鼠CD3 mAb(1μg/ml)并在37℃下孵育1小时,然后添加纯化的小鼠CD8a
在4℃下于96孔板中过夜预包被(5μg/ml)山羊抗仓鼠IgG(JacksonImmunoResearch)和hCEA。在阻断后,添加1μg/ml抗CD3e mAb(克隆145-2C11;Immunostep,西班牙萨拉曼卡),并在37℃下孵育1小时。将来自C57BL/6小鼠脾的纯化CD8a+T细胞(CD8a+T细胞分离试剂盒,小鼠,Miltenyi Biotec,GmbH)添加(2×105/孔)到具有6.67nM的纯化抗体的完全RPMI+50μM 2-巯基乙醇中。作为对照,将纯化的小鼠CD8a+T细胞与固定化的抗CD3e mAb单独培养。72小时后,使用Tecan Infinite F200板读数光度计通过CellTiter-Glo发光测定法(Promega)评估细胞增殖,然后收集上清液并通过ELISA(Diaclone,法国贝桑松)测定IFNγ分泌。结果表示为至少3个独立实验中的1个的平均值±SD(n=3)。数据报告为相对于从抗CD3e刺激的细胞获得的值的倍数变化共刺激。
活力测定
对于活力测定,将纯化的小鼠CD8a
抑制EGFR介导的细胞增殖
将A431细胞(2×10
抑制EGFR信号转导
将A431细胞在DCM中维持24小时,并且在抗体处理之前,将细胞在补充有1%FCS的DMEM中饥饿过夜。在生长因子刺激之前,将细胞在等摩尔浓度(0.1μM)的西妥昔单抗、利妥昔单抗、1D8
抗体标记
根据制造商的建议(Biotium,美国加利福尼亚州弗里蒙特),用Mix-n-StainCF488A抗体标记试剂盒标记纯化的1D8 IgG、1D8
将活细胞受体聚集成像和分子扩散定量HEK293
药代动力学研究
雌性CD-1小鼠(n=24/组)接受单次静脉内(i.v.)给药的1D8
荷瘤小鼠中的分子成像
将在105μl的DMEM+42%基质胶(BD Biosciences)中的表达人EGFR的A431细胞(1×10
治疗研究
将在100μl的PBS+30%基质胶中的CT26
毒性研究
为了分析肝毒性,三月龄雌性C57BL/6小鼠每周接受一次腹膜内注射3H3 IgG或1D8
Luminex测定
在指定的日期,通过眼眶后出血从经处理的小鼠中收集血液,并使用LuminexMilliplex磁珠试剂盒(Merck Millipore,美国马萨诸塞州比勒利卡)通过Luminex测定来确定血清样品中的炎症细胞因子(IFNγ、IL-6、TNFα)的水平。
统计分析
所有实验一式三份进行,并且使用Prism软件(GraphPad Software)进行统计分析。通过应用双尾、不成对的学生t检验来区分显著性差异(P值),假设正态分布,其中
使用源自大鼠IgG
在稳定转染的HEK293细胞中产生了三个4-1BB特异性三聚体,并通过IMAC纯化,产率为约1mg/L的条件培养基(图8A)。然后使用BLI研究它们的结合动力学。虽然所有1D8抗体均对固定在生物传感器上的m4-1BB表现出低的皮摩尔范围K
接下来,在存在次优剂量的抗CD3 mAb的情况下,通过测试1D8
由于在体外共刺激T细胞中,1D8
然后,通过17个残基长的接头将抗人EGFR单结构域抗体(V
通过BLI证明了1D8
接下来,确定1D8
首先,研究了1D8
为了研究靶向EGFR的4-1BB激动性三聚体在具有免疫能力小鼠中的抗肿瘤作用,使用了感染有编码人EGFR的逆转录病毒(CT26
在两个单独的实验中,在携带已建立的CT26
在相似的条件下,直接将1D8
靶向CEA的4-1BB激动性三聚体的设计与表达
为了产生靶向CEA的4-1BB激动性三聚体,通过17个残基长的接头将抗人CEA单结构域抗体(V
1D8
靶向CEA的4-1BB激动性三聚体的结构表征
1D8
靶向CEA的4-1BB激动性三聚体的功能表征
使用m4-1BB包被的生物传感器通过生物膜层干涉技术(BLI)研究了双特异性1D8
为了进一步评估1D8
然后,确定1D8
序列表
<110> 利达提斯有限公司(LEADARTIS, S.L.)
<120> 三聚体多肽复合物及其用途
<130> PPI21170004ES
<150> EP18382401
<151> 2018-06-06
<160> 14
<170> PatentIn version 3.5
<210> 1
<211> 59
<212> PRT
<213> 人工序列
<220>
<223> 胶原蛋白XVIII三聚化结构域
<400> 1
Ser Gly Val Ala Leu Thr Ala Thr Ala Gly Ala Met Leu Gly Gly Val
1 5 10 15
His Gly Val Pro Gly Gly Thr Leu Ile Pro Val Ala Gly Gly Gly Gly
20 25 30
Leu Thr Val Ala Val Gly Ala Gly Pro Ala Leu Val Gly Leu Gly Ala
35 40 45
Ala Thr Pro Leu Pro Ala Gly Thr Ala Ala Gly
50 55
<210> 2
<211> 64
<212> PRT
<213> 人工序列
<220>
<223> 胶原蛋白XV三聚化结构域
<400> 2
Val Thr Ala Pro Ser Ala Met Ala Ala Met Leu Gly Leu Ala His Leu
1 5 10 15
Val Ile Gly Gly Thr Pro Ile Thr Leu Ala Ala Ser Thr Gly Pro Pro
20 25 30
Ile Ala Val Ala Ala Gly Thr Leu Leu Leu Gly Leu Gly Gly Leu Ile
35 40 45
Pro Ile Pro Ala Ala Ser Pro Pro Pro Pro Ala Leu Ser Ser Ala Pro
50 55 60
<210> 3
<211> 396
<212> PRT
<213> 人工序列
<220>
<223> Ega1 (VHH)
<400> 3
Ala Thr Gly Gly Cys Thr Cys Ala Gly Gly Thr Gly Cys Ala Gly Cys
1 5 10 15
Thr Gly Cys Ala Gly Gly Ala Gly Thr Cys Thr Gly Gly Gly Gly Gly
20 25 30
Ala Gly Gly Ala Thr Thr Gly Gly Thr Gly Cys Ala Gly Cys Cys Ala
35 40 45
Gly Gly Gly Gly Gly Cys Thr Cys Gly Cys Thr Gly Ala Gly Ala Cys
50 55 60
Thr Cys Thr Cys Cys Thr Gly Thr Gly Cys Ala Gly Cys Cys Thr Cys
65 70 75 80
Thr Gly Gly Ala Cys Gly Cys Ala Cys Cys Thr Thr Cys Ala Gly Thr
85 90 95
Ala Gly Cys Thr Ala Thr Gly Cys Cys Ala Thr Gly Gly Gly Cys Thr
100 105 110
Gly Gly Thr Thr Cys Cys Gly Cys Cys Ala Gly Gly Cys Thr Cys Cys
115 120 125
Ala Gly Gly Gly Ala Ala Gly Gly Ala Gly Cys Gly Thr Gly Ala Gly
130 135 140
Thr Thr Thr Gly Thr Ala Gly Cys Ala Gly Cys Thr Ala Thr Thr Ala
145 150 155 160
Gly Gly Thr Gly Gly Ala Gly Thr Gly Gly Thr Gly Gly Thr Thr Ala
165 170 175
Cys Ala Cys Ala Thr Ala Cys Thr Ala Thr Ala Cys Ala Gly Ala Cys
180 185 190
Thr Cys Cys Gly Thr Gly Ala Ala Gly Gly Gly Cys Cys Gly Ala Thr
195 200 205
Thr Cys Ala Cys Cys Ala Thr Cys Thr Cys Cys Ala Gly Ala Gly Ala
210 215 220
Cys Ala Ala Cys Gly Cys Cys Ala Ala Gly Ala Cys Thr Ala Cys Gly
225 230 235 240
Gly Thr Gly Thr Ala Thr Cys Thr Gly Cys Ala Ala Ala Thr Gly Ala
245 250 255
Ala Cys Ala Gly Cys Cys Thr Gly Ala Ala Ala Cys Cys Thr Gly Ala
260 265 270
Gly Gly Ala Cys Ala Cys Gly Gly Cys Cys Gly Thr Thr Thr Ala Thr
275 280 285
Thr Ala Cys Thr Gly Thr Gly Cys Ala Gly Cys Ala Ala Cys Ala Thr
290 295 300
Ala Cys Cys Thr Cys Thr Cys Cys Thr Cys Gly Gly Ala Cys Thr Ala
305 310 315 320
Thr Ala Gly Cys Cys Gly Cys Thr Ala Thr Gly Cys Gly Thr Thr Gly
325 330 335
Cys Cys Cys Cys Ala Ala Ala Gly Gly Cys Cys Cys Thr Thr Gly Gly
340 345 350
Ala Cys Thr Ala Thr Gly Ala Cys Thr Ala Cys Thr Gly Gly Gly Gly
355 360 365
Cys Cys Ala Gly Gly Gly Gly Ala Cys Cys Cys Ala Gly Gly Thr Cys
370 375 380
Ala Cys Cys Gly Thr Cys Thr Cys Cys Thr Cys Ala
385 390 395
<210> 4
<211> 130
<212> PRT
<213> 人工序列
<220>
<223> Ega1 (VHH)
<400> 4
Gln Val Gln Leu Gln Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Ser Tyr
20 25 30
Ala Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ala Ala Ile Arg Trp Ser Gly Gly Tyr Thr Tyr Tyr Thr Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Thr Thr Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Thr Tyr Leu Ser Ser Asp Tyr Ser Arg Tyr Ala Leu Pro Gln
100 105 110
Arg Pro Leu Asp Tyr Asp Tyr Trp Gly Gln Gly Thr Gln Val Thr Val
115 120 125
Ser Ser
130
<210> 5
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> Ega1 (VHH) CDR1
<400> 5
Gly Arg Thr Phe Ser Ser Tyr Ala
1 5
<210> 6
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> Ega1 (VHH) CDR2
<400> 6
Ile Arg Trp Ser Gly Gly Tyr Thr
1 5
<210> 7
<211> 23
<212> PRT
<213> 人工序列
<220>
<223> Ega1 (VHH) CDR3
<400> 7
Ala Ala Thr Tyr Leu Ser Ser Asp Tyr Ser Arg Tyr Ala Leu Pro Gln
1 5 10 15
Arg Pro Leu Asp Tyr Asp Tyr
20
<210> 8
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> FLAG标签
<400> 8
Asp Tyr Lys Asp Asp Asp Asp Lys
1 5
<210> 9
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> StrepII标签
<400> 9
Trp Ser His Pro Gln Phe Glu Lys
1 5
<210> 10
<211> 18
<212> PRT
<213> 人工序列
<220>
<223> 接头序列
<400> 10
Ser Gly Ala Gly Gly Ser Gly Gly Ser Ser Gly Ser Asp Gly Ala Ser
1 5 10 15
Gly Ser
<210> 11
<211> 16
<212> PRT
<213> 人工序列
<220>
<223> 接头序列
<400> 11
Ser Gly Ala Gly Gly Ser Gly Gly Ser Ser Gly Ser Asp Gly Ala Ser
1 5 10 15
<210> 12
<211> 61
<212> PRT
<213> 人工序列
<220>
<223> 小鼠TIE XVIII
<400> 12
Gly Gln Val Arg Ile Trp Ala Thr Tyr Gln Thr Met Leu Asp Lys Ile
1 5 10 15
Arg Glu Val Pro Glu Gly Trp Leu Ile Phe Val Ala Glu Arg Glu Glu
20 25 30
Leu Tyr Val Arg Val Arg Asn Gly Phe Arg Lys Val Leu Leu Glu Ala
35 40 45
Arg Thr Ala Leu Leu Arg Gly Thr Gly Asn Glu Val Ala
50 55 60
<210> 13
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> 引物FwCMV
<400> 13
cgcaaatggg cggtaggcgt g 21
<210> 14
<211> 18
<212> DNA
<213> 人工序列
<220>
<223> 引物RvBGH
<400> 14
tagaaggcac agtcgagg 18
- 三聚体多肽复合物及其用途
- 与主要组织相容复合物分子的HLA-C-克隆10能形成复合物的分离的多肽及其用途
