抗水产养殖病原体的抗体及其用途
文献发布时间:2023-06-19 10:22:47
相关申请的交叉引用
本申请要求2018年6月5日提交的美国临时申请No.62/680,736的权益,该申请通过引用并入本文。优先权如35 U.S.C.§119描述。上述专利申请通过引用并入本文,如再次完整阐述一致。
发明领域
本发明涉及在水产养殖物中控制微生物的方法和组合物及其用途。
发明背景
牲畜病原体污染在全球水产养殖业造成巨大的损失和经济负担。随着全球人口的增长,在可用于农业种植的农田数量没有显着增加的情况下,我们需要在有限空间中生产更多食物。相较于畜牧业,水产养殖可以更加有效利用空间,因为水产养殖生物的饲料转化率约为1:1,而畜牧业养殖转化率则为1:3或更高
发明概述
以下文列出的定义为参考,本文描述了包含重链可变区片段(V
援引并入
本专利说明书中提到的所有文献,专利和专利申请都以引用的方式并入本文。每篇文献,专利或专利申请都被独立引用和并入本文。
附图简述
该发明的特性在所附的权利要求书中有具体阐述。通过参考以下对本发明原理的说明和实施方案,可以更好的了解本发明的特征和优势:
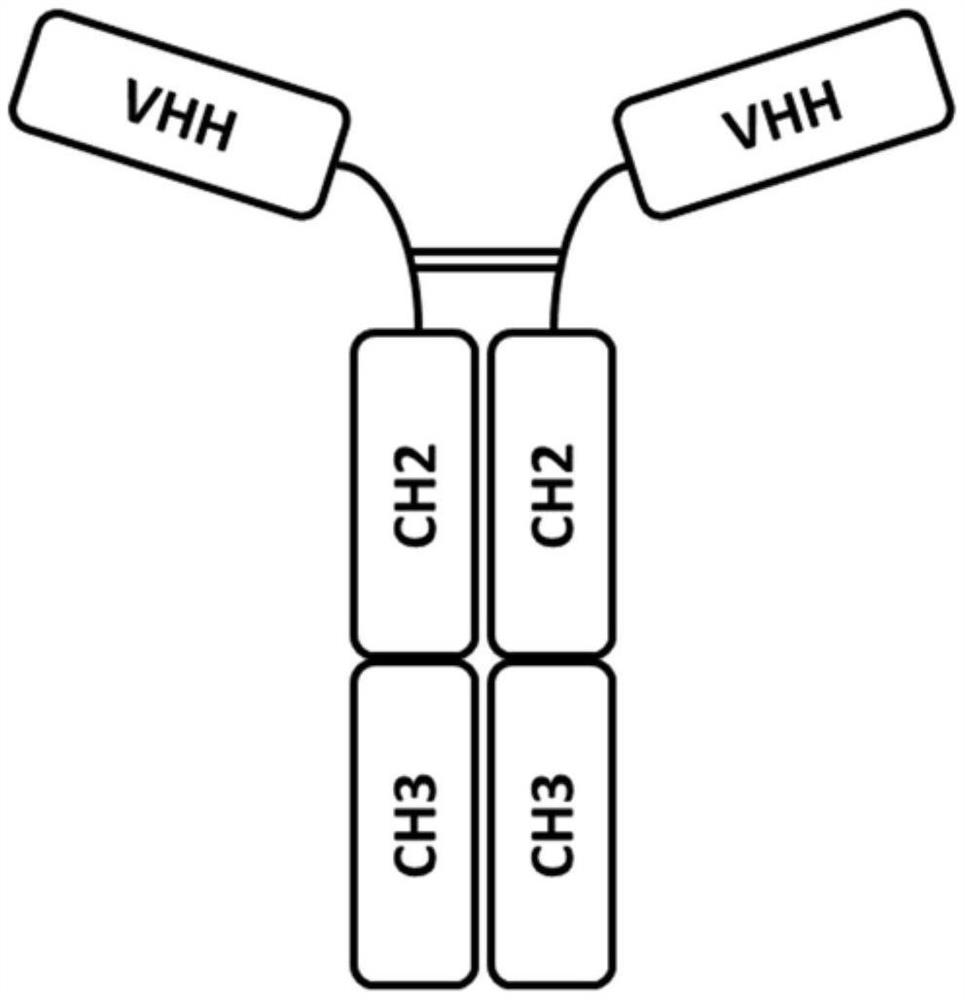
图1A-1B:图A显示骆驼科重链抗体与其V
图B展示了V
图2A-2F:显示本发明中V
图3:显示使用蛋白质下拉测定的重组表达和纯化的V
图4:针对虾中肠提取物中的PirA的所选重组表达和纯化的V
定义
本文在描述该发明时,根据以下定义使用相关术语。
以下说明阐述了某些特定细节,以便提供对各种实施方案细节的理解。然而,本领域熟练的技术人员需明白此实施方案可以在没有这些细节的情况下实践。除非上下文明确要求,否则在以下整个说明书和权利要求书中,词语“包括”及其衍生形态(例如“包括”和“包含”)应以开放,包含的方式解读,即“包括,但不限于”。如本说明书和所附权利要求书中所使用的,除非内容另外明确指出,单数形式“一个”,“一种”和“该”包括复数指示物,。还应注意,除非内容明确指出,否则术语“或”通常以包括“和/或”的含义使用。此外,本文提供的标题仅供参考,不解释专利权项的实施方案的范围或含义。
1)
如本文所指,当产品被用于成饲料中,“宿主”,“宿主生物”,“接受动物”,“宿主动物”及其衍生形态是指其产品的目标接受者。在某些实施方案中,宿主是指甲壳动物,贝类,海虾或淡水虾。
2)
如本文所指,“贝类”是指任何具有水生外骨骼的无脊椎动物。贝类可以从野外捕获或通过饲养收获。贝类包括但不限于甲壳类,双壳纲,腹足类,头足类,章鱼,鱿鱼,墨鱼,蛤蜊,牡蛎,贻贝,扇贝,鸟蛤,海螺,蛾螺,虾,对虾,鳌虾,小龙虾,龙虾,螃蟹,磷虾和藤壶。
3)
如本文所指,“水产养殖物”,“水生”及其衍生形态是指在水中对生物,包括动物和植物的培养或栖息。
4)
如本文所指,“病原体”,“致病的”及其衍生形态是指与宿主生物体相关的有毒微生物,在该生物体中引起在未被感染的宿主生物体中原先不存在的症状,包括生存,繁衍和繁殖能力的下降。病原体包括但不限于寄生虫,细菌,病毒,朊病毒,原生生物,真菌和藻类。在某些实施方案中,病原体是属于弧菌属的细菌。而在其他某些实施方案中,病原体是指白点症病毒。
“毒性”,“具毒的”及其衍生形态是指病原体在宿主生物体中引起症状的能力。“毒性因子”是指在感染中已证明或假定具有作用的核酸,质粒,基因组岛,基因,肽,蛋白质,毒素,脂质,大分子机器或其复合物。
“致病因子”是指在感染中具有已证实或假定存在作用的微生物,病原体或毒性因子。
5)
如本文所指,“细菌”,“细菌引起的”及其衍生形态包括,但不限于,弧菌属物种,气单胞菌属物种,爱德华氏菌属物种,链球菌物种,立克次体物种或与水生生物体或宿主生物体相关的任何其他细菌物种。在某些实施方案中,细菌可能在与之相关的所有宿主生物中都不具有毒性。
6)
如本文所指,“病毒”,“病毒性的”及其衍生形态包括但不限于白点症病毒或与水生生物或宿主生物有关的任何其他病毒物种。
7)
图1中显示了骆驼科重链抗体及其与V
如本文所指,“V
如本文所称,“重链抗体”是指包含两条重链并且缺乏常规抗体中常见的两条轻链的抗体。重链抗体可以源自骆驼科(Camelidae)家族或软骨鱼类的物种。在没有任何轻链的情况下,重链抗体保留其与抗原的特异性结合。
如本文所称,“特异性结合”,“特异的结合”或其变体是指在抗体与其标靶分子之间发生的结合。该结合由抗体的可变区的至少一个互补决定区(CDR)介导。恒定区与另一个分子(例如蛋白质A或G)之间的结合不构成特异性结合。
如本文所称,“抗体片段”是指常规或重链抗体中保留了可和标靶抗原特异性结合的部分,可以包括单链抗体,重链抗体的可变区片段,纳米抗体,多肽或免疫球蛋白新抗原受体(IgNAR)。
如本文所指,“抗体源自物种”是指在体内生产抗体CDR区的动物所属的物种。在某种物种中产生并随后通过体外方法(例如噬菌体展示)优化的抗体被认为源自该物种。
如本文所称,“常规抗体”是指任何完整的免疫球蛋白,其包含通过二硫键连接在一起的两个重链分子和两个轻链分子。在某些实施方案中,本文描述的抗体,组合物,饲料,产品和方法不使用常规抗体。
8)生产系统
如本文所指,“生产系统”及其衍生形态是指可用于生产本发明的实际实施方案,或其改良形态。这包括但不限于以下生物生产:细菌,酵母,藻类,节肢动物,节肢动物细胞,植物,哺乳动物细胞。生物生产可包括但不限于胞内,周质,膜相关,分泌或噬菌体相关的抗体。“生产系统”及其衍生形态也包括但不限于,任何合成生产系统。这包括但不限于新蛋白质合成,在细胞提取物里的蛋白质合成,在纯化酶存在下的蛋白质合成以及任何其他蛋白质合成系统。
9)
如本文所指,“产物”是指本发明的任何物理实施方案或本发明的修饰形式,其中V
10)
如本文所指,“饲料产品”是指本发明的任何物理实施方案或本发明的修饰形式,其中V
发明详述
关于本发明的描述将结合本文提供的定义和警告予以解释。
一些养殖的水生生物,例如一些甲壳类动物,缺乏适应性免疫反应。另外,对于小型且高度饲养的生物体,需要频繁注射治疗药物。由于以上原因,无法用疫苗来保护养殖水生生物免受致病性感染。其次,欧洲已经禁止使用抗生素作为动物饲料中的生长促进剂(自2006年起生效),以逐步淘汰非医学用途的抗生素并限制抗菌素的耐药性。许多水生生物的细菌病原体已经对普通抗生素产生抗药性,凸显了为水生生物生长和预防感染的目的而开发非抗生素产品的重要性。
影响养殖水生生物的病原体包括细菌(如弧菌属)以及病毒(如白点症病毒)。例如,由副溶血性弧菌引起的水产业损失首先出现在2009年,此后一直很普遍
WSSV感染是一个长期存在的问题。自1992年被发现以来(7),仍然没有有效的方法来控制其水生生物中病毒的传播或感染。WSSV造成的水产养殖业累计损失估计为$150亿美元(8)。被感染的微生物在3-5天内垂死。病毒包膜表面的明显特征可被靶向以用来针对性地预防感染。
影响养殖水产养殖生物的其他致病因子包括细菌(例如耶尔森菌,爱德华氏菌,气单胞菌,链球菌和立克次体),病毒(例如白点症病毒(WSSV),黄头病毒,罗非鱼虹膜病毒,流行性造血坏死病毒(EHNV),传染性造血坏死病毒(IHNV),传染性鲑鱼贫血病毒(ISAV),传染性胰腺坏死病毒(IPNV),传染性皮下和造血性坏死病毒(IHHNV))和白斑杆菌状病毒(WSBV),肝胰细小病毒样(HPV),reo样病毒,斑节杆状病毒(MBV),杆状病毒中肠GI和坏死病毒(BMN)),藻类,病毒,虫,原生生物,寄生虫,真菌,肽,蛋白质和核酸。据我们所知,尚未有针对这些致病因子,有效的,非疫苗的治疗方法用于商业用途。
现有方法未能考虑到水生生物对病原体的免疫有限,因此依赖于宿主生物自身对致病因子的防御机制。这种方法受到宿主生物体免疫系统不足的限制,因此无法提供有效的保护。本文阐述通过向宿主中引入外源肽的方法,在不引起宿主免疫反应的情况下中和致病的毒性和抑制传播。此外,本文描述的方法提供了中和肽的完善和适应的范围,其提供了宿主自身无法产生的合成功能。
抗体重链可变区片段(V
一方面,本发明含有V
另一方面,本发明所包含的V
在另一方面,本发明用重组毒性因子接种骆驼科动物或其他物种的方法,从接种生物体的淋巴细胞中检索到的V
一方面,本发明提供了在合适的量产生物中生产V
另一方面,本发明中包含V
在另一方面,本发明提供了包含V
另一方面,本发明提供了包含V
另一方面,本发明提供了包含V
在另一方面,本发明提供了包含V
在另一方面,本发明提供了包含可结合致病因子的V
另一方面,本发明提供了包含V
在某些实施方案中,V
在另一方面,本发明提供了包含V
PirA
>tr|A0A085YLC0|A0A085YLC0_VIBPH JHE-like toxin PirA-like OS=Vibrioparahaemolyticus OX=670GN=vp19 PE=4SV=1
MSNNIKHETDYSHDWTVEPNGGVTEVDSKHTPIIPEVGRSVDIENTGRGELTIQYQWGAPFMAGGWKVAKSHVVQRDETYHLQRPDNAFYHQRIVVINNGASRGFCTIYYH
PirB
>tr|A0A085YLC1|A0A085YLC1_VIBPH JHE-like toxin PirB-like OS=Vibrioparahaemolyticus OX=670GN=BTO19_25780PE=4SV=1
MTNEYVVTMSSLTEFNPNNARKSYLFDNYEVDPNYAFKAMVSFGLSNIPYAGGFLSTLWNIFWPNTPNEPDIENIWEQLRDRIQDLVDESIIDAINGILDSKIKETRDKIQDINETIENFGYAAAKDDYIGLVTHYLIGLEENFKRELDGDEWLGYAILPLLATTVSLQITYMACGLDYKDEFGFTDSDVHKLTRNIDKLYDDVSSYITELAAWADNDSYNNANQDNVYDEVMGARSWCTVHGFEHMLIWQKIKELKKVDVFVHSNLISYSPAVGFPSGNFNYIATGTEDEIPQPLKPNMFGERRNRIVKIESWNSIEIHYYNRVGRLKLTYENGEVVELGKAHKYDEHYQSIELNGAYIKYVDVIANGPEAIDRIVFHFSDDRTFVVGENSGKPSVRLQLEGHFICGMLADQEGSDKVAAFSVAYELFHPDEFGTEK
VP24
>tr|Q9E7K6|Q9E7K6_WSSV Major structural protein VP24 OS=White spotsyndrome virus OX=92652GN=VP24 PE=4SV=1
MHMWGVYAAILAGLTLILVVISIVVTNIELNKKLDKKDKDAYPVESEIINLTINGVARGNHFNFVNGTLQTRNYGKVYVAGQGTSDSELVKKKGDIILTSLLGDGDHTLNVNKAESKELELYARVYNNTKRDITVDSVSLSPGLNATGREFSANKFVLYFKPTVLKKNRINTLVFGATFDEDIDDTNRHYLLSMRFSPGNDLFKVGEK
VP28
>tr|A6ZI33|A6ZI33_WSSV Coat protein OS=White spot syndrome virus OX=92652GN=VP28 PE=4SV=1
MDLSFTLSVVSAILAITAVIAVFIVIFRYHNTVTKTIETHTGNIETNMDENLRIPVTAEVGSGYFKMTDVSFDSDTLGKIKIRNGKSDAQMKEEDADLVITPVEGRALEVTVGQNLTFEGTFKMWNNTSRKINITGMQMVPKINPSKAFVGSSNTSSFTPVSIDEDEVGTFVCGTTFGAPIAATAGGNLFDMYVHVTYSGTETE
示例
以下示例代表本文描述的应用,系统和方法的实施方案,但不意味着以任何方式进行限制。
尽管本章节描述了本发明的优化实施方案,但是对于本领域熟练的技术人员,这些实施方案仅供参考。本领域熟练的技术人员可在不背离本发明的情况下,实施多种变化,改变和替换。本文描述的关于本发明的实施方案在实际操作时可以有多种代替选择。
1.
重组抗原可以从大肠杆菌表达系统中纯化。例如,抗原基因可以在大肠杆菌BL21(DE3)细胞中表达,在自诱导培养基(Formedium)中于18℃过夜生长后,通过在含有12.5μg/ml DNase I和IX蛋白酶抑制剂混合物(Bioshop)的缓冲液A(250mM NaCl,50mM CaCl2、20mMimidazole和10mM HEPES,pH 7.4)中进行超声处理裂解细胞。细胞裂解物可通过在4℃下以22000xg离心30分钟来清除裂解液,然后将其施加到预先用缓冲液A平衡的5ml HisTrap HP色谱柱(GE Healthcare)上,用十倍柱体积的缓冲液A洗涤并用梯度为0%至60%(vol/vol)的缓冲液B(250mM NaCl,50mM CaCl2、500mM imidazole和10mM HEPES,pH 7.4)洗脱附着蛋白。然后在添加了TEV的缓冲液C(250mM NaCl,10mM HEPES,pH 7.4和5mM b-巯基乙醇)中于4℃将蛋白透析过夜。将透析获得到的蛋白质注入用缓冲液C预平衡的HisTrap HP色谱柱(GE Biosciences)中,将带有6xHis标记的TEV和6xHis-tag结合到色谱柱上,并在流通物中收集抗原样品。将样品在缓冲液D(5mM NaCl和10mM Tris pH 8.8)中透析过夜,然后注入5ml HiTrap Q HP色谱柱(GE Healthcare)中。用0%至50%(体积/体积)缓冲液E(1.0MNaCl和10mM Tris pH 8.8)洗脱蛋白质。最后,使用缓冲液F(400mM NaCl和20mM HEPES pH7.4)将洗脱液注入到Superdex 75增加10/300GL凝胶过滤柱(GE Healthcare)上。然后使用具有适当分子量截断值的Amicon浓缩器(MWCO;Millipore)将蛋白质样品浓缩至1mg/mL。纯化的蛋白质储存在-80℃。
2.
将纯化的致病原(例如抗原)注射入单个美洲驼使其产生免疫反应。该致病原可能会伴有佐剂。一共会对美洲驼进行四次抗原注射,每种抗原的质量为100μg。在注射前,将抗原解冻,并加入PBS将容量增加至1ml。然后将1ml抗原-PBS混合物与1ml完全弗氏佐剂(CFA)或不完全弗氏佐剂(IFA)混合,总计2ml。每次注射总量为2毫升,然后在第0、28、49、70天从接种动物中收集其全血和血清。后将来自28、49和70天的血清分级分离,使V
从纯化的美洲驼淋巴细胞中分离的RNA可用于生成cDNA。cDNA可克隆到噬菌粒中。所得噬菌粒可用于转化大肠杆菌TG-1细胞,以产生表达的V
图2显示了本文公开的所有抗体的噬菌体ELISA结果。在表1和表2中所述的抗原溶解于磷酸盐缓冲盐水(PBS)并用于包被酶标板。黑条为抗体和抗原包被酶标板孔的结合。灰色条是阴性对照,为与仅PBS包被的孔结合。在所有情况下,与标靶抗原的结合比与PBS包被的孔的结合至少高50%。图2A显示了NBX0401至NBX0406的结果。图2B显示了NBX0601至NBX0630的结果。图2C显示了NBX0631至NBX0637,NBX0813至NBX0825,NBX0845,NBX0846和NBX0849的结果。图2D显示了NBX0638至NBX0650和NBX0826至NBX0844的结果。图2E显示了NBX0850至NBX0865和NBX09001至NBX09011的结果。图2F显示了NBX0722至NBX0725,NBX0730,NBX0738,NBX0739,NBX0745和NBX0746的结果。
从大肠杆菌中纯化V
可被TEV蛋白酶切割的6xHis-硫氧还蛋白-NBX融合蛋白在自诱导培养基(Formedium)中于30℃下生长的大肠杆菌细胞质中表达24小时。通过离心收集细菌,将其重悬于缓冲液A(10mM HEPES,pH 7.5,250mM NaCl,20mM imidazole)中,并使用超声裂解。通过离心去除不溶物,并将剩余的可溶物上样至用缓冲液A预平衡的HisTrap柱(GEBiosciences)。使用FPLC在缓冲液A和缓冲液B之间以线性梯度洗脱蛋白质(10mM HEPES,pH7.5,500mM NaCl,500mM imidazole)。洗脱的蛋白质在含有TEV蛋白酶的以缓冲液C(10mMHEPES,pH 7.5,500mM NaCl)透析过夜。将透析过的蛋白质加到用缓冲液C预平衡的HisTrap柱上(GE Biosciences)。将6xHis标记的TEV和6xHis标记的硫氧还蛋白结合到色谱柱上,并在流通物中收集高度纯化的NBX。NBX蛋白通过在PBS中透析过夜,浓缩至~10mg/ml。
具有表达和分泌6xHis标记的VhH的构建体的巴斯德毕赤酵母菌株GS115在30℃下生长5天,每天使用0.5%(体积/体积)甲醇诱导。通过离心去除酵母细胞,并将含NBX的上清液加标10mM imidazole。将上清液加到预先用缓冲液A(10mM HEPES,pH 7.5,500mM NaCl)平衡的HisTrap柱(GE Biosciences)上。使用FPLC在缓冲液A和缓冲液B之间以线性梯度洗脱蛋白质(10mM HEPES,pH 7.5,500mM NaCl,500mM imidazole)。NBX蛋白通过在PBS中透析过夜,浓缩至~1.5mg/ml。
3.
在室温下,将约0.1mg抗原与NBX以1:5摩尔比在200ml结合缓冲液(10mM磷酸盐缓冲液pH7.4和500mM NaCl)中培养30分钟,然后加到预先用结合缓冲液预平衡过的含Ni-NTA(硝酸镍)的柱上。蛋白混合物和树脂一起培养30分钟,然后用结合缓冲液洗涤树脂,再用结合缓冲液加20mM imidazole洗涤。用100ml 1M imidazole,pH 7.4洗脱结合的蛋白质。在SDS-PAGE凝胶上分析各种洗脱部分中是否存在NBX。另外,仅包含NBX的蛋白质溶液也被加于一个单独的色谱柱,以评估NBX与树脂的非特异性结合。
图3显示了四个特异NBX的代表性结果。对应所示的四种抗体,泳道如下。(1)在加于Ni-NTA树脂之前,先将PirA(*)和NBX(+)混合物用作起始原料。(2)PirA和NBX通过Ni-NTA树脂过流。(3)在蛋白质最后洗脱之前,对Ni-NTA树脂进行的最后一次清洗。(4)从Ni-NTA树脂中洗脱的PirA和NBX。(5)从仅有NBX的Ni-NTA树脂洗脱蛋白。(6)仅加入NBX的Ni-NTA树脂在洗脱之前的最后一次清洗。(7)在加入Ni-NTA树脂之前的仅有NBX(+)的混合物。可以成功通过PirA拉下来的的NBX是出现在道4洗脱中,但不在泳道5洗脱中出现的那些。每个凝胶上都有显示以千道尔顿(kDa)为单位的已知大小的蛋白质阶梯标尺,以供参考。
4.
在室温下解冻冷冻的虾中肠提取物和NBX,然后立即置于冰上。以10,000RCF旋转虾中肠提取物和蛋白质1分钟,沉淀并去除任何沉淀物。在冰上预冷PBS和盐水。预冷并将8x0.2mL试管放在冰上,标记试管。在冰上以10μl的容量进行两个反应。第一个反应由3.2μLPBS中的5μg NBX和150mM NaCl中的4.8μL组成,并不含虾中肠提取物。第二个反应包含虾中肠提取物,并按以下比例生成:2.4μL虾中肠提取物,5μg NBX混合于0.8μL PBS和4.8μL的150mM NaCl。将试管在放在冰上5分钟(相当于图4中的时间=0分钟),然后在26℃下培养24小时。最终的培养温度(26℃)是虾的体内温度。充分培养后,用8μL预热过的2X SDS样品缓冲液终止反应。在95-100℃下煮沸5分钟。然后用18%SDS-PAGE凝胶检测NBX来评估每个NBX的稳定性。
图4显示了四个特异NBX的代表性结果。对于所示的四种抗体中的每一种,SDS-PAGE凝胶从左到右排列如下。凝胶上有显示以千道尔顿(kDa)为单位的已知大小的蛋白质阶梯标尺,以供参考。以下两条泳道显示了在实验开始和结束时不含虾中肠提取物的NBX。这些泳道表明,在没有虾中肠提取物的情况下,NBX不会随时间降解。接下来的泳道显示了在实验开始时未添加NBX的虾中肠提取物。该泳道显示了提取物中的天然蛋白质组成。随后的7-9条泳道显示了随着时间变化的虾中肠提取物中NBX稳定性。这些泳道可以直观地显示NBX的相对稳定性。越稳定的完整NBX在凝胶上的可视化时间越长。最后一条泳道显示了在测定结束时无NBX的虾中肠提取物。
本说明书中提及的所有出版物,专利申请,已发布的专利和其他文件均通过引用并入本文。每个单独的出版物,专利申请,已发布的专利或其他文件均被明确地并单独地指示通过引用整体并入。引用文献定义若与本文中的定义相抵触则予以排除。
以下为并入文献,作为参考。
1.Kierath,D.(2015,March).The growth of global aquaculture–Fishybusiness.Retrieved from deloitte.com/au/en/pages/consumer-business/articles/the-growth-of-aqua-culture-fishy-business
2.Stentiford,G.D.,Sritunyalucksana,K.,Flegel,T.W.,Williams,B.A.P.,Withyachumnarnkul,B.,Itathitphaisarn,O.,Bass,D.(2017).New paradigms to helpsolve the global aquaculture disease crisis.PLos Pathogens,13(2),pp.1-6
3.Lee,C.T.,Chen,T.I.,Yang,Y.T.,Ko,T.P.,Huang,Y.T.,Huang.,J.Y.,Huang,M.F.,Lin,S.J.,Chen,C.Y.,Lin,S.S.,Lightner,D.V.,Wang,H.C.,Wang,A.H.J.,Wang,H.C.,Hor,L.I.,Lo,C.F.(2015)The opportunistic marine pathogen Vibrioparahaemolyticus becomes virulent by acquiring a plasmid that expresses adeadly toxin.PNAS,112(34),pp.10789-10803.
4.FAO Fisheries and Aquaculture(2013)Report of the FAO/MARD TechnicalWorkshop on Early Mortality Syndrome(EMS)or Acute Hepatopancreatic NecrosisSyndrome(AHPNS)of Cultured Shrimp(under TCP/VIE/3304).rep.no.1053.Retrievedfrom www.fao.org/docrep/018/i3422e/i3422e.pdf
5.Tran,L.,Numan,L.,Redman,R.M.,Mohney,L.L.,Pantoja,C.R.,Fitzsimmons,K.,Lightner,D.V.(2013)Determination of the infectious nature of the agent ofacute hepatopancreatic necrosis syndrome affecting penaeid shrimp.Diseases ofAquatic Organisms,105(1),pp.45–55.
6.Ahmed,H.A.,El Bayomi,R.M.,Hussein,M.A.,Khedr,M.H.E.,Abo Ramela,E.M.,El-Ashram,A.M.M.(2018)Molecular characterization,antibiotic resistancepattern and biofilm formation of Vibrio parahaemolyticus and V.choleraeisolated from crustaceans and humans.International Journal of FoodMicrobiology,274,pp.31-37.
7.Flegel,T.(2012)Historic emergence,impact and current status ofshrimp pathogens in Asia,Journal of Invertebrate Pathology,110(2),pp.166-173.
8.Lightner,D.V.,Redman,R.M.,Pantoja,C.R.,Tang,K.F.J.,Noble,B.L.,Schofield,P.,Mohney,L.L.,Nunan,L.M.,Navarro,S.A.(2012)Historic emergence,impact and current status of shrimp pathogens in the Americas,Journal ofInvertebrate Pathology,110(2),pp.174-183.
尽管在此示出并描述了本发明的优选实施方案,但是对于本领域熟练的技术人员,这些实施方案仅供参考。本领域熟练的技术人员将在不背离本发明的情况下,实施多种变化,改变和替换。本文描述的关于本发明的实施方案在实际操作时可以有多种代替选择。以下权利要求书界定了本发明的范围,并且由此涵盖这些权利要求范围内的方法和结构及其等同物。
- 抗水产养殖病原体的抗体及其用途
- 抗CD33抗体、抗CD33/抗CD3双特异性抗体及其用途
