用于加速的在线自适应放射疗法的系统和方法
文献发布时间:2023-06-19 10:27:30
相关申请的交叉引用
本申请要求于2018年6月26日提交的题为“SYSTEMS AND METHODS FORACCELERATED ONLINE ADAPTIVE RADIATION THERAPY(用于加速的在线自适应放射疗法的系统和方法)”的美国临时专利申请序列号第62/690,289号的权益,所述文献以其整体通过引用并入本文。
背景技术
肿瘤或危及器官(“OAR”)的解剖结构、生物学(biology)或两者可在放射疗法(“RT”)递送期间实质地和随机地改变。在线自适应放射疗法(“ART”)是最先进的方法,通常包括:在每次RT递送(即,分剂(fraction))前一天对患者特定的解剖结构和/或生物学进行成像,创建适于肿瘤和OAR的解剖结构/生物学的新的RT计划,以及向患者递送新的自适应RT计划。应当在实际的时间段内完成这些操作,因为患者在在线自适应重新计划期间躺在台上并且等待接受治疗。
对在治疗当日获取的图像中的解剖结构进行分割并且评估计划所需的漫长的、并且可能在临床上不切实际的时间是实践在线ART的瓶颈。因此,期望提供用于在在线ART框架内对解剖结构进行分割并评估RT计划的更快且更稳健的方法。还期望提供一种稳健的技术来迅速识别在线ART的需求。
发明内容
本公开通过提供用于改进的在线自适应放射治疗(“ART”)和在线自适应重新计划(“OLAR”)来解决上述缺点。
在本公开的一个方面,提供了一种用于控制放射治疗计划系统以识别执行OLAR是否将是有利的并且可选地发起OLAR过程的方法。
在本公开的另一方面,提供了用于校正放射治疗计划轮廓并且由此生成经校正的放射治疗计划轮廓数据的方法。
在本公开的又另一方面,提供了用于验证放射治疗计划轮廓数据的准确度的方法。
在本公开的又另一方面,提供了用于评定放射治疗计划的质量的方法。
在本公开的另一方面,提供了用于从磁共振图像中产生合成计算机断层扫描(CT)图像的方法。
本公开的上述和其他方面及优点将通过以下说明书而显现。在说明书中,参考了形成说明书的一部分的附图,其中通过图示的方式示出了优选实施例。然而,此实施例不一定代表本发明的全部范围,并且因此,参考权利要求和本文来解释本发明的范围。
附图说明
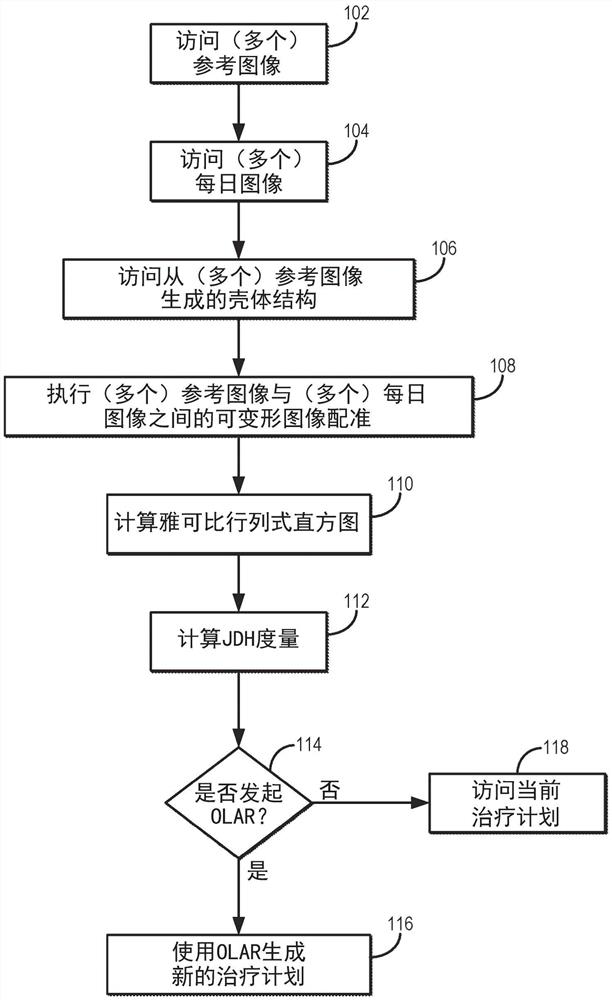
图1是阐述用于基于从雅可比(Jacobian)行列式直方图计算的度量的分析来生成是否发起在线自适应重新计划(“OLAR”)的指示的方法的步骤的流程图,从参考图像与患者的每日图像之间的可变形图像配准来生成该雅可比行列式直方图。
图2是可从使用机器学习算法获得的决策树的示例,该决策树用于确定用于生成发起OLAR是否是有利的的指示的JDH度量和标准。在该示例中,已经获得决策树以用于识别在针对前列腺癌的放射治疗期间执行OLAR是否将是有利的。
图3是根据本公开中描述的实施例的分析医学图像数据以评定是否发起或以其他方式实现OLAR的示例系统的框图。
图4是可实现图3的OLAR发起评估系统的示例部件的框图。
图5是基于纹理特征的自动轮廓校正方法的流程图。
图6A-6C示出了基于纹理的活动轮廓模型的代表性示例。图6A中示出了实况(ground truth)(绿色)轮廓和自动生成的轮廓。图6B中示出了GLCM聚类阴影特征图。图6C中示出了轮廓演化图。使用青色的线示出了演化的轮廓,同时用不同的颜色(即,绿色、蓝色和红色)高亮了实况轮廓、初始轮廓和经校正轮廓。
图7是用于基于特征的自动化轮廓质量控制和轮廓校正的示例方法的流程图。
图8是决策树模型的示例,该决策树模型可被实现以用于使用本公开中描述的方法来进行基于纹理的轮廓质量验证。
图9A是跨在实况胰头轮廓的核心区域上的计算的纹理特征的分层聚类树的示例。在该示例中,使用0.5的相异距离来识别聚类。将所选择的特征高亮为黄色。
图9B是跨在实况十二指肠轮廓的核心区域上的计算的纹理特征的分层聚类树的示例。在该示例中,使用0.5的相异距离来识别聚类。将所选择的特征高亮为黄色。
图10A-10D示出了纹理特征选择的代表性情况。图10A和图10B分别示出了每日CT图像的横轴位和冠状位。图10C和图10D示出了对于原始十二指肠(图10C)和胰头(图10D)的轮廓向内和向外的各种壳体体积的不同特征值。图10C和图10D中的X轴是轮廓扩展(正)或收缩(负)的间隔。所有特征值都被归一化为来自原始器官体积的一个特征值。
图11是可实现本公开中描述的实施例的示例自动轮廓校正和验证系统的框图。
图12是可实现图11的自动轮廓校正和验证系统的示例部件的框图。
图13示出了示例自适应计划与示例重新定位计划之间的剂量体积直方图(“DVH”)比较。
图14示出了示例自适应计划和示例重新定位计划的剂量水平共生矩阵(“DLCM”)热对比图。
图15示出了在示例自适应计划和示例重新定位计划中的计划靶体积(“PTV”)的剂量水平大小区域矩阵(“DLSZM”)图。
图16是用于基于剂量纹理特征、空间剂量度量或其组合来评估放射治疗计划质量的示例方法的流程图。
图17是可实现本公开中描述的实施例的示例自动OLAR计划质量评估系统的框图。
图18是可实现图17的自动OLAR计划质量评估系统的示例部件的框图。
图19是阐述用于从磁共振图像生成计算机断层扫描(“CT”)图像的示例方法的步骤的流程图。
图20描绘了用于对空气体素与非空气体素进行分类从而可在合成CT生成中使用以生成空气区域体积的方法的示意图。
图21是阐述用于从磁共振图像生成CT图像的另一示例方法的步骤的流程图。
图22是可实现本公开中描述的实施例的示例合成CT图像生成系统的框图。
图23是可实现图22的合成CT图像生成系统的示例部件的框图。
图24是可实现本公开中描述的方法的示例计算机系统的框图。
图25是可实现本公开中描述的方法的示例放射治疗计划系统的框图。
具体实施方式
本文描述了用于改进的在线自适应放射疗法(“ART”)的系统和方法。通常基于使用硬件处理器和存储器实现的纹理分析和机器学习算法的使用来提供对在线ART的改进。本公开中描述的系统和方法使得能够对现有在线ART技术和改进的在线ART计划系统的开发进行显著改进。具体而言,系统和方法显著地改进了在线ART的效率和准确度,由此改进放射疗法递送。作为结果,可产生更安全且更有效的放射治疗计划并将该放射治疗计划用于向患者递送治疗。此外,本公开中描述的系统和方法使得能够在临床上可接受的时间段中实现OLAR。例如,可将OLAR从耗时10-30分钟减少到5-10分钟。
例如,本公开中描述的系统和方法可以快速地识别在线自适应重新计划(“OLAR”)的必要性。在示例实现中,这可以通过分析来自参考图像与当日图像的可变形配准的雅可比行列式直方图的特征或其他度量来完成。在本公开中描述的系统和方法还可以通过使用图像纹理分析来自动并快速地识别由自动分割生成的良好质量的轮廓。本公开中描述的系统和方法还提供了基于3D剂量纹理特征的自动化计划质量评估。本公开中描述的系统和方法还可以快速地从磁共振图像创建合成计算机断层扫描(“CT”)图像。作为一个示例,该过程可通过对磁共振图像中的空气和骨区域自动地进行分割来实现。
因此,在一些方面,本公开中描述的系统和方法提供了对需要在线ART或在线ART以其他方式有益的那些情况的快速识别。如上所述并且在下文中详细描述的,该评估可基于分析来自参考图像与在治疗当日获得的患者图像的可变形配准的雅可比行列式直方图的特征或其他度量。
在一些其他方面中,本公开中描述的系统和方法提供了轮廓校正、轮廓验证或两者。如上所述,并且在下文中详细描述的,可将轮廓自动识别为具有良好的质量,并且可以自动校正被识别为不准确的那些轮廓。
在又其他方面中,本公开中描述的系统和方法提供了自动放射治疗计划评估。如上所述并且在下文中详细描述的,可基于3D剂量纹理特征的分析来实现放射治疗计划评估。
作为另一示例,在一些方面中,本公开中描述的系统和方法提供了合成CT。如上所述并且在下文中详细描述的,可从磁共振图像生成合成CT图像。作为示例,可从已经被处理以准确地分割空气和骨区域的磁共振图像来生成合成CT图像。
OLAR可以考虑到在RT期间的分剂之间的变化,但是与诸如重新定位方法之类的其他方法相比,这通常是耗时且劳动密集的过程。重新定位对于最小的分剂之间的变形是足够的。因此,确定何时期望OLAR的指示。本文描述了用于快速确定是否需要OLAR或OLAR是否将以其他方式有益的方法。在示例中,本技术包括分析从参考图像(例如,计划图像)与每日图像(例如,治疗当日获得的图像)之间的可变形图像配准获得的雅可比行列式直方图。
现在参考图1,流程图被示出为阐述用于确定是否发起OLAR以生成新的放射治疗计划的指示的步骤。方法包括使用计算机系统访问参考图像(如在步骤102所指示)和每日图像(如步骤104所指示)。如上所述,参考图像还可被称为计划图像,并且通常是在治疗当日之前获取的患者图像。每日图像通常是在治疗当日获取的患者图像。访问这些图像可包括从存储器或其他数据存储中检索先前获取的图像,或者在每日图像的实例中,可包括使用合适的医疗成像系统(诸如CT系统或MRI系统)来获取每日图像。
如步骤106所指示,从参考图像生成壳体结构并且还使用计算机系统来访问该壳体结构。壳体结构可以是例如具有已经或者是围绕在这些参考图像中的一个或多个参考图像中描绘的肿瘤、OAR、或其他关键结构而创建的具有特定厚度的壳体结构。作为一个示例,壳体结构可具有10mm的厚度。作为另一个示例,壳体结构可具有5mm的厚度。更具体地,壳体结构可具有大于或小于10mm的厚度。
如步骤108所指示,在参考图像和每日图像之间执行可变形图像配准(“DIR”)。例如,可部分基于从参考图像生成的壳体结构来执行DIR。如步骤110所指示的,基于可变形图像配准来计算雅可比行列式直方图(“JDH”)。例如,可基于DIR中估计的变形场的雅可比矩阵的行列式来计算JDH。如步骤112所指示,计算JDH的一个或多个度量。作为示例,度量可包括最小值(“min”)、最大值(“max”)、半峰全宽(“FWHM”)、峰值、标准偏差、斜度或其组合。在步骤114处基于一个或多个JDH度量来生成是否应当发起OLAR的指示。例如,如果JDH度量中的一个度量未能满足预先建立的标准,则产生应当发起OLAR的指示。该指示可被产生并提供给用户,诸如通过生成在图形用户界面(“GUI”)上显示给用户的显示元素。在其他实现中,该指示可提示用户发起OLAR。
作为前列腺癌的一个示例,如果最小JDH小于0.47,则可生成OLAR是有利的指示并且可选地应发起OLAR的指示。作为另一示例,如果最小JDH大于0.47并且斜度大于1.45,但FWHM小于0.037,则可生成重新定位足够用于前列腺癌的放射疗法期间的分剂的指示。
当在判定框114处生成应当发起OLAR的指示时,使用OLAR生成新的治疗计划并且新的治疗计划用于向患者提供放射疗法,如步骤116所指示。否则,当前治疗计划被访问并用于向患者提供放射疗法,如步骤118所指示。
在一些情况下,可使用计算机系统的硬件处理器和存储器来实现机器学习算法,以便识别JDH的度量、度量的标准或两者,这些可用于提供OLAR是否是有利的的指示,并且可选地可用于提供应当发起OLAR的指示。作为一个示例,机器学习算法可用于使用适当JDH度量来训练复杂决策树,该复杂决策树可预测OLAR是否将是有利的并且可选地是否发起OLAR的指示。图2中示出了此类决策树的示例。
在一个示例研究中,上文描述的方法被展现在用于前列腺癌的CT引导的RT期间使用室内CT获取的每日CT上。在每日CT和参考CT之间执行DIR。从前列腺和在前列腺周围的均匀的10mm扩展中提取JDH。使用可包括监督式机器学习算法的机器学习算法,使用可预测每日CT集对OLAR的需要的适当JDH度量来训练复杂决策树。从12个随机选择的前列腺病例的六十个每日CT被用作分类器的训练数据集,其中使用用于OLAR和重新定位两者的剂量测定(dosimetric)计划来确定分类。使用来自各自具有5个CT的九位其他患者的45个每日CT的独立数据集来测试所得的分类树。比较来自不同策略的5个分剂计划的累积剂量。具有混合OLAR和重新定位(使用分类树)的累积剂量与所有OLAR分剂是相当的。
现在参考图3,示出了根据本公开中描述的系统和方法的一些实施例的用于分析医疗图像数据以评定是否实现OLAR的系统300的示例。如图3所示,计算设备350可从图像源302接收一种或多种类型的数据(例如,医疗图像数据),图像源302可以是医疗图像源。在一些实施例中,计算设备350可执行OLAR发起评估系统304的至少一部分以确定是否发起OLAR以从接收自图像源302的数据生成更新的放射治疗计划。
附加地或替代地,在一些实施例中,计算设备350可以通过通信网络354将关于从图像源302接收的数据的信息传达到服务器352,服务器352可执行OLAR发起评估系统304的至少一部分。在此类实施例中,服务器352可以将指示OLAR发起评估系统304的输出的信息返回到计算设备350(和/或任何其他合适的计算设备)。
在一些实施例中,计算设备350和/或服务器352可以是任何合适的计算设备或设备的组合,诸如台式计算机、膝上型计算机、智能电话、平板计算机、可穿戴计算机、服务器计算机、由物理计算设备执行的虚拟机等等。计算设备350和/或服务器352还可以从数据重建图像。
在一些实施例中,图像源302可以是任何合适的图像数据(例如,测量数据、从测量数据重建的图像)源,诸如CT系统、MRI系统、另一计算设备(例如,存储图像数据的服务器)等等。在一些实施例中,图像源302可在计算设备350本地。例如,图像源302可以与计算设备350结合(例如,计算设备350可被配置为用于捕获、扫描和/或存储图像的设备的一部分)。作为另一示例,图像源302可通过电缆、直接无线链路等等连接到计算设备350。附加地或替代地,在一些实施例中,图像源302可相对于计算设备350本地地和/或远程地定位,并且可以经由通信网络(例如,通信网络354)将数据传达到计算设备350(和/或服务器352)。
在一些实施例中,通信网络354可以是任何合适的通信网络或通信网络的组合。例如,通信网络354可包括Wi-Fi网络(Wi-Fi网络可包括一个或多个无线路由器、一个或多个交换机等)、对等网络(例如,蓝牙网络)、蜂窝网络(例如,符合任何合适的标准(诸如CDMA、GSM、LTE、高级LTE、WiMAX等)的3G网络、4G网络等)、有线网络等等。在一些实施例中,通信网络108可以是局域网、广域网、公共网络(例如,互联网)、专用或半专用网络(例如,公司或大学内联网)、任何其他合适类型的网络、或任何合适的网络的组合。图3所示的通信链路可各自是任何合适的通信链路或通信链路的组合,诸如有线链路、光纤链路、Wi-Fi链路、蓝牙链路、蜂窝链路等等。
现在参考图4,示出了根据本公开中描述的系统和方法的一些实施例的可用于实现图像源302、计算设备350和服务器354的硬件400的示例。如图4所示,在一些实施例中,计算设备350可包括处理器402、显示器404、一个或多个输入406、一个或多个通信系统408和/或存储器410。在一些实施例中,处理器402可以是任何合适的硬件处理器或处理器的组合,诸如中央处理单元(“CPU”)、图形处理单元(“GPU”)等等。在一些实施例中,显示器404可包括任何合适的显示设备,诸如计算机监视器、触摸屏、电视机等等。在一些实施例中,输入406可包括可用于接收用户输入的任何合适的输入设备和/或传感器,诸如键盘、鼠标、触摸屏、麦克风等等。
在一些实施例中,通信系统408可包括用于通过通信网络354和/或任何其他合适的通信网络传达信息的任何合适的硬件、固件和/或软件。例如,通信系统408可包括一个或多个收发器、一个或多个通信芯片和/或芯片组等等。在更具体的示例中,通信系统408可包括可用于建立Wi-Fi连接、蓝牙连接、蜂窝连接、以太网连接等等的硬件、固件和/或软件。
在一些实施例中,存储器410可包括可用于存储指令、值、数据等等的任何合适的一个或多个存储设备,这些指令、值、数据等等例如可由处理器402使用以使用显示器404来呈现内容、以经由(多个)通信系统408与服务器352通信等等。存储器410可以包括任何合适的易失性存储器、非易失性存储器、存储或其任何合适的组合。例如,存储器410可包括RAM、ROM、EEPROM、一个或多个闪存驱动器、一个或多个硬盘、一个或多个固态驱动器、一个或多个光驱动器等等。在一些实施例中,存储器410可具有编码在其上或以其他方式存储在其中的、用于控制计算设备350的操作的计算机程序。在此类实施例中,处理器402可以执行计算机程序的至少一部分以呈现内容(例如,图像、用户界面、图形、表格)、从服务器352接收内容、向服务器352发送信息等等。
在一些实施例中,服务器352可包括处理器412、显示器414、一个或多个输入416、一个或多个通信系统418和/或存储器420。在一些实施例中,处理器412可以是任何合适的硬件处理器或处理器的组合,诸如CPU、GPU等等。在一些实施例中,显示器414可包括任何合适的显示设备,诸如计算机监视器、触摸屏、电视机等等。在一些实施例中,输入416可包括可用于接收用户输入的任何合适的输入设备和/或传感器,诸如键盘、鼠标、触摸屏、麦克风等等。
在一些实施例中,通信系统418可包括用于通过通信网络354和/或任何其他合适的通信网络传达信息的任何合适的硬件、固件和/或软件。例如,通信系统418可包括一个或多个收发器、一个或多个通信芯片和/或芯片组等等。在更具体的示例中,通信系统418可包括可用于建立Wi-Fi连接、蓝牙连接、蜂窝连接、以太网连接等等的硬件、固件和/或软件。
在一些实施例中,存储器420可包括可用于存储指令、值、数据等等的任何合适的一个或多个存储设备,这些指令、值、数据等等例如可由处理器412使用以使用显示器414来呈现内容、以与一个或多个计算设备350通信等等。存储器420可以包括任何合适的易失性存储器、非易失性存储器、存储或其任何合适的组合。例如,存储器420可包括RAM、ROM、EEPROM、一个或多个闪存驱动器、一个或多个硬盘、一个或多个固态驱动器、一个或多个光驱动器等等。在一些实施例中,存储器420可具有编码在其上的用于控制服务器352的操作的服务器程序。在此类实施例中,处理器412可执行服务器程序的至少一部分,以将信息和/或内容(例如,数据、图像、用户界面)发送到一个或多个计算设备350、从一个或多个计算设备350接收信息和/或内容、从一个或多个设备(例如,个人计算机、膝上型计算机、平板计算机、智能电话)接收指令等等。
在一些实施例中,图像源302可包括处理器422、一个或多个图像获取系统424、一个或多个通信系统426和/或存储器428。在一些实施例中,处理器422可以是任何合适的硬件处理器或处理器的组合,诸如CPU、GPU等等。在一些实施例中,一个或多个图像获取系统424通常被配置成获取数据、图像或两者,并且可包括CT系统和MRI系统或两者。附加地或替代地,在一些实施例中,一个或多个图像获取系统424可包括用于耦合到CT系统和MRI系统或两者和/或控制CT系统和MRI系统或两者的操作的任何合适的硬件、固件和/或软件。在一些实施例中,一个或多个图像获取系统424的一个或多个部分可以是可移除的和/或可替换的。
注意,尽管未示出,但是图像源302可包括任何合适的输入和/或输出。例如,图像源302可包括可用于接收用户输入的输入设备和/或传感器,诸如键盘、鼠标、触摸屏、麦克风、触控板、轨迹球等等。作为另一示例,图像源302可包括任何合适的显示设备(诸如计算机监视器、触摸屏、电视机等)、一个或多个扬声器等等。
在一些实施例中,通信系统426可包括用于向计算设备350(并且,在一些实施例中,通过通信网络354和/或任何其他合适的通信网络)传达信息的任何合适的硬件、固件和/或软件。例如,通信系统426可包括一个或多个收发器、一个或多个通信芯片和/或芯片组等等。在更具体的示例中,通信系统426可包括可用于建立使用任何合适的端口和/或通信标准(例如,VGA、DVI视频、USB、RS-232等)的有线连接、Wi-Fi连接、蓝牙连接、蜂窝连接、以太网连接等等的硬件、固件和/或软件。
在一些实施例中,存储器428可包括可用于存储指令、值、数据等等的任何合适的一个或多个存储设备,这些指令、值、数据等等例如可由处理器422使用以:控制一个或多个图像获取系统424和/或从一个或多个图像获取系统424接收数据;从数据成像;使用显示器来呈现内容(例如,图像、用户界面);与一个或多个计算设备350通信等等。存储器428可以包括任何合适的易失性存储器、非易失性存储器、存储或其任何合适的组合。例如,存储器428可包括RAM、ROM、EEPROM、一个或多个闪存驱动器、一个或多个硬盘、一个或多个固态驱动器、一个或多个光驱动器等等。在一些实施例中,存储器428可具有编码在其上或以其他方式存储在其中的、用于控制图像源302的操作的程序。在此类实施例中,处理器422可执行程序的至少一部分,以生成图像、将信息和/或内容(例如,数据、图像)发送到一个或多个计算设备350、从一个或多个计算设备350接收信息和/或内容、从一个或多个设备(例如,个人计算机、膝上型计算机、平板计算机、智能电话等)接收指令等等。
在一些实施例中,可以将任何合适的计算机可读介质用于存储用于执行本文所述的功能和/或过程的指令。例如,在一些实施例中,计算机可读介质可以是瞬态的或非瞬态的。例如,非瞬态计算机可读介质可包括以下介质,诸如:磁介质(例如,硬盘、软盘)、光介质(例如,压缩碟、数字视频碟、蓝光碟)、半导体介质(例如,随机存取存储器(“RAM”)、闪存、电可编程只读存储器(“EPROM”)、电可擦除可编程只读存储器(“EEPROM”))、在传输期间不是短暂的或不是没有任何持久外观的任何合适的介质、和/或任何合适的有形介质。作为另一示例,瞬态计算机可读介质可包括在网络上的信号、在电线的信号、导体、光纤、电路、或在传输期间是短暂地且没有任何持久外观的任何合适介质、和/或任何合适的无形介质。
如上所述,基于患者的每日图像(即,在放射治疗当日(诸如紧接在放射递送之前)获得的图像)的准确分割是在线ART重新计划的重大挑战。可用的自动分割技术不能总是生成准确的轮廓。本公开中描述的系统和方法提供了使用图像纹理信息来对从自动分割生成的不准确的轮廓进行自动校正。
通常,根据实况(ground truth)轮廓(例如,由经验丰富的放射肿瘤医生来圈定(delineate)的轮廓)在切片的基础上评估通过自动分割生成的初始轮廓。与实况相比,基于一个或多个相似度标准,初始轮廓被认为是不准确的。使用基于纹理的自动轮廓校正方法来重新处理不准确的轮廓。该过程通常包括两个步骤:计算基于体素的纹理特征图(例如,从初始轮廓创建的感兴趣的区域(“ROI”)内的使用3×3块大小的GLCM聚类阴影纹理特征图),并且将纹理特征图作为外力合并到活动轮廓算法中以找到正确的结构边界。
MRI和放射疗法的集成(例如,使用集成的线性加速器、或直线加速器)可提供高对比度实时MRI图像以用于每日在线治疗适应。当日图像(即,治疗当日获得的图像)可帮助考虑到分剂之间的解剖结构变化,并且由此更加精确地递送放射剂量。在在线自适应重新计划的整个链中,在每日图像上形成肿瘤和正常组织的轮廓是最耗时的过程之一,这限制了在线ART的临床应用。
在当前的放射学实践中,临床图像的解读主要依赖于视觉评定或基于图像强度的一些定性度量。在图像内更多的定量病理生理学信息仍未被揭示。已将定量纹理特征分析引入到放射肿瘤学领域以用于综合疾病表征和治疗响应的早期预测。最近,已经采用纹理信息用于自动分割算法。活动轮廓模型(也被称为“蛇(snake)”模型)是一种此类算法。蛇模型的适应过程将活动形状(例如,2D轮廓或3D表面)吸引到期望的图像特征(诸如,特定强度、图像边缘或纹理图案)。
蛇模型的一个已知困难是确定活动曲线的初始形状和位置。如果蛇距离实际边界太远地初始化,则结果可能不能够覆盖对象边界。在另一方面,如果初始轮廓接近实际轮廓并且具有与实际轮廓类似的形状,则可以在准确度和效率两者的方面上大大提高蛇模型的性能。
本公开中描述的系统和方法通过提供快速且半自动的轮廓校正方法来解决该问题,该轮廓校正方法将定量图像纹理特征合并到活动轮廓模型中。作为示例,通过分剂之间的可变形配准的自动生成的轮廓可用作轮廓形成算法(诸如蛇模型)的初始曲线。在这样做时,先前的结构知识用于帮助引导新图像的分割。
图5示出了示例的基于纹理的自动轮廓校正方法的工作流。在步骤502处使用计算机系统访问实况轮廓,并且在步骤504处使用计算机系统访问自动生成的初始轮廓。在步骤506处根据实况轮廓在2D切片基础上评估初始轮廓。在判定框508处评估轮廓,并且如果未满足相似度标准,则将该轮廓视为不准确的。作为一个示例,与实况相比,戴斯(Dice)系数(“DICE”)大于0.9、或者豪斯多夫(Hausdorff)距离(“HD”)小于3mm可用作相似度标准。如果轮廓被识别为准确的,则在步骤510处将这些轮廓存储用于使用。如果轮廓被识别为不准确的,则在步骤512处将这些轮廓存储用于附加的处理。
随后,在步骤514处预处理所识别的不准确的切片,以准备输入图像和轮廓以用于进一步程序。输入图像可以是磁共振图像、CT图像、超声图像、或使用合适的成像模态获取的任何图像。例如,MRI机器的磁场中的不同质性可引起将(诸如通过引起跨图像的不同质的灰度(gray level)分布以及模糊的边缘和边界)损坏图像的偏置场。可执行预处理步骤以校正偏置场的影响。此外,可应用非线性双边滤波以平滑MRI图像,以便在保留边缘的同时降低噪声。
自动轮廓校正方法516开始于GLCM纹理特征图计算,在步骤518处可针对从初始轮廓创建的ROI计算GLCM纹理特征图计算。在一些实现中,可通过提取ROI的纹理特征来加速效率,该ROI是通过向初始轮廓的边界框添加裕量(margin)(例如,10mm裕量)来创建的。对于ROI内的每个体素,由从感兴趣的体素周围的块(例如,3×3的块)导出的GLCM纹理特征来替代每个体素值。在一些情况下,GLCM特征可以是GLCM聚类阴影特征,由于GLCM聚类阴影特征增强组织边界对比度的能力,这是有利的。具有跨体素的灰度变化的块单元将具有较大的GLCM聚类阴影特征值,而同质的块将具有较小的特征值。取决于用于GLCM计算的灰度的数量,由于在形状边缘的计算方程上的三次方,形状边缘可具有非常大的大小。
其中p(i,j,θ,d)是GLCM矩阵元素,p(i,j,θ,d)包含在特定位移距离d和特定角度(θ)处的灰度i和j的一对像素的统计概率。在一些实现中,原始图像可首先被重新缩放以降低灰度的数量。可通过灰度的数量来确定GLCM矩阵的大小。为了避免方向依赖性,可以沿四个角度(即,θ=0、45、90、135)累积矩阵。两个像素之间的距离d可被选择为1。
随后,将特征图作为外力集成到活动轮廓算法中以找到正确的结构边界,如步骤520所指示。活动轮廓模型通常可包括三个阶段:初始化,变形和终止。作为一个示例,通过分剂之间的可变形配准的自动生成的轮廓可用作蛇模型的初始曲线。在变形阶段期间,蛇模型通过最小化能量函数来移动轮廓点。如方程(3)所示,能量函数(E
其中v(s)是轮廓点,并且N是轮廓点的总数量。
如方程(4)所示,可将内部能量进一步划分为两个能量分量:弹性力和弯曲力,弹性力和弯曲力分别是轮廓的一阶导数和二阶导数。
α和β表示每项的加权因子。弹性力控制蛇的张力,而弯曲力控制蛇的刚性。在变形过程期间,可调谐加权因子以调整曲线的平滑度,以更好地匹配对象边界的形状。在迭代期间,内力仅与曲线的形状有关,内力独立于图像特征。
计算出的GLCM聚类阴影特征图用作外力以引导活动曲线寻找实际边界,实际边界的特征值与同质区域相比相对较大。传统蛇模型具有外力仅存在于边缘处的问题。对于位于器官的同质区域内部的点,活动轮廓可能不能够收敛到边界。为了解决该问题,可向外部能量函数添加“气球力(balloon force)”,如方程(5)所示。如方程(6)所示,沿曲线的法线方向计算气球力,其中μ是气球力的加权因子。在蛇评估期间,参数μ可被视作蛇移动的步长。
其中n(s)是v(s)处的曲线的法向单位矢量。为了避免由气球力引起的轮廓泄漏,可应用二元阈值函数ζ(v(s))。仅对具有低于预定阈值的特征值的轮廓点激活气球力。对于高特征值点,气球力等于零。作为一个示例,可将阈值选择为常数,诸如常数50。
如上所述,对于蛇模型的每个项,总共有四个加权因子。这些因子对蛇的行为和变形过程的性能具有显著的影响。此外,MRI图像的固有特性引起较大的患者间差异以及甚至患者内差异。每个图像集受益于不同的参数值集,以使蛇表现良好。为了解决该问题,可使用用户界面来交互地调谐每个图像集的关键参数。可基于样本切片的轮廓校正性能来调谐参数。可将这些值应用于剩余的切片以提高效率。也可以根据需要针对每个切片调谐这些值。
可设置在变形过程期间执行的迭代的默认最大数量,诸如使用300次总迭代的值。在其他实现中,还可以针对每次迭代计算并存储重叠区域变化率(“CR”)。如果对于连续次数的迭代(例如,五次迭代),CR小于0.01,这意味着蛇收敛到稳定状态,则迭代过程也可以终止。
在活动轮廓形成之后,在步骤522处执行形态学操作以细化轮廓。最后,在步骤524处,在经校正的轮廓上重新计算DSC和HD,以评估所提出的方法的性能。经更新的轮廓可被存储并用于稍后使用。
图6A-6C示出了代表性示例以描绘上文描述的基于纹理的轮廓校正方法。图6A示出了实况轮廓以及从分剂内可变形配准生成的轮廓。由于不同分剂之间的较大变形,在该示例中使用的轮廓算法未能为该切片生成准确的胰头轮廓。图6B示出了计算出的GLCM聚类阴影特征图,其中与原始MRI图像相比,胰头与周围组织之间的边界被增强。在图6C中,使用青色的线示出了演化的轮廓,同时用不同的颜色(即,绿色、蓝色和红色)高亮了实况轮廓、初始轮廓和经校正轮廓。在校正之后,轮廓成功地收敛到实况。
上文描述的基于图像纹理的自动轮廓校正方法可用于提高总体轮廓准确度和轮廓修改的效率。方法可用作MRI引导的在线重新计划的分割过程的一部分。
如上所述,期望在在线自适应重新计划(“OLAR”)中稳健地验证自动分割的轮廓。本公开中描述的系统和方法提供了使用医疗图像的定量图像特征(例如,图像纹理特征)的快速且自动化的患者特定的轮廓验证方法。医疗图像可以是对象的每日图像(即,治疗当日获得的患者图像)或先前获取的图像,并且可以是CT图像、MRI图像、或任何其他合适的医疗图像。
对于OLAR,基于医疗图像(诸如当日图像)的自动分割的准确度是一个挑战。传统上通过耗时的手动审查过程来执行自动分割的轮廓的验证。本公开中描述的系统和方法提供了使用定量图像纹理特征的快速且自动化的患者特定的轮廓验证方法。
在被分剂的RT中,由于分剂之间的变化,对于给定分剂,在治疗之前使用计划CT(“pCT”)生成的治疗计划可能不是最佳的。室内成像器(诸如MRI、在轨CT和锥形束CT(“CBCT”))的引入已经在每日基础上使患者的解剖结构可视化成为可能。OLAR可用于在治疗过程期间响应于分剂之间的解剖结构变化而适应放射计划。由于重新计划过程需要在患者在床台上躺卧并等待时在实际的时间段内完成,因此OLAR的效率仍然是一个挑战。已经开发了不同种类的计算机化工具以增加重新计划过程的速度。一个所识别的瓶颈是在当日图像上圈定目标器官和关键器官的时间。
在近年中,诸如基于机器学习的图像自动分割和基于可变形图像配准(“DIR”)的轮廓传播方法之类的新技术已被开发并用于在每日图像上生成轮廓。每日MRI图像的引入在提高每日轮廓的质量的方面尤其有用。因为使用当前可用的方法自动生成的轮廓并不完美,所以在OLAR过程中通常需要对每日轮廓进行验证和手动编辑。当前,通过手动审查过程来执行轮廓的验证,这是耗时的,并且因此对于OLAR是不切实际的。期望更高效和稳健的自动轮廓评估和验证方法以促进OLAR的应用。
医疗图像不仅包含人类解剖结构的视觉描绘,而且包含可挖掘的数据(诸如定量病理生理学信息)。在图像分析和计算机视觉应用中,纹理分析可以是非常有用的图像属性。通常从图像中的像素强度的统计分布来计算纹理特征。取决于统计计算中的强度点(即,像素)的数量,可将纹理特征分类为一阶统计量、二阶统计量和高阶统计量。那些高阶纹理特征具有揭示难以从原始图像可视化的信息的潜力。
对于头部和颈部的情况,器官的形状和相对位置通常是稳定的,具有小的变化,这使得这些器官是应用基于几何的轮廓评定的良好候选项。相反,由于综合原因(诸如呼吸运动和肠运动以及不同的充盈状态),腹部和骨盆器官可呈现大的位移和变形。因此,难以在那些器官上应用基于几何的轮廓评定。然而,即使在形状和位置改变的情况下,对于特定器官,纹理特征可以是不变的。
构想到每个解剖结构具有可能对人类用户不可见的不同的、定量的图像纹理特征。还构想到在结构与周围组织之间的这些图像纹理的差异可用于识别轮廓是否有效。
本公开中描述的系统和方法提供了使用对象的当日图像或其他医疗图像的定量图像纹理特征的快速且自动化的患者特定的轮廓验证方法。作为示例,对于每个测试轮廓,可生成内壳和外壳。例如,可分别通过以设定量(例如,3mm)对轮廓进行削减和扩展来生成内壳和外壳。可计算针对这些内壳和外壳的基于二阶灰度共生矩阵(“GLCM”)的纹理特征,然后将该纹理特征归一化为相应的轮廓中的中心区域(例如,体积的20%)。可基于对于由内壳封围的体积的纹理值是否一致以及对于由外壳封围的体积的纹理值是否显著地不同来识别准确的轮廓。否则,轮廓将被识别为不准确的。基于人工智能(“AI”)的模型可被构建并训练成访问核心区域、内壳区域以及外壳区域的纹理属性。作为示例,基于AI的模型可以是基于监督式学习来构建和训练的基于机器学习(“ML”)的模型。作为另一示例,基于AI的模型可以是决策树模型。例如,基于ML的模型可以实现递归随机森林分类算法以对图像特征进行排名并选择排名最高的特征。监督式分类模型也可被实现用于轮廓验证。可从准确的轮廓数据库中导出多特征标准以验证核心区域。对于外壳和内壳评估,合适的纹理特征可被识别为在器官和周围组织之间具有大的不同的特征值的那些纹理特征。可将接收器操作特性(“ROC”)曲线用于确定针对所选择的特征的阈值以辨别准确的轮廓和不准确的轮廓。
可自信地将分类为准确的的轮廓直接用于自适应重新计划和治疗,而不准确的轮廓需要由临床医生进行附加的审查过程或使用本公开中描述的方法进行校正。在在线适应期间,本公开中描述的轮廓验证方法可替代检查轮廓的耗时的手动过程,从而促进OLAR的例行实践。
现在参考图7,流程图被示出为阐述自动化轮廓验证的示例方法的步骤。方法包括模型训练阶段702和轮廓评估阶段704,模型训练阶段702可以是离线模型训练阶段。
使用计算机系统来访问轮廓数据,如步骤706所指示。轮廓数据通常包括对象的图像和相应的准确的轮廓和不准确的轮廓。例如,轮廓数据可包括自动生成的器官轮廓以及手动生成的实况轮廓。作为示例,可基于多个标准(诸如具有戴斯相似度系数≥0.85,到一致(agreement)的平均距离≤1.5mm,以及到一致的距离的百分之95≤5mm)来识别准确的轮廓。
通过从存储器或其他存储设备或介质检索轮廓数据来使用计算机系统访问轮廓数据。在一些情况下,访问轮廓数据可包括使用医疗成像系统来获取图像并且将图像传达或以其他方式传递到计算机系统。附加地或替代地,访问轮廓数据可包括从医疗图像中生成轮廓并且将那些轮廓传达或以其他方式传递到计算机系统。
随后,将轮廓数据分成训练数据和测试数据,如步骤708所指示。训练数据将用于训练基于AI的模型以用于评估测试数据。作为示例,轮廓数据中的轮廓可被随机地分开,使得轮廓数据的第一百分比被分配为训练数据并且轮廓数据的第二百分比被分配为测试数据。例如,轮廓数据的三分之二可被用作训练数据并且轮廓数据的三分之一可被用作测试数据。
在模型训练阶段702中,可在步骤710处对训练数据中的输入图像和轮廓进行预处理以促进稍后的纹理特征计算。预处理步骤的目的在于准备输入图像和轮廓用于纹理提取和以其他方式提高图像质量和基于AI的模型的训练效率。因为在给定器官内纹理是唯一且均匀的,所以具有已知的不同纹理的部分应当被从纹理提取中排除以避免使最终结果恶化。
作为一个示例,CT图像可在范围[-200HU,300HU]内被阈值化,以便包括所有软组织,但排除骨骼和空气。附加地或替代地,对于胰腺患者,可使用100–150HU的阈值来排除十二指肠支架和来自胰头的钙化,因为胰腺组织通常具有小于150HU的CT数,而十二指肠支架的CT数一般大于该数值。在另一方面,器官内的气体内容可对计算出的纹理具有严重的影响。随后,可对所有所选择的器官应用-30HU的阈值以排除气体区域。在设置阈值之后,使用形态学开闭滤波器来进一步平滑器官轮廓。附加地或替代地,可重新缩放图像强度值,诸如以降低灰度数。作为示例,可将图像强度值重新缩放到250个灰度(面元宽度(bin width)2HU)、500个灰度等等。可以使用适当的阈值化技术来对MRI图像类似地进行阈值化。
可以仅考虑轮廓内部的体素来生成器官掩模,以增加计算效率。作为另一示例,为了增加计算效率,可将边界框定义为完全封围所有轮廓点的最小矩形框。随后,可以通过向边界框添加扩展裕量(诸如25mm的扩展裕量)来裁剪图像。
为了降低图像噪声,可将使用两个3×3高斯核(Gaussian kernel)的双边滤波应用于经裁剪的图像。核在空间域和强度域中的标准偏差可分别被选择为1和0.5。由于该滤波器类型保留尖锐边缘的能力而选择该滤波器类型。应当理解,也可实现其他降噪滤波器或其他降噪算法。
随后,从训练数据中的每个轮廓生成掩模,并将掩模细分成三个子区域(例如,核、内壳、外壳),如步骤712所指示。为了获得训练数据中的给定器官轮廓的核心区域或中心区域,可首先通过将值0分配给轮廓内部的任何像素并将值1分配给轮廓外部的像素来构建二进制掩模。随后,可使用像素与最近的边界像素之间的距离度量(诸如欧几里得距离)来生成距离图(例如,包含在掩模内的每个像素到轮廓表面的距离)。可基于距离图中具有最大值的像素的百分比(例如,20%、30%)来确定中心核心区域。可针对每个测试轮廓生成内壳和外壳。作为示例,可通过在每个2D切片上以选定量(例如,4mm)削减和膨胀器官掩模来生成内壳和外壳。可选择4mm的壳厚度来识别比典型的3mm临床公差更大的轮廓误差。
随后从核心区域、内壳区域和外壳区域中计算或以其他方式提取图像特征(例如,纹理特征、形状特征),如步骤714所指示。作为一个非限制性示例,图像特征可包括以下图像特征中的一些或全部:基于强度直方图的图像特征,包括均值、标准偏差、范围、斜度和峰度;基于灰度共生(GLC)的图像特征;以及基于灰度游程(gray-level run-length;GLR)的图像特征。
可通过在每个切片上累积数个位移角度以避免方向依赖性、然后对所有2D切片求和来计算GLC和GLR矩阵。作为一个示例,可使用四个角度(例如,0°、45°、90°和135°)。作为另一示例,可使用九个角度(例如,0°、45°、90°、135°、180°、235°、270°、315°和360°)。可分别从三个子区域中的每个子区域中提取图像特征(例如,纹理特征)。用于计算GLC矩阵的两个像素之间的距离可被选择为1。
可从GLC矩阵(“GLCM”)提取基于GLC的特征。在下面的表1中列出了一些纹理特征的对应方程。在示例研究中,随机选择三个测试用例并且使用不同的间隔从原始轮廓生成内壳和外壳,以将不同量的周围组织包括到特征计算中。合适的特征应当在器官与周围组织之间具有高方差。此后,在模型训练过程期间,可通过以设定量(例如,3mm、4mm)削减和扩展轮廓来为每个测试轮廓生成内壳和外壳。随后,可针对内壳和外壳两者计算所选择的纹理特征并将该纹理特征用于轮廓质量验证。
表1基于GLCM的纹理特征的概述
在大多数纹理分析研究中,为了在统计分析期间减少偏差并提取有意义的信息,通常按照相同的扫描协议(诸如相同的扫描机、相同的扫描管电压和电流等等)来选择对象。然而,在本公开中描述的系统和方法中,提供了用于实际使用的一般器官轮廓质量检查例程,而不论扫描协议或甚至不同的器官状态(例如,正常或异常)。即使对于同一器官,这些因素也可影响纹理特征值。为了消除机器影响、扫描影响和患者特定的影响,可对从每个壳计算的特征值进行归一化。作为示例,从每个壳计算的特征值可被归一化到对应轮廓中的中心核心区域(例如,体积的20%)。
随后,基于AI的模型被构建并用于评估核心区域、内壳区域和外壳区域的图像特征属性,如步骤716所指示。如上所述,在一些情况下,基于AI的模型可以是实现监督式学习的基于ML的模型。作为一个非限制性示例,基于AI的模型是决策树模型,该决策树模型可被训练成访问核心区域、内壳区域和外壳区域的纹理属性。图8中示出了决策树模型的示例。决策树模型提供了数据挖掘的有效方法。通常,决策树模型通过提出关于与数据相关联的属性的一系列问题来将数据分区成子集。树上的每个节点包含一个问题并且具有一个“是”子节点和一个“否”子节点。在一个示例中,如图8所示,建立了三级决策树以评估核心区域、内壳区域和外壳区域的纹理特征属性。满足来自三个级别中的所有属性问题(即,“是”节点)的轮廓被识别为准确的;否则,轮廓将被确定为不准确的并且被报告用于进一步验证。
图8所示的示例决策树模型的第一级802验证所生成的核心区域的准确度。可分析来自实况轮廓的核心区域的每个特征的分布以导出特定器官的统计置信界限。作为一个示例,为了减小特征维度,可跨所有计算出的纹理特征生成相关系数矩阵、分层聚类或两者。例如,可使用沃德(Ward)最小方差聚类方法来实现分层聚类。独立的或弱相关的特征可被识别并用于核心区域评估。
在生成了相关系数矩阵的示例中,可将以下方程用于计算相关系数ρ:
其中运算符E表示其自变量的期望(均值)值;μ
可通过使用相关系数矩阵对特征进行分层聚类来产生系统树图(dendrogram)。图9A和图9B分别示出了胰头轮廓和十二指肠轮廓的系统树图或分层聚类树的示例。聚类树中的x轴示出了两个特征之间的联接距离。该距离越小,两个特征的关联越接近。
作为一个非限制性示例,可将0.5的相异距离用作识别聚类的截止。在每个聚类内,可选择具有最小相关性标准的特征。为了进一步减小维度,可对经减小的特征集使用主成分分析(“PCA”)以识别描述数据中的方差的95%的一组主成分。在这些情况下,这些主成分被接受为“主特征”,“主特征”以高重现性且没有冗余地分别描述胰头和十二指肠的核子区域的纹理性质。可计算描述实况轮廓的核心区域的主特征的值,并且基于计算出的最小值和最大值来为每个特征定义可接受的值的范围。可将模型标准设置为要求:对于模型看到的任何新的轮廓,在核心区域中的所有主特征的值必须落在该主特征的相应接受的范围内。具有落在相应接受的范围之外的任何主特征值的轮廓被标记以供进一步检查。
作为另一个非限制性示例,在系统树图上的一个聚类内,选择了具有最小方差的特征并且选择了总共六个独立(或弱相关)特征,在该示例中,这六个独立(或弱相关)特征是熵、峰度、斜度、均值、信息测量相关性和同质性。对于给定轮廓,可选择针对“正确的”核心区域的标准,使得6个所选特征中的至少5个应在从实况轮廓导出的相应的95%统计分布范围内。通过这些标准的实况轮廓的统计概率(P)将是:
其中运算符B表示二项式系数。这意味着该标准可描述特定器官的纹理图案的96.7%。未能满足这些标准的轮廓(即,6个特征中的至少2个特征在95%统计分布范围之外)将被识别为不准确的。
图8所示的示例决策树的第二级804和第三级806识别能够最佳地辨别感兴趣的器官与周围组织的特征。为此,可针对实况轮廓生成多个壳体积,并且可针对每个壳计算纹理特征。作为非限制性示例,配对的T检验可用于将所有实况轮廓的内壳的特征值与外壳的特征值进行比较,以便识别在值上具有显著差异(例如,p<0.01)的那些特征。可以为决策树模型选择具有在内壳和外壳之间的最大绝对差异的特征,从而确保所选择的特征具有最高的灵敏度来区分误标记的周围组织(例如,脂肪或不同器官)。
由此得出,通过决策树的第二级804和第三级806的标准是:内壳的纹理特征值与核的纹理特征值之间的差异应小于定义的阈值(第二级804)并且外壳的纹理特征值与核的纹理特征值之间的差异应大于定义的值(第三级806)。纹理特征值中的差异ΔTF可被定义为:
图10A-10D中示出了纹理特征选择的代表性测试用例。对于胰头和十二指肠轮廓两者,壳体积以最大10mm的间隔向内收缩并以最大20mm向外扩展。图10C和图10D中的X轴表示从原始轮廓扩展(正)或收缩(负)的间隔。所有特征值都被归一化为从原始器官体积中提取的一个特征值。对于内壳,所有相对特征值是稳定的并且接近于1。对于外壳,GLCM聚类突出度示出了所有特征之间最显著的差异。即使1mm的外壳也显示出与初始器官体积相比显著的值变化。
GLCM聚类突出度(“PCLP”)计算的方程在上面的表1中示出。GLCM聚类突出度是矩阵值与强度加权的平均值之间的变化的四次方。由于GLCM聚类突出度的数学特性,GLCM聚类突出度对于具有高/低强度的大的反常(deviant)体素对(诸如胰头周围的脂肪组织)非常灵敏。因此,在一些情况下,GLCM聚类突出度可被选择为用于评估内壳和外壳中的纹理特征的合适的特征。为简单起见,可分别将内壳和外壳的GLCM聚类突出度称为InClusP和OutClusP。
再次参考图7,基于AI的模型的参数被优化,如步骤718所指示。例如,可采用ROC曲线分析来选择内壳和外壳的最佳阈值。可通过在所选纹理特征(诸如InClusP和OutClusP)的各种阈值设置下绘制针对(1-特异性)的灵敏度来创建ROC曲线。灵敏度和特异性的方程如下:
其中TP、TN、FP和FN分别是真阳性、真阴性、假阳性和假阴性。灵敏度是正确的轮廓被正确地识别为正确的的比率,而特异性表示不准确的轮廓被正确地识别为不准确的的比率。为了评估模型性能,也可以从ROC曲线中计算假阴性率(“FNR”)、假阳性率(“FPR”)和准确度:
FNR=1-灵敏度 (12);
FPR=1-特异性 (13);
在核心区域验证之后,可以获得ROC曲线以确定针对每个所选纹理特征的阈值。通过将内壳特征值的阈值从实况数据库的最小值离散地增加到实况数据库的最大值来生成第一ROC曲线。随着阈值增加,将正确地识别更多数量的准确的轮廓(即,灵敏度增加),并且同样地,将误标识更多数量的不准确的轮廓(即,特异性减小)。在准确度(即,灵敏度和特异性的平均值)对阈值的曲线图中可以观察到峰值。该特性可用于自动识别最佳阈值T
作为另一示例,可通过离散地增加内壳特征值的阈值来生成第一ROC曲线。随后,可将最佳阈值确定为对应于具有测试的最高可实现灵敏度和特异性的点的阈值。可通过应用预先定义的阈值并离散地增加外壳特征值的阈值来获得第二ROC曲线。可基于将特异性保持在高于所选百分比(例如,90%,对应于小于10%的FPR)并实现尽可能高的灵敏度来确定外壳特征值的最佳阈值。随后,可在决策树模型中使用所确定的阈值以确定任何新的轮廓的准确度。
最后,模型特征被准备好用于自动轮廓质量保证。在轮廓评估阶段704处,所识别的临床可接受的良好轮廓可立即用于进一步重新计划和治疗,而报告的不准确的轮廓可被发送给医师以进行手动修改或使用本公开中描述的轮廓校正方法进行校正。
使用定量纹理特征来评估并验证轮廓的质量的上述方法可以以高灵敏度和特异性来快速地识别准确的轮廓或不准确的轮廓。在在线适应期间,该方法可替代检查轮廓的耗时的手动过程,从而促进OLAR的例行实践。
现在参考图11,示出了根据本公开中描述的系统和方法的一些实施例的用于自动放射治疗计划轮廓验证和校正的系统1100的示例。如图11所示,计算设备1150可以从图像和轮廓数据源1102接收一种或多种类型的数据(例如,图像数据、轮廓数据),图像和轮廓数据源1102可包括CT图像、磁共振图像、其他医疗图像或它们的组合、以及从此类图像中生成的轮廓的源。在一些实施例中,计算设备1150可执行自动轮廓验证和校正系统1104的至少一部分以基于从图像和轮廓数据源1102接收的数据来自动验证轮廓、自动校正轮廓或两者。
附加地或替代地,在一些实施例中,计算设备1150可以通过通信网络1154将关于从图像和轮廓源1102接收的数据的信息传达到服务器1152,服务器1152可执行自动轮廓验证和校正系统1104的至少一部分。在此类实施例中,服务器1152可以将指示自动轮廓验证和校正系统1104的输出的信息返回到计算设备1150(和/或任何其他合适的计算设备)。
在一些实施例中,计算设备1150和/或服务器1152可以是任何合适的计算设备或设备的组合,诸如台式计算机、膝上型计算机、智能电话、平板计算机、可穿戴计算机、服务器计算机、由物理计算设备执行的虚拟机等等。计算设备1150和/或服务器1152还可以从数据重建图像。
在一些实施例中,图像和轮廓数据源1102可以是任何合适的图像数据(例如,测量数据、从测量数据重建的图像)源,诸如CT系统、MRI系统、另一计算设备(例如,存储图像数据的服务器)等等。在一些实施例中,图像和轮廓数据源1102可在计算设备1150本地。例如,图像和轮廓数据源1102可以与计算设备1150结合(例如,计算设备1150可被配置为用于捕获、扫描和/或存储图像的设备的一部分)。作为另一示例,图像和轮廓数据源1102可通过电缆、直接无线链接等等连接到计算设备1150。附加地或替代地,在一些实施例中,图像和轮廓数据源1102在计算设备1150本地和/或从计算设备1150远程地定位,并且可以经由通信网络(例如,通信网络1154)将数据传达到计算设备1150(和/或服务器1152)。
在一些实施例中,通信网络1154可以是任何合适的通信网络或通信网络的组合。例如,通信网络1154可包括Wi-Fi网络(Wi-Fi网络可包括一个或多个无线路由器、一个或多个交换机等)、对等网络(例如,蓝牙网络)、蜂窝网络(例如,符合任何合适的标准(诸如CDMA、GSM、LTE、高级LTE、WiMAX等)的3G网络、4G网络等)、有线网络等等。在一些实施例中,通信网络108可以是局域网、广域网、公共网络(例如,互联网)、专用或半专用网络(例如,公司或大学内联网)、任何其他合适类型的网络、或任何合适的网络的组合。图11所示的通信链路可各自是任何合适的通信链路或通信链路的组合,诸如有线链路、光纤链路、Wi-Fi链路、蓝牙链路、蜂窝链路等等。
现在参考图12,示出了根据本公开中描述的系统和方法的一些实施例的可用于实现图像和轮廓数据源1102、计算设备1150和服务器1154的硬件1200的示例。如图12所示,在一些实施例中,计算设备1150可包括处理器1202、显示器1204、一个或多个输入1206、一个或多个通信系统1208和/或存储器1210。在一些实施例中,处理器1202可以是任何合适的硬件处理器或处理器的组合,诸如中央处理单元(“CPU”)、图形处理单元(“GPU”)等等。在一些实施例中,显示器1204可包括任何合适的显示设备,诸如计算机监视器、触摸屏、电视机等等。在一些实施例中,输入1206可包括可用于接收用户输入的任何合适的输入设备和/或传感器,诸如键盘、鼠标、触摸屏、麦克风等等。
在一些实施例中,通信系统1208可包括用于通过通信网络1154和/或任何其他合适的通信网络传达信息的任何合适的硬件、固件和/或软件。例如,通信系统1208可包括一个或多个收发器、一个或多个通信芯片和/或芯片组等等。在更具体的示例中,通信系统1208可包括可用于建立Wi-Fi连接、蓝牙连接、蜂窝连接、以太网连接等等的硬件、固件和/或软件。
在一些实施例中,存储器1210可包括可用于存储指令、值、数据等等的任何合适的一个或多个存储设备,这些指令、值、数据等等例如可由处理器1202使用以使用显示器1204来呈现内容、以经由(多个)通信系统1208与服务器1152通信等等。存储器1210可以包括任何合适的易失性存储器、非易失性存储器、存储或其任何合适的组合。例如,存储器1210可包括RAM、ROM、EEPROM、一个或多个闪存驱动器、一个或多个硬盘、一个或多个固态驱动器、一个或多个光驱动器等等。在一些实施例中,存储器1210可具有编码在其上或以其他方式存储在其中的、用于控制计算设备1150的操作的计算机程序。在此类实施例中,处理器1202可以执行计算机程序的至少一部分以呈现内容(例如,图像、用户界面、图形、表格)、从服务器1152接收内容、向服务器1152发送信息等等。
在一些实施例中,服务器1152可包括处理器1212、显示器1214、一个或多个输入1216、一个或多个通信系统1218和/或存储器1220。在一些实施例中,处理器1212可以是任何合适的硬件处理器或处理器的组合,诸如CPU、GPU等等。在一些实施例中,显示器1214可包括任何合适的显示设备,诸如计算机监视器、触摸屏、电视机等等。在一些实施例中,输入1216可包括可用于接收用户输入的任何合适的输入设备和/或传感器,诸如键盘、鼠标、触摸屏、麦克风等等。
在一些实施例中,通信系统1218可包括用于通过通信网络1154和/或任何其他合适的通信网络传达信息的任何合适的硬件、固件和/或软件。例如,通信系统1218可包括一个或多个收发器、一个或多个通信芯片和/或芯片组等等。在更具体的示例中,通信系统1218可包括可用于建立Wi-Fi连接、蓝牙连接、蜂窝连接、以太网连接等等的硬件、固件和/或软件。
在一些实施例中,存储器1220可包括可用于存储指令、值、数据等等的任何合适的一个或多个存储设备,这些指令、值、数据等等例如可由处理器1212使用以使用显示器1214来呈现内容、以与一个或多个计算设备1150通信等等。存储器1220可以包括任何合适的易失性存储器、非易失性存储器、存储或其任何合适的组合。例如,存储器1220可包括RAM、ROM、EEPROM、一个或多个闪存驱动器、一个或多个硬盘、一个或多个固态驱动器、一个或多个光驱动器等等。在一些实施例中,存储器1220可具有编码在其上的用于控制服务器1152的操作的服务器程序。在此类实施例中,处理器1212可执行服务器程序的至少一部分,以将信息和/或内容(例如,数据、图像、用户界面)发送到一个或多个计算设备1150、从一个或多个计算设备1150接收信息和/或内容、从一个或多个设备(例如,个人计算机、膝上型计算机、平板计算机、智能电话)接收指令等等。
在一些实施例中,图像和轮廓数据源1102可包括处理器1222、一个或多个图像获取系统1224、一个或多个通信系统1226和/或存储器1228。在一些实施例中,处理器1222可以是任何合适的硬件处理器或处理器的组合,诸如CPU、GPU等等。在一些实施例中,一个或多个图像获取系统1224通常被配置成获取数据、图像或两者,并且可包括CT系统和MRI系统或两者。附加地或替代地,在一些实施例中,一个或多个图像获取系统1224可包括用于耦合到CT系统和MRI系统或两者和/或控制CT系统和MRI系统或两者的操作的任何合适的硬件、固件和/或软件。在一些实施例中,一个或多个图像获取系统1224的一个或多个部分可以是可移除的和/或可替换的。
注意,尽管未示出,但是图像和轮廓数据源1102可包括任何合适的输入和/或输出。例如,图像和轮廓数据源1102可包括可用于接收用户输入的输入设备和/或传感器,诸如键盘、鼠标、触摸屏、麦克风、触控板、轨迹球等等。作为另一示例,图像和轮廓数据源1102可包括任何合适的显示设备(诸如计算机监视器、触摸屏、电视机等)、一个或多个扬声器等等。
在一些实施例中,通信系统1226可包括用于(并且,在一些实施例中,通过通信网络1154和/或任何其他合适的通信网络)向计算设备1150传达信息的任何合适的硬件、固件和/或软件。例如,通信系统1226可包括一个或多个收发器、一个或多个通信芯片和/或芯片组等等。在更具体的示例中,通信系统1226可包括可用于建立使用任何合适的端口和/或通信标准(例如,VGA、DVI视频、USB、RS-232等)的有线连接、Wi-Fi连接、蓝牙连接、蜂窝连接、以太网连接等等的硬件、固件和/或软件。
在一些实施例中,存储器1228可包括可用于存储指令、值、数据等等的任何合适的一个或多个存储设备,这些指令、值、数据等等例如可由处理器1222使用以:控制一个或多个图像获取系统1224和/或从一个或多个图像获取系统1224接收数据;从数据成像;使用显示器来呈现内容(例如,图像、用户界面);与一个或多个计算设备1150通信等等。存储器1228可以包括任何合适的易失性存储器、非易失性存储器、存储或其任何合适的组合。例如,存储器1228可包括RAM、ROM、EEPROM、一个或多个闪存驱动器、一个或多个硬盘、一个或多个固态驱动器、一个或多个光驱动器等等。在一些实施例中,存储器1228可具有编码在其上或以其他方式存储在其中的、用于控制图像源1102的操作的程序。在此类实施例中,处理器1222可执行程序的至少一部分,以生成图像、将信息和/或内容(例如,数据、图像)发送到一个或多个计算设备1150、从一个或多个计算设备1150接收信息和/或内容、从一个或多个设备(例如,个人计算机、膝上型计算机、平板计算机、智能电话等)接收指令等等。
在一些实施例中,可以将任何合适的计算机可读介质用于存储用于执行本文所述的功能和/或过程的指令。例如,在一些实施例中,计算机可读介质可以是瞬态的或非瞬态的。例如,非瞬态计算机可读介质可包括以下介质,诸如:磁介质(例如,硬盘、软盘)、光介质(例如,压缩碟、数字视频碟、蓝光碟)、半导体介质(例如,随机存取存储器(“RAM”)、闪存、电可编程只读存储器(“EPROM”)、电可擦除可编程只读存储器(“EEPROM”))、在传输期间不是短暂的或不是没有任何持久外观的任何合适的介质、和/或任何合适的有形介质。作为另一示例,瞬态计算机可读介质可包括在网络上的信号、在电线的信号、导体、光纤、电路、或在传输期间是短暂地且没有任何持久外观的任何合适介质、和/或任何合适的无形介质。
如上所述,对于OLAR,当前可用的通过剂量体积度量的视觉检测或自动化检测和3D剂量分布的视觉检查来进行计划质量评估的方法可能是耗时的。基于来自愿望清单和剂量体积直方图(“DVH”)的剂量度量的常规计划评估缺少空间信息;因此,医师必须逐切片地检查剂量分布来以主观决策推断计划质量。本公开中描述的系统和方法实现基于剂量空间分布的度量(例如,DVH度量)和纹理特征,以建立用于计划质量自动评估的客观方法。
通常,本公开中描述的方法包括计算来自要比较的每个3D剂量分布的多个纹理特征和度量(例如,DVH度量)。可在本公开中描述的方法中使用从空间剂量分布计算出的四个类别的特征。这些特征包括:用于强调大的连续区域的剂量水平大小区域矩阵(“DLSZM”);定义两个计划的同一空间体素之间的剂量水平关系的剂量水平共生矩阵(“DLCM”);评估计划剂量分布与治疗计划系统中的目标剂量分布的距离的共同目标函数距离(mutualobjective function distance;“MOFD”);以及类似于人类对图像的感知以指示局部剂量变化的邻居水平剂量差异矩阵(neighbor level-dose difference matrix)。作为一个示例,可从这些特征计算出其他度量,包括:可从DLSZM计算出的大冷点(“LCS”);以及热对比度(“HC”),热对比度(“HC”)可从DLCM计算出并且评估在同一空间体素处从一个计划到另一个计划的热度。基于要比较的计划之间的这些度量和特征的差异来从所比较的计划集中确定优越的或以其他方式最佳的结果。
在线ART提供了具有器官的分剂之间变化的最佳治疗剂量递送。与IGRT重新定位相比,OLAR通过改进目标覆盖和/或OAR保留提供了优越的自适应计划。使用当前技术,在整个工作流期间使用人类交互来实现OLAR。这些人类操作的一部分是计划评估。在OLAR工作流中,通常有两个计划,医师从这两个计划中选择优越的计划。第一计划是自适应计划,该自适应计划是以进行或不进行对每日解剖结构变化的完全优化来调整的计划。第二计划是重新定位计划,该重新定位计划是基于参考图像与每日图像之间的配准来进行的参考计划的重新计算。医师选择优越的计划以实现对治疗的每日分剂的最佳剂量益处。
治疗计划评估是临床上主观的决策制定问题,治疗计划评估涉及在上下文(contextually)丰富的环境中进行视觉搜索和分析,包括在CT数据上叠加的圈定的结构和等剂量线。该劳动密集的任务通常由肿瘤医生和物理学家执行,并且受到肿瘤医师或物理学家的经验、技能和能力的限制。
类似于三维图像,每个体素的剂量水平类似于在空间剂量分布(诸如剂量图)中的每个体素的强度,该剂量图可以是2D剂量图或3D剂量图。可以与来自图像的剂量纹理特征类似地定义和计算剂量图的剂量纹理特征。
作为可从剂量的空间分布(诸如3D剂量图)中计算出的纹理特征或度量的示例,LCS可被计算为:
其中M(i,z)是N×S矩阵,该矩阵具有是大小z和剂量水平i的连续体素的频率的元素。
作为可从剂量的空间分布(诸如3D剂量图)中计算出的纹理特征或度量的另一示例,可从DLCM中计算出HC。用于第一计划(“计划1”)和第二计划(“计划2”)的DLCM是:
其中F(i,j)是N×N矩阵,该矩阵具有是在第一计划的第一剂量水平i的频率和在同一体素处在第二计划的第二剂量水平j的频率的元素。第一计划和第二计划的热对比度为:
作为可从剂量的空间分布(诸如3D剂量图)中计算出的纹理特征或度量的另一示例,逆协方差(“IC”)可被计算为:
作为可从剂量的空间分布(诸如3D剂量图)中计算出的纹理特征或度量的另一示例,可基于定义每个体素与这些体素的邻居平均值之间的局部差异来计算出邻居水平剂量差异矩阵(“NLDDM”):
其中Z是剂量水平i体素的所有邻居的集合,并且其中p
作为可从剂量的空间分布(诸如3D剂量图)中计算出的纹理特征或度量的另一示例,粗糙度(coarseness;“Co”)可被定义为:
作为可从剂量的空间分布(诸如3D剂量图)中计算出的纹理特征或度量的另一示例,繁忙度(busyness;“Bu”)可被定义为:
作为可从剂量的空间分布(诸如3D剂量图)中计算出的纹理特征或度量的示例,MOFD可如下地计算出。首先,定义目标的目标函数距离。对于大于目标剂量的处方剂量(即,p
对于小于目标剂量的处方剂量(即,p
接下来,在第一计划(例如,自适应计划“A”)和第二计划(例如,重新定位计划“R”)中的OAR的目标函数可被定义为:
可在治疗计划系统中启发式地确定参数β
其中k和s是目标和OAR的数量。
可以基于上文描述的纹理特征和度量以及从剂量的空间分布(例如,3D剂量图)计算出的其他纹理特征和度量来评估计划质量。为了辅助该过程,可将总体质量指标(general quality index;“GQI”)定义为用于评估治疗计划的临床决策的定量度量:
GQI=α
可从实况数据集确定所有系数,使得具有较低GQI的计划具有优越的计划质量。
在一些实现中,使用硬件处理器和存储器实现的机器学习算法可用于基于从3D剂量图计算出的一个或多个纹理特征或度量来评估放射治疗计划质量。作为一个示例,可实现具有超参数优化的提升的决策树算法以确定最佳剂量纹理特征以及可用于在竞争的计划之间识别较好的计划的那些参数值的范围。在此类实现中,从多组不同放射治疗计划类型(例如,自适应计划、重新定位计划)中获得的数个剂量纹理特征最初可作为预测变量与更常用的剂量体积参数一起使用。包括复杂树、判别分析、支持向量机、逻辑回归、最近邻居、集成分类(ensemble classification)、提升的决策树或其组合的初始分类器可使用所有剂量纹理特征和交叉验证(例如,留一交叉验证)来训练。
在示例研究中,对于前列腺癌患者,在RT期间使用在轨CT来获取计划CT和每日CT。在该研究中,在五位患者中随机选择11个分剂每日图像。对于每个每日CT集,IGRT重新定位计划和自适应计划两者都被生成。基于每日CT创建和编辑每日轮廓。基于新的结构位置来从参考计划中重新计算重新定位计划。图13示出了两个计划(自适应计划和重新定位计划)的剂量体积直方图(“DVH”)的示例。图14示出了这两个计划的所有OAR的DLCM。共生频率主要存在于右上部分中,指示在OAR的相同位置处重新定位计划比自适应计划具有更高剂量。图15示出了自适应计划和重新定位计划中的计划目标体积(“PTV”)的DLSZM。
每个度量具有连接到计划质量的该度量自身的物理意义。LCS是示出具有低剂量的大连接区域的指数。较大的LCS值指示结构中的更多或更大的低剂量连接区域。在PTV中,大的LCS值将与计划的较差质量相关。
HC和IC示出两个不同计划的相同位置中的累积差异。较大的值指示在同一体素中一个计划通常比其他计划更热。在OAR中,该值指示较低质量的计划。由于与相同位置的直接比较,因此不存在对计划中的结构的热度的模糊解释。
粗糙度和繁忙度指示局部剂量水平变化,并且给出对图像的类似人类视觉的感知。高值对应于视觉中的较粗糙的图像。对于剂量分布,这可以被解释为具有较低计划质量的更多岛状空间分布。
当在空间中计划的质量变化时,MOFD指示计划评估的难度。如果在第一位置(例如,“位置1”)中第一计划(例如,“计划A”)的质量优于第二计划(例如,“计划B”),但是在第二位置(例如,“位置2”)中不如第二计划,则MOFD可以通过测量计划剂量分布与最佳剂量分布之间的距离来给出绝对质量值。
GQI提供了计划质量的一般指标。可使用经验参数从方程(26)中的GQI公式中计算出GQI。通过回归分析,可从实况数据集提取准确的系数。
现在参考图16,示出了流程图,该流程图阐述了用于基于计算和比较来自与计划相关联的空间剂量分布的纹理特征、度量或两者来评估不同的可用放射治疗计划的质量的示例方法的步骤。方法包括使用计算机系统访问第一放射治疗计划,如步骤1602所指示。第二放射治疗计划也被计算机系统访问,如步骤1604所指示。访问放射治疗计划可包括,例如,从存储器或其他数据存储中检索先前生成的放射治疗计划。
随后,从第一放射治疗计划和第二放射治疗计划中包含的空间剂量分布中计算出一个或多个纹理特征、一个或多个度量或两者,如步骤1606处总体指示的。如上所述,纹理特征、度量或两者可包括DLSZM-LCS、DLCM-HC、DLCM-IC、NLDDM-Co、MOFD、GQI、其组合、或其他纹理特征或度量。随后,分析计算出的纹理特征、度量或两者以评估第一计划和第二计划的质量;由此,在步骤1608处评估第一计划的质量并且在1610处评估第二计划的质量。在一些实现中,可同时评估两个计划的质量。
基于该评估,选择具有较高质量的计划,如步骤1612所指示,并且该计划被存储以供稍后使用或提供到放射治疗计划系统以控制放射治疗系统的操作,如步骤1614所指示。
因此,已经描述了使用从空间剂量分布中提取的剂量纹理特征来自动且客观地评估剂量测定计划质量的方法。可基于机器学习算法来确定最佳剂量纹理特征。该基于剂量纹理的计划评估方法可被实现用于OLAR以显著减少计划评估的时间。
现在参考图17,示出了根据本公开中描述的系统和方法的一些实施例的用于自动评估OLAR计划质量的系统1700的示例。如图17所示,计算设备1750可从数据源1702接收一种或多种类型的数据(例如,放射治疗计划数据、图像数据),数据源1702可以是放射治疗计划数据源。在一些实施例中,计算设备1750可以执行OLAR计划质量评估系统1704的至少一部分以由从数据源1702接收的数据来自动评估OLAR计划质量。
附加地或替代地,在一些实施例中,计算设备1750可以通过通信网络1754将关于从数据源1702接收的数据的信息传达到服务器1752,服务器1752可执行OLAR计划质量评估系统1704的至少一部分。在此类实施例中,服务器1752可以将指示OLAR计划质量评估系统1704的输出的信息返回到计算设备1750(和/或任何其他合适的计算设备)。
在一些实施例中,计算设备1750和/或服务器1752可以是任何合适的计算设备或设备的组合,诸如台式计算机、膝上型计算机、智能电话、平板计算机、可穿戴计算机、服务器计算机、由物理计算设备执行的虚拟机等等。计算设备1750和/或服务器1752还可以从数据重建图像。
在一些实施例中,数据源1702可以是任何合适的放射治疗计划数据(例如,测量数据、从测量数据重建的图像)源,诸如CT系统、MRI系统或两者;另一计算设备(例如,存储放射治疗计划数据和/或图像数据的服务器)等等。在一些实施例中,数据源1702可在计算设备1750本地。例如,数据源1702可以与计算设备1750结合(例如,计算设备1750可被配置为用于捕获、扫描和/或存储图像的设备的一部分)。作为另一示例,数据源1702可通过电缆、直接无线链接等等连接到计算设备1750。附加地或替代地,在一些实施例中,数据源1702相对于计算设备1750本地地和/或远程地定位,并且可以经由通信网络(例如,通信网络1754)将数据传达到计算设备1750(和/或服务器1752)。
在一些实施例中,通信网络1754可以是任何合适的通信网络或通信网络的组合。例如,通信网络1754可包括Wi-Fi网络(Wi-Fi网络可包括一个或多个无线路由器、一个或多个交换机等)、对等网络(例如,蓝牙网络)、蜂窝网络(例如,符合任何合适的标准(诸如CDMA、GSM、LTE、高级LTE、WiMAX等)的3G网络、4G网络等)、有线网络等等。在一些实施例中,通信网络108可以是局域网、广域网、公共网络(例如,互联网)、专用或半专用网络(例如,公司或大学内联网)、任何其他合适类型的网络、或任何合适的网络的组合。图17所示的通信链路可各自是任何合适的通信链路或通信链路的组合,诸如有线链路、光纤链路、Wi-Fi链路、蓝牙链路、蜂窝链路等等。
现在参考图18,示出了根据本公开中描述的系统和方法的一些实施例的可用于实现图像源1702、计算设备1750和服务器1754的硬件1800的示例。如图18所示,在一些实施例中,计算设备1750可包括处理器1802、显示器1804、一个或多个输入1806、一个或多个通信系统1808和/或存储器1810。在一些实施例中,处理器1802可以是任何合适的硬件处理器或处理器的组合,诸如中央处理单元(“CPU”)、图形处理单元(“GPU”)等等。在一些实施例中,显示器1804可包括任何合适的显示设备,诸如计算机监视器、触摸屏、电视机等等。在一些实施例中,输入1806可包括可用于接收用户输入的任何合适的输入设备和/或传感器,诸如键盘、鼠标、触摸屏、麦克风等等。
在一些实施例中,通信系统1808可包括用于通过通信网络1754和/或任何其他合适的通信网络传达信息的任何合适的硬件、固件和/或软件。例如,通信系统1808可包括一个或多个收发器、一个或多个通信芯片和/或芯片组等等。在更具体的示例中,通信系统1808可包括可用于建立Wi-Fi连接、蓝牙连接、蜂窝连接、以太网连接等等的硬件、固件和/或软件。
在一些实施例中,存储器1810可包括可用于存储指令、值、数据等等的任何合适的一个或多个存储设备,这些指令、值、数据等等例如可由处理器1802使用以使用显示器1804来呈现内容、以经由(多个)通信系统1808与服务器1752通信等等。存储器1810可以包括任何合适的易失性存储器、非易失性存储器、存储或其任何合适的组合。例如,存储器1810可包括RAM、ROM、EEPROM、一个或多个闪存驱动器、一个或多个硬盘、一个或多个固态驱动器、一个或多个光驱动器等等。在一些实施例中,存储器1810可具有编码在其上或以其他方式存储在其中的、用于控制计算设备1750的操作的计算机程序。在此类实施例中,处理器1802可以执行计算机程序的至少一部分以呈现内容(例如,图像、用户界面、图形、表格)、从服务器1752接收内容、向服务器1752发送信息等等。
在一些实施例中,服务器1752可包括处理器1812、显示器1814、一个或多个输入1816、一个或多个通信系统1818和/或存储器1820。在一些实施例中,处理器1812可以是任何合适的硬件处理器或处理器的组合,诸如CPU、GPU等等。在一些实施例中,显示器1814可包括任何合适的显示设备,诸如计算机监视器、触摸屏、电视机等等。在一些实施例中,输入1816可包括可用于接收用户输入的任何合适的输入设备和/或传感器,诸如键盘、鼠标、触摸屏、麦克风等等。
在一些实施例中,通信系统1818可包括用于通过通信网络1754和/或任何其他合适的通信网络传达信息的任何合适的硬件、固件和/或软件。例如,通信系统1818可包括一个或多个收发器、一个或多个通信芯片和/或芯片组等等。在更具体的示例中,通信系统1818可包括可用于建立Wi-Fi连接、蓝牙连接、蜂窝连接、以太网连接等等的硬件、固件和/或软件。
在一些实施例中,存储器1820可包括可用于存储指令、值、数据等等的任何合适的一个或多个存储设备,这些指令、值、数据等等例如可由处理器1812使用以使用显示器1814来呈现内容、以与一个或多个计算设备1750通信等等。存储器1820可以包括任何合适的易失性存储器、非易失性存储器、存储或其任何合适的组合。例如,存储器1820可包括RAM、ROM、EEPROM、一个或多个闪存驱动器、一个或多个硬盘、一个或多个固态驱动器、一个或多个光驱动器等等。在一些实施例中,存储器1820可具有编码在其上的用于控制服务器1752的操作的服务器程序。在此类实施例中,处理器1812可执行服务器程序的至少一部分,以将信息和/或内容(例如,数据、图像、用户界面)发送到一个或多个计算设备1750、从一个或多个计算设备1750接收信息和/或内容、从一个或多个设备(例如,个人计算机、膝上型计算机、平板计算机、智能电话)接收指令等等。
在一些实施例中,数据源1702可包括处理器1822、一个或多个图像获取系统1824、一个或多个通信系统1826和/或存储器1828。在一些实施例中,处理器1822可以是任何合适的硬件处理器或处理器的组合,诸如CPU、GPU等等。在一些实施例中,一个或多个图像获取系统1824通常被配置成获取数据、图像或两者,并且可包括CT系统、MRI系统或两者。附加地或替代地,在一些实施例中,一个或多个图像获取系统1824可包括用于耦合到CT系统和MRI系统或两者和/或控制CT系统和MRI系统或两者的操作的任何合适的硬件、固件和/或软件。在一些实施例中,一个或多个图像获取系统1824的一个或多个部分可以是可移除的和/或可替换的。
注意,尽管未示出,但是数据源1702可包括任何合适的输入和/或输出。例如,数据源1702可包括可用于接收用户输入的输入设备和/或传感器,诸如键盘、鼠标、触摸屏、麦克风、触控板、轨迹球等等。作为另一示例,数据源1702可包括任何合适的显示设备(诸如计算机监视器、触摸屏、电视机等)、一个或多个扬声器等等。
在一些实施例中,通信系统1826可包括用于向计算设备1750传达信息的任何合适的硬件、固件和/或软件(并且,在一些实施例中,通过通信网络1754和/或任何其他合适的通信网络)。例如,通信系统1826可包括一个或多个收发器、一个或多个通信芯片和/或芯片组等等。在更具体的示例中,通信系统1826可包括可用于建立使用任何合适的端口和/或通信标准(例如,VGA、DVI视频、USB、RS-232等)的有线连接、Wi-Fi连接、蓝牙连接、蜂窝连接、以太网连接等等的硬件、固件和/或软件。
在一些实施例中,存储器1828可包括可用于存储指令、值、数据等等的任何合适的一个或多个存储设备,这些指令、值、数据等等例如可由处理器1822使用以:控制一个或多个图像获取系统1824和/或从一个或多个图像获取系统1824接收数据;从数据成像;使用显示器来呈现内容(例如,图像、用户界面);与一个或多个计算设备1750通信等等。存储器1828可以包括任何合适的易失性存储器、非易失性存储器、存储或其任何合适的组合。例如,存储器1828可包括RAM、ROM、EEPROM、一个或多个闪存驱动器、一个或多个硬盘、一个或多个固态驱动器、一个或多个光驱动器等等。在一些实施例中,存储器1828可具有编码在其上或以其他方式存储在其中的、用于控制图像源1702的操作的程序。在此类实施例中,处理器1822可执行程序的至少一部分,以生成图像、将信息和/或内容(例如,数据、图像)发送到一个或多个计算设备1750、从一个或多个计算设备1750接收信息和/或内容、从一个或多个设备(例如,个人计算机、膝上型计算机、平板计算机、智能电话等)接收指令等等。
在一些实施例中,可以将任何合适的计算机可读介质用于存储用于执行本文所述的功能和/或过程的指令。例如,在一些实施例中,计算机可读介质可以是瞬态的或非瞬态的。例如,非瞬态计算机可读介质可包括以下介质,诸如:磁介质(例如,硬盘、软盘)、光介质(例如,压缩碟、数字视频碟、蓝光碟)、半导体介质(例如,随机存取存储器(“RAM”)、闪存、电可编程只读存储器(“EPROM”)、电可擦除可编程只读存储器(“EEPROM”))、在传输期间不是短暂的或不是没有任何持久外观的任何合适的介质、和/或任何合适的有形介质。作为另一示例,瞬态计算机可读介质可包括在网络上的信号、在电线的信号、导体、光纤、电路、或在传输期间是短暂地且没有任何持久外观的任何合适介质、和/或任何合适的无形介质。
如上所述,在磁共振图像中,由于噪声和伪像,通常难以从其他低信号区域(尤其是骨骼、肝脏等)自动分离空气,这可引起用于基于MRI的RT-计划的合成CT(“sCT”)生成中的误差。对于空气区域是随机的并且因此不能从参考CT变形的腹部而言,这是有问题的。本公开中描述的系统和方法提供了一种技术,该技术可以准确且自动地确定MRI中的空气区域,这进而使得能够更稳健地从磁共振图像生成合成CT图像。
期望MR-Linac技术通过增强肿瘤靶向来改善RT。能够使用MRI在每次治疗递送之间和期间获取的高对比度图像允许在线和实时的计划适配。然而,患者解剖结构上的剂量计算使用不能直接从每日MRI获得的相对电子密度(“rED”)的图。因此,基于每日MRI生成合成CT(sCT)图像。
用于sCT生成的两种主要类型的方法是基于体素的方法(其中仅使用MRI体素数据)和基于图谱(atlas)的方法(其中使用体素的位置信息以及强度信息来生成rED值)。
基于体素的方法(其中基于体素的MR强度直接获得每个体素的rED数据)对于没有参考CT可用的情况是有用的。然而,由于在MR信号与CT信号之间没有直接关系,因此基于体素的方法需要多个MR序列以获取图像,这增加了在线准备时间并且因此对于OLAR的目的是不期望的。
基于图谱的方法涉及通过刚性或可变形配准来直接从同一患者的现有CT中传递rED数据。这些方法可应用于任何单个MR序列(即,不需要多个序列)。因此,基于图谱的方法更适合于OLAR,其中可以离线获取参考CT。另一个优点是基于图谱的方法使用患者自身的CT,并且因此,与应用基于普通人群的rED数据而不是患者特定的rED数据的基于体素的方法相比,基于图谱的方法可以更准确。
来自MR-Linac中的磁场的洛伦兹力需要对rED的准确估计,尤其是在基于人群的rED数据可能引起剂量计算误差的肺部。用于颅外部位的基于图谱的方法通常需要可变形图像配准(“DIR”)来传递rED数据,并且其中存在DIR对于大的变形可能不准确的担忧。
即使对于颅外部位,本公开中描述的系统和方法也克服了这些缺点并提供了一种快速的基于图谱的方法以生成rED数据。该方法可以是完全自动化的,并且因此可在MR-Linac系统上用于OLAR。
通常,本公开中描述的方法经由DIR将来自参考CT(“rCT”)的rED密度传递到每日磁共振图像(“dMR”)。通常在较早的日期获取rCT,并且rCT用于使rED数据变形。在治疗当日获取dMRI,并且dMRI用作rCT变形成的目标图像。
现在参考图19,流程图被示出为阐述从磁共振图像生成合成CT图像的示例方法的步骤。如步骤1902所指示,该方法包括用计算机系统访问输入图像数据。通常,输入图像数据包括患者的参考CT图像和每日MR图像。访问输入图像数据可包括从存储器或其他数据存储设备或介质检索先前获取的输入图像数据。在一些情况下,访问输入图像数据可包括使用合适的医疗成像系统获取图像(例如,rCT图像,dMR图像),并且将那些图像传达或以其他方式传递到计算机系统,该计算机系统可以形成(多个)相应的医疗成像系统的一部分。
在以下步骤中,将CT强度(即,亨氏单位(Hounsfield Units;“HU”))传递并转换成rED图。在rCT图像上分别圈定个体骨骼,如步骤1904所指示。在一些实施例中,该步骤可离线执行。在这些情况下,骨骼轮廓数据可存储在存储器或其他数据存储中并在步骤1904处用计算机系统访问。
随后将个体骨骼轮廓从rCT传递到dMR。在rCT图像和dMR图像上执行第一DIR,如步骤1906所指示。作为该步骤的结果,计算变形矢量场(“DVF”)。对于每个个体骨骼体积(例如,由骨骼轮廓封围的体积),从在每个识别的骨骼结构内部的体素的DVF计算出刚性配准矩阵M(即,平移和旋转),如步骤1908所指示。该矩阵M是从骨骼体积内部的所有点到DVF的最佳拟合,使得DVF与刚性传递之间的累积误差:
在所有体素上被最小化。可针对每个骨骼体积独立地计算该矩阵M。随后,刚性配准矩阵用于将每个骨骼轮廓从rCT刚性地传递到dMR图像,如步骤1910所指示。
在rCT图像与DMR图像之间执行第二DIR,这次使用通过骨骼结构来约束DVF的DIR算法,如步骤1912所指示。仅允许参考图像中的一个结构内部的所有体素变形成目标图像中的同一结构的体素;由此,迫使结构变形成目标图像上圈定的形状。这保留了骨骼结构的形状;由此,每个个体的骨骼保持其刚性,最小化来自骨骼的DIR的误差。
可通过自动阈值化来在dMR图像中识别dMR图像中的随机空气区域(例如,肠中的气体)的体积,如步骤1914所指示。可以建立与空气(在体模/患者外部)的MRI强度和周围材料有关的公式,并将该公式用于自动阈值化MRI上的空气区域。可基于患者MRI数据来进一步细化这些公式。作为示例,将从参考MRI传递到每日MRI并且扩展1cm的在腹部中的含空气区域(例如,结肠、肠、胃)给出了可用于阈值化的区域。扩展考虑到DIR中可能的不准确度。可使用基于纹理的方法来进一步细化该目标区域内部确定的空气区域。可从自动阈值化的区域中提取来自灰度共生矩阵(“GLCM”)的定量图像纹理特征(包括互相关、对比度、和方差、或其组合),并且可使用留一交叉验证技术来训练使用硬件处理器和存储器实现的机器学习算法(例如,朴素贝叶斯分类器)以区分空气体素和非空气体素。可使用在ROC曲线下的面积(“AUC”)来判断分类器的性能。
作为生成空气区域体积的一个非限制性示例,可对磁共振图像进行如下分析。首先,可对图像进行分析以粗略地识别封围最可能的空气/气体器官(诸如胃、十二指肠、小肠、大肠、结肠等等)的区域。然后,可以基于参考数据(诸如体模数据)来开发阈值化方程。作为示例,可从体模数据(诸如具有嵌入的空气腔的一个或多个体模的MR图像和CT图像)计算或以其他方式确定阈值。在CT图像和MRI图像两者中识别体模中的这些空气腔。可通过刚性图像配准将从CT图像中限定的空气腔轮廓传递到MRI图像,以与在MRI图像上圈定的空气腔轮廓进行比较。戴斯系数(“DC”)和豪斯道夫(Housdorff)距离被用于测量基于CT的轮廓与基于MRI的轮廓之间的差异并用于导出阈值以识别患者MRI图像上的空气/组织边界。
作为一个示例,基于体模研究生成了以下公式,并且该公式可用于指示空气区域:
MR
可丢弃扩展联合结构外部的低信号区域,因为这些低信号区域是空气的可能性非常低。在方程(28)中,STD
MR
可从随机拾取的磁共振信号与轮廓空气区域的最佳匹配来获得MR
为了进一步细化MRI上的空气边界,可在逐体素的基础上提取空气区域和非空气区域中的图像纹理特征。可提取GLCM的数个不同纹理特征以识别空气区域与非空气区域的特征值。在一个示例中,23个此类特征被提取并用于该目的。可通过上述阈值化方法来识别纯空气体素和非空气体素。在图20中描述了从自动阈值化空气区域中提取空气/非空气体素的方法。可在拾取的区域(r
在一个示例研究中,使用学生T测试来识别在空气区域与非空气区域显著不同的特征。使用朴素贝叶斯分类器和留一交叉验证技术来测试最显著特征的组合,以确定在区分空气区域与非空气区域时具有最大影响的特征。将数据划分为由(5000个空气体素和5000个非空气体素)组成的训练集和(来自包含空气/非空气体素各1000个的不同患者的数据集的)测试集。使用到训练类的质心的最小距离来执行分类。使用在ROC曲线下的面积来判断分类器性能,以识别对分类具有最大影响的特征。通过阈值化方法来确定并且通过对MRI进行纹理特征分析来细化的所有空气区域被分配用于合成CT生成的空气密度。
仍参考图19,随后使用骨骼轮廓和空气区域体积通过将rED值从rCT图像传递到变形的dMR图像来生成合成CT图像,如步骤1916所指示。在一些实现中,从rCT图像中的HU数据中计算出rED值,并且随后将rED值传递到变形的dMR图像,并且在其他实现中,在将HU数据转换成rED数据之前,将HU数据从rCT图像传递到变形的dMR图像。
可将空气区域体积传递到sCT图像,并且在这些体积中sCT值将由空气密度(rED=0.01)覆盖。气体区域随机地出现;因此,dMR对它们具有最准确的表示。在sCT上,这些区域(例如,肠区域)大致预期的位置是已知的,并且仅在这些预期位置中的来自dMR的空气区域将被覆盖。以此方式,低信号区域(例如,来自dMR的骨骼)将不会被错误地识别为空气区域。在从dMR传递的空气区域之外的sCT上的空气区域的rED将由组织密度(rED=0.92)覆盖。
在一些实现中,可在不分离和配准输入图像数据中的骨骼轮廓的情况下生成sCT图像。现在参考图21,流程图被示出为阐述从磁共振图像生成sCT图像的另一示例方法的步骤。如步骤2102所指示,该方法包括用计算机系统访问输入图像数据。通常,输入图像数据包括患者的参考CT图像和每日MR图像。访问输入图像数据可包括从存储器或其他数据存储设备或介质检索先前获取的输入图像数据。在一些情况下,访问输入图像数据可包括使用合适的医疗成像系统获取图像(例如,rCT图像,dMR图像),并且将那些图像传达或以其他方式传递到计算机系统,该计算机系统可以形成(多个)相应的医疗成像系统的一部分。
通过分割输入图像数据中的空气区域(例如,空气腔、总空气区域)和所有器官来从输入图像数据中生成分割的数据,如过程框2104所指示。例如,可通过在rCT图像上手动绘制含空气区域来生成这些分割的数据。手动绘制的轮廓可绘制有扩展(诸如1cm的扩展)。在一些情况下,生成分割的数据可包括检索存储在存储器或其他数据存储设备或介质中的先前生成的分割的数据。
随后,在输入图像数据中的dMR图像上配准CT轮廓,如步骤2106所指示。随后,可使用MRI导出的阈值来细化分割的空气区域,如步骤2108所指示。上文参考图19描述了用于确定和细化该MRI导出的阈值的方法。随后,基于图像特征(例如,纹理特征)分析来完成和/或验证细化的空气区域,如步骤2110所指示。上文也参考图19描述了用于基于图像特征(例如,纹理特征)分析来完成和验证空气区域的方法。
随后,通过使用空气区域体积将rED值从rCT图像传递到dMR图像来生成合成CT图像,如步骤2112所指示。在一些实现中,从rCT图像中的HU数据中计算出rED值,并且随后将rED值传递到dMR图像,并且在其他实现中,在将HU数据转换成rED数据之前,将HU数据从rCT图像传递到dMR图像。
已经描述了用于在特别考虑骨骼区域和空气区域的情况下、通过基于CT和MRI的可变形配准从患者自身的CT传递rED来快速创建sCT图像的方法。所生成的sCT比从通常使用的体积密度分配(bulk density assignment)生成的sCT更准确,但是不需要多个MR序列。
使用本公开中描述的方法,与使用自动阈值化方法的CT图像上的那些空气-组织边界相比,可以以1mm以内的精度在磁共振图像上识别空气-组织边界。使用空气与组织之间的MRI纹理差异来改善空气腔圈定。作为一个示例,自相关、和方差、以及对比度可用于评估空气与组织之间的纹理差异。本公开中描述的系统和方法通常包括使用基于强度的自动阈值化和基于图像纹理的体素分类来自动且准确地分割磁共振图像中的空气区域,这使得能够为基于MRI的RT计划(尤其是为OLAR)快速且精确地生成合成CT图像。
现在参考图22,示出了根据本公开中描述的系统和方法的一些实施例的用于生成合成CT图像的系统2200的示例。如图22所示,计算设备2250可从医疗图像源2202接收一种或多种类型的数据(例如,rCT图像数据、dMR图像数据),医疗图像源2202可以是rCT图像和dMR图像源。在一些实施例中,计算设备2250可执行合成CT图像生成系统2204的至少一部分以由从医疗图像源2202接收的rCT图像和dMR图像数据中生成合成CT图像。
附加地或替代地,在一些实施例中,计算设备2250可以通过通信网络2254将关于从医疗图像源2202接收的数据的信息传达到服务器2252,服务器2252可执行合成CT图像生成系统2204的至少一部分。在此类实施例中,服务器2252可以将指示合成CT图像生成系统2204的输出的信息返回到计算设备2250(和/或任何其他合适的计算设备)。
在一些实施例中,计算设备2250和/或服务器2252可以是任何合适的计算设备或设备的组合,诸如台式计算机、膝上型计算机、智能电话、平板计算机、可穿戴计算机、服务器计算机、由物理计算设备执行的虚拟机等等。计算设备2250和/或服务器2252还可以从数据重建图像。
在一些实施例中,医疗图像源2202可以是任何合适的医疗图像数据(例如,rCT图像数据、dMR图像数据)源,诸如CT系统、MRI系统、另一计算设备(例如,存储图像数据的服务器)等等。在一些实施例中,医疗图像源2202可在计算设备2250本地。例如,医疗图像源2202可以与计算设备2250结合(例如,计算设备2250可被配置为用于捕获、扫描和/或存储图像的设备的一部分)。作为另一示例,医疗图像源2202可通过电缆、直接无线链接等等连接到计算设备2250。附加地或替代地,在一些实施例中,医疗图像源2202相对于计算设备2250本地地和/或远程地定位,并且可以经由通信网络(例如,通信网络2254)将数据传达到计算设备2250(和/或服务器2252)。
在一些实施例中,通信网络2254可以是任何合适的通信网络或通信网络的组合。例如,通信网络2254可包括Wi-Fi网络(Wi-Fi网络可包括一个或多个无线路由器、一个或多个交换机等)、对等网络(例如,蓝牙网络)、蜂窝网络(例如,符合任何合适的标准(诸如CDMA、GSM、LTE、高级LTE、WiMAX等)的3G网络、4G网络等)、有线网络等等。在一些实施例中,通信网络108可以是局域网、广域网、公共网络(例如,互联网)、专用或半专用网络(例如,公司或大学内联网)、任何其他合适类型的网络、或任何合适的网络的组合。图22所示的通信链路可各自是任何合适的通信链路或通信链路的组合,诸如有线链路、光纤链路、Wi-Fi链路、蓝牙链路、蜂窝链路等等。
现在参考图23,示出了根据本公开中描述的系统和方法的一些实施例的可用于实现医疗图像源2202、计算设备2250和服务器2254的硬件2300的示例。如图23所示,在一些实施例中,计算设备2250可包括处理器2302、显示器2304、一个或多个输入2306、一个或多个通信系统2308和/或存储器2310。在一些实施例中,处理器2302可以是任何合适的硬件处理器或处理器的组合,诸如中央处理单元(“CPU”)、图形处理单元(“GPU”)等等。在一些实施例中,显示器2304可包括任何合适的显示设备,诸如计算机监视器、触摸屏、电视机等等。在一些实施例中,输入2306可包括可用于接收用户输入的任何合适的输入设备和/或传感器,诸如键盘、鼠标、触摸屏、麦克风等等。
在一些实施例中,通信系统2308可包括用于通过通信网络2254和/或任何其他合适的通信网络传达信息的任何合适的硬件、固件和/或软件。例如,通信系统2308可包括一个或多个收发器、一个或多个通信芯片和/或芯片组等等。在更具体的示例中,通信系统2308可包括可用于建立Wi-Fi连接、蓝牙连接、蜂窝连接、以太网连接等等的硬件、固件和/或软件。
在一些实施例中,存储器2310可包括可用于存储指令、值、数据等等的任何合适的一个或多个存储设备,这些指令、值、数据等等例如可由处理器2302使用以使用显示器2304来呈现内容、以经由(多个)通信系统2308与服务器2252通信等等。存储器2310可以包括任何合适的易失性存储器、非易失性存储器、存储或其任何合适的组合。例如,存储器2310可包括RAM、ROM、EEPROM、一个或多个闪存驱动器、一个或多个硬盘驱动器、一个或多个固态驱动器、一个或多个光驱动器等等。在一些实施例中,存储器2310可具有编码在其上或以其他方式存储在其中的、用于控制计算设备2250的操作的计算机程序。在此类实施例中,处理器2302可以执行计算机程序的至少一部分以呈现内容(例如,图像、用户界面、图形、表格)、从服务器2252接收内容、向服务器2252发送信息等等。
在一些实施例中,服务器2252可包括处理器2312、显示器2314、一个或多个输入2316、一个或多个通信系统2318和/或存储器2320。在一些实施例中,处理器2312可以是任何合适的硬件处理器或处理器的组合,诸如CPU、GPU等等。在一些实施例中,显示器2314可包括任何合适的显示设备,诸如计算机监视器、触摸屏、电视机等等。在一些实施例中,输入2316可包括可用于接收用户输入的任何合适的输入设备和/或传感器,诸如键盘、鼠标、触摸屏、麦克风等等。
在一些实施例中,通信系统2318可包括用于通过通信网络2254和/或任何其他合适的通信网络传达信息的任何合适的硬件、固件和/或软件。例如,通信系统2318可包括一个或多个收发器、一个或多个通信芯片和/或芯片组等等。在更具体的示例中,通信系统2318可包括可用于建立Wi-Fi连接、蓝牙连接、蜂窝连接、以太网连接等等的硬件、固件和/或软件。
在一些实施例中,存储器2320可包括可用于存储指令、值、数据等等的任何合适的一个或多个存储设备,这些指令、值、数据等等例如可由处理器2312使用以使用显示器2314来呈现内容、以与一个或多个计算设备2250通信等等。存储器2320可以包括任何合适的易失性存储器、非易失性存储器、存储或其任何合适的组合。例如,存储器2320可包括RAM、ROM、EEPROM、一个或多个闪存驱动器、一个或多个硬盘、一个或多个固态驱动器、一个或多个光驱动器等等。在一些实施例中,存储器2320可具有编码在其上的用于控制服务器2252的操作的服务器程序。在此类实施例中,处理器2312可执行服务器程序的至少一部分,以将信息和/或内容(例如,数据、图像、用户界面)发送到一个或多个计算设备2250、从一个或多个计算设备2250接收信息和/或内容、从一个或多个设备(例如,个人计算机、膝上型计算机、平板计算机、智能电话)接收指令等等。
在一些实施例中,医疗图像源2202可包括处理器2322、一个或多个图像获取系统2324、一个或多个通信系统2326和/或存储器2328。在一些实施例中,处理器2322可以是任何合适的硬件处理器或处理器的组合,诸如CPU、GPU等等。在一些实施例中,一个或多个图像获取系统2324通常被配置成获取数据、图像或两者,并且可包括CT系统和MRI系统或两者。附加地或替代地,在一些实施例中,一个或多个图像获取系统2324可包括用于耦合到CT系统和MRI系统或两者和/或控制CT系统和MRI系统或两者的操作的任何合适的硬件、固件和/或软件。在一些实施例中,一个或多个图像获取系统2324的一个或多个部分可以是可移除的和/或可替换的。
注意,尽管未示出,但是医疗图像源2202可包括任何合适的输入和/或输出。例如,医疗图像源2202可包括可用于接收用户输入的输入设备和/或传感器,诸如键盘、鼠标、触摸屏、麦克风、触控板、轨迹球等等。作为另一示例,医疗图像源2202可包括任何合适的显示设备(诸如计算机监视器、触摸屏、电视机等)、一个或多个扬声器等等。
在一些实施例中,通信系统2326可包括用于(并且,在一些实施例中,通过通信网络2254和/或任何其他合适的通信网络)向计算设备2250传达信息的任何合适的硬件、固件和/或软件。例如,通信系统2326可包括一个或多个收发器、一个或多个通信芯片和/或芯片组等等。在更具体的示例中,通信系统2326可包括可用于建立使用任何合适的端口和/或通信标准(例如,VGA、DVI视频、USB、RS-232等)的有线连接、Wi-Fi连接、蓝牙连接、蜂窝连接、以太网连接等等的硬件、固件和/或软件。
在一些实施例中,存储器2328可包括可用于存储指令、值、数据等等的任何合适的一个或多个存储设备,这些指令、值、数据等等例如可由处理器2322使用以:控制一个或多个图像获取系统2324和/或从一个或多个图像获取系统2324接收数据;从数据成像;使用显示器来呈现内容(例如,图像、用户界面);与一个或多个计算设备2250通信等等。存储器2328可以包括任何合适的易失性存储器、非易失性存储器、存储或其任何合适的组合。例如,存储器2328可包括RAM、ROM、EEPROM、一个或多个闪存驱动器、一个或多个硬盘驱动器、一个或多个固态驱动器、一个或多个光驱动器等等。在一些实施例中,存储器2328可具有编码在其上或以其他方式存储在其中的、用于控制图像源2202的操作的程序。在此类实施例中,处理器2322可执行程序的至少一部分,以生成图像、将信息和/或内容(例如,数据、图像)发送到一个或多个计算设备2250、从一个或多个计算设备2250接收信息和/或内容、从一个或多个设备(例如,个人计算机、膝上型计算机、平板计算机、智能电话等)接收指令等等。
在一些实施例中,可以将任何合适的计算机可读介质用于存储用于执行本文所述的功能和/或过程的指令。例如,在一些实施例中,计算机可读介质可以是瞬态的或非瞬态的。例如,非瞬态计算机可读介质可包括以下介质,诸如:磁介质(例如,硬盘、软盘)、光介质(例如,压缩碟、数字视频碟、蓝光碟)、半导体介质(例如,随机存取存储器(“RAM”)、闪存、电可编程只读存储器(“EPROM”)、电可擦除可编程只读存储器(“EEPROM”))、在传输期间不是短暂的或不是没有任何持久外观的任何合适的介质、和/或任何合适的有形介质。作为另一示例,瞬态计算机可读介质可包括在网络上的信号、在电线的信号、导体、光纤、电路、或在传输期间是短暂地且没有任何持久外观的任何合适介质、和/或任何合适的无形介质。
现在参考图24,示出了可执行本公开中所描述的方法的计算机系统2400的示例的框图。计算机系统2400通常包括输入2402、至少一个硬件处理器2404、存储器2406和输出2408。因此,计算机系统2400通常用硬件处理器2404和存储器2406实现。
在一些实施例中,计算机系统2400可以是放射治疗计划系统(“TPS”)。在一些示例中,计算机系统2400还可通过工作站、笔记本计算机、平板设备、移动设备、多媒体设备、网络服务器、大型机、一个或多个控制器、一个或多个微控制器、或任何其他通用或专用计算设备来实现。
计算机系统2400可自主地或半自主地操作,或者可从存储器2406或计算机可读介质(例如,硬盘驱动器、CD-ROM、闪存)读取可执行软件指令,或者可以经由输入2402从用户或逻辑上连接到计算机或设备的任何其他源(诸如另一个联网的计算机或服务器)接收指令。因此,在一些实施例中,计算机系统2400还可包括用于读取计算机可读存储介质的任何合适的设备。
通常,计算机系统2400被编程或以其他方式配置以实现本公开中描述的方法和算法。例如,计算机系统2400可被编程为基于对雅可比行列式直方图度量的分析来生成是否发起OLAR的指示、自动校正放射治疗计划中的轮廓、为OLAR验证轮廓、基于纹理特征和空间剂量度量来自动评估放射治疗计划质量、从磁共振图像生成合成CT图像、或其组合。
输入2402可根据需要采取任何合适的形状或形式,以用于计算机系统2400的操作,包括用于选择、输入、或以其他方式指定与执行任务、处理数据或操作计算机系统2400一致的参数的能力。在一些方面,输入2402可被配置成接收数据,诸如使用医疗成像系统获取的数据、先前生成的放射治疗计划等等。可以如上文描述的处理此类数据以基于对雅可比行列式直方图度量的分析来生成是否发起OLAR的指示、自动校正放射治疗计划中的轮廓、为OLAR验证轮廓、基于纹理特征和空间剂量度量来自动评估放射治疗计划质量、从磁共振图像生成合成CT图像、或其组合。另外,输入2402还可被配置成接收被认为可用于实现上述方法的任何其他数据或信息。
在用于操作计算机系统2400的处理任务中,一个或多个硬件处理器2404还可被配置用于对通过输入2402接收的数据执行任何数量的后处理步骤。
存储器2406可包含软件2410和数据2412,诸如使用医疗成像系统获取的数据或先前生成的放射治疗计划、并且可被配置用于存储和检索经处理的信息、指令和待由一个或多个硬件处理器2404处理的数据。在一些方面,软件2410可包含针对实现上述方法的指令。
另外,输出2408可根据需要采用任何形状或形式,并且可被配置用于显示医疗图像、放射治疗计划、以及从此类图像或计划中计算出、导出或以其他方式获得的其他数据、以及其他期望的信息。
如上所述,本公开中描述的系统和方法可使用放射治疗计划系统来实现。现在参考图25,示出了这样的放射治疗计划系统2510的示例。放射治疗计划系统2510优选地与一个或多个放射治疗系统2512通信,该一个或多个放射治疗系统2512可包括任何合适的放射治疗系统。
放射治疗计划系统2510通常包括可操作地耦合到处理器单元2516的存储器2514。作为示例,处理器单元2516可以是可购得的计算机处理器,诸如上文描述的那些计算机处理器。处理器单元2516被配置成执行上述方法的步骤中的一个或多个步骤。
作为示例,存储器2514可包括多个存储器元件或可包括单个存储器元件。通常,存储器2514被配置成存储关于患者数据、治疗目标(例如,位于患者体内的肿瘤)、成像束模型数据、治疗束模型数据、剂量度量等等的信息。
优选地,放射治疗计划系统2510包括用户界面2518或以其他方式与用户界面2518通信。作为示例,用户界面2518向用户(诸如医学物理学家)提供信息。例如,用户界面2518可包括显示器2520和一个或多个输入设备(诸如键盘2522和鼠标2524)。
在一些实施例中,可以将任何合适的计算机可读介质用于存储用于执行本文所述的功能和/或过程的指令。例如,在一些实施例中,计算机可读介质可以是瞬态的或非瞬态的。例如,非瞬态计算机可读介质可包括以下介质,诸如:磁介质(例如,硬盘、软盘)、光介质(例如,压缩碟、数字视频碟、蓝光碟)、半导体介质(例如,随机存取存储器(“RAM”)、闪存、电可编程只读存储器(“EPROM”)、电可擦除可编程只读存储器(“EEPROM”))、在传输期间不是短暂的或不是没有任何持久外观的任何合适的介质、和/或任何合适的有形介质。作为另一示例,瞬态计算机可读介质可包括在网络上的信号、在电线的信号、导体、光纤、电路、或在传输期间是短暂地且没有任何持久外观的任何合适介质、和/或任何合适的无形介质。
本公开已经描述了一个或多个优选实施例,并且应当理解,除了明确说明的那些之外的许多等效例、替代例、变化例和修改例是可能的并且在本发明的范围内。
- 用于加速的在线自适应放射疗法的系统和方法
- 用于基于加速器自适应速度控制的系统和方法
