乙型肝炎病毒(HBV)dsRNA剂组合物及其使用方法
文献发布时间:2023-06-19 10:36:57
与本申请相关联的序列表以文本格式代替纸质副本提供,并且据此通过引用并入本说明书中。包含序列表的文本文件的名称为930385_410WO_SEQUENCE_LISTING.txt。该文本文件为83.1KB,创建于2019年8月4日,并通过EFS-Web电子提交。
背景技术
在全球范围内,超过4亿人长期感染HBV,且因此处于患上严重肝病(例如慢性肝炎、肝硬化、肝衰竭和肝细胞癌(HCC))的增大风险中,导致估计每年60万人死亡。
慢性HBV感染的自然演变包括四个连续的阶段:(1)早期的“免疫耐受”阶段,高水平的病毒复制和极少的肝脏炎症;(2)免疫反应期,明显的肝脏炎症和血清转氨酶升高;一些患者进展至(3)“非复制”阶段,血清转化为抗HBe,检测不到或低水平病毒血症(2000IU/ml以下,通过基于PCR的测定方法),并且肝脏炎症消退;(4)HBeAg阴性的慢性乙型肝炎,原因是出现了特定的病毒突变,其阻止了HBeAg的产生,但不妨碍病毒复制。这种形式的慢性乙型肝炎(CHB)的特征在于波动的血清HBV DNA和血清转氨酶(ALT和AST)水平和进行性肝病。重要的是注意,CHB可能以HBeAg阳性或HBeAg阴性CHB呈现。对CHB患者的纵向研究表明,发生肝硬化的5年累积发病率为8%-20%。肝失代偿的5年累积发病率约为20%。世界范围的HCC发病率增加了,且目前构成第五种最常见的癌症。HBV相关HCC的年发病率很高,肝硬化形成时范围为2-5%。
HBV治疗的主要目标是永久地抑制HBV复制并改善肝脏疾病。临床上重要的短期目标是实现HBeAg-血清转化、血清ALT和AST的正常化、肝脏炎症的消退以及防止肝失代偿。治疗的最终目标是获得持久的反应以防止发生肝硬化和肝癌从而延长生存期。由于感染肝细胞的细胞核中特定形式的病毒共价闭合环状DNA(cccHBV DNA)的持续存在,因此无法完全消除HBV感染。然而,由治疗引起的血清HBsAg的清除是慢性HBV感染终止的标志,并且与最佳长期结果相关。
目前治疗HBV的标准方法包括基于干扰素或胸腺素α1的免疫疗法,以及通过抑制HBV聚合酶来抑制病毒产生。HBV聚合酶抑制剂有效减少病毒产生,但在迅速降低HBsAg方面几乎没有效果,或在长期治疗时在有限数量的患者中可缓慢降低HBsAg(如在使用富马酸替诺福韦二吡呋酯的情况中)。基于干扰素的免疫疗法可以实现病毒产生的减少和HBsAg从血液的早期去除,但仅在少部分治疗的受试者中是这样。HBsAg在血液中一般公认的作用是隔绝抗HBsAg抗体,并使传染性病毒颗粒逃脱免疫检测,这很可能是HBV感染保持慢性状况的原因之一。此外,HBsAg,HBeAg和HBcAg都具有免疫抑制特性,在施用任何当前可用的HBV治疗后这些病毒蛋白在患者血液中的持久存在可能对阻止患者获得对其HBV感染的免疫控制有重要影响。
尽管三种主要的HBV蛋白(HBsAg、HBeAg和HBcAg)均具有免疫抑制特性,但HBsAg构成了HBV感染受试者的血液循环中的绝大多数HBV蛋白。此外,虽然HBeAg的清除(通过血清转化)或血清病毒血症减轻与形成对脱离治疗的HBV感染的持续控制无关,但是在HBV感染中从血液清除血清HBsAg(和血清转化)是治疗(其导致对脱离治疗的HBV感染的控制)的抗病毒反应的公认的预后指标(尽管这仅在一小部分接受免疫治疗的患者中发生)。因此,虽然所有三种主要HBV蛋白(HBsAg、HBeAg和HBcAg)的减少可导致抑制性效应的最佳去除,但是单独的HBsAg去除本身可能也足以在HBV感染的受试者中消除大部分对免疫功能的病毒抑制。
因此,在尚无可在大部分患者中恢复对HBV的免疫控制的任何现行治疗方案的情况下,需要针对HBV感染的有效治疗,该治疗可在大多数患者中抑制病毒复制并恢复免疫控制。因此,在本领域中需要用于感染HBV或患有HBV相关疾病的受试者的替代疗法和联合疗法。
发明内容
在一些实施方案中,本公开提供了双链核糖核酸(dsRNA)剂组合物,其影响乙型肝炎病毒(HBV)基因的RNA转录物的RNA诱导沉默复合物(RISC)介导的切割。HBV基因可以在细胞内,例如在受试者(如人)体内的细胞内。
本公开还提供了使用dsRNA剂组合物治疗受益于抑制HBV基因表达的疾病,如HBV感染或HBV相关疾病,例如慢性乙型肝炎感染(CHB)的受试者的方法和疗法,所述dsRNA组合物影响HBV基因的RNA转录物的RNA诱导沉默复合物(RISC)介导的切割,从而抑制所述HBV基因的表达。
在一个方面,本公开提供了用于抑制HBV表达的dsRNA剂。例如,本公开提供了一种dsRNA剂,其包含形成双链区的有义链和反义链,其中所述反义链包含如下示出的修饰的核苷酸序列:
5′-usGfsuga(Agn)gCfGfaaguGfcAfcacsusu-3′(SEQ ID NO:16),
5′-usGfsuga(Agn)gcgaaguGfdCAfcacsusu-3′(SEQ ID NO:18),
5′-usGfsudGa(Agn)gCfGfaaguGfcAfcacsusu-3′(SEQ ID NO:20),
5′-usGfsudGadAgdCGfaaguGfcAfcacsusu-3′(SEQ ID NO:23),
5′-usGfsuga(Agn)dGCfGfaaguGfcAfcacsusu-3′(SEQ ID NO:24),
5′-usGfsudGadAgdCGfaaguGfcAfdCacsusu-3′(SEQ ID NO:25),或
5′-usGfsuga(Agn)gCfGfaaguGfdCAfcacsusu-3′(SEQ ID NO:28),
其中a、c、g和u分别为2’-O-甲基腺苷-3’-磷酸、2’-O-甲基胞苷-3’-磷酸、2’-O-甲基鸟苷-3’-磷酸和2’-O-甲基尿苷-3’-磷酸;
Af、Cf、Gf和Uf分别为2’-氟代腺苷-3’-磷酸、2’-氟代胞苷-3’-磷酸、2’-氟代鸟苷-3’-磷酸和2’-氟代尿苷-3’-磷酸;
dA、dC、dG和dT分别为2’-脱氧腺苷-3’-磷酸、2’-脱氧胞苷-3’-磷酸、2’-脱氧鸟苷-3’-磷酸和2’-脱氧胸苷-3’-磷酸;
(Agn)是腺苷-二醇核酸(GNA);并且
s是硫代磷酸酯连接(phosphorothioate linkage)。
在一些实施方案中,有义链包含修饰的核苷酸序列5′-gsusguGfcAfCfUfucgcuucaca-3′(SEQ ID NO:29),
其中a、c、g和u分别为2’-O-甲基腺苷-3’-磷酸、2’-O-甲基胞苷-3’-磷酸、2’-O-甲基鸟苷-3’-磷酸和2’-O-甲基尿苷-3’-磷酸;
Af、Cf、Gf和Uf分别为2’-氟代腺苷-3’-磷酸、2’-氟代胞苷-3’-磷酸、2’-氟代鸟苷-3’-磷酸和2’-氟代尿苷-3’-磷酸;并且
s是硫代磷酸酯连接(phosphorothioate linkage)。
在一些实施方案中,反义链和有义链包含如下示出的修饰的核苷酸序列:
(a)5′-usGfsuga(Agn)gCfGfaaguGfcAfcacsusu-3′(SEQ ID NO:16)和5′-gsusguGfcAfCfUfucgcuucaca-3′(SEQ ID NO:29);
(b)5′-usGfsuga(Agn)gcgaaguGfdCAfcacsusu-3′(SEQ ID NO:18)和5′-gsusguGfcAfCfUfucgcuucaca-3′(SEQ ID NO∶29);
(c)5′-usGfsudGa(Agn)gCfGfaaguGfcAfcacsusu-3′(SEQ ID NO:20)和5′-gsusguGfcAfCfUfucgcuucaca-3′(SEQ ID NO:29);
(d)5′-usGfsudGadAgdCGfaaguGfcAfcacsusu-3′(SEQ ID NO:23)和5′-gsusguGfcAfCfUfucgcuucaca-3′(SEQ ID NO:29);
(e)5′-usGfsuga(Agn)dGCfGfaaguGfcAfcacsusu-3′(SEQ ID NO:24)和5′-gsusguGfcAfCfUfucgcuucaca-3′(SEQ ID NO:29);
(f)5′-usGfsudGadAgdCGfaaguGfcAfdCacsusu-3′(SEQ ID NO:25)和5′-gsusguGfcAfCfUfucgcuucaca-3′(SEQ ID NO:29);或
(g)5′-usGfsuga(Agn)gCfGfaaguGfdCAfcacsusu-3′(SEQ ID NO:28)和5′-gsusguGfcAfCfUfucgcuucaca-3′(SEQ ID NO:29);
其中a、c、g和u分别为2’-O-甲基腺苷-3’-磷酸、2’-O-甲基胞苷-3’-磷酸、2’-O-甲基鸟苷-3’-磷酸和2’-O-甲基尿苷-3’-磷酸;
Af、Cf、Gf和Uf分别为2’-氟代腺苷-3’-磷酸、2’-氟代胞苷-3’-磷酸、2’-氟代鸟苷-3’-磷酸和2’-氟代尿苷-3’-磷酸;
dA、dC、dG和dT分别为2’-脱氧腺苷-3’-磷酸、2’-脱氧胞苷-3’-磷酸、2’-脱氧鸟苷-3’-磷酸和2’-脱氧胸苷-3’-磷酸;
(Agn)是腺苷-二醇核酸(GNA);并且
s是硫代磷酸酯连接。
在一些实施方案中,dsRNA剂的至少一条链包含至少1个核苷酸的3′突出端。在一些实施方案中,dsRNA剂的至少一条链包含2个核苷酸的3′突出端。
在一些实施方案中,dsRNA剂的双链区的长度是19-21个核苷酸对。
在一些实施方案中,dsRNA剂的每条链独立地具有19-23个核苷酸。在一些实施方案中,dsRNA剂的每条链独立地具有19-21个核苷酸。
在一些实施方案中,dsRNA剂还包含配体。在一些实施方案中,所述配体缀合至dsRNA剂的有义链的3’端。在一些实施方案中,所述配体为N-乙酰基半乳糖胺(GalNAc)衍生物。在某些实施方案中,配体为
在一些实施方案中,如以下示意所示的,dsRNA剂缀合至配体。
其中X为O或S。在一些实施方案中,X为O。
在一些实施方案中,所述反义链由如下示出的修饰的核苷酸序列组成:
5′-usGfsuga(Agn)gCfGfaaguGfcAfcacsusu-3′(SEQ ID NO:16),
5′-usGfsuga(Agn)gcgaaguGfdCAfcacsusu-3′(SEQ ID NO:18),
5′-usGfsudGa(Agn)gCfGfaaguGfcAfcacsusu-3′(SEQ ID NO:20),
5′-usGfsudGadAgdCGfaaguGfcAfcacsusu-3′(SEQ ID NO:23),
5′-usGfsuga(Agn)dGCfGfaaguGfcAfcacsusu-3′(SEQ ID NO:24),
5′-usGfsudGadAgdCGfaaguGfcAfdCacsusu-3′(SEQ ID NO:25),或
5′-usGfsuga(Agn)gCfGfaaguGfdCAfcacsusu-3′(SEQ ID NO:28),
其中a、c、g和u分别为2’-O-甲基腺苷-3’-磷酸、2’-O-甲基胞苷-3’-磷酸、2’-O-甲基鸟苷-3’-磷酸和2’-O-甲基尿苷-3’-磷酸;
Af、Cf、Gf和Uf分别为2’-氟代腺苷-3’-磷酸、2’-氟代胞苷-3’-磷酸、2’-氟代鸟苷-3’-磷酸和2’-氟代尿苷-3’-磷酸;
dA、dC、dG和dT分别为2’-脱氧腺苷-3’-磷酸、2’-脱氧胞苷-3’-磷酸、2’-脱氧鸟苷-3’-磷酸和2’-脱氧胸苷-3’-磷酸;
(Agn)是腺苷-二醇核酸(GNA);并且
s是硫代磷酸酯连接。
在一些实施方案中,本公开提供了dsRNA剂,其中所述有义链和反义链由如下示出的修饰的核苷酸序列组成:
(a)5′-usGfsuga(Agn)gCfGfaaguGfcAfcacsusu-3′(SEQ ID NO:16)和5′-gsusguGfcAfCfUfucgcuucaca-3′(SEQ ID NO∶29);
(b)5′-usGfsuga(Agn)gcgaaguGfdCAfcacsusu-3′(SEQ ID NO:18)和5′-gsusguGfcAfCfUfucgcuucaca-3′(SEQ ID NO:29);
(c)5′-usGfsudGa(Agn)gCfGfaaguGfcAfcacsusu-3′(SEQ ID NO:20)和5′-gsusguGfcAfCfUfucgcuucaca-3′(SEQ ID NO:29);
(d)5′-usGfsudGadAgdCGfaaguGfcAfcacsusu-3′(SEQ ID NO:23)和5′-gsusguGfcAfCfUfucgcuucaca-3′(SEQ ID NO:29);
(e)5′-usGfsuga(Agn)dGCfGfaaguGfcAfcacsusu-3′(SEQ ID NO:24)和5′-gsusguGfcAfCfUfucgcuucaca-3′(SEQ ID NO:29);
(f)5′-usGfsudGadAgdCGfaaguGfcAfdCacsusu-3′(SEQ ID NO:25)和5′-gsusguGfcAfCfUfucgcuucaca-3′(SEQ ID NO:29);或
(g)5′-usGfsuga(Agn)gCfGfaaguGfdCAfcacsusu-3′(SEQ ID NO:28)和5′-gsusguGfcAfCfUfucgcuucaca-3′(SEQ ID NO:29);
其中a、c、g和u分别为2’-O-甲基腺苷-3’-磷酸、2’-O-甲基胞苷-3’-磷酸、2’-O-甲基鸟苷-3’-磷酸和2’-O-甲基尿苷-3’-磷酸;
Af、Cf、Gf和Uf分别为2’-氟代腺苷-3’-磷酸、2’-氟代胞苷-3’-磷酸、2’-氟代鸟苷-3’-磷酸和2’-氟代尿苷-3’-磷酸;
dA、dC、dG和dT分别为2’-脱氧腺苷-3’-磷酸、2’-脱氧胞苷-3’-磷酸、2’-脱氧鸟苷-3’-磷酸和2’-脱氧胸苷-3’-磷酸;
(Agn)是腺苷-二醇核酸(GNA);
s是硫代磷酸酯连接;并且
所述有义链的3’端缀合至N-[三(GalNAc-烷基)-酰胺基癸酰基)]-4-羟基脯氨醇(L96)配体。
在另一方面,本公开还提供了包含如本文所公开的dsRNA剂的细胞。
本公开还提供了一种药物组合物,其包含本文所述的dsRNA剂和药用赋形剂。
本公开还提供了一种抑制细胞中的乙型肝炎病毒(HBV)基因表达的方法,所述方法包括使细胞与本文所公开的dsRNA剂或药物组合物接触,从而抑制细胞中HBV基因的表达。在一些实施方案中,细胞在受试者体内。在一些实施方案中,受试者是人。在一些实施方案中,所述受试者患有HBV相关疾病。在一些实施方案中,细胞是体外的。在一些实施方案中,HBV基因表达被抑制至少80%、90%、95%或98%,或被抑制至低于测定方法的检测水平。
本公开还提供了一种抑制细胞中乙型肝炎病毒(HBV)复制的方法,所述方法包括使细胞与本文所公开的dsRNA剂或药物组合物接触,从而抑制细胞中HBV的复制。在一些实施方案中,细胞在受试者体内。在一些实施方案中,受试者是人。在某些实施方案中,所述受试者患有HBV相关疾病。在一些实施方案中,细胞是体外的。在某些实施方案中,细胞中HBV的复制被抑制至少80%、90%、95%或98%,或被抑制至低于测定方法的检测水平。
本文还提供了一种降低感染HBV的受试者中乙型肝炎病毒(HBV)抗原水平的方法,所述方法包括向受试者施用治疗有效量的本文所公开的dsRNA剂或药物组合物,从而降低受试者中HBV抗原的水平。在一些实施方案中,HBV抗原是HBsAg。在一些实施方案中,HBV抗原是HBeAg。在一些实施方案中,在来自受试者的血清中测量HBV抗原。在一些实施方案中,所述受试者是HBeAg阳性的。在一些实施方案中,受试者是HBeAg阴性的。在一些实施方案中,血清中的HBV抗原水平降低至少1 log10、至少2 log10、至少3 log10或至少4 log10,或降低至低于测定方法的检测水平。
本公开还提供了一种降低感染HBV的受试者中乙型肝炎病毒(HBV)的病毒载量的方法,所述方法包括向受试者施用治疗有效量的如本文所公开的dsRNA剂或药物组合物,从而降低受试者的HBV病毒载量。在一些实施方案中,在来自受试者的血清中测量HBV病毒载量。在一些实施方案中,所述受试者是HBeAg阳性的。在一些实施方案中,受试者是HBeAg阴性的。在一些实施方案中,血清中HBV病毒载量降低至少1 log10、至少2 log10、至少3log10或至少4 log10,或降低至低于测定方法的检测水平。
本文还提供了一种治疗患有乙型肝炎病毒(HBV)感染或HBV相关障碍的受试者的方法,所述方法包括向受试者施用治疗有效量的如本文所公开的dsRNA剂或药物组合物,从而治疗受试者。在一些实施方案中,受试者是HBeAg阳性的。在一些实施方案中,受试者是HBeAg阴性的。在一些实施方案中,HBV相关障碍是慢性肝炎,并且受试者是HBeAg阳性的。在一些实施方案中,HBV相关障碍是慢性肝炎,且受试者是HBeAg阴性的。
在前述方法的一些实施方案中,以0.01mg/kg至10mg/kg、0.5mg/kg至50mg/kg或3mg/kg至10mg/kg的剂量向受试者施用dsRNA剂。在所述方法的一些实施方案中,以3mg/kg至10mg/kg的剂量向受试者施用dsRNA剂。在所述方法的一些实施方案中,以50mg至200mg的固定剂量向受试者施用dsRNA剂。
在前述方法的一些实施方案中,dsRNA剂皮下施用于受试者。
在前述方法的一些实施方案中,dsRNA剂以两个或更多个剂量施用于受试者。
在前述方法的一些实施方案中,每月一次、每两个月一次或每三个月一次向受试者施用dsRNA剂。在所述方法的一些实施方案中,每月不超过一次将dsRNA剂施用于受试者。
在前述方法的一些实施方案中,所述方法进一步包括向受试者施用另外的治疗剂,例如一种或多种另外的治疗剂。另外的治疗剂可包括但不限于抗病毒剂、逆转录酶抑制剂、免疫刺激剂、治疗性疫苗、病毒进入抑制剂、抑制HbsAg分泌或释放的寡核苷酸、衣壳抑制剂和共价闭合环状(ccc)HBV DNA抑制剂,以及上述任何的组合。在一些实施方案中,另外的治疗剂是逆转录酶抑制剂。
在一些实施方案中,施用超过一种另外的治疗剂,并且另外的治疗剂是逆转录酶抑制剂和免疫刺激剂。逆转录酶抑制剂可以包括但不限于富马酸替诺福韦二吡呋酯(TDF)、替诺福韦艾拉酚胺、拉米夫定、阿地福韦酯、恩替卡韦(ETV)、替比夫定和AGX-1009。免疫刺激剂可包括但不限于聚乙二醇化干扰素α2a(PEG-IFN-α2a)、干扰素α-2b、重组人白介素7和Toll样受体7(TLR7)激动剂。
本文还提供了用于实施本文公开的任何方法的组合物。在一些实施方案中,本公开提供了如本文公开dsRNA剂或药物组合物,用于治疗受试者的乙型肝炎病毒(HBV)感染。在一些实施方案中,本公开提供了如本文所公开的dsRNA剂或药物组合物,用于治疗受试者的乙型肝炎病毒(HBV)相关障碍。在一些实施方案中,HBV相关障碍是慢性肝炎,并且受试者是HBeAg阳性的。在一些实施方案中,HBV相关障碍是慢性肝炎,且受试者是HBeAg阴性的。在一些实施方案中,受试者正在或已经施用另外的治疗剂,例如抗病毒剂、逆转录酶抑制剂、免疫刺激剂、治疗性疫苗、病毒进入抑制剂、抑制HbsAg的分泌或释放的寡核苷酸、衣壳抑制剂或共价闭合环状(ccc)HBV DNA抑制剂,或上述任意的组合。在一些实施方案中,另外的治疗剂是逆转录酶抑制剂,例如富马酸替诺福韦二吡呋酯(TDF)、替诺福韦艾拉酚胺、拉米夫定、阿地福韦酯、恩替卡韦(ETV)、替比夫定或AGX-1009。在一些实施方案中,所施用的另外的治疗剂是逆转录酶抑制剂(富马酸替诺福韦二吡呋酯(TDF)、替诺福韦艾拉酚胺、拉米夫定、阿地福韦酯、恩替卡韦(ETV)、替比夫定或AGX-1009)和免疫刺激剂(例如,聚乙二醇化干扰素α2a(PEG-IFN-α2a)、干扰素α-2b、重组人白介素7或Toll样受体7(TLR7)激动剂)。
本公开提供了如本文所公开的dsRNA剂或药物组合物用于实施任何前述方法的用途。
本公开还提供了如本文所公开的dsRNA剂在制备或制造用于实施任何前述方法的药物中的用途。
本公开还提供了试剂盒,其包含如本文所公开的dsRNA剂或药物组合物,任选地具有用于实施本文所述方法的说明书。
附图说明
图1示意性地描绘了约3.2kb双链HBV基因组的结构。HBV基因组的复制通过RNA中间体发生,并产生4个重叠的病毒转录物(约3.5kb转录物、约2.4kb转录物、约2.1kb转录物和约0.7kb转录物),编码在三个阅读框内翻译的7种病毒蛋白(pre-S1、pre-S2、S、P、X、pre-C和C)。
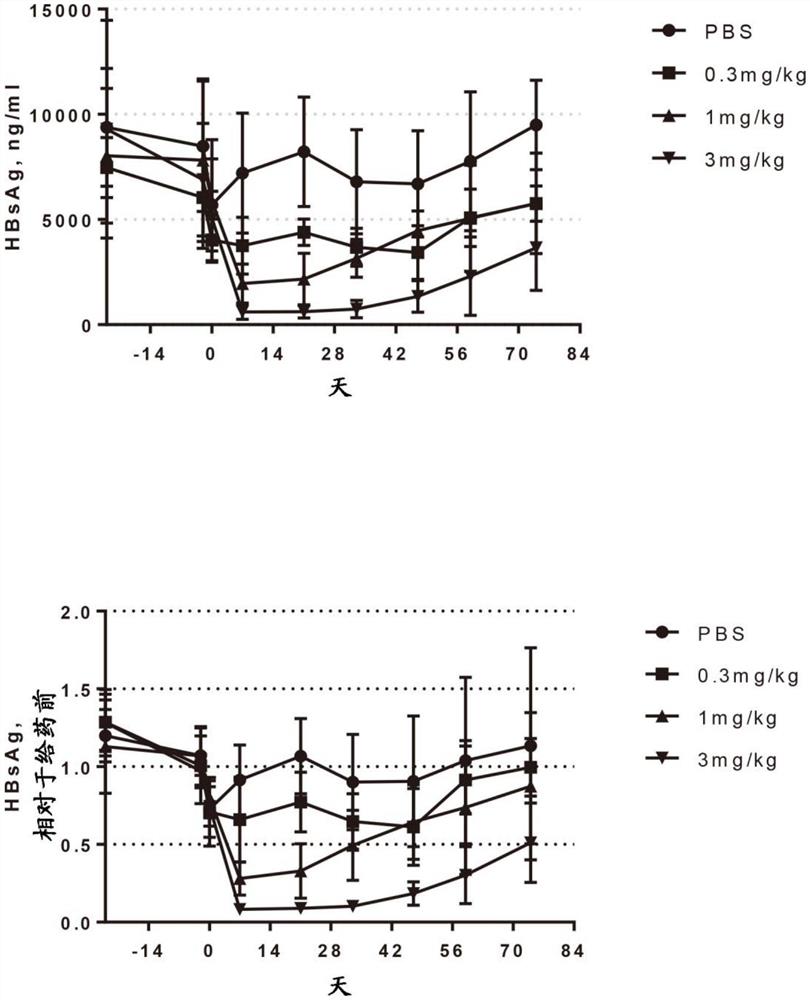
图2A-2B示出了在AAV-HBV小鼠模型中的(A)血清HBsAg浓度(ng/mL)和(B)相对于给药前的血清HBsAg水平。图2A示出了给药前(第-24天、第-2天、第0天)或0.3、1或3mg/kg的单剂量AD-81890后(第14天、第21天、第33天、第47天、第59天、第74天),HBV-AAV小鼠的HBsAg血清水平。每个点代表n=6-9只动物的平均值,条代表SD。图2B示出了相对于给药前(第-24天、第-2天、第0天)或在0.3、1或3mg/kg的单剂量AD-81890后(第14天、第21天、第33天、第47天、第59天、第74天),HBV-AAV小鼠的HBsAg血清水平。每个点代表n=6-9只动物的平均值,条代表SD。
图3示出了在第-55天、第-27天、第-13天、第0天、第14天、第28天、第42天、第56天、第84天、第112天和第140天,AAV-HBV小鼠模型中相对于给药前的血清HBsAg水平。给药方案包括对照(PBS)Q2W×6;AD-66810(1mg/kg;Q2W×6);AD-81890(1mg/kg;Q2W×6);AD-81890(1mg/kg;QM×3);AD-81890(3mg/kg;Q2W×6);AD-81890(3mg/kg;QM×3);和AD-81890(9mg/kg;QM×1)。在第0天施用第一剂。每个点代表n为4-6只动物的平均值,条代表SD。
图4示出了箱形图,其显示在AD-66810或AD-81890中显著下调(调整后p值<0.05,log2倍数变化<0)的所有基因的log2倍数变化(处理/对照)。水平粗线表示中位log2倍数变化,每个盒的垂直范围表示四分位间距(IQR),且须延伸到+/-1.58IQR/sqrt(N),其中N是每组中基因的数目。使用Welch双侧双样本t检验评估统计显著性。
图5A-5B示出了相对于施用PBS的小鼠,在施用AD-66810(图5A)或AD-81890(图5B)之后PXB小鼠中随时间的ALT水平。小鼠通过皮下注射在第0天、第21天、第28天、第35天和第42天给药12、36或100mg/kg的AD-66810、AD-81890或PBS(对照)(每组n=4)。每周两次通过眼眶后抽血收集血液,并使用常规方法制备血清。
具体实施方式
本公开了提供了dsRNA剂组合物,其影响乙型肝炎病毒(HBV)基因的RNA转录物的RNA诱导沉默复合物(RISC)介导的切割。所述基因可以在细胞内,例如在受试者(如人)体内的细胞内。这些dsRNA剂的使用使得能够在哺乳动物中靶向降解相应基因(HBV基因)的mRNA。
本文所述的dsRNA剂已被设计为靶向HBV基因组中在至少八种已知HBV基因型中保守的区域。另外,本公开的dsRNA剂已被设计为通过抑制超过一个HBV基因的表达而抑制HBV生命周期的所有步骤,例如复制、组装、病毒分泌和亚病毒抗原的分泌。特别地,由于HBV基因组的转录产生多顺反子的、重叠的RNA,因此在一些实施方案中,靶向单个HBV基因的dsRNA剂显著抑制大多数或所有HBV转录物的表达。例如,因为HBV基因组被转录成单一mRNA,所以靶向S基因的本公开的dsRNA剂将导致不仅抑制S基因的表达,而且抑制“下游”聚合酶基因的表达。此外,本公开的dsRNA剂已被设计成通过靶向HBV结构基因来抑制HBV病毒复制,及抑制HBV X基因,从而允许受试者的免疫系统检测并应答HBsAg的存在以产生抗HBV抗体从而清除HBV感染。不意图受理论的限制,据认为前述特性与特定靶部位或这些dsRNA剂中的特定修饰的组合或子组合赋予本公开的dsRNA剂改善的功效、稳定性、安全性、效力和持久性。
使用体外和体内测定方法,本发明人已经证明靶向HBV基因的dsRNA剂可以强效地介导RNAi,从而显著抑制超过一种HBV基因的表达。因此,包括这些dsRNA剂的方法和组合物可用于治疗患有HBV感染或HBV相关疾病,例如慢性乙型肝炎(CHB),的受试者。
因此,本公开还提供了使用dsRNA剂组合物治疗患有受益于抑制或降低HBV基因的表达的障碍,例如HBV相关疾病,如慢性乙型肝炎病毒感染(CHB)的受试者的方法,所述dsRNA剂组合物影响HBV基因RNA转录物的RNA诱导沉默复合物(RISC)介导的切割。
本公开的dsRNA剂包括具有互补性区域的RNA链(反义链),所述互补性区域长度为约19-21个核苷酸,例如,长度为约19个核苷酸,其与至少一种HBV基因型的HBV基因的mRNA转录物的至少一部分基本上互补。应当理解,存在多种HBV基因型,使得本公开的dsRNA剂与不同HBV基因型的互补程度可能变化。
在一些实施方案中,有义链和反义链形成19-21个连续核苷酸的双链体。
以下详细描述公开了如何制备和使用含有dsRNA剂的组合物以抑制HBV基因的表达,以及用于治疗患有受益于抑制或降低HBV基因的表达的疾病和障碍的受试者的组合物、用途和方法。
I.
为了可以更容易地理解本发明,首先定义某些术语。另外,应该注意的是,每当列举出参数的值或值的范围时,所列举的值中间的值和范围也旨在成为该特征的一部分。
除非上下文另有要求,否则在本说明书和权利要求书中,词语“包含”及其变体(例如“包括”和“含有”)应以开放式的、包含性的含义来解释,即“包括,但不限于”。“由…组成”是指排除多于痕量元素的其他成分或本文公开的实质性方法步骤。例如,当多核苷酸不包括任何其他核苷酸但不排除配体(例如靶向配体)或修饰的掺入时,该多核苷酸由一核苷酸序列组成。术语“基本上由……组成”将权利要求的范围限制为指定的材料或步骤,或者限定为不实质性影响所要求保护的发明的基本特征的那些材料或步骤。例如,基本上由本文所定义的元素组成的药物组合物将不会排除来自分离和纯化方法的痕量污染物以及药学上可接受的载体,例如磷酸盐缓冲盐水、防腐剂等。类似地,当多核苷酸包括构成多核苷酸长度的至多20%的额外核苷酸且基本不影响多核苷酸的活性(例如,改变多核苷酸活性不多于50%)时,该多核苷酸基本上由一核苷酸序列组成。由每个过渡术语定义的实施方案在本发明的范围内。
冠词“一个(a)”和“一(an)”在本文中是指一个或多于一个(即,至少一个)该冠词的语法对象。举例来说,“一个元素”是指一个元素或多于一个元素,例如多个元素。
术语“包括”在本文中用于指短语“包括但不限于”,并且与该短语互换使用。
除非上下文另外明确指出,否则术语“或”在本文中用于指术语“和/或”,并且与该术语互换使用。例如,“有义链或反义链”理解为“有义链或反义链或有义链和反义链”。
本文使用的术语“约”是指在本领域的典型公差范围内。例如,“约”可以理解为在平均值的2个标准偏差内。当在一系列数字或范围之前存在“约”时,应理解“约”可以修饰该系列或范围中的每个数字。
在一个数字或一系列数字之前的术语“至少”应理解为该系列中的每个数字以及从上下文清楚地看出可合乎逻辑地被包括在内的所有后续数字或整数。例如,核酸分子中核苷酸的数目必须是整数。例如,“21个核苷酸的核酸分子的至少18个核苷酸”是指18、19、20或21个核苷酸具有所指示的性质。当至少出现在一系列数字或范围之前时,应理解“至少”可以修饰该系列或范围中的每个数字。
如本文中所使用的,“不大于”或“小于”被理解为与该短语相邻的值以及根据上下文合乎逻辑的逻辑上较低的值或整数,至零。例如,具有“不超过2个核苷酸”的突出端的双链体具有2、1或0个核苷酸的突出端。当在一系列数字或范围之前出现“不超过”时,应理解为“不超过”可以修饰该系列或范围中的每个数字。
如本文所用,范围包括上限和下限。
如果序列与其在转录物或其他序列上的指示位点之间存在冲突,则以本说明书中记载的核苷酸序列为准。
如本领域技术人员适当确定的,可以组合本公开的各种实施方案。
如本文所用,与术语“HBV”可互换使用的“乙型肝炎病毒”是指属于嗜肝DNA病毒科的公知非致细胞病变性的、嗜肝性DNA病毒。
HBV基因组是具有重叠阅读框的部分双链的、环状DNA(参见例如图1)。
根据大小,存在由HBV基因组编码的四个转录物(在本文中可称为“基因”或“开放阅读框”)。这些转录物包含称为C、X、P和S的开放阅读框。核心蛋白由基因C编码(HBcAg)。乙型肝炎e抗原(HBeAg)通过蛋白水解加工前核心(pre-C)蛋白而产生。DNA聚合酶由基因P编码。基因S是编码表面抗原(HBsAg)的基因。HBsAg基因是一个长的开放阅读框,其包含三个框内“起始”(ATG)密码子,因此产生三种不同大小的多肽,分别称为大、中和小S抗原,pre-S1+pre-S2+S、pre-S2+S或S。表面抗原除了装饰HBV的包膜外,也是亚病毒颗粒的部分,其与病毒颗粒相比产生大大过量,并在免疫耐受和隔绝抗HBsAg抗体中发挥作用,从而使感染性颗粒逃避免疫检测。基因X编码的非结构蛋白的功能尚不完全清楚,但它在转录反式激活和复制中起作用,并且与肝癌的发展有关。
HBV是少数几种在复制过程中利用逆转录酶的DNA病毒之一,所述复制过程涉及多个阶段,包括进入、脱壳以及将病毒基因组转移到细胞核。最初,HBV基因组的复制涉及RNA中间体的产生,该RNA中间体随后被逆转录以产生DNA病毒基因组。
HBV感染细胞后,病毒基因组的松弛环状DNA(rcDNA)被转运到细胞核中并转化为游离型共价闭合环状DNA(cccDNA),其充当病毒mRNA的转录模板。转录和核输出后,细胞质病毒前基因组RNA(pgRNA)与HBV聚合酶和衣壳蛋白一起组装以形成核衣壳,在核衣壳中聚合酶催化的逆转录产生负链DNA,其随后复制成正链DNA以形成后代rcDNA基因组。然后,成熟的核衣壳与病毒包膜蛋白一起包装从而以病毒粒子的形式出现,或者穿梭到细胞核中以通过细胞内cccDNA扩增途径扩增cccDNA库。cccDNA是HBV复制周期的重要组成部分,且负责感染的建立和病毒持续。
HBV感染导致产生两种不同的颗粒:1)传染性HBV病毒本身(或Dane颗粒),其包括由HBcAg组装的病毒衣壳,并被通过带有HBV表面抗原的由脂质膜组成的包膜所覆盖,以及2)非传染性的亚病毒颗粒(或SVP),其包含小或中形式的乙型肝炎表面抗原HBsAg。对于产生的每个病毒颗粒,超过10000个SVP被释放到血液中。因此,SVP(以及它们携带的HBsAg蛋白)代表了血液中绝大多数的病毒蛋白。HBV感染的细胞还分泌前核心蛋白的可溶性蛋白水解产物,称为HBV e-抗原(HBeAg)。
已经确定了八种HBV基因型,命名为A至H,并提出了另外两种基因型I和J,每种基因型有独特的地理分布。该病毒是非致细胞病变的,其中病毒特异性细胞免疫是暴露于HBV急性感染(6个月的肝病消退)或通常与进行性肝损伤相关的慢性HBV感染的结果的主要决定因素。
术语“HBV”包括任何HBV基因型(A至J)。HBV基因组参考序列的完整编码序列可以在例如GenBank登录号GI:21326584(SEQ ID NO:1)和GI:3582357(SEQ ID NO:3)中找到。反义序列分别在SEQ ID NO:2和SEQ ID NO:4中提供。C、X、P和S蛋白的氨基酸序列可以在例如NCBI登录号YP_009173857.1(C蛋白)(SEQ ID NO:37);YP_009173867.1和BAA32912.1(X蛋白)(SEQ ID No:36和40);YP_009173866.1和BAA32913.1(P蛋白)(SEQ ID No:32和38);及YP_009173869.1、YP_009173870.1、YP_009173871.1和BAA32914.1(S蛋白)(SEQ ID NO:33、34、35、39)中找到。SEQ ID NO:36-37提供了来自HBV基因型D,毒株ayw的蛋白质和DNA序列。SEQ ID NO:38-39提供了来自HBV基因型C的蛋白质和DNA序列。SEQ ID No:41-49提供了HBV蛋白和DNA序列或其反向互补序列的其他实例。
HBV mRNA序列的其他实例可使用公共数据库例如GenBank、UniProt和OMIM容易地获得。可以在http://www.hpa-bioinformatics.org.uk/HepSEQ/main.php上访问国际乙型肝炎病毒株数据存储库(Intemational Repository for Hepatitis B Virus StrainData)。
如本文所用,术语“HBV”还指HBV基因组(例如基因型A-J及其变体)的天然存在的DNA序列变化形式,。
如本文所用,与术语“HDV”可互换使用的“D型肝炎病毒”是指属于嗜肝DNA病毒科的众所周知的非致细胞病变性、嗜肝性DNA病毒。参见例如Ciancio和Rizzetto,Nat.Rev.11:68-71,2014;Le Gal et al.,Emerg.Infect.Dis.12∶1447-1450,2006;以及Abbas和A fzal,World J.Hep.,5:666-675,2013,它们全部通过引用并入本文。除非另有说明,否则HDV是指HDV的所有进化枝和变体。
HDV产生一种蛋白质,即HDAg。它有两种形式:27kDa的大HDAg(也称为lHD、L-HDAg和大HDV抗原)和24kDa的小HDAg(也称为sHD、S-HDAg和小HDV抗原)。这两种形式的N末端相同;它们的区别在于大HDAg C末端的19个氨基酸。两种亚型都是从同一阅读框产生的,该阅读框在密码子196处包含UAG终止密码子,且通常仅产生小HDAg。但是,通过细胞酶腺苷脱氨酶-1进行编辑将该终止密码子更改为UCG,从而允许产生大HDAg。尽管具有90%相同的序列,但这两种蛋白质在感染过程中起着相异的作用。HDAg-S在感染的早期阶段产生,且进入细胞核和支持病毒复制。相反,HDAg-L在感染的后期阶段产生,充当病毒复制的抑制剂,并且是病毒颗粒装配所必需的。
HDV mRNA序列的其他实例可使用公共数据库例如GenBank、UniProt和OMIM容易地获得。
如本文所用,术语“HDV”也指HDV基因组的天然存在的DNA序列变化形式。
如本文所用,术语“核苷酸(核苷)类似物”或“逆转录酶抑制剂”是DNA复制的抑制剂,其在结构上类似于核苷酸或核苷并且特异性地抑制HBV cccDNA的复制而不显著抑制宿主(例如人)DNA的复制。这样的抑制剂包括富马酸替诺福韦二吡呋酯(TDF)、替诺福韦艾拉酚胺(TAF)、拉米夫定、阿地福韦酯、恩替卡韦(ETV)、替比夫定、AGX-1009、恩曲他滨、克拉夫定、利托那韦、dipivoxil、洛布卡韦(l0bucavir)、泛昔洛韦(famvir)、FTC、N-乙酰-半胱氨酸(NAC)、PC1323、乙肝治疗用疫苗(theradigm-HBV)、胸腺素-α、更昔洛韦(ganciclovir)、besifovir(ANA-380/LB-80380)和tenofvir-exaliades(TLX/CMX157)。在某些实施方案中,核苷酸(核苷)类似物是恩替卡韦(ETV)。核苷酸(核苷)类似物可从许多来源商购获得,并根据其标签指示(例如,通常以特定剂量口服施用)或如治疗HBV的熟练执业医生确定的用于本文提供的方法中。
如本文所用,“靶序列”是指在HBV基因转录期间形成的mRNA分子的核苷酸序列的连续部分,包括作为初级转录产物的RNA加工的产物的mRNA。在一些实施方案中,序列的靶部分至少足够长以用作在该部分处或附近进行HBV基因转录期间形成的mRNA分子的核苷酸序列的dsRNA剂指导切割的底物。
靶序列的长度可以为约19至21个核苷酸,例如,长度为19、20或21个核苷酸。
如本文所用,术语“包含序列的链”是指包含通过使用标准核苷酸命名指称的序列描述的核苷酸的链的寡核苷酸。
通常,“G”、“C”、“A”、“T”和“U”各自代表含有鸟嘌呤、胞嘧啶、腺嘌呤、胸腺嘧啶和尿嘧啶作为碱基的核苷酸。然而,应理解,术语“核糖核苷酸”或“核苷酸”也可指如下文进一步详述的修饰的核苷酸,或代理替代部分(surrogate replacement moiety)(参见,例如,表1)。技术人员熟知,鸟嘌呤、胞嘧啶、腺嘌呤和尿嘧啶可以被其他部分代替而基本上不改变包含带有这种代替部分的核苷酸的寡核苷酸的碱基配对特性。例如但不限于,包含肌苷作为其碱基的核苷酸可以与包含腺嘌呤、胞嘧啶或尿嘧啶的核苷酸碱基配对。因此,包含尿嘧啶、鸟嘌呤或腺嘌呤的核苷酸可以在本公开表征的dsRNA的核苷酸序列中被包含例如肌苷的核苷酸代替。在另一个实例中,寡核苷酸中任何地方的腺嘌呤和胞嘧啶可以分别用鸟嘌呤和尿嘧啶代替以形成与靶mRNA的G-U摆动碱基配对。包含此类代替部分的序列适用于本公开中表征的组合物和方法。
本文中可互换使用的术语“dsRNA剂”、“RNAi剂”、“iRNA剂”、“iRNA”和“RNA干扰剂”是指包含如本文中术语定义的RNA并介导通过RNA诱导沉默复合物(RISC)途径靶向切割RNA转录物的试剂。dsRNA剂通过称为RNA干扰(RNAi)的过程指导mRNA的序列特异性降解。dsRNA剂调节(例如抑制)细胞(例如受试者(例如哺乳动物受试者)体内的细胞)内HBV基因(例如,一个或多个HBV基因)的表达。
用于本文公开的组合物、用途和方法中的“dsRNA剂”是双链RNA,并且在本文中被称为“dsRNA剂”、“双链RNA剂”、“双链RNA(dsRNA)分子”、“dsRNA”、“iRNA”、“iRNA剂”、“dsRNAi剂”、“RNAi剂”或“siRNA”。术语“dsRNA”是指核糖核酸分子的复合体,其具有包含两条反向平行且基本互补的核酸链的双链体结构,所述核酸链相对于靶RNA(即,HBV基因)被称为具有“有义”和“反义”定向。在本公开一些实施方案中,dsRNA触发通过转录后基因沉默机制(本文中称为RNA干扰或RNAi)的靶RNA(例如mRNA)的降解。
通常,dsRNA分子的每条链可包含核糖核苷酸,但是如本文中详细描述的,每条链或两条链还可包含一个或多个非核糖核苷酸,例如脱氧核糖核苷酸或修饰的核苷酸。另外,如本说明书中所使用的,“dsRNA剂”可以包括具有化学修饰的核糖核苷酸;dsRNA剂可在多个核苷酸上包含实质修饰。如本文所用,术语“修饰的核苷酸”是指独立地具有修饰的糖部分、修饰的核苷酸间键或修饰的核碱基的核苷酸。因此,术语修饰的核苷酸涵盖核苷间连接、糖部分或核碱基的例如官能团或原子的取代、添加或去除。适用于本公开的试剂的修饰包括本文公开或本领域已知的所有类型的修饰。为了本说明书和权利要求书的目的,在dsRNA剂型分子中使用的任何此类修饰均被“dsRNA剂”涵盖。
如本文所用,术语“抑制”与“减少”、“沉默”、“下调”、“抑止”和其他类似术语可互换使用,并且包括任何水平的抑制。优选地,抑制包括统计学上显著的抑制或临床上显著的抑制。
如本文所用,短语“抑制HBV的表达”或“抑制HBV基因的表达”包括抑制任何HBV基因(例如,在HBV病毒感染中由HBV表达的HBV基因、细胞中由表达构建体表达的HBV基因)以及编码HBV蛋白的HBV基因的变体或突变体的表达。该术语包括编码一种或多种HBV病毒蛋白(例如,preS1/2-S、preS、S、P、X、preC和C)的任何HBV转录物(例如3.5kb、2.4kb、2.1kb或0.7kb转录物)以及HBV基因的变体或突变体的敲减。
“抑制HBV基因的表达”包括对HBV基因或转录物的任何水平的抑制,例如,HBV基因(例如,HBV基因S、P、X或C或其任意组合,例如S、P和C)的表达的至少部分抑制。可以根据与HBV基因表达相关的任何变量的水平或水平变化(例如,HBV mRNA水平或HBV蛋白水平,或HBV cccDNA水平)来评估HBV基因的表达。该水平可以在单个细胞或一组细胞中评估,包括例如源自受试者的样品,例如,可以监测血清中的水平。抑制可以通过与对照水平相比,这些变量中的一个或多个的绝对或相对水平的降低来评估。对照水平可以是本领域中使用的任何类型的对照水平,例如给药前的基线水平,或从相似受试者确定的水平或来自未处理或经对照(仅缓冲液的对照或非活性剂对照)处理的适当对照受试者、细胞或样品的群体平均值。
在本公开方法的一些实施方案中,HBV基因的表达被抑制至少80%、85%、90%、95%,例如在受试者中,被抑制至少1 log10、2 log10、3 log10或4 log10,或被抑制至低于测定方法的检测水平。在优选的实施方案中,受试者中HBV基因表达的抑制导致基因表达水平的临床相关抑制,例如,当单独或与促进或增强免疫反应的其他药剂组合施用时,充分抑制以允许针对HBV蛋白的有效免疫应答。
在体外基于细胞的测定或在体内模型(例如本文提供的小鼠AAV-hHBV模型)中异源基因的表达中,优选总HBV表达抑制至少90%,例如抑制至少1 log10、2 log10或3log10。在治疗患有HBV感染的受试者时,优选降低HBV基因或蛋白质水平至少90%,即治疗前和治疗后HBV基因或蛋白质水平的差异。可能需要超过一个剂量以实现所需的抑制水平。
HBV基因表达的抑制可以通过由第一细胞或细胞组(例如,这些细胞可存在于源自受试者的样品中)表达的RNA量的减少来体现,所述第一细胞或细胞组中HBV基因被转录并且所述第一细胞或细胞组经过处理(例如,通过使一个或多个细胞与本公开的dsRNA剂接触,或通过向所述细胞存在或曾经存在于其中的受试者施用本公开的dsRNA剂)使得与基本上与第一细胞或细胞组相同但未经过这种处理的第二细胞或细胞组(对照细胞)相比HBV的表达被抑制。在优选的实施方案中,通过WO2016/077321的实施例2中提供的rtPCR方法(该方法以引用方式并入本文)以及在适当匹配的细胞系中用10nM浓度的双链体进行的体外测定来评估抑制。使用以下公式将经处理细胞中的mRNA水平表示为对照细胞中mRNA水平的百分比:
或者,可以根据功能上与HBV基因表达相关联的参数的降低来评估HBV基因表达的抑制。HBV基因沉默可以在组成型表达或通过基因组工程而表达HBV基因的任何细胞中和通过本领域已知的任何测定方法确定。
HBV蛋白表达的抑制可以通过由细胞或细胞组表达的HBV蛋白的水平(例如,在源自受试者的样品中表达的蛋白质水平)的降低来体现。如上所述,为了评估mRNA抑制,可将经处理的细胞或细胞组中蛋白质表达水平的抑制类似地表示为对照细胞或细胞组中或血清中蛋白质水平的百分比。
可用于评估HBV基因表达的抑制的对照细胞或细胞组包括尚未与本公开的dsRNA剂接触的细胞或细胞组。例如,对照细胞或细胞组可源自在用dsRNA剂治疗受试者之前的单个受试者(例如,人或动物受试者)。在替代实施方案中,可以将所述水平与适当的对照样品,例如已知的群体对照样品进行比较。
可以使用本领域已知的用于评估mRNA表达的任何方法,优选使用WO2016/077321实施例2中提供的rtPCR方法,测定由细胞或细胞组表达的HBV RNA的水平,或循环HBV RNA水平。在一些实施方案中,通过检测转录的多核苷酸或其部分(例如HBV基因的RNA)来测定样品中HBV基因(例如,总HBV RNA、HBV转录物,例如HBV 3.5kb转录物)的表达水平。可以使用RNA提取技术从细胞中提取RNA,包括例如使用酸性苯酚/异硫氰酸胍提取(RNAzol B;Biogenesis)、RNeasy RNA制备试剂盒
在一些实施方案中,使用核酸探针测定HBV基因的表达水平。如本文所用,术语“探针”是指能够选择性结合特定HBV基因的任何分子。探针可以由本领域技术人员合成,或源自适当的生物制品。探针可以被特别设计成被标记的。可用作探针的分子的实例包括但不限于RNA、DNA、蛋白质、抗体和有机分子。
分离的RNA可用于杂交或扩增测定中,包括但不限于RNA印迹分析、聚合酶链反应(PCR)分析和探针阵列。用于测定mRNA水平的一种方法涉及使分离的mRNA与可与HBV mRNA杂交的核酸分子(探针)接触。在一些实施方案中,mRNA被固定在固体表面上并与探针接触,例如通过在琼脂糖凝胶上运行分离的mRNA并将mRNA从凝胶转移到膜如硝酸纤维素上。在一些其他实施方案中,将探针固定在固体表面上,并使mRNA与探针接触,例如,在
测定样品中HBV基因表达水平的替代方法涉及样品中例如mRNA的核酸扩增或逆转录酶(以制备cDNA)的过程,例如通过RT-PCR(实验方案示于Mullis,1987,美国专利No.4,683,202中)、连接酶链反应(Barany(1991)Proc.Natl.Acad.Sci.USA 88:189-193)、自维持序列复制(Guatelli et al.(1990)Proc.Natl.Acad.Sci.USA 87:1874-1878)、转录扩增系统(Kwoh et al.(1989)Proc.Natl.Acad.Sci.USA 86∶1173-1177)、Q-β复制酶(Lizardi etal.(1988)Bio/Technology 6:1197)、滚环复制(Lizardi et al.,美国专利No.5,854,033)或任何其他核酸扩增方法,然后使用本领域技术人员众所周知的技术检测扩增的分子。如果核酸分子以非常低的数量存在,则这些检测方案对于此类分子的检测特别有用。在本公开的特定方面,例如通过使用本文提供的方法,通过定量荧光RT-PCR(即,TaqMan
HBV RNA的表达水平可以使用膜印迹法(例如用于杂交分析,如RNA印迹、斑点印迹等)或微孔、样品管、凝胶、珠或纤维(或任何包含结合的核酸的固体支持体)监测。参见美国专利No.5,770,722、5,874,219、5,744,305、5,677,195和5,445,934,它们通过引用并入本文以提供与此类方法相关的教导。HBV表达水平的测定还可包括使用溶液中的核酸探针。
在优选的实施方案中,使用实时PCR(qPCR)评估RNA表达的水平。在WO2016/077321的实施例2中描述并举例说明了这些方法的使用。
HBV蛋白表达水平可以使用本领域已知的用于测量蛋白质水平的任何方法来测定。这样的方法包括,例如,电泳、毛细管电泳、高效液相色谱法(HPLC)、薄层色谱法(TLC)、超扩散色谱法(hyperdiffusion chromatography)、流体或凝胶沉淀反应、吸收光谱法、比色测定法、分光光度测定法、流式细胞术、免疫扩散(单向或双向)、免疫电泳、蛋白质印迹、放射免疫测定法(RIA)、酶联免疫吸附测定法(ELISA)、免疫荧光测定法、电化学发光测定法等。
双链体区域可以具有允许通过RISC途径特异性降解期望的靶RNA的任何长度,且长度可以在约19-21个碱基对的范围内,例如,长度为约19、20或21个碱基对。本文提供的示例性dsRNA剂包括19-21个碱基对的双链体长度。
如果dsRNA的两条基本互补链由单独的RNA分子组成,则这些分子虽然不需要但是可以共价连接。如果两条链以形成双链结构的一条链的3′端与另一条链的5′端之间不间断的核苷酸链以外的方式共价连接,该连接结构称为“接头”。RNA链可以具有相同或不同数量的核苷酸。碱基对的最大数目是dsRNA最短链中的核苷酸数减去双链体中存在的任何突出端。除双链体结构外,dsRNA剂可包含一个或多个核苷酸突出端。
如本文所用,术语“核苷酸突出端”是指从双链dsRNA剂的双链体结构突出的至少一个未配对的核苷酸。例如,当dsRNA的一条链的3′端延伸超出另一条链的5′端或者相反时,存在核苷酸突出端。dsRNA可包含具有至少一个核苷酸的突出端;或者,突出端可包含两个核苷酸。核苷酸突出端可以包含核苷酸/核苷类似物或由其组成,包括脱氧核苷酸/核苷。突出端可以在有义链、反义链或其任何组合上。此外,突出端的核苷酸可以存在于dsRNA的反义链或有义链任一的5′-端、3′-端或两个末端上。在优选的实施方案中,核苷酸突出端在反义链的3′端。
“钝”或“平端”是指在双链dsRNA剂的该末端没有未配对的核苷酸,即没有核苷酸突出端。“平端的”dsRNA剂在其整个长度上双链的dsRNA,即,在分子的任一端没有核苷酸突出端。在一些实施方案中,本公开的dsRNA剂包括在一端具有核苷酸突出端的dsRNA剂(即,具有一个突出端和一个平端的dsRNA剂)或在两端都具有核苷酸突出端的dsRNA剂。
术语“反义链”或“引导链”是指dsRNA剂中包含与靶序列(例如HBV mRNA)基本互补的区域的链。如本文所用,术语“互补性区域”是指反义链上与本文定义的序列,例如靶序列(例如HBV核苷酸序列)基本互补的区域。在互补性区域与靶序列不完全互补的情况下,错配可以在分子的内部或末端区域中。通常,最耐受的错配在末端区域内,例如在dsRNA剂的5′-或3′-端的5、4、3、2或1个核苷酸内。在一些实施方案中,本公开的dsRNA剂在反义链中包含核苷酸错配。在一些实施方案中,本公开的dsRNA剂在有义链中包含核苷酸错配。在一些实施方案中,核苷酸错配在例如dsRNA剂的3′端的5、4、3、2或1个核苷酸内。在一些实施方案中,核苷酸错配例如在dsRNA剂的3′-末端核苷酸中。
如本文所用,术语“有义链”或“过客链(passenger strand)”是指dsRNA剂的包含与本文所定义的反义链的区域基本互补的区域的链。
如本文所用,且除非另有说明,如本领域技术人员所理解的,当相对于第二核苷酸序列描述第一核苷酸序列时,术语“互补的”是指包含第一核苷酸序列的寡核苷酸或多核苷酸在某些条件下与包含第二核苷酸序列的寡核苷酸或多核苷酸杂交并形成双链体结构的能力。此类条件可以是例如严格条件,其中严格条件可以包括:400mM NaCl,40mM PIPES pH6.4,1mM EDTA,50℃或70℃持续12-16小时,然后进行洗涤(例如,参见“MolecularCloning:A Laboratory Manual,Sambrook,et al.(1989)Cold Spring HarborLaboratory Press)。可以应用其他条件,例如生物体内可能遇到的生理相关条件。技术人员将能够根据杂交核苷酸的最终应用来确定最适合于测试两个序列的互补性的条件集。
dsRNA剂(例如本文所述的dsRNA剂)内的互补序列包括包含第一核苷酸序列的寡核苷酸或多核苷酸与包含第二核苷酸序列的寡核苷酸或多核苷酸在一条或两条核苷酸序列的全长上的碱基配对。这样的序列在本文中可以被称为彼此“完全互补”。然而,当本文中第一序列被称为相对于第二序列“基本上互补”时,这两个序列可以是完全互补的,或者对于至多21个碱基对的双链体,它们杂交时可以形成一个或多个,但通常不超过4、3或2个错配碱基对,同时保留在与其最终应用(例如,通过RISC途径抑制基因表达)最相关的条件下杂交的能力。但是,在将两个寡核苷酸设计成在杂交时形成一个或多个单链突出端的情况下,就确定互补性而言,此类突出端不应视为错配。例如,出于本文所述的目的,包含一个长度为21个核苷酸的寡核苷酸和另一个长度为23个核苷酸的寡核苷酸的dsRNA剂(其中较长的寡核苷酸包含与较短的寡核苷酸完全互补的21个核苷酸的序列)仍可以被称为“完全互补的”。
如本文所用的,“互补”序列还可以包括或完全由非Watson-Crick碱基对或由非天然和修饰核苷酸形成的碱基对形成,只要满足针对它们杂交能力的上述要求即可。这样的非Watson-Crick碱基对包括但不限于G:U摇摆或Hoogstein碱基配对。
从其使用的语境可以理解,可以对于dsRNA的有义链与反义链之间或dsRNA剂的反义链与靶序列之间的碱基匹配使用本文的术语“互补的”、“完全互补的”和“基本上互补的”。可以理解,多种HBV基因型是已知的。因此,设计为与一种HBV基因型完全互补的dsRNA剂可能无法与所有HBV基因型完全互补。靶向特定位点的dsRNA剂有效在在多种基因型上敲减靶标而不在所有基因型上完全互补。
如本文所用,与信使RNA(mRNA)的“至少一部分基本上互补”的多核苷酸是指与目的mRNA(例如,编码HBV基因的mRNA)的连续部分基本上互补的多核苷酸。例如,如果其序列与编码HBV基因的mRNA的非中断部分基本上互补,则该多核苷酸与HBV mRNA的至少一部分互补。
因此,在一些实施方案中,本文公开的反义链多核苷酸与靶HBV序列完全互补。在一些其他实施方案中,本文公开的反义链多核苷酸与靶HBV序列基本上互补,并且包含在其全长上与SEQ ID NO:1或SEQ ID NO:1的片段的核苷酸序列的等同区域至少80%互补的连续核苷酸序列,例如至少80%、85%、90%或95%互补。
在一些实施方案中,本公开的dsRNA剂包括与反义多核苷酸基本上互补的有义链,所述反义多核苷酸又与靶HBV序列互补,且其中所述有义链多核苷酸包含在其全长上与SEQID NO:2的核苷酸序列的等同区域至少80%互补的连续核苷酸序列,例如至少85%、90%或95%互补。
在一些实施方案中,dsRNA剂包括与靶HBV序列基本上互补,并且包含在其全长上与表2中的任一有义核苷酸序列或表2中的任一有义核苷酸序列的片段的核苷酸序列的等同区域至少80%互补的连续核苷酸序列的反义链,例如至少85%、90%或95%互补。
如本文中详细描述的,每条链或两条链还包含一个或多个非核糖核苷酸,例如脱氧核糖核苷酸或修饰的核苷酸。另外,dsRNA剂可包括具有化学修饰的核糖核苷酸。这样的修饰可以包括本文公开的或本领域已知的所有类型的修饰。为了本说明书和权利要求的目的,如在dsRNA剂中使用的任何此类修饰可被“dsRNA剂”涵盖。
在一些实施方案中,每条链的大多数核苷酸是核糖核苷酸,但是如本文详细描述的,每条或两条链也可包含一个或多个非核糖核苷酸,例如脱氧核糖核苷酸或修饰的核苷酸。另外,dsRNA剂可包括具有化学修饰的核糖核苷酸。这样的修饰可以包括本文公开的或本领域已知的所有类型的修饰。为了本说明书和权利要求的目的,如在dsRNA剂中使用的任何此类修饰可被“dsRNA剂”和“dsRNA试剂”涵盖。
在受试者中的HBV基因表达或HBV蛋白产生水平或者疾病标志物或症状的情况中,术语“降低(lower)”是指此类水平的统计学显著的降低。降低可以是例如至少80%、85%、90%或95%,或低于检测方法的检测水平,或更朝向或达到正常水平(其可以为零或不为零)。在监测HBV感染时,通常使用log10标度(scale)来描述抗原血症水平(例如,血清中的HBsAg水平)或病毒血症水平(血清中的HBV DNA水平)。可以理解,1 log10的降低是90%的降低(剩余10%),2 log10的降低是99%的降低(剩余1%),等等。在某些实施方案中,疾病标志物降低到检测水平以下。在某些实施方案中,所述方法包括临床相关的HBV表达的抑制,例如,如由用减少HBV表达的药剂治疗受试者后的临床相关结果所证明的。在一些实施方案中,通过HBV mRNA量的减少来评估对HBV基因表达的至少部分抑制,所述HBV mRNA可从第一细胞或细胞组分离或在其中检测,所述第一细胞或细胞组中HBV基因被转录或者所述第一细胞或细胞组被处理以使得与基本上相同于第一细胞或细胞组但未经处理的第二细胞或细胞组(对照细胞)相比HBV基因的表达被抑制。
在某些实施方案中,“降低”或“减少”理解为使水平朝着正常水平降低或减少或者使水平降低或减少至正常水平,即使得水平正常化。在某些实施方案中,靶标的表达正常化至公认为没有该障碍的个体正常的范围内的水平,例如,疾病标志物如ALT或AST的水平。当疾病相关水平从正常水平升高时,从正常的上限(ULN)计算变化。当疾病相关水平从正常水平降低时,从正常的下限(LLN)计算变化。降低(lowering)是对象值和正常值之间变化的百分比差异。例如,正常AST水平可以报告为10-40单位/升。如果治疗前AST水平为200单位/升(即,ULN的5倍,高于正常上限160单位/升)的受试者在治疗后AST水平为120单位/升(即ULN的3倍,比正常上限高80单位/升),则升高的AST朝着正常降低50%(80/160)。
作为另一个实例,正常ALT水平通常被认为是7至55单位/升(U/L),得到正常上限水平55U/L。受试者的ALT水平在治疗前为100U/L(高于正常上限45U/L)和在治疗后为75U/L(降低25U/L),受试者的ALT朝着正常水平降低55%(25/45×100%)。如本文所用,如果疾病与用于症状的升高值相关,则“正常”被认为是正常的上限水平。如果疾病与用于症状的降低值相关,则“正常”被认为是正常的下限水平。
本文所用的短语“使细胞与dsRNA剂接触”,例如dsRNA,包括通过任何可能的方式接触细胞。使细胞与dsRNA剂接触包括使细胞与dsRNA剂体外接触或使细胞与dsRNA剂体内接触。接触可以直接或间接进行。因此,例如,可以由执行该方法的个体使dsRNA剂与细胞物理接触,或者,可以使dsRNA剂处于允许或引起其随后与细胞接触的情况中。
体外接触细胞可以例如通过将细胞与dsRNA剂一起温育来进行。体内接触细胞可以例如通过将dsRNA剂注射到细胞所在的组织中或其附近来进行,或者通过将dsRNA剂注射到另一个区域(例如血流或皮下空间)中以使得药剂随后到达其中待接触的细胞所在的组织来进行。例如,dsRNA剂可包含或偶联至配体,例如GalNAc
在一些实施方案中,使细胞与dsRNA剂接触包括通过促进或实现向细胞中的摄入或吸收来“引入”或“递送dsRNA剂至细胞中”。dsRNA剂的吸收或摄入可通过无辅助的扩散性或主动细胞过程,或通过辅助剂或装置发生。将dsRNA剂引入细胞中可以是体外或体内的。例如,对于体内引入,可以将dsRNA剂注射到组织部位中或全身施用。体外引入细胞中包括本领域已知的方法,例如电穿孔和脂质转染。进一步的方法在下文描述或在本领域中是已知的。
如本文所用,“受试者”是动物,例如哺乳动物,包括可以被HBV感染的任何哺乳动物,例如灵长类动物(例如人、非人类灵长动物,例如猴子或黑猩猩),或被认为是可接受的HBV感染临床模型的动物,HBV-AAV小鼠模型(参见,例如,Yang et al.(2014)Cell and MolImmunol11:71)或HBV 1.3xfs转基因小鼠模型(Guidotti et al.(1995)J.Virol.69:6158)。在一些实施方案中,受试者患有乙型肝炎病毒(HBV)感染。在一些实施方案中,受试者患有乙型肝炎病毒(HBV)感染和丁型肝炎病毒(HDV)感染。在一些实施方案中,受试者是人,例如正患HBV感染,特别是慢性乙型肝炎病毒(HBV)感染的人。
如本文所用,术语“治疗(treating)”或“处理(treatment)”是指有益或期望的结果,包括但不限于减轻或改善与不期望的HBV基因表达或HBV复制相关的一种或多种体征或症状,例如血清或肝脏HBV cccDNA的存在;血清HBV DNA的存在;血清或肝脏HBV抗原(例如HBsAg或HBeAg)的存在;ALT升高;AST升高(通常认为正常范围为约10-34U/L);抗-HBV抗体的缺乏或低水平,肝损伤;肝硬化;丁型肝炎,急性乙型肝炎;急性暴发性乙型肝炎;慢性乙型肝炎;肝纤维化;终末期肝病;肝细胞癌;血清病样综合征(serum sickness-likesyndrome);厌食症;恶心;呕吐,低烧;肌痛;易疲劳;失调的味觉灵敏度和嗅觉(厌恶食物和香烟);右上腹和上腹痛(间歇性,轻度至中度);肝性脑病;嗜睡;睡眠模式紊乱;精神错乱;昏迷;腹水;胃肠道出血;凝血病;黄疸;肝肿大(轻度肿大,肝软);脾肿大;手掌红斑;蜘蛛痣;肌肉萎缩;蜘蛛状血管瘤;血管炎;静脉破裂出血;外周性水肿;男性乳房发育;睾丸萎缩;腹部侧支静脉(海蛇头(caput medusa));ALT水平高于AST水平;γ-谷氨酰转肽酶(GGT)升高(正常范围通常被认为为约8-65U/L)和碱性磷酸酶(ALP)水平升高(正常范围通常被认为为约44-147IU/L(国际单位/升),不高于ULN的3倍);白蛋白水平略低;血清铁水平升高;白细胞减少(即,粒细胞减少);淋巴细胞增多;红细胞沉降率(ESR)升高;红血球存活期缩短;溶血;血小板减少;国际标准化比率(INR)延长;血清或肝脏HBsAg、HBeAg或乙型肝炎核心抗体(抗HBc)免疫球蛋白M(IgM)的存在;乙型肝炎表面抗体(抗HBs)、乙型肝炎e抗体(抗HBe)或HBV DNA的存在;胆红素水平升高;高球蛋白血症;组织非特异性抗体的存在,例如抗平滑肌抗体(ASMA)或抗核抗体(ANA)(10-20%);组织特异性抗体的存在,例如针对甲状腺的抗体(10-20%);类风湿因子(RF)水平升高;血小板和白细胞计数低;小叶的,具有退行性和再生性的肝细胞变化,并伴随炎症;以及主要中心小叶坏死,无论是可检测的还是不可检测的。例如,当具有一种或多种肝纤维化风险因子(例如慢性乙型肝炎感染)的个体无法发生肝纤维化或发生相对于具有相同的风险因子但没有接受本文所述的治疗的群体严重程度较低的肝纤维化时,发生肝纤维化的可能性降低。不发生疾病、障碍或病症,或与此类疾病、障碍或病症相关的体征或症状的发生减少(例如,临床上相关的量);或表现出延迟的体征或症状延迟(例如,延迟几天、几周、几个月或几年)被认为有效的预防。“治疗”还可意味着与没有治疗的情况下的预期生存相比生存期延长。预防可能需要施用多于一个剂量。
在优选的实施方案中,HBV感染的治疗导致乙型肝炎的“功能性治愈”。如本文所用,功能性治愈被理解为清除循环的HBsAg,且优选地伴随着转变成其中HBsAg抗体变得无法使用临床上相关的测定方法检测的状态。例如,如通过化学发光微粒免疫测定法(CMIA)或称为抗HB血清转化的任何其他免疫测定法所测量的,可检测的抗体可以包括高于10mIU/ml的信号。功能性治愈不需要清除所有复制形式的HBV(例如,来自肝脏的cccDNA)。每年约0.2-1%的慢性感染患者中自发发生抗HB血清转化。然而,即使在抗HB血清转化后,仍观察到HBV的低水平持续存在数十年,表明发生了功能性治愈而不是完全治愈。不受限于机制,提出免疫系统能够保持HBV受到控制。功能性治愈允许终止对HBV感染的任何治疗。然而,应理解,对HBV感染的“功能性治愈”可能不足以预防或治疗由HBV感染引起的疾病或病症,例如肝纤维化、HCC、肝硬化。
如本文所用,术语“乙型肝炎病毒相关疾病”或“HBV相关疾病”是由HBV感染或复制引起的或与之相关的疾病或障碍。术语“HBV相关疾病”包括从HBV基因表达或复制减少中受益的疾病、障碍或病症。HBV相关疾病的非限制性实例包括例如丁型肝炎病毒感染、丁型肝炎、急性乙型肝炎;急性暴发性乙型肝炎;慢性乙型肝炎;肝纤维化;终末期肝病;和肝细胞癌。
在一些实施方案中,HBV相关疾病是D型肝炎病毒感染。D型肝炎病毒或丁型肝炎病毒(HDV)是人类病原体。但是,该病毒是有缺陷的,并依赖于由乙型肝炎病毒(HBV)提供的专性辅助功能进行传播;实际上,HDV需要相关或预先存在的HBV感染以变得有传染性并活跃起来,特别是包含乙型肝炎表面抗原的病毒包膜。HDV可导致与HBV相关的严重的急性和慢性肝病形式。D型肝炎感染或丁型肝炎在几个非洲国家、亚马孙地区和中东非常流行,而在工业化国家(地中海除外)的流行率低。
HDV的传播既可以通过同时HBV感染(共感染)发生或叠加在慢性乙型肝炎或乙型肝炎携带者状态上(重复感染)。与单独HBV感染相比,与HDV的重复感染和共感染均导致更严重的并发症。这些并发症包括在急性感染中发生肝衰竭的更大可能性和迅速发展为肝硬化,以及在慢性感染中发生肝癌的机会增加。与乙型肝炎病毒组合,D型肝炎在所有肝炎感染中的死亡率最高,为20%。
在一些实施方案中,HBV相关疾病是急性乙型肝炎。急性乙型肝炎包括持续不到六个月的肝脏炎症。急性乙型肝炎的典型症状是疲劳、厌食、恶心和呕吐。经常观察到很高的转氨酶值(>1000U/L)和高胆红素血症。严重的急性乙型肝炎病例可能会迅速发展为急性肝衰竭,其以差的肝脏合成功能为标志。在没有先前肝病的情况下,这通常被定义为凝血酶原时间(PT)为16秒或国际标准化比率(INR)为1.5。急性乙型肝炎可演变成慢性乙型肝炎。
在一些实施方案中,HBV相关疾病是慢性肝炎。慢性乙型肝炎(CHB)包括持续超过六个月的肝脏炎症。患有CHB的受试者为HBsAg阳性的,且具有高病毒血症(≥10
在一些实施方案中,HBV相关疾病是急性暴发性乙型肝炎。患有急性暴发性乙型肝炎的受试者具有急性肝炎的症状以及另外的意识不清或昏迷(由于肝脏不能对化学物质进行解毒)以及瘀伤或出血(由于缺乏凝血因子)的症状。
患有HBV感染(例如CHB)的受试者可能发生肝纤维化。因此,在一些实施方案中,HBV相关疾病是肝纤维化。肝纤维化或肝硬化在组织学上定义为弥散性肝过程,其特征为纤维化(过多的纤维性结缔组织)以及正常肝脏结构转化为结构异常的结节。
患有HBV感染(例如CHB)的受试者可发生终末期肝病。因此,在一些实施方案中,HBV相关疾病是终末期肝病。例如,肝纤维化可能进展到其中身体可能因肝纤维化而不再能够补偿例如肝功能的降低(即,肝代偿失调),并导致例如精神和神经系统症状以及肝衰竭的程度。
患有HBV感染(例如CHB)的受试者可发生肝细胞癌(HCC),也称为恶性肝肿瘤。因此,在一些实施方案中,HBV相关疾病是HCC。HCC通常在患有CHB的受试者中发生,且可能是纤维板层的、假腺性(腺样)、多形性(巨细胞)或透明细胞。
“HDV相关障碍”或“D型肝炎病毒相关障碍”是与HDV表达相关的疾病或障碍。示例性的HDV相关障碍包括乙型肝炎病毒感染、急性乙型肝炎、急性丁型肝炎;急性暴发性丁型肝炎;慢性丁型肝炎;肝纤维化,终末期肝病;和肝细胞癌。
本文所用的“治疗有效量”旨在包括当向患者施用用于治疗患有HBV感染或HBV相关疾病的患者时足以有效治疗该疾病(例如,通过减少或维持现有疾病或疾病的一种或多种症状)的dsRNA剂的量。“治疗有效量”可根据dsRNA剂、该药剂如何施用、疾病及其严重程度以及病史、年龄、体重、家族史、遗传构成、由HBV基因表达介导的病理过程的阶段、先前或伴随治疗的类型(如果有的话)以及要治疗的患者的其他个体特征而变化。治疗有效量可能需要施用多于一个剂量。
“治疗有效量”还包括以适用于任何治疗的合理利益/风险比产生某些期望效果的dsRNA剂的量。可以以足以产生适用于这种治疗的合理利益/风险比的量施用本公开方法中使用的dsRNA剂。
如本文所用,术语“样品”包括从受试者分离的相似流体、细胞或组织,以及存在于受试者体内的流体、细胞或组织的集合。生物流体的实例包括血液、血清和浆膜液、血浆、淋巴、尿液、唾液等。组织样品可以包括来自组织、器官或局部区域的样品。例如,样品可以源自特定的器官、器官的部分或者那些器官内的流体或细胞。在某些实施方案中,样品可以源自肝脏(例如全肝或肝脏的某些区段或肝脏中某些类型的细胞,例如肝细胞)。在优选的实施方案中,“源自受试者的样品”是指从受试者抽取的血液,或者从血液获得的血浆或血清。在进一步的实施方案中,“源自受试者的样品”是指源自受试者的肝组织(或其子组分)或血液组织(或其子组分,例如血清)。
II.
本公开提供了抑制一种或多种HBV基因的表达的dsRNA剂。在一些实施方案中,dsRNA剂包括双链核糖核酸(dsRNA)分子,其用于抑制细胞(例如受试者(例如哺乳动物,如患有HBV相关疾病,例如慢性乙型肝炎的人)体内的细胞)中HBV基因的表达。dsRNA剂包括具有互补性区域的反义链,所述互补性区域与在HBV基因表达中形成的mRNA的至少一部分互补。互补性区域的长度约为19-21个核苷酸。当与表达HBV基因的细胞接触时,dsRNA剂抑制HBV基因的表达至少80%,如通过例如PCR或基于分支DNA(bDNA)的方法或通过基于蛋白质的方法(例如通过免疫荧光分析),使用例如蛋白质印迹或流式细胞术技术测定的。在优选的实施方案中,使用实施例2中提供的实时PCR方法,使用其中提供的细胞系以dsRNA剂(在转染中以10nM浓度使用)来确定抑制百分比。
dsRNA包含两条互补的且在dsRNA使用的条件下杂交以形成双链体结构的RNA链。dsRNA的一条链(反义链)包含互补性区域,该区域与靶序列基本互补且通常完全互补。但是,由于HBV基因型之间的序列变异,dsRNA可能与某些但不是全部HBV基因型完全互补。靶序列可以源自在HBV基因表达期间形成的mRNA的序列。另一条链(有义链)包括与反义链互补的区域,使得当在合适条件下组合时两条链杂交并形成双链体结构。如本文其他地方所描述的和本领域已知的,与在单独的寡核苷酸上相反,dsRNA的互补序列也可以作为单个核酸分子的自身互补区域而被包含。
通常,双链体结构的长度为19-21个碱基对,例如长度为19、20或21个碱基对。
类似地,与靶序列的互补性区域的长度是19-23个核苷酸,例如长度为19-23、19-22、19-21、19-20、20-23、20-22、20-21、21-22、19、20、21、22或23个核苷酸。在一些实施方案中,互补性区域的长度为21个核苷酸。普通技术人员还将认识到,被靶向切割的RNA区域最通常是较大RNA分子(通常mRNA分子)的部分。在相关的情况下,mRNA靶的“部分”是具有足够长度的mRNA靶的连续序列,从而使得其能够作为RNAi指导切割的底物(即,通过RISC途径的切割)。
本领域技术人员还将认识到,双链体区域是dsRNA的主要功能部分,例如约19-21个碱基对的双链体区域,例如19-21、19-20、20-21、19、20或21个碱基对。在一些实施方案中,双链体区域是19个碱基对。
本文所述的dsRNA可进一步包含一个或多个单链核苷酸突出端,例如1或2个核苷酸。核苷酸突出端可以包含或由核苷酸/核苷类似物组成,包括脱氧核苷酸/核苷。突出端可以在有义链、反义链或其任意组合上。此外,突出端的核苷酸可以存在于dsRNA的反义链或有义链或两者的5′端、3′端或两端。在一些实施方案中,dsRNA在反义链的3′端上包含2-核苷酸的突出端。
dsRNA可以如下文进一步讨论的通过本领域已知的标准方法合成,例如,通过使用自动DNA合成仪,如可从例如Biosearch,Applied Biosystems
本公开的dsRNA剂化合物可以使用两步过程来制备。首先,分别制备双链RNA分子的单个链。然后,将成分链(component strand)退火。dsRNA剂化合物的单个链可以使用溶液相或固相有机合成或两者来制备。有机合成的优点是可以容易地制备包含非天然或修饰的核苷酸的寡核苷酸链。可以使用溶液相或固相有机合成或两者来制备本公开的单链寡核苷酸。
在一些实施方案中,本公开的dsRNA剂包括至少两个核苷酸序列,有义链序列和反义链序列。有义链可包含选自表2中任一双链体的任一有义链核苷酸序列的核苷酸序列。反义链可包含选自表2中任一双链体的任一反义链核苷酸序列的核苷酸序列。在一些实施方案中,dsRNA剂不是AD-66810。
在一些实施方案中,本公开的dsRNA剂包含如表2所示的有义链和反义链、基本上由其组成或由其组成。
III.
在某些实施方案中,本公开的dsRNA剂的RNA是未修饰的,且不包含例如本领域已知和本文所描述的化学修饰或缀合。在其他实施方案中,本公开的dsRNA剂的RNA被化学修饰以增强稳定性或其他有益特性。在本公开的一些实施方案中,本公开的dsRNA剂的基本上所有核苷酸被修饰。在本公开的一些实施方案中,dsRNA剂的所有核苷酸或dsRNA剂的基本上所有核苷酸被修饰,即,不超过5、4、3、2或1个未修饰的核苷酸存在于dsRNA剂的链中。
本公开中表征的核酸可以通过本领域中良好确立的方法来合成或修饰,例如,在“Current protocols in nucleic acid chemistry,”Beaucage,S.L.et al.(Edrs.),JohnWiley&Sons,Inc.,New York,NY,USA中记载的那些方法,它们在此通过引用并入本文。修饰包括例如末端修饰,例如5′-端修饰(磷酸化、缀合、反向连接)或3′-端修饰(缀合、DNA核苷酸、反向连接等);碱基修饰,例如用稳定化碱基、去稳定碱基或与扩展的伴体库碱基配对的碱基进行置换,去除碱基(无碱基核苷酸)或缀合的碱基;糖修饰(例如在2′-位或4′-位)或糖的置换;或主链修饰,包括磷酸二酯键的修饰或置换。在本文所述的实施方案中可用的dsRNA剂化合物的具体实例包括但不限于含有修饰的主链或不包含天然核苷间连接的RNA。具有修饰的主链的RNA尤其包括那些在主链中没有磷原子的RNA。为了本说明书的目的,并且如本领域有时提及的,在核苷间主链中不具有磷原子的修饰RNA也可以被认为是寡核苷。在一些实施方案中,修饰的dsRNA剂在其核苷间主链中具有磷原子。
修饰的RNA主链包括,例如,硫代磷酸酯、手性硫代磷酸酯、二硫代磷酸酯、磷酸三酯、氨基烷基磷酸三酯、甲基膦酸酯和其他烷基膦酸酯包括3′-亚烷基膦酸酯和手性膦酸酯、次膦酸酯、氨基磷酸酯包括3′-氨基磷酸酯和氨基烷基磷酸酯、硫羰基氨基磷酸酯(thionophosphoramidate)、硫羰基烷基膦酸酯、硫羰基烷基磷酸三酯以及硼烷磷酸酯,其具有正常的3′-5′键、这些酯的2′-5′连接的类似物和具有反转极性的那些,其中相邻的核苷单元对是3′-5′至5′-3′连接的或2′-5′至5′-2′连接的。还包括各种盐、混合盐和游离酸形式。
教导了上述含磷连接的制备的代表性美国专利包括但不限于美国专利No.3,687,808;4,469,863;4,476,301;5,023,243;5,177,195;5,188,897;5,264,423;5,276,019;5,278,302;5,286,717;5,321,131;5,399,676;5,405,939;5,453,496;5,455,233;5,466,677;5,476,925;5,519,126;5,536,821;5,541,316;5,550,111;5,563,253;5,571,799;5,587,361;5,625,050;6,028,188;6,124,445;6,160,109;6,169,170;6,172,209;6,239,265;6,277,603;6,326,199;6,346,614;6,444,423;6,531,590;6,534,639;6,608,035;6,683,167;6,858,715;6,867,294;6,878,805;7,015,315;7,041,816;7,273,933;7,321,029;和美国专利RE39464,各自在此通过引用并入本文以提供与此类制备方法相关的教导。
其中不包含磷原子的修饰的RNA主链具有通过短链烷基或环烷基核苷间连接、混合杂原子和烷基或环烷基核苷间连接或一个或多个短链杂原子或杂环核苷间连接形成的主链。这些包括具有吗啉连接(部分由核苷的糖部分形成);硅氧烷骨架;硫化物、亚砜和砜主链;甲乙酰基和硫代甲乙酰基主链;亚甲基甲乙酰基和硫代甲乙酰基主链;含烯烃主链;氨基磺酸酯主链;亚甲基亚氨基和亚甲基肼基主链;磺酸酯和磺酰胺主链;酰胺主链;以及具有混合的N、O、S和CH
教导上述寡核苷酸的制备的代表性美国专利包括但不限于美国专利No.5,034,506;5,166,315;5,185,444;5,214,134;5,216,141;5,235,033;5,64,562;5,264,564;5,405,938;5,434,257;5,466,677;5,470,967;5,489,677;5,541,307;5,561,225;5,596,086;5,602,240;5,608,046;5,610,289;5,618,704;5,623,070;5,663,312;5,633,360;5,677,437;和5,677,439,各自在此通过引用以提供与此类方法相关的教导。
设想将合适的RNA模拟物用于本文提供的dsRNA剂中,其中核苷酸单元的糖和核苷间连接,即主链,被新的基团替代。维持碱基单元以与适当的核酸靶化合物杂交。一种这样的寡聚化合物被称为肽核酸(PNA),其中RNA模拟物已显示具有良好的杂交特性。在PNA化合物中,RNA的糖主链被含有酰胺的主链,特别是氨基乙基甘氨酸主链代替。核碱基被保留并直接或间接结合于主链的酰胺部分的氮杂氮原子上。教导PNA化合物的制备的代表性美国专利包括但不限于美国专利No.5,539,082;5,714,331;和5,719,262,各自在此通过引用并入本文以提供与此类方法相关的教导。适用于本公开的dsRNA剂的其他PNA化合物描述于例如Nielsen et al.,Science,1991,254,1497-1500中。
本公开中表征的一些实施方案包括具有硫代磷酸酯主链的RNA和具有杂原子主链的寡核苷,尤其是上文提及的美国专利No.5,489,677中的--CH
修饰的RNA还可以包含一个或多个取代的糖部分。本文表征的dsRNA剂可在2′-位置包括以下之一:OH;F;O-、S-或N-烷基;O-、S-或N-烯基;O-、S-或N-炔基;或O-烷基-O-烷基,其中所述烷基、烯基和炔基可以是取代或未取代的C
其他修饰包括2′-甲氧基(2′-OCH
dsRNA剂还可以包括核碱基(在本领域中通常简称为“碱基”)修饰或替换。如本文所用,“未修饰的”或“天然的”核碱基包括嘌呤碱基腺嘌呤(A)和鸟嘌呤(G),以及嘧啶碱基胸腺嘧啶(T),胞嘧啶(C)和尿嘧啶(U)。修饰的核碱基包括其他合成和天然的核碱基,例如脱氧胸腺嘧啶(dT),5-甲基胞嘧啶(5-me-C),5-羟甲基胞嘧啶,黄嘌呤,次黄嘌呤,2-氨基腺嘌呤,腺嘌呤和鸟嘌呤的6-甲基和其他烷基衍生物,腺嘌呤和鸟嘌呤的2-丙基和其他烷基衍生物,2-硫尿嘧啶,2-硫胸腺嘧啶和2-硫胞嘧啶,5-卤代尿嘧啶和胞嘧啶,5-丙炔尿嘧啶和胞嘧啶,6-偶氮尿嘧啶、胞嘧啶和胸腺嘧啶,5-尿嘧啶(伪尿嘧啶),4-硫尿嘧啶,8-卤代、8-氨基、8-巯基、8-硫代烷基、8-羟基以及其他8-取代的腺嘌呤和鸟嘌呤,5-卤代,特别是5-溴代、5-三氟甲基以及其他5-取代的尿嘧啶和胞嘧啶,7-甲基鸟嘌呤和7-甲基腺嘌呤,8-氮杂鸟嘌呤和8-氮杂腺嘌呤,7-脱氮鸟嘌呤和7-脱氮腺嘌呤以及3-脱氮鸟嘌呤和3-脱氮腺嘌呤。其他核碱基包括在美国专利No.3,687,808中公开的那些,在Modified Nucleosides inBiochemistry,Biotechnology and Medicine,Herdewijn,P.ed.Wiley-VCH,2008中公开的那些;在The Concise Encyclopedia Of Polymer Science And Engineering,858-859页,Kroschwitz,J.L,ed.John Wiley&Sons,1990中公开的那些,由Englisch et al.,Angewandte Chemie,International Edition,1991,30,613公开的那些,以及由Sanghvi,YS.,Chapter 15,dsRNA Research and Applications,289-302页,Crooke,S.T.和Lebleu,B.,Ed.,CRC Press,1993公开的那些。这些核碱基中的某些对于增加本公开表征的寡聚化合物的结合亲和力特别有用。这些核碱基包括5-取代的嘧啶,6-氮杂嘧啶和N-2、N-6和O-6取代的嘌呤,包括2-氨基丙基腺嘌呤、5-丙炔基尿嘧啶和5-丙炔基胞嘧啶。已证明5-甲基胞嘧啶取代将核酸双链体稳定性提高0.6-1.2℃(Sanghvi,Y.S.,Crooke,S.T.和Lebleu,B.,Eds.,dsRNA Research and Applications,CRC Press,Boca Raton,1993,pp.276-278)且是示例性的碱基取代,甚至当其与2′-O-甲氧基乙基糖修饰组合时尤其如此。
教导某些上述修饰的核碱基以及其他修饰的核碱基的制备的代表性美国专利包括但不限于上述美国专利No.3,687,808,4,845,205;5,130,30;5,134,066;5,175,273;5,367,066;5,432,272;5,457,187;5,459,255;5,484,908;5,502,177;5,525,711;5,552,540;5,587,469;5,594,121,5,596,091;5,614,617;5,681,941;5,750,692;6,015,886;6,147,200;6,166,197;6,222,025;6,235,887;6,380,368;6,528,640;6,639,062;6,617,438;7,045,610;7,427,672;和7,495,088,它们各自在此通过引用并入本文以提供与此类方法相关的教导。
在一些实施方案中,还可将dsRNA剂的RNA修饰为包括一个或多个双环糖部分。“双环糖”是通过两个原子的桥接修饰的呋喃糖基环。“双环核苷”(“BNA”)是具有包含连接糖环的两个碳原子的桥从而形成双环系统的糖部分的核苷。在某些实施方案中,桥连接糖环的4′-碳和2′-碳。因此,在一些实施方案中,本公开的剂可包括一个或多个锁核酸(LNA)。锁核酸是具有修饰的核糖部分的核苷酸,其中核糖部分包含连接2′和4′碳的额外桥。换句话说,LNA是包含双环糖部分的核苷酸,该双环糖部分包含4′-CH
教导锁核酸核苷酸的制备的其他代表性美国专利和美国专利公开包括但不限于以下:美国专利No.6,268,490;6,525,191;6,670,461;6,770,748;6,794,499;6,998,484;7,053,207;7,034,133;7,084,125;7,399,845;7,427,672;7,569,686;7,741,457;8,022,193;8,030,467;8,278,425;8,278,426;8,278,283;US 2008/0039618;和US 2009/0012281,它们在此通过引用并入本文以提供与此类方法相关的教导。
可以制备具有一种或多种立体化学糖构型的任何前述双环核苷,包括例如α-L-呋喃核糖和β-D-呋喃核糖(参见WO99/14226)。
dsRNA剂的RNA也可以被修饰为包括一个或多个约束乙基核苷酸。如本文所用,“约束乙基核苷酸”或“cEt”是包含双环糖部分的锁核酸,所述双环糖部分包含4′-CH(CH
本公开的dsRNA剂还可包含一个或多个“构象受限核苷酸”(“CRN”)。CRN是核苷酸类似物,其具有连接核糖的C2′和C4′碳或核糖的C3和C5′碳的接头。CRN将核糖环锁定为稳定的构象,并增加对mRNA的杂交亲和力。接头的长度足以将氧放置在对稳定性和亲和力最佳的位置,从而导致较少的核糖环折皱(puckering)。
教导某些上述CRN的制备的代表性公开出版物包括但不限于美国专利公开No.2013/0190383;和PCT公开WO2013/036868,它们在此通过引用并入本文以提供与此类方法有关的教导。
在一些实施方案中,本发明的dsRNA剂包含一个或多个为UNA(非锁核酸)核苷酸的单体。UNA是未锁定的无环核酸,其中糖的任何键被去除,从而形成未锁定的“糖”残基。在一个实例中,UNA还包括C1′-C4′间的键(即,C1′和C4′碳之间的共价碳-氧-碳键)被除去的单体。在另一个实例中,糖的C2′-C3′键(即C2′和C3′碳之间的共价碳-碳键)被去除(参见Nuc.Acids Symp.Series,52,133-134(2008)和Fluiter et al.,Mol.Biosyst.,2009,10,1039,它们在此通过引用并入以提供与非锁定核酸核苷酸有关的教导)。
教导UNA制备的代表性美国公开出版物包括但不限于美国专利No.8,314,227;和美国专利公开No.2013/0096289;2013/0011922;和201I/0313020,它们在此通过引用并入本文以提供与此类方法有关的教导。
对RNA分子末端的潜在稳定化修饰可包括N-(乙酰氨基己酰基)-4-羟基脯氨醇(Hyp-C6-NHAc)、N-(己酰基-4-羟基脯氨醇)(Hyp-C6)、N-(乙酰基-4-羟基脯氨醇)(Hyp-NHAc)、胸苷2′-O-脱氧胸苷(醚)、N-(氨基己酰基)-4-羟基脯氨醇(Hyp-C6-氨基)、2-二十二碳酰基-尿苷-3′-磷酸、反向碱基dT(idT)及其它。该修饰的公开内容可在PCT公开No.WO2011/005861中找到。
在某些实施方案中,dsRNA剂修饰为包括一个或多个腺苷-二醇核酸(“GNA”)。术语“GNA”是指二醇核酸,它是一种类似于DNA或RNA的聚合物,但其“骨架”的组成与DNA或RNA的不同之处在于它由通过磷酸二酯键连接的重复甘油单元组成:
本文所公开的dsRNA剂的核苷酸的其他修饰包括5′磷酸酯或5′磷酸酯模拟物,例如在dsRNA剂的反义链上的5′-末端磷酸酯或磷酸酯模拟物。合适的磷酸酯模拟物在例如美国专利公开No.2012/0157511中公开,在此通过将其与此类修饰相关的教导并入本文中。
例如,在WO2016/077321中提供了另外的靶向HBV的修饰的dsRNA剂,其通过引用并入本文以提供与修饰有关的教导。
在一些实施方案中,dsRNA剂包含如表2所示的修饰的有义链和修饰的反义链、基本上由其组成或由其组成。
IV.
本公开的dsRNA剂可以与配体缀合。配体可以改变其所并入的dsRNA剂的分布、靶向或寿命。在优选的实施方案中,例如,与缺少配体的种类相比,这种配体提供对选定的靶标(例如分子、细胞或细胞类型、隔室例如细胞或器官隔室、组织、身体的器官或区域)的增强的亲和力。优选的配体将不参与双链化核酸中的双链体配对。
本公开的配体缀合的寡核苷酸可通过使用具有侧基反应性官能团的寡核苷酸来合成,例如衍生自连接分子附接在寡核苷酸上(在下文中描述)。该反应性寡核苷酸可直接与市售的配体、合成的带有多种保护基团中的任一种的配体或具有连接于其上的连接部分的配体直接反应。
在本公开的配体-缀合的寡核苷酸和配体-携带序列特异性连接核苷的分子中,可以利用标准核苷酸或核苷前体,或已经带有连接部分的核苷酸或核苷缀合物前体、已经带有配体分子的配体-核苷酸或核苷-缀合物前体或带有非核苷配体的结构块在合适的DNA合成仪上组装所述寡核苷酸和寡核苷。
当使用已经带有连接部分的核苷酸-缀合物前体时,通常完成序列特异性连接的核苷的合成,和然后使配体分子与连接部分反应以形成配体-缀合的寡核苷酸。在一些实施方案中,除了可商购的和在寡核苷酸合成中常规使用的标准亚磷酰胺和非标准亚磷酰胺以外,还使用衍生自配体-核苷缀合物的亚磷酰胺由自动合成仪合成本公开的寡核苷酸或连接的核苷。
教导RNA缀合物的制备的代表性美国专利包括但不限于美国专利No.4,828,979;4,948,882;5,218,105;5,525,465;5,541,313;5,545,730;5,552,538;5,578,717,5,580,731;5,591,584;5,109,124;5,118,802;5,138,045;5,414,077;5,486,603;5,512,439;5,578,718;5,608,046;4,587,044;4,605,735;4,667,025;4,762,779;4,789,737;4,824,941;4,835,263;4,876,335;4,904,582;4,958,013;5,082,830;5,112,963;5,214,136;5,082,830;5,112,963;5,214,136;5,245,022;5,254,469;5,258,506;5,262,536;5,272,250;5,292,873;5,317,098;5,371,241,5,391,723;5,416,203,5,451,463;5,510,475;5,512,667;5,514,785;5,565,552;5,567,810;5,574,142;5,585,481;5,587,371;5,595,726;5,597,696;5,599,923;5,599,928和5,688,941;6,294,664;6,320,017;6,576,752;6,783,931;6,900,297;7,037,646;8,106,022,在此通过将它们与此类制备方法相关的教导并入本文中。
A.
在本文公开的组合物和方法的优选实施方案中,dsRNA剂寡核苷酸进一步包含碳水化合物。如本文所述,碳水化合物缀合的dsRNA剂有利于核酸以及适合于体内治疗用途的组合物的体内递送。如本文所用,“碳水化合物”是指本身由一个或多个具有至少6个碳原子(其可以是直链的、支链的或环状的)及与各个碳原子键合的氧、氮或硫原子的单糖单元组成的碳水化合物,或者以由一个或多个单糖单元组成的碳水化合物部分作为其一部分的化合物,每个单糖单元具有至少6个碳原子(其可以是直链的、支链的或环状的)及与各个碳原子键合的氧、氮或硫原子。代表性的碳水化合物包括糖类(单糖、二糖、三糖和含有约4、5、6、7、8或9个单糖单元的寡糖)和多糖,如淀粉、糖原、纤维素和多糖胶。具体的单糖包括C5及以上(例如C5、C6、C7或C8)糖;二糖和三糖包括具有两个或三个单糖单元(例如C5、C6、C7或C8)的糖。
在一些实施方案中,用于本公开的组合物和方法中的碳水化合物缀合物是单糖。在一些实施方案中,用于本公开的组合物和方法中的碳水化合物缀合物选自:
在一些实施方案中,单糖是N-乙酰半乳糖胺(GalNAc)。在一些实施方案中,碳水化合物包含多个N-乙酰半乳糖胺单元,例如
可用于本文所述的实施方案中的另一种代表性的碳水化合物缀合物包括但不限于,
其中当X或Y之一是寡核苷酸时,另一个是氢。
在本公开的一些实施方案中,GalNAc或GalNAc衍生物经由单价接头连接至本公开的dsRNA剂。在一些实施方案中,GalNAc或GalNAc衍生物通过二价接头连接至本公开的dsRNA剂。在本公开的一些实施方案中,GalNAc或GalNAc衍生物通过三价接头连接至本公开的dsRNA剂。在一些实施方案中,碳水化合物配体包含经由三价接头连接的三个N-乙酰半乳糖胺单元(“GalNAc
在一些实施方案中,双链dsRNA剂包含连接至dsRNA剂的一个GalNAc或GalNAc衍生物。在一些实施方案中,双链dsRNA剂包含多个(例如2、3、4、5或6个)GalNAc或GalNAc衍生物,其每一个通过多个单价接头独立地连接至双链dsRNA剂的多个核苷酸。
适用于本公开的另外的碳水化合物缀合物包括在PCT公开No.WO2014/179620和WO2014/179627中描述的那些,它们在此通过引用以提供与此类缀合物相关的教导。
可用于本文公开的组合物和方法中的具有接头的dsRNA剂碳水化合物缀合物的非限制性实例包括但不限于,
其中当X或Y之一是寡核苷酸时,另一个是氢。
在本文公开的组合物和方法的一些实施方案中,配体是通过二价或三价分支接头连接的一个或多个“GalNAc”(N-乙酰半乳糖胺)衍生物。
在一些实施方案中,本文公开的dsRNA剂与选自式(XXXI)-(XXXIV)中任何一个所示的结构的二价或三价分支接头缀合:
其中:
q2A、q2B、q3A、q3B、q4A、q4B、q5A、q5B和q5C每次出现时独立地0-20、其中重复单元可以相同或不同;
P
Q
R
L
其中L
合适的二价和三价分支接头基团缀合GalNAc衍生物的实例包括但不限于以上作为式I、VI、X、IX和XII所述的结构。
B.
在一些实施方案中,本文所述的缀合物或配体可以通过可切割或不可切割的各种接头连接至dsRNA剂寡核苷酸。
术语“接头”或“连接基团”是指连接化合物的两个部分,例如共价附接化合物的两个部分的有机部分。接头通常包含直接键(direct bond)或原子如氧或硫,单元如NR8、C(O)、C(O)NH、SO、SO
可切割的连接基团是在细胞外足够稳定,但是在进入靶细胞后被切割以释放由该接头保持在一起的两个部分的连接基团。在一些实施方案中,可切割的连接基团在靶细胞中或在第一参考条件下以比在受试者的血液中或在第二参考条件下(其可以例如被选择为模拟或代表血液或血清中存在的条件)快约10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍或更多倍或至少约100倍切割。
可切割的连接基团易于受到切割剂(cleavage agent)的影响,例如pH、氧化还原电势或降解性分子的存在。通常,切割剂在细胞内比在血清或血液中更普遍或以更高的水平或活性存在。此类降解剂的实例包括:氧化还原剂,其针对特定底物选择或没有底物特异性,包括例如细胞中存在的氧化或还原酶或还原剂,例如硫醇,其可通过还原降解氧化还原可切割连接基团;酯酶;可产生酸性环境的内体或试剂,例如导致5或更低的pH值的那些;可以通过充当广义酸来水解或降解酸可切割的连接基团的酶、肽酶(其可以是底物特异性的)和磷酸酶。
可切割的连接基团,例如二硫键可对pH敏感。人血清的pH值为7.4,而平均细胞内pH值略低一些,约为7.1-7.3。内体的酸性更高,pH范围为5.5-6.0,而溶酶体的酸性pH甚至更高,约为5.0。一些接头具有在优选的pH下被切割的可切割的连接基团,从而将阳离子脂质在细胞内从配体或释放到所需的细胞区室内。
接头可包括可被特定酶切割的可切割的连接基团。并入接头中的可切割的连接基团的类型可以取决于要靶向的细胞。例如,肝靶向的配体可以通过包括酯基的接头与阳离子脂质连接。肝细胞富含酯酶,因此与不富含酯酶的细胞类型相比,该接头在肝细胞中被更高效地切割。富含酯酶的其他细胞类型包括肺、肾皮质和睾丸的细胞。
当靶向富含肽酶的细胞类型(例如肝细胞和滑膜细胞)时,可以使用包含肽键的接头。
通常,可通过测试降解剂(或条件)切割候选连接基团的能力来评估候选可切割连接基团的适用性。还希望的是也测试候选可切割连接基团在血液中或与其他非靶组织接触时抗切割的能力。因此,可以测定在第一条件和第二条件之间的相对切割易感性,其中第一条件选择为指示靶细胞中的切割,且第二条件选择为指示其他组织或生物流体(例如,血液或血清)中的切割。可以在无细胞系统中、细胞中、细胞培养物中、器官或组织培养物中或整体动物中进行评估。在无细胞或培养条件下进行初步评估且通过在整体动物中的进一步评估进行确认可能是有用的。在优选的实施方案中,可用的候选化合物在细胞中(或在被选择为模拟细胞内条件的体外条件下)与血清或血液(或在被选择为模拟细胞外条件的体外条件下)切割速度块至少约2、4、10、20、30、40、50、60、70、80、90或100倍。
i.
在一些实施方案中,可切割的连接基团是在还原或氧化时切割的氧化还原可切割连接基团。还原可切割的连接基团的实例是二硫键连接基团(-S-S-)。为了确定候选可切割连接基团是否为合适的“还原可切割连接基团”,或例如是否适合与特定的dsRNA剂部分和特定的靶向剂一起使用,可以参考本文所述的方法。例如,候选者可以通过使用本领域已知的试剂与二硫苏糖醇(DTT)或其他还原剂一起温育来评估,其模拟在细胞(例如靶细胞)中观察到的切割速率。还可以在被选择为模拟血液或血清条件的条件下评估候选者。在一些实施方案中,候选化合物在血液中被切割至多约10%。在一些实施方案中,可用的候选化合物在细胞中(或在被选择为模拟细胞内条件的体外条件下)与血液(或在被选择为模拟细胞外条件的体外条件下)相比降解速度快至少约2、4、10、20、30、40、50、60、70、80、90或约100倍。可以在被选择为模拟细胞内介质的条件下使用标准的酶动力学测定法确定候选化合物的切割速度,并与被选择为模拟细胞外介质的条件进行比较。
ii.
在一些实施方案中,可切割的接头包含基于磷酸酯的可切割连接基团。基于磷酸酯的可切割连接基团被降解或水解磷酸酯基团的试剂切割。在细胞中切割磷酸酯基团的试剂的实例是酶,例如细胞中的磷酸酶。基于磷酸酯的连接基团的实例是-O-P(O)(ORk)-O-、-O-P(S)(ORk)-O-、-O-P(S)(SRk)-O-、-S-P(O)(ORk)-O-、-O-P(O)(ORk)-S-、-S-P(O)(ORk)-S-、-O-P(S)(ORk)-S-、-S-P(S)(ORk)-O-、-O-P(O)(Rk)-O-、-O-P(S)(Rk)-O-、-S-P(O)(Rk)-O-、-S-P(S)(Rk)-O-、-S-P(O)(Rk)-S-、-O-P(S)(Rk)-S-。在一些实施方案中,基于磷酸酯的连接基团的实例是-O-P(O)(OH)-O-、-O-P(S)(OH)-O-、-O-P(S)(SH)-O-、-S-P(O)(OH)-O-、-O-P(O)(OH)-S-、-S-P(O)(OH)-S-、-O-P(S)(OH)-S-、-S-P(S)(OH)-O-、-O-P(O)(H)-O-、-O-P(S)(H)-O-、-S-P(O)(H)-O、-S-P(S)(H)-O-、-S-P(O)(H)-S-或-O-P(S)(H)-S-。在一些实施方案中,基于磷酸酯的连接基团是-O-P(O)(OH)-O-。可以使用与以上所述类似的方法评估这些候选者。
iii.
在一些实施方案中,可切割的连接基包含酸可切割连接基团。酸可切割连接基团是在酸性条件下切割的连接基团。在一些实施方案中,酸可切割连接基团在约6.5或更低(例如,约6.0、5.75、5.5、5.25、5.0或更低)的pH的酸性环境中切割,或被诸如可起到广义酸作用的酶的试剂切割。在细胞中,特定的低pH细胞器(例如内体和溶酶体)可以为酸可切割的连接基团提供切割环境。酸可切割连接基团的实例包括但不限于腙、酯和氨基酸的酯。酸可切割基团可具有通式-C=NN-、C(O)O或-OC(O)。在一些实施方案中,连接至酯的氧(烷氧基)的碳是芳基、取代的烷基或叔烷基,例如二甲基戊基或叔丁基。可以使用与以上所述类似的方法评估这些候选者。
iv.
在一些实施方案中,可切割的接头包含基于酯的可切割连接基团。基于酯的可切割连接基团在细胞中被诸如酯酶和酰胺酶的酶切割。基于酯的可切割连接基团的实例包括但不限于亚烷基、亚烯基和亚炔基的酯。酯可切割连接基团具有通式-C(O)O-或-OC(O)-。可以使用与以上所述类似的方法评估这些候选者。
v.
在一些实施方案中,可切割的接头包含基于肽的可切割连接基团。基于肽的可切割连接基团在细胞中被诸如肽酶和蛋白酶的酶切割。基于肽的可切割连接基团是在氨基酸之间形成以产生寡肽(例如二肽、三肽等)和多肽的肽键。基于肽的可切割基团不包括酰胺基团(-C(O)NH-)。酰胺基可以在任何亚烷基、亚烯基或亚炔基之间形成。肽键是在氨基酸之间形成以产生肽和蛋白质的特定类型的酰胺键。基于肽的切割基团通常限于在产生肽和蛋白质的氨基酸之间形成的肽键(即,酰胺键),并且不包括整个酰胺官能团。基于肽的可切割连接基团的通式为-NHCHRAC(O)NHCHRBC(O)-,其中RA和RB是两个相邻氨基酸的R基团。可以使用与以上所述类似的方法评估这些候选者。
V.
可以以多种不同方式将本公开的dsRNA剂递送至细胞,例如受试者如人类受试者体内的细胞。例如,可以通过使细胞与本公开的dsRNA剂在体外或体内接触来进行递送。体内递送也可以直接通过将包含dsRNA剂的组合物施用于受试者来进行。或者,可间接地通过施用一种或多种编码并指导dsRNA剂表达的载体来进行体内递送。这些替代方式将在下文中进一步讨论。
通常,任何递送核酸分子(体外或体内)的方法都可以适应于与本公开的dsRNA剂一起使用(参见,Akhtar S.和Julian RL.(1992)Trends Cell.Biol.2(5):139-144和WO94/02595,它们通过引用并入本文以提供与此类递送方法有关的教导)。对于体内递送,为了递送dsRNA剂分子而要考虑的因素包括例如所递送的分子的生物学稳定性、防止非特异性作用以及所递送的分子在靶组织中的累积。
为了全身性地施用dsRNA剂以治疗疾病,可以修饰RNA或者可选地使用药物递送系统来递送RNA;两种方法起着防止核酸内切酶和核酸外切酶在体内快速降解dsRNA的作用。RNA的修饰或药物载体或药物赋形剂还可以允许使dsRNA剂组合物靶向靶组织,并避免不良的脱靶效应。dsRNA剂分子可以通过化学缀合来修饰,例如如上所述的碳水化合物缀合物。
VI.
本发明还包括包含本公开的dsRNA剂的药物组合物和制剂。在一些实施方案中,本文提供了包含如本文所述的dsRNA剂和药学上可接受的载体的药物组合物。包含dsRNA剂的药物组合物可用于治疗与HBV基因的表达或活性相关的疾病或病症。此类药物组合物是基于递送方式配制的。一个实例是配制用于通过肠胃外递送(例如通过皮下(SC)、肌内(IM)或静脉内(IV)递送)进行系统性施用的组合物。在某些实施方案中,本公开提供了配制用于器官特异性(例如,肝)动脉内、肿瘤内、真皮内、玻璃体内注射、眼外用、眼用(滴眼液)、雾化、眼局部或其他局部途径、栓剂或口服施用的组合物。在优选的实施方案中,组合物皮下施用。
本公开的药物组合物可以以足以抑制HBV基因表达的剂量施用。在一些实施方案中,以如下剂量施用dsRNA剂:每剂约0.5mg/kg至50mg/kg,或0.3mg/kg至20mg/kg,或3mg/kg至10mg/kg,或优选每剂3mg/kg至10mg/kg。例如,dsRNA可以以每单一剂量约0.5mg/kg、1mg/kg、1.5mg/kg、2mg/kg、3mg/kg、10mg/kg、20mg/kg、30mg/kg、40mg/kg或50mg/kg的剂量施用。在一些实施方案中,dsRNA剂以50mg至900mg的剂量施用。
组合物也可以制备并以不依赖于体重的对于受试者的固定剂量包装。可以通过将每公斤体重乘以平均受试者的体重来计算示例性剂量水平。例如,一般成年人的平均体重认为是约70公斤。
重复剂量方案可以包括定期施用治疗量的dsRNA剂,例如每月一次、每隔一月一次或每三个月一次。在优选的实施方案中,以不超过每月一次的频率施用dsRNA剂。在初始治疗方案后,可以较低频率施用治疗。
所述药物组合物可以无限期地施用,例如在具有HBV感染的一种或多种体征或症状的受试者中,例如可检测的HBV抗原或HBV DNA(包括HBV cccDNA)。在一些实施方案中,使用dsRNA剂的治疗进行不连续的或或限定的时间段,并提供功能性治愈。
技术人员将理解,某些因素可影响有效治疗受试者所需的剂量和时机,包括但不限于疾病或病症的严重程度、先前的治疗、受试者的总体健康状况或年龄以及存在的其他疾病。此外,用治疗有效量的组合物治疗受试者可以包括单一治疗或一系列治疗。如本文其他地方所描述的,可以使用常规方法或基于使用适当动物模型的体内测试,来估计本发明涵盖的单个dsRNA剂的有效剂量和体内半衰期。
A.
“药物载体”或“药物赋形剂”是用于将一种或多种核酸递送给动物的药学上可接受的溶剂、助悬剂或任何其他药学上惰性的媒介。这样的试剂是本领域众所周知的。
B.
本公开的组合物可以以本领域已确立的使用水平另外包含药物组合物中常规存在的其他辅助组分。因此,例如,该组合物可以包含另外的、相容的药物活性物质,例如止痒剂、收敛剂、局部麻醉剂或消炎剂,或者可以包含可用于物理配制本公开的组合物的各种剂型的另外的物质,例如防腐剂、抗氧化剂和稳定剂。然而,当添加时,此类物质不应不适当地干扰本公开组合物的组分的生物活性。可以对制剂进行灭菌,且如果需要,可以与不会有害地与制剂的核酸相互作用的助剂混合,例如是防腐剂、稳定剂、湿润剂、乳化剂、影响渗透压的盐或缓冲剂等。
在一些实施方案中,本公开中表征的药物组合物包括(a)一种或多种dsRNA剂化合物和(b)一种或多种通过非RNAi机制发挥功能并且可用于治疗HBV相关障碍的药剂。此类药剂的实例包括但不限于抗炎剂、抗脂肪变性剂、抗病毒剂和抗纤维化剂。
另外,通常用于保护肝脏的其他物质,例如水飞蓟素,也可以与本文所述的dsRNA剂结合使用。可用于治疗肝脏疾病的其他药剂包括替比夫定、恩替卡韦和蛋白酶抑制剂,例如特拉匹韦和在例如US2005/0148548、US2004/0167116、US2003/0144217和US2004/0127488中公开的其他药物。
此类化合物的毒性和治疗功效可通过细胞培养或实验动物中的标准制药程序(例如,用于确定LD50(50%群体致死的剂量)和ED50(50%群体中治疗有效的剂量))来确定。毒性和治疗功效之间的剂量比率是治疗指数,且其可以表示为LD50/ED50比率。在一些实施方案中,表现出高治疗指数的化合物是优选的。
从细胞培养测定法和动物研究获得的数据可用于配制用于人类的剂量范围。本文表征的组合物的剂量通常在包括ED50而具有很少毒性或没有毒性的循环浓度的范围内。剂量可以在此范围内根据所采用的剂型和所采用的施用途径变化。对于在本公开中表征的方法中使用的任何化合物,治疗有效剂量可以初始从细胞培养测定估计。可以在动物模型中制定剂量以达到化合物或(合适时)靶序列的多肽产物的循环血浆浓度范围(例如,实现降低的多肽浓度),所述循环血浆浓度范围包括如在细胞培养中测定的IC50(即,实现症状的半最大抑制的测试化合物的浓度)。此类信息可用于更准确地确定用于人的可用剂量。血浆中的水平可以例如通过高效液相色谱法测量。
如上所述,除了它们的施用之外,本文所表征的dsRNA剂可以与有效治疗HBV感染的其他已知药剂组合施用。无论如何,给药医师可以基于使用本领域已知或本文所述的标准功效测量法所观察到的结果来调整dsRNA剂施用的量和时机。
VII.
本公开还提供了抑制细胞中HBV表达的方法。该方法包括使细胞与有效抑制细胞中HBV表达的量的dsRNA剂(例如双链dsRNA剂)接触,从而抑制细胞中HBV的表达。
细胞与dsRNA剂(例如双链dsRNA剂)的接触可以在体外或体内进行。在体内使细胞与dsRNA剂接触包括使受试者如人类受试者体内的细胞或细胞组与dsRNA剂接触。细胞接触的体外和体内方法的组合也是可能的。如上所述,接触细胞可以是直接或间接的。此外,细胞接触可以通过靶向配体来实现,包括本文所述或本领域已知的任何配体。在优选的实施方案中,靶向配体是碳水化合物部分,例如GaINAc
在本公开的方法的一些实施方案中,将dsRNA剂施用给受试者以使得dsRNA剂被递送至受试者内的特定部位。HBV基因表达的抑制可以通过测量源自受试者内特定部位的流体或组织的样品中HBV mRNA或HBV蛋白的水平或水平的变化来评估。在优选的实施方案中,该部位选自肝脏和血液。该部位也可以是从任何上述部位制备的细胞或流体的分段或亚组。
在一些实施方案中,本文公开的方法可用于治疗患有HBV感染的受试者,例如从HBV基因表达或HBV复制减少受益的受试者。在一个方面,本公开提供了降低感染HBV的受试者中乙型肝炎病毒cccDNA水平的方法。在另一方面,本公开提供了降低感染HBV的受试者中HBV抗原(例如HBsAg或HBeAg)的水平的方法。在另一方面,本公开提供了降低感染HBV的受试者中HBV病毒载量的方法。本公开还提供了降低感染HBV的受试者中丙氨酸氨基转移酶(ALT)或天冬氨酸氨基转移酶(AST)水平的方法(尽管ALT或AST的短暂升高可能与病毒清除相关)。在一个方面,本公开提供了用于在感染HBV的受试者中提高抗HBV抗体的水平的方法。在另一方面,本公开提供了治疗患有HBV感染的受试者的方法。在一个方面,本公开提供了治疗患有HBV相关疾病的受试者的方法,所述疾病例如是D型肝炎病毒感染、丁型肝炎、急性乙型肝炎;急性暴发性乙型肝炎;慢性乙型肝炎;肝纤维化;终末期肝病;或肝细胞癌。此外,由于HDV感染依赖于由HBV提供的专性辅助功能进行传播,并且患有HBV感染的受试者也可能患有HDV感染,因此在一些实施方案中,本文所述的治疗方法也可用于治疗患有HDV感染或HDV相关障碍的受试者,例如乙型肝炎病毒感染、慢性乙型肝炎感染(CHB)、慢性乙型肝炎感染(CHB)、肝硬化、肝衰竭和肝细胞癌(HCC)。在一些实施方案中,本公开的治疗方法(和用途)包括向受试者例如人施用治疗有效量的本公开的靶向HBV基因的dsRNA剂或包含本公开的靶向HBV基因的dsRNA剂的药物组合物。
在一个方面,本公开提供了预防患有HBV感染的受试者中的至少一种症状的方法,例如,血清或肝HBV cccDNA的存在;血清HBV DNA的存在;血清或肝HBV抗原(如HBsAg或HBeAg)的存在;ALT升高;AST升高;抗-HBV抗体的缺乏或低水平;肝损伤;肝硬化;丁型肝炎,急性乙型肝炎;急性暴发性乙型肝炎;慢性乙型肝炎;肝纤维化;终末期肝病;肝细胞癌;血清病样综合征;厌食;恶心;呕吐,低烧;肌痛;疲劳;味觉灵敏度和嗅觉失调(厌恶食物和香烟);右上腹和上腹痛(间歇性,轻度至中度);肝性脑病;嗜睡;睡眠模式紊乱;精神错乱;昏迷;腹水;胃肠道出血;凝血病;黄疸;肝肿大(轻度肿大,肝软);脾肿大;手掌红斑;蜘蛛痣;肌肉萎缩;蜘蛛状血管瘤;血管炎;静脉破裂出血;外周性水肿;男性乳房发育;睾丸萎缩;腹部侧支静脉(海蛇头);ALT水平高于AST水平;γ-谷氨酰转肽酶(GGT)升高和碱性磷酸酶(ALP)水平升高(不高于ULN的3倍);白蛋白水平略低;血清铁水平升高;白细胞减少(即粒细胞减少);淋巴细胞增多;红细胞沉降率(ESR)升高;红血球存活期缩短;溶血;血小板减少;国际标准化比率(INR)延长;血清或肝脏HBsAg、HBeAg或乙型肝炎核心抗体(抗HBc)免疫球蛋白M(IgM)的存在;乙型肝炎表面抗体(抗HB)、乙型肝炎e抗体(抗HBe)或HBV DNA的存在;胆红素水平升高;高球蛋白血症;组织非特异性抗体的存在,例如抗平滑肌抗体(ASMA)或抗核抗体(ANA)(10-20%);组织特异性抗体的存在,例如针对甲状腺的抗体(10-20%);类风湿因子(RF)水平升高;血小板和白细胞计数低;小叶的、具有退行性和再生性的肝细胞变化,并伴有炎症;以及主要中心小叶坏死,无论是可检测的还是不可检测的。所述方法包括向受试者施用治疗有效量的dsRNA剂,例如dsRNA,或包含dsRNA剂的药物组合物,从而预防患有从HBV基因表达降低中受益的疾病受试者,例如患有HBV感染的受试者或同时患有HBV和HDV感染的受试者中的至少一种症状。
在另一方面,本公开提供治疗有效量的本公开的dsRNA剂用于治疗受试者的用途,例如从HBV基因表达的降低或抑制中受益的受试者,例如患有HBV感染的受试者或同时患有HBV和HDV感染的受试者。
在又一方面,本发明提供靶向HBV基因的本公开的dsRNA剂,例如dsRNA,或包含靶向HBV基因的dsRNA剂的药物组合物在制备用于治疗受试者的药物中的用途,例如,受益于HBV基因表达或HBV复制的减少的受试者,例如患有HBV感染的受试者或同时患有HBV和HDV感染的受试者,以及患有受益于HBV基因表达的减少的障碍(例如HBV相关疾病)的受试者。
在另一方面,本公开提供本文所述的dsRNA剂用于预防患有受益于HBV基因表达或HBV复制的减少或抑制的障碍的受试者的至少一种症状的用途。
在又一方面,本公开提供如本文所述的dsRNA剂在制备用于预防患有受益于HBV基因表达或HBV复制的减少或抑制的障碍如HBV相关疾病的受试者中的至少一种症状的药物中的用途。
在一些实施方案中,靶向HBV的dsRNA剂施用给患有HBV感染或同时患有HBV感染和HDV感染,或患有HBV相关疾病的受试者,使得当将dsRNA剂施用于受试者时,例如受试者的细胞、组织、血液或其他组织或流体中一种或多种HBV基因的表达、HBV ccc DNA水平、HBV抗原水平、HBV病毒载量水平、ALT或AST降低至少80%、85%、90%、95%、98%或更多以趋向于正常或正常化。
在一些实施方案中,本公开的方法和用途包括施用本文所述的组合物,使得靶HBV基因的表达降低,例如约1个月。在一些实施方案中,靶HBV基因表达降低延长的持续时间,例如至少两个月、三个月或更长时间。在一些实施方案中,本公开的方法和用途包括施用本文所述的组合物导致功能性治愈。
根据本文所述的方法和用途施用dsRNA可能导致患有HBV感染或同时患有HBV和HDV感染或患有HBV相关疾病的患者中此类疾病或障碍的严重程度、体征、症状或标志物降低。在这种情况中,“降低”是指此类水平的临床上显著的降低。降低可以是例如至少80%、85%、90%、95%或98%,或降低至检测水平以下。
在一些实施方案中,可以通过检测或监测HBV相关疾病的症状减轻来监测本公开方法的功效。可以使用本领域已知的任何方法在体外或体内评估这些症状。
可以通过例如测量疾病进展、疾病消退、症状严重程度、疼痛减轻、生活质量、维持治疗效果所需的药物剂量、疾病标志物水平或任何适于所治疗的给定疾病的其他可测量参数来评估疾病的治疗功效。通过测量这些参数中的任何一个或参数的任何组合来监测治疗功效完全在本领域技术人员的能力范围内。例如,例如可以通过定期监测病毒载量和转氨酶水平来评估CHB的治疗功效。随后的读数与初始读数的比较为医师提供了治疗是否有效的指示。通过测量这些参数中的任何一个或参数的任何组合来监测治疗功效完全在本领域技术人员的能力范围内。与靶向HBV的dsRNA剂或其药物组合物的施用相结合,“有效对抗”HBV相关疾病表明以临床上适当的方式施用对至少统计学上显著部分的患者产生有益作用,例如症状的改善、治愈、疾病的减轻、寿命的延长、生活质量的改善或被熟悉HBV感染或HBV相关疾病及相关病因的医生认为是积极的其他效果。
当疾病状态的一个或多个参数在临床上有显著改善,或者通过如原本预期地那样失败或加重或者发生症状,治疗效果是明显的。例如,可测量的疾病参数至少50%、优选至少70%或更多的有利变化可以指示有效的治疗。给定的dsRNA剂药物或该药物的制剂的功效也可以使用本领域已知的姨该给定疾病的实验动物模型来判断。当使用实验动物模型时,如果观察到体征或症状的统计学显著的减轻,那么治疗功效得到了证明。
dsRNA剂的施用可以在例如患者的细胞、组织、血液、尿液或其他区室(compartment)中使血清或肝HBV cccDNA的存在、血清或肝HBV抗原(例如HBsAg或HBeAg)的存在减少;或使ALT水平或AST水平正常化至少70%、75%、80%、85%、90%或95%,至低于测定方法的检测水平,从而接近或达到实验值的正常上限。
dsRNA剂的施用可以在例如患者细胞、组织、血液、尿液或其他区室中使血清或肝抗HBV抗体(例如抗HBsAg抗体)的存在可检测到或使其增加至少80%、85%、90%、95%或更多;或在治疗前未检测到抗体时使抗体变得可检测。
由于对HBV表达的抑制作用,在一些实施方案中,根据本公开的组合物或由其制备的药物组合物可以提高生活质量。
受益于HBV基因表达的减少或抑制的受试者是患有如本文所述的HBV感染或HBV相关疾病或障碍的受试者。
对受益于HBV基因表达的减少或抑制的受试者的治疗包括治疗性治疗和预防性治疗。
本公开进一步提供dsRNA剂或其药物组合物与其他药物或其他治疗方法组合用于治疗受益于HBV基因表达的降低或抑制的受试者(例如患有HBV相关疾病的受试者)的方法和用途,例如与已知药物或已知治疗方法组合,例如当前用于治疗这些障碍的那些。
例如,在一些实施方案中,靶向一个或多个HBV基因的dsRNA剂与例如可用于治疗如本文所述的HBV相关疾病的药剂联合施用。例如,适合于治疗受益于HBV表达的降低的受试者(例如患有HBV相关疾病的受试者)的另外的治疗剂和治疗方法包括靶向HBV基因组不同部分的dsRNA剂、抗病毒剂、核苷酸类似物、核苷类似物、逆转录酶抑制剂(例如富马酸替诺福韦二吡呋酯(TDF)、替诺福韦艾拉酚胺、拉米夫定、阿地福韦酯、恩替卡韦(ETV)、替比夫定、AGX-1009、恩曲他滨、克拉夫定、利托那韦、dipivoxil、洛布卡韦、泛昔洛韦、FTC,N-乙酰-半胱氨酸(NAC)、PC1323、HBV治疗性疫苗(radigm-HBV)、胸腺素α和更昔洛韦)、免疫刺激剂(例如,聚乙二醇化干扰素α2a(PEG-IFN-α2a)、干扰素α-2b、重组人白介素7和Toll样受体7(TLR7)激动剂)、治疗性疫苗(例如GS-4774、DV-601和TG1050)、病毒进入抑制剂(例如Myrcludex)、抑制HbsAg的分泌或释放的寡核苷酸(例如REP 9AC)、衣壳抑制剂(例如Bay41-4109和NVR-1221)、cccDNA抑制剂(例如IHVR-25)或用于治疗HBV相关疾病的其他治疗剂或程序,例如肝移植或化学疗法,或上述任何的组合。
施用本公开的dsRNA剂的受试者可以进一步施用一种或多种通过非RNAi机制起作用并且可用于治疗HBV感染的其他治疗剂。可以用于本公开的组合疗法的示例性治疗剂包括免疫调节剂,其通过例如增强辅助性T细胞活性、B淋巴细胞的成熟、抑制T细胞抑制剂和增强HLAI型表达来刺激免疫系统。合适的免疫调节剂包括干扰素,其具有包括抗病毒、免疫调节和抗增殖作用在内的多种特性。
例如,目前对慢性乙型肝炎的治疗是干扰素治疗,该疗法被施用给已证明有至少六个月的HBV感染、肝酶(AST和ALT)升高、血液中病毒活跃分裂(HBeAg或HBV DNA阳性测试)的受试者。干扰素-α疗法可在约35%的慢性乙型肝炎患者中产生长期的持续的疾病缓解,使肝酶正常化并失去活动性感染的三种标志物(HBeAg、HBV DNA和HBsAg)。具有急性HBV感染、终末期肝硬化或其他主要医学问题的受试者通常不用干扰素进行治疗。
此外,对患有HBV相关肝硬化的患者进行干扰素治疗显著降低肝细胞癌(HCC)率,尤其是在血清HBV DNA量较大的患者中。在HBeAg阳性代偿性肝硬化患者中,干扰素治疗后的病毒学和生物化学缓解与生存率提高相关。在患有慢性HBV感染的患者中,干扰素-α治疗后HBeAg的清除与改善的临床结果相关。标准治疗持续时间为16周。在标准治疗方案结束时表现出低水平病毒复制的患者从延长的治疗中受益最大。
在一些实施方案中,本公开的方法包括向患有HBV感染或HBV相关疾病的受试者施用逆转录酶抑制剂。在一些实施方案中,本公开的方法包括向患有HBV感染或HBV相关疾病的受试者施用逆转录酶抑制剂和免疫刺激剂。
dsRNA剂和另外的治疗剂或治疗可以同时施用或以同一组合例如肠胃外施用,或者另外的治疗剂可以作为单独的组合物的部分或在单独的时间或通过本领域已知的或本文描述的另一种方法施用。
本公开还提供使用本文所述的dsRNA剂或包含dsRNA剂的组合物减少或抑制细胞中HBV表达的方法。还在其他方面中,提供了本文所述的dsRNA剂或包含dsRNA剂的组合物在制备用于减少或抑制细胞中HBV基因表达的药物中的用途。在再其他方面中,本公开提供了用于减少或抑制细胞中的HBV复制的本文公开的dsRNA剂或包含dsRNA剂的组合物。还在其他方面,提供了本文公开的dsRNA剂或包含dsRNA剂的组合物在制备用于减少或抑制细胞中HBV复制的药物中的用途。所述方法和用途包括使细胞与如本文所公开的dsRNA剂接触,并维持细胞足以降解HBV基因的mRNA转录物的时间,从而抑制细胞中HBV基因的表达或抑制HBV复制。
在上述方法和用途中,细胞可以在体外或体内进行接触,即细胞可以在受试者体内。
适用于使用本文公开的方法进行处理的细胞可以是表达HBV基因的任何细胞,例如感染HBV的细胞、包含含有HBV基因组或HBV基因的部分的表达载体的细胞或表达HBV基因的转基因小鼠。适用于本文公开的方法和用途中的细胞可以是哺乳动物细胞,例如灵长类细胞(例如人细胞或非人灵长类细胞,例如猴细胞或黑猩猩细胞)或非灵长类细胞(例如小鼠细胞、大鼠细胞或其他哺乳动物细胞)。在某些实施方案中,细胞是可以被HBV感染的细胞。在某些实施方案中,细胞是人细胞,例如人肝细胞。
HBV基因表达在细胞中可被抑制至少80%、85%、90%或95%或更多,例如,被抑制至低于测定方法的检测水平。
HBV复制在细胞中可被抑制至少80%、85%、90%或95%或更多,例如,被抑制至低于测定方法的检测水平。
本文所公开的体内方法和用途可包括向受试者施用包含dsRNA剂的组合物,其中所述dsRNA剂包含与待治疗的哺乳动物的HBV基因的RNA转录物的至少一部分互补的核苷酸序列。当待治疗的生物体是人时,可以通过本领域已知的任何方式来施用组合物,包括但不限于皮下、静脉内或肌内施用。在一些实施方案中,所述组合物通过皮下注射施用。在一些实施方案中,将dsRNA剂配制为以单次注射施用整个剂量。在一些实施方案中,本公开提供了配制用于器官特异性(例如,肝)动脉内、肿瘤内、真皮内、玻璃体内注射、眼外用、眼内(滴眼液)、雾化、眼局部或其他局部途径、栓剂或口服施用的组合物。
在一个方面,本公开还提供抑制哺乳动物例如人中的HBV基因表达的方法。本公开还提供了一种包含靶向哺乳动物细胞中的HBV基因的dsRNA剂的组合物,其用于抑制哺乳动物中HBV基因的表达。在另一方面,本公开提供靶向哺乳动物细胞中的HBV基因的dsRNA剂在制备用于抑制哺乳动物中HBV基因表达的药物中的用途。
所述方法和用途包括向哺乳动物例如人施用包含靶向所述哺乳动物细胞中的HBV基因的dsRNA剂的组合物,并将所述哺乳动物维持足以降解所述HBV基因的mRNA转录物的时间,从而抑制哺乳动物中HBV基因的表达。
在某些实施方案中,可以通过本领域已知的任何方法,例如本文所述的qRT-PCR,评估施用dsRNA剂的受试者的外周血样品中基因表达的降低。蛋白质产生的减少可以通过本领域已知的任何方法和本文所述的方法(例如ELISA或蛋白质印迹)来评估。可视情况使用用于确定基因和蛋白质表达水平的临床上可接受的方法。在某些实施方案中,穿刺肝活检样品用作用于监测HBV基因或蛋白质表达减少的组织材料。在一些其他实施方案中,血液样品用作用于监测HBV基因或蛋白质表达减少的组织材料。
在一些实施方案中,通过实施5′-RACE或本领域已知的修良方案来完成dsRNA剂施用后体内靶标的RISC介导切割的验证(Lasham A et al.,(2010)Nucleic Acid Res.,38(3)p-e19)(Zimmermann et al.(2006)Nature 441:111-4)。
通过以下实施例进一步说明本发明,这些实施例不应解释为限制性的。
实施例1
dsRNA剂合成
试剂来源
在本文中没有具体给出试剂来源的情况下,这些试剂可以从任何分子生物学试剂供应商处以应用于分子生物学的质量/纯度标准获得。
如WO/2016/077321中所述,靶向HBV的dsRNA设计的选择受到两个主要因素的驱动:a)效力,和b)使用具有近乎完美的匹配并且具有所有已知基因型(A到H)的大量公共HBV序列的大于90%局部覆盖率的药剂的希望。相对于NCBI HBV参考基因组序列NC_003977.1(GenBank登录号GI:21326584(SEQ ID NO:1))确定用于RNA剂选择的坐标。设计、合成并体外筛选第一组RNA剂,其包含结构-活性修饰(包括各种2′-O-甲基和2′-氟取代模式),以HBV基因组中编码表面抗原(HbSAg)和HBV聚合酶的两个相邻区域为中心。还设计、合成并体外筛选第二组RNA剂,其靶向HBV基因组中的其他区域,尤其是SEQ ID NO:1的位置1581-1599,编码HbSAg、聚合酶和X基因的区域。对选择的序列进行进一步的化学修饰和测试。这些双链体设计提供于WO2016/077321中(其全部内容通过引用并入本文);未修饰的HBV有义和反义链核苷酸序列的详细列表提供于WO2016/077321的表3、6、12、22和25中,且修饰的HBV有义和反义链核苷酸序列的详细列表提供于WO2016/077321的表4、7、13、23和26中。其中还提供了用这些药剂进行的筛选测定的结果。
这些研究鉴定了具有反义链和有义链的双链体AD-66810,该反义链具有修饰的核苷酸序列5′-usGfsugaAfgCfGfaaguGfcAfcacsusu-3′(SEQ ID NO:13),该有义链具有修饰的核苷酸序列5′-gsusguGfcAfCfUfucgcuucaca-3’(SEQ ID NO:29),其中a、c、g和u分别为2′-O-甲基腺苷-3′-磷酸、2′-O-甲基胞苷-3′-磷酸、2′-O-甲基鸟苷-3′-磷酸和2′-O-甲基尿苷-3′-磷酸;Af、Cf、Gf和Uf分别为2’-氟代腺苷-3’-磷酸、2’-氟代胞苷-3’-磷酸、2’-氟代鸟苷-3’-磷酸和2’-氟代尿苷-3’-磷酸;和s是硫代磷酸酯连接;并且其中N-乙酰半乳糖胺部分N-[三(GalNAc-烷基)-酰胺基癸酰基)]-4-羟基脯氨醇(也称为(Hyp-(GalNAc-烷基)3)或在本文中称为L96)共价连接至有义链的3′端。
基于先前鉴定的靶向人乙型肝炎病毒(HBV;U95551)的X转录物的序列AD-66810,本文提供进一步研究以鉴定有效且特异性的dsRNA剂分子。为了实现此目标,一系列化学修饰的dsRNA剂被设计、合成并使用基于Dual-Luc报告体的测定方法和HepG2.2.15细胞系进行了体外活性测试。将所有化合物与共价连接至有义链的3′端的三触角(triantennary)N-乙酰基半乳糖胺(GalNAc)配体(L96)缀合。
HBV有义链和反义链序列是在Mermade 192合成仪(BioAutomation)上使用固体支持物介导的亚磷酰胺化学方法以1μmol规模合成的。固体支持物是加载有定制GalNAc配体的可控孔隙玻璃(500A)或通用固体支持物(AM biochemical)。辅助合成试剂,2′-F和2′-O-甲基RNA和脱氧亚磷酰胺分别获自Thermo-Fisher
固相合成完成后,将寡核糖核苷酸从固相支持物切割下来,并在60℃下使用200μL甲胺水溶液试剂在密封的96孔深孔板中脱保护20分钟。在切割和脱保护步骤结束时,使合成板达到室温,并通过加入1mL的乙腈:乙醇混合物(9∶1)沉淀。将板在-80℃下冷却2小时,借助于多通道移液管小心移出上清液。将寡核苷酸沉淀重新悬浮在20mM NaOAc缓冲液中,并在配备A905自动进样器和Frac 950级分收集器的AKTA Purifier System上使用5mLHiTrap
在Tecan液体处理机器人上进行HBV单链的退火。将有义和反义单链的等摩尔混合物在96孔板中合并并退火。合并互补单链后,将96孔板紧密密封并在100℃的烘箱中加热10分钟,并允许在2-3小时内缓慢升至室温。将每种双链体的浓度相对1×PBS中10μM标准化。
表1中显示了本文公开的修饰的核苷酸单体的缩写。表2显示了AD-66810和使用上述方法合成的HBV dsRNA剂。
应当理解,除非另有说明,否则当存在于寡核苷酸中时,这些单体通过5′-3′磷酸二酯键相互连接。
表2.GalNAc-缀合的HBV dsRNA剂的修饰的核苷酸序列
实施例2
dsRNA剂双链体的体外筛选
在补充有10%FBS的DMEM(ATCC)中,Cos7细胞(
dsRNA剂和psiCHECK2质粒转染后48小时;测量Firefly(转染对照)和Rinella(与HBV靶序列融合)荧光素酶。首先,从细胞去除培养基。然后通过向每个孔和混合物中加入等于培养基体积的20μl
表3提供了使用表2中列出的dsRNA剂进行的这些测定的结果。
HepG2.2.15和PLC(人肝癌细胞;
表4提供了使用表2中列出的dsRNA剂进行的这些测定的结果。
收获细胞并在140μl裂解/结合溶液中裂解,然后使用Eppendorf
将每反应2μl 10×缓冲液,0.8μl 25×dNTP,2μl随机引物,1μl逆转录酶,1μlRNase抑制剂和3.2μl的H
将2μl的cDNA添加到384孔板(Roche cat#04887301001)中每孔含有0.5μl的人GAPDH TaqMan探针(Applied Biosystems Cat#4319413E)、1μl SORF2特异性
为了计算相对倍数变化,使用DDCt法分析实时数据,并相对于用非靶向对照dsRNA剂转染的细胞进行的测定标准化。
实施例3
在Dual-Luc系统中GalNAc缀合的HBV靶向dsRNA剂的转染
表3中显示了用每种缀合的dsRNA剂转染后HBV mRNA的沉默。通过在Cos7细胞中以50nM、10nM和0.1nM的dsRNA剂浓度转染来测试每种dsRNA剂。根据筛选结果,20种dsRNA剂中的7种显示出与AD-66810亲本相当的功效。
缩写:ID=身份;SD=标准偏差
实施例4
在HepG2.2.15细胞中GalNAc缀合的HBV靶向dsRNA剂的转染
表4显示了用每种缀合的dsRNA剂转染后,HepG2.2.15细胞中HBV mRNA(如使用正向和反向引物以及TaqMan探针测定的PORF1和SORF2 mRNA)的沉默。总体而言,使用功效与亲本分子相当的10种dsRNA剂时,与在Dual-Luc过表达系统中的沉默相比在HepG2.2.15中观察到了更强的PORF1和SORF2病毒转录物的沉默。观察到针对PORF1和SORF2 mRNA的相似的dsRNA剂活性,这是预期的,因为dsRNA剂靶位点存在于两种转录物中。
缩写:SD=标准偏差
基于以上研究,选择双链体AD-81890进行进一步分析。
实施例5
单次皮下注射后腺相关HBV小鼠模型中AD-81890药理学的评估
在腺相关的HBV(HBV-AAV)小鼠模型中测定了AD-81890的药理学。将AAV8-HBV(SignaGen Laboratories)在1×PBS中稀释至最终浓度为2×10
用无菌1×PBS稀释AD-81890,并以10μl/g的可变体积施用。如表5所述,动物以0.3、1或3mg/kg接受单次SC剂量的AD-81890,并在给药后第-24、-2、0、14、21、33、47、59和74天经由眼眶后静脉窦收集血液。
缩写:No.=数;PBS=磷酸盐缓冲盐水
收集后,使血液凝结30分钟,然后在微量离心机中以13,000rpm于4℃下离心10分钟。吸出血清并储存在-20℃下。
乙型肝炎病毒表面抗原蛋白水平通过ELISA(BioTang,Waltham,MA)进行评估。使用US Biologics(Memphis,TN)HBsAg蛋白生成标准曲线。将血清样品在1×PBS(Gibco,Gaithersburg,MD)中以1∶2000或1∶500稀释,并使用有少许修改的ELISA方案进行评估。简而言之,将50μL/孔的稀释血清或标准品加载至板中,并在37℃下温育1小时。在这一温育后,将50μL/孔酶缀合物添加至每个孔,并将板在37℃下温育30分钟。用300μL/孔的1×洗涤缓冲液洗涤板3次,然后吸干直至从孔中除去所有液体,加入100μL/孔的底物,并将板在37℃下温育30分钟。最后,再添加100μL/孔的终止溶液,并在450nm波长处测量吸光度。在计算的HBsAg水平低于测定法的定量下限(LLOQ)的任何情况下,值记录为LLOQ(即313ng/mL)。
单次皮下(SC)剂量的AD-81890后,HBV-AAV小鼠中的平均±SD血清HBsAg浓度如图2A所示。HBV-AAV小鼠中相对于基线的平均±SD血清HBsAg水平如图2B所示。单次SC注射0.3、1或3mg/kg的AD-81890导致有效且持续降低HBV-AAV小鼠中的血清HBsAg浓度,在最高(3mg/kg)AD-81890剂量组中在第7天观察到最高92%的降低。在最高剂量组中,直至第33天维持最高水平的降低,此后HBsAg水平开始返回到基线(图2B)。在0.3mg/kg和1mg/kgAD081890剂量组中,观察到血清HBsAg浓度的中等程度的降低,第7天的最高降低分别为23%和72%。在研究完成时(第74天),0.3mg/kg和1mg/kg AD-81890剂量组的HBsAg水平返回到基线水平。
实施例6
多次皮下注射后腺相关HBV小鼠模型中AD-81890药理学的评估
在腺相关HBV(HBV-AAV)小鼠模型中测定了AD-81890的药理学。将AAV8-HBV(SignaGen Laboratories)在1×PBS中稀释至终浓度为2×10
各自用无菌1×DPBS稀释AD-66810和AD-81890,并以10μl/g的可变体积施用。动物接受以1mg/kg,Q2Wx6给予的AD-66810,或以9mg/kg接受单剂量的AD-81890,或以1或3mg/kg,Q2Wx6或QMx3接受多个剂量的AD-81890。在如表6所述的在多个时间点从动物收集血清。如表6所述经由眼眶后静脉窦收集血液。
如先前实施例中所述处理血样并进行ELISA测定。结果显示在以下表7中。带有标准偏差的结果如图3所示。
AD-81890施用后,在AAV8-HBV小鼠模型中观察到剂量反应性血清HBsAg水平。单次9mg/kg剂量或3mg/kg q2w x 6的AD-81890后,观察到最大HBsAg降低约2.7log10。接受3mg/kg q2w x 6的动物在总共约8周的时间内具有大于2log10的持续HBsAg降低。
这些体内研究表明,AD-81890有效降低HBV-AAV小鼠模型的血清中的HBsAg。
实施例7
AD-81890的特异性脱靶分析
使用计算机生物信息学方法和体外方法的组合来评价AD-81890反义链的潜在脱靶活性。
使用定制的R和Python脚本设计一组靶向乙型肝炎病毒(HBV)亚型ayw的“X”基因(GenBank核苷酸ID U95551;NCBI Gene基因ID:7276;SEQ ID NO:49)的dsRNA剂。环状U95551HBV基因组的长度为3182个碱基,且NCBI记录中的1376-1840位编码“X”基因CDS区。以上和WO2016/077321中提供了dsRNA剂设计和筛选方法的细节。
为了测量脱靶抑制,通过qPCR在肝细胞系HepG2.2.15中测试内源表达的转录物的反应。在96孔板中,使用Lipofectamine RNAiMax(ThermoFisher)以50nM至5fM的浓度范围用AD-81890转染细胞(每孔2×10
为了评估脱靶沉默,使用对每种潜在的脱靶(表8)特异性的TaqMan探针进行定量。用LightCycler 480实时PCR仪(Roche)进行qPCR。
为了确定中靶(HBV)以及潜在的脱靶基因抑制的程度,通过相对于来自同一样品的人GAPDH RNA表达来确定相对RNA水平。将结果与转染的非特异性dsRNA剂对照进行比较,且误差表示为标准偏差。AD-81890对于PORF1转录物靶的IC50为0.803nM,和对于SORF2转录物靶为0.766nM。即使在最高的AD-81890浓度下,也未观察到针对SIDT2和ZBTB2转录物的显著靶标敲低。
在剂量反应筛选中评估了AD-81890对于在HepG2.2.15中内源表达转录物的2个潜在脱靶的脱靶抑制程度。AD-81890在任何测试剂量下不抑制SIDT2或ZBTB2的表达,而HBV抑制是剂量反应性的。使用四参数拟合模型(XLfit)拟合剂量-反应数据得到针对PORF-1或SORF-2的IC50分别为803pM和766pM。
实施例8
使用RNA-Seq在HepG2.2.15细胞中AD-81890特异性的体外分析
使用全转录组表达水平的变化以及RNA-Seq,通过在表达HBV的HepG2.2.15细胞中比较AD-66810和AD-81890测量dsRAN剂化学改变的影响。AD-66810和AD-81890分子具有相同的核苷酸序列,但区别在于从反义链分子的5′端起第6位上单一二醇核酸(GNA)的取代(参见表2)。
用培养基稀释HepG2.2.15细胞(稳定转染了全基因组HBV的HepG2衍生细胞系)至终浓度187500个细胞/mL,且将80μL移液至96孔胶原蛋白包被板(BD Biocoat,目录号356407)中以得到终浓度15000个细胞/孔。
将dsRNA剂储备液在1×DPBS中稀释至以下浓度:1,000nM或100nM。将RNAiMAX(ThermoFisher,目录号13778150)用Opti-MEM(ThermoFisher,目录号31985062)以0.3μLRNAiMAX/10μL Opti-MEM浓度稀释,并在室温下温育5分钟。温育后,以10μL/孔添加到96孔胶原蛋白包被板(BD Biocoat,目录号356407)的每个孔中,以及10μL/孔的合适dsRNA剂稀释液,轻轻混合并在室温下温育20分钟。将80μL制备的细胞悬液添加到每个孔中以使最终细胞密度为15000个细胞/孔,并且最终dsRNA剂浓度为100nM和10nM。将细胞在含有5%CO
根据实验方案,使用ThermoFisher RNAqueous-96总RNA分离试剂盒分离RNA。简而言之,在16-22小时后,从每个孔中吸出上清液,加入100μL/孔的1×DPBS以冲洗掉残留的培养基,然后吸出。将200μL裂解/结合溶液添加到每块板的第1行和第5行的每个孔中,上下吸打几次,并转移至后续行以便合并4个孔/条件以确保足够的RNA回收。这导致每个条件四个重复。将100μL 100%乙醇添加到含有裂解物的培养板的每个孔中,混合几次并转移到滤板的孔中。通过一系列离心步骤(1900×g,1分钟),将样品用提供的洗涤液洗涤,用DNase试剂处理,并洗脱到100μL无核酸酶水中。RNA浓度用NanoDrop 8000分光光度计(ThermoFisher)测定。
RNA用TURBO DNase(Ambion)进一步处理。每个RNA样品(≤10μgRNA/样品)与2μLDNase、10μL10×缓冲液和无核酸酶水混合至总体积为100μL,然后在37℃下温育30分钟。DNase处理后,按照实验方案用RNeasy MinElute Cleanup试剂盒(Qiagen)进一步纯化RNA。RNA在30uL无核酸酶水中洗脱,和用NanoDrop 8000分光光度计测定RNA浓度。RNA保存于-80℃下。随后,该RNA用于使用TruSeq Stranded TotalRNA文库制备试剂盒(Illumina)进行cDNA文库制备,并在NextSeq500台式测序仪(Illumina)上测序,以上均根据制造商的说明书。进行两次实验重复。
将HepG2.2.15细胞一式四份地用10nM或100nM AD-66810或AD-81890转染,并与未处理的对照一起培养24小时。用Purelink RNA试剂盒(ThermoFisher)提取的RNA使用具有用于rRNA耗尽的Ribo-ZeroHuman/Mouse/Rat的TruSeq Stranded Total RNA文库制备试剂盒以及用于rRNA耗尽的Ribo-Zero Human/Mouse/Rat(Illumina),所有按照制造商的说明书进行。每个NextSeq 500/550High Output v2(75个循环)流动池(Illumina)合并总共40个样品。进行两次实验重复。
使用fastq-mcf,以最小平均质量得分25和最小剩余长度36过滤原始RNA-Seq阅读片段。使用STAR(2.4.2a版)将过滤的阅读片段同时与人(hg19/GRCh37)和HBV(GenBank核苷酸ID U95551;NCBI GeneID:7276)基因组比对。由于HBV基因组的环状结构,46个碱基对在HBV序列的线性化形式的末端重复以允许阅读片段映射于断裂点处。通过featureCounts(1.5.0版),对映射到外显子的唯一比对阅读片段进行计数。所有样品具有>5M的映射阅读片段。使用软件包DESeq2(1.16.1版)在R(3.4.1版)中进行差异基因表达分析。使用Benjamini&Hochberg,1995的方法通过DESeq2进行多重检验校正以获得调整的p值。
MA图用于可视化中靶HBV敲低和脱靶效应。在减少总体脱靶效应方面对GNA化学的分析限于下调的基因(log
表9.显著下调的基因的统计学测试
exp:实验重复;Mean.AD-66810.IFC:AD-66810和/或AD-81890中显著下调的基因的平均log
在两个实验重复中观察到AD-81890与AD-66810相比的脱靶效应的一致降低(图4,表9)。在10nM下,与AD-66810相比,AD-81890显示出显著下调基因的平均log
实施例9
PXB小鼠的人特异性肝毒性的评估
PXB小鼠是一种嵌合小鼠,具有人肝细胞高度再殖的人源化肝(PhoenixBio)。该小鼠是移植人肝细胞的尿激酶型纤溶酶原激活物(uPA)/严重联合免疫缺陷(SCID)小鼠(人源化肝uPA/SCID小鼠)(Mercer等人,Nat.Med.7:927-933,2001)。报告的人源化肝uPA/SCID小鼠的替代指数(RI)(即肝脏中人肝细胞的百分比)超过70%。该小鼠可用作预测人类药物代谢、药代动力学和肝毒性的模型(Naritomi et al.,Drug Metab Pharmacokinet.33:31-39,2018)。
在PBX小鼠中进行研究以比较AD-66810和AD-81890的肝毒性。通过皮下注射在第0、21、28、35和42天对小鼠给药12、36或100mg/kg的AD-66810、AD-81890或PBS(对照)(每组n=4)。直至第49天,每周两次进行一般状况观察和体重测量。每周两次通过眼眶后抽血收集血液,并使用常规方法制备血清。进行最后一次抽血,并通过心脏穿刺和放血处死动物。放血后进行尸检。收获肝脏并称重。将肝脏分割用于储存在RNAlater溶液(Ambion)中,在石蜡包埋前置于福尔马林中,并速冻。
在整个研究期间,所有动物的体重保持在初始水平的80%以上。另外,在化合物处理组中,体重的最低算术平均值高于对照PBS处理组。
在整个研究期间,监测血液中人血清白蛋白水平。在研究的生命期内,所有存活的动物的血液h-Alb浓度保持为高于7.0mg/ml。
在整个研究期间,监测肝酶。尤其在整个研究期间监测ALT、AST、ALP、GGT、TBIL和TG。下表10显示了接受AD-66810、AD-81890或PBS的小鼠在第49天测量的酶水平。图5A和5B显示了施用AD-66810(图5A)或AD-81890(图5B)后相对于PBS施用的随时间的ALT水平。
与对照组相比,两个测试化合物处理组的ALT、AST、ALP和GGT均升高。另外,在AD-66810处理组中ALT、AST和GGT中显示出剂量依赖性的变化。
在尸检中,两组均未没有测试化合物特异性的发现。当与对照组比较时,在化合物处理组中动物的相对(肝/体重)肝脏重量没有明显变化。
等同方案
本领域技术人员将认识到或能够仅使用常规实验确定本文所述的特定实施方案和方法的许多等同方案。这样的等同方案旨在被所附权利要求的范围所涵盖。
尽管已经图示和描述了特定实施方案,但是应容易理解,上述各种实施方案可以组合以提供其他实施方案,并且可以在不脱离本发明的精神和范围的情况下进行各种改变。
除非另有说明,否则本说明书中提及或在申请数据表中列出的所有图形、美国专利、美国专利申请公开、美国专利申请、外国专利、外国专利申请和非专利出版物均通过引用整体并入本文中,包括于2018年8月13日递交的美国临时专利申请No.62/718,314。如果需要,可以修改实施方案的各方面以采用各种专利、申请和出版物的概念提供其他实施方案。
可以根据以上详细描述对实施方案进行这些和其他改变。通常,在以下权利要求书中,所使用的术语不应解释为将权利要求书限制为说明书和权利要求书中公开的特定实施方案,而应解释为包括所有可能的实施方案以及与这些权利要求所要求保护的等价方法的全部范围。因此,权利要求不受本公开的限制。
- 乙型肝炎病毒(HBV)dsRNA剂组合物及其使用方法
- 作为HBsAg(HBV表面抗原)和HBV DNA生成的抑制剂用于治疗乙型肝炎病毒感染的四氢吡啶并嘧啶和四氢吡啶并吡啶类化合物
