感测系统
文献发布时间:2023-06-19 10:40:10
相关申请的交叉引用
本申请要求2018年12月21日提交的美国临时申请序列号62/783,951的权益;该美国临时申请的内容通过引用以其整体并入本文。
背景
生物或化学研究中的各种方案涉及在局部支撑表面上或在预定的反应室内进行大量的受控反应。然后可以观察或检测指定的反应,并且随后的分析可以帮助鉴定或揭示反应中涉及的化学品的性质。在一些实例中,受控反应产生荧光,并且因此光学系统可以用于检测。在其他实例中,受控反应改变电荷、电导率或一些其他电特性,并且因此电子系统可以用于检测。
引言
本文公开的第一方面是一种感测系统,所述感测系统包括电荷传感器,所述电荷传感器包括:两个电极和连接两个电极的导电通道;带电荷的分子,其附接至所述导电通道,其中所述带电荷的分子包括:可逆地结合标记的核苷酸的标记(label)的识别位点,具有与未结合的电荷配置(charge configuration)相关的未结合的有利构象(favoredconformation),并且当所述识别位点与所述标记结合时具有与电荷配置相关的有利构象,其中所述电荷配置不同于未结合的电荷配置;和聚合酶,其附接至所述导电通道或所述带电荷的分子。
在该第一方面的实例中,带电荷的分子是带电荷的适体(aptamer)。在该实例中,带电荷的适体选自由DNA适体、RNA适体及其类似物组成的组。
在该第一方面的实例中,带电荷的分子选自由带电荷的蛋白质和带电荷的肽组成的组。
在该第一方面的实例中,带电荷的分子:还包括可逆地结合第二标记的核苷酸的第二标记的第二识别位点,并且当第二识别位点结合至第二标记时,具有与第二电荷配置相关的第二有利构象;还包括可逆地结合第三标记的核苷酸的第三标记的第三识别位点,并且当第三识别位点结合至第三标记时,具有与第三电荷配置相关的第三有利构象;并且还包括可逆地结合第四标记的核苷酸的第四标记的第四识别位点,并且当第四识别位点结合至第四标记时,具有与第四电荷配置相关的第四有利构象;并且当识别位点、第二识别位点、第三识别位点和第四识别位点中的每一个未被结合时,出现与未结合的电荷配置相关的未结合的有利构象。
在该第一方面的实例中,感测系统还包括被附接至导电通道的第二带电荷的分子,其中所述第二带电荷的分子:包括可逆地结合第二标记的核苷酸的第二标记的第二识别位点;具有与第二带电荷的分子的未结合的电荷配置相关联的第二带电荷的分子的未结合的有利构象;并且当第二识别位点结合至第二标记时,具有与第二带电荷的分子的电荷配置相关的第二带电荷的分子的有利构象。在该实例中,感测系统还可以进一步包括被附接至导电通道的第三带电荷的分子,其中第三带电荷的分子:包括可逆地结合第三标记的核苷酸的第三标记的第三识别位点;具有与第三带电荷的分子的未结合电荷配置相关的第三带电荷的分子的未结合的有利构象;并且当第三识别位点结合至第三标记时,具有与第三带电荷的分子的电荷配置相关的第三带电荷的分子的有利构象;和附接至导电通道的第四带电荷的分子,其中第四带电荷的分子:包括可逆地结合第四标记的核苷酸的第四标记的第四识别位点;具有与第四带电荷的分子的未结合电荷配置相关的第四带电荷的分子的未结合的有利构象;并且当第四识别位点结合至第四标记时,具有与第四带电荷的分子的电荷配置相关的第四带电荷的分子的有利构象。
在该第一方面的实例中,带电荷的分子还包括可逆地结合第二标记的核苷酸的第二标记的第二识别位点,并且当第二识别位点结合至第二标记时,具有与第二电荷配置相关的第二有利构象;并且所述感测系统还包括附接至所述导电通道的第二带电荷的分子,其中所述第二带电荷的分子:包括可逆地结合第三标记的核苷酸的第三标记的第三识别位点,以及可逆地结合第四标记的核苷酸的第四标记的第四识别位点;具有与第二带电荷的分子的未结合的电荷配置相关的第二带电荷的分子的未结合的有利构象;当第三识别位点结合至第三标记时,具有与第三电荷配置相关的第三有利构象;并且当第四识别位点结合至第四标记时,具有与第四电荷配置相关的第四有利构象。
在该第一方面的实例中,带电荷的分子还包括可逆地结合标记的核苷酸的第二标记的第二识别位点。
应当理解,本文公开的感测系统的任何特征可以以任何期望的方式和/或配置组合在一起。
本文公开的第二方面是一种感测设备,包括流动池(flow cell)和集成到所述流动池中的感测系统,所述感测系统包括电荷传感器,所述电荷传感器包括导电通道;附接至所述导电通道的带电荷的分子,其中所述带电荷的分子:具有与未结合的电荷配置相关的未结合的有利构象;并且当带电荷的分子的识别位点结合至标记的核苷酸的标记时,具有与电荷配置相关的有利构象,其中电荷配置不同于未结合的电荷配置;和附接至所述导电通道或所述带电荷的分子的聚合酶。
在该第二方面的实例中,感测设备还包括选择性地将试剂引入到流动池的输入端的试剂递送系统。在一些实例中,试剂在样品容器中,试剂包括标记的核苷酸,所述标记的核苷酸包括:核苷酸;附接至核苷酸的磷酸基团的连接分子;和附接至连接分子的识别位点特异性标记。
在该第二方面的实例中,感测设备还包括检测器,以检测来自电荷传感器的响应。
应当理解,感测设备的任何特征可以以任何期望的方式组合在一起。此外,应当理解,感测系统和/或感测设备的特征的任何组合可以一起使用,和/或与本文公开的任何实例组合。
本文公开的第三方面是一种方法,包括将模板多核苷酸链引入到感测系统中,该感测系统包括:电荷传感器,其包括两个电极和连接所述两个电极的导电通道;附接至所述导电通道的带电荷的分子,其中所述带电荷的分子包括识别位点;和附接至导电通道或带电荷的分子的聚合酶;将包括标记的核苷酸的试剂引入到感测系统中,由此标记的核苷酸中的一种的核苷酸与聚合酶缔合,并且标记的核苷酸中的所述一种的识别位点特异性标记与识别位点缔合,以诱导带电荷的分子的构象变化;以及响应于带电荷的分子的构象变化,检测电荷传感器的响应。
在该第三方面的实例中,该方法还包括将电荷传感器的响应与相关的识别位点特异性标记相关联;以及基于相关的识别位点特异性标记,鉴定标记的核苷酸中的一种的核苷酸。
在该第三方面的实例中,带电荷的分子包括多个不同的识别位点,每个识别位点以不同的速率可逆地结合不同标记的核苷酸的不同标记。在一些实例中,该方法还包括当不同标记的核苷酸分别与聚合酶缔合并且不同标记的核苷酸的不同识别位点特异性标记分别与多个不同识别位点中的一个结合时,响应于带电荷的分子的不同构象变化,检测电荷传感器的多个响应;以及通过不同的速率来鉴定分别缔合的不同标记的核苷酸。
在该第三方面的实例中,识别位点以多种不同的速率可逆地结合多种不同标记的核苷酸的多种不同标记,并且其中所述方法还包括:当至少一些不同标记的核苷酸分别与聚合酶缔合并且至少一些不同标记分别与识别位点结合时,响应于带电荷的分子的不同构象变化,检测电荷传感器的多个响应;以及通过不同的速率来鉴定分别缔合的不同标记的核苷酸。
在该第三方面的实例中,识别位点可逆地结合高达四种不同标记的核苷酸,并且其中所述方法还包括:当高达四种不同标记的核苷酸分别与聚合酶和识别位点缔合时,响应于带电荷的分子的不同构象变化,检测电荷传感器的高达四种不同响应,其中高达四种不同响应中的每一种具有不同的量值(magnitude);以及通过不同的量值来鉴定分别缔合的不同标记的核苷酸。
应当理解,该方法的任何特征可以以任何期望的方式组合在一起。此外,应当理解,该方法和/或感测系统和/或感测设备的特征的任何组合可以一起使用,和/或与本文公开的任何实例组合。
本文公开的第四方面是一种感测系统,所述感测系统包括电荷传感器,所述电荷传感器包括:两个电极和连接所述两个电极的导电通道;附接至所述导电通道的带电荷的分子,其中所述带电荷的分子:包括可逆地结合标记的核苷酸的标记的识别位点;具有与未结合的电荷配置相关的未结合的有利构象;并且当所述识别位点结合至所述标记时,具有与电荷配置相关的有利构象,其中电荷配置不同于未结合的电荷配置;和附接至两个电极中的至少一个或基底的聚合酶,所述电荷传感器被定位在所述基底上。
在第四方面的一个实例中,基底是图案化的基底,其中电荷传感器被定位在图案化的基底的凹陷部(depression)中,并且其中聚合酶被附接至凹陷部的表面。
应当理解,该感测系统的任何特征可以以任何期望的方式组合在一起。此外,应当理解,该感测系统和/或该方法和/或其他感测系统和/或感测设备的特征的任何组合可以一起使用,和/或与本文公开的任何实例组合。
本文公开的第五方面是一种感测设备,包括流动池;以及集成到流动池中的感测系统,所述感测系统包括:包括导电通道的电荷传感器;附接至所述导电通道的带电荷的分子,其中所述带电荷的分子:具有与未结合的电荷配置相关的未结合的有利构象;并且当带电荷的分子的识别位点结合至标记的核苷酸的标记时,具有与电荷配置相关的有利构象,其中电荷配置不同于未结合的电荷配置;和附接至两个电极中的至少一个或流动池的基底的聚合酶。
在第五方面的一个实例中,基底是图案化的基底,其中电荷传感器被定位在图案化的基底的凹陷部中,并且其中聚合酶被附接至凹陷部的表面。
应当理解,该感测设备的任何特征可以以任何期望的方式组合在一起。此外,应当理解,该感测设备和/或该方法和/或感测系统和/或其他感测设备的特征的任何组合可以一起使用,和/或与本文公开的任何实例组合。
此外,应当理解,任何方法和/或任何感测系统和/或任何感测设备的任何特征可以以任何期望的方式组合在一起,和/或可以与本文公开的任何实例组合。
附图简述
通过参考以下详细描述和附图,本公开内容的实例的特征将变得显而易见,其中相似的附图标记对应于相似但可能不相同的部件。为了简洁起见,具有先前描述的功能的附图标记或特征可以结合出现它们的其他附图描述或者可以不结合出现它们的其他附图描述。
图1A是当带电荷的分子处于其未结合的有利构象(在“(i)”处示出)和其有利构象(在“(ii)”处示出)时,本文公开的传感器的实例的示意图;
图1B是当带电荷的分子处于其未结合的有利构象(在“(i)”处示出)和其有利构象(在“(ii)”处示出)时,本文公开的传感器的另一个实例的示意图;
图2是本文公开的传感器的另一个实例的示意图;
图3A至图3E是图示出了包括具有四个不同识别位点的带电荷的分子的传感器的另一个实例的示意图;
图4是包括流动池的感测系统的实例和本文公开的传感器的实例的示意性透视图;
图5示意性地图示出了本文公开的方法的实例;
图6A和图6B是图示出了本文公开的传感器的潜在响应的图;
图7A是流动池的另一个实例的俯视图;和
图7B是定位在图7A的流动池的架构中的传感器的实例的放大的且部分剖开的视图。
详细描述
本文公开了一种感测系统,所述感测系统可以用于核酸测序程序中的单分子检测。所述感测系统包括附接至电荷传感器的导电通道的带电荷的部分。所述带电荷的部分以这样的方式附接至导电通道,使得直到发生将带电荷的部分重新配置为可由电荷传感器检测的事件(例如,靶标记的结合)时才检测到所述带电荷的部分。更具体地说,所述带电荷的部分能够经历与靶标记的可逆结合,所述靶标记附接至能够被聚合酶掺入的核苷酸。由于靶标记与带电荷的部分结合,结合的带电荷的部分经历构象变化,该构象变化改变电荷的空间分布。由于带电荷的部分相对于电荷传感器中的导电通道的接近性,电荷传感器对新呈现的电荷做出响应并产生可检测的信号。即使在生物相关或生理浓度的盐离子下也产生可检测的信号,其中德拜屏蔽长度(Debye screening length)通常小于1nm。作为实例,将带负电荷的部分移动更靠近导电通道的构象可以降低跨导(transconductance),而将带负电荷的部分移动远离导电通道的构象可以增加跨导。因此,不同的带电荷的部分的构象导致有区别的可检测信号。因为可检测的电荷驻留在带电荷的部分上,所以电荷不需要驻留在靶标记上,这可以是有利的。
在本文公开的实例中,靶标记可以被定制为能够被聚合酶掺入的特定核苷酸。因为靶标记在带电荷的部分中诱导所需的构象变化,所以产生的信号可以用于鉴定特定的核苷酸。此外,除了电荷量值之外,靶标记和一个或更多个带电荷的部分之间的结合速率和解离速率(on-and off-rate)可以用于产生以独特的频率表现的独特指纹信号,其可以用于鉴定连接至靶标记的相应核苷酸。
现在参考图1A和图1B,分别描绘了感测系统10、10’的两个实例。感测系统10、10’中的每一个包括电荷传感器11、11’,所述电荷传感器11、11’包括两个电极12、14和连接两个电极12、14的导电通道16。感测系统10、10’还包括附接至电荷传感器11、11’的导电通道16的带电荷的分子18或18’,以及附接至导电通道16(图1A)或带电荷的分子18’(图1B)的聚合酶20。
在感测系统的其他实例中,聚合酶20可以附接至感测系统10、10’的其他部件(例如,附接至电极12或14)和/或附接至其中集成有感测系统10、10’的流动池的其他部件。聚合酶20可以附接至邻近电荷传感器11、11’的任何区域,只要通过聚合酶20掺入的核苷酸的标记可以被可逆地结合至带电荷的分子18或18’。在一些实例中,聚合酶20附接在带电荷的分子18或18’的约5nm至约50nm的距离内。
电荷传感器11、11’可以是场效应晶体管(FET),诸如基于碳纳米管(CNT)的FET、基于单壁碳纳米管(SWNT)的FET、硅纳米线(SiNW)FET、硅纳米管FET、聚合物纳米线FET、石墨烯纳米带FET(以及由诸如MoS
电极12、14可以包括任何合适的导电材料。合适的源极材料和漏极材料的实例包括钴、硅化钴、镍、硅化镍、铝、钨、铜、钛、钼、氧化铟锡(ITO)、氧化铟锌、金、铂、碳等。
导电通道16可以是纳米结构,其具有至少一个纳米级尺寸(dimension)(范围从1nm至小于1μm)。在一个实例中,至少一个尺寸是指最大的尺寸。
导电通道16也可以具有任何合适的几何形状,例如管状结构、导线结构、平面结构等,并且可以是任何合适的半导体材料或导电材料。作为实例,导电通道16可以选自由半导体纳米结构、石墨烯纳米结构、金属纳米结构、导电聚合物纳米结构或分子线组成的组。在一些实例中,纳米结构可以是多壁纳米管或单壁纳米管、纳米线、纳米带等。作为具体的实例,纳米结构可以是碳纳米管、单壁碳纳米管、硅纳米线、硅纳米管、聚合物纳米线、石墨烯纳米带、MoS
在系统10、10’中,带电荷的分子18、18’被共价地或非共价地附接至电荷传感器11、11’的导电通道16。带电荷的分子18、18’可以直接结合至导电通道16,或者可以通过系链被间接地结合至导电通道16。带电荷的分子18、18’的附接将带电荷的分子18、18’保持在导电通道16的附近,例如在几个德拜长度内。可以使用任何合适的带电荷的分子18、18’,其可以经历与标记的核苷酸26的靶标记24的可逆结合。更具体地,带电荷的分子18、18’包括能够可逆地结合至标记24的识别位点28,具有与未结合的电荷配置相关的未结合的有利构象A(参见图1A和图1B的每一个中的顶部部分(标记为(i)),并且当识别位点28结合至标记24时,具有与电荷配置相关的有利构象B(参见图1A和图1B的每一个中的底部部分(标记为(ii))。
术语“未结合的有利构象”是指当标记24未结合到带电荷的分子18、18’上时,由带电荷的分子18、18’优先呈现的一种空间排列。当标记24未被结合时,带电荷的分子18、18’可以在若干种不同的构象之间动态地移动。然而,带电荷的分子18、18’具有优选的空间排列,当靶标记24未被结合时,该空间排列比其他空间排列更经常呈现。在该实例中,这种优选的空间排列(或优先地呈现的空间排列)是最可能的排列,例如,由于分子稳定性和/或处于其最低能量状态,并且因此是未结合的有利构象A。在一些情况下,未结合的有利构象A可以是最稳定的构象和/或最低能量构象。
未结合的有利构象A与未结合的电荷配置相关联。未结合的电荷配置是带电荷的分子18、18’在其处于其未结合的有利构象A时的电荷分布。
术语“有利的构象”是指当标记24与带电荷的分子18、18’可逆地结合时,由带电荷的分子18、18’优先呈现的一种空间排列。带电荷的分子18、18’的有利构象B不同于未结合的有利构象A。当靶分子结合至带电荷的分子18、18’时,带电荷的分子18、18’移动到优选的空间排列,当靶标记被结合时,该优选的空间排列比其他空间排列更经常呈现。在该实例中,当靶标记被结合时,这种优选的空间排列是最可能的排列,例如由于分子稳定性,并且因此是有利的构象。在一个实例中,带电荷的分子18、18’具有多种处于平衡的构象,并且标记24能够使构象之一稳定。
有利的构象B与电荷配置相关联。电荷配置是带电荷的分子18、18’在其处于其有利的构象B时的电荷分布。与有利的构象B相关的电荷配置可检测地不同于未结合的电荷配置。电荷配置可以(通过电荷传感器)检测为增加或减少的量值,或者频率的变化等。
如所提及的,标记的核苷酸26的标记24能够可逆地结合至识别位点28。因此,识别位点28是标记24的临时受体。
图1A和图1B的顶部部分(标记为(i))示出了处于未结合的有利构象A的带电荷的分子18、18’。如本文所提及的,未结合的有利构象A是指当识别位点28不具有结合于其上的标记24时带电荷的分子18、18’的优选的取向或空间排列。未结合的构象A(在图1A和图1B中的(i)处示出)与未结合的电荷配置相关联。未结合的电荷配置是带电荷的分子18、18’在其处于其未结合的有利构象A时的电荷分布。在图1A和图1B中,电荷分布的质心被示出为“·”,并且电荷质心和导电通道16的表面之间的距离被示出为“δ
图1A和图1B的底部部分(标记为(ii))示出了处于有利的构象B的带电荷的分子18、18’,即当靶标记24结合至识别位点28时。如本文所提及的,有利的构象B(在图1A和图1B中的(ii)处示出)是指当标记24结合至识别位点28时,带电荷的分子18、18’的优选的取向或空间排列。有利的构象B与电荷配置相关联。电荷配置是带电荷的分子18、18’在其处于其有利的构象B时的电荷分布。在图1A(ii)中,当与未结合的有利构象A相比时,带电荷的分子18的有利构象B使带电荷的分子18更靠近导电通道16的表面移动。在有利构象B的该实例中,δ
带电荷的分子18、18’可以是带电荷的适体、带电荷的蛋白质或带电荷的肽。如本文所使用的,术语“带电荷的适体”是指结构化的和带电荷的核酸,其能够:1)可逆地结合至标记,和2)在可逆地结合至标记时,改变其有利的构象,并且从而改变电荷的分布;术语“带电荷的蛋白质”是指结构化的和带电荷的大分子,其能够:1)可逆地结合至标记,和2)在可逆地结合至标记时,改变其有利的构象,并且从而改变电荷的分布;并且术语“带电荷的肽”是指通过肽(酰胺)键连接的氨基酸单体的结构化的和带电荷的短链:1)可逆地结合至标记,和2)在可逆地结合至标记时,改变其有利的构象,并且从而改变电荷的分布。
在一些实例中,带电荷的分子18,18’带负电荷。合适的带负电荷的分子18、18’的实例包括带负电荷的适体、带负电荷的蛋白质、带负电荷的肽和其他带负电荷的分子。带负电荷的适体的一些具体实例包括DNA适体、RNA适体或其类似物。带负电荷的蛋白质的一些具体实例包括HSF1(-17)、SHFM1(-21)、NFKBIA(-25)、RBBP4(-26)、APP(-55)、PJA2(-87)和许多其他。带负电荷的肽的实例包括聚谷氨酸盐和聚天冬氨酸盐,以及更结构化的肽,诸如具有带负电荷的表面的卷曲螺旋。
在一些实例中,带电荷的分子带正电荷。合适的带正电荷的分子18、18’的实例包括带正电荷的适体、带正电荷的蛋白质、带正电荷的肽和其他带正电荷的分子。带正电荷的蛋白质的一些具体实例包括H2AFX(+17)、PARP1(+21)、ELN(+40)、TERT(+98)和许多其他。带正电荷的肽的实例包括聚赖氨酸和聚精氨酸,以及更结构化的肽,诸如具有带正电荷的表面的卷曲螺旋。
在实例中,带电荷的分子18、18’不是聚合酶。
带电荷的分子18、18’可以直接地或间接地和/或通过共价键或非共价键被附接至电荷传感器11、11’的导电通道16。在带电荷的分子18、18’和导电通道16之间形成的键的类型将取决于所使用的分子18、18’和通道16。当适体被用作带电荷的分子18、18’时,导电通道16可以被硅烷化以生成胺封端的硅烷,该胺封端的硅烷可以与硫醇化的适体结合。可以用于结合带电荷的分子18、18’的合适的表面化学的其他实例可以包括(1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐)(EDC)、二芳基环辛炔(DBCO)、可以经历铜催化的点击反应的叠氮化物等。在其他实例中,系链可以用于将带电荷的分子18、18’附接至导电通道16。该系链可以是本文针对系链22描述的任何实例。
在图1A所示的实例中,聚合酶20被固定在电荷传感器11、11’的导电通道16上。在图1B所示的实例中,聚合酶20被固定在带电荷的分子18’上。在其他实例中,聚合酶20被固定在电极12或14之一上(参见图7B)。在还其他实例中,聚合酶20被固定在基底上,例如该基底支撑电荷传感器11、11’(参见图7B)。在任何情况下,聚合酶20可以通过系链22固定。系链22用作聚合酶20的锚(anchor)。合适的系链22的实例包括聚乙二醇(PEG)。在一些实例中,系链22保持聚合酶20远离导电通道16或远离带电荷的分子18至少10nm。例如,这可能是期望的,使得聚合酶20的保形变化、聚合酶20的电荷和/或由聚合酶20保持的靶/模板多核苷酸链的电荷不会干扰电荷传感器11、11’的感测操作。
可以使用任何合适的聚合酶20。实例包括来自家族A的聚合酶,诸如Bsu聚合酶、Bst聚合酶、Taq聚合酶、T7聚合酶,和许多其他聚合酶;来自家族B的聚合酶,诸如Phi29聚合酶、Pfu聚合酶、KOD聚合酶,和许多其他聚合酶;来自家族C的聚合酶,诸如大肠杆菌DNA PolIII,和许多其他聚合酶;来自家族D的聚合酶,诸如极端嗜热菌(Pyrococcus furiosus)DNAPol II,和许多其他聚合酶;来自家族X的聚合酶,诸如DNA Polμ、DNA Polβ、DNA Polσ,和许多其他聚合酶。
应当理解,由于靶标记24与带电荷的分子18、18’结合,聚合酶20没有被释放。而是,当结合事件发生时和在结合事件发生后,聚合酶20保持拴系,例如,拴系到通道16或带电荷的分子18、18’或一些其他流动池部件。
在本文公开的一些实例中,带电荷的分子18、18’和聚合酶20是具有不同角色/功能的不同(分离的且有区别的)实体,它们一起能够实现单分子感测。在单分子感测的实例中,当核苷酸被掺入到沿着模板链形成的新生链中时,在电荷传感器11、11’处检测到信号。在一个示例性的核苷酸掺入事件中,聚合酶20保持模板多核苷酸链,并将一个核苷酸掺入到与沿着模板的核苷酸互补的新生链中,同时带电荷的分子18、18’可逆地结合标记(其附接至被掺入的核苷酸),并经历构象变化,该构象变化在电荷传感器11、11’处产生可鉴定的信号。如本文所提及的,在一些实例中,可能期望配置聚合酶20(例如,通过调节系链22的长度),使得聚合酶20的任何构象变化都不干扰由带电荷的分子18、18’的构象变化产生的信号。
如图1A(ii)和图1B(ii)所示,标记的核苷酸26被引入到感测系统10、10’中。标记的核苷酸26包括核苷酸30、附接至核苷酸30的磷酸基团的连接分子32和附接至连接分子32的识别位点特异性标记24(也被称为标记24或靶标记24)。标记的核苷酸26可以被认为是非天然的或合成的核苷酸,因为它在结构上或化学上不同于天然核苷酸。
标记的核苷酸26的核苷酸30可以是天然核苷酸。天然核苷酸包括含氮杂环碱基、糖和一个或更多个磷酸基团。天然核苷酸的实例包括,例如,核糖核苷酸或脱氧核糖核苷酸。在核糖核苷酸中,糖是核糖,并且在脱氧核糖核苷酸中,糖是脱氧核糖(即,缺乏在核糖中的2’位存在的羟基基团的糖)。在实例中,核苷酸30是呈多磷酸盐形式,因为它包括若干个磷酸基团(例如,三磷酸盐(即,γ磷酸盐)、四磷酸盐、五磷酸盐、六磷酸盐(如图5所示)等)。杂环碱基(即核碱基)可以是嘌呤碱基或嘧啶碱基或任何其他核碱基类似物。嘌呤碱基包括腺嘌呤(A)和鸟嘌呤(G)及其修饰的衍生物或类似物。嘧啶碱基包括胞嘧啶(C)、胸腺嘧啶(T)和尿嘧啶(U)及其修饰的衍生物或类似物。脱氧核糖的C-1原子与嘧啶的N-1或嘌呤的N-9结合。
标记的核苷酸26还包括连接分子32。连接分子32可以是任何长链分子,其在一端可以化学键合至核苷酸30的磷酸基团并且在另一端可以化学键合至标记24。连接分子32也可以被选择成使得它将不与聚合酶20相互作用。连接分子32被选择成使得其足够长以允许标记24与带电荷的分子18、18’的识别位点28缔合,同时例如核苷酸30被聚合酶20保持。
作为实例,连接分子32可以包括烷基链、聚(乙二醇)链、酰氨基基团、磷酸基团、杂环诸如三唑、核苷酸或其组合。烷基链的实例可以包括至少6个碳原子,并且聚(乙二醇)链的实例可以包括至少3个乙二醇单元。
以下实例说明了标记的核苷酸26的实例,其中连接分子32包括烷基链、酰胺基团、聚(乙二醇)链和三唑:
以下实例说明了标记的核苷酸26的另一个实例,其中连接分子32包括烷基链、酰胺基团、聚(乙二醇)链、三唑和磷酸基团:
以下实例说明了标记的核苷酸26的又一个实例,其中连接分子32包括烷基链、酰胺基团、聚(乙二醇)链、三唑和磷酸基团:
以下实例说明了标记的核苷酸26的又一个实例,其中连接分子32包括烷基链、酰胺基团、聚(乙二醇)链、三唑、磷酸基团和多核苷酸链:
虽然已经描述了若干个示例性的连接分子32,但应当理解,可以使用其他连接分子32。
识别位点特异性标记24是可以被带电荷的分子18、18’识别并且可以在识别位点28处可逆地结合至带电荷的分子18、18’的分子。合适的识别位点特异性标记24的实例包括抗生素,诸如卡那霉素、利维霉素、妥布霉素、新霉素、紫霉素、链霉素等;酶辅因子,诸如FMN、NAD、维生素B12、呫吨等;氨基酸,诸如精氨酸、瓜氨酸、精氨酸酰胺、缬氨酸、异亮氨酸、色氨酸等;和许多杂类小分子,诸如茶碱、多巴胺、硫罗丹明、纤维二糖等。
图1A和图1B图示出了带电荷的分子18、18’的实例,所述带电荷的分子18、18’能够结合至一个标记的核苷酸26的一个靶标记24。在其他实例中,一个标记的核苷酸26可以包括多个标记24,其可以结合至单个带电荷的分子18、18’(图2),或者一个带电荷的分子18、18’可以包括多个识别位点28,每个识别位点可以结合至相应核苷酸的相应标记24(图3A至图3E)。
在图2中,带电荷的分子18’包括可逆地附接标记的核苷酸26’的第一标记24的第一识别位点28A,并且还包括可逆地附接标记的核苷酸26’的第二标记24’的第二识别位点28B。该实例包括三种不同的构象变化—一种是当单独的第一标记24被结合时,另一种是当单独的第二标记24’被结合时,以及还有一种是当标记24、24’两者同时被结合时。在图2中,带电荷的分子18’的特定构象变化通过将两个不同的标记24、24’结合至两个不同的识别位点28A、28B来实现。如所图示的,一个标记的核苷酸26’包括标记24和24’两者,并且这些标记24、24’通过相应的连接分子32和32’被附接至一个核苷酸30。标记24和连接分子32的任何实例都可以用于标记的核苷酸26’的该实例中,只要标记24和24’彼此不同,并且可以被带电荷的分子18’的识别位点28A和28B分别或同时识别。在所示出的实例中,当标记24、24’两者都被结合时,带电荷的分子18’处于其修饰的构象B之一,并且产生可检测的信号。
虽然在图2中示出了带有附接至其上的聚合酶20的带电荷的分子18’,但应当理解,带电荷的分子18和单独附接的聚合酶20可以用于图2所示的实例中。
在附图中未示出的还另一个实例中,带电荷的分子18、18’包括两个识别位点(例如,28A、28B),其中任一个可以结合到附接至核苷酸30的单个标记24上。该实例包括两种不同的有利构象变化—一种是当标记24结合至第一识别位点28A时,并且另一种是当标记24结合至第二识别位点28B时。
在图3A至图3E中,带电荷的分子18’包括四个不同的识别位点28A、28B、28C、28D,每个识别位点能够可逆地结合至不同的标记的核苷酸26A、26B、26C、26D的不同靶标记24A、24B、24C、24D。虽然在图3A至图3E中示出了带有附接至其上的聚合酶20的带电荷的分子18’,但是应当理解,带电荷的分子18和单独附接的聚合酶20可以用于图3A至图3E所示的实例中。
在该实例中,如图3A所示,带电荷的分子18’包括可逆地附接第一标记的核苷酸26A的第一标记24A的第一识别位点28A,并且当第一识别位点28A结合至第一标记24A时,具有与第一电荷配置相关的第一有利构象B
带电荷的分子18’的未结合的有利构象A在图3E中示出。如所描绘的,当第一识别位点28A、第二识别位点28B、第三识别位点28C和第四识别位点28C中的每一个都未被结合时(即,没有标记的核苷酸26A-26D结合至位点28A-28D),发生该实例的未结合的有利构象A(其与未结合的电荷配置相关联)。未结合的有利构象A的电荷分布的质心距导电通道16的表面具有设定的距离δ
在图3A所示的实例中,标记的核苷酸26A包括作为核苷酸30A的鸟嘌呤多磷酸盐、接头32A和独特的标记24A。当聚合酶20掺入核苷酸30A时,标记24A的有效浓度在带电荷的分子18’(其具有标记24A的识别位点24A)的附近有效地增加,导致带电荷的分子18’结合标记24A。在图3A所示的实例中,结合导致电荷质心和通道表面之间的距离δ
在图3B所示的实例中,标记的核苷酸26B包括作为核苷酸30B的腺嘌呤多磷酸盐、接头32B和独特的标记24B。当聚合酶20掺入核苷酸30B时,标记24B的有效浓度在带电荷的分子18’(其具有标记24A的识别位点24B)的附近有效地增加,导致带电荷的分子18’结合标记24B。在图3B所示的实例中,结合导致电荷质心和通道表面之间的距离δ
在图3C所示的实例中,标记的核苷酸26C包括作为核苷酸30C的胞嘧啶多磷酸盐、接头32C和独特的标记24C。当聚合酶20掺入核苷酸30C时,标记24C的有效浓度在带电荷的分子18’(其具有标记24C的识别位点24C)的附近有效地增加,导致带电荷的分子18’结合标记24C。在图3C所示的实例中,结合导致电荷质心和通道表面之间的距离δ
在图3D所示的实例中,标记的核苷酸26D包括作为核苷酸30D的胸腺嘧啶多磷酸盐、接头32D和独特的标记24D。当聚合酶20掺入核苷酸30D时,标记24D的有效浓度在带电荷的分子18’(其具有标记24D的识别位点24D)附近有效地增加,导致带电荷的分子18’结合标记24D。在图3D所示的实例中,结合导致电荷质心和通道表面之间的距离δ
在图3A至图3E所示的实例中,一个带电荷的分子18’具有四个不同的识别位点28A-28D,并且因此具有四种不同的修饰的配置,其导致四种不同且有区别的可测量信号。这些不同且有区别的信号使得四种不同的核苷酸30A-30D能够被鉴定,因为它们分别被并入到模板链中。
多识别位点的带电荷的分子的其他变型也被预期。例如,两个带电荷的分子18、18’,每个具有两个不同的识别位点28,可以被附接至电荷传感器11、11’的导电通道16。对于这些带电荷的分子18、18’中的每一个,当两个不同的识别位点保持未结合时,未结合的有利构象A将被呈现。在该实例中,两个带电荷的分子18、18’中的第一个包括可逆地附接第一标记的核苷酸(例如,图3A中的26A)的第一标记(例如,图3A中的24A)的第一识别位点(例如,图3A中的28A),并且当第一识别位点结合至第一标记时,具有与第一电荷配置相关联的第一有利构象(例如,图3A中的B
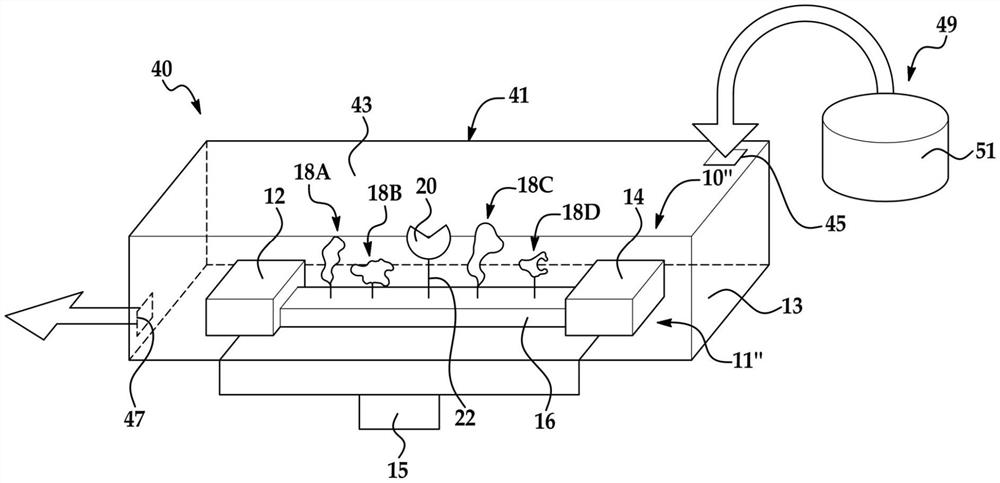
在还其他实例中,感测系统10、10’可以包括附接至电荷传感器11、11’的导电通道16的若干个带电荷的分子18、18’。在一个实例中,每个带电荷的分子18、18’能够可逆地结合至不同的标记的核苷酸26。该感测系统10”的实例在图4中示出。
在该实例中,四个不同的带电荷的分子18A、18B、18C、18D被附接至电荷传感器11”的导电通道16。在该实例中,每个带电荷的分子18A、18B、18C、18D都具有其自己的识别位点、未结合的有利构象和独立于每个其他带电荷的分子18A、18B、18C、18D的有利构象(在标记结合期间)。更具体地,附接至导电通道16的第一带电荷的分子18A包括可逆地结合第一标记的核苷酸的第一标记的第一识别位点、当第一识别位点未被结合时的未结合的有利构象、以及当第一识别位点被结合至第一标记时具有电荷配置的有利构象。在该实例中,附接至导电通道16的第二带电荷的分子18B包括可逆地结合第二标记的核苷酸的第二标记的第二识别位点、第二带电荷的分子的未结合的有利构象、以及当第二识别位点结合至第二标记时具有第二带电荷的分子的电荷配置的第二带电荷的分子的有利构象。同样在该实例中,附接至导电通道16的第三带电荷的分子18C包括可逆地结合第三标记的核苷酸的第三标记的第三识别位点、第三带电荷的分子的未结合的有利构象、以及当第三识别位点结合至第三标记时具有第三带电荷的分子的电荷配置的第三带电荷的分子的有利构象。同样在该实例中,附接至导电通道16的第四带电荷的分子18D包括可逆地结合第四标记的核苷酸的第四标记的第四识别位点、第四带电荷的分子的未结合的有利构象、以及当第四识别位点结合至第四标记时具有第四带电荷的分子的电荷配置的第四带电荷的分子的有利构象。
如图4所示,单个聚合酶20可以结合至导电通道16。在该实例中,可以选择相应的标记的核苷酸26的每个连接分子32的长度,使得当相应的核苷酸30被聚合酶20保持时,相应的标记24可以与其对应的带电荷的分子18A、18B、18C、18D结合,而不与相邻的带电荷的分子18A、18B、18C、18D结合。
图4还图示出了感测设备40的实例。图4所示的感测设备40的实例包括流动池41和被集成到流动池41中的感测系统10”。应当理解,感测系统10、10’、10”的任何实例都可以用于感测设备40中。
流动池41是包含感测系统10”的容器。应当理解,其他容器,诸如孔(well)、管、通道、透明小容器(cuvette)、培养皿、瓶等可以可选地包含感测系统10”。循环工艺,诸如核酸测序反应,特别良好地适合于流动池41。
示例性的流动池41包括基底/支撑物13和直接或间接地结合到其上或与其一体形成的盖43。流动池41可以包括流体入口45和流体出口47,所述流体入口45和流体出口47使得能够将散装试剂(bulk reagent)递送至流动池41内包含的一个感测系统10”或感测系统10”的阵列。任何单独的流动池41可以包括数十个、数百个、数千个、数百万个甚至数十亿个单独可寻址的和可读的感测系统10、10’、10”。
图7A和图7B中所示的实例是包括感测系统10、10’、10”的阵列的流动池41’的一个实例。该阵列可以包括若干个感测系统10、10’、10”,每个感测系统被定位在基底上并且配置有电子电路,使得它是单独可寻址和可读的。在实例中,阵列的每个感测系统10、10’、10”可以在单独的凹陷部中被定位在基底上。凹陷部在物理上将每个感测系统10、10’、10”分开。
在图7A的实例中,流动池41’包括流动通道52。虽然示出了若干个流动通道52,但应当理解,在流动池41’中可以包括任何数量的通道52(例如,单个通道52、四个通道52等)。每个流动通道52是界定在两个结合的部件(例如,基底和盖或两个基底)之间的区域,其可以具有被引入到其中并从其中移除的流体(例如,本文描述的那些流体)。每个流动通道52可以与每个其他流动通道52隔离,使得引入到任何特定的流动通道52中的流体不流入任何相邻的流动通道52中。引入到流动通道52中的流体的一些实例可以引入反应组分(例如,标记的核苷酸26等)、洗涤溶液等。
流动池41’的流动通道52内的架构的实例在图7B中示出。在图7B所示的实例中,流动池41’包括基底13,基底13包括支撑物54和定位在支撑物54上的图案化的材料56。图案化的材料56界定由间隙区域60分隔开的凹陷部58。在该实例中,支撑物54的表面暴露在每个凹陷部58处,并且感测系统10、10’、10”被定位在每个凹陷部58内。
图7B中的支撑物54为流动池41’的其他部件提供支撑。支撑物54通常是刚性的,并且不溶于水性液体。合适的支撑物54的实例包括环氧硅氧烷、玻璃、改性玻璃、塑料、尼龙、陶瓷/陶瓷氧化物、二氧化硅(氧化硅(SiO
支撑物54的形式可以是晶片、面板、矩形片材、管芯(die)或任何其他合适的配置。在实例中,支撑物54可以是具有在从约2mm至约300mm范围的直径的圆形晶片或面板。作为更具体的实例,支撑物54是具有在从约200mm至约300mm范围内的直径的晶片。在另一个实例中,支撑物54可以是其最大尺寸高达约10英尺(~3米)的矩形片材或面板。作为具体的实例,支撑物54是具有在从约0.1mm至约10mm的范围内的宽度的管芯。虽然已经提供了示例性的尺寸,但应当理解,可以使用具有任何合适的尺寸的支撑物54。
在图7B所示的实例中,图案化的材料56被定位在支撑物54上。应当理解,可以选择性沉积或沉积并图案化以形成凹陷部58和间隙区域60的任何材料都可以用于图案化的材料56。
作为一个实例,无机氧化物可以通过气相沉积、气溶胶印刷或喷墨印刷被选择性地施加到支撑物66上。合适的无机氧化物的实例包括氧化钽(例如,Ta
作为另一个实例,树脂可以被施加到支撑物54上,并且然后被图案化。合适的沉积技术包括化学气相沉积、浸涂、浸渍涂布、旋涂、喷涂、水坑分配、超声喷涂、刮刀涂布、气溶胶印刷、丝网印刷、微接触印刷等。合适的图案化技术包括光刻、纳米压印光刻(NIL)、冲压技术、压花技术、模制技术、微蚀刻技术、印刷技术等。合适的树脂的一些实例包括多面体低聚倍半硅氧烷树脂(POSS)基树脂、非POSS环氧树脂、聚(乙二醇)树脂、聚醚树脂(例如开环环氧树脂)、丙烯酸树脂、丙烯酸酯树脂、甲基丙烯酸酯树脂、无定形含氟聚合物树脂(例如来自Bellex的
如本文中所使用的,术语“多面体低聚倍半硅氧烷”(POSS)是指作为在二氧化硅(SiO
单体单元可以具有带有10个硅原子和10个R基团的笼状结构,其被称为T
如图7B所示,图案化的材料56包括在其中界定的凹陷部58和分隔相邻的凹陷部58的间隙区域60。凹陷部58的许多不同布局可以被预期,包括规则的图案、重复的图案和不规则的图案。在实例中,凹陷部58被布置成六边形网格,用于紧密填充和提高的密度。其他布局可以包括例如直线(矩形)布局、三角形布局等。在一些实例中,布局或图案可以是成行和列的凹陷部58的x-y格式。在一些其他实例中,布局或图案可以是凹陷部58和/或间隙区域60的重复布置。在还其他实例中,布局或图案可以是凹陷部58和/或间隙区域60的随机布置。图案可以包括点(spot)、垫、孔、柱、条纹、漩涡、线、三角形、矩形、圆形、弧形、小方格、格子、对角线、箭头、正方形和/或交叉影线。
凹陷部58的布局或图案可以相对于界定的区域中凹陷部58的密度(凹陷部58的数量)来表征。例如,凹陷部58可以以约200万/mm
凹陷部58的布局或图案也可以或可选地根据平均间距或从凹陷部58的中心到相邻凹陷部58的中心的间隔(中心到中心的间隔)或从一个凹陷部58的边缘到相邻凹陷部58的边缘的间隔(边缘到边缘的间隔)来表征。图案可以是规则的,使得围绕平均间距的变化系数较小,或者图案可以是非规则的,在这种情况下,变化系数可以相对较大。在任一种情况下,平均间距可以是例如约50nm、约0.1μm、约0.5μm、约1μm、约5μm、约10μm、约100μm或更大或更小。凹陷部58的特定图案的平均间距可以在选自上述范围的较低值之一和较高值之一之间。在实例中,凹陷部58具有约1.5μm的间距(中心到中心的间隔)。虽然已经提供了示例性的平均间距值,但应当理解,可以使用其他平均间距值。
每个凹陷部58的尺寸可以由其体积、深度和/或直径来表征。
每个凹陷部58可以具有能够限制流体的任何体积。可以选择最小或最大体积,例如,以适应预期用于流动池41’的下游用途的通过量(例如,多重性(multiplexity))、分离度(resolution)、标记的核苷酸26或分析物反应性。例如,体积可以是至少约1×10
每个凹陷部58的深度可以足够大以容纳一个感测系统10、10’、10”。在实例中,深度可以是至少约1μm、至少约10μm、至少约100μm或更大。可选地或另外地,深度可以为至多约1×10
在一些情况下,每个凹陷部58的直径或长度和宽度可以是至少约50nm、至少约0.1μm、至少约0.5μm、至少约1μm、至少约10μm、至少约100μm或更大。可选地或另外地,直径或长度和宽度可以是至多约1×10
如图7B所示,阵列中的每个凹陷部58包括相应的电荷传感器11、11’、11”。期望每个凹陷部58中的每个电荷传感器11、11’、11”具有一个附接至其上的带电荷的分子18、18’,并且具有一个附接在其附近的聚合酶20。在一些实例中,每个凹陷部58在其中具有一个电荷传感器11、11’、11”,一个带电荷的分子18、18和一个聚合酶20。在其他实例中,一些凹陷部58在其中具有一个电荷传感器11、11’、11”,一个带电荷的分子18、18和一个聚合酶20;而其他凹陷部58在其中具有一个电荷传感器11、11’、11”,一个带电荷的分子18、18和多于一个的聚合酶20;并且还有的其他凹陷部58具有一个电荷传感器11、11’、11”,一个带电荷的分子18、18,并且其中没有聚合酶20。在这些实例中,在任何给定的凹陷部58内变得附接的聚合酶20的数量可以是随机的,并且由泊松分布来确定。
在一些实例中,具有附接在其上的带电荷的分子18、18’的电荷传感器11、11’、11”可以被预先组装在凹陷部58中。为了将聚合酶20附接在相应的凹陷部58内,可以将含有聚合酶20的流体引入到流动池41’的每个泳道(lane)52中。聚合酶20可以包括附接在凹陷部58内的系链22,或者接头22可以预先附接在凹陷部58内,并且聚合酶20可以附接至接头22。可以允许流体孵育持续期望的时间并且在允许聚合酶20附接的期望的温度孵育。
如图7B中所描绘的,聚合酶20可以附接至流动池41’内的任何部件和/或任何表面上。在一些实例中,聚合酶20附接至电极12或14、基底13的表面(例如,凹陷部58的底部、凹陷部58的侧壁等)、导电通道16上、带电荷的分子18、18’上,等等。
电荷传感器11、11’、11”中的每一个都是单独可电寻址的和可读的。因此,由在每个凹陷部58内发生的带电荷的分子构象变化产生的信号可以被单独地检测和分析。
感测设备40的任何实例还可以包括试剂递送系统49,以选择性地将试剂引入到流动池41的输入端(例如,流体入口45)或流动池41’的泳道52,越过感测系统10、10’、10”,并且然后从流体出口47流出。试剂递送系统49可以包括可以永久地或可移除地附接至流体入口45的管道或其他流体(fluidics)。试剂递送系统49可以包括样品容器51。试剂(包括待被引入到感测系统10”中的标记的核苷酸26的任何实例)可以储存在样品容器中,或者就在使用前制备并引入到样品容器中。试剂递送系统49还可以包括泵或其他合适的设备,以从样品容器51中取回试剂并将其递送至流体入口45。在其他实例中,样品容器51被定位成使得试剂可以通过重力流动到流体入口45,越过感测系统10”,并从流体出口47流出。
当使用感测系统10、10’、10”和感测设备40时,流动池41、41’中的电荷传感器11、11’、11”也可以可操作地连接至检测器15,以检测电荷传感器11、11’、11”的电导变化。
本文公开的感测系统10、10’、10”可以用于感测方法中。该方法的实例在图5中示意性地示出。该方法包括:
将模板多核苷酸链48引入到感测系统10、10’、10”中,所述感测系统10、10’、10”包括:电荷传感器11、11’、11”,其包括两个电极12、14和连接两个电极12、14的导电通道16;附接至导电通道16的带电荷的分子18、18’,其中带电荷的分子18、18’包括识别位点28;和附接至导电通道16或带电荷的分子18、18’的聚合酶20;
将包括标记的核苷酸26的试剂引入到感测系统10、10’、10”中,由此标记的核苷酸26之一的核苷酸30与聚合酶20缔合,并且标记的核苷酸26之一的识别位点特异性标记24与识别位点28缔合,以诱导带电荷的分子18、18’的构象变化;和
响应于带电荷的分子18、18’的构象变化,检测电荷传感器11、11’、11”的响应。
模板多核苷酸链48可以是任何待被测序的样品,并且可以包含DNA、RNA或其类似物(例如,肽核酸)。模板(或靶)多核苷酸链48的来源可以是基因组DNA、信使RNA或来自天然来源的其他核酸。在一些情况下,源自这样的来源的模板多核苷酸链48可以在用于本文的方法或系统40之前被扩增。可以使用多种已知的扩增技术中的任何一种,包括但不限于聚合酶链反应(PCR)、滚环扩增(RCA)、多重置换扩增(MDA)或重组酶聚合酶扩增(RPA)。应当理解,在用于本文阐述的方法或系统40之前,模板多核苷酸链48的扩增是任选的。因此,在一些实施例中,模板多核苷酸链48在使用前将不被扩增。模板/靶多核苷酸链48可以任选地来源于合成文库。合成的核酸可以具有天然的DNA或RNA组成,或者可以是其类似物。
可以从其衍生模板多核苷酸链48的生物样品包括例如来自以下的生物样品:哺乳动物,诸如啮齿动物、小鼠、大鼠、兔、豚鼠、有蹄动物、马、绵羊、猪、山羊、牛、猫、狗、灵长类动物、人类或非人类灵长类动物;植物诸如拟南芥(Arabidopsis thaliana)、玉米、高粱、燕麦、小麦、水稻、油菜或大豆;藻类,诸如莱茵衣藻(Chlamydomonas reinhardtii);线虫,诸如秀丽线虫(Caenorhabditis elegans);昆虫,诸如黑腹果蝇(Drosophilamelanogaster)、蚊子、果蝇、蜜蜂或蜘蛛;鱼,诸如斑马鱼;爬行动物;两栖动物,诸如青蛙或非洲爪蟾(Xenopus laevis);盘基网柄菌(dictyostelium discoideum);真菌,诸如卡氏肺孢子虫(pneumocystis carinii)、红鳍东方鲀(Takifugu rubripes)、酵母、酿酒酵母(Saccharamoyces cerevisiae)或粟酒裂殖酵母(Schizosaccharomyces pombe);或恶性疟原虫。模板多核苷酸链48也可以来源于原核生物,诸如细菌、大肠杆菌(Escherichiacoli)、葡萄球菌(staphylococci)或肺炎支原体(mycoplasma pneumoniae);古细菌;病毒,诸如丙型肝炎病毒、埃博拉病毒或人类免疫缺陷病毒;或类病毒。模板多核苷酸链48可以来源于上述生物体的同质培养物或群体,或者可选地来源于例如群落或生态系统中的若干种不同生物体的集合。
此外,模板多核苷酸链48可能不来自天然来源,而是可以使用已知的技术来合成。例如,基因表达探针或基因分型探针可以被合成并用于本文阐述的实例中。
在一些实例中,模板多核苷酸链48可以作为一个或更多个较大核酸的片段获得。可以使用本领域中已知的多种技术中的任何一种进行片段化(fragmentation),包括例如雾化、声处理、化学切割、酶促切割或物理剪切。片段化也可以由于使用特定的扩增技术而产生,所述特定的扩增技术通过仅复制较大的核酸链的一部分来产生扩增子。例如,PCR扩增产生这样的片段,所述片段具有由原始模板上的核苷酸序列的长度确定的大小,所述原始模板在扩增期间侧翼引物杂交的位置之间。模板多核苷酸链48的长度可以根据核苷酸的数量或根据度量长度(例如,纳米)。
模板/靶多核苷酸链48或其扩增子的群体可以具有平均链长度,该平均链长度对于本文阐述的方法或系统40的特定应用是期望的或合适的。例如,平均链长度可以小于约100,000个核苷酸、约50,000个核苷酸、约10,000个核苷酸、约5,000个核苷酸、约1,000个核苷酸、约500个核苷酸、约100个核苷酸或约50个核苷酸。可选地或另外地,平均链长度可以大于约10个核苷酸、约50个核苷酸、约100个核苷酸、约500个核苷酸、约1,000个核苷酸、约5,000个核苷酸、约10,000个核苷酸、约50,000个核苷酸或约100,000个核苷酸。靶多核苷酸链48或其扩增子的群体的平均链长度可以在上文阐述的最大值和最小值之间的范围内。
在一些情况下,模板/靶多核苷酸链48的群体可以在一定条件下产生或以其他方式被配置为对其成员具有最大长度。例如,成员的最大长度可以小于约100,000个核苷酸、约50,000个核苷酸、约10,000个核苷酸、约5,000个核苷酸、约1,000个核苷酸、约500个核苷酸、约100个核苷酸或约50个核苷酸。可选地或另外地,模板多核苷酸链48或其扩增子的群体可以在一定条件下产生或以其他方式被配置为对其成员具有最小长度。例如,成员的最小长度可以大于约10个核苷酸、约50个核苷酸、约100个核苷酸、约500个核苷酸、约1,000个核苷酸、约5,000个核苷酸、约10,000个核苷酸、约50,000个核苷酸或约100,000个核苷酸。群体中模板多核苷酸链48的最大链长度和最小链长度可以在上文阐述的最大值和最小值之间的范围内。
如图5所示,引入到感测系统10(或10’,10”)中的模板多核苷酸链48可以由聚合酶20保持在适当的位置,在该实例中,聚合酶20被拴系至导电通道16。图5中所示的模板多核苷酸链48是DNA的模板链。模板多核苷酸链48可以与试剂诸如标记的核苷酸26一起引入到生物稳定的溶液中。生物稳定的溶液可以是任何适合于聚合酶碱基掺入反应诸如聚合酶链反应(PCR)或线性扩增的缓冲液。作为实例,生物稳定的溶液可以包括具有接近7的pH、高于几毫摩尔的盐浓度和毫摩尔浓度的Mg
同样如图5所示,标记的核苷酸26可以包括与模板多核苷酸链48的靶核酸互补的碱基。标记的核苷酸26将部分地通过聚合酶20保持在适当的位置,聚合酶20也结合至模板多核苷酸链48。作为实例,聚合酶20可以掺入特定的核苷酸30,核苷酸30可以保持持续在从几毫秒(例如2毫秒)到几百毫秒的范围的时间段。
标记的核苷酸26和聚合酶20之间的相互作用以及连接分子32的长度使得靶标记24能够在带电荷的分子18附近缔合。当感测系统10、10’、10”以阵列存在并且包括单独可寻址的和单独可读的电荷传感器11、11’、11”时,应当理解,一旦标记的核苷酸26与特定感测系统10、10’、10”的聚合酶20相互作用,连接分子32的长度也可以阻止任何单独的靶标记24与相邻的感测系统10、10’、10”缔合。
在一些实例中,靶标记24的缔合导致标记24的有效浓度增加,导致带电荷的分子18结合至靶标记24。带电荷的分子18可以在平衡时动态地改变其构象,并且在没有靶标记24的情况下,可以在一种特定构象(即,未结合的有利构象)中花费大部分时间。靶标记24的结合将导致带电荷的分子18移动到不同的有利构象(从未结合的有利构象)。结合期间的有利构象不同于未结合的有利构象(例如,在没有结合的标记24的情况下,由带电荷的分子18最能表现出的构象)。未结合的有利构象中的电荷分布不同于有利构象中的电荷分布(例如,当带电荷的分子18结合至标记24时)。带电荷的分子18的电荷分布的变化进而改变通道16中的电导。
电荷传感器11、11’、11”的响应可以指示标记的核苷酸26的掺入的碱基,这是因为靶标记24是核苷酸特异性的(即,针对特定的碱基选择特定的标记24),并且因为带电荷的分子18的识别位点28是标记特异性的。因此,该方法还可以包括将电荷传感器11、11’、11”的响应与相关的识别位点特异性标记24(即,已经改变带电荷的分子18的构象的标记24)相关联,并且基于相关的识别位点特异性标记24,鉴定相关的标记的核苷酸26(即,已经与聚合酶20和识别位点28相关联的标记的核苷酸26)的核苷酸(例如碱基)。
应当理解,可以调节带电荷的分子18、18’和标记24之间的结合速率和解离速率,使得产生独特的指纹信号。
对于具有慢解离速率的标记24,标记24将保持结合持续显著的持续时间,例如,在整个核苷酸掺入循环期间。这种扩展的结合将在流过电荷传感器11、11’的通道16的电流的DC水平中产生变化。这在图6A中示意性地示出,其中具有慢解离速率的不同标记24被用于四种不同的核苷酸,产生四种不同且有区别的可检测信号。这些信号可以通过具有四个不同识别位点28的单个带电荷的分子18、18’来检测;或者通过高达四个不同的带电荷的分子18、18’来检测,每个带电荷的分子18、18’具有标记特异性识别位点28;或者通过具有单个识别位点28的单个带电荷的分子18、18’来检测,所述单个识别位点28可以以不同的慢解离速率结合高达四种不同的核苷酸。
对于具有快的结合速率和解离速率的标记24,标记24可以在整个核苷酸掺入循环期间多次与带电荷的分子18、18’缔合/解离。这种快速的结合和解离结合将从电荷传感器11、11’产生类似颤动的信号(例如,DC水平、振幅、频率、百分位水平、特征分布等)。这在图6B中示意性地示出,其中具有快结合速率和解离速率的不同标记24被用于四种不同的核苷酸,产生四种不同且有区别的可检测信号。这些信号可以通过具有四个不同识别位点28的单个带电荷的分子18、18’来检测;或者通过高达四个不同的带电荷的分子18、18’来检测,每个带电荷的分子18、18’具有标记特异性识别位点28;或者通过具有单个识别位点28的单个带电荷的分子18、18’来检测,该单个识别位点28可以以不同的结合速率和解离速率结合一种直至四种不同的核苷酸。
也可以监测带电荷的分子18、18’的构象状态改变的频率。
电荷传感器响应的量值也可以不同。在一些实例中,识别位点28可逆地结合高达四种不同的标记的核苷酸26。当四种不同的标记的核苷酸26中的一种与聚合酶20和识别位点28缔合时,电荷传感器11、11’、11”的响应具有可以用于鉴定四种不同的标记的核苷酸26之一的不同量值。四种不同标记的核苷酸26中的每一种也可以具有不同的量值(例如,与其他四种不同标记的核苷酸26中的每一种相关联的量值不同的量值)。
在其他实例中,来自图6A和图6B的模态可以以某种形式组合。例如,在暴露于感测系统10、10’、10”的多个标记的核苷酸26中,可以使用具有慢结合速率和解离速率的一些标记24,并且可以使用具有快结合速率和解离速率的其他标记24。
作为本文所描述的掺入循环的结果,相关的标记的核苷酸26的碱基将被掺入到与模板多核苷酸链48杂交的新生链50中。当碱基被完全掺入并且新生链50的糖骨架被延伸时,核苷酸30和标记24之间的接头32被自然切割。这导致标记24的有效浓度降低回到背景水平。靶标记24解离,并且带电荷的分子18、18’返回到其未结合的(有时被称为“野生型”)构象,在该构象中,它优先地表现出有利的未结合构象。
本文公开的方法可以被重复持续期望数量的测序循环。
本文公开的标记的核苷酸26和感测系统10、10’、10”可以用于多种应用中的任何一种。如参考图5所描述的,特别有用的应用是核酸测序,例如合成测序(SBS)。在SBS中,监测核酸测序引物沿着模板核酸48的延伸,以确定模板中核苷酸的序列。潜在的化学过程可以是聚合(例如,如本文所描述的如由聚合酶20催化的)。在特定的基于聚合酶的SBS实例中,核苷酸(例如,碱基)以模板依赖性方式被添加到测序引物中(从而延伸测序引物),使得对被添加到引物中以形成新生链的核苷酸的顺序和类型的检测可以用于确定模板的序列。在阵列的不同感测系统10、10’、10”处的多个不同模板48可以经历SBS技术。在不同的模板48处发生的事件可以部分地由于阵列中特定感测系统10、10’、10”的位置而被区分。阵列中每个感测系统10、10’、10”的电荷传感器11、11’可以是单独可寻址的和可读的,并且因此可以检测每个传感器11、11’处的信号。
本文公开的标记的核苷酸26和感测系统10、10’、10”的其他合适的应用包括连接测序和杂交测序。
应当理解,前述概念和下面更详细地讨论的另外的概念的所有组合(条件是这样的概念不相互矛盾)被认为是本文公开的发明主题的一部分。特别地,出现在本公开内容末尾的所要求保护的主题的所有组合被认为是本文公开的发明主题的一部分。还应当理解,本文明确使用的也可能出现在通过引用并入的任何公开内容中的术语应当被赋予与本文公开的特定概念最一致的含义。
在整个说明书中对“一个实例”、“另一个实例”、“实例”等的提及意味着结合该实例描述的特定要素(例如,特征、结构和/或特性)被包括在本文描述的至少一个实例中,并且可以存在于其他实例中或可以不存在于其他实例中。此外,应当理解的是,在各种实例中,用于任何实例的所描述的要素可以以任何合适的方式组合,除非上下文清楚地另有规定。
在整个本公开内容包括权利要求中使用的术语“基本上”和“约”用于描述和说明小的波动,诸如由于加工中的变化。例如,它们可以指小于或等于±5%,诸如小于或等于±2%,诸如小于或等于±1%,诸如小于或等于±0.5%,诸如小于或等于±0.2%,诸如小于或等于±0.1%,诸如小于或等于±0.05%。
此外,应当理解,本文提供的范围包括所陈述的范围和所陈述的范围内的任何值或子范围,就好像它们被明确地叙述一样。例如,由从1nm至小于1μm表示的范围应被解释为不仅包括明确列举的从1nm至小于1μm的限值,而且还包括单独的值,诸如约15nm、22.5nm、45nm等,以及子范围,诸如从约20nm至约48nm等。
虽然已经详细地描述了若干个实例,但应当理解,可以修改所公开的实例。因此,前面的描述被认为是非限制性的。
- 线缆、线缆的形状感测系统、感测系统、线缆形状的感测方法
- 传感器管理单元、感测数据流通系统、感测数据评价方法和感测数据评价程序
