采用过继性T细胞免疫疗法治疗肿瘤患者的方法
文献发布时间:2023-06-19 10:48:02
技术领域
本发明涉及治疗肿瘤疾病的方法,在所述治疗肿瘤疾病的方法中使用的T细胞产品以及在所述治疗肿瘤疾病的方法中使用的试剂盒。
背景技术
采用T细胞的过继性细胞疗法(ACT)是肿瘤疾病治疗最有前景的进展之一。在过去的几十年中,ACT在肿瘤患者的个体治疗方面取得了显著成果。在这种细胞疗法中,使用人体自身的免疫细胞刺激患者的免疫系统,以提升抗原特异性的抗肿瘤效果。
使用针对肿瘤的T细胞(肿瘤反应性T细胞)在黑色素瘤患者中已经获得了临床相关的和长期缓解
TIL疗法已对患有化疗难治性癌症诸如转移性黑色素瘤、胆管癌、肾细胞癌、结直肠癌、宫颈癌和卵巢癌的患者显示出临床益处
多形性胶质母细胞瘤(GBM)是一种高级中枢神经系统(CNS)肿瘤,其5年生存率低于5%
现有的临床证据支持对TIL疗法用于治疗GBM做进一步的评价。1999年,一项试点研究表明,鞘内再灌注TIL联合白介素(IL)-2是安全的,并在5/6的复发性GBM患者中产生临床响应
如先前报道的,GBM来源的TIL能够被成功地分离,并且在与γ链细胞因子IL-2、IL-15和IL-21组合时能够有效地体外繁殖;这样的TIL显示出抗原特异性的促炎作用和细胞毒性的抗肿瘤作用以及中枢记忆表型
已有针对CD8+和CD4+TIL的抗肿瘤功能(即强细胞毒性)的描述(Zanetti的综述,2015)
在WO 2015/189357 A1中,已经描述了IL-2、IL-15和IL-21的组合用于淋巴细胞、特别是T细胞的扩增。通过在存在细胞因子的情况下进行扩增所获得的T细胞群体不仅能够识别自体肿瘤细胞而且还能在体外杀死此类肿瘤细胞。另外,WO 2015/189357 A1也描述了多种T细胞产品,其是从来自胰腺癌或胶质母细胞瘤患者的肿瘤中的T细胞(即TIL)或外周血中的T细胞的扩增获得的。利用所述扩增方案,使用包含IL-2、IL-15和IL-21的细胞因子混合物,可以平行地产生若干T细胞产品。这些T细胞产品通常表现出有利于主动免疫治疗的表型分布。
Tran等(2015年)描述了来自9/10的转移性胃肠道癌患者的TILs,其是在存在IL-2的情况下扩增的,包含CD4+和/或CD8+T细胞,它们识别一至三个由患者自身的肿瘤所表达的来源于体细胞突变的新表位
2014年,Tran等人描述了主要使用CD4+T细胞治疗上皮癌的免疫疗法
在这两种方法中,患者均在施用TIL之前接受非清髓性淋巴细胞消耗化疗方案。该淋巴细胞消耗(lymphodepleting)方案包括用60mg/kg体重的剂量的环磷酰胺治疗2天,随后进行每平方米体表面积25mg的氟达拉滨治疗5天。在所述淋巴细胞消耗之后,患者接受单次TIL输注,然后施用4或5个剂量的IL-2(720 000IU/kg)。如Rosenberg和Restifo(2015)所评述,这种淋巴细胞消耗预备方案是当今ACT中最常用的方案
但是,在TIL的施用之前应用的较高浓度的免疫抑制剂和细胞抑制剂,可能会对已经虚弱的患者产生严重的副作用。因此,本领域需要改进使用ACT治疗肿瘤疾病的方法。
因此,本发明的目的是改善和进一步开发用于治疗肿瘤疾病的ACT。
发明内容
该目的通过本发明的主题解决。本发明人已经发现,在治疗肿瘤疾病的方法中,一次或更多次施用T细胞产品,结合在其之前的淋巴细胞消耗(其包括少于两次的免疫抑制剂治疗),可导致肿瘤完全消退。
因此,在第一方面,本发明提供了一种治疗肿瘤疾病的方法,其包括一次或更多次施用T细胞产品,其中,至少一次施用之前进行淋巴细胞消耗,其中,所述淋巴细胞消耗包括少于两次的免疫抑制剂治疗。
根据第二方面,本发明提供了在所述治疗肿瘤疾病的方法中使用的T细胞产品,其中,所述方法包括一次或更多次施用T细胞产品,其中,至少一次施用之前进行淋巴细胞消耗,其中,所述淋巴细胞消耗包括少于两次的免疫抑制剂治疗。
此外,根据第三方面,本发明提供了在治疗肿瘤疾病的方法中使用的试剂盒,其中,所述方法包括一次或更多次施用T细胞产品,其中,至少一次施用之前进行淋巴细胞消耗,其中,所述淋巴细胞消耗包括少于两次的免疫抑制剂治疗。
附图说明
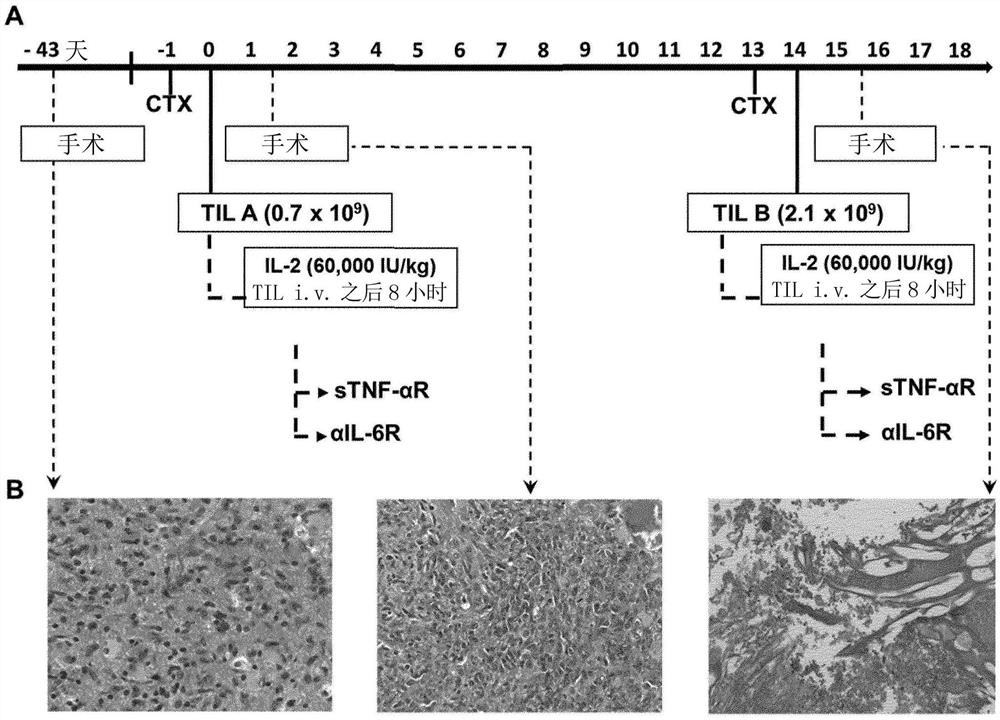
图1示出了指示TIL输注和环磷酰胺给药的治疗方案(A)。在任何一种情况下(TIL-A和TIL-B),都在施用TIL之前的一天使用60mg/kg环磷酰胺(CTX)进行淋巴细胞消耗。在施用TIL之后八小时,静脉施用IL-2(60,000IU/kg),然后分别在TIL-A和TIL-B输注后24小时和72小时,皮下施用抗sTNF-αR(25mg)并静脉施用抗IL-6R(4mg/kg)。代表性的组织病理学分析示于(B)中。在TIL-A治疗前(第-43天)、TIL-A治疗后(第1天)和TIL-B治疗后(第15天)所切除的肿瘤的HE染色显示第二次TIL治疗后肿瘤块的坏死性转化。
图2示出了代表性的MRI和CT扫描图,其显示出GBM的消退。部分切除前,第-43天的MRI:T2、DWI和ADC。TIL-A输注前第-1天的MRI:T2、DWI、ADC、Flair和T1,施用造影剂后。在TIL-A输注后的第+1天,在给予造影剂并增强(造影剂增强)后进行CT扫描。TIL-A输注后的第+2天的MRI(具有T2透射效应的ADC)。在TIL-A输注后第+6天的MRI:DWI和ADC(TIL-A输注后第+6天)。第10天(即TIL-B输注的第-1天)的MRI:T2和具有T2透射效应的ADC,TIL-B输注后的第+10天同时也是TIL-A输注后的第+24天的MRI(T2)。关键词:DWI=弥散加权成像MRI;ADC=表观弥散系数MRI;CE-CT=造影增强的CT。
图3示出了T细胞的表型(左图)和暴露于PMA后的TIL中CD107a的诱导(表示为CD107a-阳性T细胞的百分比)(右图)的流式细胞术分析,虚线表示组成性的(constitutive)CD107a表达。
图4示出了TIL细胞产品的T细胞受体(TCR)Vβ(Vβ)谱系(repertoire)。突出显示了TIL细胞产品中存在的主要Vβ家族。
图5示出了抗肿瘤活性分析的结果。(A)在用OKT3刺激24小时之后的TIL中的IFN-γ的产生,用于测定输注前的TIL的功能。(B)TIL细胞产品在标准的铬-51释放试验中的细胞毒性潜力,说明了铬-51(Cr51)标记的靶细胞(自体肿瘤细胞系以及对照白血病细胞系K562)的裂解。异基因GBM细胞系U-373(ATCC编号:HTB-17)和DBTRG05(ATCC编号:CRL-2020),Daudi B淋巴瘤细胞系和自体EBV转化的B细胞系用作对照。
图6示出了冷靶标抑制试验的结果。(A)使用恒定的E:T比90:1时的测定结果,在存在较高数量的与热肿瘤细胞共孵育的冷肿瘤细胞的情况下,最高的阻断作用是相当的(在90:1时接近100%,在30:1时接近95%)。(B)使用设定的冷:热肿瘤细胞比例(90:1)来测量在变化的T细胞数目下的TIL活性。当在仅有自体肿瘤细胞系(ATCL)的对照共培养物中存在大量T细胞时观察到最高的TIL活性,并以剂量依赖性方式下降。相反,当在靶标抑制试验之前将冷的ATCL与热的ATCL一起预孵育时,则没有观察到TIL活性。
发明的详细说明
定义
根据本发明的术语“肿瘤疾病”是指组织的一种异常和过度生长。本文使用的术语包括原发性肿瘤和继发性肿瘤以及转移瘤。
根据本申请的“原发性肿瘤”是在其中肿瘤进程开始并进行到产生癌性肿块的解剖部位处生长的肿瘤。
根据本发明的“转移瘤”是指在其原发部位发展但随后转移或扩散到身体其他部位的肿瘤。这些进一步的肿瘤也称为“继发性肿瘤”。
如本文所用,“抗原”是任何结构的物质,其分别作为适应性免疫应答的受体、T细胞受体或抗体的靶标。抗原特别是蛋白质、多糖、脂质及它们的亚结构,例如肽。当与蛋白质或多糖结合时,脂质和核酸特别具有抗原性。
“疾病相关抗原”是与疾病有关的抗原。因此,临床相关抗原可以是肿瘤相关抗原(TAA)。
根据本发明的“肿瘤相关抗原”或“TAA”是肿瘤细胞表面上由MHC I或MHC II分子或非经典MHC分子呈递的抗原。如本文所用,TAA包括“肿瘤特异性抗原”,其仅在肿瘤细胞的表面上发现,而未在正常细胞的表面上发现。
如本文所用,“扩增”或“克隆扩增”是指全部来源于单个细胞的子细胞的产生。在T细胞的克隆扩增中,所有子代都具有相同的抗原特异性。
与本领域的一般理解一致的是,“T细胞”或“T淋巴细胞”是在细胞介导的免疫中起主要作用的一种淋巴细胞(白细胞的亚型)。通过细胞表面上存在的T细胞受体,可以将T细胞与其他淋巴细胞(例如B细胞和自然杀伤细胞)区分开。之所以称为T细胞,是因为它们是在胸腺中由胸腺细胞发育成熟的。
遗传修饰的T细胞(GM T细胞)特别是已经被遗传修饰以改变T细胞特异性的T细胞。GM T细胞可以通过表达特定的TCRα和β链(其介导抗原识别过程)而产生
如本文所用,“PBMC”是指外周血单核细胞,其可以从外周血获得。PBMC主要由淋巴细胞(即T细胞、B细胞和NK细胞)和单核细胞组成。“PBMC”还涉及前体外周血单核细胞。被转变成GM T细胞的PBMC也称为基因工程PBMC。
根据本发明的“TIL”是指肿瘤浸润淋巴细胞。这些是主要在肿瘤中发现的淋巴细胞、特别是T细胞。来源于肿瘤的淋巴细胞样品也称为TIL。TIL还涉及位于肿瘤中、肿瘤上或肿瘤周围的任何种类的淋巴细胞,或者是已与肿瘤组织或肿瘤细胞接触过的淋巴细胞。TIL也涉及前体TIL。被转变成GM T细胞的TIL也称为基因工程TIL。
如本文所用,“T细胞产品”是指在免疫治疗中使用的T细胞群。“T细胞产品”可以通过T细胞或GM T细胞的(克隆)扩增获得。T细胞可以是自体的、同种异体的或基因修饰的T细胞。
“TIL细胞产品”是T细胞产品,其通过TIL或GM TIL的克隆扩增获得。
如本文所用,术语“调节性T细胞”或“Treg”是指一种通过抑制其他细胞的免疫反应来调节免疫系统的T细胞亚群。在患有肿瘤疾病的个体中,Treg趋向于上调,并且似乎被募集到许多肿瘤部位。人们认为Treg抑制肿瘤免疫力,从而阻碍了机体控制癌细胞生长的先天能力。
根据本发明使用的术语“先前”、“之前”、“在......之前”是指单个方法步骤在另一提及的方法步骤之前在特定的时间点或特定的时间间隔内执行。该时间点或时间间隔可以从不到一小时到长达几个月。该术语指不同的步骤或相同类型的步骤。重要的是,该术语不排除在相同类型的步骤之间不执行不同的步骤。
如本文所用,术语“随后”或“之后的”或“在……之后”是指时间上隔开但随后的步骤或事件。
如本文所用,术语“淋巴细胞消耗(lymphodepletion)”是指在免疫治疗之前进行患者中淋巴细胞和T细胞的破坏和/或消融。因此,淋巴细胞消耗导致免疫细胞的连续减少,这被称为淋巴细胞减少症。淋巴细胞消耗的不互相排斥的另一个作用是Treg的降低。
术语“免疫抑制剂”是指抑制、阻碍或防止免疫系统活性的药物。如本发明中使用的,术语“免疫抑制剂”是指通常在ACT之前在化学疗法中施用的药物。在化学疗法中,“免疫抑制剂”消除初始并荷瘤的宿主中的Treg,诱导T细胞生长因子(如I型IFN),和/或通过建立免疫空间生态位来增进过继转移的肿瘤反应性效应T细胞的移植。
术语“自体”是指供体和接受者都是同一个人。术语“同种异体”是指供体和受体是不同的人。
如本文所用,“白介素2”或“IL-2”是指人IL-2及其功能等同物。IL-2的功能等同物包括仍保持IL-2功能的IL-2的相关亚结构或融合蛋白。类似地,“白介素15”或“IL-15”是指人IL-15及其功能等同物。IL-15的功能等同物包括仍保持IL-15功能的IL-15的相关亚结构或融合蛋白。“白介素21”或“IL-21”是指人IL-21及其功能等同物。IL-21的功能等同物包括仍保持IL-21功能的IL-21的相关亚结构或融合蛋白。
如本文所用,术语“抗IL-6R”是指指向人白介素6(IL-6)受体的抗IL-6受体的抗体及其功能变体。抗IL-6R的功能变体包括仍保持抗IL-6R功能的抗IL-6R的相关亚结构或融合蛋白。抗IL-6R是可商购的,例如托西珠单抗(tocilizumab或atlizumab)。
如本文所用,术语“sTNF-αR”是指人可溶性肿瘤坏死因子-α受体及其功能变体。本领域已知两种天然受体亚型,即TNFR超家族成员1A(TNFR 1;UniProt P19438)和TNFR超家族成员1B(TNFR 2;UniProt P20333)。sTNF-αR的功能变体包括仍保持sTNF-αR功能的sTNF-αR的相关亚结构或融合蛋白。遗传修饰的sTNF-αR是可商购的,例如依那西普(etanercept或benepali)。
如本文所用,“临床/生物学相关性”涉及T细胞提供以下至少一项的能力:肿瘤细胞的遏制、肿瘤细胞的破坏、防止肿瘤转移、增殖停止、细胞活性停止、细胞向恶性转化的进展停止、预防肿瘤转移和/或肿瘤复发(包括将恶性细胞重编程为非恶性状态);防止和/或阻止与癌症相关的不良临床因素(例如营养不良或免疫抑制),导致免疫逃逸和疾病进展的突变(包括表观遗传学改变)的积累停止,诱导长期免疫记忆以防止疾病扩散或未来的恶性转化影响到靶标(潜在的肿瘤细胞),所述靶标包括结缔组织和未转化的有利于肿瘤疾病的细胞。
与“包括”、“含有”或“特征在于”同义的过渡性术语“包含”是包含性的或开放性的,并且不排除其他未列出的要素或方法步骤。
治疗方法
根据第一方面,本发明提供了一种治疗肿瘤疾病的方法,该方法包括一次或更多次施用T细胞产品,其中在至少一次施用之前进行淋巴细胞消耗,其中,所述淋巴细胞消耗包含少于两次的免疫抑制剂治疗。
该方法与现有方法相比具有若干优点。在本方法中,淋巴细胞消耗包含少于两次的免疫抑制剂治疗,与标准治疗相比相对“温和”,这意味着在施用T细胞之前使用的淋巴细胞消耗未完全切断患者的免疫系统,因此降低了现有技术的方法中已知的副作用风险。因此,根据本发明的方法可以显著改善患者在施用T细胞之前的化疗期间的状况。
在实施例2中,单次施用T细胞产品后便已经观察到肿瘤消退,而第二次施用T细胞产品则完全消除了患者的肿瘤组织。由于根据本发明的方法是在相对温和的条件下进行的,即减少的淋巴细胞消耗方案和/或注入患者体内的细胞数相对较少,因此可以实现多次施用T细胞产品。因此,在根据本发明的方法中的施用次数可以是例如一次施用、两次施用、三次施用、四次施用或五次施用。如实施例2中的两次连续施用所显示的,多次施用可以支持和/或增强该方法的积极结果。因此,在本发明的优选实施方案中,该方法包括至少两次施用T细胞产品。在本发明的另一实施方案中,该方法包括至少三次施用T细胞产品。在本发明的另一实施方案中,该方法包括至少四次施用T细胞产品。
大多数肿瘤在宿主中引发由肿瘤抗原介导的免疫反应,从而将肿瘤与其他非癌性细胞区分开。这导致在肿瘤微环境中发现大量的靶向癌细胞的TIL,因此减慢或终止了肿瘤的发展。但是,该过程很复杂,因为Treg优先向肿瘤微环境迁移(traffic)。尽管Treg通常仅占CD4+T细胞的约4%,但它们可以占在肿瘤微环境周围的CD4+群体总数的20%-30%。
肿瘤微环境中高水平的Treg与许多癌症的不良预后相关。这表明Treg抑制TIL并阻碍人体针对肿瘤的免疫反应。
因此,在ACT中,在施用T细胞产品之前建立了预备性淋巴细胞消耗方案。一般而言,这种淋巴细胞消耗的目的是减少患者体内的循环Treg的量。在这方面,有利的是不将另外的Treg与T细胞产品一起引入,即,未经历任何免疫抑制剂治疗的Treg。
本发明人已经发现,当在上述方法中施用的T细胞产品中的Treg的量低于2.5%、优选低于1.5%时,获得了良好的抗肿瘤活性。当T细胞产品中Treg的量低于0.5%或0.1%时,获得了最佳结果。理想地,T细胞产品不包含任何Treg。
因此,在一个实施方案中,T细胞产品中调节性T细胞(Treg)的含量低于2.5%。Treg的含量可以是例如0.01%,0.03%,0.05%,0.1%,0.15%,0.2%,0.25%,0.3%,0.35%,0.4%,0.45%,0.5%,0.55%,0.6%,0.65%,0.7%,0.75%,0.8%,0.85%,0.9%,0.95%,1.0%,1.05%,1.1%,1.15%,1.2%,1.25%,1.3%,1.35%,1.4%,1.45%,1.5%,1.55%,1.6%,1.65%,1.7%,1.75%,1.8%,1.85%,1.9%,1.95%,2.0%,2.05%,2.1%,2.15%,2.2%,2.25%,2.3%,2.35%,2.4%或2.45%。
在本发明的一个实施方案中,T细胞产品中Treg的含量低于1.5%。优选地,T细胞产品中Treg的含量低于0.5%。在本发明的另一实施方案中,T细胞产品中Treg的含量低于0.1%。
由于T细胞(特别是TIL)可以指向不同类型的肿瘤,即来自于其已分离环境的肿瘤,因此该方法适用于治疗多种肿瘤疾病,诸如脑癌,胰腺癌,起源于神经嵴的肿瘤例如成神经细胞瘤、节细胞神经瘤、节细胞性神经母细胞瘤和嗜铬细胞瘤,上皮(例如皮肤、结肠或乳腺)以及间充质来源的(例如脂肪性、软骨性、纤维性、成纤维细胞性、肌成纤维细胞性、骨性或血管性)肿瘤,以及例如血液、骨髓、淋巴或淋巴系统的造血系统肿瘤(hematopoietictumors)。
根据本发明的一个实施方案,所述肿瘤疾病选自脑癌,胰腺癌,造血系统肿瘤,起源自神经嵴的肿瘤,以及上皮或间充质来源的肿瘤。
在本发明的一个实施方案中,肿瘤疾病是脑癌。优选地,肿瘤疾病是星形细胞瘤。更优选地,肿瘤疾病是GBM。如实施例2所示,可以用根据本发明的包括施用TIL细胞产品的方法成功地治疗GBM。因此,在本发明的优选实施方案中,T细胞产品是TIL细胞产品。
许多免疫抑制药物的常见副作用是免疫缺陷,因为它们中的大多数非选择性地起作用,导致感染易感性增加和癌症免疫监视下降。以特别高的剂量或超长时间给予免疫抑制药物甚至可能需要干细胞移植,因为化学疗法能够完全破坏骨髓。还有其他副作用,诸如高血压、血脂异常、高血糖、消化性溃疡、脂肪营养不良、月脸、肝脏和肾脏损伤。免疫抑制药物还与其他药物相互作用,并影响其代谢和作用。可以使用免疫组织化学方法根据其对组织中淋巴细胞亚群的影响来评价实际或疑似的免疫抑制剂。
在根据本发明的方法中使用的预备性淋巴细胞消耗方案与在其他已知的T细胞研究中所采用的方案明显不同,在已知的研究中,在T细胞输注前,在第1天和第2天使用两次相同剂量的免疫抑制剂,然后第3-7天使用25mg/m
因此,在本发明的另一实施方案中,每次T细胞施用之前进行淋巴细胞消耗,其中,每次淋巴细胞消耗包括少于两次的免疫抑制剂治疗。在本发明的一个优选的实施方案中,每次淋巴细胞消耗包括一次免疫抑制剂治疗。
为了进一步降低不需要的副作用的风险,通过根据本发明的方法可以降低一次淋巴细胞消耗中免疫抑制剂的总浓度或每次治疗中免疫抑制剂的浓度。
当在每次淋巴细胞消耗中使用总浓度高达65mg/kg的免疫抑制剂时,已观察到足够的淋巴细胞消耗和Treg减少。此外,与已知方法相比,每次淋巴细胞消耗利用免疫抑制剂总浓度高达80mg/kg的治疗即可足够减少。
因此,在本发明的一个实施方案中,每次淋巴细胞消耗中免疫抑制剂的总浓度高达80mg/kg。在每次淋巴细胞消耗中免疫抑制剂的总浓度可以是例如5mg/kg,10mg/kg,15mg/kg,20mg/kg,25mg/kg,30mg/kg,35mg/kg,40mg/kg,45mg/kg,50mg/kg,55mg/kg,60mg/kg,65mg/kg,70mg/kg,75mg/kg或80mg/kg。优选地,每次淋巴细胞消耗中免疫抑制剂的总浓度高达75mg/kg。更优选地,每次淋巴细胞消耗中免疫抑制剂的总浓度高达70mg/kg。最优选地,每次淋巴细胞消耗中免疫抑制剂的总浓度高达65mg/kg。
此外,当通过用从已处于每次治疗5mg/kg的低浓度到80mg/kg的高浓度的免疫抑制剂进行治疗来建立淋巴细胞消耗方案时,可以实现足够的淋巴细胞消耗和Treg减少。当应用每次治疗20mg/kg至65mg/kg的浓度范围时,实现了足够的淋巴细胞消耗以及良好的药物相容性。
因此,在本发明的另一实施方案中,每次治疗中免疫抑制剂的浓度范围为5mg/kg至80mg/kg。每次治疗中免疫抑制剂的浓度可以是例如5mg/kg,10mg/kg,15mg/kg,20mg/kg,25mg/kg,30mg/kg,35mg/kg,40mg/kg,45mg/kg,50mg/kg,55mg/kg,60mg/kg,65mg/kg,70mg/kg,75mg/kg或80mg/kg。优选地,每次治疗中免疫抑制剂的浓度范围为10mg/kg至75mg/kg。更优选地,在每次治疗中免疫抑制剂的浓度范围为15mg/kg至70mg/kg。最优选地,在每次治疗中免疫抑制剂的浓度范围为约20mg/kg至约65mg/kg。
通常,可以在本发明中使用的免疫抑制剂选自这样的药物,其诱导淋巴细胞减少而不显著影响造血干细胞,以及减小免疫抑制和促瘤活性,例如IL-10和/或TGF-β的产生和/或活性。
由于施用根据本发明的T细胞产品未将大量的新Treg引入患者体内,因此选择一种也降低患者体内Treg的数量的免疫抑制剂是有利的。这样的免疫抑制剂可以是细胞抑制药物。使用细胞抑制药物作为免疫抑制剂的另一个优点是,与其他常用的免疫抑制剂相比,它可以以较低的剂量给药。
因此,在本发明的一个实施方案中,免疫抑制剂是一种细胞抑制药物,优选地,免疫抑制剂选自环磷酰胺、硫唑嘌呤、甲氨蝶呤和雷帕霉素(rapamycin)。
本发明的另一个优点是该方法在要施用的细胞数目方面是高度可变的。例如,在稳定的患者中,可以给予具有高细胞数目的T细胞产品作为初始剂量。高细胞数目可以是例如10
相反,对于病情较差的患者,可以通过首先施用低细胞数目的T细胞产品来降低使机体免疫细胞过载的风险。低细胞数目可以是例如10
因此,在本发明的一个实施方案中,一次施用中的T细胞产品中的细胞数目高于先前一次施用中的T细胞产品中的细胞数目。
在本发明的另一实施方案中,一次施用中的T细胞产品中的细胞数目低于先前一次施用中的T细胞产品中的细胞数目。
此外,与以前的研究相比,利用较低的细胞数目有利于与抗肿瘤活性相结合地更快的T细胞生产的技术可行性。直到使用约10
因此,在本发明的一个实施方案中,T细胞产品包含的细胞数目为10
已经观察到用单剂量的IL-2支持T细胞施用导致患者体内T细胞的抗肿瘤活性升高和快速扩增。
不希望受任何理论的束缚,相信所述升高的而仍未知的抗肿瘤活性是通过施用本发明的T细胞产品而被新引入患者体内的T细胞与暴露于IL-2之后已经历免疫抑制剂治疗的患者的免疫细胞相组合的结果。
可以利用与另外施用抗IL-6R和sTNF-αR相组合,以防止进一步的高炎症反应,以及避免会导致免疫力耗竭并会对免疫细胞与肿瘤和/或肿瘤细胞的相互作用直接产生负面影响的免疫特征(signatures)。
因此,根据本发明的一个实施方案,在每次T细胞施用之后,另外施用IL-2、抗IL-6-受体的抗体和sTNF-αR。
与在现有技术的方法中施用的细胞数目相比,使用相对低的细胞数目的T细胞产品进行施用可以通过在T细胞施用后的单剂量的IL-2得到充分支持。因此,在本发明的另一实施方案中,每次T细胞产品施用,以单剂量形式施用IL-2。
可以在施用T细胞产品后直至1周进行IL-2输注。可以在例如T细胞施用后8小时、T细胞施用后12小时、T细胞施用后16小时、T细胞施用后1天、T细胞施用后2天、T细胞后3天、T细胞施用后4天、T细胞施用后5天、T细胞施用后6天或T细胞施用后7天输注IL-2。在在本发明的一个特定的实施方案中,在施用T细胞产品后8小时输注单剂量的IL-2。
在本发明的附加实施方案中,IL-2以20000IU/kg至720000IU/kg的范围内的浓度施用。所述浓度可以是例如20000IU/kg,40000IU/kg,60000IU/kg,80000IU/kg,100000IU/kg,120000IU/kg,140000IU/kg,160000IU/kg,180000IU/kg,200000IU/kg,220000IU/kg,240000IU/kg,260000IU/kg,280000IU/kg,300000IU/kg,320000IU/kg,340000IU/kg,360000IU/kg,380000IU/kg,400000IU/kg,420000IU/kg,440000IU/kg,460000IU/kg,480000IU/kg,500000IU/kg,520000IU/kg,540000IU/kg,560000IU/kg,580000IU/kg,600000IU/kg,620000IU/kg,640000IU/kg,660000IU/kg,680000IU/kg,700000IU/kg或720000IU/kg。优选地,IL-2以40000IU/kg至500000IU/kg的范围内的浓度施用。更优选地,IL-2以60000IU/kg至200000IU/kg的范围内的浓度施用。
在本发明的一个实施方案中,以约60000IU/kg的浓度施用IL-2。在本发明的另一实施方案中,以约120000IU/kg的浓度施用IL-2。在本发明的另一实施方案中,以约240000IU/kg的浓度施用IL-2。在本发明的另一实施方案中,以约480000IU/kg的浓度施用IL-2。在本发明的另一实施方案中,以约600000IU/kg的浓度施用IL-2。
在另一实施方案中,以高达10mg/kg的浓度施用抗IL-6R。所述浓度可以是例如4mg/kg,5mg/kg,6mg/kg,7mg/kg,8mg/kg,9mg/kg或10mg/kg。优选地,抗IL-6R的浓度为4mg/kg。
根据本发明的一个实施方案,以每次皮下施用绝对浓度10mg至30mg施用sTNF-αR。所述绝对浓度可以是例如10mg,15mg,20mg,25mg或30mg。优选地,以每次皮下施用25mg的绝对浓度施用sTNF-αR。
所述方法中使用的复合物和细胞可以通过本领域已知的施用途径来输送。合适的施用途径是例如静脉内施用、皮下施用、动脉内施用、皮内施用、鞘内施用。
本领域技术人员知道该方法中要施用的复合物与细胞的不同配方。因此,示例性配方可以包含聚乙二醇(PEG)或其他支持和/或促进复合物或细胞施用的物质。
此外,可以通过众所周知的方法获得所施用的复合物。这样的方法可以是例如通过重组方式生产蛋白质。另外,可以在已经适应于产生重组蛋白的多种细胞类型中产生重组蛋白。可以通过本领域已知的方法(例如逆转录病毒、非逆转录病毒载体或基于CRISP-Cas9的方法)用要生产的相应的蛋白质的基因构建体来转染那些细胞。
优选地,所述T细胞产品经由静脉内途径、动脉内途径、鞘内途径或腹膜内途径施用,或经由导管直接施用到组织或脑脊液中。免疫抑制剂也优选使用静脉内途径给药。但是,为了首要地减少和/或消耗Treg,可以口服免疫抑制剂。此外,免疫抑制剂可以经由导管经动脉内、鞘内、腹膜内直接施用到组织中或脑脊液中。用于IL-2施用的优选施用途径是静脉内途径。然而,可以原位或经动脉内将IL-2全身施用或局部施用于受影响的组织或器官。也可以利用连续输注或在20-30分钟内提供剂量的峰值的输注进行IL-2的皮下施用。抗IL-6R优选经由导管经静脉内、动脉内、鞘内、腹膜内直接施用到组织中或脑脊液中。对于TNF-αR,优选皮下施用,但是该药物还可以经由导管经动脉内、鞘内、腹膜内直接施用到组织或脑脊液中。
在又一实施方案中,抗IL-6R是静脉内施用的,而TNF-αR是皮下施用的。两种施用途径代表相应复合物的最合适途径。
因此,在本发明的一个实施方案中,T细胞产品、免疫抑制剂、IL-2和抗IL-6R是经由静脉内施用而施用的,而TNF-αR是皮下施用的。
用于治疗的细胞产品
在第二方面,本发明提供了在根据本发明的第一方面的治疗肿瘤疾病的方法中使用的T细胞产品。因此,所使用的T细胞产品适用于与根据本发明的第一方面的治疗肿瘤疾病的方法有关的每个实施方案。
根据本发明的T细胞产品可以获自T细胞或基因工程T细胞。根据一个实施方案,所述T细胞产品是从T细胞而不是基因工程T细胞获得的。根据进一步优选的实施方案,所述T细胞产品不是从CAR T细胞获得的。
根据本发明第二方面的T细胞产品显示出抗肿瘤活性。如本文所示的实施例3和实施例4所说明的,可以通过本领域已知的方法评估抗肿瘤活性。例如,如实施例3中所示,可以通过使用FACS相对于已知的细胞毒性T细胞对T细胞产品进行表型分析和分选。在本发明中已被赋予细胞毒性潜能的T细胞例如为CD4+、CD8+和/或CD107a+。
分析抗肿瘤活性的另一种方法是测量T细胞产品中IFN-γ的产量(参见实施例4.1)。在本发明中,在30ng OKT3刺激时,阈值被设置为200pg/10
优选地,所述T细胞产品是通过在存在IL-2、IL-15和IL-21的情况下进行T细胞扩增而获得。根据本发明的另一实施方案,液体组合物中IL-2的浓度在10至6000U/ml的范围内。国际单位(U)是IL-2的量的标准度量。它是由其诱导CTLL-2细胞增殖的能力决定的。IL-2的浓度优选在500至2000U/ml的范围内。更优选地,IL-2的浓度在800至1100U/ml的范围内。根据一个实施方案,IL 15的浓度在0.1至100ng/ml的范围内。优选地,IL-15的浓度在2至50ng/ml的范围内,更优选在5至20ng/ml的范围内。最优选的浓度是约10ng/ml。在本发明的又一实施方案中,IL-21的浓度在0.1ng/ml的范围内,优选在2至50ng/ml的范围内,更优选在5至20ng/ml的范围内。
在上述方法中使用的以IL-2/IL-15/IL-21扩增的T细胞代表了一种治疗患有肿瘤疾病的患者的高效方法。这是因为在T细胞扩增过程中存在IL-2、IL-15和IL-21不会促进Treg的生长。因此,在本发明的又一实施方案中,通过在包含IL-2、IL-15和IL-21的细胞因子混合物存在的情况下进行患者的自体T细胞的克隆扩增来生产T细胞产品,其中所述T细胞优选是从选自原发性肿瘤、转移瘤或外周血的机体样本中分离的。
机体样本可以从含有T细胞的任何机体部位获取。机体样本的实例是原发性肿瘤组织、转移瘤和外周血,例如PBMC。如实施例中所示,可以通过根据本发明的包括施用TIL细胞产品的方法成功地治疗肿瘤。因此,在优选的实施方案中,T细胞产品是TIL细胞产品。根据进一步优选的实施方案,所述TIL细胞产品是从GM TIL获得的。
获得T细胞的方法是本领域已知的。例如,可以在外科干预例如活检期间分离T细胞(参见实施例1)。还可以通过从组织和/或器官中抽吸单一细胞来分离T细胞。
为了节省时间,可以将T细胞在从机体样本中分离之后立即在存在IL-2、IL-15和IL-21的情况下进行扩增,直到所得到的T细胞产品可以施用为止。此外,还可以例如通过冷冻将新鲜分离的T细胞或从先前的扩增获得的T细胞产品储存直至使用。发明人发现,已经获得的T细胞产品可以储存并在存在IL-2、IL-15和IL-21的情况下再扩增,并且这种进一步扩增的T细胞产品通常表现出改变的抗肿瘤活性。
在本发明的一个实施方案中,一次施用中的T细胞产品的抗肿瘤活性高于先前一次施用中的T细胞产品的抗肿瘤活性。这样做的好处是,如果患者的状况良好并且第一次T细胞施用耐受良好,那么使用表现出更高抗肿瘤活性的T细胞产品的第二次T细胞施用就可能足以消除肿瘤。
在本发明的另一实施例中,一次施用中的T细胞产品的抗肿瘤活性低于先前一次施用中的T细胞产品的抗肿瘤活性。这样做的好处是,如果第一次施用的耐受不佳,则不必停止治疗直到患者状况恢复,而是可以继续治疗。
当先前的步骤是淋巴细胞消耗并且后继的步骤是T细胞施用时,术语“之前”是指T细胞施用前1天或2天的时间点或在淋巴细胞消耗与T细胞使用之间1-2天的时间间隔。如果两个涉及的步骤都是T细胞施用,则术语“先前”、“之前”、“在……之前”是指在两次施用之间从1周至数周或月的时间间隔。第二次施用的确切时间点将基于患者的临床数据确定。在这方面重要的是在两次T细胞施用之间不进行另外的T细胞施用。
用于治疗的试剂盒
本文所述的方法依赖于高质量的组分,并且是高度规范的工艺。为了获得最佳结果并帮助使用者的准备行为,本发明在第三方面提供了一种在根据本发明的第一方面的方法中使用的试剂盒。
因此,在一个实施方案中,所使用的试剂盒包含IL-2、IL-15、IL-21、抗IL6-受体的抗体,sTNF-αR,以及可选地至少一种刺激TCR的组分、特别是OKT3,共刺激分子和饲养细胞。在另一实施方案中,使用的试剂盒包含所有这些组分。
通过以下实施例进一步定义本发明。
实施例
实施例1–GBM患者中TIL的分离和扩增
从GBM活检中分离TIL,首先以补充了人血清(10%)、OKT3(抗人CD3抗体,其例如可以从Miltenyi获得)和同种异体的经55-Gy照射的饲养细胞(1×10
实施例2–治疗方法和肿瘤进展
在图1中提供了代表性治疗和相应肿瘤进展的概述。在TIL输送前一天,患者接受剂量为60mg/kg的环磷酰胺。在接下来一天,在45分钟内通过静脉内途径(i.v.)施用0.7×10
本研究中使用的预备性环磷酰胺方案(单剂量60mg/kg)与已知的TIL研究中使用的方案明显不同,在已知TIL研究中,在TIL输注之前,在第1天和第2天使用两次相同剂量的环磷酰胺,随后在第3-7天使用25mg/m
在第-1天给予单剂量环磷酰胺的调节方案介导了轻度淋巴细胞减少和适中的中性白细胞减少,但并未造成患者完全的淋巴细胞消耗。基于令人信服的临床进展,显示GBM组织大量坏死,可以认为所述调节方案有效降低了抑制性的循环Treg
在治疗中,对患者进行持续监测,并在治疗的不同时间点对肿瘤组织进行分析。因此,使用具有表观弥散系数(ADC)的弥散加权磁共振成像(DWI-MRI)或增强(随后的造影剂)的计算机断层扫描(CT)来判定TIL治疗前后的放射学随访。
如图2所示,患者在首次TIL(TIL-A)输注之前6周时的第一次MRI检查(T2,部分切除前),显示被实性肿块包围的囊性颞部肿瘤延伸到左侧顶区中。肿块显示出中线向右移位而无疝形成的最初迹象。DWI和ADC序列显示出弥散受限,同时细胞的密集堆积表示高度恶性。在TIL-A输注第-1天时的下一次MRI检查显示出在所有序列(T2、DWI、ADC、Flair、T1,施用造影剂后)中均出现实性病变的巨大进展。中线向右移位显示出暂时性疝气风险,同时随着肿瘤进入中脑,实性病变的大量扩散受限(DWI和ADC)。在TIL-A施用后第+1天,进行了CT扫描,而不是MRI。在脑部造影剂增强的CT扫描中,在左顶部分中可见与偏侧颅骨肥大(hemicraniectomy)并列的中央坏死性病变,同时实体瘤中增强程度降低。因此,在第+2天的MRI显示出ADC序列中的T2透射效应,其表示血管性水肿而非弥散受限。在TIL-A输注后第+6天的DWI和ADC证实了这一点。在第+13天(TIL-A后)的MRI显示出以中央坏死部分为主的萎缩的实体瘤(T2序列),这由ADC中代表T2透射效应的高信号强度所证实。TIL-B输注后10天进行的MRI显示实体瘤中有死细胞块(T2图像)。由于在TIL-A和TIL-B输送后出现了脑部的压迫症状,因此重复进行了手术减压。肿瘤活检显示完全的坏死性组织转化,如图1B中的右图所示。
结果,通过使用根据本发明的方法,可以完全消除患者的脑部肿瘤。
实施例3–TIL细胞产品中T细胞的表型
可以通过对TIL细胞产品中的细胞进行表型分析(即,确定TIL细胞产品中的细胞组成)来确定细胞的肿瘤反应性。为了对TIL细胞产品中的细胞组成进行这样的定义,进行了以下方法。
3.1方法
3.1.1流式细胞仪分析
在TIL输注前进行流式细胞术以评价表型、豆蔻酰佛波醇乙酯(phorbol-myristate-acetate,PMA)驱动的CD107a的诱导以及Treg计数。
3.1.2T细胞表型
将1×10
3.1.3CD107a的诱导
将1×10
3.1.4调节性T细胞(Treg)
将1×10
3.1.5 TCR Vβ谱系
TIL产品中的TCR Vβ谱系使用IO Beta Mark TCR VβRepertoire试剂盒(BeckmanCoulter,目录号:IM3497)在存在与以下抗体共染色的情况下进行测定:抗人CD3 PE-Cy7(BD Biosciences,产品目录号:563423),抗人CD4 Krome Orange(Beckman Coulter,产品目录号:A 96417)和抗人CD8αAPC-Cy7(BD Biosciences,目录号:557834)。在BD Fortessa流式细胞仪(BD Biosciences,瑞典斯德哥尔摩)上采集染色的细胞。使用FlowJo软件(FlowJo LLC,俄勒冈州(Oregon))分析了来自流式细胞仪采集的数据。该试剂盒可覆盖人的约70%的TCR VB的利用。
3.2结果
如图3所示,流式细胞仪表型分析显示,在第一次(TIL-A)和第二次(TIL-B)输注产品中分别有约90%和70%的CD8+TIL(左图)。CD4+T细胞从在TIL-A中的5.4%增加到在TIL-B中的26.4%(增加5倍)。65%的TIL(主要是CD8+T细胞)为CD107a+,表现出细胞毒性潜力(右图)。在两种TIL制剂中,发现CD25hi CD127-FoxP3+调节性CD4+T细胞(Treg)均为阴性(0.03%)。
如图4所示,TCR Vβ流式细胞仪分析显示,TCR Vβ2家族分别代表了TIL-A和TIL-B中约46%和73%的CD8+T细胞。TCR Vβ1家族代表了TIL-A中19%的CD8+T细胞,而在TIL-B中8%的CD8+T细胞属于Vβ14家族。TIL-B中的CD4+T细胞分别占24%的Vβ3和47%的Vβ13.1TCR家族。
如所表明的,两种TIL细胞产品都包含可以指定抗肿瘤活性的大量细胞类型,因此可以在根据本发明的方法中很好地发挥作用。为了确定TIL细胞产品的抗肿瘤活性,可以进行进一步的测定。
实施例4–分析抗肿瘤活性
为了测试TIL细胞产品靶向和抵制肿瘤细胞的能力,执行了标准方法以确定抗肿瘤活性的水平。
4.1方法
4.1.1 IFN-γ的产生
通过用OKT3刺激TIL细胞产品24小时,随后通过酶联免疫吸附测定(ELISA)进行所述培养上清液中细胞因子的定量来测试IFN-γ的产生。结果表示为IFN-γ产量pg/1.0×10
4.1.2铬51释放试验
如先前所述,在标准的铬-51(Cr
4.2结果
如图5A所示,1×10
从实施例2中所述的扩增获得的TIL细胞产品显示出良好的抗肿瘤活性,并且可以应用于根据本发明的方法中。
参考文献
1.Rosenberg SA,Restifo NP.Adoptive cell transfer as personalizedimmunotherapy for human cancer.Science2015;348:62-8.
2.Tran E,Robbins PF,Lu YC,et al.T-Cell Transfer Therapy TargetingMutant KRAS in Cancer.The New England journal of medicine 2016;375:2255-62.
3.Andersen R,Donia M,Westergaard MC,Pedersen M,Hansen M,SvaneIM.Tumor infiltrating lymphocyte therapy for ovarian cancer and renal cellcarcinoma.Human vaccines&immunotherapeutics 2015;11:2790-5.
4.Davis ME.Glioblastoma:Overview of Disease and Treatment.Clin JOncol Nurs 2016;20:S2-8.
5.Belhadj Z,Zhan C,Ying M,et al.Multifunctional targeted liposomaldrug delivery for efficient glioblastoma treatment.Oncotarget 2017;8:66889-900.
6.Zheng S,Cheng Y,Teng Y,et al.Application of luteolin nanomicellesanti-glioma effect with improvement in vitro and in vivo.Oncotarget 2017;8:61146-62.
7.Kast RE,Skuli N,Karpel-Massler G,Frosina G,Ryken T,HalatschME.Blocking epithelial-to-mesenchymal transition in glioblastoma with asextet of repurposed drugs:the EIS regimen.Oncotarget 2017;8:60727-49.
8.Ferber S,Tiram G,Sousa-Herves A,et al.Co-targeting the tumorendothelium and P-selectin-expressing glioblastoma cells leads to aremarkable therapeutic outcome.eLife 2017;6.
9.Rajora MA,Ding L,Valic M,et al.Tailored theranostic apolipoproteinE3 porphyrin-lipid nanoparticles target glioblastoma.Chem Sci 2017;8:5371-84.
10.Quattrocchi KB,Miller CH,Cush S,et al.Pilot study of localautologous tumor infiltrating lymphocytes for the treatment of recurrentmalignant gliomas.Journal of neuro-oncology 1999;45:141-57.
11.Brown CE,Alizadeh D,Starr R,et al.Regression of Glioblastoma afterChimeric Antigen Receptor T-Cell Therapy.The New England journal of medicine2016;375:2561-9.
12.Liu Z,Meng Q,Bartek J,Jr.,et al.Tumor-infiltrating lymphocytes(TILs)from patients with glioma.Oncoimmunology 2017;6:e1252894.
13.Liu Z,Rao M,Poiret T,et al.Mesothelin as a novel biomarker andimmunotherapeutic target in human glioblastoma.Oncotarget 2017;8:80208-22.
14.Zanetti M.Tapping CD4 T cells for cancer immunotherapy:the choiceof personalized genomics.Journal of immunology 2015;194:2049-56.
15.Tran E,Ahmadzadeh M,Lu Y-C,et al.Immunogeneicity of somaticmutations in human gastrointestinal cancers,Science 2015,10:1126
16.Tran E,Turcotte S,Gros A,et al.Cancer immunotherapy based onmutation-specific CD4+T-cells in a patient with epithelial cancer.Science2014,Vol 344,10.1126
17.
18.Greten TF,Ormandy LA,Fikuart A,et al.Low-dose cyclophosphamidetreatment impairs regulatory T cells and unmasks AFP-specific CD4+T-cellresponses in patients with advanced HCC.Journal of immunotherapy2010;33:211-8.
19.Madondo MT,Quinn M,Plebanski M.Low dose cyclophosphamide:Mechanisms of T cell modulation.Cancer treatment reviews 2016;42:3-9.
20.Scurr M,Pembroke T,Bloom A,et al.Low-Dose Cyclophosphamide InducesAntitumor T-Cell Responses,which Associate with Survival in MetastaticColorectal Cancer.Clinical cancer research:an official journal of theAmerican Association for Cancer Research 2017;23:6771-80.
21.Knuth A,Danowski B,Oettgen HF,Old LJ.T-cell-mediated cytotoxicityagainst autologous malignant melanoma:analysis with interleukin 2-dependentT-cell cultures.Proceedings of the National Academy of Sciences of the UnitedStates of America 1984;81:3511-5.
22.Sharpe M,Mount N.Genetically modified T cells in cancer therapy:opportunities and challenges.Disease Models&Mechanisms 2015;8:337-350
- 采用过继性T细胞免疫疗法治疗肿瘤患者的方法
- 使用白介素-2受体α,β选择性激动剂与过继性细胞转移疗法的组合的免疫治疗肿瘤治疗方法
