一种与茄子萼片覆盖下果皮颜色相关的分子标记及应用
文献发布时间:2023-06-19 11:03:41
技术领域
本申请属于生物分子检测及育种领域,具体涉及一种与茄子萼片覆盖下果皮颜色相关的分子标记及应用。
背景技术
竞争性等位基因特异PCR(KASP)技术是针对等位基因SNP位点设计的两端引物,利用实时荧光PCR技术,对底物进行扩增,相应的荧光探针可以与对应引物结合位点相结合,根据检测出的荧光颜色确定扩增产物的基因型,是一种无需电泳新型快速简便方法。
随着设施农业的快速发展,温室覆盖物和北方雾霾天气的共同影响,茄子等蔬菜品种着色不良的问题愈加严重,归根到底是品种耐弱光性不强。茄子颜色是公认的耐弱光指标,前人围绕弱光处理和农艺性状进行了研究。但是,关于萼下果色调控相关基因研究甚少,尤其是萼下果色与衰老基因是否有关联未见报道,亟需一种高效的分子标记辅助本专利采用基因组重测序结合BSA方法,综合应用生物信息学预测候选基因,并利用其SNP位点开发KASP标记,在已知基因型群体验证,以期开发出萼下果色连锁KASP标记辅助育种。
发明内容
本发明首先提供一种分子标记,其与茄子萼片覆盖下果皮颜色相关。
本发明进一步提供了特异性扩增该分子标记的引物。
本发明还提供了一种鉴定茄子萼片覆盖下果皮颜色的方法。
本发明还提供了一种预判茄子衰老倾向的方法。
本发明还提供了一种预判茄子种子成熟时间的长短的方法。
本发明还提供了一种预判茄子果实光泽持续的时间长短的方法。
本发明还提供了一种预判弱光时茄子果实皮色是否易出现斑驳或是否耐弱光的方法。
本发明公开了一种与茄子萼片覆盖下果皮颜色相关的分子标记,所述分子标记的序列如SEQ ID NO:1所示,其中,在所述SEQ ID NO:1第100bp处发生A→G的突变,第100bp处碱基为A时茄子萼片覆盖下果皮颜色为紫色。
优选的,所述SEQ ID NO:1第100bp处碱基为G时茄子萼片覆盖下果皮颜色为绿色。
本发明公开了一种制备与茄子萼片覆盖下果皮颜色相关的分子标记的KASP引物,所述KASP引物包括上游引物1、上游引物2以及下游引物。
优选的,上游引物1的序列如SEQ ID NO:2所示,上游引物2的序列如SEQ ID NO:3所示,下游引物的序列如SEQ ID NO:4所示。
优选的,所述的KASP引物采用荧光素进行标记。
优选的,所述荧光素为HEX和FAM。
本发明公开了一种特异性扩增所述与茄子萼片覆盖下果皮颜色相关的分子标记的引物。
本发明公开了一种检测茄子萼片覆盖下果皮颜色的试剂盒,其特征在于,所述试剂盒包括所述的分子标记和/或所述的KASP引物和/或所述的引物。
本发明公开了一种鉴定茄子萼片覆盖下果皮颜色的方法,其特征在于,包括如下步骤:
(1)提取茄子叶片基因组DNA,以所述基因组DNA为模板,设计引物,PCR扩增获得SEQ ID NO:1所示的产物;
(2)对所述PCR产物进行分析或测序;
(3)结果判定:在所述SEQ ID NO:1第100bp处碱基为A时茄子萼片覆盖下果皮颜色为紫色,所述SEQ ID NO:1第100bp处碱基为G时茄子萼片覆盖下果皮颜色为绿色。
本发明公开了所述的分子标记在鉴定茄子萼片覆盖下果皮颜色和/或茄子育种中的应用。
本发明公开了所述的KASP引物和/或所述的引物和/或所述的试剂盒在鉴定茄子萼片覆盖下果皮颜色和/或茄子育种中的应用。
本发明利用茄子衰老基因-KASP标记辅助筛选茄子萼片覆盖下果皮紫色性状。所述衰老基因在10号染色体2618643处有一个SNP位点,其为A或G。本发明提供了一种与茄子衰老基因紧密连锁的SNP位点,并且开发了KASP标记,该标记可以高通量检测该衰老基因在2618643处的基因型,与萼下果色相关。田间筛选耐弱光茄子材料需要人工模拟弱光环境,容易受到环境和人为因素影响,选择误差较大。利用衰老基因-KASP分子标记辅助筛选耐弱光茄子材料可以排除环境和人为操作误差,易于批量化操作,苗期选择可以节约用地和人工成本,提高育种效率。
本发明不但解决了耐弱光农艺性状勘察的难题,还利用衰老基因-KASP分子标记快速筛选技术大大降低了田间劳动量,节约了人力、物力和时间成本。与现有技术相比所具有的积极效果在于:
(1)证明了特定的衰老基因与茄子萼片覆盖下果皮颜色紧密关联:通过连锁标记筛选萼下紫色茄子品种和自交系,可以辅助快速鉴定其耐弱光性,克服环境影响。
(2)建立了本发明的分子标记与种子成熟时间、光泽持续时间、果实皮色是否易出现斑驳、是否耐弱光等重要特性的关联:利用本方法筛选茄子耐弱光材料比起人工气候箱和传统田间试验效率更高,结果可靠。
附图说明
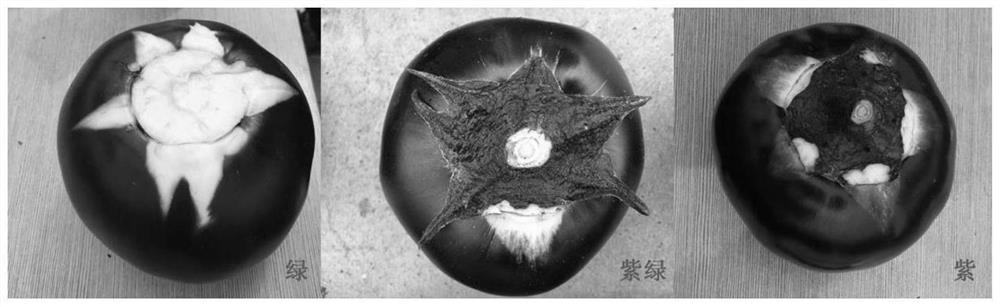
图1为茄子萼下果色分离情况示意图,分别为绿(左)、紫绿(中)、紫(右);
图2为F2萼下果色分离图;
图3为茄子基因组SNP Delta-index分布图;
图4为引物信息;
图5为测试群体基因分型图(左上蓝点代表萼下紫基因型,右下红点代表萼下绿基因型,中间绿点代表杂合基因型)。
具体实施方式
下面通过具体的实施方案叙述本发明。除非特别说明,本发明中所用的技术手段均为本领域技术人员所公知的方法。本发明所用原料及试剂均有市售,且任何生物种质材料均可对外作为科研研究加以提供。
实施例1分子标记的确定
1.1实验材料
实验于2018年在天津市农业科学院武清创新基地进行,春季以天津农业科学院蔬菜研究所种质资源库的实验种子Y5为母本,Y73为父本,配制组合并收获F1杂交种。2019年春季种植F1代并自交获得F2代种子,2019年秋季同时种植亲本Y5、Y73和F2代种子。6月15日播种育苗,7月16日定植于联栋大棚,亲本材料种植20株,F2群体种植185株,株行距为60cm×70cm,黑色地膜覆盖,常规栽培管理。种植环境为联栋大棚,提前喷施降温遮阳剂,控制浓度,使其遮光率达到83%(指的是DOGAL KIMYEVI MAD.VE ZIRAI ILACLAR SAN.VETIC.A.S.土耳其道格尔公司生产的品牌为欧宝耐的遮阳剂,主要成分为轻质碳酸钙)。
如图1所示,Y5萼片下遮挡部分果色仍为紫色,耐弱光;而Y73萼片遮挡部分为绿色,不耐弱光;F2群体萼下果色出现分离,表现为萼下紫、紫绿和绿。
1.2实验方法
1.2.1田间试验与性状调查
萼下果色性状采集:为最大限度减少人为视觉误差,于对茄商品成熟期集中拍照采集萼下果色性状。
萼下果色分级:根据供试材料亲本及F2群体萼下果色分离表现,按照茄子种质资源描述规范(李锡香和朱德蔚,2006)中绿、紫绿和紫色三类萼下果色划分,制定本试验萼下果色比色板。对照比色板,将采集到的萼下果色性状进行计算机界面目测比色,相近萼下果色性状归类并赋值,例如1=绿色、2=紫绿、3=紫色,进行分类统计分析。
1.2.2极端混合池构建与基因分型
F2群体中挑选30株萼下紫色单株和30株萼下绿色单株,连同2个亲本Y5和Y73,取幼嫩植株叶片1g,利用上海生工植物DNA提取试剂盒基于CTAB法提取DNA。将30个萼下紫F2单株和30个萼下绿F2单株的DNA分别等量混合,构建成萼下紫混合池和萼下绿混合池。2个混合池DNA和2个亲本DNA按照诺唯赞(Vagyme)标准流程构建文库,并通过illuminaHiSeq4000(pare-end 150bp)对2个混合池和两亲本开展30×和10×覆盖度的全基因组重测序。使用FastQC软件进行数据质控(默认参数),对测序得到的原始序列去除接头和低质量序列,再通过BWA软件比对到茄子参考基因组。比对结果经SAMTOOLS的rmdup命令去除重复。采用GATK3.3软件进行多个样本单核苷酸多态性(SNPs)标记和插入缺失(InDels)标记的检测,使用VariantFiltration进行过滤,并利用ANNOVAR软件对SNP和InDel进行注释。
1.2.3基于混合池的萼下果色基因定位与候选基因预测
基于基因分型的结果,筛选亲本间纯合差异的多态性位点。以亲本互为参照,参考TAKAGI等的方法计算2个子代混合池在每个多态性位点上的SNP频率(SNP-index)。为减少测序错误和比对错误造成的影响,对计算出SNP-index后的亲本多态性位点进行过滤,过滤标准如下:(1)2个子代中SNP-index都小于0.3,并且SNP深度都小于5的位点,过滤掉;(2)1个子代SNPindex缺失的位点,过滤掉。随后,计算2个子代SNP-index作差(△SNP-index)。选择2Mb为窗口、5 0kb为步长对△SNP-index在各个染色体上的分布进行作图,选取95%置信水平作为筛选的阈值,置信水平以上的窗口作为候选区间。
1.3实验结果
1.3.1茄子萼下果色性状的初步遗传分析
通过对185株F2代分离群体萼下果色的调查统计,萼下果色为绿的为55株,萼下果色为紫绿的为92株,萼下果色为紫的为38株,整体分离规律为正态分布,符合数量性状遗传特点,可以进行BSA极端混池重测序,见图2。
1.3.2极端群体混合池构建与测序数据分析
对30个萼下紫F2单株和30个萼下绿F2单株构建的混合池以及两亲本开展全基因重测序,总共得到72.39G的原始数据。过滤后4个样本的有效序列数据量在9662.97-26582.26M,总数据量为71.79G。测序数据Q20>97.92%,Q30>93.98%,GC含量在36.09%-36.47%,测序数据有93.7-97.6%的序列可以成功比对到参考基因组。由此可知,所有样本的数据量足够,测序质量合格,GC分布正常,测序数据与茄子参考基因组比对结果正常,可用于后续的变异检测及性状的基因定位。
将萼下紫亲本Y5和萼下绿亲本Y73测序结果比较,共获得2888023个SNPs和111653个InDels。亲本间检测到的SNPs明显多于InDels。根据变异发生的位置进行比较发现,无论SNPs变异还是InDels变异,位于基因非编码区的多态性位点显著多于基因编码区。这些多态性位点在染色体间呈现非均匀分布,其中10号染色体拥有最丰富的多态性位点。
1.3.3萼下果色性状基因定位
分析2个混合池△SNP-index,用于茄子萼下果色性状的基因定位。定位结果显示,分布于茄子12条染色体的1个区域出现了超过临界值水平的极显著峰,说明这个区域可能包含调控茄子萼下果色的基因。显著关联区间在茄子基因组上的分布为Chr10:1.9—5.1Mb。显著关联区间覆盖的染色体长度为3.2Mb。关联区间顶点峰值最高,暗示该区间可能具有引起茄子萼下果色变异的主效基因,见图3。
1.3.4萼下果色候选基因确定
定位结果检测获得的1个显著关联区间分布于茄子第10号染色体3.2Mb区间内,关联区间峰值最高,是控制萼下果色性状的主效位点。同时,发现位于10号染色体关联区间有1个候选基因,位于1.9M到5.1M,在2618643位置处从A突变为G,发生于基因外显子区,产生了非同义突变,为衰老基因。后续的育种实践中发现:萼下紫色茄子材料确实比萼下绿色材料果皮颜色受光照影响小,弱光时皮色不斑驳,光泽持续时间长,同时,种子成熟时间也晚(不易衰老)。
实施例2分子标记的特异性引物的确定
2.1变异碱基前后100bp碱基信息
>SNP1→chr10→2618543→2618743
AAGCAATGGATATGGGAAGTGCTGGCAAGGCATGTCGACACACAGCTAACAATATAAGTGTGCACCCTAATCCAGATATAATAGCGAGATAACAAGCAT[A/G]AACAGTCATCAAATCATACATTGCAGCTCTCCCCACCAACACACTATAGAAAACAAAATCTCCTAAACCAAGCTTTATCCCCCTCCCTCTCTCCTCCTCT
2.2根据变异碱基信息设计KASP引物
如图4,所述KASP引物包括上游引物1、上游引物2以及下游引物。
上游引物1:
GAAGGTGACCAAGTTCATGCTGCTGCAATGTATGATTTGATGACTGTTT。
上游引物2:
GAAGGTCGGAGTCAACGGATTGCTGCAATGTATGATTTGATGACTGTTC。
下游引物:CAATGGATATGGGAAGTGCTGGC。
上游引物1的序列如SEQ ID NO:2所示,上游引物2的序列如SEQ ID NO:3所示,下游引物的序列如SEQ ID NO:4所示。
生物实验表明,上述引物组合能在退火温度接近61℃时进行梯度PCR扩增,特异性极高。
进一步的,将所述的KASP引物采用荧光素进行标记。
进一步的,所述标记的荧光素为HEX和FAM。
实施例3分子标记的验证
3.1试验材料
2020年秋季和2021年春季育种材料,包括萼下紫色和萼下绿色茄子两种类型,共计91个实验材料。
3.2试验方法
(1)播种待检测紫茄子种子,采用32穴育苗盘,每穴播种1粒种子,常规栽培管理。
(2)苗期一叶一心时取待检测幼苗一片子叶于2mL离心管中运回实验室;
(3)每个离心管内放两颗2mm直径钢珠,采用高通量组织研磨器(宁波新芝Scientz-48)破碎,频率设定69Hz,时间设定60s;
(4)DNA提取过程中65℃水浴60min;
(5)体积比为25:24:1的苯酚-氯仿-异戊醇抽提,颠倒混匀次数10次,12000rpm转速,离心时间4分钟;
(6)取上清200uL,加入等体积无水乙醇,4℃静置1小时,12000rpm转速,离心时间4分钟;
(7)倒掉上部液体后加入500ul dd H
(8)溶解后的DNA经过核酸蛋白仪浓度检测后统一调整为1-10ng/uL。
(9)取2uLDNA采用KASP鉴定体系对茄子品种和自交系进行连锁标记辅助筛选。
上述实验中,所述KASP的引物组如下:
Forward
primer1:GAAGGTGACCAAGTTCATGCTGCTGCAATGTATGATTTGATGACTGTTT
Forward
primer2:GAAGGTCGGAGTCAACGGATTGCTGCAATGTATGATTTGATGACTGTTC
Reverse primer:CAATGGATATGGGAAGTGCTGGC由擎科生物合成。
上述实验中采用的药品及材料来源:北京嘉程生物科技有限公司HiGeno 2xProbe Mix、引物、DNA模板、dd H
上述实验中采用KASP标准反应体系为:总共10uL,包括5uL Mix(北京嘉程生物科技有限公司HiGeno 2x Probe Mix),2.86uL dd H
上述实验中PCR程序为:95℃预变性10min;10×循环(95℃变性20s,61-55℃退火40s,每循环降低0.6℃);40×循环(95℃变性20s,55℃退火40s);最后25℃保存备用。
上述实验中,为了保证基因分型数据的准确性,除测试样品外,在PCR板上使用已知基因型对照样品2个,对照样品应聚集在其基因型的预期区域中。
上述实验中,采用7500实时荧光定量PCR仪检测,选择genetyping功能进行分析。HEX和FAM荧光信号值分别绘制在x轴和y轴上。根据荧光信号值,对样品进行聚类分簇,进一步根据样品簇确定基因型。
3.3试验结果
验证结果显示,该标记符合率可达85-95%,例如表1和图5。表明本发明的分子标记可以很好地辅助筛选田间育种材料。
表1萼下果色连锁分子标记验证群体信息
验证结果还发现:萼片覆盖下果皮色仍为紫的茄子品种耐弱光性较强,表现为弱光下果皮颜色不易变浅,而萼片覆盖下果皮色变绿的茄子品种耐弱光性较差,表现为弱光下果皮颜色易变浅、斑驳,甚至过早失去光泽,严重影响果实商品性。
序列表
<110> 天津市农业科学院
<120> 一种与茄子萼片覆盖下果皮颜色相关的分子标记及应用
<130> 2021
<160> 4
<170> SIPOSequenceListing 1.0
<210> 1
<211> 200
<212> DNA
<213> Solanum melongena
<400> 1
aagcaatgga tatgggaagt gctggcaagg catgtcgaca cacagctaac aatataagtg 60
tgcaccctaa tccagatata atagcgagat aacaagcata aacagtcatc aaatcataca 120
ttgcagctct ccccaccaac acactataga aaacaaaatc tcctaaacca agctttatcc 180
ccctccctct ctcctcctct 200
<210> 2
<211> 49
<212> DNA
<213> Solanum melongena
<400> 2
gaaggtgacc aagttcatgc tgctgcaatg tatgatttga tgactgttt 49
<210> 3
<211> 49
<212> DNA
<213> Solanum melongena
<400> 3
gaaggtcgga gtcaacggat tgctgcaatg tatgatttga tgactgttc 49
<210> 4
<211> 23
<212> DNA
<213> Solanum melongena
<400> 4
caatggatat gggaagtgct ggc 23
- 一种与茄子萼片覆盖下果皮颜色相关的分子标记及应用
- 一种与茄子萼片覆盖下果皮颜色相关的分子标记及应用
