有机化合物及其制备方法
文献发布时间:2023-06-19 11:03:41
技术领域
本申请属于有机分子技术领域,尤其涉及一种有机化合物及其制备方法。
背景技术
现有的经典轴手性配体骨架有:1,1'-联二萘酚(I),螺环二酚(II),5,5',6,6',7,7',8,8'-八氢-[1,1'-联萘]-2,2'-二酚(III),2,2’,6,6’-取代的联苯(IV)等,也有醚链(V),碳链(VI)的联苯二酚等类型,结构式如下:
但是,不同的不对称配体骨架催化剂合成过程中,配体和底物作用模式往往是独特而微妙的,配体及底物上的一点点变化,都会导致产物反应性和选择性发生急剧变化,限制了手性配体骨架催化剂的发展和应用。
发明内容
本申请的目的在于提供一种包含手性二苯并[e,g][1,4]二氮杂环辛四烯骨架的有机化合物及其制备方法,旨在一定程度上解决现有手性配体骨架通用性差,配体及底物上的一点点变化,都会导致产物反应性和选择性发生急剧变化,且手性化合物骨架类型少的技术问题。
为实现上述申请目的,本申请采用的技术方案如下:
第一方面,本申请提供一种有机化合物,所述有机化合物包含手性二苯并[e,g][1,4]二氮杂环辛四烯骨架,所述有机化合物的结构通式如下式I或式II所示:
第二方面,本申请提供一种有机化合物的制备方法,包括以下步骤:
将1,1'-联苯-2,2'-二胺衍生物、偶苯酰衍生物和手性磷酸催化剂溶解在有机溶剂中,进行催化反应,得到包含手性二苯并[e,g][1,4]二氮杂环辛四烯骨架的有机化合物;
其中,所述有机化合物的结构通式为式I或式II:
本申请第一方面提供的有机化合物包含手性二苯并[e,g][1,4]二氮杂环辛四烯骨架,和连接在该骨架结构上的取代基R
本申请第二方面提供的有机化合物的制备方法,将1,1'-联苯-2,2'-二胺衍生物、偶苯酰衍生物溶解在有机溶剂中,在手性磷酸催化剂的催化作用下反应,即可得到包含手性二苯并[e,g][1,4]二氮杂环辛四烯骨架的有机化合物。本申请包含手性二苯并[e,g][1,4]二氮杂环辛四烯骨架的有机化合物的制备方法,工艺简单,条件温和,适用于大规模生产和应用。且制备的包含手性二苯并[e,g][1,4]二氮杂环辛四烯骨架的有机化合物结构稳定性好,催化活性高,应用范围广。
附图说明
为了更清楚地说明本申请实施例中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本申请的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
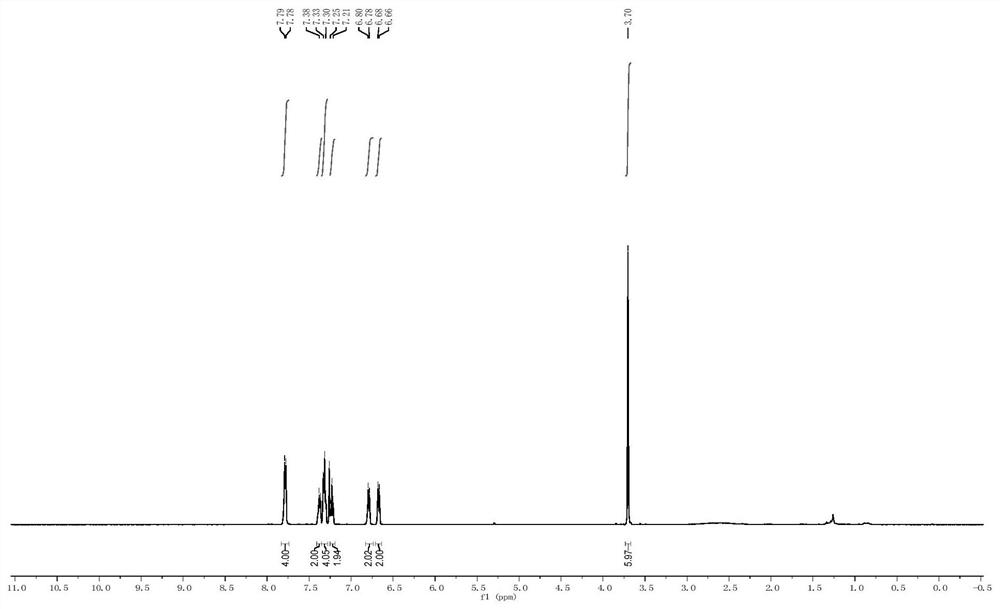
图1是本申请实施例提供的化合物(R)-3的核磁共振氢谱图;
图2是本申请实施例提供的化合物A的核磁共振氢谱图;
图3是本申请实施例提供的化合物B的核磁共振氢谱图;
图4是本申请实施例提供的化合物C的核磁共振氢谱图
图5是本申请实施例提供的化合物D的核磁共振氢谱图;
图6是本申请实施例提供的化合物E的核磁共振氢谱图;
图7是本申请实施例提供的化合物F的核磁共振氢谱图;
图8是本申请实施例提供的化合物G的核磁共振氢谱图;
图9是本申请实施例提供的化合物H的核磁共振氢谱图;
图10是本申请实施例提供的化合物I的核磁共振氢谱图;
图11是本申请实施例提供的化合物J的核磁共振氢谱图。
具体实施方式
为了使本申请要解决的技术问题、技术方案及有益效果更加清楚明白,以下结合实施例,对本申请进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本申请,并不用于限定本申请。
本发明中,术语“和/或”,描述关联对象的关联关系,表示可以存在三种关系,例如,A和/或B,可以表示:单独存在A,同时存在A和B,单独存在B的情况。其中A,B可以是单数或者复数。字符“/”一般表示前后关联对象是一种“或”的关系。
本发明中,“至少一个”是指一个或者多个,“多个”是指两个或两个以上。“以下至少一项(个)”或其类似表达,是指的这些项中的任意组合,包括单项(个)或复数项(个)的任意组合。例如,“a,b或c中的至少一项(个)”,或,“a,b和c中的至少一项(个)”,均可以表示:a,b,c,a-b(即a和b),a-c,b-c,或a-b-c,其中a,b,c分别可以是单个,也可以是多个。
应理解,在本发明的各种实施例中,上述各过程的序号的大小并不意味着执行顺序的先后,部分或全部步骤可以并行执行或先后执行,各过程的执行顺序应以其功能和内在逻辑确定,而不应对本发明实施例的实施过程构成任何限定。
在本发明实施例中使用的术语是仅仅出于描述特定实施例的目的,而非旨在限制本发明。在本发明实施例和所附权利要求书中所使用的单数形式的“一种”和“该”也旨在包括多数形式,除非上下文清楚地表示其他含义。
本发明实施例说明书中所提到的相关成分的重量不仅仅可以指代各组分的具体含量,也可以表示各组分间重量的比例关系,因此,只要是按照本发明实施例说明书相关组分的含量按比例放大或缩小均在本发明实施例说明书公开的范围之内。具体地,本发明实施例说明书中的质量可以是μg、mg、g、kg等化工领域公知的质量单位。
术语“第一”、“第二”仅用于描述目的,用来将目的如物质彼此区分开,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。例如,在不脱离本发明实施例范围的情况下,第一XX也可以被称为第二XX,类似地,第二XX也可以被称为第一XX。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。
本申请实施例第一方面提供一种有机化合物,有机化合物包含手性二苯并[e,g][1,4]二氮杂环辛四烯骨架,有机化合物的结构通式如下式I或式II所示:
本申请实施例第一方面提供的有机化合物包含手性二苯并[e,g][1,4]二氮杂环辛四烯骨架,和连接在该骨架结构上的取代基R
在一些实施例中,本申请实施例包含手性二苯并[e,g][1,4]二氮杂环辛四烯骨架的有机化合物,包括如下衍生化合物:
中的至少一种,其中,R和R’分别独立地选自:烷基、芳基、杂芳基中的至少一种,其他取代基可选类型同后具体实施例。在一些具体实施例中,本申请实施例包含手性二苯并[e,g][1,4]二氮杂环辛四烯骨架的有机化合物中,R和R’为苯基,包括如下衍生化合物:
中的至少一种。其中,R
本申请实施例提供的包含有手性二苯并[e,g][1,4]二氮杂环辛四烯骨架的衍生化合物可通过如下方法制得。
本申请实施例第二方面提供一种有机化合物的制备方法,包括以下步骤:
将1,1'-联苯-2,2'-二胺衍生物、偶苯酰衍生物和手性磷酸催化剂溶解在有机溶剂中,进行催化反应,得到包含手性二苯并[e,g][1,4]二氮杂环辛四烯骨架的有机化合物;
其中,1,1'-联苯-2,2'-二胺衍生物的结构式为:
在一些实施例中,将1,1'-联苯-2,2'-二胺衍生物、偶苯酰衍生物和手性磷酸催化剂溶解在四氢呋喃等有机溶剂中,在温度为60~80℃的条件下催化反应12~48小时,得到包含手性二苯并[e,g][1,4]二氮杂环辛四烯骨架的有机化合物。
在一些具体实施例中,合成路线如下:
本申请实施例第二方面提供的有机化合物的制备方法,将1,1'-联苯-2,2'-二胺衍生物、偶苯酰衍生物溶解在有机溶剂中,在手性磷酸催化剂的催化作用下反应,即可得到包含手性二苯并[e,g][1,4]二氮杂环辛四烯骨架的有机化合物。本申请实施例包含手性二苯并[e,g][1,4]二氮杂环辛四烯骨架的有机化合物的制备方法,工艺简单,条件温和,适用于大规模生产和应用。且制备的包含手性二苯并[e,g][1,4]二氮杂环辛四烯骨架的有机化合物结构稳定性好,催化活性高,应用范围广。
在一些实施例中,1,1'-联苯-2,2'-二胺衍生物选自手性或者消旋的6,6'-二甲氧基-[1,1'-联苯]-2,2'-二胺;偶苯酰衍生物选自偶苯酰;有机化合物的制备包括以下步骤:
S10.将手性或者消旋的6,6'-二甲氧基-[1,1'-联苯]-2,2'-二胺与偶苯酰和手性磷酸催化剂溶解在第一有机溶剂中,进行缩合反应,得到化合物(R)-3;
S20.将化合物(R)-3中一个或两个甲氧基转化为羟基,分别得到化合物A,
本申请实施例以手性或者消旋的6,6'-二甲氧基-[1,1'-联苯]-2,2'-二胺和偶苯酰为原料,通过手性磷酸催化剂的催化作用,发生脱水缩合反应,得到R
在一些实施例中,步骤S10中,按手性的6,6'-二甲氧基-[1,1'-联苯]-2,2'-二胺(R)-1与偶苯酰2的当量比为1:(1~1.3),将两者与20mol%的磷酸二苯酯质子酸催化剂(Diphenyl phosphate)溶解在四氢呋喃(THF)、二氧六环、乙二醇二甲醚、甲苯等第一有机溶剂中后,在温度为60~80℃的加热条件下,进行脱水缩合反应12~36小时,分离得到化合物(R)-3。
在另一些实施例中,步骤S10中,按消旋的6,6'-二甲氧基-[1,1'-联苯]-2,2'-二胺(rac)-1与偶苯酰2的当量比为1:(2~2.3),将两者与10mol%的手性磷酸(S)-CPA为催化剂溶解在四氢呋喃(THF)等第一有机溶剂中后,在温度为20~38℃的室温条件下,进行不对称缩合反应1~3天,分离得到化合物(R)-3。
在一些实施例中,步骤S20中,将化合物(R)-3中一个或两个甲氧基转化为羟基的步骤包括:将化合物(R)-3、三(五氟苯基)硼、三乙基硅烷与第二有机溶剂进行混合处理后,添加氟化钾和乙醇进行反应,分离得到化合物A和化合物B。具体地,在室温条件下,将化合物(R)-3、三(五氟苯基)硼、三乙基硅烷溶剂在二氯甲烷(DCM)、三氯甲烷、甲苯等第二有机溶剂中,搅拌4~8小时,三(五氟苯基)硼作为催化剂将化合物(R)-3中一个或两个甲氧基的甲基脱除,连接上三乙基硅基(TES保护基团)后,再添加氟化钾和乙醇搅拌12~24小时,使TES保护基团置换为羟基,分离得到化合物A,
在另一些实施例中,将化合物(R)-3中一个或两个甲氧基转化为羟基的步骤包括:在不高于0℃的条件下,向化合物(R)-3的溶液(溶剂可为二氯甲烷、三氯甲烷等)中滴加BBr
在一些实施例中,化合物A和B的合成路线如下:
在一些实施例中,还包括步骤:将化合物A与六甲基磷酰三胺溶解在第三有机溶剂中,反应得到化合物C,
在一些实施例中,还包括步骤:将化合物A与六乙基亚磷酸胺溶解在第四有机溶剂中,反应得到化合物D,
在一些实施例中,还包括步骤:在不高于0℃的条件下,将二异丙胺滴加到三氯化磷和三乙胺的混合溶液后,在室温下反应;然后,添加化合物A和三乙胺的混合溶液,反应得到化合物E,
在一些实施例中,还包括步骤:在不高于0℃的条件下,将(+)-二[(R)-1-苯乙基]胺滴加到三氯化磷和三乙胺的混合溶液后,在室温下反应;然后,添加化合物A和三乙胺的混合溶液,反应得到化合物F,
在一些实施例中,还包括步骤:将化合物A与吡啶和三氯氧磷混合后,在70~90℃的条件下反应,然后添加水,在40~60℃的条件下反应;再添加盐酸,在90~120℃的条件下反应,分离得到化合物G,
在一些实施例中,化合物C、D、E、F和G的合成路线如下:
在一些实施例中,还包括步骤:将化合物B与三氟甲磺酸酐(Tf
将化合物(R)-7与醋酸钯等第一钯催化剂、1,3-双(二苯基膦)丙烷、N,N-二异丙基乙基胺和二苯基氧膦溶解在二甲基亚砜等第六有机溶剂中,反应得到化合物(R)-8。优选地,反应体系中,第一钯催化剂的摩尔浓度为10~15mol%,1,3-双(二苯基膦)丙烷的摩尔浓度为23~28mol%。优选地,化合物(R)-7与N,N-二异丙基乙基胺和二苯基氧膦的当量比为1:(3~5):(1~2)。优选地,反应条件为:在90~110℃的加热条件下反应12~36小时。
将(R)-8与三氯硅烷和N,N-二甲基苯胺溶解在甲苯等第七有机溶剂中,反应得到化合物H,
在一些实施例中,化合物H的合成路线如下:
在一些实施例中,还包括步骤:将化合物A与三氟甲磺酸酐和吡啶溶解在二氯甲烷等第八有机溶剂中,反应得到化合物(R)-9。优选地,化合物A与三氟甲磺酸酐和吡啶的当量比为1:(4~6):(9~11)。优选地,反应条件为:室温下反应24~36小时。
将化合物(R)-9与醋酸钯等第二钯催化剂、1,4-双(二苯基膦)丁烷、N,N-二异丙基乙基胺(DIPEA)和二苯基膦溶解在二甲基亚砜等第九有机溶剂中,反应得到化合物I,
在一些实施例中,还包括步骤:将化合物(R)-9与醋酸钯等第三钯催化剂、1,3-双(二苯基膦)丙烷、N,N-二异丙基乙基胺(DIPEA)和二苯基氧膦溶解在二氯甲烷等第十有机溶剂中,反应得到化合物(R)-10。优选地,反应体系中,第三钯催化剂的摩尔浓度为20~30mol%,1,3-双(二苯基膦)丙烷的摩尔浓度为40~60mol%。优选地,化合物(R)-9与N,N-二异丙基乙基胺和二苯基氧膦的当量比为1:(7~9):(2~5)。优选地,反应条件为:在90~110℃的加热条件下反应12~36小时。
将化合物(R)-10与三氯硅烷、N,N-二甲基苯胺溶解在甲苯等第十一有机溶剂中,反应得到化合物(R)-11。优选地,化合物(R)-10与三氯硅烷的当量比为1:(65~75)。优选地,反应条件为:在90~110℃的加热条件下反应12~36小时。
将化合物(R)-11与醋酸钯等第四钯催化剂、1,4-双(二苯基膦)丁烷、N,N-二异丙基乙基胺(DIPEA)和二苯基氧膦溶解在二甲基亚砜等第十二有机溶剂中,反应得到化合物J,
在一些实施例中,还包括步骤:将化合物(R)-11与醋酸钯等第五钯催化剂、1,4-双(二苯基膦)丁烷、N,N-二异丙基乙基胺和二苯基氧膦溶解在二甲基亚砜等第十三有机溶剂中,反应得到化合物K,
在一些实施例中,化合物I、J和K的合成路线如下:
本申请上述实施例合成的包含手性二苯并[e,g][1,4]二氮杂环辛四烯骨架的衍生化合物化合物C~F,可以作为手性亚磷酰胺配体,相比其他手性膦配体由于其骨架结构稳定,合成简便,易于修饰等优点,因此,可广泛应用于多种不对称催化反应,如:不对称氢化反应,不对称共轭加成反应,不对称烯丙基化反应,不对称Heck反应,不对称环加成反应,不对称偶联反应等等,均能表现出优异的催化性能,且催化效果稳定。
本申请上述实施例合成的包含手性二苯并[e,g][1,4]二氮杂环辛四烯骨架的衍生化合物G,可以作为手性磷酸催化剂,应用于质子酸催化的不对称反应中,应用非常广泛。
本申请上述实施例合成的包含手性二苯并[e,g][1,4]二氮杂环辛四烯骨架的衍生化合物H,可以作为手性单磷配体可以和钯共同催化烯烃的不对称氢化硅烷化反应。
本申请上述实施例合成的包含手性二苯并[e,g][1,4]二氮杂环辛四烯骨架的衍生化合物I-K,可以作为手性双磷配体,和Ru,Pd,Ag,Rh,Ir,Au等各种金属配合催化各种不对称反应,如:Tsuji-Trost Allylation反应,不对称共轭加成反应,Buchwald-Hartwig反应,不对称Micheal加成反应,不对称环加成反应,不对称Aldol反应,不对称Heck反应,不对称亲核加成反应等等,均能表现出优异的催化性能,且催化效果稳定。
为使本申请上述实施细节和操作能清楚地被本领域技术人员理解,以及本申请实施例包含手性二苯并[e,g][1,4]二氮杂环辛四烯骨架的有机化合物及其制备方法的进步性能显著的体现,以下通过多个实施例来举例说明上述技术方案。
实施例1
一种包含手性6,7-二苯基二苯并[e,g][1,4]二氮杂环辛四烯骨架的衍生化合物A和B,包括以下制备步骤:
方法一:取手性6,6'-二甲氧基-[1,1'-联苯]-2,2'-二胺(R)-1与偶苯酰2(1.1eq.)加入THF中,用20mol%的磷酸二苯酯做催化剂,在70℃下反应24小时,以95%的产率获得(R)-3。
方法二:取消旋的6,6'-二甲氧基-[1,1'-联苯]-2,2'-二胺(rac)-1与偶苯酰2(2eq.)加入THF中,用10mol%手性磷酸(S)-CPA为催化剂,在35℃下反应48小时,以48%收率,68%ee获得(R)-3,在经过一步原位沉淀及相分离可以99%ee获得(R)-3。
(R)-3与三(五氟苯基)硼(30mol%),三乙基硅烷(5.0eq.)在DCM中室温搅拌5小时,再加入氟化钾和乙醇,室温搅拌12小时。分别以72%和16%的收率得到化合物A和B。
合成路线如下:
实施例2
一种包含手性6,7-二苯基二苯并[e,g][1,4]二氮杂环辛四烯骨架的衍生化合物C,包括制备步骤:化合物A与六甲基磷酰三胺(HMPT,1.5eq.)在甲苯溶液中,115℃反应6小时后,以63%的产率得到化合物C。
实施例3
一种包含手性6,7-二苯基二苯并[e,g][1,4]二氮杂环辛四烯骨架的衍生化合物D,包括制备步骤:化合物A与六乙基亚磷酸胺(HEPT,1.5eq.)在甲苯溶液中,115℃反应6小时后,以72%的产率得到化合物D。
实施例4
一种包含手性6,7-二苯基二苯并[e,g][1,4]二氮杂环辛四烯骨架的衍生化合物E,包括制备步骤:取干燥Schlenk管,加入DCM,三氯化磷(2eq.)和三乙胺(10eq.),再置于0℃下,滴加二异丙胺5后缓慢升至室温反应7小时;再加化合物A(1eq.)和三乙胺(2eq.)的DCM溶液,室温反应18小时,以65%的产率得到化合物E。
实施例5
一种包含手性6,7-二苯基二苯并[e,g][1,4]二氮杂环辛四烯骨架的衍生化合物F,包括制备步骤:取干燥Schlenk管,加入DCM,三氯化磷(2eq.)和三乙胺(10eq.),再置于0℃下,滴加化合物6(2eq.)后缓慢升至室温反应7小时;再加化合物A(1eq.)和三乙胺(2eq.)的DCM溶液,室温反应18小时,以56%的产率得到化合物F。
实施例6
一种包含手性6,7-二苯基二苯并[e,g][1,4]二氮杂环辛四烯骨架的衍生化合物G,包括制备步骤:取干燥Schlenk管,加入化合物A与吡啶1mL,再加入现蒸的三氯氧磷(2eq.),在80℃反应5小时后,加入0.2mL水,50℃反应12小时,反应结束后再加入6N HCl(6mL)在100℃下反应30分钟,反应完后用乙酸乙酯和水(1:1)萃取,收集乙酸乙酯相再减压旋蒸,残渣用乙酸乙酯和石油醚重结晶,收集固体,以45%的产率得到化合物G。
实施例2~6的合成路线如下:
实施例7
一种包含手性6,7-二苯基二苯并[e,g][1,4]二氮杂环辛四烯骨架的衍生化合物H,包括制备步骤:
取化合物B与三氟甲磺酸酐(2eq.)和吡啶(4eq.),加入DCM溶液中,室温反应24小时,以78%产率得到化合物(R)-7;
(R)-7与醋酸钯(12.5mol%)、1,3-双(二苯基膦)丙烷(25mol%)、N,N-二异丙基乙基胺(4eq.)和二苯基氧膦(1.5eq.),在二甲基亚砜溶液中,100℃反应24小时,以89%的产率得到化合物(R)-8;
(R)-8与三氯硅烷(35eq.)、N,N-二甲基苯胺,在甲苯溶液中,100℃反应24小时,以74%的产率得到化合物H。
合成路线如下:
实施例8
一种包含手性6,7-二苯基二苯并[e,g][1,4]二氮杂环辛四烯骨架的衍生化合物I,包括制备步骤:
化合物A和三氟甲磺酸酐(5eq.)、吡啶(10eq.),在DCM溶液中,室温反应24小时,以95%产率得到化合物(R)-9;
(R)-9与醋酸钯(25mol%)、1,4-双(二苯基膦)丁烷(50mol%)、N,N-二异丙基乙基胺和二苯基膦(6eq.),在二甲基亚砜溶液中,125℃反应24小时,以36%的产率得到化合物I。
实施例9
一种包含手性6,7-二苯基二苯并[e,g][1,4]二氮杂环辛四烯骨架的衍生化合物J,包括制备步骤:
(R)-9与醋酸钯(25mol%)、1,3-双(二苯基膦)丙烷(50mol%)、N,N-二异丙基乙基胺(8eq.)和二苯基氧膦(3eq.),100℃反应24小时,以78%的产率得到化合物(R)-10;
(R)-10与三氯硅烷(70eq.)、N,N-二甲基苯胺,在甲苯溶液中,100℃反应24小时,以86%的产率得到化合物(R)-11;
(R)-11与醋酸钯(20mol%)、1,4-双(二苯基膦)丁烷(50mol%)、N,N-二异丙基乙基胺和二苯基氧膦(3eq.),在二甲基亚砜溶液中,100℃反应12小时,以50%的产率得到化合物J。
实施例10
一种包含手性6,7-二苯基二苯并[e,g][1,4]二氮杂环辛四烯骨架的衍生化合物K,包括制备步骤:
(R)-11与醋酸钯(20mol%)、1,4-双(二苯基膦)丁烷(50mol%)、N,N-二异丙基乙基胺和二苯基氧膦(3eq.),在二甲基亚砜溶液中,100℃反应36小时,以60%的产率得到化合物K。
实施例8~10合成路线如下:
进一步的,本申请对实施例1~10合成的手性6,7-二苯基二苯并[e,g][1,4]二氮杂环辛四烯骨架衍化合物分别进行了核磁定性分析,实施例1~10中化合物A~K的核磁数据如下所示:
(R)-3
1H NMR(500MHz,CDCl3)δ7.78(d,J=7.5Hz,4H),7.38(t,J=6.7Hz,2H),7.32(t,J=7.4Hz,4H),7.23(t,J=8.1Hz,2H),6.79(d,J=7.9Hz,2H),6.67(d,J=8.2Hz,2H),3.70(s,6H).13C NMR(125MHz,CDCl3)δ167.11,158.00,152.29,134.01,131.73,129.06,128.74,128.28,114.63,112.88,107.49,55.93.
化合物A
化合物B
化合物C
化合物D
化合物E
化合物F
化合物G
化合物H
化合物I
化合物J
以上所述仅为本申请的较佳实施例而已,并不用以限制本申请,凡在本申请的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本申请的保护范围之内。
- 氘化有机化合物的制备方法及根据该制备方法制备的氘化有机化合物
- 氢或重氢的制造方法、氢化或重氢化有机化合物的制造方法、有机化合物的氢化或重氢化方法、具有卤素的有机化合物的脱卤化方法、机械化学反应用球
