一种具有除草作用的短梗霉素及其制备方法、测定方法
文献发布时间:2023-06-19 11:08:20
技术领域
本发明属于除草剂制备技术领域,尤其涉及一种具有除草作用的短梗霉素 及其制备方法、测定方法。
背景技术
目前:杂草是危害农业生产的一个重要因素,通过与作物竞争水分、养分 和光照等生长必须条件造成作物的产量和质量受到严重影响。现阶段我国农田 杂草治理仍以化学除草为主,每年投入防治费用235亿元,仍然导致粮食减产 5000万t,直接经济损失千亿元。农业效率的增高很大程度上仍然依赖于化学除 草剂的应用,因此开发新型高效、环境友好的绿色除草剂具有重要的现实意义。 近年来,微生物源除草剂由于其对环境的副作用小和易降解等优点,逐渐进入 了人们的视线,并成为绿色农业和放心农产品理念下的主要趋势。短梗霉素是 出芽短梗霉菌产生的环肽类抗生素,表现出很强的抗菌活性,主要是由于该抗 生素能强烈抑制真菌肌醇磷脂酰神经酰胺合成酶的活性,导致鞘磷脂类物质的 合成不足,细胞膜结构遭到破坏,细胞内物质外渗,导致真菌死亡。因此,该 抗生素在农业和食品方面常常被用作生防制剂和保鲜剂。然而到目前为止,关 于对短梗霉素的除草活性方面的应用及其除草机制方面的研究尚未见报道。本 发明的目的是拓展短梗霉素化合物的用途,提供短梗霉素化合物作为农用除草 剂的新用途。
通过上述分析,现有技术存在的问题及缺陷为:现有技术是对短梗霉素的 应用仅仅在杀菌活性领域,而没有将短梗霉素应用到除草活性中。
解决以上问题及缺陷的难度为:发明人对该化合物制备方法和生物测定方 法以及对多种杂草的活性进行了深入研究,实验结果发现,短梗霉素对杂草具 有较好的防除作用,为把该化合物开发成一种新型除草剂提供了一种新的思路。
发明内容
针对现有技术存在的问题,本发明提供了一种具有除草作用的短梗霉素及 其制备方法。
本发明是这样实现的,一种具有除草作用的短梗霉素及其制备方法包括:
步骤一,菌株活化与发酵:利用出芽短梗霉菌PA-2(保藏编号:CGMCC No.8413,于2013年10月28日保藏在中国北京市朝阳区北辰西路1号院3号 中国微生物菌种保藏管理委员会普通微生物中心)制备孢子悬浮液,接种于种 子培养基中进行活化,然后转入到发酵罐中进行发酵;
步骤二,发酵生产优化:从温度、装液量、培养时间和转速4个方面对培 养条件进行优化;
步骤三,短梗霉素的粗提物制备:取发酵液,弃去菌体,利用大孔树脂进 行振荡吸附,对吸附后的树脂进行清洗,洗脱后减压干燥,即为出芽短梗霉菌 PA-2的短梗霉素粗提物;
步骤四,短梗霉素的分离纯化:通过薄层层析初步分离,得到短梗霉素产 物样品,然后通过高效液相色谱对样品进行制备,得到分离纯化后的短梗霉素。
进一步,步骤一中,所述菌株活化与发酵具体包括:
(1)取-80℃甘油保藏菌株PA-2放置于冰浴器中,待甘油成融化状态时, 在超净工作台中倒掉甘油,挖取一块菌苔置于马铃薯葡萄糖固体培养基中,25℃ 培养基3~5d,刮取菌落表面,制备孢子悬浮液;
(2)将5mL孢子悬浮液接种于150mL的种子培养基中,25℃、180r/m振 荡培养2d进行活化;
(3)将150mL种子培养基转入到含有15L发酵培养基A的30L发酵罐 中,在25℃、180r/m条件下振荡培养56h,然后加入2L发酵培养基B,在25℃、 180r/m条件下,继续振荡培养88h,获得发酵液。
进一步,所述种子培养基包括0.67%yeast nitrogen base和2%glucose,所述PDA固体培养基包括2%potato、2%glucose和1.5%agar;
所述发酵培养基A包括4%glucose、3%skim milk、3%soybean flour、0.5%(NH
进一步,步骤三中,所述短梗霉素的粗提物制备具体包括:
取发酵液30L,10000r/m离心,弃去菌体,加入3%的大孔树脂XAD-16, 室温置于摇床振荡,120r/m,24h;吸附后的树脂用蒸馏水清洗至树脂表面无发 酵液残留,然后置于1000mL具塞三角瓶中,加入300mL无水乙醇,室温下, 置于摇床洗脱24h,然后减压干燥,即为出芽短梗霉菌PA-2的短梗霉素粗提物。
进一步,步骤四中,所述短梗霉素的分离纯化具体包括:
(1)薄层层析初步分离:采用硅胶板作为层析固定相,层析试剂为二氯 甲烷∶甲醇∶水=65∶25∶4(v∶v∶v),首先分别将粗提物以及短梗霉素标准 样品溶解在少量的甲醇中,点样于硅胶板上进行层析,粗提物各点两块板,在 层析系统中展开2h,挥发干试剂后,其中一块以茚三酮显色,另一块放在耐高 温的密闭容器中,以小杯盛约2mL浓盐酸,将其放入110℃烘箱中熏蒸3h进行 原位水解,然后冷却、吹去盐酸,用茚三酮显色,在放入110℃烘箱中熏蒸1h 观察结果,确认短梗霉素的位置;取同样条件薄层层析后的分析板,在与对应 显色位点刮取硅胶并收集硅胶粉末,用甲醇浸泡洗脱、浓缩,即为短梗霉素样 品,供高效液相色谱分析;
(2)高效液相色谱分析:将短梗霉素样品和标准品,用流动相溶解后过 0.22μm的针孔式有机滤膜除菌除杂,平衡色谱柱后再加入样品等梯度洗脱分离 样品化合物,根据标准样品与粗提样品的出峰时间,重复收集样品峰10次;
(3)短梗霉素结构鉴定:采用质谱仪测定短梗霉素的分子量;称取样品5mg 分别溶于0.5mL CD
本发明的另一目的在于提供一种具有除草作用的短梗霉素的测定方法,所 述具有除草作用的短梗霉素的测定方法包括短梗霉素化合物除草活性测定、短 梗霉素化合物理化性质的测定和短梗霉素化合物除草机制的测定。
进一步,所述短梗霉素化合物除草活性测定包括:
1)种子萌发法:
将短梗霉素用二甲基亚砜配制成100、50、10μg/mL 3种浓度的溶液,分别 取1mL待测液均匀加入到铺有双层滤纸的12孔培养板中,待溶剂挥发干后,选 取10粒催芽后的杂草种子均匀散在上述处理好的培养板孔中,以清水作对照, 每个处理4次重复,将12孔培养板置于25℃、相对湿度70%的恒温培养箱中培 养,3天后测量杂草种子胚根和胚芽长度,利用下式计算胚根(芽)抑制率,
2)盆栽除草效果测定:
将试验杂草种子分别播种于小盆中,每盆20~30株/盆;待各种植物长至 3~5叶期时,分别用浓度为100、50、10μg/mL的短梗霉素叶面喷施杂草植株, 以叶面喷湿而药液不滴为度,对照喷清水;每处理重复4次,施药7天后测量 株高、株数和鲜重,计算株高抑制率、株防效和鲜重效,同时观察杂草中毒症 状,
3)田间小区除草试验:
田间试验在试验田进行,随机区组排列,小区面积8m
进一步,所述短梗霉素化合物理化性质的测定包括:
1)对温度的敏感性测定:
将短梗霉素分别在25℃、35℃、55℃、65℃、85℃、100℃、121℃下处理 30min,冷却至室温后利用种子萌发法检测其除草活性,以对应温度处理的无菌 水为对照,观察其除草活性变化;
2)对酸、碱的敏感性测定:
用6M的HCI或NaOH将短梗霉素分别调pH值至2.0、3.0、4.0、5.0、6.0、 7.0、8.0、9.0、10.0、11.0、12.0,静置15min后10000r/min离心10min,保留 上清液,采用种子萌发的方法检测其除草活性,以对应pH值的无菌水为对照, 观察其除草活性变化;
3)对蛋白酶的敏感性测定:
将短梗霉素分别用胰蛋白酶、胃蛋白酶、蛋白酶K 37℃处理1h后94℃处 理10min停止酶反应,酶反应浓度为500μg/mL;12000r/m下离心5min保留上 清液,采用种子萌发法检测其除草活性,以各种蛋白酶处理的无菌水为对照, 观察其除草活性变化。
进一步,所述短梗霉素化合物除草机制的测定包括测定短梗霉素化合物对 α-淀粉酶活性的影响和测定短梗霉素化合物对乙酰乳酸合成酶活性的影响。
结合上述的所有技术方案,本发明所具备的优点及积极效果为:
本发明提供的具有除草作用的短梗霉素具有较强的耐热性,耐受pH值广 泛,对蛋白酶不敏感,该化合物抑制种子萌发时期α-淀粉酶活性,同时抑制乙 酰乳酸酶活性,进而抑制种子的萌发和杂草的生长,达到除草的目的。除草活 性平皿试验表明,该化合物对禾本科杂草的种子萌发抑制率高于阔叶杂草,在 100μg/mL的浓度下对禾本科杂草的胚芽抑制达到88%以上,对阔叶杂草的培养 抑制率仅为73%左右,同样,该化合物对禾本科杂草的胚芽抑制率达到80%以 上,对阔叶杂草的胚根抑制率达到80%以下。盆栽除草活性表明,在100μg/mL 浓度下,药后5天调查可知,短梗霉素对不同杂草的株高、株防效和鲜重效具 有不同程度的抑制作用,最高株高抑制率达到59%,对禾本科杂草的株防效和 鲜重效分布达85%和81%以上,对阔叶杂草的株防效和鲜重效分别达73%和71% 以上。
田间小区试验结果表明,在100μg/mL浓度下,喷药后15天后,发现除零 星的植株生长外,处理小区的杂草均被杀死,对照区杂草生长旺盛,叶色浓绿。 对禾本科杂草发现对杂草均有较好的株防效,为90.6%,对藜的防效最低,仅为 76.3%;同样,对野燕麦的鲜重效最高,达88.2%,对密花香薷的鲜重效最低, 为72.9%。总体来说,在100μg/mL浓度下,对杂草的防除效果很好,可以进行 下一步的剂型研制。
附图说明
为了更清楚地说明本申请实施例的技术方案,下面将对本申请实施例中所 需要使用的附图做简单的介绍,显而易见地,下面所描述的附图仅仅是本申请 的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下 还可以根据这些附图获得其他的附图。
图1是本发明实施例提供的具有除草作用的短梗霉素制备方法流程图。
图2是本发明实施例提供的不同条件对短梗霉素产量的影响示意图。
图3是本发明实施例提供的短梗霉素的紫外吸收图谱。
图4是本发明实施例提供的短梗霉素化合物的质谱图。
图5是本发明实施例提供的短梗霉素化合物的核磁图。
图6是本发明实施例提供的短梗霉素的结构示意图。
图7是本发明实施例提供的不同浓度的短梗霉素对杂草种子胚芽萌发的抑 制作用示意图。
图8是本发明实施例提供的不同浓度的短梗霉素对杂草种子胚根萌发的抑 制作用示意图。
图9是本发明实施例提供的喷施100μg/mL浓度的短梗霉素后对杂草株高的 影响示意图。
图10是本发明实施例提供的喷施100μg/mL浓度的短梗霉素后对杂草株数 和鲜重的影响示意图。
图11是本发明实施例提供的喷施短梗霉素后田间小区除草效果示意图。
图12是本发明实施例提供的温度对短梗霉素生物活性的影响示意图。
图13是本发明实施例提供的pH对短梗霉素生物活性的影响示意图。
图14是本发明实施例提供的蛋白酶对短梗霉素生物活性的影响示意图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例, 对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以 解释本发明,并不用于限定本发明。
针对现有技术存在的问题,本发明提供了一种具有除草作用的短梗霉素及 其制备方法,下面结合附图对本发明作详细的描述。
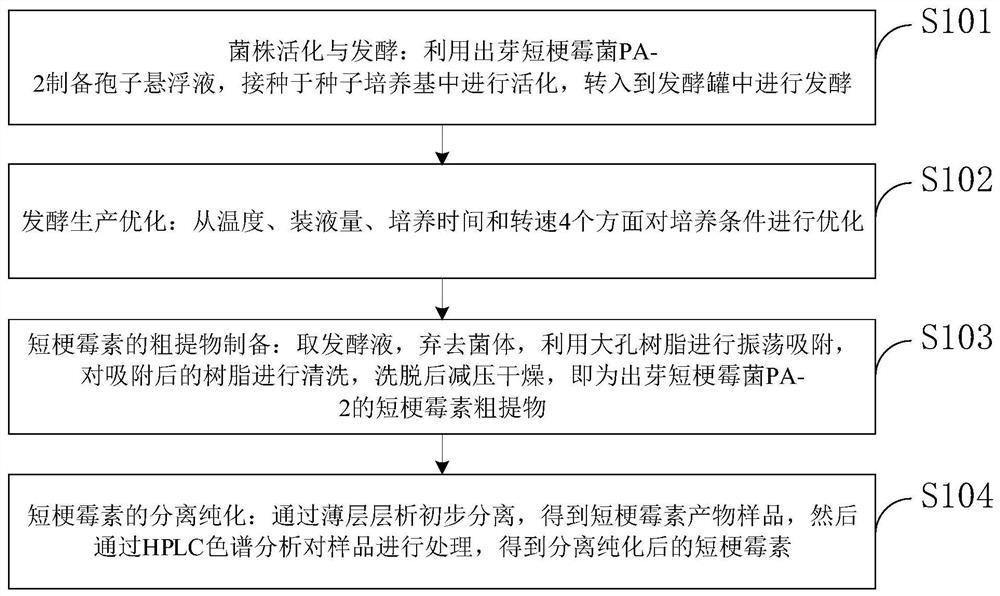
如图1所示,本发明实施例提供的具有除草作用的短梗霉素制备方法包括:
S101,菌株活化与发酵:利用出芽短梗霉菌PA-2制备孢子悬浮液,接种于 种子培养基中进行活化,转入到发酵罐中进行发酵;
S102,发酵生产优化:从温度、装液量、培养时间和转速4个方面对培养 条件进行优化;
S103,短梗霉素的粗提物制备:取发酵液,弃去菌体,利用大孔树脂进行 振荡吸附,对吸附后的树脂进行清洗,洗脱后减压干燥,即为出芽短梗霉菌PA-2 的短梗霉素粗提物;
S104,短梗霉素的分离纯化:通过薄层层析初步分离,得到短梗霉素粗样 品,然后通过高效液相色谱对样品进行分析处理,得到短梗霉素纯品。
下面结合具体实施例对本发明进一步进行描述。
1、供试菌株及培养基
供试菌株:出芽短梗霉菌(Aureobasidium pullulans)PA-2由青海省农业有 害生物综合治理重点实验室分离并保存。
靶标草:野燕麦、旱雀麦、稗草、狗尾草、藜、野油菜、野胡萝卜、遏蓝 菜、密花香薷和猪殃殃。
PDA培养基:2%potato、2%glucose和1.5%agar。
种子培养基:0.67%Yeast Nitrogen Base和2%glucose。
发酵培养基A:4%glucose、3%skim milk、3%soybean flour、0.5%(NH
发酵培养基B:10%glucose、5%polypepton、0.75%KH
2、方法与步骤
2.1菌株PA-2活化与发酵
(1)取-80℃甘油保藏菌株PA-2放置于冰浴器中,待甘油成融化状态时, 在超净工作台中倒掉甘油,挖取一块菌苔置于马铃薯葡萄糖固体培养基中,25℃ 培养基3~5d,刮取菌落表面,制备孢子悬浮液。
(2)将5mL孢子悬浮液接种于150mL的种子培养基中,25℃、180r/m振 荡培养2d进行活化。
(3)将150mL种子培养基转入到含有15L发酵培养基A的30L发酵罐中, 在25℃、180r/m条件下振荡培养56h。然后加入2L发酵培养基B,在25℃、180r/m 条件下,继续振荡培养88h,获得发酵液。
2.2发酵生产优化
从温度、装液量、培养时间和转速4个方面对培养条件进行优化。设定温 度(23℃、25℃、27℃、30℃)、装液量(150mL、200mL、250mL、300mL)、 培养时间(5d、7d、9d、11d)、摇床转速(140r/m、160r/m、180r/m、200r/m、 220r/m)进行单因素试验,考察各因素对短梗霉素物质产量的影响。
2.3短梗霉素粗提物制备及产率计算
取发酵液30L,10000r/m离心,弃去菌体,加入3%的大孔树脂XAD-16, 室温置于摇床振荡,120r/m,24h。吸附后的树脂用蒸馏水清洗至树脂表面无发 酵液残留,然后置于1000mL具塞三角瓶中,加入300mL无水乙醇,室温下, 置于摇床洗脱24h,然后减压干燥,即为出芽短梗霉菌PA-2的短梗霉素粗提物。 称取一个空的贴有标签的样品瓶,标签上记录样品瓶质量M
2.4短梗霉素的分离纯化
(1)薄层层析初步分离
采用硅胶板(Silica Gel GF
(2)高效液相色谱分析
色谱条件:ODS-silica C
流动相:A:70%-95%,B:30%-5%
A:水(含0.1%三氟乙酸(TFA))
B:甲醇;0~30min;
流速:1mL/min;柱温:30℃;进样体积:10μL
检测波长:210nm。
样品处理:将短梗霉素粗提样品和标准品,用流动相溶解后过0.22μm的针 孔式有机滤膜除菌除杂,平衡色谱柱后再加入样品梯度洗脱分离样品,根据标 样与样品的出峰时间,重复收集样品峰10次。
(4)短梗霉素物质结构鉴定
采用Mariner System 5304质谱仪测定短梗霉素(AbA)的分子量。采用德 国Bruker UltraShied
2.5短梗霉素的除草活性测定
2.5.1种子萌发法
将短梗霉素用二甲基亚砜(DMSO)配制成100、50、10μg/mL 3种浓度的 溶液,分别取1mL待测液均匀加入到铺有双层滤纸的12孔培养板中,待溶剂挥 发干后,选取10粒催芽后的杂草种子均匀散在上述处理好的培养板孔中,以清 水作对照,每个处理4次重复。将12孔培养板置于25℃、相对湿度70%的恒温 培养箱中培养,3天后测量杂草种子胚根和胚芽长度,计算胚根(芽)抑制率。
2.5.2盆栽除草效果
将试验杂草种子分别播种于小盆中,每盆20~30株/盆;待各种杂草长至 3~5叶期时,分别用浓度为100、50、10μg/mL的短梗霉素叶面喷施杂草植株, 以叶面喷湿而药液不滴为度,对照喷施清水。每处理重复4次。施药7天后 测量株高、株数和鲜重,计算株高抑制率、株防效和鲜重效,同时观察杂草中 毒症状。
2.5.3田间小区除草试验
田间试验在农科院植保所试验田进行,随机区组排列,小区面积8m
2.6短梗霉素的理化性质测定
(1)对温度的敏感性
将短梗霉素(分别在25℃、35℃、55℃、65℃、85℃、100℃、121℃下处 理30min,冷却至室温后采用种子萌发的方法检测其除草活性,以对应温度处理 的无菌水为对照,观察其除草活性变化。
(2)对酸、碱的敏感性
用6M的HCI或NaOH将短梗霉素分别调pH值至2.0、3.0、4.0、5.0、6.0、 7.0、8.0、9.0、10.0、11.0、12.0,静置15min后10000r/min离心10min,保留 上清液,采用种子萌发法检测其除草活性,以对应pH值的无菌水为对照,观察 其除草活性变化。
(3)对蛋白酶的敏感性
将短梗霉素分别用胰蛋白酶、胃蛋白酶、蛋白酶K 37℃处理1h后94℃处 理10min停止酶反应,酶反应浓度为500μg/mL。12000r/m下离心5min保留上 清液,采用种子萌发法检测其除草活性,以各种蛋白酶处理的无菌水为对照, 观察其除草活性变化。
2.7短梗霉素的除草机制测定
2.7.1短梗霉素对α-淀粉酶活性的影响
(1)短梗霉素稀释液处理杂草种子,以无菌水对照,培养3~8d,期间每天 提取α-淀粉酶。
(2)称取约0.1g样本,加0.8mL蒸馏水匀浆;匀浆后在室温下放置提取 15min,每隔5min振荡1次,使其充分提取;6000g,常温离心10min,吸取上 清液并加蒸馏水定容10mL,摇匀,即为淀粉酶原液。
(3)α-淀粉酶活性测定,取12支试管,6支用于处理组,6支用于对照组, 分别贴标签标记。吸取粗酶液1mL于试管中,置于70℃下水浴15min,使α-淀 粉酶受热发生钝化,水浴后快速取出在自来水中冷却;吸取pH5.6的柠檬酸缓 冲液4mL加到试管中;吸取0.4M NaOH溶液4mL到两组的试管中;使酶的活 性钝化,后吸取1%淀粉2mL至试管中;处理组试管置于40℃下水浴15min, 再加入到预热的1%淀粉2mL(40℃),混匀后进行40℃水浴13~15min,最后 加入0.4M NaOH溶液4mL,以终止酶的活性。
(4)制作标准曲线。取10mL试管标注5个编号,分别加入浓度为1mg/mL 的麦芽糖标准液0、0.5、1.0、1.5、2.0mL,然后与各试管中加蒸馏水使溶液为 2mL,再各加3,5-二硝基水杨酸溶液2mL,置沸水浴中准确煮沸5min,取出冷 却,用蒸馏水稀释至10mL,混匀,采用UV-7500型分光光度计测量上述混合液 在520nm波长下的吸光值,并记录光密度读数,以光密度读数为总坐标,以麦 芽糖含量为横坐标绘制曲线。
(5)样品测定。吸取上述两组的处理试管和对照试管中的反应溶液2mL 分别加入到10mL量瓶中,再加入3,5-二硝基水杨酸溶液2mL,混匀后于沸水中 煮沸5min,取出冷却,加蒸馏水稀释至10mL,混匀。利用UV-7500型分光光 度计在520nm波长下进行比色,记录光密度读数,通过上述标准曲线计算麦芽 糖含量,以此来表示酶活。
(6)结果计算。A:α-淀粉酶水解淀粉生成的麦芽糖含量(毫克);B:α- 淀粉酶的对照试管中麦芽糖含量(毫克);C:比色时所用样品液毫升数。
α-淀粉酶活性[麦芽糖(毫克)/鲜重(克)/5分钟]=[[(A-B)×样品稀释总体 积]/样品重(克)×C]×100
2.7.2短梗霉素对乙酰乳酸合成酶(ALS)活性的影响
(1)前期处理。供试杂草培养至3~4叶期时,对其进行液面喷施已配好的 抑制中浓度的短梗霉素,对照组喷施清水至叶面不滴落为止,置于光照培养箱 中培养,分别在处理后的第3、5、7、9、11d剪取地上部分,进行ALS活性的 测定。
(2)ALS的提取。剪取处理组和对照组的叶片组织,剪碎后置于提前预冷 的研钵中,向研钵中加入10mmol/L的磷酸钾缓冲液(按叶片重量:缓冲液=1: 1),研磨至匀浆后4000r/m,4℃离心30min,上清液即为提取的粗酶液,4℃ 保存待用,以上操作均在4℃以下进行。
(3)ALS的活性测定。取6支10mL试管,3支用于处理组,3支用于对 照组。向试管中加入0.8mL酶促反应缓冲液和0.4mL粗酶液,将试管置于37℃ 水浴锅中水浴60min,加入50μL 3mol/L H
3、试验结果
3.1发酵生产优化
通过从温度、装液量、培养时间和摇床转速4个因素测试对短梗霉素产量 的影响(图2)。随着装液量的增加短梗霉素产量出现先增加后减小的现象,当 装液量为200mL时产量最大。短梗霉素产量随着培养天数的增加出现先增加后 趋于不变的现象,在培养到第7d时,短梗霉素产量几乎不再增加。短梗霉素产 量随着温度的增加也出现先增加后减小的现象,当温度为25℃时产量最高,且 在25℃前后的温度对短梗霉素产量影响较大,说明该产物的产量对温度比较敏 感。摇床转速在200r/m时,短梗霉素产量最高达到0.65g/L,与转速在180r/m 时的短梗霉素产量(0.64g/L)没有显著区别,转速高于220r/m时产量缓慢下降。因此,确定最佳培养条件为:温度25℃、装液量200mL、培养时间7d和摇床转 速180r/m,短梗霉素产量在0.60g/L-0.65g/L之间。
3.2短梗霉素的分离纯化
3.2.1短梗霉素化合物紫外吸收广谱
用紫外分光光度计对生物活性强的活性条带进行紫外波谱区200~490nm 全波长扫描,以确定条带的最大吸收波长,由图3可见,在波长为220nm处有 较大的吸收峰,且无次级吸收,故在以下的高效液相分析时选用220nm为分析 波长。
3.2.2短梗霉素结构鉴定
采用质谱和核磁共振谱对短梗霉素的结构进行解析(图4、5,表1),波 谱数据如下:
表1短梗霉素的氢谱、碳谱数据
MS m/z 1100.694(M+H),123.696[M+Na]
3.2.3短梗霉素除草活性测定
3.2.3.1种子萌发法
不同浓度的短梗霉素对禾本科杂草野燕麦、旱雀麦、稗草和狗尾草的胚芽 生长抑制效果要高于阔叶杂草(图7),其中在100μg/mL的浓度下对旱雀麦胚 芽的生长抑制效果达到90.98%,对稗草胚芽生长的抑制效果为90.58%,野燕麦 胚芽生长的抑制效果为88.2%;而在同样浓度下对阔叶杂草藜的胚芽生长抑制效 果达73.67%,而在10μg/mL的浓度下对藜胚芽生长的抑制效果仅为28.02%。对 阔叶杂草生长萌发抑制效果最好的是野油菜,在100μg/mL的浓度下,抑制效果 为84.44%,对其它杂草的生长抑制效果均在80%以下。同样,对禾本科杂草野 燕麦、旱雀麦、稗草和狗尾草的胚根生长抑制效果要高于阔叶杂草(图8),其 中在100μg/mL的浓度下对旱雀麦的胚根生长抑制效果为86.64%,稗草胚根生长的抑制效果为81.05%,狗尾草胚根生长的抑制效果为80.62%,野燕麦胚根生 长的抑制效果为79.28%;对阔叶杂草胚根生长抑制效果最好的野油菜,在 100μg/mL浓度下为85.92%,藜、野胡萝卜、遏兰菜、密花香薷和猪殃殃的胚根 生长抑制效果均在80%以下,其中对藜胚根生长的抑制效果最差,在100和 10μg/mL浓度下的抑制效果分别为74.33%和37.95%。总体来看,对杂草胚芽的 抑制效果要好于对胚根的抑制效果。
3.2.3.2盆栽除草效果
盆栽除草效果从表2中可以看出,喷施浓度为100μg/mL的短梗霉素后,杂 草2-3天内就开始出现症状,禾本科杂草7天内可以完全杀死。野油菜和猪殃殃 直到7-10天左右完全被杀死,但对一些阔叶杂草(藜、野胡萝卜、遏蓝菜、密 花香薷),需要15天才可以完全杀死。说明短梗霉素对杂草的防除具有一定的 选择性。
表2短梗霉素喷施后杂草中毒症状
此外,喷施不同浓度短梗霉素后,杂草出现症状的时间也不一样,100μg/mL 浓度下杂草在3-5天开始出现症状,7-15天左右杂草完全被杀死,同时,禾本科 杂草受害症状比阔叶杂草受害出现的早3-5天。同样,50μg/mL和10μg/mL浓 度下,杂草出现受害症状也相应的推迟2-3天。
用100μg/mL浓度的短梗霉素对盆栽杂草进行喷施,药后5天调查杂草的 株高、株数和鲜重,评价其对杂草的防除效果。由图9可知短梗霉素对不同杂 草的株高具有不同程度的抑制作用,其中对野燕麦株高的抑制率最大,达到 59.1%,旱雀麦为50.7%,其它杂草的株高率小于50%;对阔叶杂草的株高抑制 率中,野油菜的株高抑制率最高为49.7%,对藜株高的抑制率最低,仅为30.3%。 由图10可知,对禾本科杂草的株防效均在85%以上,其中稗草的株防效最高为 91.9%,其次为旱雀麦的株防效90%;对阔叶杂草藜的株防效为80.5%,密花香 薷的株防效为73.6%。但从鲜重效来看,对野燕麦的鲜重效最高,为83.6%,其 次是稗草,鲜重效为81.8%,但对藜的鲜重效最低,仅为62.8%,在阔叶杂草中,对野胡萝卜的鲜重效最高,达71%。
3.2.3.3田间小区除草效果
喷药后15天调查,除零星的植株生长外,处理小区的杂草均被杀死,对照 区杂草生长旺盛,叶色浓绿。通过调查田间小区的株数和鲜重(图11),发现 对杂草均有较好的株防效,对野燕麦的株防效最高,为90.6%,对藜的防效最低, 仅为76.3%;同样,对野燕麦的鲜重效最高,达88.2%,对密花香薷的鲜重效最 低,为72.9%。总体来说,在100μg/mL浓度下,对杂草的防除效果很好,可以 进行下一步的剂型研制。
3.3短梗霉素的理化性质
3.3.1对温度的敏感性
短梗霉素经不同温度处理后对杂草生长的抑制率介于72.1%~82.4%之间, 各个温度处理之间没有显著的差异,而121℃处理的杂草生长抑制率达到72.1% (图12),由此说明短梗霉素有较强的耐热性。
3.3.2对酸、碱的敏感性
在pH7.0时杂草生长抑制率最大,为82.5%。当pH在4.0-11.0时,杂草抑 制率变化不大,差异不显著(图13)。随着pH的降低或者升高,其杂草抑制 率缓慢降低,说明在极酸或极碱的条件下短梗霉素的生物活性有所下降,但总 体可以较耐受的pH范围较广。
3.3.3对蛋白酶的敏感性
从图14可以看出,短梗霉素经3种酶处理后,杂草生长抑制率变化不大, 介于78.9%~79.3%,处理之间没有显著差异,表明该化合物对3种蛋白酶不敏 感。
3.4短梗霉素的除草机制的测定
3.4.1短梗霉素对α-淀粉酶活性的影响
利用短梗霉素对杂草进行平皿种子的萌发试验,处理后第3、4、5、6、7d 分别提取种子的α-淀粉酶并测定其活性。结果如表3所示,处理组相比于对照 的α-淀粉酶的活性显著被抑制,且抑制率高于93%,同时发现有第3d的萌发期 至第7d的1叶1心期,α-淀粉酶活性逐渐下降,说明α-淀粉酶主要存在于种子 的萌发时期。上述结果表明,该化合物抑制了种子萌发时的α-淀粉酶活性,因 此抑制了杂草种子的萌发。
表3短梗霉素对杂草种子萌发时期的α-淀粉酶活性的影响
注:±,标准差;不同列字母代表差异显著性(P<0.05)。
3.4.2短梗霉素对乙酰乳酸合成酶活性的影响
杂草种子培养至3叶期利用短梗霉素进行液面喷施处理,分别在处理后3、 5、7、9、11d剪取杂草的地上部分进行乙酰乳酸合成酶(ALS)的提取并测定 其活性。结果如表4所示。处理组的ALS活性下降,且随着处理天数的增加, ALS酶活性的抑制率也逐渐增加。上述结果表明该化合物可以抑制杂草植物体 内ALS活性,进而抑制其生物合成,最终导致杂草死亡。
表4短梗霉素对杂草种子生长过程中ALS活性的影响
注:±,标准差;不同列字母代表差异显著性(P<0.05)。
4、结论
(1)发酵优化生产试验表明,出芽短梗霉菌株PA-2产短梗霉素的最佳培 养条件为:温度25℃、装液量200mL、培养时间7d和摇床转速180r/m,短梗 霉素产量在0.60g/L-0.65g/L之间。该物质是一类环状脂肽类物质,由8个α-氨 基酸单元和1个羟基酸组成的环肽组成,在220nm下有较强吸收。
(2)该物质的理化性质分析表明,具有较强的耐热性,耐受pH值广泛, 对蛋白酶不敏感。除草机理研究试验表明,该化合物抑制种子萌发时期α-淀粉 酶活性,同时抑制乙酰乳酸酶活性,进而抑制种子的萌发和杂草的生长,达到 除草的目的。
(3)除草活性平皿试验表明,短梗霉素对禾本科杂草的种子萌发抑制率高 于阔叶杂草,在100μg/mL的浓度下对禾本科杂草的胚芽抑制达到88%以上,对 阔叶杂草的培养抑制率仅为73%左右,同样,对禾本科杂草的胚芽抑制率达到 80%以上,对阔叶杂草的胚根抑制率达到80%以下。盆栽除草活性表明,在 100μg/mL浓度下,药后5天调查可知,短梗霉素对不同杂草的株高、株防效和 鲜重效具有不同程度的抑制作用,最高株高抑制率达到59%,对禾本科杂草的 株防效和鲜重效分别达85%和81%以上,对阔叶杂草的株防效和鲜重效分别达 73%和71%以上。
(4)田间小区试验结果表明,在100μg/mL浓度下,喷药后15天后,发现 除零星的植株生长外,处理小区的杂草均被杀死,对照区杂草生长旺盛,叶色 浓绿。对禾本科杂草发现对杂草均有较好的株防效,达90.6%,对藜的防效最低, 仅为76.3%;同样,对野燕麦的鲜重效最高,达88.2%,对密花香薷的鲜重效最 低,为72.9%。总体来说,在100μg/mL浓度下,对杂草的防除效果很好,可以 进行下一步的剂型研制。
在本发明的描述中,除非另有说明,“多个”的含义是两个或两个以上; 术语“上”、“下”、“左”、“右”、“内”、“外”、“前端”、“后端”、 “头部”、“尾部”等指示的方位或位置关系为基于附图所示的方位或位置关 系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元 件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明 的限制。此外,术语“第一”、“第二”、“第三”等仅用于描述目的,而不 能理解为指示或暗示相对重要性。
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于 此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,凡在本发明 的精神和原则之内所作的任何修改、等同替换和改进等,都应涵盖在本发明的 保护范围之内。
- 一种具有除草作用的短梗霉素及其制备方法、测定方法
- 一种具有抗氧化活性的短梗五加浆果花色苷的制备方法
