一种包含UCHs抑制剂的药物组合物及其应用
文献发布时间:2023-06-19 11:17:41
技术领域
本发明属于生物医药领域,涉及一种包含UCHs抑制剂的药物组合物及其应用,特别是涉及一种包含UCHs修饰抑制剂的用于促进神经元生长和脊髓损伤修复的药物组合物及其应用。
背景技术
由大脑及脊髓组成的中枢神经系统是人体神经系统最重要的部分,其中脊髓损伤患者在全球范围内每年新增250000至500000例。由于脊髓损伤具有高发生率、高致残率、高耗费、低死亡率的特点,给患者本人、家庭及社会带来沉重的负担。现有技术中通常采用神经保护疗法例如甲基泼尼松龙或采用手术方法减轻对中枢神经系统的压迫或采用损伤后短时间内行高压氧治疗等方法进行脊髓损伤的治疗。然而,传统方法的局限性促使人们去探索中枢神经系统损伤后神经的修复的新方法、新机制,干细胞移植;新型生物材料,如水凝胶;硬膜外电刺激等。
尽管新型治疗方案层出不穷,然而中枢神经系统损伤后,通过突起再生或者代偿性纤维生长修复病变的能力极为有限。随着研究的深入,人们已经认识到脊髓损伤后促进突起生长、分枝,然后再建立起神经元与神经元之间的联系是脊髓损伤后修复关键的过程。突起的分枝和生长,受到多重因素影响,并通过细胞骨架、微管运动、微丝重塑得以实现。突起分枝形成时,微管侵入且被切割,微管进一步生长使得突起形成新的分枝进而促进突起生长。
神经元是神经系统结构和功能的基础,在神经元发育过程中,突起负责收集环境的变化及刺激,细胞体负责分析处理信息。神经元发育过程中分三个主要阶段,首先是细胞增殖,分裂的子细胞命运主要取决于基因表达的差异性;然后是细胞迁移,由靠近脑室发源地出发,新发育成的神经元向神经管外周迁移,然后定位于不同层次;最后是细胞分化,包括外在形态及内在功能的变化,这个过程受到靶器官分泌的影响。其中神经元的微管骨架组装、架构和动态重塑对于完成神经元发育不同阶段必不可少。
神经元的突起包括轴突和树突,轴突生长早于树突,轴突沿着特定的路线生长、延长,依赖着细胞外的导向分子如细胞外基质、细胞粘连分子、生长因子等朝向行进。同时在细胞内存在细胞骨架,微管蛋白负责运输,肌动蛋白、肌球蛋白负责伸缩转向,促进突起的生长。轴突末端的生长锥通过阿米巴样运动引导轴突延伸,轴突的延伸及稳定本质上都离不开微管骨架。树突的受到轴突逆行运输一些化学信息如NTF调节而生长,同时很大程度上依赖微管稳定性的变化。在快速生长过程中,微管在动态上是不稳定的,但突起生长端被微管相关蛋白覆盖,微管就会变得更加稳定,通过调节不稳定的微管和稳定的微管之间的平衡,进而调节树突的生长。因而,在神经元突起生长过程中,微管发挥了很大的作用。
泛素化修饰是指一个或多个泛素分子(Ubiquitin)在一系列酶的作用下与底物蛋白质共价结合的过程。整个过程涉及泛素分子、蛋白底物、多种酶系统及蛋白酶体,他们共同构成了泛素-蛋白酶体系统(Ubiquitin Proteasome System,UPS)。泛素化-蛋白酶体系统介导了真核生物体内80%以上的蛋白质降解,是一种重要的蛋白质翻译后修饰。泛素化修饰与神经发育、轴突再生关系密切,泛素化修饰的异常是很多神经疾病的致病因素。泛素C端水解酶(ubiquitin carboxy terminalhydrolases,UCHs)是广泛存在于不同生物中的半胱氨酸蛋白酶类,也是一种可以将泛素分子从底物蛋白上释放出来的去泛素化酶类(deubiquitinating enzymes,DUBs),对蛋白质的降解具有反向调控作用,可促进泛素的再循环。
本发明发明人在研究中发现,UCHs在神经系统中高度表达,同时在泛素蛋白酶体降解中具有双重作用。然而现有的研究显示,UCHs通过发挥水解酶的作用,以介导蛋白的去泛素化发挥调控蛋白稳定性的功能,从而在不同类型肿瘤的不同发展阶段发挥促癌或抑癌的作用。而对于UCHs在微管切割、神经元生长、脊髓损伤修复等过程中的具体作用和机制,现有技术中罕有研究。因此,有必要对UCHs调控轴突发育及再生的机制进行研究,为脊髓损伤的临床治疗提供新的理论基础和新的方向。
发明内容
本发明的目的在于解决现有技术中所存在的上述问题,从而针对UCHs在神经元生长及脊髓损伤修复的功能及机制进行了深入研究,揭示了通过抑制UCHs以调控突起生长及促进神经元再生的新机制,为脊髓损伤的临床治疗提供了切实的实验证据和科学依据。
为了解决上述技术问题,本发明是通过如下技术方案得以实现的。
本发明第一方面提供了一种用于促进神经元生长的药物组合物,包括UCHs抑制剂。
作为优选地,所述UCHs抑制剂选自UCHL1抑制剂、UCHL3抑制剂、UCHL5抑制剂中的一种或多种;最优选地,所述UCHs抑制剂选自UCHL1抑制剂。
作为优选地,所述UCHL1抑制剂选自基于UCHL1基因设计的siRNA(siUCHL1)。
作为优选地,所述siUCHL1选自siUCHL1-1,siUCHL1-2,siUCHL1-3中的一种或多种;所述siUCHL1-1,siUCHL1-2,siUCHL1-3的序列分别如SEQ ID NO:1、SEQ ID NO:2、SEQID NO:3所示。
本发明第二方面提供了一种用于促进脊髓损伤修复的药物组合物,包括UCHs抑制剂。
作为优选地,所述UCHs抑制剂选自UCHL1抑制剂、UCHL3抑制剂、UCHL5抑制剂中的一种或多种;最优选地,所述UCHs抑制剂选自UCHL1抑制剂。
作为优选地,所述UCHL1抑制剂选自基于UCHL1基因设计的siRNA(siUCHL1)。
作为优选地,所述siUCHL1选自siUCHL1-1,siUCHL1-2,siUCHL1-3中的一种或多种;所述siUCHL1-1,siUCHL1-2,siUCHL1-3的序列分别如SEQ ID NO:1、SEQ ID NO:2、SEQID NO:3所示。
本发明第三方面提供了UCHs抑制剂用于制备促进神经元生长药物中的应用。
作为优选地,所述UCHs抑制剂通过促进Spastin微管切割功能从而促进神经元生长。
作为优选地,所述UCHs抑制剂选自UCHL1抑制剂、UCHL3抑制剂、UCHL5抑制剂中的一种或多种;最优选地,所述UCHs抑制剂选自UCHL1抑制剂。
作为优选地,所述UCHL1抑制剂选自基于UCHL1基因设计的siRNA(siUCHL1)。
作为优选地,所述siUCHL1选自siUCHL1-1,siUCHL1-2,siUCHL1-3中的一种或多种;所述siUCHL1-1,siUCHL1-2,siUCHL1-3的序列分别如SEQ ID NO:1、SEQ ID NO:2、SEQID NO:3所示。
本发明第四方面提供了UCHs抑制剂用于制备促进脊髓损伤修复药物中的应用。
作为优选地,所述UCHs抑制剂通过促进Spastin微管切割功能从而促进脊髓损伤修复。
作为优选地,所述UCHs抑制剂选自UCHL1抑制剂、UCHL3抑制剂、UCHL5抑制剂中的一种或多种;最优选地,所述UCHs抑制剂选自UCHL1抑制剂。
作为优选地,所述UCHL1抑制剂选自基于UCHL1基因设计的siRNA(siUCHL1)。
作为优选地,所述siUCHL1选自siUCHL1-1,siUCHL1-2,siUCHL1-3中的一种或多种;所述siUCHL1-1,siUCHL1-2,siUCHL1-3的序列分别如SEQ ID NO:1、SEQ ID NO:2、SEQID NO:3所示。
泛素连接酶和去泛素化酶介导的蛋白泛素化/去泛素化平衡调控在肿瘤恶性进程中发挥了重要作用。UCHL1、UCHL3、UCHL5作为泛素C端水解酶(UCHs)家族中的重要成员,近年来备受关注,尤其是UCHL1。现有研究发现,UCHs通过发挥水解酶的作用,以介导蛋白的去泛素化发挥调控蛋白稳定性的功能,从而在不同类型肿瘤的不同发展阶段发挥促癌或抑癌的作用。而对于UCHs在微管切割、神经元生长、脊髓损伤修复等过程中的具体作用和机制,现有技术中罕有研究。
本发明发明人先前的研究发现,Spastin是重要的微管切割蛋白之一,且在中枢神经系统高度表达。Spastin与泛素分子能够产生相互作用,在神经系统内Spastin能够被泛素化。Spastin作为一种微管切割蛋白,可调控微管促进轴突分支及生长。泛素化修饰可以通过调控Spastin蛋白的稳定性而影响其的微管切割功能,进而影响神经元突起的生长。神经元轴突发育时,Spastin蛋白发挥功能之后需要进行泛素化标记并被降解,以免Spastin过度活跃而引起微管切割异常;脊髓损伤时,为促进侧枝形成及突起生长,可通过抑制Spastin的泛素化修饰增加Spastin蛋白稳定性,以增强微管切割从而促进轴突再生、加快脊髓损伤修复。
在此基础上,本发明发明人进行了进一步地深入研究,发现UCHs与Spastin存在相互作用,尤其是UCHL1,其能够介导Spastin降解,并抑制Spastin的微管切割功能;而干扰UCHL1后则可以显著降低Spastin的降解,同时使Spastin的微管切割功能恢复,进而促进神经元的生长。
本发明相对于现有技术具有如下技术效果:
(1)本发明对UCHs与神经元生长的作用进行了深入研究,发现了UCHs对微管切割及神经元生长的抑制作用;
(2)本发明明确了UCHs所介导的微管切割及神经元生长过程的具体作用机制,即UCHs能够通过与Spastin相互作用,从而影响Spastin的稳定性,进而影响其微管切割功能;
(3)本发明发现通过对UCHs表达的抑制,能够显著降低Spastin的降解,同时使Spastin的微管切割功能恢复,进而促进神经元的生长;揭示了UCHs调控神经元生长的新机制,为脊髓损伤的临床治疗提供了切实的科学依据和新的方向。
附图说明
图1为鼠脑裂解液中通过IP检测Spastin结果示意图。
图2为鼠脑裂解液中通过IP检测UCHL1结果示意图。
图3为293T细胞中Spastin与UCHL1免疫共沉淀结果示意图。
图4为COS7细胞内过表达GFP-UCHL1对内源性Spastin降解定性结果示意图。
图5为COS7细胞内过表达GFP-UCHL1对内源性Spastin降解定量结果示意图。
图6为不同剂量UCHL1对内源性Spastin降解水平的影响。
图7为不同剂量UCHL1对外源性Spastin降解水平的影响。
图8为UCHL1处理不同时间下对Spastin降解水平的影响。
图9为不同siUCHL1对UCHL1抑制作用示意图。
图10为siUCHL1-2对内源性Spastin降解抑制定性结果示意图。
图11为siUCHL1-2对内源性Spastin降解抑制定量结果示意图。
图12为不同剂量siUCHL1-2对抑制内源性Spastin降解水平的影响。
图13为siUCHL1-2处理不同时间下对内源性Spastin降解水平的影响。
图14为UCHL1对Spastin微管切割功能影响定性结果示意图。
图15为UCHL1对Spastin微管切割功能影响定量结果示意图。
图16为siUCHL1-2对Spastin微管切割功能恢复影响定性结果示意图。
图17为siUCHL1-2对Spastin微管切割功能恢复影响定量结果示意图。
图18为UCHL1处理下对海马神经元细胞突起的激光共聚焦采集图像示意图。
图19为UCHL1处理下各组海马神经元突起数量的统计图。
图20为UCHL1处理下各组海马神经元突起长度的统计图。
图21为siUCHL1-2处理下海马神经元细胞突起的激光共聚焦采集图像示意图。
图22为siUCHL1-2处理下两组海马神经元突起数量的统计图。
图23为siUCHL1-2处理下两组海马神经元突起长度的统计图。
具体实施方式
为使本发明的目的、技术方案及效果更加清楚、明确,以下参照实施例对本发明作进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
在无特别说明的情况下,本发明上下文中所列出的包括大鼠海马神经元细胞系和COS7猴成纤维细胞系等永生化细胞工具均市售获得并根据细胞生物学中的常规方法进行培养。所有细胞系均通过中国典型培养物保藏中心(武汉)的短串联重复分析鉴定,并使用PCR检测试剂盒(上海Biothrive Sci)验证是否存在支原体污染,同时在液氮中冷冻保存并用于后续实验。本发明所使用的试剂中,均通过市售获得。本发明所使用的实验方法和技术,例如COS7培养、293T细胞培养、大鼠海马神经元培养、Western blot、分子克隆、PCR、免疫荧光染色、激光共聚焦、免疫沉淀、免疫共沉淀及动物实验等均为本领域的常规方法和技术。
生物学实验重复中选择具有代表性的结果呈现在上下文附图中,数据按照图示中规定的以mean±SD和mean±SEM展示。所有实验至少重复三次。数据采用GraphPad Prism5.0或SPSS 20.0软件进行分析。采用t检验或方差分析比较两组或两组以上的平均值差异。p<0.05被认为是一个显著的差异。
实施例1 UCHL1与Spastin相互作用的验证
(1)选取出生1天内的SD大鼠,取鼠脑,加入细胞裂解液,其中每1mg鼠脑加入10μL细胞裂解液;
(2)加入PMSF,于冰上充分研磨,然后再裂解30min;
(3)于4℃,12000rpm离心10min,取上清,获得鼠脑裂解液;
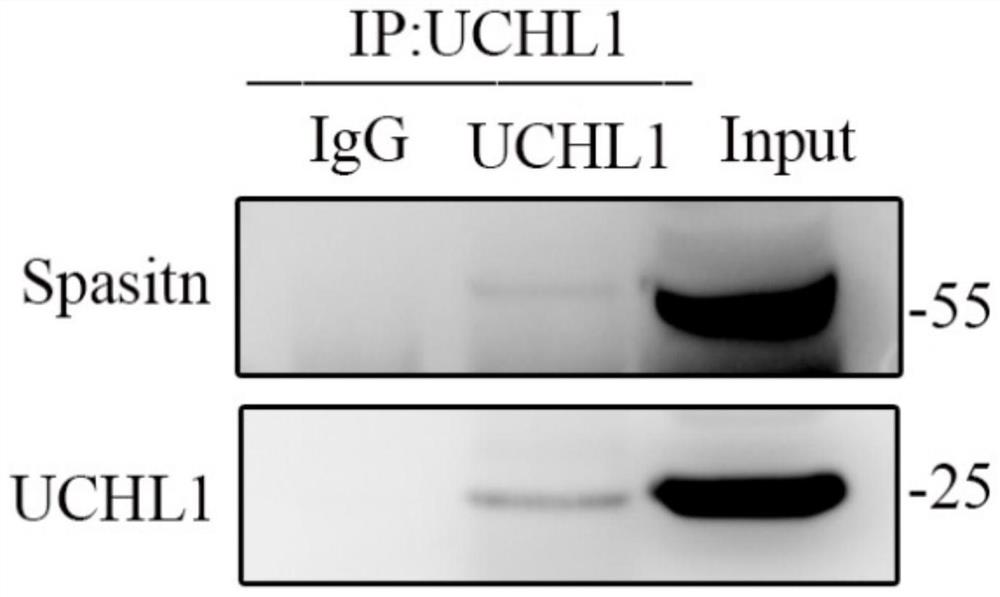
(4)将鼠脑裂解液与anti-UCHL1抗体孵育后进行免疫沉淀实验,利用WesternBlot检测Spastin蛋白(参见图1);
(5)将鼠脑裂解液与anti-Spastin抗体孵育后进行免疫沉淀实验,利用WesternBlot检测UCHL1蛋白(参见图2);
(6)将Spastin免疫沉淀后的沉淀物进行质谱鉴定。
结果分别如图1-图2所示。由结果可以看到,IP UCHL1所得到的沉淀物中能够检测到Spastin,同样地,IP Spastin所得到的沉淀物中亦能够检测到UCHL1,这意味着Spastin与UCHL1确实存在着相互作用,即说明在体内Spastin与UCHL1是存在相互结合。随后通过对IP Spastin之后的沉淀物进行的质谱分析发现,共打出了七段属于UCHL1分子的肽段序列,分别为QIEELKGQEVSPKETVEEQASTTER、QFLSETEK、LSPEDR、NEAIQAAHDSVAQEGQCR、MPFPVNHGASSEDSLLQDAAK、LGVAGQWR和FSAVALCK,进一步肯定了UCHL1与Spastin的相互作用
既然Spastin与UCHL1能在体内结合,那么对于Spastin与UCHL1能否在体外的相互作用,进一步地,利用293T细胞进行免疫共沉淀实验进行验证:
(1)将GFP或GFP-UCHL1及Flag-Spastin转染至293T细胞中;
(2)转染24h后,弃掉原培养基,加入PBS清洗2遍;
(3)加入细胞裂解液(含PMSF),于冰上裂解30min;
(4)用细胞刮刮落细胞,转移至灭菌离心管中,于4℃,12000rpm离心10min,取上清,获得细胞裂解液;
(5)用anti-GFP作为沉淀抗体与293T细胞裂解液进行免疫共沉淀,利用WesternBlot检测Flag标签。
结果如图3所示。结果显示,GFP-UCHL1及上清组都能检测到Flag-Spastin,而GFP对照组则没有检测到Flag-Spastin,说明了Spastin与UCHL1在体外也能相互结合。
实施例2 UCHL1可以介导Spastin的降解
(1)预热MEM、PBS和含10%FBS的DMEM,准备灭菌的1.5 mL离心管若干;
(2)弃掉原先COS7细胞培养板中的培养基,加入等量MEM饥饿细胞,放回孵育箱;
(3)往离心管加入适量的MEM,通常6孔板中每孔终体积为200μL,24孔板中每孔终体积为50μL,其中1个离心管加GFP-UCHL1质粒,通常6孔板中每孔加4μg质粒,24孔板中每孔加1μg质粒,另外1个离心管按照质粒:脂质体为1:3加入脂质体;
(4)将脂质体与MEM混合物加到质粒与MEM混合物中,轻轻混匀,室温静置15 min;
(5)将脂质体及质粒混合物均匀滴到细胞培养板中;
(6)3h后用弃掉原先的MEM,再用PBS清洗2遍,最后加入新配置的含10%FBS的DMEM,将细胞放回孵育箱继续培养直至进行处理;获得转染有GFP-UCHL1质粒的COS7细胞,用同样的方法获得转染有GFP空质粒的COS7细胞;
(7)利用Western Blot检测细胞中对内源性Spastin表达水平的影响。
结果如图4所示。结果显示,与空载体GFP相比,过表达有UCHL1可使Spastin蛋白水平显著下降。随后以图4中对照组Spastin/GAPDH标准化为1,重复以上实验3次,计算GFP-UCHL1实验组Spastin的相对蛋白表达含量。结果如图5所示,显示二者含量差异具有统计学意义(*
随后,在COS7细胞中分别过表达不同剂量的GFP-UCHL1(0,1,4μg),再利用WesternBlot检测细胞中内源性Spastin及GFP-UCHL1表达水平。
结果如图6所示,结果显示UCHL1对内源性Spastin的降解呈明显的剂量依赖性。
进一步地,用上述同样的方法在293T细胞中过表达GFP-Spastin(2μg),并分别过表达不同剂量的Flag-UCHL1(0,1,4μg),再利用Western Blot检测293T细胞中外源性GFP-Spastin及Flag-UCHL1表达水平。
结果如图7所示。结果显示,UCHL1对293T细胞中外源性Spastin能够产生降解作用,且该降解呈明显的剂量依赖性。
更进一步地,在COS7细胞中过表达GFP或GFP-UCHL1;培养12h后加入CHX(Cycloheximide,放线菌酮,可抑制蛋白质翻译合成);并于加入CHX的0、6和12h后裂解细胞收集蛋白,再利用Western Blot检测细胞中内源性Spastin表达水平。
结果如图8所示。结果显示,在加入CHX抑制蛋白翻译后,Spastin蛋白含量随时间逐渐降低;而在加入UCHL1后,Spastin的降解水平显著升高,且呈时间依赖性,即UCHL1明显加快了内源性Spastin的降解。对该结果的定量分析显示二者差异具有统计学意义(*
实施例3 干扰UCHL1可延缓Spastin的降解
(1)针对UCHL1基因设计siRNA(siUCHL1-1,siUCHL1-2及siUCHL1-3,三种siRNA序列分别如SEQ ID NO:1,SEQ ID NO:2,SEQ ID NO:3所示);
(2)在COS7细胞中过表达GFP-UCHL1;
(3)在过表达有GFP-UCHL1的COS7细胞中分别过表达siUCHL1-1,siUCHL1-2或siUCHL1-3;
(4)利用Western Blot检测细胞中对内源性Spastin表达水平的影响。
结果如图9所示。结果显示,siUCHL1-2对UCHL1具有较高的干扰效率,从而显著降低对Spastin的降解作用;后续试验采用siUCHL1-2进行相关研究。
随后,在COS7细胞内过表达GFP-UCHL1,同时过表达siUCHL1-2或NC(NegativeControl),并利用Western Blot检测细胞中对内源性Spastin表达水平的影响。
结果如图10所示。结果显示,siUCHL1-2确实可以显著干扰UCHL1从而抑制内源性Spastin的降解。以图10中对照组Spastin/GAPDH比值标准化为1,重复以上实验3次,计算两组Spastin的相对蛋白表达含量。结果如图11所示,显示二者含量差异具有统计学意义(*
进一步地,在COS7细胞中过表达GFP及不同浓度的siUCHL1-2(1,2,4μL),再利用Western Blot检测细胞中内源性Spastin表达水平及GFP-UCHL1表达水平。
结果如图12所示。结果显示,在一定范围内,随着siUCHL1-2浓度的增大,COS7中内源性Spastin的降解延缓,即干扰UCHL1抑制内源性Spastin降解具有浓度依赖性,siUCHL1-2的浓度越高,对UCHL1抑制作用越强,延缓Spastin降解作用越明显,反向说明了UCHL1本身可以促进Spastin降解。
更进一步地,在COS7细胞中过表达4μg GFP-UCHL1,同时过表达4μL siUCHL1-2或NC;培养12h后加入CHX;并于加入CHX后的0、6和12h后裂解细胞收集蛋白,再利用WesternBlot检测siUCHL1-2或NC对COS7细胞中内源性Spastin表达水平的影响。
结果如图13所示,结果显示,在加入CHX抑制蛋白翻译后,Spastin蛋白含量随时间逐渐降低;而在加入siUCHL1-2后则显著抑制UCHL1的功能,并可恢复Spastin的蛋白水平,且呈时间依赖性,再次反面论证了UCHL1本身可以促进Spastin降解。对该结果的定量分析显示二者差异具有统计学意义(*
实施例4 UCHL1对Spastin微管切割功能的影响
(1)在COS7细胞中过表达GFP或GFP-Spastin、mCherry或mCherry-UCHL1、NC或siUCHL1-2;
(2)转染12h后加入CHX,再培养12h后进行免疫细胞化学;
(3)孵育anti-Tubulin检测COS7细胞中微管的情况,通过共聚焦显微镜采集图像,ImageJ进行统计COS7中微管荧光强度的变化。
结果如图14所示。其中,Tubulin:微管;GFP:绿色荧光蛋白;mCherry:红色荧光蛋白;GFP-Spastin:Spastin绿色荧光融合蛋白;mCherry-UCHL1:UCHL1红色荧光融合蛋白;Dapi:细胞核。
结果显示,COS7中以过表达GFP和mCherry为对照组,Tubulin能保持完好,不会被切割;当过表达GFP和mCherry-UCH1,Tubulin能保持完好,也不会被切割,即mCherry-UCHL1对微管几乎没有影响;当过表达GFP-Spastin和mCherry时,Tubulin荧光强度明显减弱,微管被切割;当过表达GFP-Spastin和mCherry-UCHL1,与对照组相比Tubulin荧光强度虽然有减弱,但与GFP-Spastin和mCherry相比,微管荧光强度是增强的,说明此时GFP-Spastin切割微管能力可因为mCherry-UCHL1的存在而减弱,标尺为20μm。
随后利用ImageJ进行微管荧光强度的统计,结果如图15所示。每组统计30个细胞,并把对照组标准化为1,采用完全随机方差分析进行检验,结果以Mean±SEM表示, *
进一步地,在COS7细胞内过表达GFP-Spastin、mCherry-UCHL1、NC或siUCHL1-2;通过免疫荧光化学染色观察其Tubulin的变化。
结果如图16所示。其中,Tubulin:微管;GFP:绿色荧光蛋白;mCherry:红色荧光蛋白;GFP-Spastin:Spastin绿色荧光融合蛋白;mCherry-UCHL1:UCHL1红色荧光融合蛋白;Dapi:细胞核;NC: Negative Control,阴性对照;siUCHL1-2:小分子干扰UCHL1-2。
结果显示,mCherry-UCHL1红色荧光明显被干扰消失,同时GFP-Spastin荧光强度相比GFP-Spastin和mCherry上升,而微管荧光强度大大降低。因而,当存在Spastin而不存在UCHL1(无外源性导入或共转siUCHL)时,Spastin能正常进行微管切割;当存在Spastin且存在UCHL1(外源性导入或共转NC)时,Spastin微管切割能力下降,而单独的过表达UCHL1未检测到对微管切割有影响。说明了过表达UCHL1可抑制Spastin的微管切割功能,干扰UCHL1可使Spastin微管切割功能恢复,标尺为20μm。
随后利用ImageJ统计微管荧光强度,并将对照组微管的荧光强度标准化为1,实验组的微管荧光强度为相对荧光强度,每组统计30个细胞,采用两独立样本T检验进行检验,结果以Mean±SEM表示,结果如图17所示,显示差异具有统计学意义。
由此可见,过表达UCHL1可以抑制Spastin的微管切割功能,而干扰UCHL1则可以显著恢复Spastin的微管切割功能。
实施例5 UCHL1对神经元生长的影响
(1)培养并观察海马神经元细胞,注意海马神经元细胞的状态以及是否有污染;
(2)将原培养基转移至辅孔,每一孔加入500μL Neurobasal培养基进行饥饿;
(3)使用磷酸钙转染试剂盒,向EP管中分别加入1μg GFP、mCherry、mCherry-UCHL1、GFP-Spastin质粒和25μL CaCl
(4)将步骤(3)中的溶液进行混合,暗箱静置15min;
(5)每孔滴加50μL混合液,混合液分次在孔内不同方位滴加,轻柔摇晃数次,40min后,用1×SA清洗钙磷颗粒2次后,加入原培养基;
(6)转染24h后,使用4%PFA固定细胞,进行免疫荧光化学染色,于激光共聚焦下观察。
结果如图18-20所示。其中,GFP:绿色荧光蛋白;mCherry:红色荧光蛋白;GFP-Spastin:Spastin绿色荧光融合蛋白;mCherry-UCHL1:UCHL1红色荧光融合蛋白;Dapi:细胞核。图18显示了海马神经元细胞突起的激光共聚焦采集图像;图19为各组海马神经元突起数量的统计图;图20为各组海马神经元突起长度的统计图。n=30/组,结果以Mean±SEM表示,标尺为20 μm。
结果显示,海马神经元中以过表达GFP和mCherry为对照组,当过表达GFP和mCherry-UCH1时,海马神经元突起总数量及突起总长度并没有发生明显的变化;当过表达GFP-Spastin和mCherry,海马神经元突起总数量及突起总长度并明显增加;当过表达GFP-Spastin和mCherry-UCHL1与GFP-Spastin和mCherry组相比较,海马神经元突起总数量及突起总长度明显地降低。由此可见,Spastin可以介导神经元突起的生长,而UCHL1则可以显著抑制Spastin所介导的神经元突起的生长,使得无论是神经元突起的长度还是神经元突起的数量都得到了明显的增加,差异具有统计学意义。
进一步地,在原代海马神经元中过表达GFP-Spastin、mCherry-UCHL1、NC或siUCHL1-2,进行免疫荧光化学染色后,于激光共聚焦下观察。
结果如图21-23所示。其中,Tubulin:微管;GFP-Spastin:Spastin绿色荧光融合蛋白;mCherry-UCHL1:UCHL1红色荧光融合蛋白;Dapi:细胞核;NC:Negative Control,阴性对照;siUCHL1-2:小分子干扰UCHL1-2。图21显示了海马神经元细胞突起的激光共聚焦采集图像;图22为两组海马神经元突起数量的统计图;图23为两组海马神经元突起长度的统计图。n=30/组,结果以Mean±SEM表示,标尺为20 μm。
结果显示,与GFP-Spastin和mCherry相比,海马神经元突起总数量及突起总长度明显地降低;当过表达GFP-Spastin、mCherry-UCHL1和siUCHL1-2时, mCherry-UCHL1红色荧光明显被干扰并在共聚焦显微镜下只能在海马神经元细胞核检测到微弱的红色荧光,此时观察到海马神经元突起总数量及突起总长度明显增多。因此,当存在Spastin而不存在UCHL1(无外源性导入或共转siUCHL1-2)时,Spastin能促使海马神经元突起数量及长度增加;当存在Spastin且存在UCHL1(外源性导入或共转NC)时,Spastin能促进海马神经元突起数量增加及突起长度增加的功能受到UCHL1的抑制,而单独的过表达UCHL1未检测海马神经元总突起数量及长度有所影响。说明了过表达UCHL1可抑制Spastin的促进海马神经元突起数量及长度功能,干扰UCHL1可使Spastin促进海马神经元突起总数量及突起总长度增加功能得以恢复。即siUCHL1-2可以明显促进Spastin所介导的神经元突起的生长,使得神经元无论是数量还是长度均得到了显著的增加,*
综合上述结果,本发明对UCHs在神经元生长过程中的作用及机制进行明确揭示。发现UCHs与Spastin存在相互作用,尤其是UCHL1,其能够介导Spastin降解,并抑制Spastin的微管切割功能,进而抑制神经元突起生长;而干扰UCHL1后则可以显著降低Spastin的降解,同时使Spastin的微管切割功能恢复,进而促进神经元突起的生长。揭示了UCHs调控神经元生长的新机制,为脊髓损伤的临床治疗提供了切实的科学依据和新的方向。
以上具体实施方式部分对本发明所涉及的分析方法进行了具体的介绍。应当注意的是,上述介绍仅是为了帮助本领域技术人员更好地理解本发明的方法及思路,而不是对相关内容的限制。在不脱离本发明原理的情况下,本领域技术人员还可以对本发明进行适当的调整或修改,上述调整和修改也应当属于本发明的保护范围。
序列表
<110> 暨南大学
<120> 一种包含UCHs抑制剂的药物组合物及其应用
<160> 3
<170> SIPOSequenceListing 1.0
<210> 1
<211> 19
<212> RNA
<213> 人工序列(Artificial Sequence)
<400> 1
gcugaaaccg auggagauu 19
<210> 2
<211> 19
<212> RNA
<213> 人工序列(Artificial Sequence)
<400> 2
ggaacugaag ggacaagaa 19
<210> 3
<211> 19
<212> RNA
<213> 人工序列(Artificial Sequence)
<400> 3
ggauggauca guccugaaa 19
- 一种包含UCHs抑制剂的药物组合物及其应用
- 嘧啶化合物、PI3K抑制剂、包含PI3K抑制剂的药物组合物及应用
