抗生素检测传感器及其制作方法
文献发布时间:2023-06-19 11:19:16
技术领域
本发明涉及抗生素检测技术领域,尤其是一种抗生素检测传感器。
背景技术
抗生素作为一种抗菌药物,被广泛应用于畜牧、养殖业中治疗动物的细菌感染。然而,抗生素的滥用也给人类健康和环境带来一些负面影响。例如,青霉素可能会对皮肤产生过敏反应,链霉素可损害肾脏和听觉神经,四环素可导致肝损伤和牙齿变黄等。因此,在一些特殊的领域,尤其是食品安全领域内,需要对抗生素的含量进行检测。
传统的检测方法如高效液相色谱、液相色谱-质谱联用虽稳定可靠,但由于需要相对较大的仪器,限制了它们设计成便携式设备来实现实际样品的现场检测。
发明内容
有鉴于此,本发明提供了一种抗生素检测传感器及其制作方法,该抗生素检测传感器体积较小,具有较好的便携性,能够进行待检测物的快速现场检测。
本发明提供了一种抗生素检测传感器,包括基底层及设置于所述基底层上的电极层,所述电极层包括工作电极、对电极及参比电极,在所述工作电极上设置有树状金纳米颗粒层,在所述树状金纳米颗粒层上通过Au-S键共价结合有巯基修饰的抗生素适配体。
进一步地,在所述工作电极上还设置有电子传导层,所述电子传导层设置于所述工作电极与所述树状金纳米颗粒层之间。
进一步地,所述电子传导层为由还原氧化石墨烯、单壁碳纳米管、多壁碳纳米管或碳纳米纤维制成的电子传导层。
进一步地,所述基底层为由PET、PDMS或PI制成的柔性基底层。
进一步地,所述抗生素检测传感器还包括绝缘层,所述绝缘层覆盖于所述电极层上,并露出所述工作电极、所述对电极及所述参比电极。
本发明还提供了一种抗生素检测传感器的制作方法,该方法包括如下步骤:
S11:提供一基底层,在所述基底层上通过丝网印刷工艺形成工作电极、对电极及参比电极;
S12:在所述工作电极上通过电沉积工艺形成树状金纳米颗粒层;
S13:向所述树状金纳米颗粒层上滴加巯基修饰的抗生素适配体溶液,并进行设定时间的组装,以将所述巯基修饰的抗生素适配体通过Au-S键共价结合于所述树状金纳米颗粒层上。
进一步地,在进行S12步骤之前,该方法还包括在所述工作电极上形成电子传导层,然后在将所述树状金纳米颗粒层设置于所述电子传导层上。
进一步地,该方法还包括对抗生素检测传感器进行标定,在标定时,该方法包括:
S21:配制0.1M Tris-HCl(pH 7.4)缓冲液,测量所制备的抗生素传感器在不含待测物的缓冲液中的基准电极电位E
S22:配制设定浓度的抗生素溶液,并将抗生素检测传感器与设定浓度的抗生素溶液进行孵育,然后用所述Tris-HCl缓冲液缓冲液进行冲洗,测定孵育后所述抗生素传感器的电极电位E
S23:重复配制不同设定浓度的抗生素溶液,并重复进行S22步骤,测得不同浓度的抗生素溶液对应的不同的电极电位;
S24:计算不同设定浓度的抗生素溶液与所述基准电位的电位差,根据不同所述设定浓度的抗生素溶液及所述电位差,建立所述电位差与抗生素浓度的线性方程。
进一步地,所述Tris-HCl缓冲液的pH值为7.0-8.0,传感器与待测物溶液的孵育时间为30-60min。
进一步地,所述巯基修饰的抗生素适配体溶液的浓度为1-3μM。
综上所述,通过在工作电极上设置树状金纳米颗粒层,并使树状金纳米颗粒层通过Au-S键共价结合有巯基修饰的抗生素核酸适配体序列,其能够极大地扩展工作电极的有效面积,因此其可以在保证传感器的性能的同时,减小传感器的体积,具有较好的便携性,能够进行待检测物的快速现场检测。进一步地,通过丝网印刷工艺一体形成三电极体系,较传统的玻碳电极、金电极,其具有更小的体积,且成本更低,易批量生产。进一步地,该抗生素检测传感器具有较好的重现性及稳定性。
上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,可依照说明书的内容予以实施,并且为了让本发明的上述和其他目的、特征和优点能够更明显易懂,以下特举较佳实施例,并配合附图,详细说明如下。
附图说明
图1所示为本发明实施例提供的抗生素检测传感器结构示意图。
图2所示为树状金纳米颗粒层的电镜表征图。
图3所示为图1中抗生素检测传感器去掉绝缘层后的结构示意图。
图4所示为抗生素检测传感器的系统框图。
图5所示为电位差与抗生素溶液的线性关系图。
图6所示为在进行电位差测量时,由不同浓度巯基修饰的抗生素适配体溶液制备的抗生素检测传感器与同一浓度的抗生素溶液的电位差的对比关系曲线图。
图7所示为在进行电位差测量时,Tris-HCl缓冲液不同的pH值对抗生素传感器检测同一浓度的抗生素溶液的影响曲线图。
图8所示为在进行电位差测量时,抗生素检测传感器与抗生素溶液不同的孵育时间与同一浓度的抗生素溶液的电位差的对比关系曲线图。
图9所示为抗生素检测传感器稳定性的柱状图。
具体实施方式
为更进一步阐述本发明为达成预定发明目的所采取的技术手段及功效,以下结合附图及较佳实施例,详细说明如下。
本发明提供了一种抗生素检测传感器及其制作方法,该抗生素检测传感器体积较小,具有较好的便携性,能够进行待检测物的快速现场检测。
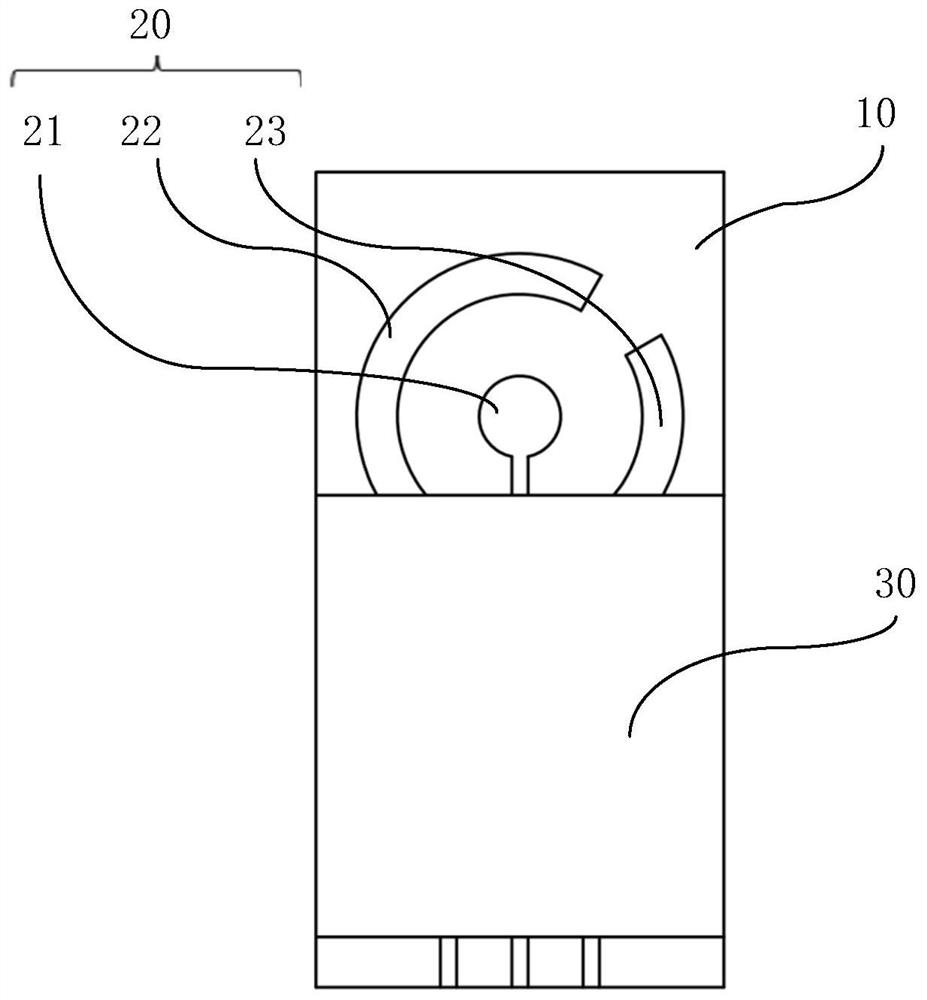
图1所示为本发明实施例提供的抗生素检测传感器结构示意图,图2所示为树状金纳米颗粒层的电镜表征图,图3所示为图1中抗生素检测传感器去掉绝缘层后的结构示意图,图4所示为抗生素检测传感器的系统框图。如图1至图4,本发明实施例提供的抗生素检测传感器包括基底层10及电极层20,电极层20设置于基底层10上,电极层20包括工作电极21、对电极22及参比电极23,在工作电极21上设置有树状金纳米颗粒层,在树状金纳米颗粒层上通过Au-S键共价结合有巯基修饰的抗生素适配体。
在本实施例中,通过在工作电极21上设置树状金纳米颗粒层,并使树状金纳米颗粒层通过Au-S键共价结合有巯基修饰的抗生素核酸适配体序列,其能够极大地扩展工作电极21的有效面积,并对抗生素核酸适配体进行固定。抗生素核酸适配体的DNA骨架中大量磷酸根基团会使工作电极21上带有大量负电荷,也即在抗生素核酸适配体未与目标抗生素发生反映时,工作电极21上具有负电位。
在工作时,可以将工作电极21、参比电极23这两个电极连接到处理器40,如电化学工作站上,并将该传感器浸入配制好的待检测溶液内,待检测溶液内的目标抗生素能够与抗生素核酸适配体发生反映,以造成电位的变化,处理器40从工作电极21、参比电极23上获得待检测溶液的开路电位,并根据检测前后的电位得到待检测溶液中抗生素的含量。
如图2所示,由于树状金纳米颗粒层的存在,能够通过Au-S键共价结合更多的抗生素核酸适配体序列,因此其可以在保证传感器的性能的同时,减小传感器的体积,具有较好的便携性,能够进行待检测物的快速现场检测。可以理解地,巯基修饰的抗生素核酸适配体序列的种类根据需要检测的抗生素的种类而确定,如当需要检测卡那霉素时,其巯基修饰的抗生素核酸适配体序列为卡那霉素核酸适配体序列。
进一步地,在本实施例中,在工作电极21上还设置有电子传导层,该电子传导层设置于工作电极21与树状金纳米颗粒层之间,以利于工作电极21上电子的传导。优选地,电子传导层可以由还原氧化石墨烯(rGO),或单壁碳纳米管、多壁碳纳米管及碳纳米纤维等碳纳米材料制成。
进一步地,基底层10可以由PET(聚对苯二甲酸乙二酯)、PDMS(聚二甲基硅氧烷)或PI(聚酰亚胺)等柔性材料制成的柔性基底层。
如图1所示,在本实施例中,在基底层10上,工作电极21呈圆形设置,而对电极22及参比电极23呈环形环绕工作电极21设置,对电极22及参比电极23设置于同一个圆环上,且彼此之间相互分离。而在其它实施例汇总,工作电极21、对电极22及参比电极23的结构并不以此为限。
工作电极21、对电极22及参比电极23各自通过印刷的导电银浆24延伸至基底层10的端部,绝缘层覆盖于电极层20上,并露出工作电极21、对电极22及参比电极23,整个电极通过电极通讯线与处理器40相连。在本实施例中,工作电极21的直径可以为2-5mm。
在本实施例中,工作电极21、对电极22及参比电极23可以通过丝网印刷工艺一体印刷而成,在进行制作时,工作电极21及对电极22可以由碳油墨印刷而成,而参比电极23可以由银油墨印刷而成。
本发明还提供了一种抗生素检测传感器的制作方法,该方法包括如下步骤:
S11:提供一基底层10,在基底层10上通过丝网印刷工艺形成工作电极21、对电极22及参比电极23;
在该步骤中,工作电极21及对电极22可以由碳油墨印刷而成,而参比电极23可以由银油墨印刷而成。在本实施例中,通过印刷工作电极21、对电极22、参比电极23一体的三电极体系,较传统的玻碳电极、金电极,其具有更小的体积,且成本更低,易批量生产。
S12:在工作电极21上通过电沉积工艺形成树状金纳米颗粒层;
在本实施例中,可以将工作电极21在-1.5V的恒电位下,在2.8mMHAuCl
S13:向树状金纳米颗粒层上滴加巯基修饰的抗生素适配体溶液,并进行设定时间的组装,以将巯基修饰的抗生素适配体通过Au-S键共价结合于树状金纳米颗粒层的表面。
在该步骤中,巯基修饰的抗生素适配体溶液的浓度可以为1-3μM,组装时间可以为10-15h。
进一步地,在进行S12步骤之前,该方法还可以包括在工作电极21上形成电子传导层。该电子传导层可以为还原氧化石墨烯材料制成,在形成时,可以在特定的恒电位-0.8V下,对一定浓度的氧化石墨烯分散液,如0.5mg/mL浓度的氧化石墨烯分散液进行电化学还原来制备。
在其他实施例中,也可以通过滴涂的方式将单壁碳纳米管、多壁碳纳米管、碳纳米纤维等碳纳米材料形成于工作电极21上,以形成电子传导层。
该方法还包括对抗生素检测传感器进行标定。
在本实施例中,该标定方法可以为:
S21:配制Tris-HCl缓冲液,测量所制备的抗生素传感器在不含待测物的缓冲液中的基准电极电位E
S22:配制设定浓度的抗生素溶液,并将抗生素检测传感器与设定浓度的抗生素溶液进行孵育,然后用Tris-HCl缓冲液进行冲洗,测定孵育后的抗生素检测传感器的电极电位E
该抗生素溶液中抗生素的种类与抗生素检测传感器内巯基修饰的抗生素适配体的种类相同,如抗生素检测传感器内为卡那霉素适配体序列时,抗生素溶液为卡那霉素溶液。
S23:重复配制不同设定浓度的抗生素溶液,并重复进行S22步骤,测得不同浓度的抗生素溶液对应的不同的电极电位En;
S24:计算不同设定浓度的抗生素溶液与标准电位的电位差,即ΔOCP=En-E
由于抗生素适配体本身带有大量负电荷,因此,制备好的抗生素检测传感器具有较负的初始电位,而当溶液中有目标抗生素存在时,由于抗生素适配体可特异识别目标物并与目标抗生素结合,这能够引起电极表面有效电荷数的改变,继而使得抗生素检测传感器的电极电位发生变化。
因此,在进行检测时,通过检测待检测溶液中的电极电位及基准电位,再结合电位差与抗生素溶液浓度的线性方程,即可获得待测溶液中目标抗生素的含量。
以卡那霉素为例,根据上述实验步骤进行检测后,记录抗生素检测传感器的电极孵育前的起始开路电位和孵育后的开路电位。如图4所示,ΔOCP与卡那霉素浓度的对数呈线性相关,线性方程为ΔOCP=9.40lg C
以下以检测牛奶样品中卡那霉素含量为例,对其检测方法进行说明。
在牛奶样品内定量加入卡那霉素的标准溶液,并混合均匀,作为人工污染的牛奶样品。预处理步骤如下:首先在样品溶液中滴加乙酸(20%,v/v)调节溶液的pH至4.7,使牛奶中主要的蛋白质——酪蛋白在其等电点下变性和沉淀。随后,样品在45℃下水浴加热30min,以确保酪蛋白彻底沉淀。在11000r/min下离心20min以去除沉淀后,用0.22μm膜过滤样品,得到的溶液即为处理好的样品。然后,利用制备好的抗生素传感器分别测定与待测样品溶液孵育后的电极电位,以及基准电位,计算得到ΔOCP值代入对应表即可求出卡那霉素的浓度。
图6所示为在进行电位差测量时,由不同浓度巯基修饰的抗生素适配体溶液得到的抗生素检测传感器对同一浓度的抗生素溶液检测的影响曲线图。在该曲线图中,其电位差是以不同浓度的巯基修饰的抗生素适配体溶液得到与树状金纳米颗粒通过Au-S键共价结合的抗生素检测传感器对1.0×10
图7所示为在进行电位差测量时,缓冲液不同的pH值对同一浓度的抗生素溶液检测的影响曲线图。在该曲线图中,其电位差是以不同pH值的0.5M Tris-HCl缓冲液对1.0×10
图8所示为在进行电位差测量时,抗生素检测传感器与抗生素溶液不同的孵育时间对同一浓度的抗生素溶液检测的影响曲线图。在该曲线图中,其电位差是由抗生素检测传感器内巯基修饰的抗生素适配体对1.0×10
通过该方法制作而成的抗生素检测传感器具有较好的重现性。
以下以重现性实验对该抗生素检测传感器的重现性进行说明:
以同样的方式同时制备一批抗生素检测传感器,并分别对1.00×10
表1传感器的重现性
与此同时,通过该方法制作而成的抗生素检测传感器具有较好的稳定性。
以下以稳定性实验对该抗生素检测传感器的稳定性进行说明:
同时制备了多个抗生素检测传感器,将其置于4℃冰箱下储存,分别在第1、4、7天取出两支抗生素检测传感器,测定对1.00×10
以上所述,仅是本发明的较佳实施例而已,并非对本发明作任何形式上的限制,虽然本发明已以较佳实施例揭露如上,然而并非用以限定本发明,任何熟悉本专业的技术人员,在不脱离本发明技术方案范围内,当可利用上述揭示的技术内容作出些许更动或修饰为等同变化的等效实施例,但凡是未脱离本发明技术方案内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与修饰,均仍属于本发明技术方案的范围内。
- 抗生素检测传感器及其制作方法
- 一种通用型抗生素检测传感器的制备方法及其应用
