在自动化模块和仪器中对经核酸酶经编辑的序列的改进的检测
文献发布时间:2023-06-19 11:21:00
相关申请
本国际PCT申请要求2018年8月30日提交的美国临时申请第62/724,851号和2019年1月23日提交的美国临时申请第62/795,739号的优先权,为了所有目的将两者通过引用以其整体并入。
发明领域
本发明涉及用于核酸引导的核酸酶编辑和经编辑的活细胞的富集的自动化模块、仪器和方法。
发明背景
在以下讨论中,为了背景和介绍的目的,将会描述某些文章和方法。本文中包含的任何内容均不得解释为对现有技术的“承认”。本申请人明确地保留在适当的情况下证明本文所引用的方法在适用法律条文下不构成现有技术的权利。
对活细胞基因组进行精确、靶向性改变的能力一直是生物医学研究和开发中的长期目标。最近,已鉴定出多种核酸酶,它们允许操纵基因序列,从而操纵基因功能。核酸酶包括核酸引导的核酸酶,使研究人员能够在活细胞中产生永久性编辑。在细胞群体中的编辑效率可以很高;然而,由于未经编辑的细胞缺少编辑过程中发生的双链DNA断裂,因此在汇集(pool)或多重化形式中未经编辑的细胞往往被选择性富集。双链DNA断裂极大地负面影响细胞存活力,从而导致未经编辑的细胞的存活率增强,并使得难以鉴定经编辑的细胞。此外,具有赋予生长优势或劣势的编辑的细胞可以导致群体中不同编辑的占比(representation)出现偏倚。
因此,在核酸引导的核酸酶基因编辑领域中需要改进的用于在细胞群体中生成编辑的方法以及改进的用于富集和选择经编辑的细胞的方法。本发明满足了这种需求。
发明概述
本概述被提供用于以简化的形式介绍一些概念,这些概念将在下面的详细描述中进一步描述。本概述并不意图用于标识所要求保护的主题的关键特征或基本特征,也不意图用于限制所要求保护的主题的范围。根据下面的书面详细描述,包括在附图中示出并且在所附权利要求中定义的那些方面,所要求保护的主题的其他特征、细节、效用和优点将变得明显。
本公开内容提供了用于自动化高通量富集经核酸引导的核酸酶编辑的细胞的方法、模块和仪器。该方法利用了在细胞生长周期中特定的点诱导编辑的优势,其中核酸酶和gRNA中的一种或两者在诱导型启动子的控制下。当细胞培养物达到生长静止期(stationary phase of growth)时(或细胞培养物即将达到生长静止期之前)诱导编辑克服了来自未经编辑的细胞的生长偏倚、来自差异编辑率的生长效应以及不同编辑的适应性效应导致的生长偏倚。实际上,已经确定消除生长率偏倚使得观察到的编辑效率比传统方法提高多达3-4x或更多。
因此,本文提供了包括用于执行经核酸引导的核酸酶编辑的细胞的富集的方法的实施方案,该方法包括:在生长培养基中提供转化的细胞,其中细胞包含核酸引导的核酸酶编辑组分,并且其中至少gRNA在诱导型启动子的控制下;允许转化的细胞生长直至细胞生长至对数期的至少60%;诱导一种或更多种核酸引导的核酸酶编辑组分的转录;并允许细胞进行编辑并且然后生长。在一些方面,核酸引导的核酸酶编辑组分在单个载体上提供至细胞,并且在一些方面,细胞为细菌细胞、酵母细胞或哺乳动物细胞。在一些方面,该方法还包括在第二允许步骤之后,使细胞成为电感受态(electrocompetent)并且用第二轮核酸引导的核酸酶编辑组分转化细胞的步骤,其中至少gRNA在诱导型启动子的控制下。在又一些方面,在诱导一种或更多种核酸引导的核酸酶编辑组分的转录之前,使细胞生长直至它们至少生长至对数期的75%、对数期的80%、对数期的85%、对数期的90%、对数期的95%或处于生长静止期。
在一些方面,诱导型启动子为在温度升高时活化的启动子,并且在一些方面,诱导型启动子为pL启动子,其中通过将细胞的温度升高至42℃来诱导转录。在又其他方面,诱导型启动子为在添加诱导部分后被活化的启动子。
其他实施方案提供了用于执行经核酸引导的核酸酶编辑所编辑的细胞的自动化富集的自动化独立式多模块细胞处理仪器,该自动化独立式多模块细胞处理仪器包括:用于接受细胞的接受器;用于接受核酸的接受器,所述核酸包含核酸酶的编码序列、引导核酸的编码序列和DNA供体序列的编码序列,其中,至少引导核酸的转录在诱导型启动子的控制下;第一生长模块,该第一生长模块用于使待被转化的细胞生长;过滤模块,该过滤模块用于浓缩生长的细胞和使生长的细胞成为电感受态;转化模块,该转化模块用于用核酸转化电感受态细胞;第二生长模块,该第二生长模块用于使转化的细胞生长,其中,第二生长模块包括容器,该容器用于使细胞生长;分光光度计,该分光光度计被配置为监测转化的细胞的生长;和温度组件,该温度组件用于提供诱导诱导型启动子的温度;处理器;以及自动化液体处理系统,该自动化液体处理系统用于根据处理器运行的脚本将液体从用于接受细胞的接受器移动至第一生长模块、将液体从第一生长模块移动至过滤模块、将液体从过滤模块移至转化模块、将液体从用于接受核酸的接受器移动至转化模块,并将液体从转化模块移至第二生长模块,而无需用户干预。
在一些方面,代替温度诱导型启动子,诱导型启动子通过添加由自动化液体处理系统提供的诱导剂来诱导。
在一些方面,第二生长模块还包括警报器,以警告用户细胞已经达到对数期的60%或更多。在一些方面,第一生长模块和第二生长模块为同一生长模块。在一些方面,自动化独立式多模块细胞处理仪器还包括壳体和/或试剂筒。在一些方面,转化模块包括流通式电穿孔装置;和/或第一生长模块包括旋转生长瓶;和/或第二生长模块包括旋转生长瓶。
另外提供了一种用于执行经核酸引导的核酸酶编辑的细胞的富集的方法,该方法包括:在生长培养基中提供转化的细胞,其中,细胞包含第一核酸引导的核酸酶编辑组分,其中,至少第一gRNA在诱导型启动子的控制下;允许转化的细胞生长直至细胞生长至对数期的至少60%;诱导gRNA的转录;允许细胞进行编辑并且然后生长至适于转化的光密度;以及用第二核酸引导的核酸酶编辑组分转化细胞,其中,第二gRNA在诱导型启动子的控制下。在一些方面,使细胞生长至对数期的至少75%、85%或95%,或者使细胞生长直到它们达到生长静止期。
下面更详细地描述本发明的这些方面以及其他特征和优点。
附图简述
图1A为在批量液体培养物中经由核酸引导的核酸酶编辑来编辑活细胞的方法的简化框图。图1B描绘了培养物中细胞的典型生长曲线。
图2为用于在细胞群体中生长、编辑、富集和筛选经编辑的细胞的方法的图。
图3A-3P描绘了自动化多模块系统及其可以与富集/选择模块一起使用的其他模块。
图4为使用如例如图3A中示出的自动化多模块系统在活细胞中创建编辑并筛选经编辑的细胞的方法的框图。
图5为示例性自动化多模块细胞处理仪器的实施方案的简化过程图。
图6A和图6B为示出了经由用于在活细胞中增加观察到的编辑的液体批量方法获得的编辑结果的图。
详述
除了在明确说明的情况下或者在特征或功能与附加实施例不兼容的情况下以外,结合一个实施例描述的所有功能旨在适用于本文描述的附加实施例。例如,在结合一种实施方案明确地描述了给定的特征或功能而结合替代实施方案没有明确提及该给定的特征或功能的情况下,应当理解,可以结合替代实施方案来部署、利用或实现该特征或功能,除非该特征或功能与替代实施方案不兼容。
除非另有说明,否则本文所述的技术的实践可以采用常规技术和有机化学、聚合物技术、分子生物学(包括重组技术)、细胞生物学、生物乳液产生、生物化学和测序技术的描述,这些技术应是从事本领域的技术人员所能掌握的技术。这样的常规技术包括聚合物阵列合成、多核苷酸的杂交和连接以及使用标记物检测杂交。参考本文的实施例可得到关于适合的技术的具体说明。然而,当然也可以使用其他等效的常方案序。此类常规技术和描述可在标准实验室手册,诸如Green等人,编辑(1999),Genome Analysis:A LaboratoryManual Series(I-IV卷);Weiner,Gabriel,Stephens,编辑(2007),Genetic Variation:ALaboratory Manual;Dieffenbach、Dveksler,编辑(2003),PCR Primer:A LaboratoryManual;Bowtell和Sambrook(2003),DNA Microarrays:A Molecular Cloning Manual;Mount(2004),Bioinformatics:Sequence and Genome Analysis;Sambrook和Russell(2006),Condensed Protocols from Molecular Cloning:A Laboratory Manual;以及Sambrook和Russell(2002),Molecular Cloning:A Laboratory Manual(全部来自ColdSpring Harbor Laboratory Press);Stryer,L.(1995)Biochemistry(第4版)W.H.Freeman,New York N.Y.;Gait,“Oligonucleotide Synthesis:A PracticalApproach”1984,IRL Press,London;Nelson和Cox,Lehninger,Principles ofBiochemistry第3版,W.H.Freeman Pub.,New York,N.Y.;Berg等人(2002)Biochemistry,第5版,W.H.Freeman Pub.,New York,N.Y.;Cell and Tissue Culture:LaboratoryProcedures in Biotechnology(Doyle&Griffiths编辑,John Wiley&Sons 1998);Mammalian Chromosome Engineering-Methods and Protocols(G.Hadlaczky编辑,HumanaPress 2011);Essential Stem Cell Methods,(Lanza和Klimanskaya编辑,AcademicPress 2011),为了所有目的,将所有这些通过引用以其整体并入本文。CRISPR专用技术可见于例如Genome Editing and Engineering from TALENs and CRISPRs to MolecularSurgery,Appasani和Church(2018);以及CRISPR:Methods and Protocols,Lindgren和Charpentier(2015)中;为了所有目的,将两者通过引用以其整体并入本文。
需指出,如本文和所附权利要求书中所使用的,单数形式“一(a)”、“一个(an)”和“所述/该(the)”包括复数指示物,除非上下文另外明确指出。因此,因此例如,对“寡核苷酸”的引用是指一个或更多个寡核苷酸,并且对“自动化系统”的引用包括本领域技术人员已知的与该系统一起使用的等效步骤和方法的引用,等等。另外,应理解,本文中可以使用的诸如“左”、“右”、“顶部”、“底部”、“前”、“后”、“侧”、“高度”、“长度”、“宽度”、“上部”、“下部”、“内部”、“外部”、“内”、“外”的术语仅描述参考点,而不必将本公开内容的实施方案限制为任何特定的定向或配置。此外,本文所公开的诸如“第一”、“第二”、“第三”等术语仅表示多个部分、部件、步骤、操作、功能和/或参考点中的一种,并且同样地并非必须将本公开内容的实施方案限制为任何特定的配置或定向。
除非另有定义,否则本文使用的所有技术术语和科学术语具有与本发明所属领域的普通技术人员通常理解的含义相同的含义。为了描述和公开可与当前描述的发明结合使用的装置、方法和细胞群体,本文提及的所有出版物均通过引用并入本文。
在提供值的范围的情况下,应理解,在该范围的上限值和下限值之间的每个中间值以及该陈述范围内的任何其他陈述值或中间值都包括在本发明内。这些较小范围的上限值和下限值可以独立地包括在较小的范围内,并且也包含在本发明内,但要受所陈述范围内的任何明确排除的限制。在所陈述的范围包括极限值中的一个或两个的情况下,这两个所包括的极限值都不包括的范围也包括在本发明内。
在以下描述中,阐述了许多具体细节以提供对本发明的更透彻的理解。然而,对于本领域普通技术人员明显的是,可以在没有这些具体细节中的一者或更多者的情况下实施本发明。在其他情况下,没有对本领域技术人员众所熟知的特征和熟知的过程进行描述,以避免使本发明不清楚。
如本文所用,术语“互补”是指核苷酸之间的沃森-克里克碱基配对,并且具体地是指彼此氢键键合的核苷酸,其中胸腺嘧啶残基或尿嘧啶残基通过两个氢键与腺嘌呤残基连接,并且胞嘧啶残基和鸟嘌呤残基通过三个氢键连接。通常,核酸包括被描述为与指定的第二核苷酸序列具有“互补性百分比”或“同源性百分比”的核苷酸序列。例如,核苷酸序列可以与指定的第二核苷酸序列具有80%、90%或100%的互补性,表明序列的10个核苷酸中的8个核苷酸、序列的10个核苷酸中的9个核苷酸、序列的10个核苷酸中的10个核苷酸与指定的第二核苷酸序列互补。例如,核苷酸序列3'-TCGA-5'与核苷酸序列5'-AGCT-3'100%互补;核苷酸序列3'-TCGA-5'与核苷酸序列5'-TTAGCTGG-3'的一个区域100%互补。
术语DNA“控制序列”统称为启动子序列、聚腺苷酸化信号、转录终止序列、上游调控域、复制起点、内部核糖体进入位点、核定位序列、增强子等,它们共同为接受细胞中的编码序列提供复制、转录和翻译。这些类型的控制序列不需要全都存在,条件是选择的编码序列能够在适当的宿主细胞中复制、转录和(对于一些组分而言)能够翻译。
如本文所用,术语“供体DNA”或“供体核酸”是指这样的核酸,该核酸被设计为使用核酸引导的核酸酶通过同源重组将DNA序列修饰(插入、缺失、取代)引入基因座中。对于同源性引导的修复,供体DNA必须与基因组靶序列中位于“切割位点”或待编辑位点的侧翼的区域具有足够的同源性。同源臂的长度将取决于例如所进行的修饰的类型和尺寸。在许多情况下并且优选地,供体DNA将与基因组靶基因座具有两个序列同源性区域(例如,两个同源臂)。优选地,“插入”区域或“DNA序列修饰”区域(人们期望引入细胞中基因组靶基因座的核酸修饰)将位于两个同源性区域之间。DNA序列修饰可以在靶基因组DNA序列的一个特定位点或多于一个特定位点处改变一个或更多个碱基。改变可以包括改变靶序列的1个、2个、3个、4个、5个、10个、15个、20个、25个、30个、35个、40个、50个、75个、100个、150个、200个、300个、400个或500个或更多个碱基对。缺失或插入可以是对靶序列的1个、2个、3个、4个、5个、10个、15个、20个、25个、30个、40个、50个、75个、100个、150个、200个、300个、400个或500个或更多个碱基对的缺失或插入。
如本文所用,“富集”或“筛选”是指通过以下来富集经编辑的细胞:在液体培养基中培养细胞,使细胞生长直至细胞达到生长静止期(例如,对数或指数生长期之后的生长期),然后通过诱导至少gRNA的转录(并且在一些实施方案中,也诱导核酸酶的转录)来诱导细胞的编辑。
术语“引导核酸”或“引导RNA”或“gRNA”是指包含以下的多核苷酸:1)能够与基因组靶基因座杂交的引导序列,和2)能够与核酸引导的核酸酶相互作用或复合的支架序列。
“同源性”或“同一性”或“相似性”是指两个肽之间的序列相似性,或更通常地,在本公开内容的上下文中,是指两个核酸分子之间的序列相似性。术语“同源区域”或“同源臂”是指供体DNA上与靶基因组DNA序列具有一定程度的同源性的区域。同源性可以通过比较每个序列中的位置来确定,所述序列可以为了比较的目的而进行比对。当比较的序列中的一个位置被相同的碱基或氨基酸占据时,则分子在该位置是同源的。序列之间的同源性程度是序列共有的匹配或同源的位置数目的函数。
“核酸引导的编辑组分”是指以下中的一种、一些或全部:核酸酶、引导核酸、供体核酸以及如果需要的话,重组(例如,重组工程化)系统(在细菌中)。
“可操作地连接”是指元件的所描述的部件被配置为执行其通常的功能的布置。因此,可操作地连接至编码序列的控制序列能够实现编码序列的转录,并且在一些情况下,实现翻译。控制序列不必与编码序列邻接,条件是它们起作用以引导编码序列的表达。因此,例如,在启动子序列和编码序列之间可以存在中间的非翻译但仍被转录的序列,并且仍然可以认为该启动子序列与编码序列“可操作地连接”。实际上,这样的序列不必位于同一连续DNA分子(即染色体)上,并且仍然可以具有相互作用,从而导致调控改变。
“启动子”或“启动子序列”为DNA调控区,其能够结合RNA聚合酶并启动由任何类别的任何RNA聚合酶I、II或III转录的多核苷酸或多肽编码序列(诸如信使RNA、核糖体RNA、小核或核仁RNA、引导RNA或任何种类RNA)的转录。启动子可以为组成型或诱导型的,并且在本文的方法中,至少gRNA的转录为诱导型的,并且核酸引导的核酸酶编辑系统的一种或更多种其他组分在诱导型启动子的控制下。
如本文所用,术语“选择性标志物”是指引入细胞中的这样的基因,该基因赋予适于人工选择的性状。通常使用的选择性标志物是本领域普通技术人员熟知的。可以使用药物选择性标志物,诸如氨苄青霉素/羧苄青霉素,卡那霉素,氯霉素,红霉素,四环素,庆大霉素,博来霉素,链霉素,嘌呤霉素,潮霉素,杀稻瘟素和G418。在其他实施方案中,选择性标志物包括但不限于人类神经生长因子受体(用MAb检测,诸如美国专利第6,365,373号中描述的)、截短的人类生长因子受体(用MAb检测)、突变型人类二氢叶酸还原酶(DHFR;可用的荧光MTX底物)、分泌型碱性磷酸酶(SEAP;可用的荧光底物);人类胸苷酸合酶(TS;赋予对抗癌剂氟脱氧尿苷的抗性)、人类谷胱甘肽S-转移酶α(GSTA1;将谷胱甘肽与干细胞选择性烷基化剂白消安缀合;CD34+细胞中的化疗保护性选择性标志物)、造血干细胞中的CD24细胞表面抗原、赋予对N-膦酰基乙酰基(phosphonacetyl)-L-天冬氨酸(PALA)的抗性的人类CAD基因、人类多药耐药性蛋白1(human multi-drug resistance-1,MDR-1;可通过增加耐药性来选择或通过FACS富集的P糖蛋白表面蛋白)、人类CD25(IL-2α;可通过Mab-FITC检测)、甲基鸟嘌呤-DNA甲基转移酶(MGMT;可通过卡莫司汀选择)、鼠李糖以及胞苷脱氨酶(CD;可通过Ara-C选择)。如本文所用的“选择性培养基”是指已经向其中添加了选择选择性标志物或针对选择性标志物进行选择的化合物或生物部分的细胞生长培养基。
术语“靶基因组DNA序列”、“靶序列”或“基因组靶基因座”是指体外或体内或细胞或细胞群体的核酸(例如,基因组或附加体(episome))中的任何基因座,其中期望使用核酸引导的核酸酶编辑系统改变至少一个核苷酸。靶序列可以是基因组基因座或染色体外基因座。
“载体”是包含期望的待递送至细胞和/或在细胞中表达的一个或更多个序列的多种核酸中的任一种。载体通常由DNA组成,尽管RNA载体也是可用的。载体包括但不限于质粒、F黏粒(fosmid)、噬粒(phagemid)、病毒基因组、BAC、YAC、PAC、合成的染色体等。如本文所用,短语“引擎载体”包含待用于本公开内容的核酸引导的核酸酶系统和方法的核酸酶的编码序列。在细菌系统中,引擎载体还可以包含λRed重组工程化系统或其等同物。引擎载体通常还包含选择性标志物。如本文所用,短语“编辑载体”包含至少两个连续连接(contiguously-linked)的编辑盒,其中每个编辑盒包含引导RNA(gRNA)的编码序列,供体核酸的编码序列,以及防止发生编辑后核酸酶在靶序列中的PAM或间隔区(spacer)处结合的对靶序列的改变。编辑载体还可以包括选择性标志物和/或条形码。在一些实施方案中,引擎载体和编辑载体可以被组合;也就是说,引擎载体上的核酸引导的核酸酶系统组分可以存在于编辑载体上。此外,引擎和编辑载体包含控制序列,该控制序列可操作地连接至例如核酸酶编码序列、重组工程化系统编码序列(如果存在的话)、供体核酸、引导核酸和选择性标志物。
通常在核酸引导的核酸酶基因组系统中的编辑
本公开内容提供用于核酸引导的核酸酶编辑活细胞的方法和仪器,并且特别是用于在批量液体培养物中生长的经编辑的细胞的改进的富集的高通量方法。本文所述的组合物和方法改进了CRISPR编辑系统,其中核酸引导的核酸酶(例如,RNA引导的核酸酶)用于编辑生物体的基因组中的特定靶区域。在细胞中与合适的合成的引导核酸(synthetic guidenucleic acid)复合的核酸引导的核酸酶(nucleic acid-guided nuclease)可以在期望的位置处切割细胞的基因组。引导核酸帮助核酸引导的核酸酶识别并切割特定靶序列处的DNA。通过操纵引导核酸的核苷酸序列,核酸引导的核酸酶可以被编程为靶向任何DNA序列以进行裂解,条件是附近有合适的前间区序列邻近基序(PAM)。
通常,引导核酸(例如,gRNA)与相容的核酸引导的核酸酶复合,并且然后可以与靶序列杂交,从而将核酸酶引导至靶序列。所述gRNA可以由多核苷酸分子(诸如质粒、线性构建体)上的DNA序列编码,或者编码序列可以位于编辑盒内并且在诱导型启动子的控制下,如下文描述的。
引导核酸包含引导序列,其中引导序列是这样的多核苷酸序列,该多核苷酸序列与靶序列具有足够互补性以与靶序列杂交,并且引导复合的核酸引导的核酸酶与靶序列的序列特异性结合。当使用合适的比对算法进行最佳比对时,引导序列与对应靶序列之间的互补性程度为约以下或大于约以下:50%、60%、75%、80%、85%、90%、95%、97.5%、99%或更大。最佳比对可以通过使用任何合适的用于比对序列的算法来确定。在一些实施方案中,引导序列的长度为约以下或大于约以下:10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个、30个、35个、40个、45个、50个、75个或更多个核苷酸。在一些实施方案中,引导序列的长度为小于约75个、50个、45个、40个、35个、30个、25个、20个核苷酸。优选地,引导序列的长度为10-30个或15-20个核苷酸,或长度为15个、16个、17个、18个、19个或20个核苷酸。
在优选实施方案中,引导核酸作为从质粒或载体表达的编辑盒中的编码序列提供,并且引导核酸作为在诱导型启动子的控制下的单个转录物包含引导序列和支架序列两者。描述编辑盒的各个方面的美国专利和申请包括2019年3月26日发布的USPN 10,240,167;2019年4月23日提交的USPN 10,266,849;2018年5月29日发布的USPN 9,982,278;2019年7月16日发布的USPN 10,351,877;和2019年7月30日发布的USPN 10,362,442;以及2018年2月14日提交的USSN 16/275,439;和2019年2月14日提交的USSN 16/275,465。引导核酸可以通过以下进行工程化以靶向期望的靶序列:改变引导序列,使得引导序列与期望的靶序列互补,从而允许引导序列和靶序列之间杂交。通常,为了在靶序列中产生编辑,gRNA/核酸酶复合物结合到由引导RNA确定的靶序列,并且核酸酶识别与靶序列相邻的前间区序列邻近基序(PAM)序列。靶序列可以是原核细胞或真核细胞内源或外源或在体外的任何基因组多核苷酸或附加体多核苷酸。例如,靶序列可以是位于在真核细胞的核中的多核苷酸。靶序列可以是编码基因产物(例如,蛋白)的序列或非编码序列(例如,调控性多核苷酸、内含子、PAM、间隔区或“无用(junk)”DNA)。
靶序列与PAM相关联,PAM是被gRNA/核酸酶复合物识别的短核苷酸序列。不同的核酸引导的核酸酶对PAM的精确序列和长度的要求有所不同;然而,PAM通常是与靶序列相邻或邻近的2-7个碱基对序列,并且取决于核酸酶,可以在靶序列的5'或3'侧。对核酸引导的核酸酶的PAM相互作用域的工程化允许改变PAM特异性,提高靶位点识别准确性,降低靶位点识别准确性或增加核酸引导的核酸酶的多功能性。在某些实施方案中,编辑盒提供供体DNA序列,这允许对靶序列进行基因组编辑,包括对靶序列(例如,细胞的基因组DNA)的期望的DNA改变,以及对靶序列中前间区序列(PAM)区域的去除、突变或者使靶序列中前间区序列(PAM)区域失活。使靶序列处的PAM失活阻止了在该靶序列处对细胞基因组的额外编辑,例如,在后面轮次的编辑中随后暴露于与合成的引导核酸复合的核酸引导的核酸酶时。因此,可以使用与和靶序列互补的合成的引导核酸复合的核酸引导的核酸酶来选择具有期望的靶序列编辑和改变的PAM的细胞。未经历第一次编辑事件的细胞将被切割,致使双链DNA断裂,并且因此将无法继续存活。包含期望的靶序列编辑和PAM改变的细胞将不会被切割,因为这些经编辑的细胞不再包含必需的PAM位点,并且将继续生长和增殖。
核酸引导的核酸酶可以识别的靶序列的范围受到定位于期望的靶序列附近的特定PAM的需要的限制。因此,常常难以以基因组编辑所必需的精度来靶向编辑。已经发现,核酸酶可以很好地识别一些PAM(例如,经典的PAM),而对其他PAM的识别不是很好或较差(例如,非经典的PAM)。因为本文公开的方法允许在未经编辑的细胞的大背景中鉴定经编辑的细胞,所以该方法允许在PAM次于最佳值的情况下鉴定经编辑的细胞;也就是说,即使编辑效率非常低,本文中用于鉴定经编辑的细胞的方法也允许鉴定经编辑的细胞。另外,本发明的方法扩大了可以被编辑的靶序列的范围,因为更容易鉴定编辑,包括基因组编辑与功能较弱的PAM相关联的细胞。
对于核酸引导的核酸酶编辑系统的核酸酶组分,可以对编码核酸引导的核酸酶的多核苷酸序列进行密码子优化,以在特定细胞诸如古细菌细胞、原核细胞或真核细胞中表达。真核细胞可以是酵母细胞、真菌细胞、藻类细胞、植物细胞、动物细胞或人类细胞。真核细胞可以是特定生物体的真核细胞或源自特定生物体的真核细胞,所述特定生物体诸如哺乳动物,,包括但不限于人类、小鼠、大鼠、兔、犬或非人类哺乳动物包括非人类灵长类动物。待使用的核酸引导的核酸酶的选择取决于许多因素,诸如在靶序列中将进行何种类型的编辑以及合适的PAM是否位于期望的靶序列附近。在本文所述的方法中使用的核酸酶包括但不限于Cas 9、Cas 12(例如,CpfI)、MAD2、MAD7和其他MAD酶。与引导核酸一样,核酸酶可以且优选地由载体(例如,引擎载体)上的DNA序列编码,并且可以且优选地在诱导型启动子的控制下。在一些实施方案中,编码核酸酶的序列在诱导型启动子的控制下,并且该诱导型启动子可以与控制引导核酸转录的诱导型启动子分开但相同;也就是说,分开的诱导型启动子驱动核酸酶序列和引导核酸序列的转录,但是这两个诱导型启动子可以是同一类型的诱导型启动子(例如,都是pL启动子)。可选地,控制核酸酶表达的诱导型启动子可以与控制引导核酸转录的诱导型启动子不同;也就是说,例如,核酸酶可以在pBAD诱导型启动子的控制下,而引导核酸可以在pL诱导型启动子系统的控制下。
核酸引导的核酸酶系统的另一组分是供体核酸。供体核酸与引导核酸在同一多核苷酸(例如,编辑盒)上,并且可以(但不是必须)与引导核酸在同一启动子的控制下(例如,单个启动子驱动引导核酸和供体核酸两者的转录)。供体核酸被设计成用作与靶序列(被作为gRNA/核酸酶复合物的一部分的核酸引导的核酸酶切口(nick)或裂解)同源重组的模板。供体核酸多核苷酸可以是任何合适的长度,诸如长度为约以下或大于约以下:20个、25个、50个、75个、100个、150个、200个、500个或1000个核苷酸。在某些优选方面,供体核酸可以以20-300个核苷酸之间、更优选50-250个核苷酸之间的寡核苷酸提供。供体核酸包含与靶序列的一部分互补的区域(例如,同源臂)。当进行最佳比对时,供体核酸的例如约20个、25个、30个、35个、40个、50个、60个、70个、80个、90个或更多个核苷酸与靶序列重叠(互补)。在许多实施方案中,供体核酸包含位于供体核酸与靶模板之间的突变或差异的侧翼的两个同源臂(与靶序列互补的区域)。与靶序列相比,供体核酸包含至少一个突变或改变,诸如与靶序列相比具有插入、缺失、修饰或其任何组合。
供体核酸可以并且优选地作为编辑盒中的组件提供,其中编辑盒可以是插入载体骨架中的多于一个编辑盒中的一个。也就是说,可以存在插入编辑载体中的多于一个,例如两个、三个、四个、五个或更多个个体编辑盒,其中每个引导核酸/供体核酸对在单独的不同的启动子的控制下,在单独的相似的启动子的控制下,或者其中所有引导核酸/供体核酸对均在单个启动子的控制下。参见例如2019年2月14日提交的USSN 16/275,465。如前所述,驱动gRNA转录的启动子是诱导型启动子。在一些实施方案中,核酸酶的转录也是诱导型的,并且在一些实施方案中,核酸酶和gRNA两者的转录都是诱导型的。诱导型编辑的优势在于,在启动编辑之前,可以使细胞生长若干次至许多次细胞倍增,达到生长静止期(或几乎达到生长静止期),这增加了带有编辑的细胞将存活的可能性。由于在编辑期间造成的双链DNA断裂,编辑往往对细胞具有毒性。这种毒性导致经编辑的细胞的细胞死亡以及确实存活但必须在编辑后进行修复和恢复的经编辑的细胞的生长滞后。
除供体核酸外,编辑盒可包含一个或更多个引物位点。通过使用寡核苷酸引物和桥接寡核苷酸,引物位点可以用于扩增编辑盒和组装多重编辑盒;例如,如果引物位点位于编辑盒的一个或更多个其他组件的侧翼。
同样,如上所述,供体核酸可以包含(除了至少一个相对于靶序列的突变外)一个或更多个使靶序列中的PAM位点突变、缺失或使其失活的PAM序列改变。如果使用相同的核酸酶,则靶序列中的PAM序列改变使得PAM位点对核酸引导的核酸酶“免疫”,并且在随后轮次的编辑中保护靶序列免于进一步的编辑。
另外,编辑盒可以包含条形码。条形码是对应于供体DNA序列的独特DNA序列,使得条形码可以鉴定对相应靶序列进行的编辑。条形码通常包含四个或更多个核苷酸。在一些实施方案中,编辑盒包含供体核酸的集合,该供体核酸的集合代表例如全基因范围或全基因组范围的供体核酸文库。将编辑盒文库组装成至少两个编辑盒的多重编辑盒,并且然后克隆到载体骨架中,其中例如,每个不同的供体核酸与不同的条形码缔合。
另外,在一些实施方案中,核酸引导的核酸酶系统的载体编码组件还编码包含一个或更多个核定位序列(NLS)(诸如约或多于约1个、2个、3个、4个、5个、6个、7个、8个、9个、10个或更多个NLS)的核酸引导的核酸酶。在一些实施方案中,工程化核酸酶包含氨基末端处的NLS或氨基末端附近的NLS、羧基末端处的NLS或羧基末端附近的NLS、或其组合。
引擎载体和编辑载体(或组合的引擎/编辑单个载体)包含可操作地链接至待转录的组件序列的控制序列。如上所述,驱动核酸引导的核酸酶编辑系统中的至少gRNA和任选地一种或更多种另外的组件转录的启动子是诱导型的。已经开发了许多基因调节控制系统以用于在植物细胞、微生物细胞和动物细胞(包括哺乳动物细胞)中基因的受控表达,包括pL启动子(由CI857阻遏物的热失活诱导),pBAD启动子(通过向细胞生长培养基中添加阿拉伯糖诱导)和鼠李糖诱导型启动子(通过向细胞生长培养基中添加鼠李糖诱导)。其他系统包括四环素控制的转录活化系统(Tet-On/Tet-Off,Clontech,Inc.(Palo Alto,CA);Bujard和Gossen,PNAS,89(12):5547-5551(1992)),the Lac Switch Inducible system(Wyborski等人,Environ Mol Mutagen,28(4):447-58(1996);DuCoeur等人,Strategies 5(3):70-72(1992);美国专利第4,833,080号),蜕皮激素诱导型基因表达系统(No等人,PNAS,93(8):3346-3351(1996)),cumate基因转换系统(Mullick等人,BMC Biotechnology,6:43(2006))以及他莫昔芬诱导型基因表达(Zhang等人,Nucleic Acids Research,24:543-548(1996))以及其他。
本发明的组合物和方法利用编辑盒,诸如在以下描述编辑盒的各个方面的美国专利和申请中描述的编辑盒,包括2019年3月26日发布的USPN 10,240,167;2019年4月23日提交的USPN 10,266,849;2018年5月29日发布的USPN 9,982,278;2019年7月16日发布的USPN10,351,877;和2019年7月30日发布的USPN 10,362,442;以及2018年2月14日提交的USSN16/275,439;和2019年2月14日提交的USSN 16/275,465。每个编辑盒包含gRNA、供体DNA和PAM或间隔区突变;因此,例如,双盒多重编辑盒(two-cassette multiplex editingcassette)包含第一gRNA、第一供体DNA和第一PAM或间隔区突变,以及至少第二gRNA、至少第二供体DNA和至少第二PAM或间隔区突变。参见例如2019年2月14日提交的USSN 16/275,465。在一些实施方案中,单个启动子可以驱动第一gRNA和第二gRNA两者以及第一供体DNA和第二供体DNA两者的转录,并且在一些实施方案中,分开的启动子可以驱动第一gRNA和第一供体DNA的转录以及第二gRNA和第二供体DNA的转录。另外,多重编辑盒可以在编辑盒之间包含具有例如引物序列、桥接寡核苷酸和允许多重编辑盒组装的其他“盒连接”序列元件的核酸元件。用于多重编辑盒的合成和组装方法使其能够基于合成的编辑盒的汇集中每个gRNA/供体DNA盒的占比,实现不同频率的不同编辑的“可调”掺入。
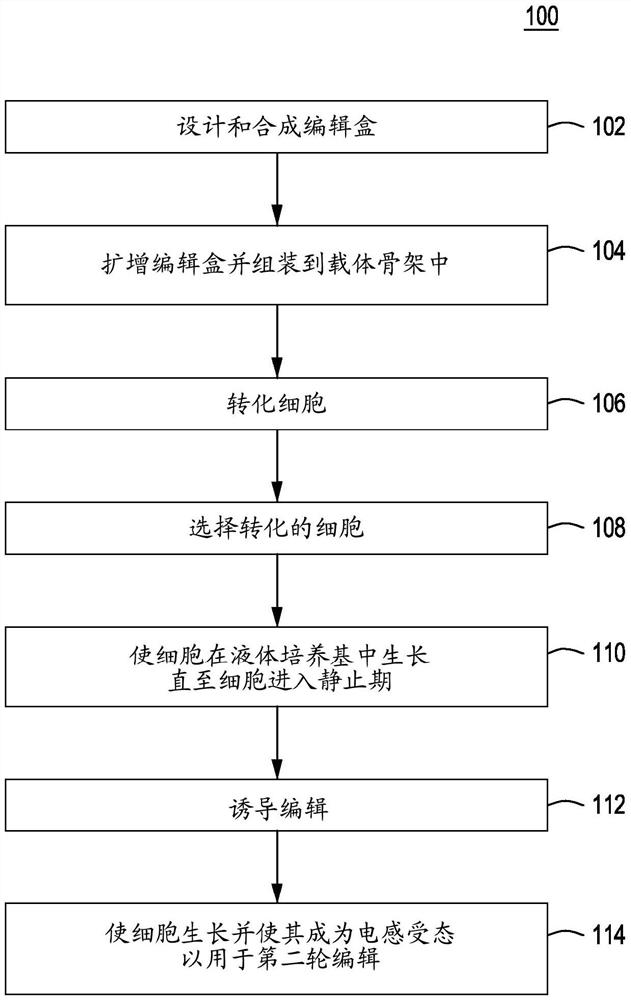
图1A示出了用于富集经编辑的细胞的示例性方法100的简化流程图。参见图1A,方法100开始于设计和合成编辑盒102。如上所述,每个编辑盒包含gRNA、供体DNA和PAM或间隔区突变。在合成个体编辑盒后,可以将个体编辑盒“连接”或“组装”在一起,并且扩增和组装到编辑载体骨架中104,使得编辑盒位于诱导型启动子的3'。然后,包含编辑盒的编辑载体用于转化细胞106,从而创建转化细胞的文库。除了包含组装的编辑盒的载体以外,还可以用包含核酸酶编码序列的单独的引擎载体同时转化细胞。可选地,细胞可以已经表达核酸酶(例如,细胞可以已经用引擎载体转化,或者核酸酶的编码序列可以已经稳定整合到细胞基因组中),使得仅需要将编辑载体转化到细胞中;或者可以用包含执行核酸引导的核酸酶基因组编辑所需的所有组件(例如,所有核酸酶和编辑盒)的单个载体转化细胞,这在采用处理(curing)和递归轮的编辑时是有利的。
各种递送系统可用于将核酸引导的核酸酶编辑系统组分引入(例如,转化或转染)到宿主细胞中108。这些递送系统包括使用酵母系统,脂质转染系统,显微注射系统,生物弹射系统,病毒体(virosome),脂质体,免疫脂质体,聚阳离子,脂质:核酸缀合物,病毒颗粒,人工病毒颗粒,病毒载体,电穿孔,细胞可渗透肽,纳米颗粒,纳米线,外泌体(exosome)。可选地,分子木马脂质体(molecular trojan horse liposomes)可用于跨血脑屏障递送核酸引导的核酸酶组分。特别令人感兴趣的是使用电穿孔,特别是流通式电穿孔(作为独立仪器或作为自动化多模块系统中的模块),如在例如2018年9月28日提交的16/147,120;2018年9月28日提交的16/147,353;2018年9月30日提交的16/147,865;2019年5月30日提交的16/426,310;以及2018年9月30日提交的16/147,871中描述的。如果筛选/选择模块为自动化多模块细胞编辑系统中的一个模块,则细胞可能会在自动化细胞转化模块中进行转化。
在转化106后,可以使用选择性标志物对细胞进行选择108。使用选择性标志物来选择已经接收引擎载体和编辑载体两者的细胞或已经用单个组合的引擎和编辑载体转化的细胞。常用的选择性标志物包括药物选择性标志物,诸如氨苄青霉素/羧苄青霉素、卡那霉素、氯霉素、红霉素、四环素、庆大霉素、博来霉素、链霉素、鼠李糖、嘌呤霉素,潮霉素,杀稻瘟素和G418。
在选择已经正确转化的细胞108后,方法100中的下一步是使细胞在液体培养基中生长,直至细胞进入(或接近进入)生长静止期。在细胞处于静止期110(或几乎达到静止期)时,通过诱导至少gRNA以及优选地核酸酶的转录在细胞中诱导编辑112。在诱导编辑112后,可以使细胞生长,使细胞成为电感受态,并进行另一轮编辑114。
图1B描绘了培养物中细胞的典型生长曲线160(光密度与时间)。最初存在停滞期150,然后细胞进入对数期152,在对数期细胞快速生长,并且最后,细胞达到静止期154,在静止期,细胞不再分裂。本发明的方法采用在时间点156时或时间点156之后,当细胞处于生长静止期或接近生长静止期时,诱导至少gRNA(以及任选地核酸酶)的转录;也就是说,细胞在以下时间点被诱导:进入对数生长期至少60%,或进入对数生长期至少65%,或进入对数生长期至少70%,或进入对数生长期至少71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、79%、98%或99%,以及在生长静止期期间的任何时间。
图2描绘了用于进行核酸引导的核酸酶基因组编辑的示例性方案。图2描绘了图1A中示出的用于编辑细胞的方案。首先,将编辑载体202的文库或集合(编辑载体各自包含具有在诱导型启动子控制下的gRNA的编辑盒)引入203(例如,电穿孔)到培养的细胞204中,细胞204包含在组成型启动子或诱导型启动子(优选诱导型启动子)的控制下的核酸酶的编码序列,该核酸酶的编码序列1)包含(最通常是与选择性标志物一起)在已经转化到细胞中的“引擎质粒”上;2)整合到被转化细胞的基因组中;或3)该核酸酶的编码序列可以位于编辑载体上。编辑载体202包含供体DNA、PAM或间隔区改变序列(最通常是使基因组中靶位点处的PAM失活的序列)、在诱导型启动子控制下的gRNA的编码序列和选择性标志物的编码序列。
在步骤209,使细胞生长直至它们达到静止期或接近静止期。在细胞达到静止期时诱导编辑217(例如,其中gRNA和/或任选地核酸酶的转录被诱导),并且培养物222中的细胞被编辑并且然后允许从编辑恢复。恢复后,可以将细胞铺板219,生长并汇集224。可选地,可将来自培养物222的细胞铺板221,并选择缓慢生长的集落226(例如,择优挑选(cherry-picking)小的集落)。在又另一种替代方案中,可以将细胞保留在液体培养物中,生长至合适的OD,使细胞成为电感受态,并进行另一轮编辑228。这种经编辑的细胞的富集方法是特别理想的,因为该富集方法可以以高通量方式进行,并且不需要细胞铺板且是可自动化的。在步骤217,诱导可以通过例如使用pL启动子系统进行,其中pL启动子通过以下步骤诱导:将培养基216中的细胞的温度升高至42℃持续例如一小时至许多小时,以诱导核酸酶和gRNA的表达,以进行切割和编辑。在诱导编辑并且允许进行所需的时间段后,使培养物222的温度返回至30℃。
在一种方法221中,将来自批量液体培养物的细胞铺板并选择缓慢生长的集落226。在经编辑的细胞中,在诱导编辑后的时间段内细胞存活力受到损害。在图2中示出的选择方法(例如,选择缓慢生长的集落221)利用经编辑的细胞的集落中的生长滞后来鉴定经编辑的细胞。在一些实施方案中,经编辑的细胞的集落尺寸比未经编辑的细胞的集落小20%。在一些方面,经编辑的细胞的集落尺寸比未经编辑的细胞的集落小30%、40%、50%、60%、70%、80%或90%。在许多实施方案中,经编辑的细胞的集落尺寸比未经编辑的细胞的集落小30%-80%,并且在一些实施方案中,经编辑的细胞的集落尺寸比未经编辑的细胞的集落小40%-70%。
虽然已在测量琼脂板上细胞集落的集落尺寸的背景下描述了使用细胞生长作为编辑指标来筛选经编辑的细胞的方法,但替代地可以测量生长的细胞集落(诸如在微量滴定板或一系列管中)的光密度(OD)。此外,除了或替代细胞集落尺寸或OD,可以测量其他细胞生长参数。例如,使用可见光、UV光或近红外(NIR)光的光谱法允许监测细胞培养物中营养物和/或废产物的浓度。另外,光谱测量可以用于同时量化多于一种化学物质。非对称性化学物质可以通过鉴定NIR的特征性吸收特征来量化。相反,对称性化学物质可以使用拉曼光谱法容易地量化。许多重要的代谢物,诸如葡萄糖、谷氨酰胺、氨和乳酸盐具有独特的IR光谱特征,使得可以容易地对它们进行量化。样品吸收的光的量和频率可以与样品中存在的化学物质的类型和浓度相关。这些测量类型中的每一种均提供特定的优势。FT-NIR提供最大的光穿透深度,并且因此可以用于较厚的样品,使得它们提供较高的光散射度。FT-mid-IR(MIR)由于对于某些分析物是特异的而提供更容易分辨的信息,因为这些波长更接近于基础IR吸收。当要使由水引起的干扰最小化时,FT-Raman是有利的。其他光谱特性可以经由例如介电阻抗谱法、可见荧光、荧光偏振或发光来测量。另外,用于测量例如溶解氧、二氧化碳、pH和/或电导率的传感器可用于评估细胞生长速率。关于选择或择优挑选经编辑的细胞的其他方法和材料,参见2019年6月26日提交的USSN 16/454,865。
执行核酸引导的核酸酶编辑的自动化系统
图3A描绘了用于例如执行上述示例性工作流程之一的示例性自动化多模块细胞处理仪器300,以及另外的示例性模块。示出了门架(gantry)302,其提供自动化机械运动系统(致动器)(未示出),该自动化机械运动系统向例如自动化多模块细胞处理仪器300的模块(包括例如空气置换移液器332)提供XYZ轴运动控制。在一些自动化多模块细胞处理仪器中,空气置换移液器由门架移动,并且各种模块和试剂筒保持静止;然而,在其他实施方案中,移液系统可以保持静止,而各种模块移动。自动化多模块细胞处理仪器300中还包括洗涤或试剂筒304,包括储器306。如以下关于图3B所描述的,洗涤或试剂筒304可被配置为容纳大的管,例如洗涤溶液或在整个迭代过程中经常使用的溶液。在一种实例中,洗涤或试剂筒304可被配置为当两个或更多个试剂筒310被顺序地使用和更换时保持在原位。尽管试剂筒310和洗涤或试剂筒304在图3A中被示为分离的盒,但是洗涤盒304的内容物可以并入到试剂筒310中。
图3A的示例性自动化多模块细胞处理仪器300还包括细胞生长模块334。在图3A所示的实施方案中,细胞生长模块334包括两个细胞生长瓶318、320(以下关于图3E更详细地描述)以及细胞浓缩模块322(如关于图3J-3P更详细地描述的)。在可选的实施方案中,细胞浓缩模块322可以与细胞生长模块334分开,例如在单独的专用模块中。还示出了作为图3A的自动化多模块细胞处理仪器300的一部分的浓缩/选择模块340,浓缩/选择模块340由例如空气置换移液器332服务。还可见废液储器326,以及核酸组装/脱盐模块314,该核酸组装/脱盐模块314包括反应室或管接受器(未示出),并且还包括磁体316,以允许使用例如磁性固相可逆固定化(SPRI)珠(Applied Biological Materials Inc.,Richmond,BC)来纯化核酸。试剂筒、转化模块和细胞生长模块在下文更详细地描述。关于自动化多模块细胞处理仪器的详细描述,参见2018年6月30日提交的USPN 10,253,316;2019年2月7日提交的USPN10,329,559;和2019年2月7日提交的10,323,242;以及2019年5月14日提交的USSN 16/412,175;2019年5月14日提交的16/412,195;以及2019年5月28日提交的16/423,289,所有这些通过引用以其整体并入本文。
图3B描绘了可以与筛选/选择模块一起在自动化多模块细胞处理仪器中使用的示例性组合试剂筒和电穿孔装置310(“筒”)。在某些实施方案中,用于制造筒的材料为导热的,因为在某些实施方案中,筒310接触热装置(未示出),诸如珀耳帖装置(peltierdevice)或热电冷却器,其加热或冷却试剂接受器或储器312中的试剂。试剂接受器或储器312可以是如图3B中所示的其中插入个体试剂管的接受器,或者试剂接受器可以容纳试剂而无需插入的管。另外,试剂筒中的接受器可以被配置为用于管、连接的管和试剂的直接填充的任何组合。
在一种实施方案中,试剂筒310的试剂接受器或储器312被配置为容纳多种尺寸的管,包括例如250ml管,25ml管,10ml管,5ml管以及Eppendorf管或微量离心管。在又另一种实施方案中,所有接受器可被配置为容纳相同尺寸的管,例如5ml管,并且储器插入件可用于将较小的管容纳在试剂储器中(未示出)。在又另一种实施方案中,特别是在其中试剂筒是一次性的实施方案中,试剂储器容纳试剂而无需插入的管。在该一次性实施方案中,试剂筒可以为试剂盒的一部分,其中试剂筒预装有试剂,并且接受器或储器用例如箔、热封丙烯酸等密封,并提供给消费者,然后可以将试剂筒用于自动化多模块细胞处理仪器。如本领域技术人员鉴于本公开内容将理解的是,容纳在试剂筒中的试剂将根据工作流程而变化;也就是说,试剂将根据自动化多模块细胞处理仪器中细胞所经受的处理而变化。
试剂,诸如细胞样品、酶、缓冲液、核酸载体、编辑盒、蛋白或肽、反应组分(诸如,例如MgCl
例如,试剂筒可包括脚本以从储器移取感受态细胞,将细胞转移至转化模块(诸如试剂筒310中的流通式电穿孔装置330),从试剂筒中的另一个储器中移取包含带有表达盒的载体的核酸溶液,将核酸溶液转移至转化模块,启动转化过程持续指定的时间,然后将转化的细胞移至试剂筒(reagent cassette)中的又另一个储器或移至又另一个模块,诸如自动化多模块细胞处理仪器中的细胞生长模块。在另一种实例中,试剂筒可包括脚本,以便将来自试剂筒中的储器的包含载体的核酸溶液、试剂筒中的储器中的包含编辑寡核苷酸盒的核酸溶液、以及来自另一储器的核酸组装混合物转移至核酸组装/脱盐模块(图3A的314)。脚本还可以指定由自动化多模块细胞处理仪器中的其他模块执行的处理步骤。例如,脚本可以指定将核酸组装/脱盐储器加热至50℃持续30min以生成组装产物;并经由基于磁珠的核酸纯化(包括一系列磁珠、乙醇洗涤和缓冲液的移液转移和混合)将组装产物脱盐和重悬。
如以下关于图3C和图3D描述的,用于自动化多模块细胞处理仪器中的示例性试剂筒310可以包括一个或更多个电穿孔装置330,优选流通式电穿孔装置。电穿孔是用于细胞膜透化的广泛使用的方法,该方法通过用电刺激在细胞膜中暂时产生孔而起作用。电穿孔的应用包括将DNA、RNA、siRNA、肽、蛋白、抗体、药物或其他物质递送至各种细胞,诸如哺乳动物细胞(包括人类细胞)、植物细胞、古细菌细胞、酵母细胞、其他真核细胞、细菌以及其他细胞类型。电刺激还可以用于杂交瘤或其他融合细胞的产生中的细胞融合。在典型的电穿孔程序中,将细胞悬浮在有利于细胞存活的缓冲液或介质中。对于细菌细胞电穿孔,通常使用低电导率介质,诸如水、甘油溶液等,以减少瞬时大电流产生的热量。
在典型的电穿孔装置中,将细胞和待电穿孔进入细胞的材料(统称为“细胞样品”)放置在嵌有两个用于放电的扁平电极的杯(cuvette)中。例如,Bio-Rad(Hercules,Calif.)生产用于在杯中对细胞进行电穿孔的GENE PULSER XCELL
图3C和图3D分别为示例性流通式电穿孔装置350的顶部透视图和底部透视图,该流通式电穿孔装置350可以为图3B中的试剂筒300的一部分或可以包含在单独的模块(例如,转化/转染模块)中。图3C描绘了流通式电穿孔单元350。流通式电穿孔单元350具有限定细胞样品入口352和细胞样品出口354的孔。图3D为图3C的流通式电穿孔装置350的底部透视图。在该视图中可见入口孔352和出口孔354。在图3D中还可见对应于孔352的入口362的底部,对应于出口孔354的出口364的底部,限定的流动通道366的底部以及在流动通道366的任一侧上的两个电极368的底部。另外,流通式电穿孔装置可包括推-吸式气动装置,以允许多次通过式(multi-pass)电穿孔程序;也就是说,可以将待进行电穿孔的细胞从入口“吸”向出口以进行一次通过式电穿孔,然后从流通式电穿孔装置的出口端“推”向入口端以再次在电极之间通过以进行另一次通过式电穿孔。此过程可以重复一次至许多次。关于可用于自动化多模块细胞处理仪器的流通式电穿孔装置的细节,参见2018年9月28日提交的USSN 16/147,120;2018年9月28日提交的USSN 16/147,353;2018年9月30日提交的USSN16/147,865;以及2018年9月30日提交的16/147,871,所有这些通过引用以其整体并入本文。此外,试剂筒的其他实施方案可以提供或容纳不是配置为流通式装置的电穿孔装置,诸如在2018年8月22日提交的USSN 16/109,156中描述的电穿孔装置。
图3E描绘了可与细胞生长模块一起使用的生长瓶的一种实施方案,该细胞生长模块为诸如图3A中示出的自动化多模块细胞处理仪器或系统的一部分。在一种实施方案中,生长瓶不断地测量正在生长的细胞培养物的光密度。细胞生长模块的一个优点在于可以连续测量光密度(动态监测)或以特定的时间间隔(例如,每5秒、10秒、15秒、20秒、30秒、45秒或60秒,或每1分钟、2分钟、3分钟、4分钟、5分钟、6分钟、7分钟、8分钟、9分钟或10分钟等)测量光密度。可选地,可以在细胞生长周期的早期以特定的时间间隔测量OD,并且在细胞培养物的OD达到设定点OD之后连续地测量OD。细胞生长模块由处理器控制,可以对处理器进行编程以不断地或按用户定义的间隔测量OD。例如,试剂筒上的脚本也可以指定读取OD的频率,以及目标OD和目标时间。另外,用户可以手动设置用户期望细胞培养物达到目标OD的目标时间。为了在目标时间达到目标OD,处理器测量正在生长的细胞的OD,实时计算细胞生长速率,并预测将达到目标OD的时间。然后,处理器根据需要自动调节细胞生长瓶(和细胞培养物)的温度。较低的温度减慢生长,而较高的温度增加生长。
在图3E中描绘的生长瓶实施方案中,生长瓶370为透明容器,其具有用于接收液体培养基和细胞的开口端374,限定用于使细胞生长的主容器的中央瓶区域376,限定至少一个光路380的锥形至收缩区域388,封闭端386和驱动接合机构382。生长瓶具有瓶绕其旋转的中心纵轴390,并且光路380通常垂直于瓶的纵轴。第一光路380位于锥形至收缩区域388的下部收缩部分中。任选地,生长瓶370的一些实施方案在锥形至收缩区域388的锥形区域中具有第二光路378。在该实施方案中,两个光路都位于生长瓶的始终填充有细胞培养物(细胞+生长培养基)的区域中,并且不受生长瓶的旋转速度影响。第一光路380比第二光路378短,从而允许当瓶中的细胞培养物的OD值处于高水平时(例如,在细胞生长过程的后期)对OD值进行灵敏测量,而第二光路378允许当瓶中的细胞培养物的OD值处于较低水平时(例如,在细胞生长过程的早期)对OD值进行灵敏测量。驱动接合机构382与马达(未示出)接合以使瓶旋转。旋转生长瓶的体积可以是5mL至250mL,或10mL至200mL,或15mL至150mL或20mL至100mL。对于转录前细胞的初始生长,旋转生长瓶的体积通常较低,例如5mL至50mL,而对于生长和诱导编辑,旋转生长瓶的体积通常较高,例如50mL至250mL。
生长瓶370可以是可重复使用的,或者优选地,像试剂筒一样,生长瓶为消耗品。在一些实施方案中,旋转生长瓶为消耗品,并且预填充有生长培养基提供给用户,其中瓶在开口端374处用箔密封件密封。
旋转生长瓶可用于在转化之前使细胞生长,但也可用于批量培养物生长和诱导编辑,因为旋转生长瓶提供了细胞生长、细胞生长监测、诱导编辑所需的工具,并由可以添加培养基或诱导因子的液体处理系统提供服务。可选地,可以在烧瓶或其他容器(包括试管,微管或12孔板、24孔板、96孔板和128孔板中的孔)中进行批量培养物生长和诱导编辑。培养物的体积范围可以为200μL至250mL。
图3A的示例性自动化多模块细胞处理仪器300还包括任选的核酸组装模块。核酸组装模块314被配置为执行例如等温核酸组装。等温核酸组装在单个等温反应中连接多于一种DNA片段(诸如单一个体编辑盒或多于一种个体编辑盒和载体骨架),从而需要少的组分和过程操纵。例如,等温核酸组装可以基于序列同一性同时组合多达20种或更多种核酸片段(诸如个体编辑盒)。该组装方法要求待组装的核酸与相邻核酸片段包含至少15个碱基的重叠。将这些片段与三种酶(一种外切核酸酶、一种聚合酶和一种连接酶)以及缓冲液组分的混合物混合。因为该过程为等温的,并且可以使用单个反应容器以1步法或2步法进行,所以等温核酸组装方法适用于自动化多模块细胞处理仪器。1步法允许使用一步恒温过程组装多达五种不同的片段。将片段和酶的主混合物合并,并在50℃孵育长达一小时。为了创建更复杂的构建体或为了掺入100bp至多达10kb的片段,通常使用2步法,其中2步反应需要两次分别添加主混合物;一次用于外切核酸酶和退火步骤,并且第二次用于聚合酶和连接步骤。
在图3A的示例性自动化多模块细胞处理仪器300的一种实施方案中,载体骨架、待插入载体中的两种或更多种个体编辑盒以及核酸组装混合物的等分试样可以从布置在试剂筒310内的十六个试剂储器312中的三个储器中取出。将载体、编辑盒和反应混合物在位于核酸组装模块中的管接受器(未示出)中的反应室或管中合并,并将模块加热至50℃。在发生核酸组装反应之后,可以从布置在试剂筒310内的一个试剂储器312中取出磁珠,并添加到核酸模块314的反应室中的核酸组装混合物中。如在图3A中可见,磁体316(诸如螺线管磁体)与核酸组装模块314相邻或邻近。在将磁珠添加到核酸组装反应物中后,核酸产物结合磁珠,并且在一定时间段的孵育之后,磁体316被接合,从而在反应室中分离与核酸结合的磁珠。核酸组装模块314中的反应溶液(上清液)可以通过空气置换移液器332去除,并且洗涤溶液和/或乙醇可以从试剂筒310中的试剂储器312或从洗涤盒304中的洗涤溶液储器306中移取,并且用于洗涤与珠结合的核酸。在洗涤珠和结合的核酸时,可以使磁体脱离,然后使磁体重新接合以从核酸组装模块中除去洗涤溶液。可选地,在洗涤珠和结合的核酸时,磁体可以不脱离。然后可以将脱盐的组装的载体+编辑盒移至例如关于图3B至图3D描述的流通式电穿孔装置(转化/转染模块)。
图3F为细胞生长装置3330的一种实施方案的透视图。图3G描绘了图3F的细胞生长装置3330的剖视图。在两个图中均可见旋转生长瓶370位于主壳体3336内,旋转生长瓶370的延伸唇缘372在主壳体3336上方延伸。另外,在两个图中都示出了端部壳体3352、下部壳体3332和凸缘3334。凸缘3334用于将细胞生长装置3330附接到加热/冷却装置或其他结构(未示出)。图3G描绘了附加细节。在图3G中,示出了位于主壳体3336内的上承座3342和下承座3340。上承座3342和下承座3340支撑旋转生长瓶3300的竖直负载。下部壳体3332包含驱动马达3338。图3G的细胞生长装置3330包括两个光路:主光路3344和次级光路3350。光路3344对应于位于旋转生长瓶370的锥形至收缩部分的收缩部分中的光路3310,并且光路3350对应于位于旋转生长的锥形至收缩部分的锥形部分中的光路3308。在图3G中未示出光路3310和3308,但在图3F中可以看到。除了光路3344和3350外,还有发射板3348,用于照亮光路,还有检测器板3346,用于在光穿过旋转生长瓶370中的细胞培养液后检测光。
马达3338与驱动机构3312接合,并且用于使旋转生长瓶3300旋转。在一些实施方案中,马达3338为具有内置驱动控制器的无刷DC型驱动马达,该驱动控制器可被设置为保持0和约3000RPM之间的恒定的每分钟转数(RPM)。可选地,可以使用其他马达类型,诸如步进马达,伺服马达,有刷DC马达等。任选地,马达3338还可以具有方向控制器以允许反转旋转方向,以及具有转速表以感测并报告实际RPM。马达由处理器(未示出)根据例如编程到处理器和/或用户输入中的标准方案来控制,并且马达可以被配置为改变RPM以引起细胞培养物的轴向进动(axial precession),从而增强混合,例如,以便防止细胞聚集、增加通气并优化细胞呼吸。
细胞生长装置3330的主壳体3336、端部壳体3352和下部壳体3332可以由任何合适的、坚固的材料(包括铝、不锈钢和其他导热材料,包括塑料)制成。这些结构或其部分可以通过各种技术,例如金属制造、注塑成型、融合的结构层的构建等来形成。尽管在一些实施方案中旋转生长管形瓶370被设想为可以重复使用,但优选为消耗品,细胞生长装置3330的其他部件优选地是可重复使用的,并且用作独立台式装置或用作多模块细胞处理系统中的模块。
细胞生长装置3330的处理器(未示出)可以用待用作生长细胞培养物的“空白(blank)”或对照的信息进行编程。“空白”或对照为仅包含细胞生长培养基的容器,其产生100%的透射率和0的OD,而细胞样品将使光线偏转,并且将具有较低的透射率百分比和较高的OD。随着细胞在培养基中生长并变得更致密,透射率将降低,而OD将增加。可以对细胞生长装置3330的处理器(未示出)进行编程以使用与通常用于细胞培养(例如,哺乳动物细胞,细菌细胞,动物细胞,酵母细胞等)的生长培养基相对应的空白的波长值。可选地,第二分光光度计和容器可以被包括在细胞生长装置3330中,其中第二分光光度计用于以指定的间隔读取空白。
图3H示出了作为组件的一部分的细胞生长装置3330,该组件包括联接至光源3390、检测器3392和热部件3394的图3F的细胞生长装置3330。旋转生长瓶370被插入到细胞生长装置中。光源3390和检测器3392的部件(例如,诸如具有增益控制以覆盖5-log的光电二极管)联接至细胞生长装置的主壳体。示出了容纳使旋转生长瓶370旋转的马达的下部壳体3332,以及将细胞生长装置3330固定至组件的凸缘3334中的一个。此外,所示的热部件3394为珀耳帖装置或热电冷却器。在该实施方案中,通过将细胞生长装置3330经由下部壳体3332的基部上的凸缘3334附接并电集成至热部件3394来实现热控制。热电冷却器能够将热量“泵送”到接合处的任一侧,以根据电流流动的方向冷却表面或加热表面。在一种实施方案中,使用热敏电阻来测量主壳体的温度,并且然后通过标准的电子比例-积分-微分(PID)控制器回路,将旋转生长瓶370控制在约+/-0.5℃。
在使用中,通过刺穿箔密封件或膜,将细胞接种(例如,可以从自动化液体处理系统或由用户移取细胞)到旋转生长瓶370的预填充的生长培养基中。细胞生长装置3330的编程软件设置用于生长的控制温度,通常为30℃,然后缓慢地使旋转生长瓶370开始旋转。细胞/生长培养基混合物由于离心力而缓慢地沿壁竖直向上移动,从而允许旋转生长瓶370将混合物的大的表面积暴露于正常的氧气环境。生长监测系统以预设或预编程的时间间隔连续读取OD或OD测量值。这些测量值存储在内部存储器中,并且如果需要,软件绘制测量值与时间的图以展示生长曲线。如果需要增强混合,例如为了优化生长条件,则可以改变瓶旋转的速度以引起液体的轴向进动,和/或可以以编程的间隔进行完全的方向改变。可以对生长监测进行编程,以便在预定的OD自动终止生长阶段,并且然后将混合物快速冷却至较低的温度以抑制进一步的生长。
细胞生长装置3330的一种应用是不断地测量正在生长的细胞培养物的光密度。细胞生长装置的一个优点在于可以连续测量光密度(动态监测)或以特定的时间间隔(例如,每5秒、10秒、15秒、20秒、30秒、45秒或60秒,或每1分钟、2分钟、3分钟、4分钟、5分钟、6分钟、7分钟、8分钟、9分钟或10分钟)测量光密度。尽管已经在测量正在生长的细胞培养物的光密度(OD)的背景下描述了细胞生长装置3330,但是,鉴于本说明书的教导,技术人员应该理解,除了或代替细胞培养物OD之外,可以测量其他细胞生长参数。与上文描述的关于实体壁装置或模块的细胞生长的任选测量一样,使用可见光、UV或近红外(NIR)光的光谱法允许监测细胞培养物中营养物和/或废产物的浓度并且可以进行其他光谱学测量;也就是说,可以经由例如介电阻抗谱、可见荧光、荧光偏振或发光来测量其他光谱特性。另外,细胞生长装置3330可以包括用于测量例如溶解氧、二氧化碳、pH、电导率等的其他传感器。以下美国专利文献描述了旋转生长瓶和细胞生长组件:2019年3月21日提交的16/360,404;以及2019年3月21日提交的16/360,423。
图3I为在下文描述的TFF模块中使用的切向流过滤的模型。TFF装置为自动化多模块细胞处理仪器中的部分模块。在细胞生长模块中生长后,使用TFF来浓缩细胞并使细胞成为电感受态。待被浓缩的细胞可以是装载到旋转生长瓶中用于第一轮编辑的细胞,或者细胞可以是经过一轮编辑、从液体培养基中回收、浓缩、并且在旋转生长瓶中重新生长以便进行转化和准备用于第二轮编辑的细胞。设计所述的TFF装置考虑了两个主要的设计注意事项。首先,TFF装置的几何形状导致在大的表面积上过滤细胞培养物,从而使处理时间最小化。其次,TFF装置的设计被配置为使过滤器结垢(fouling)最小化。图3I为切向流过滤的一般模型30。TFF装置使用切向流过滤(也称为交叉流过滤)进行操作。图3I示出了在膜34上流动的细胞,其中在培养基或缓冲液中的细胞32的进料流平行于膜34。TFF与死端过滤(dead-end filtration)不同,死端过滤中进料流和压力下降均垂直于膜或过滤器。
图3J-3P描绘了切向流过滤(TFF)装置/模块的实施方案。图3J描绘了截留物构件(retentate member)3022(在左侧)、膜或过滤器3024(中间)和渗透物构件3020(在右侧)的构造。在图3J中,截留物构件3022包括切向流动通道3002,切向流动通道3002具有蛇形构型,该蛇形构型起始于截留物构件3022的一个下角处(具体地在截留物端口3028处),穿越并向上然后向下并穿越截留物构件3022,终止于截留物构件3022的另一个下角的第二截留物端口3028处。在截留物构件3022上还可见能量导向器3091,能量导向器3091围绕膜或过滤器3024所在的区域。在该实施方案中,能量导向器3091经由渗透物构件3020上的能量导向器部件与截留物构件3022和渗透物构件3020配合,并用于促进截留物构件3022与渗透物构件3020的超声焊接或粘合。膜或过滤器3024具有用于截留物端口3028的通孔,并且被配置为位于截留物构件3022和渗透物构件3020之间的能量导向器3091的围绕内。除了能量导向器3091之外,渗透物构件3020还包括在每个底角处的用于截留物端口3028的通孔(每个底角与膜3024的底角处的用于截留物端口3028的通孔和在截留物构件3022中的截留物端口3028相配合)以及位于渗透物构件3020顶部和中心的切向流动通道3002和单个渗透物端口3026。尽管可以使用其他几何形状,但是该实施方案中的切向流动通道3002结构具有蛇形构型和波状起伏的几何形状。在一些方面,切向流动通道的长度为10mm至1000mm,60mm至200mm或80mm至100mm。在一些方面,通道结构的宽度为10mm至120mm,40mm至70mm或50mm至60mm。在一些方面,切向流动通道3002的横截面为矩形。在一些方面,切向流动通道3002的横截面的宽度为5μm至1000μm且高度为5μm至1000μm,宽度为300μm至700μm且高度为300μm至700μm,或宽度为400μm至600μm且高度为400μm至600μm。在其他方面,切向流动通道3002的横截面为圆形、椭圆形、梯形或长方形,并且水力半径为100μm至1000μm,水力半径为300μm至700μm,或水力半径为400mm至600μm。
图3K为储器组件3050的侧面透视图。储器组件3050包括在单个渗透物储器3054的任一侧上的截留物储器3052。在细胞浓缩过程中,当细胞转移通过TFF装置或模块并进入截留物储器时,截留物储器3052用于容纳细胞和培养基。渗透物储器3054用于收集细胞浓缩过程中从细胞培养物中去除的滤液流体或细胞生长过程中的旧缓冲液或培养基。在图3J-3P中描绘的实施方案中,缓冲液或培养基从与装置模块分开的试剂储器供应到渗透物构件。另外在图3K中可见用于容纳气动端口(未示出)的凹槽3032、渗透物端口3026和截留物端口通孔3028。截留物储器流体地联接至截留物端口3028,截留物端口3028继而流体地联接至布置在截留物构件中的切向流动通道的部分(未示出)。渗透物储器流体地联接至渗透物端口3026,渗透物端口3026继而流体地联接至布置在渗透物构件中的切向流动通道的部分(未示出),其中切向流动通道的部分被膜分为两部分(未示出)。在包括本实施方案的实施方案中,可以生长和/或过滤多达120mL的细胞培养物,或者可以生长和/或浓缩多达100mL、90mL、80mL、70mL、60mL、50mL、40mL、30mL或20mL的细胞培养物。
图3L描绘了图3K中所示的储器组件3050的俯视图,图3M描绘了图3K中所示的储器组件3050的盖3044,并且图3N描绘了图3K中所示的在操作中布置在储器组件3050的盖3044上的垫圈3045。图3L为储器组件3050的俯视图,示出了两个截留物储器3052,在渗透物储器3054的两侧各有一个。还可见将与气动端口(未示出)配合的凹槽3032,以及位于截留物储器3052底部的流体通道3034,流体通道3034经由渗透物构件3220和膜3024中用于截留物端口的通孔(也未示出)将截留物储器3052与截留物端口3028(未示出)流体地联接。图3M描绘了盖3044,盖3044被配置为布置在储器组件3050的顶部上。盖3044在截留物储器3052和渗透物储器3054的顶部处具有圆形开孔(cut-out)。同样,在截留物储器3052的底部可见流体通道3034,其中流体通道3034将截留物储器3052与截留物端口3028(未示出)流体地联接。还示出了各截留物储器3052和渗透物储器3054的三个气动端口3030。图3N描绘了垫圈3045,该垫圈3045被配置为布置在储器组件3050的盖3044上。可见各截留物储器3052和渗透物储器3054的三个流体转移端口3042。同样,示出了各截留物储器3052和渗透物储器3054的三个气动端口3030。
图3O描绘了TFF模块3000的分解图。可见部件储器组件3050,待布置在储器组件3050上的盖3044,待布置在盖3044上的垫圈3045,截留物构件3022,膜或过滤器3024和渗透物构件3020。还可见渗透物端口3026,其与渗透物储器3054上的渗透物端口3026配合;以及两个截留物端口3028,其与截留物储器3052上的截留物端口3028配合(其中在此图3O中仅可清楚看到一个截留物储器3052)。还可见膜3024和渗透物构件3020中的截留物端口3028的通孔。
图3P描绘了组装的TFF模块3000的一种实施方案。截留物构件3022、膜构件3024和渗透物构件3020与储器组件3050并排(side-to-side)联接。可见两个截留物端口3028(其将截留物构件3022中的切向流动通道3002联接至两个截留物储器(未示出))以及一个渗透物端口3026(其将渗透物/滤液构件3020中的切向流动通道3002联接至渗透物储器(未示出)。还可见切向流动通道3002,其由截留物构件3022和渗透物构件3020的配合形成,其中膜3024被夹在截留物构件3022和渗透物构件3020之间并将切向流动通道3002分成两部分。还可见能量导向器3091,在该图3L中,能量导向器3091已被用于超声焊接或联接围绕膜3024的截留物构件3022和渗透物构件3020。可以在储器组件3050的顶部看到盖3044,并且垫圈3045布置在盖3044上。垫圈3045分别与流体转移端口3042和气动端口3030接合并分别提供与流体转移端口3042和气动端口3030的流体密封和气动连接。图3P还示出了TFF模块3000的长度、高度和宽度尺寸。组装的TFF装置3000典型地高度为50mm至175mm,或高度为75mm至150mm,或高度为90mm至120mm;长度为50mm至175mm,或长度为75mm至150mm,或长度为90mm至120mm;并且深度为30mm至90mm,或深度为40mm至75mm,或深度为50mm至60mm。示例性的TFF装置的高度为110mm,长度为120mm,并且深度为55mm。有关TFF的另外的信息和替代实施方案,参见例如2018年9月7日提交的USSN62/728,365;2019年6月5日提交的62/857,599;以及2019年6月27日提交的62/867,415。
图4为使用图3A的自动化多模块细胞处理仪器的方法400的一种实施方案的框图。在第一步,将细胞从试剂筒310转移401至生长瓶318(请参考图3A关于元件编号300)。孵育细胞402,例如,直到细胞生长至期望的OD 403。然后将细胞转移404至细胞浓缩模块322,以进行培养基或缓冲液交换,并经由培养基/缓冲液交换使细胞成为感受态(例如,电感受态),同时也将细胞样品的体积减小到适于电穿孔的体积,以及从细胞样品中去除不需要的组分,例如盐。在使细胞成为感受态并悬浮在适于转化的体积中405后,将细胞样品转移412至试剂筒310中的流通式电穿孔装置330(转化模块)。
在对细胞进行电穿孔处理时,提供一种或更多种编辑载体411,将组装的编辑载体转移412至试剂筒310中的电穿孔装置330。组装的载体(载体文库)和细胞由此在流通式电穿孔装置330中组合,并且流通式电穿孔装置被接合413。
在电穿孔后,任选地将转化的细胞转移到液体培养基中以从转化处理恢复并进行选择。允许细胞生长,直到它们达到静止期(或直到细胞几乎达到静止期)422,并且在此点诱导编辑425。编辑完成(例如,~1-3小时)后,可以对细胞进行测序、测定或用于研究424,或者可以重复步骤401-405、411-413和422以用于另一轮编辑426。
图5为用于诱导编辑和富集经编辑的细胞的包括批量液体生长模块的示例性自动化多模块细胞处理仪器的实施方案的简化框图。细胞处理仪器500可包括壳体544,待转化或转染的细胞的储器502,以及生长模块(细胞生长装置)504。将待转化的细胞从储器转移至生长模块以进行培养,直到细胞达到目标OD。细胞达到目标OD后,生长模块可以冷却或冷冻细胞以用于以后的处理,或者可以将细胞转移至过滤或浓缩模块530,在过滤模块530中使细胞成为电感受态并浓缩至最适于细胞转化的体积。浓缩后,将细胞然后转移至电穿孔装置508(例如,转化/转染模块)。
除了用于储存细胞的储器之外,系统500可以包括用于储存编辑盒的储器516和用于储存表达载体骨架的储器518。将编辑寡核苷酸盒和表达载体骨架两者从试剂筒转移至核酸组装模块520中,其中编辑寡核苷酸盒被插入表达载体骨架中。可以将组装的核酸转移至任选的纯化模块522,以进行所需的脱盐和/或其他纯化和/或浓缩程序,以准备组装的核酸用于转化。可选地,可以将预组装的核酸,例如编辑载体,储存在储器516或储器518中。由纯化模块522执行的处理完成后,将组装的核酸转移至例如电穿孔装置508,该电穿孔装置508已经包含生长至目标OD并经由过滤模块530成为电感受态的细胞培养物。在电穿孔装置508中,将组装的核酸引入细胞中。电穿孔后,将细胞转移至组合的恢复/选择模块510。
在恢复和任选地选择后,将细胞转移至生长、诱导和编辑模块(批量液体培养物)540。允许细胞生长直至细胞达到生长静止期(或几乎达到生长静止期),然后通过诱导核酸酶和gRNA中的一种或两者的转录来诱导编辑。在一些实施方案中,通过在诱导型启动子的控制下的核酸酶和gRNA中的一种或两者的转录来诱导编辑。在一些实施方案中,诱导型启动子为pL启动子,其中该启动子通过温度升高而活化,并且通过温度降低而“失活”。
恢复模块、选择模块、生长模块、诱导模块、编辑模块和存储模块全都可以是分开的,可以如图5所示进行布置和组合,或者可以按其他配置进行布置或组合。在某些实施方案中,恢复和选择在一个模块中执行,而生长、编辑和重新生长在分开的模块中执行。可选地,恢复、选择、生长、编辑和重新生长可以在单一模块中执行。
在细胞被编辑并重新生长(例如,从编辑恢复)后,可以将细胞储存在例如储存模块512中,在储存模块512中,可以将细胞保持在例如4℃直至取出细胞用于进一步研究。可选地,这些细胞可以用于另一轮编辑。多模块细胞处理仪器受处理器542控制,处理器542被配置为基于用户输入(如由一个或更多个脚本所指示,或者作为用户输入或脚本的组合)来运行仪器。处理器542可以控制系统500的各个模块的时机、持续时间、温度和运行以及试剂的分配。例如,处理器542可以在转化后冷却细胞,直到需要编辑为止,这时可以将温度升高到有利于基因组编辑和细胞生长的温度。可以用标准方案参数(用户可以从其中进行选择)对处理器进行编程,用户可以手动指定一个或更多个参数,或者与试剂筒关联的一个或更多个脚本可以指定一个或更多个运行和/或反应参数。另外,处理器可以通知用户(例如,经由到智能电话或其他装置的应用程序)细胞已经达到目标OD,以及向用户更新关于多模块系统中的各个模块中的细胞的进展。
自动化多模块细胞处理仪器500为核酸酶引导的基因组编辑系统,并且可以用于单个编辑系统,其中例如经由多重编辑盒使用单个编辑过程将对细胞基因组的两种或更多种编辑引入。该系统可以被配置为执行顺序编辑和/或递归编辑,顺序编辑例如,顺序地使用不同的核酸酶引导的系统,以在两轮或更多轮编辑的每轮编辑中在细胞中提供两种或更多种基因组编辑;递归编辑例如,利用单一核酸酶引导的系统,以在两轮或更多轮编辑的每轮编辑中将两种或更多种基因组编辑顺序地引入细胞中。
鉴于本公开内容,对于本领域的普通技术人员应该明显的是,所描述的过程可以为递归和多重化的;也就是说,细胞可以经历关于图5所描述的工作流程,然后所得到的经编辑的培养物可以经历用不同编辑载体进行的另一轮(或若干轮或许多轮)的另外的编辑(例如,递归编辑)。例如,可以稀释来自第一轮编辑的细胞,并且可以将通过编辑载体A编辑的经编辑的细胞的等分试样与编辑载体B组合,可以将通过编辑载体A编辑的经编辑的细胞的等分试样与编辑载体C组合,可以将通过编辑载体A编辑的经编辑的细胞的等分试样与编辑载体D组合,以此类推以进行第二轮编辑。在第二轮之后,可以对每种经双重编辑的细胞的等分试样进行第三轮编辑,其中,例如,将经AB编辑、AC编辑、AD编辑的细胞的每一种的等分试样与另外的编辑载体诸如编辑载体X、Y和Z组合。也就是说,经双重编辑的细胞AB可以与载体X、Y和Z组合并由载体X、Y和Z编辑以产生三重编辑的经编辑的细胞ABX、ABY和ABZ;经双重编辑的细胞AC可以与载体X、Y和Z组合并由载体X、Y和Z编辑以产生经三重编辑的细胞ACX、ACY和ACZ;并且经双重编辑的细胞AD可以与载体X、Y和Z组合并由载体X、Y和Z编辑以产生经三重编辑的细胞ADX、ADY和ADZ,等等。在此过程中,可以执行编辑的许多排列和组合,从而导致非常多样化的细胞群体和细胞文库。
在任何递归过程中,“处理(cure)”先前的引擎载体和编辑载体(或单个载体系统中的单个的引擎+编辑载体)是有利的。“处理”是这样的过程,其中从经转化的细胞中消除先前轮编辑中使用的一个或更多个载体。处理可以通过以下来实现:例如,使用处理质粒来裂解载体从而使编辑载体和/或引擎载体(或单个、组合的载体)无功能化;经由细胞生长来稀释细胞群体中的载体(也就是说,细胞经历的生长周期越多,将保留编辑载体或引擎载体的子细胞就越少),或者通过例如利用编辑载体或引擎载体(或组合的引擎+编辑载体)上的热敏感型复制起点。处理条件将取决于处理所使用的机理;也就是说,在本实例中,处理质粒如何裂解编辑和/或引擎质粒。关于适用于本文描述的方法的处理方法,参见例如2018年6月6日提交的USSN 62/857,967。
实施例
提出以下实施例以便向本领域普通技术人员提供如何进行和使用本发明的完整公开内容和描述,并且不意图限制本发明人认为的其发明的范围,也不意图表示以下实验是所进行的全部或仅有的实验。其他等同的方法、步骤和组合物被意图包括在本发明的范围内。已经尽力确保关于所使用的数字(例如量,温度等)的准确性,但是应该考虑一些实验误差和偏差。除非另有说明,否则部份是按重量计的部份,分子量是重均分子量,温度是摄氏度,并且压力是大气压或接近大气压。
实施例1:编辑盒和骨架扩增和组装
量化后,使用来自SPRI清理的洗脱液的稀释液进行第二扩增程序。PCR在以下条件下进行:在95℃持续1分钟;在95℃持续30秒/在72℃持续2.5分钟进行18轮;最后在72℃持续5分钟。在2%的琼脂糖凝胶上检查扩增子,并鉴定具有最干净的产物的汇集。未使用看起来具有异二聚体或嵌合体的扩增产物。
实施例2:将编辑载体库转化到E
实施例3:用引擎载体转化的新细胞系的创建
实施例4:感受态细胞的制备
将用引擎载体转化的EC1细胞的新鲜过夜生长的培养物的1mL等分试样添加到含有100mL LB/SOB+25μg/mL chlor培养基的250mL瓶中。使细胞生长至0.4-0.7OD,并通过将培养物转移至冰上10分钟来停止细胞生长。将细胞在JA-18转子中以8000x g离心5分钟,用50mL冰冷的ddH
实施例5:批量液体方案:诱导和优势生长
准备含有50mL的SOB+100μg/mL羧苄青霉素和25μg/mL氯霉素的250mL带挡板的摇瓶。对于完整的解卷积实验(deconvolution experiment),每个转化准备3个摇瓶。将来自每个转化反应的500μL未稀释的培养物转移到所准备的250mL摇瓶中。在培养箱上设置以下温度设定:在30℃持续9小时→在42℃持续2小时→在30℃持续9小时。该温度方案用于允许细胞在最初的八小时期间从转化额外恢复。在诱导核酸酶之前1小时诱导λRed系统,其中通过向培养物添加阿拉伯糖(2.5mL的20%阿拉伯糖)来触发λ诱导,并且通过将培养物温度增加至42℃来触发核酸酶诱导。对于完整的解卷积实验,未向摄取(UPTAKE)烧瓶和切割(CUT)烧瓶添加阿拉伯糖,因为它们应不表达λRed;此外,未将摄取烧瓶移至42℃。
温度循环完成(~21小时)后,取出摇瓶。对于NGS-单重:用0.8%NaCl制备每种培养物的10
图6A为示出观察到的各种类型的编辑的柱状图,在液体培养物中使用组成型编辑(观察到约20%的编辑),标准铺板程序(观察到约76%的编辑),在液体批量中诱导编辑的两个重复实验(replica experiment)(观察到约70%和76%的编辑),以及使用标准铺板程序的诱导编辑的两个重复实验(观察到约60%和76%的编辑)。图6B示出了两个编辑克隆形成能力(clonality)的图。标准铺板程序的编辑克隆形成能力(上图)示出96孔的混合型克隆形成能力,其中一些菌落达到100%的克隆形成能力(孔1-21),大多数菌落达到大于50%的克隆形成能力(孔1-56),并且两次重复的平均克隆形成能力为70%和60%。液体批量方案的编辑克隆形成能力显示,大多数细胞被100%编辑或0%编辑(例如,野生型),而少数细胞(约8%)在100%或0%之间。须注意,这些方案的平均编辑效率相似。
实施例6:全自动化单重RGN引导的编辑运行
使用MAD7核酸酶的单重自动化基因组编辑通过本公开内容的自动化多模块仪器成功进行。参见美国专利第9,982,279号。
在包括在自动化仪器中的等温核酸组装模块中经由Gibson
在自动化处理和恢复后,将细胞的等分试样铺在补充有乳糖(作为糖底物)、氯霉素和羧苄青霉素的MacConkey琼脂基底上并且生长直至出现菌落。白色菌落代表经功能编辑的细胞,紫色菌落代表未经编辑的细胞。所有液体转移均由自动化多模块细胞处理仪器的自动化液体处理装置执行。
自动化处理的结果为总计约1.0E
实施例7:全自动化递归编辑运行
使用自动化的多模块细胞处理系统成功实现了递归编辑。在包括在自动化系统中的等温核酸组装模块中经由Gibson
在细胞生长期间,在等温核酸组装模块中制备第二编辑载体。第二编辑载体包含卡那霉素抗性基因,并且编辑盒包含galK Y145*编辑。如果成功,则galK Y145*编辑赋予细胞摄取半乳糖和代谢半乳糖的能力。通过galK Y154*盒产生的编辑在第154位氨基酸残基处引入终止密码子,从而将酪氨酸氨基酸改变为终止密码子。此编辑使得galK基因产物无功能并且抑制细胞,使细胞不能够代谢半乳糖。组装后,在等温核酸组装模块中使用AMPure珠将第二编辑载体产物脱盐,用80%乙醇洗涤,并以缓冲液洗脱。将组装的第二编辑载体和电感受态大肠杆菌细胞(已经用第一编辑载体转化并针对第一编辑载体进行了选择)转移到转化模块中,使用与上文描述相同的参数进行电穿孔。电穿孔后,将细胞转移至恢复模块(另一个生长模块),允许细胞在含有羧苄青霉素的SOC培养基中恢复。恢复后,将细胞保持在4℃直至取出,然后将细胞的等分试样铺在补充有氯霉素和卡那霉素的LB琼脂上。为了量化lacZ编辑和galK编辑,在以下两种培养基类型上生成了复制贴片板(replica patchplate):1)补充有乳糖(作为糖底物)、氯霉素和卡那霉素的MacConkey琼脂基底,和2)补充有半乳糖(作为糖底物)、氯霉素和卡那霉素的MacConkey琼脂基底。所有液体转移均由自动化多模块细胞处理系统的自动化液体处理装置执行。
在该递归编辑实验中,所筛选的菌落中41%具有lacZ编辑和galK编辑两者,其结果与使用“台式”或手动方法获得的双重编辑效率相当。
尽管本发明由许多不同形式的实施方案来满足,如结合本发明的优选实施方案所详细描述的,但是应当理解,本公开内容应被认为是本发明原理的实施例,而无意于将本发明限制在本文图示和描述的具体实施方案。在不脱离本发明的精神的情况下,本领域技术人员可以做出许多变化。本发明的范围将由所附权利要求及其等同物来确定。摘要和标题不应被解释为限制本发明的范围,因为它们的目的是使适当的主管部门以及公众能够快速确定本发明的一般性质。在所附的权利要求中,除非使用术语“装置”,否则根据35 U.S.C.§112,
- 在自动化模块和仪器中对经核酸酶经编辑的序列的改进的检测
- 经由批量细胞培养在自动化模块和仪器中对经核酸酶编辑的序列的改进的检测
