Survivin多点突变体重组蛋白及其应用
文献发布时间:2023-06-19 11:24:21
技术领域
本发明涉及生物药物学领域,更具体地讲,涉及一种高效抗肿瘤Survivin突变体重组蛋白及其应用。
背景技术
Survivin是凋亡抑制蛋白家族的成员之一,具有抑制细胞凋亡、调控细胞有丝分裂和促进肿瘤血管生成的作用。Survivin在正常成人组织中几乎检测不到,而在肿瘤细胞中表达量很高。越来越多的研究发现,survivin在被认为是肿瘤发生的启动细胞的CSCs中的表达量更高,并赋予CSCs更强的抗凋亡以及耐药能力,使得癌症难以治愈。鉴于Survivin在癌细胞和CSCs中的高表达和多重作用,使得靶向Survivin的癌症治疗方法要比靶向单一致癌途径中的分子更具有优势。目前已经开发出许多抑制Survivin功能的策略,包括小分子抑制剂,反义寡核苷酸(ASO),小干扰RNA(siRNA)和Survivin显性负突变。然而,小分子抑制剂,ASO和siRNA可能不适合靶向Survivin,因为它们不能消除已经存在的Survivin蛋白。考虑到易于制备,可直接与细胞内野生型survivin蛋白结合并可在蛋白表达的终末端抑制Survivin生物学功能的优势,Survivin负显性突变体引起了广泛关注。
Survivin负显性突变体是通过突变野生型survivin的功能必需氨基酸为非必须氨基酸所形成的一种非功能性蛋白质。由于其与野生型survivin具有相似的靶点,因此可竞争性抑制野生型survivin的功能。Survivin BIR结构域存在多种蛋白翻译后修饰位点,包括磷酸化位点、泛素化位点以及乙酰化位点,其中磷酸化修饰位点主要集中在BIR结构域,如Thr34和Thr48,磷酸化位点的突变能够破坏Survivin与Caspase的结合,进而释放Caspase的促凋亡功能。泛素化修饰位点同样在BIR结构域(1-88AA)上分布较多,如第23/62/78/79位赖氨酸(Lys)位点,该修饰主要用来调节Survivin与着丝粒的相互作用,促进有丝分裂的完成。乙酰化修饰位点则主要分布在Survivin的α-螺旋区,如第120/121/122/129/130Lys位点,该修饰主要是维持Survivin单体和二聚体形式之间平衡,进而介导Survivin的核输入与核输出。此外,Survivin上的Zn
本发明在T34A的基础上,单独或同时将同样位于Survivin BIR结构域的T48和C84再次突变为Ala,位于Survivin BIR结构域的T48和C84再次突变为Ala,并通过细胞活性检测以及凋亡评价优选一种高效的Survivin突变体蛋白,并推进Survivin负显性突变体在癌症临床治疗上的应用,并为解决癌症治疗中的耐药性问题提供一种有效的方法。
发明内容
本发明的目的在于,提供一种高效抗肿瘤的Survivin多点突变体重组蛋白。
本发明的第二个目的在于,提供高效抗肿瘤的Survivin多点突变体重组蛋白的应用。
为了实现上述目的,本发明提供了一种Survivin多点突变体重组蛋白,所述蛋白通过基因工程制备,N端融合转导肽,将野生型Survivin第34位苏氨酸、第48位苏氨酸和第84位半胱氨酸中的两个或三个氨基酸突变为丙氨酸。
作为一个优选方案,将野生型Survivin第34位苏氨酸和第48位苏氨酸突变为丙氨酸获得TmSm34/48。
作为一个优选方案,将野生型Survivin第34位苏氨酸和第84位半胱氨酸突变为丙氨酸获得TmSm34/84。
作为一个优选方案,将野生型Survivin第34位苏氨酸、第48位苏氨酸和第84位半胱氨酸突变为丙氨酸获得TmSm34/48/84。
作为一个优选方案,所述转导肽的序列为Tyr-Ala-Arg-Lys-Ala-Arg-Arg-Gln-Ala-Arg-Arg(SEQ ID NO:1)。
生物大分子药物在许多疾病的治疗中发挥着重要作用,但由于细胞膜的天然屏障作用,只有高脂溶性或者分子量足够小的药物才可以内化进入细胞,这在一定程度上限制了一些具有治疗价值但没有细胞穿透性的药物的应用。近年来发现一种来源于人类免疫缺陷病毒HIV-1的转录激活因子(trans-activator,TAT),能够有效引导肽段或者蛋白质穿透细胞膜。本发明中优选N端插入一段来自HIV-1TAT的转导肽突变体,TAT的11个氨基酸转导序列是目前为止所发现的TAT蛋白转导结构域最短的序列,其转导能力并不比全长TAT序列转导能力差,其特点是转导速度快,效率高。目前随着蛋白质工程的发展,经人工改造和优化后的9-11个氨基酸组成TAT突变体最小片段,既有高于天然HIV-TAT 10-100倍的介导蛋白质、多肽、基因穿膜的特性,又无细胞毒性,是一个极好的转运载体。有文献报道TAT的模型结构是强两亲性螺旋,若是将TAT穿膜肽47-57位氨基酸中的精氨酸用丙氨酸(TATm:YARKARRQARR)(SEQ ID NO:1)代替,由于丙氨酸在所有氨基酸中具有最高的α-螺旋稳定值,会使得TAT穿膜肽的穿膜效率更强。
为了实现上述第二个目的,本发明提供了一种Survivin多点突变体重组蛋白在制备肿瘤化疗药物增敏剂中的应用。
作为一个优选方案,所述肿瘤为肺癌,所述化疗药物为Adriamycin(ADM)。
在本发明的优选实施例中,当癌干细胞(CSCs)为A549 CSCs时,蛋白增敏的有效剂量为1.05-2.09μM。
本发明提供了一种Survivin多点突变体重组蛋白在制备抗肿瘤药物中的应用,所述肿瘤为过表达Survivin的肿瘤。
作为一个优选方案,所述肿瘤包括但不限于肺癌、肝癌、乳腺癌、胰腺癌和膀胱癌。
目前应用Survivin负显性突变体最常见的方法是腺病毒转染,但是这种方法不仅容易在体内产生免疫原性,而且价格昂贵。因此我们选择在体外利用大肠杆菌表达Survivin突变体蛋白。相较于腺病毒转染,蛋白药物具有更好的生物相容性以及靶向性,且成本较低。通过比较不同Survivin突变体蛋白对肿瘤细胞活性以及凋亡的影响,进而优选更高效的Survivin突变体蛋白,最终促进Survivin负显性突变体在癌症治疗上的临床应用。经过细胞活性检测和凋亡评价优选获得抗癌活性最强的Survivin双点突变体TmSm34/84,并且它能增强癌干细胞(CSCs)对化疗药物的敏感性。说明TmSm34/84蛋白不仅是一种高效抗肿瘤蛋白药物,而且在肿瘤化疗中也可作为一种新型的化疗增敏剂。
本发明的优点在于,本发明获得高效抗肿瘤的Survivin多点突变体重组蛋白,将野生型Survivin第34位苏氨酸、第48位苏氨酸和第84位半胱氨酸中的两个或三个氨基酸突变为丙氨酸,多点突变的抗肿瘤和增敏效果都优于野生型和34位单突变的效果,并且将多点突变体重组蛋白与化疗药物联合使用作用于CSCs,发现多点突变体重组蛋白能有效促进化疗药物的杀伤作用,并有效降低化疗药物的使用量,是一种有效的肿瘤化疗的增敏剂,为解决癌症治疗过程中的耐药性问题提供了新的解决思路和方法。
附图说明
图1为重组质粒的构建及重组蛋白的表达与纯化。其中,A:重组质粒构建示意图。B:重组质粒的菌液PCR电泳图。C:DNA测序图。D:六种蛋白纯化后SDS-PAGE电泳分析。
图2为六种Survivin突变体蛋白对A549细胞的细胞毒性测定。其中,A:六种Survivin突变体蛋白以相同的浓度梯度(0,2.09,4.19,6.28和8.37μM)作用于A549细胞24h后的细胞活力测定。B:六种Survivin突变体蛋白对A549细胞的IC
图3为流式检测六种Survivin突变体蛋白对A549细胞凋亡诱导的能力。六种Survivin突变体蛋白以相同的浓度梯度(0,4.19和8.37μM)作用于A549细胞24h后,利用流式细胞仪检测细胞凋亡。数据表示为Mean±SD(n=3)。与TmSm34/84处理组相比,*P<0.05,**P<0.01和***P<0.001。
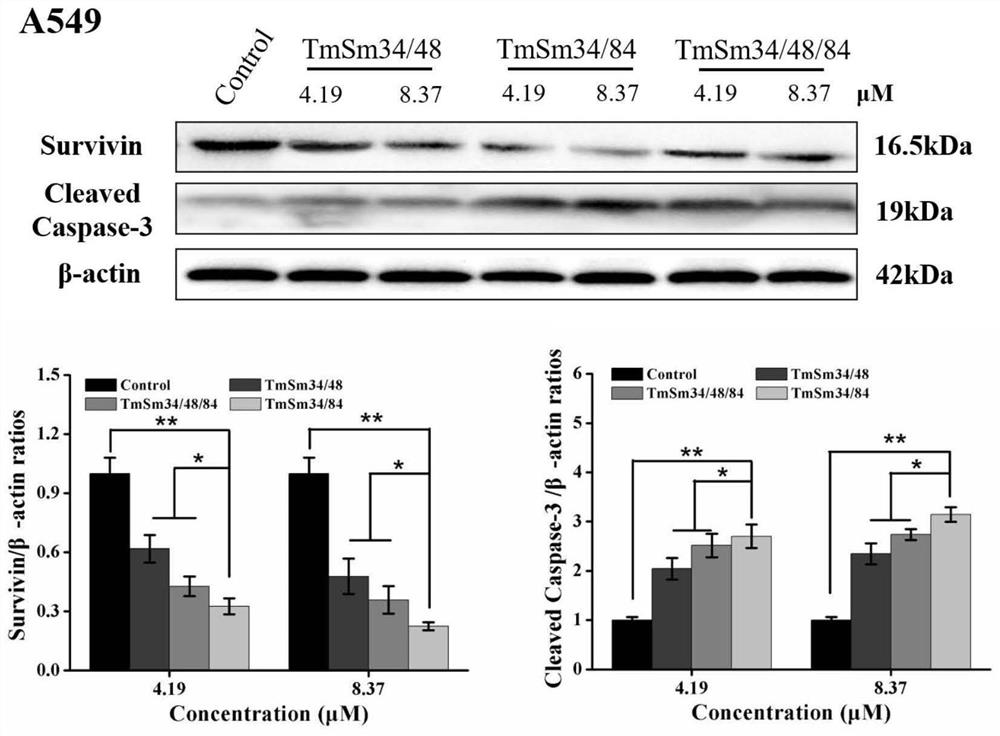
图4为Western blot分析三种多点突变体蛋白对A549细胞中Survivin以及Cleaved Caspase-3含量的影响。三种Survivin突变体蛋白以相同的浓度梯度(0,4.19和8.37μM)作用于A549细胞24h后,利用Western blot检测蛋白含量变化。数据表示为Mean±SD(n=3)。*P<0.05和**P<0.01。
图5为A549 CSCs的富集与“干性”鉴定。其中,A:无血清悬浮培养获得的CSCs的形态学观察。B:免疫荧光和流式检测富集得到的CSCs细胞膜表面CD133的表达。
图6为A549 CSCs体外增殖能力鉴定。A:MTT检测CSCs 7天增殖曲线。B:克隆形成实验检测CSCs的体外增殖能力。数据表示为Mean±SD(n=3)。*P<0.05。
图7为A549 CSCs耐药性检测。A:不同浓度ADM(0,0.2,0.4,0.6,0.8和1.6μM)作用于A549 CSCs 24h后的细胞活力测定。B:Western blot检测A549 CSCs中凋亡相关蛋白和耐药相关蛋白的表达量。数据表示为Mean±SD(n=3)。*P<0.05和**P<0.01。
图8为TmSm34/84以不同的浓度(0,1.05,2.09,4.19,6.28和8.37μM)作用于A549CSCs 24h后的细胞活力测定。数据表示为Mean±SD(n=3)。*P<0.05,**P<0.01和***P<0.001。
图9为ADM单独和TmSm34/84(1.05μM)单独以及二者联合分别作用于A549 CSCs24h后的细胞活力测定。数据表示为Mean±SD(n=3)。*P<0.05。
图10为ADM单独和TmSm34/84(1.05μM)单独以及二者联合分别作用于A549 CSCs24h后,对其细胞形态的影响。
图11为ADM单独和TmSm34/84(1.05μM)单独以及二者联合分别作用于A549 CSCs24h后,对其细胞凋亡的影响。数据表示为Mean±SD(n=3)。**P<0.01和***P<0.001。
图12为ADM单独和TmSm34/84(1.05μM)单独以及二者联合分别作用于A549 CSCs24h后,对其细胞内凋亡相关蛋白以及耐药相关蛋白表达量的影响。数据表示为Mean±SD(n=3)。*P<0.05和**P<0.01。
具体实施方式
下面结合具体实施例,进一步阐述本发明。下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如J.萨姆布鲁克(Joseph Sambrook)等编写的《分子克隆实验指南》中所述的条件,或按照制造厂商所推荐的条件进行实验。
实施例1.重组质粒的构建及重组蛋白的表达纯化
利用实验室已有的pET-24a(+)-TmSm34质粒作为模板,通过重叠延伸PCR的技术分别扩增出TmSm34/48和TmSm34/84基因片段,随后进行酶切和连接,构建了pET-24a(+)-TmSm34/48和pET-24a(+)-TmSm34/84两种重组表达质粒;同理,以pET-24a(+)-TmSm34/48为模板,构建了pET-24a(+)-TmSm34/48/84重组表达质粒。重组质粒构建示意图见图1A。
试剂与试剂盒:Premix Taq DNA polymerase,Pyrobest DNA polymerase,限制内切酶(Ned I、Xho I),蛋白分子量标准品Premixed Protein Marker(Low),蛋白上样缓冲液4×Protein SDS PAGE Loading Buffer,DNA marker购置于宝生物工程有限公司(大连)。异丙基-B-D-硫代吡喃半乳糖苷(IPTG)、卡那霉素购自Sigma-Aldrich公司(美国),Ni-NTA柱购置于GE公司(美国)。其他的生化试剂属于国产常规的分析纯试剂。
菌株和质粒:E.coli DH5α和BL21(DE3)(Invirogen,USA)分别作为质粒克隆和表达菌株,重组质粒pET-24a(+)-TmSm34、pET-24a(+)-TmSm48和pET-24a(+)-TmSm84为本实验室所构建,pET-24a(+)购置Invirogen。
卡那霉素(50μg/mL):称取1g,溶于20mL ddH
异丙基-β-D-硫代吡喃半乳糖苷(IPTG)母液(1mol/L):称量2.38g IPTG溶解于10mL超纯水中,配制成238mg/mL的水溶液,用0.22μm无菌滤膜过滤除菌后,分装1mL/支,-20℃保存,备用。诱导时每1mL LB培养基中加入0.75μL IPTG母液。终浓度为0.75mM。
LB液体培养基:称取胰蛋白胨10g、酵母提取物5g、氯化钠10g,去离子水定容到1L,121℃高压灭菌20min,常温保存。
5×蛋白电泳缓冲液(Tris-甘氨酸):称取Tris碱15.1g,甘氨酸94g,SDS 5g,ddH
15%蛋白电泳分离胶:量取ddH
5%蛋白电泳浓缩胶:量取ddH
考马斯亮蓝染色液:称取考马斯亮蓝(R-250)2g,量取乙醇200mL,冰醋酸100mL,去离子水750mL,室温保存。
PBS缓冲液:8g NaCl,0.2g KCl,0.24g KH
0.2M pH7.0磷酸盐缓冲母液(PB):分别称取43.69g Na
包涵体洗涤液:20mmol/L甘氨酸-氢氧化钠缓冲液,0.5%Triton X-100,0.5mol/L尿素,1mol/L氯化钠,2.5mmol/L EDTA,pH 10.0。
包涵体溶解液:20mmol/L PB,8mol/L尿素,pH 7.0。量取500mL 20mmol/L PB,称取240.24g尿素溶解。通过pH计用NaOH溶液或H
平衡缓冲液:0.2M PB 100mL,4M NaCl 125mL,尿素480.48g,咪唑1.3616g,超纯水定容至1L。
洗脱缓冲液:0.2M PB 100mL,4M NaCl 125mL,尿素480.48g,咪唑27.23g,超纯水定容至1L。
透析液A:0.2M PB 100mL,4M NaCl 125mL,甘油50mL,8M尿素500mL,超纯水定容至1L。
透析液B:0.2M PB 100mL,4M NaCl 125mL,甘油50mL,8M尿素250mL,超纯水定容至1L。
透析液C:0.2M PB 100mL,4M NaCl 125mL,甘油50mL,8M尿素125mL,超纯水定容至1L。
透析液D:0.2M PB 100mL,4M NaCl 125mL,甘油50mL,8M尿素62.5mL,超纯水定容至1L。
Bradford法测蛋白浓度相关溶液:
BSA蛋白标准液(mg/mL):10mg BSA 溶解于10mL无菌水。
Bradford工作液:称取100mg考马斯亮蓝G-250,加入50mL 95%的乙醇,100mL85%的磷酸,去离子水定容至1L,避光保存。
重组质粒的构建
引物设计:
表1.1引物序列
PCR反应体系和反应条件:
表1.2 PCR反应体系
表1.3 PCR反应条件
以实验室已构建的pET-24a(+)-TmSm34为模板,分别扩增上下游两部分具有重叠链的基因产物,随后再以这两部分基因产物作为模板,进行扩增获得TmSm34/48基因产物。同理可获得TmSm34/84基因产物。
利用琼脂糖凝胶电泳分析TmSm34/48与TmSm34/84的基因扩增情况,并通过琼脂糖凝胶DNA回收试剂盒从PCR反应液中纯化DNA。将上述回收所得的目的片段和提取的表达载体进行双酶切,双酶切体系见下表1.4。酶切温度为37℃,酶切时间为3-5h。酶切后,PCR产物的酶切反应液按照上述步骤进行回收。将双酶切回收后的目的基因和表达载体按表1.5的连接体系进行连接。连接温度为16℃,连接时间为10h。
表1.4双酶切体系
表1.5目的基因和载体连接的体系
待连接反应结束后,离心PCR反应管并将离心管置于冰上,进行后续的转化实验。次日,挑取单克隆菌落于5mL的含有卡那的LB液体培养基中培养16h,之后取1mL菌液于无菌的EP管中送上海睿勉生物科技有限公司进行测序。随后重复上述操作,以构建好的pET-24a(+)-TmSm34/48为模板,成功构建pET-24a(+)-TmSm34/48/84质粒(图1B和1C)。
重组蛋白的表达及纯化
蛋白的表达:(1)从-80℃取出甘油菌,划线过夜培养。(2)于5mL无抗LB培养基中接种单克隆,37℃,200rpm过夜培养。(3)将上述菌液以2.5%的接种量接种于含卡那抗性的LB培养基中,37℃,200rpm培养2h,待OD600nm值达到0.6-0.8后,加入150μL IPTG(终浓度为0.75mM),30℃,200rpm诱导表达10h,即可收集菌液。
菌体的破碎及包涵体的洗涤:(1)收集菌液,12000rpm,1min离心收集菌体。(2)PBS洗涤菌体,100mL的菌体用10mL PBS洗涤。(3)PBS重悬菌体,并进行超声破碎,条件为:200W,超5s,停5s,99次,循环三轮。(4)4℃,12000rpm对破碎后的菌体进行20min离心,弃上清,获得粗制包涵体。(5)洗涤粗制包涵体。洗涤条件:400rpm,磁力搅拌15min。(6)对洗涤后的沉淀进行离心,条件为:4℃,12000rpm,15min。弃上清收沉淀,重复步骤5、6两次,得到精制包涵体。(7)8M尿素溶解精制包涵体。冰浴搅拌1h,得到包涵体溶解液。(8)4℃,12000rpm离心上述溶液20min,弃沉淀收上清。(9)利用0.45μm滤膜过滤上清液,过滤后得到的液体可用于后续蛋白的纯化。
AKTA蛋白纯化仪纯化目的蛋白:(1)启动AKTA纯化仪,将A、B两个管道放到装有超纯水的蓝口瓶里,将显示屏参数调节为“set B 100%”,流速设置为10mL/min。点击开始之后,待B管道液体的体积冲到20mL后,将显示屏参数改为“set B 0%”,点击开始之后,待A管道的液体也冲到20mL,管道清洗完毕,即可上镍柱。(2)将镍柱(5mL)装在AKTA纯化仪上,将A管道放到装有平衡缓冲液的蓝口瓶中,将B管道放到装有洗脱缓冲液的蓝口瓶中,调节显示屏参数为“set B 0%”,流速设置为3mL/min,点击开始后,即开始清洗镍柱上的杂质,一直清洗到基线(电导和紫外)平衡。(3)从AKTA纯化仪上卸下镍柱,用注射器吸取蛋白,推掉气泡后,利用注射器将适量的蛋白缓慢推到镍柱里,同时用Bradford溶液测量从镍柱里流穿下来的蛋白,直到流穿下来的蛋白与Bradford溶液反应变蓝后,这说明目前已达到镍柱的最大蛋白承载量,即可停止上样。(4)将上样后的镍柱装到AKTA纯化仪上,调节显示屏参数为“set B0%”,流速设置为3mL/min,开始洗杂,当洗杂峰出现一段时间,基线重新平衡后,调节显示屏参数为梯度洗脱模式“Target B 100%,50mL”,流速设置为3mL/min,等到出峰后即可用EP管接洗脱下来的目的蛋白,以进行后续蛋白电泳鉴定。(5)纯化完成后,将A管道和B管道放到装有超纯水的蓝口瓶里,将显示屏参数设置为“set B 50%”,流速设置为10mL/min,对整个管道进行冲洗,超纯水冲洗完成后,将A管道和B管道放到装有20%乙醇的蓝口瓶里,对整个管道进行冲洗,使乙醇充满整个管路,镍柱同样也用20%乙醇保存。(6)从AKTA纯化仪上卸下镍柱,放于4℃保存,同时关上AKTA纯化仪的电源。
包涵体复性:(1)透析袋预处理。将新购透析袋置于透析袋处理液A中煮沸10min,超纯水冲洗后,置于透析袋处理液B中煮沸10min,超纯水冲洗后置于20%乙醇溶液,4℃保存。(2)将待透析的蛋白稀释到0.4-0.6mg/mL,并加入到超纯水冲洗干净的透析袋中,随后将透析袋放入透析液A中(蛋白体积和透析液体积比为1:10)透析6h。(3)6h后,取出透析袋放置于透析液B中,按此依次透析到透析液D。每次透析时间都为6h,以上操作均在冰浴或4℃条件下搅拌进行。(4)透析完成后,4℃,12000rpm离心透析袋中的液体20min。(5)上清液通过超滤管(3kDa)进行蛋白浓缩,Bradford测定蛋白浓度并置于-80℃保存。
SDS-PAGE电泳检测蛋白的表达:(1)超纯水清洗玻璃板,晾干。(2)按顺序组装好制胶器,并加水验漏。(3)配制分离胶。按照下表进行配制,混匀后注入制胶器中。(4)分离胶注入制胶器后,注入无水乙醇对其进行液封。等待30min,分离胶凝好后,倒掉无水乙醇,并用吸水纸吸去多余的乙醇。(5)按表2.17配制浓缩胶,搅拌均匀后缓慢注入制胶器,并缓慢插入梳子,注意不要产生气泡。(6)室温等待30min,蛋白胶凝固,即可加入电泳缓冲液。(7)垂直缓慢拔掉电泳梳,用针头拨正变形的加样孔。(8)将4×SDS-PAGE loading buffer以合适的比例与蛋白样品混匀后,沸水煮10min,随后用低速离心机混匀样品,将其缓慢加到加样孔中。(9)80V电泳至样品进入分离胶后,更换电压为120V。(10)待溴酚蓝即将要跑出分离胶后,蛋白电泳基本完成,可视情况停止电泳。(11)撬开玻璃板后,用水将蛋白胶缓慢冲下。(12)考马斯亮蓝染蛋白胶30min后,将其放入微波炉中高火煮10min,即可置于凝胶成像仪中拍照。如图1D所示,通过镍柱纯化,得到了纯度均在95%以上的TmSm蛋白。
实施例2.Survivin突变体蛋白的优选
试剂与试剂盒:RPMI 1640培养基,胎牛血清,胰酶购自Gibco公司(美国);三抗,二甲基亚砜(DMSO),MTT购自索莱宝(北京);0.2μm PVDF膜购自碧云天(上海);Annexin V-FITC/PI细胞凋亡试剂盒购自Elabscience(上海);anti-Caspase 3单克隆抗体(兔源),anti-Survivin单克隆抗体(兔源),anti-β-actin单克隆抗体(鼠源),羊抗兔/羊抗鼠IgG-HRP二抗购自Proteintech(美国)。其他的生化试剂属于国产常规的分析纯试剂。
细胞株:人肺腺癌细胞A549,培养条件为37℃,5%CO
试剂配制:
RPMI 1640完全培养基:量取RPMI 1640基本培养基89mL,胎牛血清10mL,三抗1mL混合均匀,置于4℃保存。
5mg/mL MTT溶液:称取MTT 250mg,PBS定容至50mL,0.22μm无菌滤膜过滤除菌,-20℃避光保存。
体外活性检测
A549细胞的培养:(1)细胞的复苏:取出冻存细胞,置于37℃温水使细胞快速融化,随后将其加入到含有细胞培养基的培养瓶里,37℃,5%CO
Survivin突变体蛋白抑制A549细胞生长活性实验:(1)取出A549细胞,PBS润洗细胞2次,加入适量胰酶消化2min。(2)吸弃胰酶,加入适量细胞培养基吹打细胞,调节细胞密度为2×10
从图2A可以看出,相较于3种Survivin单点突变体蛋白(TmSm34,TmSm48和TmSm84),3种Survivin多点突变体蛋白(TmSm34/48,TmSm34/84和TmSm34/48/84)抑制A549细胞增殖的能力更强。在蛋白药物浓度为8.37μM时,3种Survivin多点突变体蛋白对A549细胞增殖的抑制率分别达到60.76%,71.06%和62.71%,高于3种Survivin单点突变体蛋白(50.23%,42.45%和47.75%)。利用SPSS软件确定细胞的半数抑制浓度(IC
Annexin V-FITC/PI双染检测细胞凋亡:(1)调节A549细胞密度为2×10
从图3可以看出,6种Survivin突变体蛋白均能以浓度依赖的方式诱导A549细胞的凋亡。其中,3种Survivin多点突变体蛋白诱导A549细胞凋亡的能力强于3种Survivin单点突变体蛋白。在蛋白浓度为8.37μM时,3种Survivin多点突变体蛋白所引起的A549细胞凋亡率分别达到60.30%,73.50%和63.40%,高于3种Survivin单点突变体蛋白(50.60%,37.86%和45.80%)。
Western blot检测凋亡相关蛋白Survivin和Caspase-3含量变化:(1)A549细胞以2×10
从图4可以看到,3种Survivin多点突变体蛋白均能以浓度依赖的方式引起A549细胞中Survivin和Cleaved Caspase-3表达量的变化,说明Survivin突变体蛋白是通过下调A549细胞中Survivin的表达量,引起细胞中Cleaved Caspase-3含量的变化,最终引起了A549细胞的凋亡。综上,我们认为Survivin多点突变体蛋白的抗癌活性优于其单点突变体蛋白。
实施例3.Tm34/84对A549 CSCs的化疗增敏作用
试剂与试剂盒:DMEM/F12培养基,B27购自Gibco公司(美国);表皮生长因子EGF,碱性成纤维生长因子bFGF购自Peprotech(美国);Annexin V-FITC/7-AAD细胞凋亡试剂盒购自Elabscience(上海);FITC标记anti-human CD44、PE标记anti-human CD133、FITC同型对照和PE同型对照购自达科为(上海);anti-P-gp单克隆抗体(兔源),anti-Bcl-2单克隆抗体(兔源)购自Proteintech(美国);其他的生化试剂属于国产常规的分析纯试剂。
试剂配制:
200μg/mL EGF浓缩液:将100μg EGF冻干粉溶解在500μL 0.1%BSA溶液中,配制成200μg/mL浓缩液后,用EP管以每管10μL的容积分装,并于-20℃保存。使用时,在无菌环境下将10μL浓缩液加至100mL CSCs培养基中最终配制成浓度为20ng/mL的EGF溶液。
200μg/mL bFGF浓缩液:将10μg EGF冻干粉溶解在50μL 0.1%BSA溶液中,配制成200μg/mL浓缩液后,用EP管以每管10μL的容积分装,并于-20℃保存。使用时,在无菌环境下将5μL浓缩液加至100mL CSCs培养基中最终配制成浓度为10ng/mL的EGF溶液。
CSCs培养基:量取RPMI 1640基本培养基89mL,胎牛血清10mL,三抗1mL,EGF 10μL,bFGF 5μL混合均匀,置于4℃保存。
A549 CSCs的富集和鉴定
A549 CSCs的富集:(1)取生长状态良好的A549亲本细胞进行胰酶消化,培养基重悬后1000rpm,5min离心,弃上清。(2)加入PBS重悬细胞,再次离心,弃上清,重复此操作一次。(3)加入干细胞培养基重悬细胞沉淀,调整细胞浓度为1×10
从图5A可以看出,随着传代次数的增加,球形细胞的形状趋于规则,细胞碎片及单个细胞数目也逐渐减少,说明CSCs在无血清细胞培养基中得到了富集,可离心收集第三代球形细胞进行后续实验。
A549 CSCs的鉴定:1.免疫荧光和流式细胞仪检测干细胞表面标志物CD133的表达:(1)取第三代A549 CSCs接种于含细胞爬片(经多聚赖氨酸预处理)的共聚焦培养皿中,A549亲本细胞接种于普通共聚焦培养皿中,加入RPMI 1640完全培养基培养约6h。(2)细胞完全贴壁后取出培养皿,PBS漂洗3次。(3)利用4%多聚甲醛对细胞进行固定操作,时间为15min,再次漂洗。(4)3%BSA(TBST溶液稀释)室温封闭1h,加入兔抗人CD133抗体(1:100),4℃静置过夜。(5)吸去一抗工作液后,加入PE-羊抗兔IgG(1:250),室温避光孵育1h。(6)吸弃二抗,TBST漂洗细胞3次后,用Hoechst 33342标记细胞核,15min后TBST漂洗3次,置于共聚焦显微镜下观察。流式细胞仪检测干细胞表面标志物CD133的表达:(1)取第三代悬浮生长的细胞球和状态良好的A549亲本细胞进行消化,至细胞完全分散后,1000rpm,5min离心细胞,弃上清。(2)PBS清洗沉淀2次,加入100μL PBS重悬沉淀并调整细胞浓度为l×10
从图5B可以看出,第三代球形细胞表面发出较强的红色荧光,其细胞表面CD133的表达量为45.10%。
2.MTT和平板克隆形成实验检测A549 CSCs体外增殖能力:(1)取生长状况良好的A549细胞球和亲本细胞进行消化,并调整细胞浓度至2×10
从图6A可以看出,第三代球形细胞的增殖曲线一直位于A549亲本细胞的下方,说明其增殖能力弱于A549亲本细胞。从图6B可以看出,第三代球形细胞形成克隆的能力弱于A549亲本细胞。
3.MTT检测CSCs对ADM的耐药能力:(1)将A549亲本细胞和CSCs于完全培养基中重悬,调整细胞密度为2×10
从图7A可以看出,CSCs对ADM的药敏性曲线一直位于A549亲本细胞上方,这说明CSCs对ADM的敏感性低于A549细胞对ADM的敏感性。利用SPSS软件可以算出:当ADM作用于A549细胞时,IC
4.Western blot检测CSCs中凋亡、耐药相关蛋白的表达:(1)离心收集第三代悬浮生长的细胞球和对数生长期A549亲本细胞。(2)PBS清洗细胞2次,其裂解以及后续Westernblot步骤可参考实施例2“Western blot检测凋亡相关蛋白Survivin和Caspase-3含量变化”。
从图7B可以看出,第三代球形细胞中凋亡相关蛋白Survivin,Bcl-2以及耐药相关蛋白P-gp的表达量相较于A549细胞都有所上调,分别是A549细胞的1.79倍,2.43倍和1.58倍。综上,本研究发现,与A549亲本细胞相比,第三代球形细胞拥有较高的CD133,Survivin,Bcl-2和P-gp表达量,较缓慢的细胞生长速度以及较强的化疗耐药性,说明通过无血清悬浮培养所获得的第三代球形细胞是A549 CSCs。
Tm34/84对A549 CSCs的化疗增敏作用
TmSm34/84对CSCs增殖活性影响的检测:(1)将A549亲本细胞和CSCs于完全培养基中重悬,调整细胞密度为2×10
如图8所示,TmSm34/84能够抑制Survivin高表达的CSCs的增殖活性。其中当TmSm34/84浓度为1.05μM时,CSCs活性降低了7.23%,所以本研究选取1.05μM作为非细胞毒性剂量,研究TmSm34/84对CSCs化疗增敏的作用。非细胞毒性剂量是研究化疗增敏的一个重要指标,其本身并不会抑制细胞活性,但是可改变细胞耐药机制,如影响耐药蛋白的表达和分布,或者影响药物进入细胞的通道,进而协助化疗药物发挥作用。
MTT检测非细胞毒性剂量TmSm34/84对CSCs耐药的影响:(1)将A549亲本细胞和CSCs于完全培养基中重悬,调整细胞密度为2×10
如图9MTT结果所示,当用不同浓度的ADM联合非细胞毒性剂量TmSm34/84作用于CSCs时,CSCs的活性比单独使用ADM时都有所降低。其ADM作用于CSCs的IC
针对图9MTT实验结果,分组如下:对照组,1.05μM TmSm34/84,1.6μM ADM单独处理组以及二者联合处理组。作用于CSCs 24h后,其细胞形态变化如图10所示:与对照组相比,单独1.05μM TmSm34/84对CSCs形态未产生很大的影响,单独1.6μM ADM处理组CSCs形态变得不规则,少量CSCs出现裂解死亡现象,而联合用药组大多数细胞形态发生明显变化,细胞球变得疏松,漂浮的死细胞进一步增多,说明TmSm34/84能增强CSC对ADM的敏感性。
流式检测非细胞毒性剂量TmSm34/84对CSCs耐药的影响:(1)离心收集CSCs,Accutase消化后调整细胞密度至5×10
如图11的流式结果也进一步表面表明非细胞毒性剂量TmSm34/84能够提高CSCs对ADM的敏感性:单独使用1.6μM的ADM时,CSCs凋亡率达到21.81%,而联合非细胞毒性剂量TmSm34/84使用后,CSCs凋亡率达到了42.2%。
Western blot检测非细胞毒性剂量TmSm34/84对CSCs凋亡和耐药相关蛋白表达的影响:(1)离心收集CSCs,并调整细胞密度至5×10
如图12所示,与ADM单独处理组相比,1.05μM TmSm34/84与1.6μM ADM的联合使用,显著下调了CSCs中Survivin、Bcl-2以及P-gp的表达量(P<0.05),并且显著上调促凋亡蛋白Cleaved Caspase-3的表达量(P<0.05),表明非细胞毒性剂量TmSm34/84提高CSCs对ADM敏感性的机制可能与其下调Survivin、Bcl-2和P-gp,上调cleaved Caspase-3的表达有关。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
序列表
<110> 华东理工大学
<120> Survivin多点突变体重组蛋白及其应用
<130> /
<160> 13
<170> SIPOSequenceListing 1.0
<210> 1
<211> 11
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 1
Tyr Ala Arg Lys Ala Arg Arg Gln Ala Arg Arg
1 5 10
<210> 2
<211> 31
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
ggaattccat atgtacgctc gtaaagctcg t 31
<210> 3
<211> 30
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 3
tctggctcgt tctcggcggg gcagtggatg 30
<210> 4
<211> 30
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 4
catccactgc cccgccgaga acgagccaga 30
<210> 5
<211> 31
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 5
ccgctcgaga tccatggcag ccagctgctc g 31
<210> 6
<211> 31
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 6
ggaattccat atgtacgctc gtaaagctcg t 31
<210> 7
<211> 30
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 7
cagaaaggaa agcggcaccg gacgaatgct 30
<210> 8
<211> 30
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 8
agcattcgtc cggtgccgct ttcctttctg 30
<210> 9
<211> 31
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 9
ccgctcgaga tccatggcag ccagctgctc g 31
<210> 10
<211> 31
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 10
ggaattccat atgtacgctc gtaaagctcg t 31
<210> 11
<211> 30
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 11
agaaaggaaa gcggcaccgg acgaatgctt 30
<210> 12
<211> 30
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 12
aagcattcgt ccggtgccgc tttcctttct 30
<210> 13
<211> 31
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 13
ccgctcgaga tccatggcag ccagctgctc g 31
- Survivin多点突变体重组蛋白及其应用
- ACTH突变体、重组蛋白及其应用,以及含有该ACTH重组蛋白的试剂盒
