一种金属有机框架材料固定化葡萄糖氧化酶及其制备方法和应用
文献发布时间:2023-06-19 11:30:53
技术领域
本发明属于材料制备技术领域,具体涉及一种金属有机框架材料固定化葡萄糖氧化酶及其制备方法和应用。
背景技术
酶是一种生物大分子催化剂,由于其具有底物特异性、选择性和绿色化学等特点,在医药、食品、化工、农业等领域得到了广泛应用。然而,天然酶的热稳定性和操作稳定性较低,最优pH范围狭窄,对大多数有机溶剂的耐受能力较低,回收困难以及在操作条件下缺乏重复使用性。此外,酶通常在均相体系中表现最好,这导致从产品混合物中去除酶需要复杂的分离步骤。
金属有机骨架(MOFs)是通过金属阳离子或团簇与有机配体的配位而形成的具有高结晶度和多孔性的三维网络结构。近年来,MOFs因其具有高比表面积和孔容、易于调节孔径、易于修饰金属阳离子或簇合物以及有机配体,合成条件温和等优点,被认为是一种很有前景的酶固定化支撑基质。此外,由于MOFs节点和连接体通过配位键、共价键、氢键、范德华力等方式为酶的结合提供了大量的锚点,可以防止酶在受热、脱水和溶剂变化时的浸出和变性,提高催化剂的可重复使用性。然而,酶@MOF在底物亲和度以及催化效率中仍有不足,并且在水溶液中诱导生成酶@MOF时间长。
发明内容
针对现有技术中存在不足,本发明提供了一种金属有机框架材料固定化葡萄糖氧化酶及其制备方法和应用。在本发明中,采用一步固定化法将葡萄糖氧化酶(glucoseoxidase,简写为GOx)引入金属锌离子和2-甲基咪唑形成的金属有机框架材料ZIF-8的孔道结构中,实现对酶的一步快速固定化;得到的固定化酶3-MPBA/GOx@ZIF-8克服了游离葡萄糖氧化酶在pH稳定性、热稳定性、贮藏稳定性以及尿素耐受性等方面的不足,在可视化检测葡萄糖中有着很好的应用。
本发明中首先提供了一种金属有机框架材料固定化葡萄糖氧化酶,记为3-MPBA/GOx@ZIF-8,所述3-MPBA/GOx@ZIF-8为粒状结构,粒径为180~200nm。
本发明中还提供了上述金属有机框架材料固定化葡萄糖氧化酶的制备方法,具体制备步骤包括:
称取葡萄糖氧化酶GOx,用聚乙烯吡咯烷酮PVP混匀后,加入3-巯基苯硼酸3-MPBA、2-甲基咪唑2- MIM溶液混合均匀,接着加入硝酸锌溶液,充分混合得到混合溶液,将混合溶液静置培养反应,反应结束后在4 ℃下离心,洗涤,干燥,得到金属有机框架材料固定化葡萄糖氧化酶,记为3-MPBA/GOx@ZIF-8。
进一步的,GOx在混合溶液中的终浓度为0.2-1.8mg/mL。
进一步的,GOx在混合溶液中的终浓度为1mg/mL。
进一步的,所述PVP在混合溶液中的浓度为0.1-1.2mg/mL,优选为0.8mg/mL。
进一步的,所述3-MPBA在混合溶液中的终浓度为0.1-1mg/mL,优选为0.6mg/mL。
进一步的,所述2- MIM在混合溶液中的终浓度为64mM;所述硝酸锌在混合溶液中的终浓度为16mM。
进一步的,所述静置培养的时间为10min-24h,优选为30min。
本发明中还提供了上述金属有机框架材料固定化葡萄糖氧化酶3-MPBA/GOx@ZIF-8在可视化检测葡萄糖中的应用。
与现有技术相比,本发明的有益效果在于:
(1)目前,酶的固定化通常是先合成固定化材料,再进行酶的固定化,对酶活的损失较大;而本发明创新性地选择了3-巯基苯硼酸快速一步合成方法,本发明在MOFS形成的过程中同时引入葡萄糖氧化酶,实现了固定化。酶的固定化与框架材料的制备同时进行避免了金属有机框架材料孔道过小,酶无法进入材料,或者材料孔道过大,无法起固定作用的缺陷,提高了酶的温度稳定性、耐酸碱性和储藏稳定性,显著提高循环利用率,同时提高了葡萄糖氧化酶降解葡萄糖的速率。
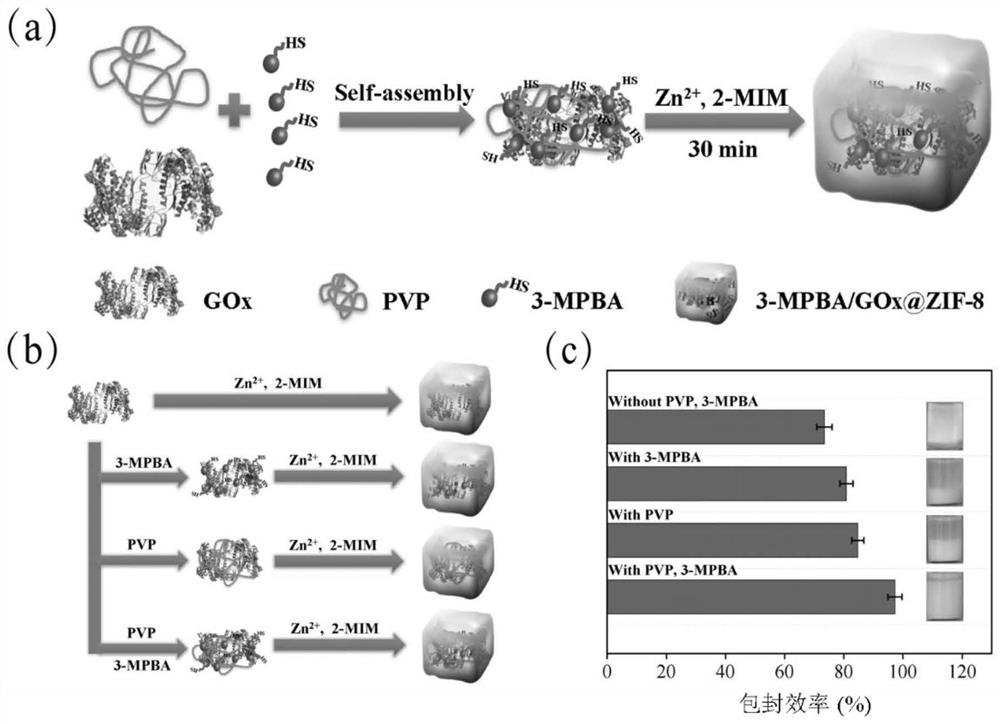
(2)本发明中将葡萄糖氧化酶溶液与PVP混匀后,再依次与3-巯基苯硼酸、2-甲基咪唑和硝酸锌溶液混匀,在常温水相温和条件下成功制备出固定化酶3-MPBA/GOx@ZIF-8,与没有3-MPBA的封装实验相比,封装效率提高了12.23%。
(3)本发明通过调整PVP、3-巯基苯硼酸以及酶的量从而最大程度地得到固定化酶,并且优化了固定化条件,当选择酶浓度为1mg/mL,聚乙烯吡咯烷酮溶液的浓度为0.8mg/mL,3-巯基苯硼酸的浓度为0.6mg/mL,固定化时间为30min时,酶的包封效率及保留活力达到最佳值,分别为97.32%和86.15%。
(4)本发明对固定化酶3-MPBA/GOx@ZIF-8的酶学性质进行了考察,发现其在稳定性等方面有着明显的提高。ZIF-8材料的三维孔道结构为葡萄糖氧化酶提供了刚性屏蔽环境从而有效地减小外界不利环境对酶活力的影响,提高了其热稳定性、耐酸碱性、储藏稳定性、重复利用稳定性等特性。
附图说明
图1为3-MPBA/GOx@ZIF-8的合成原理图(a)及不同封装体系示意图(b)和封装效率对比图(c)。
图2为游离GOx (a)、金属-有机框架材料ZIF-8 (b)及固定化酶3-MPBA/GOx@ZIF-8(c)的红外光谱图。
图3为3-MPBA@ZIF-8 (a)和3-MPBA/GOx@ZIF-8 (b)的N
图4为3-MPBA@ZIF-8 (a)和3-MPBA/GOx@ZIF-8 (b)的TEM图。
图5为3-MPBA@ZIF-8和3-MPBA/GOx@ZIF-8的LPSD图,图中a为3-MPBA@ZIF-8,b为3-MPBA/GOx@ZIF-8。
图6为ZIF-8 (a)和3-MPBA@ZIF-8 (b)和3-MPBA/GOx@ZIF-8 (c)的热重分析图。
图7为PVP添加量对酶的包封效率效果的影响结果图。
图8为葡萄糖氧化酶添加量对酶的包封效率效果的影响结果图。
图9为不同葡萄糖氧化酶浓度下的3-MPBA/GOx@ZIF-8的SEM图。
图10为3-巯基苯硼酸添加量对酶的包封效率效果的影响结果图。
图11为有无3-巯基苯硼酸时固定化时间对酶的包封效率效果的影响结果图。
图12为有无3-巯基苯硼酸时固定化时间对酶的保留活力效果的影响结果图。
图13为GOx@ZIF-8和3-MPBA/GOx@ZIF-8在不同孵育时间下的SEM图和其悬浊液的照片。
图14为GOx@ZIF-8和3-MPBA/GOx@ZIF-8与葡萄糖的反应示意图(a)及催化产生H2O2的速率曲线图(b)。
图15为pH对游离GOx及其固定化酶3-MPBA/GOx@ZIF-8催化反应活性的影响结果图。
图16为温度对游离GOx及其固定化酶3-MPBA/GOx@ZIF-8催化反应活性的影响结果图。
图17为游离GOx及其固定化酶3-MPBA/GOx@ZIF-8的pH稳定性验证的结果图。
图18为游离GOx及其固定化酶3-MPBA/GOx@ZIF-8的热稳定性验证的结果图。
图19为游离GOx及其固定化酶3-MPBA/GOx@ZIF-8的储藏稳定性验证的结果图。
图20为固定化酶3-MPBA/GOx@ZIF-8的重复利用稳定性验证的结果图。
图21为固定化酶3-MPBA/GOx@ZIF-8对葡萄糖的选择性可视化检测图(a)和对不同浓度的葡萄糖的可视化检测图(b)。
具体实施方式
下面结合附图以及具体实施例对本发明作进一步的说明,但本发明的保护范围并不限于此。
对本发明得到的固定化酶通过以下的方式对其性质进行验证:
(1) 酶的封装效率测定:
采用改良版Bradford蛋白检测试剂盒的方法测定。具体方法是在100μL工作液中加入10μL的酶液及离心后的上清液,室温孵育10 min。在595 nm处平行测定吸光度,根据蛋白标准曲线的线性回归方程可以求出蛋白浓度,进一步可以求出葡萄糖氧化酶的封装效率。
封装效率(%)= (加入酶的量-上清液中酶的量)/酶的总量×100%
(2)葡萄糖氧化酶活力的测定:
采用比色法进行酶活力测量,以对葡萄糖为底物,催化水解所得产物为过氧化氢(H2O2),其使靛蓝胭脂红褪色,在615 nm处有特征吸收峰,可直接进行比色测定。
靛蓝胭脂红溶液配制:称取0.0233 g靛蓝胭脂红样品,用适量去离子水溶解后定容到50 mL,得到1 mM的靛蓝胭脂红溶液。
0.2 M 醋酸-醋酸钠(NaAc-HAc)溶液配制:称取2.46 g醋酸钠固体于烧杯中,用适量的去离子水充分溶解后加入594μL冰醋酸,定容至200 mL。
0.2 M葡萄糖溶液配制:称取0.9 g醋酸钠固体于烧杯中,用适量去离子水溶解后定容到25 mL。
酶活力的测定:1 mL葡萄糖(0.2 M)和1 mL酶在37℃水浴中预热5 min。然后将两种溶液混合,在37℃下反应10 min。接着将3 mL NaAc-HAc (0.2 M, pH 5.2)缓冲液,1.3mL靛蓝胭脂红(1 mM)和上述反应液加入到25 mL比色管中。将去离子水加入到管中定容到刻度线,在沸水中反应13 min,最后用流水降温5 min以终止反应。以去离子水为参比,在615 nm处测定溶液的吸光度。
(3) 酶活力的计算:
葡萄糖氧化酶活力的定义:在37℃下单位时间(min)催化葡萄糖产生H
(4)固定化酶3-MPBA/GOx@ZIF-8降解葡萄糖应用:
固定化酶3-MPBA/GOx@ZIF-8和纤维素酶在3,3',5,5'-四甲基联苯胺(TMB)作用下可视化检测葡萄糖:用特制的圆形棉片进行葡萄糖的视觉检测。将50μL的3-MPBA/GOx@ZIF-8滴入棉片中,在室温下完全干燥。然后,将15 μL不同浓度的葡萄糖、10 mM的TMB和HRP混合加入棉片中。在室温和常压条件下,15 min后用相机记录棉片的颜色。
实施例1:金属有机框架材料固定化酶3-MPBA/GOx@ZIF-8的制备
3-MPBA/GOx@ZIF-8的制备:将3- MPBA溶于50μL乙醇,向其中加入1mL的GOx、分子量为8000的PVP,混合均匀,接着加入2 mL 浓度为160 mM 的2- MIM和2 mL浓度为40 mM的硝酸锌溶液混合均匀,使得葡萄糖氧化酶在混合溶液中的终浓度为0.2mg/mL,PVP在混合溶液中的终浓度为0.1mg/mL,3-巯基苯硼酸在混合溶液中的终浓度为0.1mg/mL,将混合溶液室温静置10分钟,然后将静置后的混合溶液在8000 rpm, 5min下离心,洗涤,真空干燥得到3-MPBA/GOx@ZIF-8。
3-MPBA@ZIF-8的制备:将3- MPBA溶于50μL乙醇,向其中加入1mL的去离子水、分子量为8000的PVP,混合均匀,接着加入2 mL 浓度为160 mM 的2- MIM和2 mL浓度为40 mM的硝酸锌溶液混合均匀,使得PVP在混合溶液中的终浓度为0.1mg/mL,3-巯基苯硼酸在混合溶液中的终浓度为0.1mg/mL,将混合溶液室温静置10分钟,然后将静置后的混合溶液在8000rpm, 5min下离心,洗涤,真空干燥得到3-MPBA/GOx@ZIF-8。
如图1a所示,由于3-MPBA和Zn
采用傅里叶变换红外光谱仪对游离GOx、金属有机框架材料ZIF-8单体和其固定化酶3-MPBA/GOx@ZIF-8三种样品的分子结构进行检测,测定结果如图2所示。图中,a为游离GOx (a)的红外光谱图,可以看出,GOx的特征峰出现在1400-1600 cm
图3a和3b分别为3-MPBA@ZIF-8和3-MPBA/GOx@ZIF-8的N
实施例2:金属有机框架材料固定化酶3-MPBA/GOx@ZIF-8的制备
将3- MPBA溶于50μL乙醇,向其中加入1mL的 GOx、分子量为8000的PVP,混合均匀,接着加入2 mL 浓度为160 mM 的2- MIM和2 mL浓度为40 mM的硝酸锌溶液混合均匀,使得GOx在混合溶液中的终浓度为1mg/mL,PVP在混合溶液中的终浓度为0.8mg/mL,3-巯基苯硼酸在混合溶液中的终浓度为0.6mg/mL,将混合溶液室温静置30分钟,然后将静置后的混合溶液在8000 rpm, 5min下离心,洗涤,真空干燥得到3-MPBA/GOx@ZIF-8。
图4 a和4b分别是3-MPBA@ZIF-8和3-MPBA/GOx@ZIF-8的TEM图。通过对比可以看出,3-MPBA@ZIF-8和3-MPBA/GOx@ZIF-8都呈现为粒状,尺寸约在200 nm左右,而MOFs在加入GOx之后出现粒径减小的现象,也表明葡萄糖氧化酶的引入并没有破坏ZIF-8的形貌。
图5为3-MPBA@ZIF-8和固定化酶3-MPBA/GOx@ZIF-8的LPSD图,图中a为3-MPBA@ZIF-8,b为固定化酶3-MPBA/GOx@ZIF-8。从图中可以看出,3-MPBA@ZIF-8和3-MPBA/GOx@ZIF-8的平均粒径分别为234.6 nm和183.4 nm,加入GOx后GOx@MOF的粒径减小,这主要是由于GOx@MOF中的成核位点增加所致。
实施例3:金属有机框架材料固定化酶3-MPBA/GOx@ZIF-8的制备
将3- MPBA溶于50μL乙醇,向其中加入1mL的 GOx、分子量为8000的PVP,混合均匀,接着加入2 mL 浓度为160 mM 的2- MIM和2 mL浓度为40 mM的硝酸锌溶液混合均匀,使得GOx在混合溶液中的终浓度为1.8mg/mL,PVP在混合溶液中的终浓度为1.2mg/mL,3-巯基苯硼酸在混合溶液中的终浓度为1mg/mL,将混合溶液室温静置24h,然后将静置后的混合溶液在8000 rpm, 5min下离心,洗涤,真空干燥得到3-MPBA/GOx@ZIF-8。
图6a、6b和6c分别为ZIF-8, 3-MPBA@ZIF-8和其固定化酶3-MPBA@ZIF-8的热重分析图。如图6所示,从25℃到211℃,ZIF-8由于样品中水分子的蒸发而损失了约6%的质量,第二阶段从357℃左右开始,失重速度较慢,这是由于ZIF-8自身分解造成的,失重率为25.79%。从3-MPBA@ZIF-8和3-MPBA/GOx@ZIF-8的失重曲线可以看出,由于水分子的蒸发,失重的第一阶段也在102℃以下;在3-MPBA@ZIF-8曲线中,第二阶段(277℃-800℃)主要由3-MPBA和ZIF-8的分解引起,失重率约为51.36%。相比之下,3-MPBA/GOx@ZIF-8的减重曲线第二阶段(305°C-800°C)呈现先快后慢的趋势,总减重约为84.50%,丢失的GOx重量约为33.14% wt%,从305 °C-357 °C开始,质量损失归因于3-MPBA和GOx的分解;在357°C以上的温度下,重量的缓慢下降主要是MOFs材料部分继续坍塌分解所致。通过ZIF-8, 3-MPBA@ZIF-8和其固定化酶3-MPBA@ZIF-8的三条失重图分析可知葡萄糖氧化酶成功固定于ZIF-8中。
实施例4:3-MPBA/GOx@ZIF-8的固定化条件优化
本实施例中分别考察了3-MPBA/GOx@ZIF-8在不同条件下固定化对其包封率和酶活性回收率的影响。
(1) PVP的添加量对固定化的影响:
PVP是一种类似于蛋白的生物相容性大分子,可作为封装剂,形成一个PVP/蛋白复合物,有利于通过氢键相互作用引导氨基酸倾向蛋白质形成3-MPBA/GOx@ZIF-8,PVP对GOx的封装效果如图7所示。从图中可以看出,与不加入PVP相比,加入PVP后的沉淀量显著增加,并且GOx的包封效率提高了15.29%,显著优于不加入PVP的包封实验。随着PVP浓度的增加,GOx的包封效率表现为先提高后保持不变,酶活回收率先提高后降低,这可能是由于PVP浓度过高导致3-MPBA/GOx@ZIF-8发生了严重的聚集,抑制了3-MPBA/GOx@ZIF-8与底物的反应。在PVP浓度为0.8 mg/mL时,包封率和酶活性回收率最佳,此时包封率为96.18±2.03%,酶活性回收率为84.58±2.20%。
(2) 酶的添加量对固定化的影响:
在其他步骤不变仅改变GOx的添加量来考察GOx的用量对3-MPBA/GOx@ZIF-8形成的影响。从图8中可以看出,随着GOx浓度的增加,GOx的包封率以及酶活性回收率都是先升高后降低的。当GOx浓度为1.0 mg/mL时,沉淀量最大,此时,GOx包封率达到96.98±2.57%,它的酶活回收率为85.87±2.13%。
图9为不同葡萄糖氧化酶浓度下的3-MPBA/GOx@ZIF-8的SEM图。从SEM图像看出,随着GOx的浓度从0.2 mg/mL增加到1.8 mg/mL,3-MPBA/GOx@ZIF-8晶体大小也随之减小,这表明3-MPBA/GOx@ZIF-8的大小和形态可以通过调整GOx的量来控制。
(3)3-巯基苯硼酸的添加量及时间对固定化的影响:
在其他步骤不变仅改变3-巯基苯硼酸的添加量来考察3-巯基苯硼酸的添加量对3-MPBA/GOx@ZIF-8形成的影响,图10为3-巯基苯硼酸添加量对酶的包封效率效果的影响结果图。
如图10所示,与没有3-MPBA的封装实验相比提高了12.23%,这表明巯基的增加可以促进3-MPB/GOx@ZIF-8的形成。随着3-MPBA用量的增加,GOx的包封效率呈先提高后下降趋势。当3-MPBA浓度为0.6 mg/mL时,包封率和酶活性回收率均达到最优水平,此时包封率为96.98±2.08%和酶活性回收率为85.71±3.02%。
图11为有无3-巯基苯硼酸时固定化时间对酶的包封效率效果的影响结果图,图12为有无3-巯基苯硼酸时固定化时间对酶的保留活力效果的影响结果图。通过对比两幅图可以看出,10-30min时3-MPBA/GOx@ZIF-8逐渐包封完全,包封效率达到最高值97.32±2.82%,此时酶活性回收率为86.15±2.56%。3-MPBA/GOx@ZIF-8在30分钟时呈现出均匀的粒状结构,GOx@ZIF-8仍呈现未组装的片层结构。当固定化时间为30分钟到24h时,3-MPBA/GOx@ZIF-8的包封效率保持稳定,3-MPBA/GOx@ZIF-8的尺寸和形貌保持不变,3-MPBA/GOx@ZIF-8的酶活性回收率随时间的延长而降低。未添加3-MPBA的GOx@ZIF-8至少需要12小时才能完成包封,包封效率为93.83±2.30%。其原因可能是巯基的存在与金属离子相互作用改变了纳米颗粒的形状和大小。
图13为GOx@ZIF-8和3-MPBA/GOx@ZIF-8在不同孵育时间下的SEM图和其悬浊液的照片。从图中可以看出,不含3-MPBA的GOx@ZIF-8呈絮凝状,3-MPBA/GOx@ZIF-8则分散十分均匀。
(4)3-巯基苯硼酸的添加对催化葡萄糖产生H
图14a为GOx@ZIF-8和3-MPBA/GOx@ZIF-8与葡萄糖的反应示意图,可以看出葡萄糖可以在3-MPBA/GOx@ZIF-8附近迅速聚集,导致3-MPBA/GOx@ZIF-8附近的葡萄糖浓度高于本体溶液,葡萄糖的富集明显降低了
图14b为GOx@ZIF-8和3-MPBA/GOx@ZIF-8催化产生H
实施例5:固定化酶3-MPBA/GOx@ZIF-8的酶学性质
(1) 游离GOx及固定化酶3-MPBA/GOx@ZIF-8的最适催化反应pH值:
pH是影响酶活力的一个重要因素,酶的构象易受pH变化而产生重大改变,从而引起酶活力损失;同时一些底物的溶解状态和pH变化也紧密相关。如图15所示,游离酶和固定化酶的最佳反应pH都为6.0,这说明3-MPBA/GOx@ZIF-8中GOx的构象没有发生明显变化。与游离GOx相比,3-MPBA/GOx@ZIF-8在pH值5.5-8.0时表现出较高的相对活性。pH 7.0时游离GOx的相对活性仅为77.28±3.24%,而3-MPBA/GOx@ZIF-8的相对活性为88.30±2.76%;当pH值低于5.5时,ZIF-8会溶解并释放其所含的酶,该特性可用于药物缓释等方面。
(2)游离GOx及固定化酶3-MPBA/GOx@ZIF-8的最适催化反应温度:
温度是影响酶催化反应活性的另一个重要因素,本发明探究了游离GOx及固定化酶3-MPBA/GOx@ZIF-8在不同温度体系下的催化反应活性。如图16所示,游离GOx和3-MPBA/GOx@ZIF-8的最佳反应温度均为35 ℃,但是当70 ℃时3-MPBA/GOx@ZIF-8的相对活性仍为47.15±2.95%,而游离GOx的相对活性仅为23.31±2.78%,这可能是由于ZIF-8带来的结构刚度增强,更有利于3-MPBA/GOx@ZIF-8对温度的适应。
(3)游离GOx及固定化酶3-MPBA/GOx@ZIF-8的pH稳定性:
本实施例考察游离GOx及固定化酶3-MPBA/GOx@ZIF-8在pH 3.0-8.0体系下培养30min后,其酶活力保留情况。如图17所示,当pH小于5的条件下,游离GOx更稳定,这是因为3-MPBA/GOx@ZIF-8会在pH小于5的条件下溶解;当pH为5.5-8.0时3-MPBA/GOx@ZIF-8具有较高的活性,这是因为3-MPBA/GOx@ZIF-8表面不同的电荷对微环境有一定的缓冲作用。因此,ZIF-8材料固定化酶后,ZIF-8孔道骨架提供了刚性屏蔽环境,从而减小了酸碱环境所带来的不利影响,提高了酶的pH稳定性。
(4)游离GOx及固定化酶3-MPBA/GOx@ZIF-8的热稳定性:
酶促反应需要的时间较长,为了提高催化速率,反应需要在较高温度下进行,这对酶的热稳定性提出了很高的要求。虽然高温下的酶解速率较快,但是很容易引起酶的不可逆失活,从而失去获得高产率的意义。
本实施例将游离GOx及其固定化酶在20-70 ℃下培养30 min后,测其相对酶活力。如图18所示,温度超过40℃时,游离GOx的稳定性迅速下降;在50℃下,3-MPBA/GOx@ZIF-8的相对活性为84.69±3.28%高于游离GOx的相对活性53.60±4.00%;当温度达到70℃时,游离GOx几乎失活,3-MPBA/GOx@ZIF-8的相对活性仍为32.27±3.02%。可见,高温环境会破坏GOx的结构,导致不可逆地失活,而3-MPBA/GOx@ZIF-8为GOx提供了刚性结构,提高了热稳定性。
(5)游离GOx及固定化酶3-MPBA/GOx@ZIF-8的储藏稳定性:
酶的贮藏条件及稳定性等问题是酶工业化应用中必须应对的问题。本实施例将游离GOx及固定化酶3-MPBA/GOx@ZIF-8保存在4 ℃的冰箱中,测定其30天内的保留活性。如图19所示,在4℃条件下,30天后测定游离GOx和3-MPBA/GOx@ZIF-8的相对活性分别为78.2±3.09%和65.73±3.25%。3-MPBA/GOx@ZIF-8能够在一定的温度和时间范围内成功保存而不失去活性,这可能是由于ZIF-8的结构对酶的保护作用强于游离GOx。
(6)固定化酶3-MPBA/GOx@ZIF-8的重复利用稳定性:
如图20所示,排除实验中离心等一系列破坏酶活力因素,在第一次降解酶活性为100%的情况下,3-MPBA/GOx@ZIF-8经过9个循环后仍保持71.47±3.59%的相对活性。3-MPBA/GOx@ZIF-8使用简单,可有效回收,可重复使用,符合经济和绿色化学要求。
(7)游离GOx及固定化酶3-MPBA/GOx@ZIF-8的热失活动力学参数:
表1为游离 GOx和3-MPBA/GOx@ZIF-8的热失活动力学参数
表1. 游离GOx及固定化酶3-MPBA/GOx@ZIF-8的热失活动力学参数表
从表1可以看出,随着温度的升高,游离 GOx和3-MPBA/GOx@ZIF-8的
(8)游离GOx及固定化酶3-MPBA/GOx@ZIF-8的动力学常数:
配制浓度为0-0.2M底物葡萄糖,短时间内进行催化反应,测定游离GOx及固定化酶3-MPBA/GOx@ZIF-8的酶活力,利用Lineweaver-Burk法求出其两者的
表2. 游离GOx及固定化酶3-MPBA/GOx@ZIF-8的动力学常数表
从表2中可以看出,与游离GOx和GOx@ZIF-8相比,3-MPBA/GOx@ZIF-8的
实施例6:游离GOx及固定化酶3-MPBA/GOx@ZIF-8的可视化检测葡萄糖应用测试
(1) 固定化酶3-MPBA/GOx@ZIF-8对葡萄糖检测的选择性:
糖尿病筛查可以通过棉片上蓝色的规律变化来实现,为了避免其他物质的干扰,对 3-MPBA/GOx@ZIF-8的选择性进行鉴定,干扰物质包括10 mM的半乳糖、海藻糖、鼠李糖、甘露糖、山梨糖、核糖、阿拉伯糖、木糖、麦芽糖和抗坏血酸。图21(a)可以看出,在相同浓度下,只有含葡萄糖的棉片呈现出明显的蓝色,说明3-MPBA/GOx@ZIF-8对葡萄糖具有敏感的特异性颜色反应。基于以上特点,3-MPBA/GOx@ZIF-8可以很好地应用于血糖的检测。
(2)固定化酶3-MPBA/GOx@ZIF-8对不同浓度葡萄糖的可视化检测:
糖尿病患者血清中的葡萄糖浓度约为9-40 mM,选择0-20 mM的葡萄糖浓度进行可视化检测。如图21(b)所示,棉片显示的颜色随葡萄糖浓度的增加而加深,视觉检测葡萄糖的最低浓度为2.0 mM。结果表明,3-MPBA/GOx@ZIF-8可视化检测葡萄糖具有较大的视觉检测范围,具有良好的选择性和简易性,可应用于工业和医学领域。
所述实施例为本发明的优选的实施方式,但本发明并不限于上述实施方式,在不背离本发明的实质内容的情况下,本领域技术人员能够做出的任何显而易见的改进、替换或变型均属于本发明的保护范围。
- 一种金属有机框架材料固定化葡萄糖氧化酶及其制备方法和应用
- 金属有机框架材料固定化β-葡萄糖苷酶及其制备方法和应用
