优化BAG3基因治疗
文献发布时间:2023-06-19 11:32:36
相关申请
本申请要求于2018年6月8日提交的美国临时专利申请号62/682,404的优先权。上述申请的全部内容,包括所有文本、表格、序列表和附图,通过引用的方式并入本文。
政府赞助声明
本发明是在美国国立卫生研究院所授予的资助号:ROl HL123093和HL 091799-01的政府资助下完成的。政府拥有本发明的某些权利。
技术领域
本发明的实施方案涉及在非洲血统的个体中识别BAG3遗传变体,其通过调节BAG3的功能而对诸如非缺血性或缺血性扩张型心肌病的心脏病患者的结果产生负面影响。组合物包括使Bcl2相关的抗凋亡基因3(BAG3)表达和/或功能正常化的制剂。
背景技术
继发于扩张型心肌病(DCM)的心力衰竭(HF)估计影响250万二十岁以上的美国人
在非洲血统美国人中,DCM的患病率增加归因于多种医学和社会学因素,包括邻域
发明内容
在非洲血统的个体中,对BAG3(Bcl2相关的抗凋亡基因3)遗传变体的识别与非缺血性或缺血性扩张型心肌病(DCM)的流行和DCM结果有关。在具有突变的患者中发现死亡或心力衰竭住院的风险显著增加。
因此,在某些实施方案中,一种治疗患有心脏病的患者的方法,其中与对照BAG3核酸序列相比,所述患者具有至少一个Bcl2相关的抗凋亡基因3(BAG3)核苷酸变体(NV)框内(in-frame)插入,该方法包括向患者施用治疗有效量的制剂,其中该制剂调节靶细胞或组织中BAG3分子、蛋白质或其肽的表达或量。
在某些实施方案中,框内插入编码氨基酸。在特定的实施方案中,框内插入编码非极性氨基酸。在特定的实施方案中,框内插入包括在位置160处添加丙氨酸的3个核苷酸插入(p.Ala160dup,10:121429647A/AGCG;rs139438727)。
在特定的实施方案中,一种诊断和治疗患有心脏病的患者的方法,包括与对照Bcl2相关的抗凋亡基因3(BAG3)核酸序列相比,在患者样品中识别至少一种BAG3遗传变体,其中特定变体的检测预测BAG3水平的升高是否对患者具有治疗作用,并向识别为具有这种变体的患者施用治疗有效量的制剂,其中与正常对照相比,该制剂调节靶细胞或组织中的BAG3分子、蛋白质或其肽的表达或量。几乎仅在非洲血统的个体中发现的BAG3中的遗传变体不是疾病的病因,而是通过调节BAG3的功能对非缺血性或缺血性扩张型心肌病患者的结果产生负面影响。
在特定的实施方案中,诊断和治疗患有心脏病的患者的方法包括:与对照BAG3核酸序列相比,在患者样品中识别至少一种Bcl2相关的抗凋亡基因3(BAG3)遗传变体;并向识别为具有BAG3遗传变体的患者施用治疗有效量的制剂,其中与正常对照相比,该制剂调节靶细胞或组织中BCL2相关的抗凋亡基因3(BAG3)分子、蛋白质或其肽的表达或量。
在特定的实施方案中,遗传变体是框内插入。在特定的实施方案中,框内插入编码氨基酸。在特定的实施方案中,框内插入编码非极性氨基酸。在特定的实施方案中,框内插入包括在位置160处添加丙氨酸的三核苷酸插入(p.Ala160dup,10:121429647A/AGCG;rs139438727)。
在特定的实施方案中,一种治疗处于患心脏衰竭风险或患有心脏衰竭的受试者的方法包括向该受试者施用药物组合物,该药物组合物包含治疗有效量的至少一种调节BCL2相关的抗凋亡基因3(BAG3)分子的表达或量的制剂,其中与对照BAG3核酸序列相比,受试者具有至少一个BAG3遗传变体,其中所述BAG3遗传变体是框内插入,并且其中该制剂包含编码BCL2相关的抗凋亡基因3(BAG3)分子的表达载体。
在特定的实施方案中,框内插入编码氨基酸。在特定的实施方案中,框内插入编码非极性氨基酸。在特定的实施方案中,框内插入包括在位置160处添加丙氨酸的3个核苷酸插入(p.Ala160dup,10:121429647A/AGCG;rs139438727)。
在特定的实施方案中,遗传变体是单核苷酸变体(SNV)框内插入、缺失、取代或其组合。在特定的实施方案中,SNV包括:p.Pro63Ala(10:121429369C/G;rs133031999);p.His83Gln(10:151331972;rs151331972);Pro380Ser(10:121436204C/T;rs144692954);Ala479Val(10:121436502C/T,rs34656239)或其组合。在特定的实施方案中,框内插入编码氨基酸。在特定的实施方案中,框内插入编码非极性氨基酸。在某些实施例中,框内插入在位置160处编码丙氨酸。
在特定的实施方案中,一种用于治疗被识别为在BCL2相关的抗凋亡基因3(BAG3)基因中具有遗传变体的患者的制剂,其中该遗传变体是包含框内插入、框内删除、截断、替换或其组合的单核苷酸变体(SNV)。
在特定的实施方案中,与正常对照相比,制剂调节靶细胞或组织中BCL2相关的抗凋亡基因3(BAG3)分子、蛋白质或其肽的表达或量,该制剂包含表达BAG3蛋白或其活性片段、寡核苷酸或其组合的表达载体。
在特定的实施方案中,一种治疗处于患心力衰竭风险或患有心力衰竭的受试者的方法,其包括在生物样品中识别预测BAG3水平升高是否对该受试者具有治疗性的BAG3变体,且向被识别为具有这种变体的患者施用治疗有效量的制剂。在特定的实施方案中,与正常对照相比,该制剂调节靶细胞或组织中BAG3分子、其蛋白质或肽的表达或量。
在特定的实施方案中,一种识别具有较差预后的心脏病患者的方法,所述方法包括:与对照BAG3核酸序列相比,筛查患者样品中Bcl2相关的抗凋亡基因3(BAG3)核苷酸变体(NV)框内插入,其中BAG3核苷酸变体(NV)框内插入的检测识别所述心脏病患者为具有较差预后。
在特定的实施方案中,一种识别处于患心脏病风险的患者的方法,该方法包括:与对照BAG3核酸序列相比,筛查患者样品中Bcl2相关的抗凋亡基因3(BAG3)核苷酸变体(NV)框内插入的存在,其中BAG3核苷酸变体(NV)框内插入的检测识别所述患者为具有心脏病的风险。
在特定的实施方案中,框内插入编码氨基酸。在特定的实施方案中,框内插入编码非极性氨基酸。在特定的实施方案中,框内插入包括在位置160处添加丙氨酸的3个核苷酸插入(p.Ala160dup,10:121429647A/AGCG;rs139438727)。
在特定的实施方案中,一种识别处于患心脏病风险的患者的方法,包括:筛查患者样品中Bcl2相关的抗凋亡基因3(BAG3)遗传变体的存在,其中所述BAG3遗传变体包含p.Ala160dup(10:121429647A/AGCG;rs139438727);p.Pro63Ala(10:121429369C/G;rs133031999);p.His83Gln(10:151331972;rs151331972);Pro380Ser(10:121436204C/T;rs144692954);Ala479Val(10:121436502C/T,rs34656239)或其组合。
在特定的实施方案中,一种制剂盒,其包含与用于识别生物样品中BCL2相关的抗凋亡基因3(BAG3)变体的可检测标签偶联的一种或多种探针。特定变体的检测预测受试者是否会从治疗中受益。
本文公开的所有基因、基因名称和基因产物旨在对应于适用于本文公开的组合物和方法的任何物种的同源物。因此,该术语包括但不限于来自人和小鼠的基因和基因产物。应当理解,当公开来自特定物种的基因或基因产物时,本公开仅意图是示例性的,并且不应解释为限制性的,除非其出现的上下文明确指出。因此,例如,对于本文公开的基因或基因产物,其在一些实施方案中涉及哺乳动物核酸和氨基酸序列,旨在涵盖来自其他动物的同源和/或直系同源基因和基因产物,包括但不限于其他哺乳动物、鱼类、两栖动物、爬行动物和鸟类。在特定的实施方案中,基因、核酸序列、氨基酸序列、肽、多肽和蛋白质是人的。
下文描述其他方面。
定义
除非另有定义,否则本文中使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常所理解的相同含义。尽管在实践中可以使用与本文描述的那些类似或等同的任何方法和材料来测试本发明,但是本文描述了某些材料和方法。在描述和要求保护本发明时,将使用以下术语。
冠词“一”和“一个”在本文中用于指一个或多个(即,至少一个)该物品的语法对象。举例来说,“一个元件”是指一个元件或一个以上元件。因此,“一个细胞”的叙述例如包括多个相同类型的细胞。此外,就在详细描述和/或权利要求中使用的术语“包括”、“包含”、“含有”、“具有”、“有”或其变体而言,这些术语旨在以类似于术语“包括”的方式包括在内。
如本文所使用的,涉及物品、组合物、装置、方法、过程、系统等的定义或描述的要素的术语“包括”、“包含”或“含有”及其变体为包容性的或开放式的,允许额外的元素,从而表示所定义或描述的物品、组合物、装置、方法、过程、系统等包括那些指定的元素-或视情况包括其等效内容-并且其他元素可以包括在内,但仍落入所定义的物品、组合物、装置、方法、过程、系统等的范围/定义内。
当涉及诸如量,时间持续时间之类的可测量值时,本文所使用的“约”意指涵盖相对于指定值+/-20%,+/-10%,+/-5,+/-1%或+/-0.1%的变化,因为这样的变化适合执行所公开的方法。可替代地,特别是关于生物系统或过程,该术语可以意指数值的5倍以内,也可以是数值的2倍以内。在本申请和权利要求书中描述了特定值的情况下,除非另有说明,否则应假设术语“约”是指在特定值的可接受误差范围内。
如本文所用,“BAG3”、“BAG3分子”、“BCL2相关的抗凋亡基因3(BAG3)基因”、“BCL2相关的抗凋亡基因3(BAG3)分子”包括所有家族成员、突变体、cDNA序列、等位基因、片段、种类、编码和非编码序列,有义和反义多核苷酸链等。(HGNC(939)Entrez基因(9531)Ensembl(ENSG00000151929)OMIM(603883)UniProtKB(095817))。类似地,“BAG3”、“BAG3分子”、“BCL2相关的抗凋亡基因3(BAG3)分子”也指BAG3多肽或其片段、蛋白质、变体、衍生物等。术语“分子”因此涵盖了BAG3的核酸序列和氨基酸序列两者。
如本文所用,“生物样品”包括固体和体液样品。本发明中使用的生物样品可以包括细胞,细胞的蛋白质或膜提取物,血液或诸如腹水或脑液(例如脑脊髓液)等生物液。固体生物样品的例子包括但不限于来自中枢神经系统、骨骼、乳房、肾脏、子宫颈、子宫内膜、头/颈、胆囊、腮腺、前列腺、垂体、肌肉、食道、胃、小肠、结肠、肝脏、脾脏、胰腺、甲状腺、心脏、肺、膀胱、脂肪、淋巴结、子宫、卵巢、肾上腺、睾丸、扁桃体、胸腺和皮肤的样本,或取自肿瘤的样本。“体液样品”的示例包括但不限于血液、血清、精液、前列腺液、精液、尿液、粪便、唾液、痰、粘液、骨髓、淋巴液和泪液。
如本文所用,“心脏疾病”是指任何类型的心脏病,包括心力衰竭,心肌疾病,心肌病,肥厚型心肌病,扩张型心肌病,动脉粥样硬化,冠状动脉疾病,非缺血性心脏病,缺血性心脏病,心肌炎,病毒感染,创伤,高血压心脏病,瓣膜病,先天性心脏病,心肌梗塞,充血性心力衰竭,心律不齐,导致心脏重塑的疾病等。心脏疾病可以是由于任何原因引起的,例如,对心脏组织的损害,例如收缩力的丧失(例如,可以通过降低的射血分数来证明)。以心脏功能不足为特征的心脏损害或病症包括正常心脏功能的任何损害或不存在或异常心脏功能的存在。心脏功能异常可以是疾病、损伤和/或衰老的结果。如本文所用,“心脏功能异常”包括心肌细胞,心肌细胞群或心脏本身的形态和/或功能异常。形态学和功能异常的非限制性示例包括心肌细胞的物理退化和/或死亡,心肌细胞的异常生长方式,心肌细胞之间的物理连接异常,心肌细胞产生的一种或多种物质不足或过量,心肌细胞不能产生它们通常产生的一种或多种物质,以及以异常模式或异常时间传输电脉冲。大体上的异常包括运动障碍,射血分数降低,通过超声心动图(如扩张)观察到的变化,EKG的变化,运动耐量的变化,毛细血管灌注的减少以及通过血管造影术观察到的变化。在许多疾病中均可见到心脏功能异常,包括例如非缺血性或缺血性心脏病,例如心绞痛,心肌梗塞,慢性缺血性心脏病,高血压性心脏病,肺源性心脏病(肺心病),瓣膜性心脏病,例如风湿热,二尖瓣脱垂,二尖瓣环钙化,类癌性心脏病,感染性心内膜炎,先天性心脏病,心肌病(例如心肌炎,扩张型心肌病,高血压性心肌病),导致充血性心力衰竭的心脏疾病以及心脏肿瘤,例如原发性肉瘤和继发性肿瘤。心脏损伤还包括创伤,例如刀伤;生物的(例如病毒;自身免疫性疾病)或化学的(例如化学疗法,药物);手术;移植等。
如本文所用,词语“诊断”是指对疾病或症状进行分类,确定疾病的严重性,监测疾病的进展,预测疾病的结果和/或恢复的前景。术语“检测”还可以任选地包括以上任何一种。可以通过测定从受试者获得的生物样品中本发明的多核苷酸或多肽的水平来实现根据本发明的疾病的诊断,其中所确定的水平可以与疾病的易感性、存在疾病或不存在疾病相关联。应当注意,“从受试者获得的生物样品”也可以任选地包括尚未从受试者物理移除的样品。
如本文所用,词语“诊断的”是指识别病理状况的存在或性质。诊断方法的灵敏度和特异性不同。诊断的“灵敏度”是指测试到阳性的患病个体的百分比(“真实阳性”的百分比)。通过测试法未测试到的患病个体为“假阴性”。未患病且在测试中测试到阴性的受试者称为“真阴性”。诊断测试的“特异性”为1减去假阳性率,其中“假阳性”率定义为没有疾病的患者测试到阳性的比例。尽管特定的诊断方法可能无法提供对疾病的确定诊断,但只要该方法提供有助于诊断的阳性指示就足够了。
如本文所用,“有效量”是指提供治疗或预防益处的量。
“编码”是指多核苷酸中的特定核苷酸序列的固有特性,例如基因、cDNA或mRNA,以用作具有限定的核苷酸序列(即rRNA,tRNA和mRNA)或限定的氨基酸序列及其产生的生物学特性的生物学过程中合成其他聚合物和大分子的模板。因此,如果对应于该基因的mRNA的转录和翻译在细胞或其他生物系统中产生该蛋白质,则该基因编码蛋白质。其核苷酸序列与mRNA序列相同并且通常在序列表中提供的编码链和用作基因或cDNA转录的模板的非编码链两者可以被称作编码该基因或cDNA的蛋白质或其它产物。
如本文所用,术语“表达”定义为由其启动子驱动的特定核苷酸序列的转录和/或翻译。
“表达载体”是指包含重组体的载体包含重组体多核苷酸的载体,该重组体多核苷酸包含与待表达的核苷酸序列可操作地连接的表达控制序列。表达载体包含用于表达的足够的顺式作用元件。用于表达的其他元件可以由宿主细胞或在体外表达系统中提供。表达载体包括本领域中所有已知的载体,例如掺入了重组多核苷酸的粘粒、质粒(例如裸露或包含在脂质体中)和病毒(例如慢病毒、逆转录病毒、腺病毒和腺相关病毒)。
“抑制性核酸”是指双链RNA,siRNA,shRNA或反义RNA,或其一部分,或其模拟物,当给予哺乳动物细胞时会导致靶基因的表达减少(例如,减少了10%,25%,50%,75%或甚至90-100%)。通常,核酸抑制剂包含靶核酸分子或其直系同源物的至少一部分,或包含靶核酸分子的互补链的至少一部分。例如,抑制性核酸分子包含本文所述的任何或所有核酸的至少一部分。
“分离的”是指从自然状态改变或去除。例如,活体动物中天然存在的核酸或肽不是“分离的”,但是与其天然状态的共存材料部分或完全分离的相同核酸或肽是“分离的”。分离的核酸或蛋白质可以基本上纯化的形式存在,或可以存在于非天然环境中,例如宿主细胞中。
“分离的核酸”是指已经从天然存在状态的侧翼序列中分离的核酸片段或片段,即,从通常与该片段相邻的序列(即,与在其天然存在的基因组中的片段相邻的序列)中除去的DNA片段。该术语也适用于基本上从天然伴随核酸的其它组分(即RNA或DNA或蛋白质)中纯化的核酸,其在细胞中天然伴随。因此,该术语包括,例如,掺入载体、掺入自主复制的质粒或病毒的重组DNA、或掺入原核生物或真核生物的基因组DNA的重组DNA、或以独立于其他序列的独立分子(即通过PCR或限制性酶切产生的cDNA或基因组或cDNA片段)形式存在的重组DNA。它还包括:重组DNA,它是编码附加多肽序列的杂种基因的一部分,互补DNA(cDNA),天然和/或修饰的单体或链的线性或环状低聚物或聚合物,包括脱氧核糖核苷,核糖核苷,其取代和α-异构形式,肽核酸(PNA),锁核酸(LNA),硫代磷酸酯,膦酸甲酯等。
核酸序列可以是“嵌合的”,即由不同的区域组成。在本发明的上下文中,“嵌合的”化合物是寡核苷酸,其包含两个或更多个化学区域,例如,DNA区域,RNA区域,PNA区域等。每个化学区域由至少一个单体单元(即核苷酸)组成。这些序列通常包含至少一个区域,其中该序列被修饰以显示一种或多种所需的性质。
如本文所使用的,术语“制剂盒”是指用于输送材料的任何输送系统。在反应测试的背景下,这样的递送系统包括允许反应制剂(例如,在适当的容器中寡核苷酸,酶等)和/或支持材料(例如,缓冲液,用于进行测试的书面说明书等)从一个位置到另一位置进行的存储、运输或递送的系统。例如,制剂盒包括一个或多个包含相关反应制剂和/或支持材料的外壳(例如,盒子)。如本文所用,术语“零散制剂盒”是指包括两个或更多个单独容器的递送系统,每个容器包含全部制剂盒组分的子部分。容器可以一起或分开地递送给预期的接收者。例如,第一容器包含用于测试的酶,而第二容器包含寡核苷酸。术语“分散制剂盒”旨在涵盖含有根据《联邦食品,药品和化妆品法》第520(e)条规定的分析物特异性制剂(ASR)的制剂盒,但不限于此。实际上,任何包括两个或更多个单独容器的递送系统都包括在术语“碎片制剂盒”中,每个容器包含全部制剂盒组分的子部分。相反,“组合制剂盒”是指在单个容器中(例如,在容纳每个所需组分的单个盒子中)包含反应测试的所有组分的递送系统。术语“制剂盒”包括分散制剂盒和组合制剂盒。
术语“靶核酸”序列是指寡核苷酸被设计为与其特异性杂交的核酸(通常衍生自生物样品)。其中待检测的是靶核酸的存在或不存在,或待定量的是靶核酸的量。靶核酸具有与针对靶的相应寡核苷酸的核酸序列互补的序列。术语靶核酸可以指寡核苷酸所针对的较大核酸的特定亚序列或整个序列(例如基因或mRNA)。从上下文中看,使用上的差异是显而易见的。
在本发明的上下文中,使用以下常见核酸碱基的缩写,“A”是指腺苷,“C”是指胞嘧啶,“G”是鸟苷,“T”是指胸苷,“U”是指尿苷。
除非另有说明,否则“编码”氨基酸序列的核苷酸序列包括彼此为简并形式并且编码相同氨基酸序列的所有核苷酸序列。短语编码蛋白质或RNA的核苷酸序列也可以包括内含子,其程度为编码蛋白质的核苷酸序列在某些形式中可以包含一个或多个内含子。
免疫原性组合物的“肠胃外”施用包括例如皮下(s.c.),静脉内(i.v.),肌肉内(i.m.)或胸骨内注射或输注技术。
术语“患者”或“个体”或“受试者”在本文可互换使用,并且是指待治疗的哺乳动物受试者,其中人类患者为一个实例。在某些情况下,本发明的方法可用于实验动物,兽医应用以及用于疾病的动物模型的开发,所述动物包括但不限于啮齿类动物,包括小鼠,大鼠,仓鼠和灵长类动物。
术语“百分比序列同一性”或具有“序列同一性”是指任何给定查询序列与受试者序列之间的同一性程度。
术语“药学上可接受的”(或“药理学上可接受的”)是指当适当地施用于动物或人时不会产生不利,过敏或其他不良反应的分子实体和组合物。如本文所用,术语“药学上可接受的载体”包括可用作药学上可接受的物质的介质的任何和所有的溶剂、分散介质,包覆、抗菌剂,等渗剂和吸收延迟剂、缓冲剂、赋形剂、粘合剂、润滑剂、凝胶、表面活性剂等。
术语“多核苷酸”是核苷酸链,也称为“核酸”或“核酸序列”,并且包括但不限于通过可用于该领域的任何方式获得的所有核酸序列,天然的和合成的核酸,互补DNA(cDNA),天然和/或修饰的单体或链的线性或环状寡聚物或聚合物,包括脱氧核糖核苷,核糖核苷,其取代和α-异构体形式,肽核酸(PNA),锁核酸(LNA),硫代磷酸酯,甲基膦酸酯等。核酸序列可以是“嵌合的”,即由不同的区域组成。在本发明的上下文中,“嵌合的”化合物是寡核苷酸,其包含两个或更多个化学区域,例如,DNA区域、RNA区域、PNA区域等。每个化学区域由至少一个单体单元(即核苷酸)组成。这些序列通常包含至少一个区域,其中该序列被修饰以显示一种或多种所需的性质。
术语“肽”,“多肽”和“蛋白质”可互换使用,并且是指由通过肽键共价连接的氨基酸残基组成的化合物。蛋白质或肽必须包含至少两个氨基酸,并且对可包含蛋白质或肽序列的氨基酸的最大数量没有限制。多肽包括任何包含通过肽键相互连接的两个或更多个氨基酸的肽或蛋白质。如本文所用,该术语是指短链和长链,短链在本领域中通常也被称为例如肽、寡肽和寡聚物,长链在本领域中通常被称为蛋白质,其中有很多类型。“多肽”包括,例如,生物活性片段,基本上同源的多肽,寡肽,同二聚体,异二聚体,多肽的变体,修饰的多肽,衍生物,类似物,融合蛋白等。多肽包括天然肽、重组肽、合成肽或其组合。
术语“转染的”或“转化的”或“转导的”是指将外源核酸转移或引入宿主细胞的过程。“转染的”或“转化的”或“转导的”细胞是已经用外源核酸转染,转化或转导的细胞。转染/转化/转导的细胞包括原代受试细胞及其后代。
如本文所用,“治疗”疾病是指降低受试者经历的疾病或病症的至少一种体征或症状的频率或严重程度。疾病或病症的治疗包括病毒的消除。
“治疗”是旨在防止疾病的发展或改变疾病的病理学或症状的干预。因此,“治疗”是指治疗性治疗和预防性或预防性措施。“治疗”也可以被指定为姑息治疗。需要治疗的那些包括已经患有该疾病的那些以及要预防该疾病的那些。因此,对状态、病症或病状的“治疗”或“疗法”包括:(1)消除病毒;(2)预防或延缓可能患有或易患该状态、病症或病状但尚未经历或未表现出该状态、病症或病状的临床或亚临床症状的人或其他哺乳动物所发展的状态、病症或病状的临床症状的出现;(3)抑制状态、病症或病状,即阻止、减少或延迟疾病或其复发的发展(在维持治疗的情况下)或其至少一种临床或亚临床症状;或(4)减轻疾病,即引起状态、病症或病状或其至少一种临床或亚临床症状的消退。对要治疗的个体的益处在统计学上显著的,或者至少对于患者或医师是可察觉的。
当在多核苷酸序列的上下文中使用时,术语“变体”可以涵盖与野生型基因有关的多核苷酸序列。该定义还可以包括例如“等位基因”,“剪接”,“物种”或“多态”变体。剪接变体可以与参考分子具有显著同一性,但是通常由于在mRNA加工期间外显子的交替剪接而具有更多或更少数量的多核苷酸。相应的多肽可具有另外的功能结构域或不存在结构域。物种变体是从一个物种到另一个物种变化的多核苷酸序列。在本发明中特别有用的是野生型基因产物的变体。变体可以由核酸序列中的至少一种突变产生,并且可以导致改变的mRNA或其结构或功能可以改变或可以不改变的多肽。任何给定的天然或重组基因可以没有一种或多种等位基因形式。导致变体的常见突变改变通常归因于核苷酸的天然缺失、添加或取代。这些类型的改变中的每一种都可以单独发生,也可以与其他类型组合按给定顺序进行一次或多次。
“载体”是包含分离的核酸并且可以用于将分离的核酸递送至细胞内部的物质组合物。载体的实例包括但不限于线性多核苷酸,与离子或两亲化合物相关的多核苷酸、质粒和病毒。因此,术语“载体”包括自主复制质粒或病毒。该术语也被解释为包括促进核酸转移到细胞中的非质粒和非病毒化合物,例如聚赖氨酸化合物、脂质体等。病毒载体的例子包括但不限于腺病毒载体、腺相关病毒载体、逆转录病毒载体等。
范围:在整个本公开中,可以以范围格式来呈现本发明的各个方面。应当理解,范围格式的描述仅是为了方便和简洁,而不应被解释为对本发明范围的不灵活的限制。因此,范围的描述应被认为已具体公开了所有可能的子范围以及该范围内的各个数值。例如,对范围从1到6的描述应被认为具体公开了从1到3、从1到4、从1到5、从2到4、从2到6、从3到6等的子范围,以及该范围内的单个数字,例如1、2、2.7、3、4、5、5.3和6。无论该范围的宽度如何,这都适用。
其中任何核酸序列或氨基酸序列被Swiss Prot.或GENBANK登录号特别提及,该序列通过引用并入本文。与登录号相关的信息,例如信号肽、细胞外结构域、跨膜结构域、启动子序列和翻译起始的识别,也通过引用整体并入本文。
附图说明
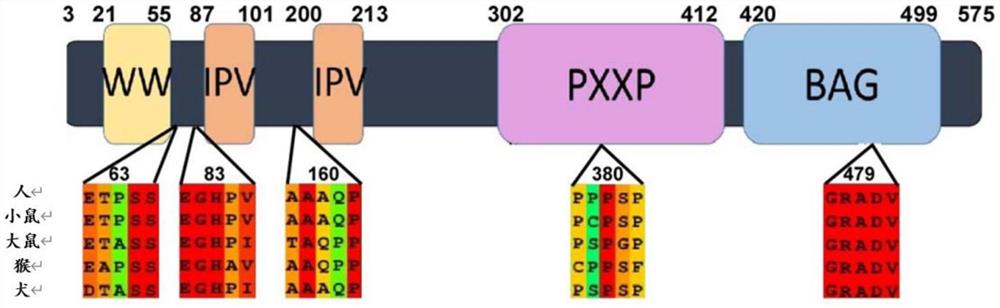
图1是BAG3的示意图,其显示单个非同义变体、单个3个核苷酸插入和双杂合体非同义变体的蛋白质结合结构域和位点。区块表示跨多种哺乳动物物种的氨基酸保守性。WW结构域与PXXP区域相互作用,以修饰BAG3的3维结构,并且还参与了伴侣辅助的选择性自噬(CASA)。IPV基序与小热激蛋白HspB8和HspB6相互作用,以支持巨噬细胞自噬。PXXP区促进与Src同源3(SH3)结构域的结合,以促进癌细胞的迁移和转移,并与动力蛋白复合物结合以促进细胞内蛋白转运至核周聚集体;BAG结构域与Bcl-2相互作用,导致细胞凋亡的抑制。
图2A-2C是Kaplan-Meier曲线,显示了具有或不具有BAG3遗传变体的患者的无事件生存率。图2A显示了所有具有或不具有BAG3变体的患者的无事件生存率。图2B显示具有或不具有BAG3变体的非缺血性HF患者的无事件生存率。图2C显示缺血性扩张型心肌病患者的无事件生存率。对于每一个比较,指示统计显著性。每组中的患者数量沿X轴表示。
图3A显示了用空质粒或含有野生型BAG3,c.187C>G+c.1138C>T(p.Pro63Ala+p.Pro380Ser),c.249C>A(p.His83Gln),c.474_476dupGGC(p.Ala160dup),或c.1436C>T(p.Ala479Val),并用Adv-RFP-GFP-LC3共转染的质粒转染的AC16细胞的代表性共聚焦图像。红色点代表自噬酶体中LC3的增加,其中GFP在溶酶体-自噬体融合后被增加的酸度淬灭。图3B是每种条件下来自8至42个细胞的图像的量化。图3C是用膜联蛋白-V(绿色)和碘化丙啶(红色)染色的AC16细胞的代表性共聚焦图像,以区分存活细胞和凋亡细胞。凋亡细胞呈现绿色,晚期凋亡和/或坏死细胞呈现红色,无活细胞呈现绿色和红色。图3D是每种条件下约200个细胞的图像的量化,其表示既不是绿色也不是红色的细胞的数量。
图4A是从患有特发性扩张型心肌病(n=23)或缺血性心脏病(n=16)或非衰竭对照(n=4)的继发性严重左心功能障碍的人心脏分离的蛋白质的代表性蛋白质印迹。从心脏中发现的携带BAG3变体的样品用红色方块标出,其编号为a-c。图4B显示了多种蛋白质印迹的定量。图4C显示了以GAPDH作为内部对照的衰竭缺血性扩张型心肌病(n=13),IDC(n=18)和未衰竭的人心脏(n=4)中BAG3的qPCR定量。
图5A-5C显示了人衰竭心脏中BAG3水平的代表性蛋白质印迹(图5A),多种蛋白质印迹的定量(图5B),人衰竭心脏中mRNA水平的定量(图5C)。数据显示,在没有BAG3突变且患有特发性扩张型心肌病或缺血性心肌病的患者中,BAG3的水平始终低于未衰竭的人心脏。在Al60Adup框内插入的情况下,BAG3水平也很低。相比之下,在P63A+P380S(带有顺式变体的双杂合子)和Ala479Val中,BAG3的水平实际上都升高了-这表明通过基因疗法添加外源BAG3可能对该基因型没有有益的作用。
图6A、6B是示出具有BAG3单倍功能不全和WtBAG3重构的心功能的图。为了评估普通(>1%)BAG3遗传变体的功能效果,将小鼠感染BAG3单倍功能不全,继之BAG3等位基因缺失,用腺相关病毒(AAV)血清型9,驱动BAG3的野生型或突变形式的转染。因为缺失BAG3中的一个等位基因的小鼠具有野生型小鼠中发现的BAG3含量的一半,所以当用AAV-BAG3感染时,正常水平的BAG3是充足的,从而减轻缺乏一个BAG3等位基因(cBAG3
图7A、7B是显示具有p.Pro63Ala+Pro380Ser表达的心功能的图。为了评估常见p.Pro63Ala+Pro380Ser遗传变体小鼠的作用,用AAV9-BAG3-WT或AAV9-BAG3-63/380感染小鼠。图7A显示了与cBAG3
图8A、8B是显示具有p.Ala479Val表达的心功能的图。为了评估Ala479Val的功能效果,向眶后空间注入AAV9-BAG3-Ala479Val。图8A:与AAV9-BAG3-63/380相比,AAV9-BAG3-A479V的眶后注射对具有正常基因型(BAG3
具体实施方案
下面对某些实施例的描述本质上仅是示例性的,绝不旨在限制本发明、其应用或用途。可以在没有提出理论方面的情况下实践本发明的实施例。此外,在提出理论方面的前提是申请人不希望受到提出的理论的束缚。
本发明部分基于以下发现:几乎仅在非洲血统美国人中发现的BAG3中独特的遗传变体的存在预示着具有不良后果的风险高出将近2倍。此外,还显示了评估遗传变体的致病性的重要性,以及在可能的情况下,显示它们与人心脏中蛋白质水平的关系。因此,在非洲血统个体中,BAG3突变在心血管病理生物学中发挥着重要作用。
Bcl-2相关的抗凋亡基因3(BAG3),也称为BCL2相关的抗凋亡基因3;MFM6;Bcl-2-结合蛋白Bis;CAIR-1;对接蛋白CAIR-1;BAG家族分子伴侣调节剂3;BAG-3;BCL2-结合的抗凋亡基因3;或BIS是与Hip-1竞争结合HSP 70的细胞保护性多肽。BAG3的NCBI参考氨基酸序列可在Genbank找到,登录号NP_004272.2;公共GI:14043024。Genbank登录号NP_004272.2,公共GI:14043024的氨基酸序列在本文中称为SEQ ID NO:1。BAG3的NCBI参考核酸序列可在Genbank找到,登录号为NM_004281.3,GI:62530382。Genbank登录号NM_004281.3,GI:62530382的核酸序列称为SEQ ID NO:2。其他BAG3氨基酸序列包括但不限于例如095817.3GI:12664365(SEQ ID NO:3);EAW49383.1 GI:119569768(SEQ ID NO:4);EAW49382.1 GI:ll9569767(SEQ ID NO:5);和CAE55998.1 GI:38502170(SEQ ID NO:6)。本发明的BAG3多肽可以是本文所述多肽的变体,只要其保留功能性即可。
组合物
已经将超过40个基因的遗传变体与DCM关联。其中一种这样的基因编码BAG3(与Bcl-2相关的抗凋亡基因3),它是一种进化保守的蛋白,主要在心脏、骨骼肌和许多癌症中表达。BAG3在心脏中具有多效性作用:它抑制细胞凋亡,促进自噬,介导兴奋收缩耦合,维持肌小节
因此,在特定的实施方案中,一种诊断和治疗患有心脏病的患者的方法包括:与对照BAG3核酸序列相比,在患者样品中识别至少一种Bcl2相关的抗凋亡基因3(BAG3)遗传变体,其中特定变体的检测预测BAG3水平的升高是否对患者具有治疗作用,并且向识别为具有这种变体的患者施用治疗有效量的制剂,其中与正常对照相比,该制剂调节靶细胞或组织中的BAG3分子、蛋白质或其肽的表达或量。
在特定的实施方案中,遗传变体是单核苷酸变体(SNV)框内插入、缺失、取代或其组合。在特定的实施方案中,SNV包括:p.Pro63Ala(10:121429369C/G;rs133031999);p.His83Gln(10:151331972;rs151331972);Pro380Ser(10:121436204C/T;rs144692954);Ala479Val(10:121436502C/T,rs34656239)或其组合。在一些实施方案中,框内插入编码氨基酸。在一些实施方案中,框内插入编码非极性氨基酸。在一些实施方案中,框内插入编码在位置160处的丙氨酸。
在进一步的实施方案中,一种治疗患有心脏病的患者的方法,其中与对照BAG3核酸序列相比,所述患者具有至少一个Bcl2相关的抗凋亡基因3(BAG3)核苷酸变体(NV)框内插入,该方法包括向患者施用治疗有效量的制剂,其中该制剂调节靶细胞或组织中BAG3分子、蛋白质或其肽的表达或量。
在特定的实施方案中,框内插入编码氨基酸。在特定的实施方案中,框内插入编码非极性氨基酸。在特定的实施方案中,框内插入包括在位置160处添加丙氨酸的3个核苷酸插入(p.Aal60dup,10:121429647A/AGCG;rs139438727)。
在特定的实施方案中,用于治疗具有IDC并被识别为在BCL2相关的抗凋亡基因3(BAG3)基因中具有遗传变体的患者的制剂,其中所述遗传变体其中特定变体的检测预测BAG3水平的增加是否对患者具有治疗作用。
在特定的实施方案中,用于治疗受试者中与BAG3及其相关分子和途径有关的疾病的治疗剂调节细胞中BAG3的表达或数量。在一些实施方案中,组合物包含BCL2相关的抗凋亡基因3(BAG3)的核酸序列,包括但不限于BAG3的cDNA、有义和/或反义序列。
在特定的实施方案中,所述制剂包含一种或多种基因编辑或核酸酶系统以删除或编辑受试者中的遗传变体,其中BAG3的增加将不是治疗性的,甚至可能对受试者有害。
可以使用任何合适的核酸酶系统,包括例如成簇的规则间隔的短回文重复(CRISPR)核酸酶,Argonaute家族核酸内切酶,锌指核酸酶(ZFN),转录激活因子样效应子核酸酶(TALEN),巨核酸酶,其他核酸内切酶或核酸外切核酸酶或其组合。参见Schiffer,2012,J Virol 88(17):8920-8936,通过引用并入。在特定的实施方案中,该系统是Argonaute核酸酶系统。
CRISPR/Cas:在特定的实施方案中,基因编辑剂包含簇状规则间隔的短回文重复序列(CRISPR)相关的内切核酸酶/Cas(CRISPR/Cas)。
在特定的实施方案中,CRISPR/Cas包含催化缺陷的Cas蛋白(dCas)、直系同源物、同系物、突变体变体或片段。
本文公开的组合物可以包括编码CRISPR相关核酸内切酶的核酸,例如Cas9。在细菌中,CRISPR/Cas基因座编码针对移动遗传元件(病毒、转座因子和结合质粒)的RNA引导的适应性免疫系统。已经确定了三种类型(I-III)的CRISPR系统。CRISPR簇包含间隔子,该间隔子与先前的移动元件互补。CRISPR簇被转录并加工成成熟的CRISPR RNA(crRNA)。CRISPR相关的核酸内切酶Cas9属于II型CRISPR/Cas系统,具有强大的核酸内切酶活性以切割靶DNA。Cas9由成熟的crRNA指导,该成熟的crRNA包含约20个碱基对(bp)的独特靶序列(称为间隔子)和用作核糖核酸酶III辅助的pre-crRNA的处理的引导物的反式激活的小RNA(tracrRNA)。crRNA:tracrRNA双链体通过crRNA上的间隔子和靶DNA上的互补序列(称为原间隔子(protospacer))之间的互补碱基配对将Cas9引导至靶DNA。Cas9识别三核苷酸(NGG)原间隔子相邻基序(PAM)以指定切割位点(来自PAM的第3核苷酸)。可以分别表达crRNA和tracrRNA,也可以通过合成茎环(AGAAAU)将其工程化为人工融合小向导RNA(sgRNA),以模拟天然crRNA/tracrRNA双链体。这种sgRNA(如shRNA)可以合成或体外转录以进行直接RNA转染,或从U6或H1促进的RNA表达载体表达,尽管人工sgRNA的切割效率低于单独表达crRNA和tracrRNA的系统的切割效率。
在实施方案中,CRISPR/Cas系统可以是I型、II型或III型系统。合适的CRISPR/Cas蛋白的非限制性实例包括Cas9,CasX,CasY.1,CasY.2,CasY.3,CasY.4,CasY.5,CasY.6,spCas,eSpCas,SpCas9-HF1,SpCas9-HF2,SpCas9-HF3,SpCas9-HF4,ARMAN 1,ARMAN 4,Cas3,Cas4,Cas5,Cas5e(或CasD),Cas6,Cas6e,Cas6f,Cas7,Cas8a1,Cas8a2,Cas8b,Cas8c,Cas9,Cas10,Cas10d,CasF,CasG,CasH,Csy1,Csy2,Csy3,Cse1(或CasA),Cse2(或CasB),Cse3(或CasE),Cse4(或CasC),Csc1,Csc2,Csa5,Csn2,Csm2,Csm3,Csm4,Csm5,Csm6,Cmr1,Cmr3,Cmr4,Cmr5,Cmr6,Csb1,Csb2,Csb3,Csx17,Csx14,Csx10,Csx16,CsaX,Csx3,Csz1,Csx15,Csf1,Csf2,Csf3,Csf4,和Cu1966。
Cas9可以是直向同源的。已经使用了六种较小的Cas9直向同源物,并且报告显示来自金黄色葡萄球菌(SaCas9)的Cas9可以编辑基因组,其效率与SpCas9相似,但短了1千多碱基。
除了所描述的野生型和变体Cas9核酸内切酶之外,本发明的实施方案还涵盖了CRISPR系统,其包括新开发的“增强特异性”化脓性链球菌Cas9变体(eSpCas9),其显著减少了离靶切割。这些变体用丙氨酸取代物进行工程改造,以中和与DNA的非靶链相互作用的凹槽中带正电荷的位点。该修饰的目的是减少Cas9与非靶链的相互作用,从而促进靶链与非靶链之间的再杂交。这种修饰的作用是在gRNA与靶DNA链之间需要更严格的Watson-Crick配对的要求,这会限制离靶切割(Slaymaker,I.M.等(2015)DOI:10.1126/science.aad5227)。
在特定的实施方案中,发现具有最佳切割效率和最少离靶效应的三种变体:SpCas9(K855A),SpCas9(K810A/K1003A/R1060A)(又称eSpCas91.0),和SpCas9(K848A/K1003A/R1060A)(又称eSPCas9 1.1)用于该组合物中。本发明并不限于这些变体,并且还涵盖所有Cas9变体(Slaymaker,IM等人(2015))。本发明还包括另一种类型的增强特异性Cas9变体,“高保真”spCas9变体(HF-Cas9)。高保真变体的示例包括SpCas9-HF1
(N497A/R661A/Q695A/Q926A),SpCas9-HF2
(N497A/R661A/Q695A/Q926A/D1135E),SpCas9-HF3(N497A/R661A/Q695A/Q926A/L169A),SpCas9-HF4(N497A/R661A/Q695A/Q926A/Y450A)。还包括带有N497A,R661A,Q695A,Q926A,或任何其它取代物的所有可能的单、双、三和四联组合的所有SPCAS9变体(Kleinstiver,B.P等人,2016,Nature.DOI:10.1038/Nature 16526)。
如本文所用,术语“Cas”是指包括变体,突变体,直向同源物,高保真变体等的所有Cas分子。
在一种实施方案中,内切核酸酶衍生自II型CRISPR/Cas系统。在其他实施方案中,核酸内切酶衍生自Cas9蛋白,包括Cas9、CasX、CasY.1、CasY.2、CasY.3、CasY.4、CasY.5、CasY.6、spCas、eSpCas、SpCas9-HF1、SpCas9-HF2、SpCas9-HF3、SpCas9-HF4、ARMAN 1、ARMAN4、突变体、变体、高保真变体、直向同源物、类似物、片段或其组合。Cas9蛋白可来自化脓性链球菌(Streptococcus pyogenes),嗜热链球菌(Streptococcus thermophilus),链球菌属种(Streptococcus sp.),达松维尔拟诺卡氏菌(Nocardiopsis dassonvillei),始旋链霉菌(Streptomyces pristinaespiralis)、产绿色链霉菌(Streptomycesviridochromogenes)、产绿色链霉菌,粉红链孢囊菌(Streptosporangium roseum)、酸热脂环酸杆菌(Alicyclobacillus acidocaldarius)、假蕈状芽孢杆菌(Bacilluspseudomycoides)、硒化还原芽孢杆菌(Bacillus selenitireducens),西伯利亚微小杆菌(Exiguobacterium sibiricum),德氏乳杆菌(Lactobacillus delbrueckii),唾液乳杆菌(Lactobacillus salivarius),海洋微颤菌(Microscilla marina),伯克霍尔德氏菌属细菌(Burkholderiales bacterium),萘降解极单胞菌(Polaromonas naphthalenivorans),单胞菌属种(Polaromonas sp.),瓦氏鳄球藻(Crocosphaera watsonii),蓝丝菌属种(Cyanothece sp.)、铜绿微囊藻(Microcystis aeruginosa),聚球藻属(Synechococcussp.),阿拉伯醋杆菌(Acetohalobium arabaticum),根制氨菌(Ammonifex degensii),热解纤维素菌(Caldicelulosiruptor becscii),脱硫菌候选种(Candidatus Desulforudis)、肉毒梭菌(Clostridium botulinum)、艰难梭菌(Clostridium difficile)、大芬戈尔德菌(Finegoldia magna)、嗜热盐碱厌氧菌(Natranaerobiusthermophilus)、Pelotomaculumthermopropionicum、嗜酸性喜温硫杆菌(Acidithiobacillus caldus)、嗜酸氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans)、酒色异着色菌(Allochromatium vinosum)、海杆菌属种(Marinobacter sp.)、嗜盐亚硝化球菌(Nitrosococcus halophilus)、瓦氏亚硝化球菌(Nitrosococcus watsoni)、游海假交替单胞菌(Pseudoalteromonas haloplanktis)、消旋纤线杆菌(Ktedonobacter racemifer)、调查甲烷盐菌(Methanohalobiumevestigatum)、多变鱼腥藻(Anabaena variabilis)、泡沫节球藻(Nodularia spumigena)、念珠藻属种(Nostoc sp.)、极大节旋藻(Arthrospira maxima)、钝顶节旋藻(Arthrospiraplatensis)、节旋藻属种(Arthrospira sp.)、林氏藻属种(Lyngbya sp.)、原型微鞘藻(Microcoleus chthonoplastes)、颤藻属种(Oscillatoria sp.)、运动石袍菌(Petrotogamobilis)、非洲栖热腔菌(Thermosipho africanus)或海洋无核氯菌(Acaryochlorismarina)。其中包括在纳米古生菌ARMAN-1(Candidatus Micrarchaeumacidiphilum ARMAN-1)、和ARMAN-4(Candidatus Parvarchaeum acidiphilum ARMAN-4)的基因组中编码的Cas9蛋白、CasY(Kerfeldbacteria,Vogelbacteria,卡坦菌门(Komeilibacteria),Katanobacteria),CasX(浮霉菌(Planctomycetes),δ变形菌纲(Deltaproteobacteria))。
通常,CRISPR/Cas蛋白包含至少一个RNA识别和/或RNA结合结构域。RNA识别和/或RNA结合域与导向RNA相互作用。CRISPR/Cas蛋白还可以包含核酸酶结构域(即DNase或RNase结构域)、DNA结合结构域、解旋酶结构域、RNAse结构域,蛋白质-蛋白质相互作用结构域、二聚化结构域以及其他结构域。活性DNA靶向的CRISPR-Cas系统使用位于靶序列附近的2至4个核苷酸与原间隔子相邻基序(PAM),以进行自体或非自体区分。ARMAN-1具有强的“NGG”PAM偏好。Cas9还采用了两种分离的转录子,即CRISPR RNA(crRNA)和反式激活CRISPRRNA(tracrRNA),用于RNA导向的DNA切割。在ARMAN-1和ARMAN-4CRISPR-Cas9系统附近均识别出推定的tracrRNA。
本发明的实施方式还包括在从地下水和沉积物样品中回收的两种细菌的基因组中发现的新型的2类CRISPR-Cas系统。该系统包括Cas1,Cas2,Cas4和称为CasX的大约980个氨基酸的蛋白质。在属于不同门(δ变形菌纲(Deltaproteobacteria)和浮霉菌(Planctomycetes))的两种生物中的蛋白的高度保守性(68%的蛋白质序列同一性)表明最近的跨门转移。与每个CasX相关的CRISPR阵列具有37核苷酸(nt),33-34nt的间隔子以及在Cas操纵子和CRISPR阵列之间的推定tracrRNA的高度相似的重复序列(86%相同)。远距离的同源性检测和蛋白质建模确定了CasX C末端附近的RuvC结构域,其组织结构让人联想到V型CRISPR-Cas系统中的结构。CasX蛋白的其余部分(630N-末端氨基酸)与任何已知蛋白均未发现可检测的相似性,表明这是一种新型的2类效应子。tracrRNA和单独的Cas1、Cas2和Cas4蛋白的组合在V型系统中是独特的,并且系统发育分析表明,来自CRISPR-CasX系统的Casl与任何其他已知的V型蛋白相距甚远。此外,CasX远远小于任何已知的V型蛋白:与Cpfl、C2c1和C2c3的典型大小为约1200个氨基酸相比,为980aa(Burstein,D.等人,2016,同上)。
在一些实施方案中,BAG3的核酸序列与野生型BAG3或其cDNA序列具有至少约50%的序列同一性。在其他实施方案中,BAG3核酸序列与野生型BAG3或其cDNA序列具有至少约75%,80%,85%,90%,95%,96%,97%,98%,99%的序列同一性。
在一些实施方案中,BAG3的核酸序列进一步包含一种或多种其突变、替代、缺失、变体或组合。
在一些实施方案中,包含一种或多种其突变,替代,缺失,变体或组合的BAG3核酸序列与BAG3的天然或野生型或cDNA序列之间的同源性、序列同一性或互补性为约50%至约60%。在一些实施方案中,同源性、序列同一性或互补性为约60%至约70%。在一些实施方案中,同源性、序列同一性或互补性为约70%至约80%。在一些实施方案中,同源性、序列同一性或互补性为约80%至约90%。在一些实施方案中,同源性、序列同一性或互补性为约90%,约92%,约94%,约95%,约96%,约97%,约98%,约99%或约100%。
在样品中检测到的变体预示着BAG3水平或活性的增加将是治疗性的情况下,将包含BAG3分子的制剂施用于该受试者。在一种实施方案中,表达载体编码BCL2相关的抗凋亡基因3(BAG3)基因或其cDNA序列或其修饰的序列。在一种实施方案中,表达载体编码与野生型BCL2相关的抗凋亡基因3(BAG3)或其cDNA序列具有至少约50%的序列同一性的核酸序列。在其他实施方案中,核酸序列包含与野生型BCL2相关的抗凋亡基因3(BAG3)或其cDNA序列至少约75%,80%,85%,90%,95%,96%,97%,98%,99%的序列同一性。
合适的核酸递送系统包括病毒载体,其通常是来自日本脂质体(HVJ)复合物的腺病毒、腺病毒相关病毒(AAV)、辅助性腺病毒、逆转录病毒或血凝病毒中的至少一种的序列。在特定的示例中,病毒载体包含与多核苷酸可操作地连接的强真核启动子,例如巨细胞病毒(CMV)启动子。
如果需要,本发明的多核苷酸也可以与微递送载体例如阳离子脂质体和腺病毒载体一起使用。对于脂质体制备,靶向和内容物递送的过程的综述,参见Mannino and Gould-Fogerite,BioTechniques,6:682(1988)。另请参阅Felgner and Holm,BethesdaRes.Lab.Focus,11(2):21(1989)及Maurer,R.A.,Bethesda Res.Lab.Focus,11(2):25(1989)。
复制缺陷的重组腺病毒载体可以根据已知技术生产。参见,Quantin等人,Proc.Natl.Acad.Sci.USA,89:2581-2584(1992);Stratford-Perricadet等人,J.Clin.Invest.,90:626-630(1992);和Rosenfeld等人,Cell,68:143-155(1992)。
另一种递送方法是使用可以在细胞内(例如心脏组织)产生BAG3的单链DNA产生载体。参见例如Chen等人,BioTechniques,34:167-171(2003),其通过引用整体并入本文。
BAG3的表达可以通过本领域已知的任何启动子/增强子元件来控制,但是这些调节元件必须在选择用于表达的宿主中起作用。在一些实施方案中,启动子是组织特异性启动子。特别感兴趣的是肌肉特异性启动子,更特别地,是心脏特异性启动子。这些包括肌球蛋白轻链2启动子(Franz等人(1994)Cardioscience,Vol.5(4):235-43;Kelly等人.(1995)J.Cell Biol.,Vol.129(2):383-396),α肌动蛋白启动子(Moss等人(1996)Biol.Chem.,Vol.271(49):31688-31694),肌钙蛋白1启动子(Bhaysar等人(1996)Genomics,Vol.35(1):11-23);Na+/Ca 2+交换启动子(Barnes等人(1997)J.Biol.Chem.,Vol.272(17):11510-11517),肌营养不良蛋白启动子(Kimura等人(1997)Dev.Growth Differ.,Vol.39(3):257-265),α7整联蛋白启动子(Ziober和Kramer(1996)J.Bio.Chem.,Vol.271(37):22915-22),脑利钠肽启动子(LaPointe等人(1996)Hypertension,Vol.27(3 Pt 2):715-22)和αB-晶状体蛋白/小热激蛋白启动子(Gopal-Srivastava(1995)J.Mol.Cell.Biol.,Vol.15(12):7081-7090),α肌球蛋白重链启动子(Yamauchi-Takihara等人(1989)Proc.Natl.Acad.Sci.USA,Vol.86(10):3504-3508)和ANF启动子(LaPointe等人(1988)J.Biol.Chem.,Vol.263(19):9075-9078)。
酵母表达系统也可以根据本发明用于表达BAG3。例如,仅提及两种,可以根据本发明使用非融合pYES2载体(Xbal、Sphl、Shol、Notl、GstXI、EcoRI、BstXI、BamH1、Sacl、Kpnl和Hindlll克隆位点;Invitrogen)或融合pYESHisA,B,C(Xbal,Sphl,根据本发明,可以使用Shol、NotI、BstXI、EcoRI、BamHI、Sac1、KpnI和HindIII克隆位点,用ProBond树脂纯化并用肠激酶切割的N-末端肽;Invitrogen)。可以根据本发明制备酵母双杂交表达系统。
一种示例性的递送系统是重组病毒载体,其在其中掺入了一个或多个多核苷酸,例如约一个多核苷酸。用于本发明方法的示例性病毒载体具有约10
在一些实施方案中,载体是腺病毒相关病毒载体(AAV),例如,AAV9。术语“AAV载体”是指衍生自腺相关病毒血清型的载体,包括但不限于AAV-1、AAV-2、AAV-3、AAV-4、AAV-5、AAV-6、AAV-7和AAV-8。AAV载体可以具有全部或部分缺失的AAV野生型基因中的一个或多个,例如rep和/或cap基因,但保留功能性侧翼ITR序列。尽管具有高度的同源性,但不同的血清型对于不同的组织仍具有趋向性AAV1的受体未知;但是,已知AAV1比AAV2更有效地转导骨骼肌和心肌。由于大多数研究是针对假型载体进行的,其中将具有AAV2 ITR侧翼的载体DNA包装到其他血清型的衣壳中,显然,生物学差异与衣壳而不是基因组有关。最近的证据表明,包装在AAV 1衣壳中的DNA表达盒比包装在AAV2衣壳中的DNA表达盒在转导心肌细胞上的效率至少高1 log 10。在一种实施方案中,病毒递送系统是腺相关病毒递送系统。腺相关病毒可以是血清型1(AAV 1)、血清型2(AAV2)、血清型3(AAV3)、血清型4(AAV4)、血清型5(AAV5)、血清型6(AAV6)、血清型7(AAV7)、血清型8(AAV8)或血清型9(AAV9)。
本领域技术人员通过使用腺病毒“杂交”病毒规避了基于腺病毒的载体的某些局限性,该病毒并入了腺病毒以及其他类型的病毒的合乎理想的特征,作为产生具有高度特异性的独特载体的手段。例如,在腺病毒和腺相关病毒(AAV)之间产生了病毒载体嵌合体。本发明的这些方面不脱离本文描述的本发明的范围。
可以通过本领域已知的方法将编码本发明的BAG3蛋白的核酸递送至心肌。例如,可以通过包括通过在施用核酸之前和/或同时对所述哺乳动物施用血管扩张物质来扩张冠状动脉的血管的方法来转染大型哺乳动物的心脏细胞。在一些实施方案中,该方法包括在体内将核酸施用到冠状动脉循环的血管中,其中在至少约三分钟的时间段内将核酸注入到血管中,其中冠状动脉循环与哺乳动物的体循环不是分离的或基本上不分离的,并且其中核酸转染哺乳动物的心脏细胞。
在一些实施方案中,受试者可以是人,实验动物(例如大鼠或小鼠),家畜(例如狗、牛、羊、猪或马)或非人灵长类动物(例如,猴)。受试者可能患有心脏疾病,例如心力衰竭、局部缺血、心肌梗塞、充血性心力衰竭、心律不齐、移植排斥等。在一种实施方案中,受试者患有心力衰竭。在另一种具体的实施方案中,受试者患有心律不齐。在一种实施方案中,受试者是人。例如,受试者在18至65岁之间。在另一种实施方案中,受试者是非人类动物。
在一种实施方案中,受试者患有心力衰竭或处于心力衰竭的风险,例如非缺血性心肌病、二尖瓣返流、缺血性心肌病或主动脉瓣狭窄或返流。
在一些实施方案中,用编码BAG3蛋白或与效应子域融合的BAG3蛋白的核酸分子转染心肌细胞增加了侧室部分缩短。在一些实施方案中,哺乳动物是人类,疾病是充血性心力衰竭。在一些实施方案中,当在输注后约4个月测量时,与多核苷酸输注之前的侧室部分缩短相比,心肌细胞的转染使侧室部分缩短增加了至少25%。在一些实施方案中,心肌细胞的转染导致心脏功能的量度的改善,该量度选自BAG3蛋白的表达、部分缩短、射血分数、心输出量、心室舒张时间常数和反流体积。
可以通过评估对与收缩性有关的参数的治疗效果来评估治疗。例如,可以测量SRCa
修饰的核酸序列:并非意图使本发明受到所用核酸的性质的限制。核酸可以是DNA或RNA,并且可以以双链、单链或部分双链的形式存在。
用于本发明的核酸包括,例如但不限于,寡核苷酸和多核苷酸,例如反义DNA和/或RNA;核酶;shRNA;抑制性核酸;用于基因治疗的DNA;病毒片段,其包括病毒DNA和/或RNA;DNA和/或RNA嵌合体;mRNA;质粒;粘粒;基因组DNA;cDNA;基因片段;各种结构形式的DNA,包括单链DNA、双链DNA、超螺旋DNA和/或三螺旋DNA;Z-DNA;等等。可以通过通常用于大量制备核酸的任何常规方法来制备核酸。例如,可以使用可商购的制剂和合成仪通过本领域公知的方法化学合成DNA和RNA(参见,例如,Gait,1985,Oligonucleotide Synthesis:APractical Approach(IRL Press,Oxford,England))。可以使用质粒,例如pGEM
因此,本发明的某些核酸序列是嵌合核酸序列。在本发明的上下文中,“嵌合核酸序列”或“嵌合体”包含两个或更多个化学上不同的区域,每个区域由至少一个核苷酸组成。这些序列通常含有赋予一种或多种有益的性质(诸如,例如,增加的核酸酶抗性,增加的细胞内摄取,增加的对靶标的结合亲和力)的修饰的核苷酸的至少一个区域。
本发明的嵌合核酸序列可以形成为两个或更多个寡核苷酸,修饰的寡核苷酸,寡核苷和/或寡核苷酸模拟物的复合结构。这样的化合物在本领域中也被称为杂合体或间隔体。教导制备此类杂化结构的代表性美国专利包括但不限于美国专利No.5,013,830;5,149,797;5,220,007;5,256,775;5,366,878;5,403,711;5,491,133;5,565,350;5,623,065;5,652,355;5,652,356;和5,700,922,其每个通过引用并入本文。
本发明设想的一些修饰的核酸序列的具体实例包括那些包含修饰的主链的序列,例如,硫代磷酸酯,磷酸三酯,甲基膦酸酯,短链烷基或环烷基糖间键或短链杂原子或杂环糖间键。在一些实施方案中,修饰的寡核苷酸包括具有硫代磷酸酯主链的寡核苷酸和具有杂原子主链的寡核苷酸,CH
示例性的修饰寡核苷酸主链包括但不限于硫代磷酸酯,手性硫代磷酸酯,二硫代磷酸酯,磷酸三酯,氨基烷基磷酸三酯,包含3'亚烷基膦酸酯和手性膦酸酯的甲基膦酸酯和其他烷基膦酸酯,次膦酸酯,包含3'-氨基磷酰胺酸酯和氨基烷基磷酰胺酸酯的氨基磷酸酯,硫代磷酰胺酸酯,具有正常3'-5'键的硫代烷基膦酸酯,硫代烷基磷酸三酯和硼酸磷酸酯,它们的2'-5'连接类似物以及极性反转的类似物,其中相邻的核苷单元对是连接的3'-5'至5'-3'或2'-5'至5'-2'。也包括各种盐、混合盐和游离酸形式。
在其中不包括磷原子的示例性修饰寡核苷酸主链具有由短链烷基或环烷基核苷键,混合的杂原子和烷基或环烷基核苷键或一个或多个短链杂原子或杂环核苷键形成的主链。这些主链包括具有吗啉代键(部分由核苷的糖部分形成)的主链;硅氧烷主链;硫化物、亚砜和砜主链;乙酰基和硫代甲胺基主链;亚甲基甲酰基和硫代甲酰基主链;含烯烃的主链;氨基磺酸盐主链;亚甲基亚氨基和亚甲基肼基主链;磺酸盐和磺酰胺主链;酰胺主链;以及具有混合的N、O、S和CH
核酸序列还可以另外地或可替代地包括核碱基(在本领域中通常简称为“碱基”)修饰或取代。如本文所用,“未修饰的”或“天然的”核苷酸包括腺嘌呤(A)、鸟嘌呤(G)、胸腺嘧啶(T)、胞嘧啶(C)和尿嘧啶(U)。修饰的核苷酸包括仅在天然核酸中很少或暂时发现的核苷酸,例如次黄嘌呤,6-甲基腺嘌呤,5-Me嘧啶,特别是5-甲基胞嘧啶(也称为5-甲基-2'脱氧胞嘧啶,在本领域中通常称为5-Me-C),5-羟甲基胞嘧啶(HMC),糖基HMC和gentobiosylHMC,以及合成核苷酸,例如2-氨基腺嘌呤,2-(甲基氨基)腺嘌呤,2-(咪唑基烷基)腺嘌呤,2-(氨基烷基氨基)腺嘌呤或其他杂取代的烷基腺嘌呤,2-硫尿嘧啶,2-硫胸腺嘧啶,5-溴尿嘧啶,5-羟甲基尿嘧啶,8-氮杂鸟嘌呤,7-脱氮鸟嘌呤,N6(6-氨基己基)腺嘌呤和2,6-二氨基嘌呤。(Kornberg,A.,DNA Replication,W.H.Freeman&Co.,San Francisco,1980,pp 75-77;Gebeyehu,G.,(1987)等人Nucl.Acids Res.15:4513)。可以包括本领域已知的“通用”碱,例如肌苷。
另一种修饰涉及将增强寡核苷酸的活性或细胞摄取的一个或多个部分或偶联物化学连接至寡核苷酸。这样的部分包括但不限于脂质部分,例如胆固醇部分,胆固醇基部分,胆酸,硫醚,例如己基-5-三苯硫醇,脂族链例如十二烷二醇或十一烷基残基,磷脂例如二-十六烷基-外消旋-甘油或1,2-二-O-十六烷基-外消旋-甘油-3-H-膦酸酯,多胺或聚乙二醇链或金刚烷乙酸。包含亲脂性部分的核酸序列以及制备此类寡核苷酸的方法在本领域中是已知的,例如,美国专利5,138,045,5,218,105和5,459,255。
不必对给定核酸序列中的所有位置进行均匀修饰,并且实际上,可以将多个上述修饰中的一个以上并入单个核酸序列中,或者甚至在此类序列中的单个核苷内。本发明还包括寡核苷酸,其是如上文所定义的嵌合寡核苷酸。
在另一种实施方案中,本发明的BAG3核酸分子与另一部分偶联,所述另一部分包括但不限于脱碱基核苷酸、聚醚、聚胺、聚酰胺、肽、碳水化合物、脂质或聚烃化合物。本领域技术人员将认识到,这些分子可以在糖、碱基或磷酸基团上的几个位置处与包含核酸分子的任何核苷酸中的一个或多个连接。
在另一种实施方案中,BAG3核酸序列包含一个或多个被锁核酸(LNA)取代的核苷酸。LNA修饰的核酸序列可以具有与亲本或天然序列相似的大小,或者可以更大或更小。此类LNA修饰的寡核苷酸可包含少于约70%,或少于约60%,或少于约50%的LNA单体,并且它们的大小在约1至25个核苷酸之间。
反义BAG3-寡核苷酸:在另一种实施方案中,可能有必要降低包含一种或多种变体的BAG3的表达,该变体通过寡核苷酸调节BAG3的表达(例如,转录调节元件)来预测细胞或患者的治疗结果。
在一种实施方案中,寡核苷酸包含与核酸序列互补的至少五个连续碱基,其中所述寡核苷酸在体内或体外特异性杂交BAG3并调节BAG3的表达。在另一种实施方案中,本发明的寡聚化合物还包括其中化合物中核苷酸位置中的一个或多个存在不同碱基的变体。例如,如果第一个核苷酸是腺苷,则可以产生在该位置含有胸苷、鸟苷或胞苷的变体。这可以在寡核苷酸的任何位置进行。然后使用本文所述的方法测试这些化合物以确定它们抑制靶核酸表达的能力。
在一些实施方案中,寡核苷酸与靶标之间的同源性、序列同一性或互补性为约50%至约60%。在一些实施方案中,同源性、序列同一性或互补性为约60%至约70%。在一些实施方案中,同源性、序列同一性或互补性为约70%至约80%。在一些实施方案中,同源性、序列同一性或互补性为约80%至约90%。在一些实施方案中,同源性、序列同一性或互补性为约90%、约92%、约94%、约95%、约96%、约97%、约98%、约99%或约100%。
在另一种实施方案中,寡核苷酸包含硫代磷酸酯核苷酸间键和至少一个核苷酸间键的组合,所述至少一个核苷酸间键选自:烷基膦酸酯、二硫代磷酸酯、烷基硫代磷酸酯、氨基磷酸酯、氨基甲酸酯、碳酸酯、磷酸三酯、乙酰亚胺酯、羧甲基酯和/或其组合。
在另一种实施方案中,寡核苷酸任选地包含至少一种修饰的核碱基,其包含肽核酸、锁核酸(LNA)分子、类似物、衍生物和/或其组合。
当化合物与靶核酸的结合干扰靶核酸的正常功能以导致活性丧失时,寡核苷酸是特异性杂交的,并且具有足够程度的互补性以避免寡核苷酸在需要特异性结合的条件下与非靶核酸序列的非特异性结合。这样的条件包括,即在体内测试或治疗处理的情况下的生理条件,以及在体外测试的情况下进行测试的条件。
当化合物与靶DNA或RNA分子的结合干扰靶DNA或RNA的正常功能以致丧失效用时,寡核苷酸,无论是DNA、RNA、嵌合的、取代的等,均可特异性杂交,并且在需要特异性结合的条件下,即在体内测试或治疗处理的情况下的生理条件下,以及在体外测试的情况下,在进行测试的条件下,有足够程度的互补性来避免寡核苷酸与非靶序列的非特异性结合。
本领域技术人员还可以将反义的特异性和敏感性用于治疗用途。反义寡核苷酸已被用作治疗动物和人类疾病状态的治疗部分。已经将反义寡核苷酸安全有效地施用于人,并且目前正在进行许多临床试验。因此,证明了寡核苷酸可以是有用的治疗方式,其可以被配置成治疗细胞、组织和动物,特别是人的治疗方案。
在本发明的实施方案中,寡聚寡核苷酸,特别是寡核苷酸,与靶核酸分子结合并调节由BAG3基因编码的分子的表达,该BAG3基因包含将从BAG3的增加或是否缺失、替代或其中所用制剂对该特定受试者在治疗上有益处的一些其他机制中受益的一种或多种变体。待干扰的DNA的功能包括例如复制和转录。待干扰的RNA的功能包括所有重要功能,例如,RNA到蛋白质翻译位点的易位,来自RNA的蛋白质的翻译,RNA的剪接以产生一种或多种mRNA的种类以及可能参与RNA或由RNA促进的催化活性。取决于期望的功能,可以上调或禁止功能。
寡核苷酸包括反义寡聚化合物,反义寡核苷酸,外部引导序列(EGS)寡核苷酸,交替剪接物,引物,探针和与靶核酸的至少一部分杂交的其他寡聚化合物。因此,可以以单链、双链、部分单链或环状低聚化合物的形式引入这些化合物。
在本发明的上下文中,将寡核苷酸靶向特定的核酸分子可以是多步过程。该过程通常从识别其功能将被调节的靶核酸开始。该靶核酸可以是例如其表达与特定病症或疾病状态相关的细胞基因(或从该基因转录的mRNA)。
靶向过程通常还包括确定靶核酸内至少一个靶区域、区段或位点,以使反义相互作用发生,从而将产生期望的作用,例如表达的调节。在本发明的上下文中,术语“区域”定义为靶核酸的具有至少一种可识别的结构、功能或特征的部分。靶核酸的区域内是区段。“区段”定义为靶核酸内的区域的较小部分或亚部分。本发明中使用的“位点”定义为靶核酸内的位置。
在另一种实施方案中,反义寡核苷酸结合至靶多核苷酸的编码和/或非编码区,并调节靶分子的表达和/或功能。
在另一种实施方案中,反义寡核苷酸与天然反义多核苷酸结合并调节靶分子的表达和/或功能。“功能”的例子可以是抑制转录的负调节子,从而允许所需分子例如BAG3的表达增加的功能。
在另一种实施方案中,反义寡核苷酸结合有义多核苷酸并调节靶分子的表达和/或功能。
在本发明的实施方案中,寡核苷酸结合至特定靶标的反义链。寡核苷酸的长度为至少5个核苷酸,并可以合成使得每个寡核苷酸靶向重叠的序列,使得合成寡核苷酸以覆盖靶多核苷酸的全长。靶标还包括编码区域和非编码区域。
根据本发明,反义化合物包括反义寡核苷酸,核酶,外部引导序列(EGS)寡核苷酸,siRNA化合物,单链或双链RNA干扰(RNAi)化合物,例如siRNA化合物,和与靶核酸的至少一部分杂交并调节其功能的其他寡聚化合物。因此,它们可以是DNA、RNA、类DNA、类RNA或其混合物,或者可以是这些中的一种或多种的模拟物。这些化合物可以是单链、双链、环状或发夹状的寡聚化合物,并且可以包含结构元件,例如内部或末端凸起、错配或环。反义化合物通常是线性制备的,但是可以连接或以其他方式制备成环状和/或分支的。反义化合物可包括构建体,例如,杂交以形成完整或部分双链化合物的两条链,或具有足够的自互补性以允许杂交并形成完整或部分双链化合物的单链。两条链可以在内部连接,留下自由的3'或5'末端,或者可以连接以形成连续的发夹结构或环。发夹结构可包含在5'或3'末端上的突出部,从而产生单链特征的延伸。双链化合物可以任选地包括在末端上的突出部。进一步的修饰可包括连接至末端中的一种、选定的核碱基位置、糖位置或核苷键合中的一种的偶联物基团。或者,两条链可以通过非核酸部分或链接基团连接。当仅由一条链形成时,dsRNA可以采取自互补发夹型分子的形式,该分子自身会加倍以形成双链体。因此,dsRNA可以是完全或部分双链的。可以通过在转基因细胞系中稳定表达dsRNA发夹来实现基因表达的特异性调节,但是,在特定的实施方案中,基因表达被上调。当由两条链或以自身互补发夹型分子形式加倍形成双链体的单链形成时,两条链(或单链的双链体形成区域)是以Watson-Crick方式碱基配对的互补RNA链。
在另一种实施方案中,所需的寡核苷酸或反义化合物包含以下至少一种:反义RNA,反义DNA,嵌合反义寡核苷酸,包含修饰键的反义寡核苷酸,干扰RNA(RNAi),短干扰RNA(siRNA);微小干扰RNA(miRNA);短暂的小RNA(stRNA);或短发夹RNA(shRNA);小RNA诱导的基因激活(RNAa);小激活RNA(saRNA)或其组合。
dsRNA还可以激活基因表达,该机制已经被称为“小RNA诱导的基因激活”或RNAa。靶向基因启动子的dsRNA诱导相关基因的有效转录激活。使用合成的dsRNA(称为“小激活RNA”(saRNA))在人细胞中证明了RNAa。
小双链RNA(dsRNA)也可以充当小激活RNA(saRNA)。不希望受到理论的束缚,通过靶向基因启动子中的序列,saRNA将以称为dsRNA诱导的转录激活(RNAa)的现象诱导靶向基因表达。
在一些实施方案中,核糖核酸序列对于控制BAG3的转录的基因组的调控片段是特异性的。因此,候选治疗剂可以是激活细胞中BAG3表达的dsRNA,并被施用至需要治疗的患者。
肽:在另一种实施方案中,BAG3肽由包含BCL2相关的抗凋亡基因3(BAG3)野生型、其嵌合或cDNA序列的核酸编码。所述肽也可以是BCL2相关的抗凋亡基因3(BAG3)的合成肽。
应当理解,肽序列不限于BCL2相关的抗凋亡基因3(BAG3)分子的天然序列或其cDNA序列。本领域技术人员将认识到,可以进行保守的氨基酸改变,尽管它们改变了蛋白质或肽的主要序列,但通常不会改变其功能。保守氨基酸取代通常包括以下组内的取代物:甘氨酸,丙氨酸,缬氨酸,异亮氨酸,亮氨酸;天冬氨酸,谷氨酸,天冬酰胺,谷氨酰胺,丝氨酸,苏氨酸,赖氨酸,精氨酸,苯丙氨酸,酪氨酸。
还可基于多种类型的氨基酸进行保守取代:脂族(缬氨酸、异亮氨酸、亮氨酸和丙氨酸);带电荷的(天冬氨酸、谷氨酸、赖氨酸,精氨酸和组氨酸);芳香族残基(苯丙氨酸、酪氨酸和色氨酸);和含硫(蛋氨酸和半胱氨酸)。多肽序列BCL2相关的抗凋亡基因3(BAG3)核酸序列或其cDNA序列具有至少约68%的同一性,至少约70%的同一性或至少约71%的同一性的。
两个核苷酸或氨基酸序列之间的同一性百分比的确定可以使用数学算法来完成。例如,可用于比较两个序列的数学算法是Karlin和Altschul(1990,Proc.Natl.Acad.Sci.USA 87:2264-2268)的算法,如Karlin和Altschul(1993,Proc.Natl.Acad.Sci.USA 90:5873-5877)所修改的。该算法被合并入Altschul等人(1990,J.Mol.Biol.215:403-410)的NBLAST和XBLAST程序,并且可以例如在具有通用资源定位器的国家生物技术信息中心(NCBI)万维网站点上进行访问。http://blast(dot)ncbi(dot)nlm(dot)nih(dot)gov/blast.cgi/。可以使用以下参数,使用NBLAST程序(在NCBI网站上指定为“blastn”)进行BLAST核苷酸搜索:缺口罚分=5;缺口延伸罚分=2;不匹配罚分=3;匹配奖励=1;期望值10.0;和字长=11以获得与本文所述核酸同源的核苷酸序列。可以使用以下参数,使用XBLAST程序或NCBI“blastp”程序执行BLAST蛋白质搜索:期望值10.0,BLOSUM62评分矩阵,以获得与本文所述蛋白质分子同源的氨基酸序列。为了获得用于比较目的的缺口比对,可以如Altschul等人所述(1997,Nucleic Acids Res.25:3389-3402)中使用Gapped BLAST。或者,PSI-Blast或PHI-Blast可用于执行迭代搜索,该搜索检测分子之间的远距离关系和共享共同模式的分子之间的关系。当使用BLAST,Gapped BLAST,PSI-Blast和PHI-Blast程序时,可以使用各个程序(例如XBLAST和NBLAST)的缺省参数。在计算同一性百分比时,通常会计算出完全匹配。
本发明的实施方案还包括编码杂合蛋白的多核苷酸,所述杂合蛋白包含通过肽接头可操作地直接或间接融合至第二多肽序列的BCL2相关的抗凋亡基因3(BAG3)多肽。接头序列是本领域众所周知的。在一种实施方案中,杂合蛋白包含可操作地融合至可检测部分的BAG3多肽或BAG3多肽,例如报道多肽,其中所述报道多肽直接或间接融合至BAG3多肽的N-或C-末端。示例性的报道多肽包括荧光素酶(LUC),绿色荧光蛋白(GFP)和GFP衍生物。
除了报道多肽以外或代替报道多肽,包含BAG3多肽或其片段的杂合蛋白可以连接至其他类型的多肽。这些另外的多肽可以是用于肽的纯化、识别和/或治疗或预防应用的任何氨基酸序列。另外,另外的多肽可以是信号肽或靶向肽等。
在某些情况下,其他添加、取代或缺失可增加多肽的稳定性(包括但不限于对蛋白水解降解的抗性)或增加多肽对其适当的受体、配体和/或结合蛋白的亲和力。在某些情况下,其他添加、取代或缺失可增加多肽的溶解度。在一些实施方案中,为了增加在重组宿主细胞中表达后增加多肽溶解度的目的,除了用于掺入非天然氨基酸的另一个位点之外,选择位点以取代天然编码或非天然氨基酸。在一些实施方案中,所述多肽包含另一种添加,取代或缺失,其针对相关配体、结合蛋白和/或受体调节亲和力,调节(包括但不限于,增加或减少)受体二聚化、稳定受体二聚体,调节循环半衰期,调节释放或生物利用度,促进纯化,或者改善或改变特定的施药途径。类似地,非天然氨基酸多肽可包含化学或酶切割序列,蛋白酶切割序列,反应性基团,抗体结合结构域(包括但不限于FLAG或poly-His)或其他基于亲和力的序列(包括但不限于FLAG、poly-His、GST等)或改善检测(包括但不限于GFP)、纯化、通过组织或细胞膜运输、前药释放或激活,缩小尺寸,或多肽的其他特征的连接分子(包括但不限于生物素)。
本文所述的方法和组合物包括将一种或多种非天然氨基酸掺入多肽。可以在不破坏多肽活性的一个或多个特定位置掺入一种或多种非天然氨基酸。这可以通过进行“保守”取代来实现,包括但不限于用非天然或天然疏水性氨基酸取代疏水性氨基酸,用非天然或天然大体积氨基酸取代大体积氨基酸,用非天然或天然亲水性氨基酸取代亲水性氨基酸)和/或将非天然氨基酸插入不需要活性的位置。
可以采用多种生物化学和结构方法来选择所需的位点,以用多肽内的非天然氨基酸取代。多肽链的任何位置都适合于选择以掺入非天然氨基酸,并且选择可以基于合理的设计或通过随机选择以达到任何目的或没有特定期望目的。所需位点的选择可基于产生非天然氨基酸多肽(可进一步修饰或保持未修饰)具有任何所需的性能或活性,包括但不限于激动剂,超级激动剂,部分激动剂,反向激动剂,拮抗剂,受体结合调节剂,受体活性调节剂,与结合物伴侣结合的调节剂,结合物伴侣活性调节剂,结合物伴侣构象调节剂,二聚体或多聚体形成,与天然分子相比活性或性质没有改变,或操纵多肽的任何物理或化学性质,如溶解性、聚集性或稳定性。例如,可以使用包括但不限于点突变分析,丙氨酸扫描或同源物扫描方法的方法来识别多肽的生物活性所需的多肽中的位置。除了那些通过包括但不限于丙氨酸或同源物扫描诱变的方法识别为对生物活性关键的残基之外,根据多肽所需的活性,这些残基可能是用非天然氨基酸取代的良好候选物。或者,再次取决于多肽所需的活性,被识别为对生物活性关键的位点也可以是用非天然氨基酸取代的良好候选物位点。另一种替代方式是在多肽链的每个位置用非天然氨基酸进行序列取代,并观察对多肽活性的影响。用于选择用非天然氨基酸取代成任何多肽的位置的任何手段、技术或方法适用于本文所述的方法、技术和组合物。
候选制剂和筛选测试
本文体现的组合物也可以应用于药物发现和靶标验证的领域。本发明包括本文体现的核酸序列和肽在药物发现研究中的用途,以阐明Bcl-2相关的抗凋亡基因-3(BAG3)多核苷酸与疾病状态、表型或病状之间存在的关系。该方法包括在患者样品中识别与对照BAG3核酸序列相比的至少一种Bcl2相关的抗凋亡基因3(BAG3)遗传变体;以及向识别为具有BAG3遗传变体的患者施用治疗有效量的制剂,其中与正常对照相比,该制剂调节靶细胞或组织中BCL2相关的抗凋亡基因3(BAG3)分子、蛋白质或肽的表达或量。在特定的实施方案中,遗传变体是单核苷酸变体(SNV)框内插入、缺失、取代或其组合。在特定的实施方案中,SNV包括:p.Pro63Ala(10:121429369C/G;rs133031999);p.His83Gln(10:151331972;rs151331972);Pro380Ser(10:121436204C/T;rs144692954);Ala479Val(10:121436502C/T,rs34656239)或其组合。在特定的实施方案中,框内插入编码氨基酸。在特定的实施方案中,框内插入编码非极性氨基酸。在某些实施例中,框内插入编码在位置160处的丙氨酸。
本发明的筛选测试法适当地包括并体现为动物模型、基于细胞的系统和基于非细胞的系统。本文体现的核酸序列和肽用于识别感兴趣的治疗剂,治疗目的的药物,例如通过筛选化合物文库或通过多种药物筛选或分析技术或新化合物的合成中的任何一种来识别感兴趣的化合物。在这种筛选中使用的基因、等位基因、片段或其寡肽可以在溶液中游离,附着在固体支持物上,携带在细胞表面或位于细胞内。如以下实例部分中详细描述的那样进行测量。在实施方案中,进行筛选候选制剂以识别那些调节BAG3翻译的制剂。
测试可以是体外或体内形式的。感兴趣的体外形式包括基于细胞的形式,其中例如通过将底物引入存在细胞的介质例如水性介质中而发生接触。在其他实施方案中,该测试可以是体内的,其中使用了包括该细胞的多细胞生物。编码本文中包含的核酸序列的靶向载体与靶细胞的接触可以使用任何方便的方案来实现。在靶细胞作为多细胞生物例如动物的一部分存在的那些实施方案中,将载体方便地施用于(例如注射、饲喂等)多细胞生物,例如整个动物,其中施用可以是全身性或局部性的,例如直接至多细胞生物的特定组织和/或器官。
感兴趣的多细胞生物包括但不限于:昆虫,脊椎动物,例如禽类,例如鸡;哺乳动物,包括啮齿类动物,例如小鼠,大鼠;有蹄类动物,例如猪,牛,马;狗,猫,灵长类动物,例如猴子,猿,人;等等。因此,感兴趣的靶细胞包括但不限于:昆虫细胞,脊椎动物细胞,特别是禽类细胞,例如鸡细胞;哺乳动物细胞,包括鼠,猪,有蹄类,羊,马,大鼠,狗,猫,猴和人细胞;等等。
在特定的实施方案中,以高通量(HT)格式执行本发明的方法。在本发明的主题HT实施方案中,同时测定或测试多个不同的细胞。同时测试是指多个电池中的每个基本同时进行测试。通常,在本发明的HT方法中同时测试的细胞数量为约10至10,000个,通常为约100至10,000个,并且在特定的实施方案中为约1000至5000个。用于确定候选制剂的活性的多种高通量筛选测试法在本领域中是已知的,并且容易适用于本发明,包括例如在Schultz(1998)Bioorg Med Chem Lett 8:2409-2414;Fernandes(1998)Curr Opin Chem Biol 2:597-603;以及美国专利No.6,127,133中所描述的方法;其公开内容在此引入作为参考。
在实施方案中,可检测部分与感兴趣的制剂偶联,其中可检测部分包括:发光部分、化学发光部分、荧光部分、生物发光部分、酶、天然或合成部分。
候选制剂:该方法可以用任何测试化合物作为候选制剂来实施。可以使用本领域已知的组合文库方法中的多种方法中的任何一种来获得可用于实施本发明方法的测试化合物,包括生物学文库,空间可寻址的平行固相或溶液相文库,需要解卷积的合成文库方法,“一珠一化合物”文库方法,以及使用亲和色谱选择的合成文库方法。生物学文库方法限于肽文库,而其他四种方法适用于化合物的肽、非肽寡聚物或小分子文库(Lam,1997,Anticancer Drug Des.12:145)。
用于合成分子文库的方法的示例可以在本领域中找到,例如,在:DeWitt等人,1993,Proc.Natl.Acad.Sci.USA 90:6909-6913;Erb等人,1994,Proc.Natl.Acad.Sci.USA91:11422-11426;Zuckermann等人,1994,J.Med.Chem.37:2678-2685;Cho等人,1992,Science 261:1303-1305;Carell等人,1994,Angew.Chem.Int.Ed.Engl.33:2059-2061;Carell等人,1994,Angew.Chem.Int.Ed.Engl.33:2061-2064;和Gallop等人,1994,J.Med.Chem.37:1233-1251。
化合物库可存在于溶液中(例如Houghten,1992,Bio/Techniques13:412-421),或存在于珠(Lam,1991,Nature 354:82-84),芯片(Fodor,1993,Nature 364:555-556),细菌(美国专利号5,223,409),孢子(美国专利号5,571,698;5,403,484;和5,223,409),质粒(Cull等人,1992,Proc.Natl.Acad.Sci.USA 89:1865-1869)或噬菌体(Scott和Smith,1990,Science249:386-390;Devlin,1990,Science 249:404-406;Cwirla等人,1990,Proc.Natl.Acad.Sci.USA 87:6378-6382;and Felici,1991,J Mol.Biol.222:301-310)。
可以筛选的市售文库包括但不限于TimTec天然产物文库(NPL),NPL-640和TimTecNDL-3000文库。也可以筛选包含以多胺为模型的化合物(即多胺类似物)的文库。
在特定的实施方案中,候选制剂是小分子或大分子配体。小分子配体是指大小范围为约50至约10,000道尔顿,通常为约50至约5,000道尔顿,更通常为约100至约1000道尔顿的配体。大分子是指大小范围为约10,000道尔顿或更大分子量的配体。
可以使用不同浓度的测试候选物和/或不同的测试条件(例如反应时间的持续时间)来迭代地实践该方法。可以通过本领域的常规方法进一步测试通过该方法识别的测试候选物,以验证特异性、剂量依赖性、体内功效等。候选测试可以用作开发其他候选测试的先导化合物。
根据本领域技术人员可获得的任何信息,可以认为原型化合物或制剂具有治疗活性。例如,可以基于医师课桌参考资料中包含的信息认为原型制剂具有治疗活性。另外,作为非限制性示例,基于临床医生的经验,化合物的结构,结构活性关系数据,EC
治疗活性化合物或制剂是具有治疗活性的制剂,该活性包括例如当施用于受试者或在体外测试时该制剂诱导特定反应的能力。治疗活性包括疾病或病症的治疗,包括预防性和改善性治疗。疾病或病症的治疗可以包括疾病或病症的任何程度的改善,包括预防、改善和消除疾病或病症。可以针对任何疾病或病症进行治疗活动,在一种实施方案中包括对抗与活性氧中间体损害相关的任何疾病或病症。为了确定治疗活性,可以使用可以评估化合物的治疗活性的任何方法。例如,可以使用体内和体外方法,包括例如临床评估,EC
与本发明的测试一起使用或通过本发明的测试识别为有用的药理学制剂的候选化合物可以是本领域已知的药理学制剂或其变体,或者可以是先前未知的具有任何药理学活性的化合物。候选化合物可以天然存在或在实验室中设计的。候选化合物可以包含单个的非对映异构体,一种以上的非对映异构体,或单个的对映异构体或一种以上的对映异构体。
候选化合物可以例如从微生物、动物或植物分离,并且可以重组产生或通过本领域已知的化学方法合成。如果需要,可以使用本领域已知的多种组合文库方法中的任何一种获得本发明的候选化合物,包括但不限于生物学文库,空间可寻址的平行固相或溶液相文库,需要解卷积的合成文库方法,“一珠一化合物”文库方法,以及使用亲和层析选择的合成文库方法。生物文库方法仅限于多肽文库。其他四种方法适用于多肽、非肽寡聚物、或化合物的小分子文库,并且是本发明中的示例性方法。参见Lam,Anticancer Drug Des.12:145-167(1997)。
在一种实施方案中,本发明提供了一种识别候选化合物为合适的前药的方法。合适的前药包括可以通过本发明的方法识别的任何前药。对技术人员而言显而易见的任何方法都可以用于识别候选化合物作为合适的前药。
在另一方面,本发明提供了筛选候选化合物作为治疗剂的适用性的方法。筛选治疗剂的适用性可包括与可能影响化合物作为治疗剂的能力的化合物有关的一个、一些或多个标准。诸如功效、安全性、效率、保留、定位、组织选择性等因素,可以考虑降解或细胞内持久性。在一种实施方案中,提供了一种筛选候选化合物作为治疗剂的适用性的方法,其中该方法包括提供被识别为合适的前药的候选化合物,确定该候选化合物的治疗活性,以及确定该候选化合物的细胞内持久性。细胞内持久性可以通过技术人员显而易见的任何技术来测量,例如通过放射性示踪剂、重同位素标签或LCMS。
在针对适用性筛选作为治疗剂的化合物中,评估了候选化合物的细胞内持久性。在一种实施方案中,响应于候选治疗剂,在一段时间内,评估制剂调节本文中体现的组合物翻译的能力。
在另一种实施方案中,本文体现的组合物的可溶和/或膜结合形式,例如蛋白质、突变体或其生物学活性部分,可以用于筛选候选制剂的测试。当使用膜结合形式的蛋白质时,可能需要使用增溶剂。这种增溶剂的实例包括非离子型洗涤剂,例如正辛基葡糖苷,正十二烷基葡糖苷,正十二烷基麦芽糖苷,辛酰基-N-甲基葡糖酰胺,癸酰基-N-甲基葡糖酰胺,TRITON
也可以使用无细胞测试并涉及在一定条件和时间段内制备包含BAG3分子(核酸或肽)的反应混合物,以允许测量翻译和/或转录活性随时间的变化以及测试制剂的浓度,该BAG3分子包含生物发光部分和测试化合物。
微阵列:能够结合靶分子的核酸序列或肽的识别可通过将核酸文库固定在底物表面上以使每个独特的核酸位于限定的位置以形成阵列来实现。通常,在有利于生物分子与核酸或肽结合的条件下,将固定化的核酸或肽文库暴露于生物分子或候选制剂。然后将通过本文实施的方法分析该阵列,以确定哪些核酸序列或肽结合至生物分子。这样的生物分子可以带有用于检测结合的核酸或肽的位置的预定标签。
使用BAG3核酸序列的固定阵列的测试可以用于确定未知核酸的序列;单核苷酸多态性(SNP)分析;分析来自特定物种、组织、细胞类型等的BAG3基因表达模式;基因识别;等等。
在进一步的实施方案中,可以将衍生自任何BAG3多核苷酸序列的寡核苷酸或更长的片段用作微阵列中的靶标。该微阵列可用于同时监测大量基因和基因转录物的身份和/或表达水平,以识别与靶基因或其产物相互作用的基因和/或评估候选治疗剂在调节调解例如神经障碍的基因的表达产物中的功效。该信息可用于确定基因功能,以及开发和监测治疗剂的活性。
可以使用本领域已知的方法制备,使用和分析微阵列(参见,例如,Brennan等人,1995,U.S.Pat.No.5,474,796;Schena等人,1996,Proc.Natl.Acad.Sci.U.S.A.93:10614-10619;Heller等人,1997,Proc.Natl.Acad.Sci.U.S.A.94:2150-2155;和Heller等人,1997,U.S.Pat.No.5,605,662)。在其他实施方案中,微阵列包含BAG3肽或可以分析以识别候选制剂的其他所需分子。
在另一种实施方案中,用于筛选用于治疗或预防心脏病或病症的候选药物的方法包括使样品与候选治疗制剂接触并测量该制剂对靶标的作用。例如,该制剂可以调节BAG3表达,然后可以进一步研究该制剂的任何可能的治疗效果(增加或减少被监测的参数,例如表达)。异常表达状态可由诸如心力衰竭、疾病、癌症、遗传缺陷和/或毒素之类的病理引起的。
抗体。有用的诊断测试可以包括一种或多种特异性结合BAG3的抗体。在一些实施方案中,抗体特异性结合突变体BAG3。术语抗体用于广泛地指基于免疫球蛋白的结合分子,并且该术语涵盖常规抗体(例如,G类的四聚体抗体(例如,IgG1)),其保留结合其预期靶标的能力的其片段(例如,Fab'片段)和单链抗体(scFv)。该抗体可以是多克隆的或单克隆的,并且可以由人、小鼠、兔、绵羊或山羊细胞或源自这些细胞的杂交瘤产生。抗体可以是人源化的、嵌合的或双特异性的。
抗体可以采取各种构型并且涵盖由基本上由免疫球蛋白基因编码的一种或多种多肽组成的蛋白质。可以使用多种抗体结构中的任何一种,包括完整的抗体、抗体多聚体或抗体片段或其包含抗体的功能性抗原结合区的其他变体。我们可以将术语“免疫球蛋白”与“抗体”同义使用。抗体来源可以是单克隆或多克隆的。无论抗体的来源如何,合适的抗体都包括完整的抗体,例如,具有两条重(H)链和两条轻(L)链的IgG四聚体,单链抗体,嵌合抗体,人源化抗体,互补决定区(CDR)接枝的抗体以及抗体片段,例如Fab,Fab',F(ab')2,scFv,Fv和衍生自此这些片段(例如骆驼抗体、微抗体、双抗体和双特异性抗体)的重组抗体。
完整的抗体是包含抗原结合可变区(V
抗BAG3抗体可以来自任何种类的免疫球蛋白,例如IgA,IgG,IgE,IgD,IgM(及其亚型(例如IgG1、IgG2、IgG3和IgG4)),并且免疫球蛋白的轻链可以是κ或λ型。公认的人免疫球蛋白基因包括κ、λ、α(IgA1和IgA2)、γ(IgG1、IgG2、IgG3、IgG4)、δ、ε和μ恒定区基因,以及许多免疫球蛋白可变区基因。
术语免疫球蛋白或抗体的“抗原结合部分”通常是指免疫球蛋白的与靶标特异性结合的部分,在这种情况下,靶标是包括在BAG3多肽上的氨基酸残基的表位。因此,免疫球蛋白的抗原结合部分是分子,其中一个或多个免疫球蛋白链不是全长的,而是与细胞靶标特异性结合。抗原结合部分或片段的示例包括:(i)Fab片段,由VLC、VHC、CL和CH1结构域组成的单价片段;(ii)F(ab')2片段,包含在铰链区通过二硫键连接的两个Fab片段的二价片段;(iii)由抗体单臂的VLC和VHC结构域组成的Fv片段,和(v)具有足够的框架以特异性结合例如可变区的抗原结合部分的分离的CDR。轻链可变区的抗原结合部分和重链可变区的抗原结合部分,例如,Fv片段的两个结构域,VLC和VHC,可以使用重组方法通过合成接头连接,使它们成为单条蛋白链,其中VLC和VHC区域配对形成单价分子(称为单链Fv(scFv)。这样的scFv可以是本发明的靶制剂,并被抗体的术语“抗原结合部分”涵盖。
“Fv”片段是包含完整抗原识别和结合位点的最小抗体片段。该区域由紧密共价结合的一个重链和一个轻链可变结构域的二聚体组成。在该构型中,每个可变结构域的三个高变区相互作用以在VH-VL二聚体的表面上限定抗原结合位点。尽管六个高变区具有抗原结合特异性,但即使单个可变结构域(或仅包含三个对抗原具有特异性的高变区的Fv的一半)也具有识别和结合抗原的能力,尽管其亲和力低于整个结合位点。为了提高稳定性,V
本发明的组合物包含以下抗体:(1)表现出结合活性的阈值水平的抗体;和/或(2)不会与已知的相关多肽分子发生明显的交叉反应的抗体。抗体的结合亲和力可以通过本领域普通技术人员容易地确定,例如通过Scatchard分析(Scatchard,Ann.NY Acad,Sci.51:660-672(1949))。
在一些实施方案中,抗BAG3抗体可结合其靶表位或模拟物诱饵是与预计和BAG3具有某些同源性的其他蛋白质相比的至少1.5倍,2倍,5倍,10倍,100倍,10
在一些实施方案中,抗BAG3抗体以10
在一些实施方案中,抗体不结合已知的相关多肽分子;例如,它们结合BAG3,但不结合已知的相关多肽。在一些实施方案中,抗体特异性结合突变体BAG3多肽,例如具有十个碱基对缺失的BAG3多肽,但不结合野生型BAG3多肽。可以针对已知的相关多肽筛选抗体,以分离特异性结合BAG3的抗体群体。
本发明的诊断测试可以包括同时进行的免疫电泳、放射免疫测试(RIA)、放射免疫沉淀、酶联免疫吸附测试(ELISA)、斑点印迹或蛋白质印迹测试、抑制或竞争测试以及夹心测试。抗BAG3抗体可以包括标记物,其也可以称为报道基因或标记物(例如,可检测的标记物)。可检测的标记物可以是与抗BAG3抗体或其生物活性片段共价连接的任何分子,其允许定性和/或定量评估标记肽的表达或活性。活性可以包括生物活性、物理化学活性或其组合。只要标记的抗体保留生物学活性,可检测标志物的形式和位置都可以变化。可以使用许多不同的标记物,并且特定标记物的选择将取决于所需的应用。标记的抗BAG3抗体可用于,例如,评估生物样品(例如尿液、唾液、脑脊液、血液或活检样品)中BAG3或突变型BAG3的水平,或用于评估对心血管治疗(例如上述BAG3构建体)的临床反应。
可与制剂偶联的示例性可检测标签包括不透射线的制剂或造影剂,例如钡,泛影酸盐,乙碘油,柠檬酸镓,碘甲酸,碘酸胺酸,碘达胺,胆影酸,碘沙酸,iogulamide,碘海醇,碘帕醇,碘番酸,碘普西酸,碘西法酸,碘丝酸,碘磺胺葡甲胺,iosemetic acid,碘酞硫,碘替酸,碘他拉酸,碘曲西酸,碘克沙酸,羟泛影酸,碘泊酸钠,甲葡胺,甲泛葡胺,甲泛影钠,丙碘酮和氯化亚铊。替代地或另外,可检测标签可以是荧光标签,例如,异硫氰酸荧光素,若丹明,藻红素,藻蓝蛋白,别藻蓝蛋白,邻苯二甲醛和荧光胺;化学发光化合物,选自鲁米诺,异鲁米诺,芳族吖啶酯,咪唑,吖啶盐和草酸酯;脂质体或聚葡萄醣;或生物发光化合物,例如,荧光素,萤光素酶和水母素等。
合适的标记物包括,例如,酶、光亲和配体、放射性同位素以及荧光或化学发光化合物。将可检测标记物引入肽中的方法是本领域众所周知的。标记可以在合成过程中或合成后添加。重组抗BAG3抗体或其生物活性变体也可以通过将标记的前体(例如,放射性标记的氨基酸)添加到生长转化细胞的培养基中来进行标记。在一些实施方案中,可以使用肽的类似物或变体以促进可检测标记物的掺入。例如,任何N-末端苯丙氨酸残基都可以被紧密相关的芳香族氨基酸(例如酪氨酸)取代,该氨基酸可以很容易地用1251标记。在一些实施方案中,可以将支持有效标记的其他官能团添加到抗BAG3抗体或其生物活性变体的片段中。例如,可以将3-三丁基锡苯甲酰基加至天然结构的N-末端;随后将三丁基锡基团置换为
可以使用任何本领域已知的方法来检测这样的标签,例如,正电子发射断层扫描(PET)、SPECT成像、磁共振成像、X射线;或可以通过超声波检测到。
诊断、治疗、制剂盒
本文的组合物和本发明的化合物可以用于诊断、治疗和预防,并且可以用作研究制剂和制剂盒的组分。
本文公开的组合物通常和以各种方式用于治疗患有心脏疾病或病症例如心力衰竭或扩张型心肌病的受试者。术语“受试者”、“患者”或“个体”可互换地指代。每当获得临床有益结果时,受试者就得到有效的治疗。例如,这可能意味着疾病症状的完全缓解、疾病症状严重程度的降低或疾病进程的减缓。这些方法可以进一步包括在生物样品中识别预测BAG3水平升高是否对该受试者有治疗作用的BAG3变体,以及向识别为具有这种变体的患者施用治疗有效量的制剂。
在特定的实施方案中,制剂盒包含与用于识别生物样品中与BCL2相关的抗凋亡基因3(BAG3)变体的可检测标签偶联的一种或多种探针。特定变体的检测可预测受试者是否将从治疗中受益。
适用于本发明的治疗和/或预后方法的心血管疾病可以是对BAG3的调节有反应的疾病,或在治疗那些可能对BAG3调节剂无反应的受试者时的疾病。本发明的组合物不限于通过影响任何特定细胞机制起作用的组合物。与BAG3的失调有关的任何形式的心血管疾病都在本发明的范围内。
本发明的方法可以根据药物的制备来表达。因此,本发明包括本文所述的制剂和组合物在药物制备中的用途。本文所述的化合物可用于治疗性组合物和方案或用于制备用于治疗本文所述的疾病或病症(例如本文公开的心血管疾病)的药物。
本文所述的任何组合物可被施用至宿主身体的任何部分,以随后递送至靶细胞。不受限制的,组合物可被递送至哺乳动物的脑、脑脊液、关节、鼻粘膜、血液、肺、肠、肌肉组织、皮肤或腹膜腔。就递送途径而言,组合物可以通过静脉内、颅内、腹膜内、肌内、皮下、肌内、直肠内、阴道内、鞘内、气管内、真皮内或经皮注射、口服或鼻内施用或通过逐步灌注来施用。在另一个示例中,组合物的气溶胶制剂可以通过吸入给予宿主。
所需剂量将取决于施用途径、制剂的性质,患者疾病的性质,患者的体型、体重、表面积、年龄和性别,所施用的其他药物以及主治医生对的判断。合适的剂量在0.01-1,000mg/kg的范围内。鉴于细胞靶标的变化以及各种施用途径的不同效率,所需剂量的宽泛变化是可以预见的。如本领域所熟知,可以使用标准的经验程序来调节这些剂量水平的变化以进行优化。施药可以是单或多倍(例如2倍或3倍,4倍,6倍,8倍,10倍,20倍,50倍,100倍,150倍或更多倍)。将化合物封装在合适的递送媒介物中(例如,聚合物微粒或可植入装置)可以提高递送效率。
用本文提供的任何组合物治疗的持续时间可以是从短至一天到宿主的寿命(例如,多年)的任何时间长度。例如,化合物可以每周一次(例如4周至数月或数年);每月一次(例如,三到十二个月或多年);或每年一次,持续5年、10年或更长时间进行施用。还应注意,治疗频率可以是可变的。例如,本发明化合物可以每天、每周、每月或每年一次(或两次、三次等)施用。
可将有效量的本文提供的任何组合物施用给需要治疗的个体。如本文所用,术语“有效”是指在患者中不引起明显毒性而诱导期望的反应的任何量。这样的量可以通过在施用已知量的特定组合物之后评估患者的反应来确定。另外,如果有毒性,可以通过在施用已知量的特定组合物之前和之后评估患者的临床症状来确定毒性水平。注意,可以根据期望的结果以及患者的反应和毒性水平来调节施用给患者的特定组合物的有效量。对于每个特定患者,显著的毒性会变化,并且取决于多种因素,包括但不限于患者的疾病状态、年龄和对副作用的耐受性。
本领域技术人员已知的任何方法都可以用于确定是否诱发了特定的反应。可以使用可以评估特定疾病状态程度的临床方法来确定是否诱发反应。用于评估反应的特定方法取决于患者疾病的性质、患者的年龄和性别,正在施用的其他药物以及主治医生的判断。
两种或多种治疗剂的同时施用不要求同时或通过相同途径施用,只要在该治疗剂发挥其治疗作用的时间段上存在重叠即可。同时或顺序施用是可预期的,如在不同天或不同周施用。所述组合物还可与另一种用于治疗心血管疾病的标准治疗剂一起施用。这些相关疾病或病症的示例包括:心脏病或病症、骨骼肌疾病或病症、多发性硬化、老年斑、脑淀粉样血管病、动脉粥样硬化、成胶质细胞瘤、淀粉样蛋白沉积、神经退行性疾病、神经原纤维缠结、痴呆、绒毛膜癌、星形细胞瘤、淀粉样变性病、高脂血症、神经退行性病变、赘生物转化、前列腺癌、动脉粥样硬化斑块、梗阻、艾滋病、转移、心肌梗塞、肺纤维化、坏死、休克、黑素瘤、结直肠癌、遗传易感性、银屑病、癌症(cancer)、炎症、神经胶质瘤、癌(carcinoma)、乳腺癌、神经病理学、肿瘤、前列腺癌、血管疾病、细胞损伤、脑肿瘤、非小细胞肺癌(NSCLC)、高胆固醇血症。骨骼肌疾病的示例包括肌肉原发性(遗传性)疾病(例如,肌肉营养不良和先天性肌病、代谢性肌病);获得性疾病(例如肌炎、中毒性肌病);肌肉继发性疾病(例如神经源性萎缩、慢性肺部萎缩、心脏病、肾病、HIV/AID、癌症、肌肉减少症等)。
制剂盒:本发明还提供包含足够、必需或用于实施本文所述的任何方法的组分中的一种或多种或全部的系统和制剂盒(例如,商业治疗、诊断或研究产品、反应混合物等)。这些系统和制剂盒可包括缓冲物、检测/成像组件、阳性/阴性对照制剂、说明书、软件、硬件、包装或其他所需组件。
制剂盒提供了用于筛选能够调节化合物对靶分子作用的测试化合物的有用工具。可以以任何合适的方式将制剂盒和使用说明书一起包装在合适的容器中,以辅助研究、临床和测试实验室(通常带有各个部件)。
在特定的实施方案中,制剂盒可进一步包含脂质和/或溶剂。在特定的实施方案中,制剂盒可进一步包含该程序所需的缓冲液和制剂,以及进行测试的说明。在特定的实施方案中,制剂盒在必要时可进一步包括用于减少测试中的背景干扰的制剂、阳性和阴性对照制剂、用于进行测试的装置等。
还提供了制剂盒,该制剂盒用于确定受试者是否在BAG3多肽中具有突变,以诊断患有心血管疾病或有发展心血管疾病的倾向的患者。该制剂盒还可用于监测用于治疗心血管疾病的制剂的效率。
组合物的施用
可以配制通过本文体现的方法识别的制剂,并且可以将本发明的组合物与一种或多种另外的活性成分、药物组合物或其他化合物联合施用。本发明的治疗剂可以施用于动物,例如哺乳动物,包括人。
在其他实施方案中,药物组合物包含至少一种或多种本文体现的制剂和/或候选治疗剂。
药物制剂可以通过口服(固体或液体),肠胃外(肌内、腹膜内,静脉内(IV)或皮下注射),心内,透皮(被动地或使用离子电渗疗法或电穿孔),经粘膜和全身(鼻、阴道、直肠或舌下)或施用吸入途径,或使用可生物蚀解的插入物施用,并且可配制成适合每种施用途径的剂型。
所述制剂可以配制成药学上可接受的载体或稀释剂,例如生理盐水或缓冲盐溶液。可以基于施用的方式和途径以及标准药学实践来选择合适的载体和稀释剂。示例性药学上可接受的载体和稀释剂以及药物制剂的描述可以在该领域中的以及USP/NF中的标准文本,《Remington's Pharmaceutical Sciences》中找到。其他物质可以添加至组合物以稳定和/或保存组合物。
本发明的组合物可以通过任何常规技术施用于动物。可以通过例如外科手术递送至内部或外部靶位点,或通过导管递送至血管可到达的部位,将组合物直接施用至靶位点。其他递送方法,例如脂质体递送或从浸渍有组合物的装置中扩散,是本领域已知的。该组合物可以单次、多次注射或通过连续输注(例如静脉内)施用。对于肠胃外施用,组合物例如被配制成无菌的无热原的形式。
本发明识别的化合物也可以以药物浓度足以抑制骨吸收或达到本文公开的任何其他治疗适应症的方式口服施用至患者。通常,以与患者状况一致的方式,以约0.1至约50mg/kg之间的口服剂量施用包含该化合物的药物组合物。示例性的口服剂量为约0.5至约20mg/kg。
尽管肌肉推注也是有用的,但是将化合物在5%葡萄糖的水溶液或生理盐水或具有合适赋形剂的类似制剂的静脉内输注是最有效的。通常,肠胃外剂量以将血浆中药物的浓度维持在有效增加BAG3表达的浓度的方式为约0.01至约100mg/kg;例如在0.1至20mg/kg之间。化合物可以达到约0.4至约400mg/kg/day的日总剂量的水平每天施用一至四次。本领域普通技术人员可以通过比较所制剂的血液水平与具有治疗作用所需的浓度来容易地确定治疗有效的本发明化合物的精确量以及最佳施用该化合物的途径。本发明化合物的前药可以通过任何合适的方法来制备。
当根据本发明施用本发明的化合物、衍生物、盐、组合物等时,不期望产生不可接受的毒理作用。可能具有良好生物利用度的本发明化合物可以在几种生物学测试中的一种进行测试,以确定其具有给定药理作用所需的化合物的浓度。
在另一种实施方案中,提供了包含一种或多种已识别化合物和药学上或兽医学上可接受的载体的药物或兽医学组合物。也可以存在其他活性物质,因为对于所治疗或预防的疾病或状况是适当的或可取的。
在与制剂的其他成分相容且对接受者无害的意义上,载体,或者如果存在一种以上的载体,则每种载体必须是可接受的。
通过本文的方法识别的化合物将适用于上述各种药物递送系统。另外,为了延长所施加的化合物的体内血清半衰期,可以将化合物包封,引入脂质体的内腔,制成胶体,或者可以采用提供化合物的延长的血清半衰期的其他常规技术。如Szoka等人的美国专利号4,235,871,4,501,728和4,837,028中所述,有多种方法可用于制备脂质体,其每一个在此通过引用并入本文。此外,可以在靶向药物递送系统中,例如在用组织特异性抗体包被的脂质体中施用药物。脂质体将靶向器官并被器官选择性吸收。
制剂包括适合于直肠、鼻腔、局部(包括颊和舌下)、阴道或肠胃外(包括皮下、肌内、静脉内和皮内)施用的制剂,或者该制剂是口服施用的制剂。该制剂可以方便地以单位剂型,例如片剂和缓释胶囊的形式存在,并且可以通过药学领域公知的任何方法制备。
这样的方法包括使以上定义的活性剂与载体结合的步骤。通常,通过使活性剂与液体载体或细分的固体载体或两者均匀且紧密地结合,然后如果需要使产品成型来制备制剂。
可以根据已知方法配制使用这些方法识别的化合物以制备药学上有用的组合物,由此将化合物与药学上可接受的载体媒介物混合。通过将具有所需纯度的活性成分与以冻干制剂或水溶液的形式的任选的生理上可接受的载体、赋形剂或稳定剂混合制备用于储存的治疗制剂(雷明顿药物科学第16版,Osol,A.编(1980))。可接受的载体、赋形剂或稳定剂在使用的剂量和浓度下对接受者无毒,并包括缓冲剂,例如磷酸盐、柠檬酸盐和其他有机酸;抗氧化剂,包括抗坏血酸;低分子量(少于约10个残基)多肽;蛋白质,例如血清白蛋白、明胶或免疫球蛋白;亲水聚合物,例如聚乙烯吡咯烷酮,氨基酸,例如甘氨酸、谷氨酰胺、天冬酰胺、精氨酸或赖氨酸;单糖,二糖和其他碳水化合物,包括葡萄糖、甘露糖或糊精;螯合剂,如EDTA;糖醇,例如甘露醇或山梨糖醇;成盐的抗衡离子,例如钠;和/或非离子表面活性剂,例如TWEEN
用于体内施用的制剂必须是无菌且无热原的。这易于在冻干和重构之前或之后通过无菌过滤膜过滤来实现。
本发明药物组合物的剂量和所需药物浓度可以根据预期的特定用途而变化。确定合适的剂量或施用途径完全在普通医师的能力范围内。动物实验为确定人类治疗的有效剂量提供了可靠的指导。可以按照Mordenti,J.和Chappell,W.“The use of interspeciesscaling in toxicokinetics”In Toxicokinetics and New Drug Development,Yacobi等人,Eds.,Pergamon Press,New York 1989,pp.42-96进行有效剂量的种间定标。
本发明中用于口服施用的制剂可以表示为:每个均包含预定量的活性剂的离散单元,例如胶囊、扁囊剂或片剂;粉末或颗粒;活性剂在水性液体或非水性液体中的溶液或悬浮液;或水包油型液体乳剂或油包水型液体乳剂;或丸剂等。
对于用于口服施用的组合物(例如片剂和胶囊),术语“可接受的载体”包括媒介物,例如常见的赋形剂,例如结合剂,例如糖浆,阿拉伯胶,明胶,山梨糖醇,黄芪胶,聚乙烯吡咯烷酮(聚维酮),甲基纤维素,乙基纤维素,羧甲基纤维素钠,羟丙基甲基纤维素,蔗糖和淀粉;填料和载体,例如玉米淀粉,明胶,乳糖,蔗糖,微晶纤维素,高岭土,甘露醇,磷酸氢钙,氯化钠和藻酸;以及润滑剂,例如硬脂酸镁,硬脂酸钠和其他金属硬脂酸盐,硬脂酸甘油酯,硬脂酸硅油,滑石蜡,油和胶体二氧化硅。还可以使用调味剂,例如薄荷,冬青油,樱桃调味剂等。可能需要添加着色剂以使剂型易于识别。片剂也可以通过本领域公知的方法进行包被。
片剂可以通过压制或模制,任选地与一种或多种辅助成分一起制成。可以通过在合适的机器中将自由流动形式的活性剂如粉末或颗粒压缩,任选地与粘合剂、润滑剂、惰性稀释剂、防腐剂、表面活性剂或分散剂混合来制备压制片剂。模制片剂可以通过在合适的机器中模制用惰性液体稀释剂润湿的粉末状化合物的混合物来制备。片剂可以任选地被包被或刻痕,并且可以被配制以提供活性剂的缓慢或受控释放。
其他适合于口服施用的制剂包括:含片,其包含在调味基料(通常是蔗糖和阿拉伯胶或黄芪胶)中的活性剂;锭剂,其包含在惰性基质(例如明胶和甘油,或蔗糖和阿拉伯胶)中的活性剂;以及漱口剂,其包含在合适的液体载体中的活性剂。
肠胃外制剂通常会是无菌的。
剂量:将有效剂量的本公开的主题的组合物施用于需要其的受试者。“治疗有效量”或“治疗量”是足以产生可测量的反应(例如,被治疗的受试者的生物学或临床相关反应)的治疗组合物的量。如上所述,可以以许多方式来测量反应,例如细胞因子谱、细胞类型、细胞表面分子等。本公开主题的组合物中活性成分的实际剂量水平可以改变,以施用一定量的有效地实现针对特定受试者的所需治疗反应的一种或多种活性化合物。选择的剂量水平将取决于治疗组合物的活性、施药途径,与其他药物或疗法的组合、所治疗疾病的严重程度以及所治疗患者的疾病状况和既往病史。但是,以低于获得所需治疗效果所需的剂量开始化合物剂量并逐渐增加剂量直至获得所需效果,这是在本领域技术范围内的。组合物的效力可以变化,因此“治疗有效量”可以变化。然而,使用本文所述的测试方法,本领域技术人员可以容易地评估当本发明公开的主题的候选化合物的效力和功效,并相应地调整治疗方案。
已经参考本发明的某些实施例详细描述了本发明。然而,将理解,本领域技术人员在考虑到本公开内容之后,可以在本发明的精神和范围内进行修改和改进。
本文提及的所有文献均通过引用并入本文。本申请中引用的所有出版物和专利文件出于所有目的以引用的方式并入本文,其程度如同每个单独的出版物或专利文件都被单独地表示。通过引用本文档中的各种参考文献,申请人不认可任何特定的参考文献是其发明的“现有技术”。
实施例
实施例1:BAG3中的变体预测患有心肌病的非洲血统美国人的恶化结果
为了研究非洲血统的受试者中BAG3遗传变体与DCM之间的相关性,对从参与三项临床试验之一的受试者获得的DNA测序BAG3。结果首次证明,在非洲血统的个体中发现的一组功能性BAG3变体与IDC患者的不良结果相关,并可以为治疗干预提供精确靶标。
方法
患者:基因组DNA获自参与三项美国临床试验的509名患有DCM的非洲血统美国人,其DNA分为:342名来自非洲血统的美国人心力衰竭遗传风险评估(GRAHF)试验的患者(队列A)
使用了三个参比群体。首先,对参与了群体队列A-C的研究中的患有缺血性心肌病的非洲血统个体DNA测序。其次,BAG3序列数据是来自整个美国的HF诊所收集的欧洲血统个体从Boston的Brigham and Women医院收集的具有家族性和散发性DCM的欧洲血统个体的队列中获得的
DNA测序和分析:在约翰霍普金斯大学医学院,麦库锡纳森遗传医学研究所,遗传资源的核心实验室中对来自GRAHF试验的DNA进行测序。简而言之,来自每个GRAHF队列患者的基因组DNA进行PCR扩增,然后使用荧光双脱氧终止子循环测序法测序。使用Sequencher软件版本5.4.6(Gene Codes,Ann Arbor,MI)分析序列数据。SNV使用软件“调用二级峰值(Call Secondary Peaks)”功能来识别,并手动检查所有数据。
进行靶向基因分型以确认GRAHF队列的结果,并使用实时PCR和SNP特异性制剂在随后的每个队列中识别SNV。如果满足以下条件,则选择SNV用于验证性基因分型和功能分析:1)在GRAHF中等位基因频率>0.005;2)是非同义的;和3)在非洲血统中比在欧洲血统中更常见。为了确定同一样品中的两个BAG3 SNV是否顺式排列,将BAG3基因座扩增,克隆到质粒中并进行Sanger测序。
人心脏组织的蛋白质印迹分析:如先前所述进行蛋白质印迹分析
自噬通量和细胞凋亡的测量:所述方法先前已经详细描述。
在第二组实验中,将细胞以相同的方式转染36小时,暴露于缺氧12小时,然后再充氧2小时。用膜联蛋白-V和碘化丙啶将细胞染色30分钟,并用共聚焦显微镜成像。Annexin-V阳性细胞(凋亡)呈绿色,而碘化丙啶阳性细胞(晚期凋亡和坏死)呈红色。每个场至少计数20个细胞,每个条件至少计数10个场。研究者对实验组视而不见。
统计分析:根据通过BAG3 SNV(SNV与无SNV)、缺血(缺血与非缺血)以及伴随的相互作用的分层/划分进行统计分析。根据情况,使用学生t检验或ANOVA评估连续变量,使用卡方检验或Fisher精确检验评估分类变量。对于事件进行时间分析,将事件定义为死亡、移植或HF相关住院。使用Kaplan-Meier方法评估生存率;使用对数秩检验评估得到的曲线。使用Cox比例危险模型评估危险比。使用
结果
研究对象:来自三项独立研究的总共509名患有DCM的非洲血统美国人的基因组DNA:342名来自GRAHF的患者(队列A)
BAG3遗传变体:
GRAHF队列的Sanger测序揭示了18个变体(表1),其中八个是同义的。四个SNV符合纳入本研究的标准:p.Pro63Ala(10:121429369C/G;rs133031999);p.His83Gln(10:151331972;rs151331972);Pro380Ser(10:121436204C/T;rs144692954);和Ala479Val(10:121436502C/T,rs34656239)。还识别了在蛋白质的位置160上添加丙氨酸的3核苷酸的框内插入(p.Ala160dup;10:121429647A/AGCG)。通过靶向测序证实了Sanger结果。携带p.Pro63Ala变体的每个个体也都携带p.Pro380Ser变体,并且gnomAD中这两个SNV的相应等位基因频率几乎相同,这提供了两个SNV顺式连接的证据。Sanger测序证实了这一点。表1显示了具有和不具有4种识别的BAG3变体的非洲血统HF患者的特征。链接的SNV命名为p.Pro63Ala+Pro380Ser。如图1所示,BAG3变体中受影响的残基(His83、Alal60、Pro380和Ala479)在整个哺乳动物中高度保守。
当针对多个等位基因进行了调整时,在A、B和C队列的402名IDC患者中,四种BAG3变体的流行性(402名受试者中的42名;10.45%)大于在缺血性HF患者中的四种BAG3变体的流行性(107名受试者中的9名;8.41%);但是,该差异在统计上并不显著。(表2)同样,具有IDC和四种BAG3变体之一的队列A、B和C中患者的比例与每个变体的相应gnomAD数据集的总和中具有BAG3变体的受试者的比例没有显著差异(9.06%)。相比之下,三个队列中具有BAG3变体的受试者比例(10.02%)显著(p<0.0001)高于gnomAD欧洲数据集中的60000名以上欧洲血统受试者中四种BAG3变体的流行性(0.020%;p<0.000l),并且显著大于359名欧洲血统的不具有BAG3变体的IDC个体的参考人群。(波士顿队列;0.000%BAG3变体;p<0.000l)。
BAG3变体对心力衰竭结果的影响:接下来寻求确定四种BAG3变体中的任一种是否与如心力衰竭住院、心脏移植或死亡的综合结果变量所反映的较差的结果相关联。如图2A所示,当与没有携带四种BAG3变体之一的患有缺血性和非缺血性疾病的HF受试者相比时,具有BAG3变体的受试者具有显著较高的不良事件发生率(p=0.010)。同样,携带BAG3变体的非缺血性HF患者与不具有BAG3变体的非缺血性患者相比,具有更差的后果。(图2B;p=0.018)在患有缺血性HF和BAG3 SNV的受试者中,存在趋向于较差结果的趋势。但是,差异没有统计学意义(图2C,p=0.177)。使用Cox比例风险分析,我们确定了四种BAG3变体之一的携带者发生不良事件的风险比不具有BAG3变体的HF患者高1.906倍(95%CL:1.157-3.141,p=0.011)。
BAG3变体的致病性:评估了BAG3变体对在细胞中的BAG3两个主要作用的影响:自噬和凋亡。如图3A所示,用空质粒或含有野生型BAG3 c.187C>G+c.1138C>T(p.Pro63Ala+p.Pro380Ser),c.249C>A(p.His83Gln),c.474_476dupGGC(p.Ala160dup),或c.1436C>T(p.Ala479Val)的血浆转染AC16细胞,并用Adv-RFP-GFP-FC3共转染。当用缺氧-复氧对细胞施加压力时,用空质粒或野生型BAG3转染的细胞中LC3显著增加。然而,在过表达四种BAG3变体中的每一种的AC16细胞中,由于LC3没有明显增加,对缺氧-复氧的自噬反应显著减弱(图3A和3B)。此外,在缺氧-复氧后,用BAG3变体转染的细胞显示比用表达野生型BAG3的蛋白的质粒转染的细胞明显更多的膜联蛋白-V阳性细胞(图3C和3D)。因此,与野生型BAG3相反,BAG3变体不能阻止缺氧诱导的细胞凋亡。
BAG3在人心力衰竭中的水平:进行BAG3水平的Western印迹分析和qPCR以定量分析非洲血统受试者(队列D和队列E)衰竭的人心脏和非衰竭的对照心脏中的BAG3 m RNA。如图4A-4C所示,与非衰竭对照(n=4)相比,从患有IDC(p=0.0001,n=23)或缺血性HF(p<0.0001,n=16)的移植受体中提取的心脏中BAG3水平显著降低。来自IDC心脏(n=18)和来自患有缺血性DCM的DCM心脏(n=13)的Bag3mRNA水平与对照组(n=4)中的BAG3mRNA水平没有差异。靶序列分析发现,一个心脏含有p.His83Gln变体,两个心脏含有p.Pro63Ala+Pro380Ser变体,一个心脏含有p.Ala160dup插入。BAG3水平在两个p.Pro63Ala+Pro380心脏中是超正常的,这提供证据表明BAG3变体的表达胜过控制BAG3表达的内在调节机制。相反,在p.His83Gln心脏中BAG3水平没有改变,并且在含有p.Ala160dup的心脏中不能被察觉到,这使得它们成为基因治疗的潜在靶标。
表1.基于存在或不存在BAG3 SNV的受试者的特征
表2A.BAG3突变频率(按病理和数据来源)。
表2B:黑人和欧洲患者与BAG3突变(均为非缺血性HF)的分析
讨论
BAG3调节重要的细胞功能,包括蛋白质质量控制,细胞凋亡和兴奋/收缩偶联
ClinVar
在本研究中识别的变体先前尚未在家族性DCM的先证者队列中被识别。例如,在识别具有家族性IDC独立索引病例中的BAG3变体的四项研究中,识别为非洲血统的受试者不到16名
在欧洲血统的个体中的早期研究支持了本研究的结果。BAG3变体在种族或地理上隔离的先证者队列中最常见:从魁北克省Gaspesie地区的隔离群体招募的指标病例中为15%
本文的结果提供了几乎仅在非洲血统个体中发现的BAG3独特变体的证据,该变体对患有IDC患者以及可能患有缺血性DCM的患者的结果产生负面影响。对非洲血统美国人具有选择性的BAG3遗传变体的研究指出将生物学差异视为引起不同患者群体中表型差异的几个因素之一的重要性。
参考文献
1.Benjamin EJ,Blaha MJ,Chiuve SE,et al.Heart Disease and StrokeStatistics-2017 Update:A Report From the American HeartAssociation.Circulation.2017;135(10):e146-e603.
2.Yancy CW.Heart failure in African Americans:a cardiovascularengima.J Card Fail.2000;6(3):183-186.
3.Loehr LR,Rosamond WD,Chang PP,Folsom AR,Chambless LE.Heart failureincidence and survival(from the Atherosclerosis Risk in Communities study).AmJ Cardiol 2008;101(7):1016-1022.
4.Echols MR,Felker GM,Thomas KL,et al.Racial differences in thecharacteristics of patients admitted for acute decompensated heart failureand their relation to outcomes:results from the OPTIME-CHF trial.J CardFail.2006;12(9):684-688.
5.Bahrami H,Kronmal R,Bluemke DA,et al.Differences in the incidenceof congestive heart failure by ethnicity:the multi-ethnic study ofatherosclerosis.Arch Int Med.2008;168(19):2138-2145.
6.Dries DL,Exner DV,Gersh BJ,Cooper HA,Carson PE,Domanski MJ.Racialdifferences in the outcome of left ventricular dysfunction.N Engl J Med.1999;340(8):609-616.
7.Yeboah J,Rodriguez CJ,Stacey B,et al.Prognosis of individuals withasymptomatic left ventricular systolic dysfunction in the multi-ethnic studyof atherosclerosis(MESA).Circulation.2012;126(23):2713-2719.
8.Sliwa K,Wilkinson D,Hansen C,et al.Spectrum of heart disease andrisk factors in a black urban population in South Africa(the Heart of SowetoStudy):a cohort study.Lancet.2008;371(9616):915-922.
9.Bibbins-Domingo K,Pletcher MJ,Lin F,et al.Racial differences inincident heart failure among young adults.N Engl J Med.19 2009;360(12):1179-1190.
10.Rosamond W,Johnson A.Is Home Where the Heart Is?The Role ofNeighborhood in Heart Failure Risk.Circ Cardiovasc Qual Outcomes.2018;11(1):e004455.
11.Carnethon MR,Pu J,Howard G,et al.Cardiovascular Health in AfricanAmericans:A Scientific Statement From the American HeartAssociation.Circulation.2017;136(21):e393-e423.
12.Damasceno A,Mayosi BM,Sani M,et al.The causes,treatment,andoutcome of acute heart failure in 1006 Africans from 9 countries.Arch IntMed.2012;172(18):1386-1394.
13.Ntusi NB,Mayosi BM.Epidemiology of heart failure in sub-SaharanAfrica.Expert Rev Cardiovasc Ther.2009;7(2):169-180.
14.Herman DS,Lam L,Taylor MR,et al.Truncations of titin causingdilated cardiomyopathy.N Engl J Med.2012;366(7):619-628.
15.Ware JS,Seidman JG,Arany Z.Shared Genetic Predisposition inPeripartum and Dilated Cardiomyopathies.N Engl J Med.2016;374(26):2601-2602.
16.Behl C.Breaking BAG:The Co-Chaperone BAG3 in Health andDisease.Trends Pharmacol Sci.May 6 2016.
17.Knezevic T,Myers VD,Gordon J,et al.BAG3:a new player in the heartfailure paradigm.Heart Fail Rev.2015;20(4):423-434.
18.Myers VD,Tomar D,Madesh M,et al.Haplo-insufficiency of Bcl2-associated Athanogene 3 in Mice Results in Progressive Left VentricularDysfunction,beta-Adrenergic Insensitivity and Increased Apoptosis.J CellPhysiol.2018,10.1002/jcp.26482..
19.Franaszczyk M,Bilinska ZT,Sobieszczanska-Malek M,et al.The BAG3gene variants in Polish patients with dilated cardiomyopathy:four novelmutations and a genotype-phenotype correlation.J Transl Med.2014;12:192.
20.Chami N,Tadros R,Lemarbre F,et al.Nonsense mutations in BAG3areassociated with early-onset dilated cardiomyopathy in French Canadians.Can JCaridol.2014;30(12):1655-1661.
21.Lek M,Karczewski KJ,Minikel EV,et al.Analysis of protein-codinggenetic variation in 60,706 humans.Nature.2016;536(7616):285-291.
22.Taylor AL,Ziesche S,Yancy C,et al.Combination of isosorbidedinitrate and hydralazine in blacks with heart failure.N Engl J Med.2004;351(20):2049-2057.
23.McNamara DM,Tam SW,Sabolinski ML,et al.Aldosterone synthasepromoter polymorphism predicts outcome in African Americans with heartfailure:results from the A-HeFT Trial.J Amer Coll Cardiol.2006;48(6):1277-1282.
24.McNamara DM,Tam SW,Sabolinski ML,et al.Endothelial nitric oxidesynthase(NOS3)polymorphisms in African Americans with heart failure:resultsfrom the A-HeFT trial.J Card Fail.2009;15(3):191-198.
25.McNamara DM,Taylor AL,Tam SW,et al.G-protein beta-3 subunitgenotype predicts enhanced benefit of fixed-dose isosorbide dinitrate andhydralazine:results of A-HeFT.JACC Heart Fail.2014;2(6):551-557.
26.McNamara DM,Starling RC,Cooper LT,et al.Clinical and demographicpredictors of outcomes in recent onset dilated cardiomyopathy:results of theIMAC(Intervention in Myocarditis and Acute Cardiomyopathy)-2 study.J AmerColl Cardiol.2011;58(11):1112-1118.
27.McNamara DM,Holubkov R,Janosko K,et al.Pharmacogeneticinteractions between beta-blocker therapy and the angiotensin-convertingenzyme deletion polymorphism in patients with congestive heartfailure.Circulation.2001;103(12):1644-1648.
28.McNamara DM,Holubkov R,Postava L,et al.Pharmacogeneticinteractions between angiotensin-converting enzyme inhibitor therapy and theangiotensin-converting enzyme deletion polymorphism in patients withcongestive heart failure.J Amer Coll Cardiol.2004;44(10):2019-2026.
29.Bristow MR,Minobe WA,Raynolds MV,et al.Reduced beta 1receptormessenger RNA abundance in the failing human heart.J Clin Invest.1993;92(6):2737-2745.
30.Esslinger U,Garnier S,Korniat A,et al.Exome-wide association studyreveals novel susceptibility genes to sporadic dilated cardiomyopathy.PloSone.2017;12(3):e0172995.
31.Feldman AM,Begay RL,Knezevic T,et al.Decreased levels of BAG3 in afamily with a rare variant and in idiopathic dilated cardiomyopathy.J CellPhysiol.2014;229(11):1697-1702.
32.Su F,Myers VD,Knezevic T,et al.Bcl-2-associated athanogene3protects the heart from ischemia/reperfusion injury.JCI Insight.2016;1(19):e90931.
33.Davidson B,Shi W,Levine M.Uncoupling heart cell specification andmigration in the simple chordate Ciona intestinalis.Development.2005;132(21):4811-4818.
34.Tomar D,Dong Z,Shanmughapriya S,et al.MCUR1 Is a Scaffold Factorfor the MCU Complex Function and Promotes Mitochondrial Bioenergetics.CellRep 2016;15(8):1673-1685.
35.Feldman AM,Gordon J,Wang J,et al.BAG3 regulates contractility andCa homeostasis in adult mouse ventricular myocytes.J Mol CellCardiol.2016.92:10-20.
36.Fang X,Bogomolovas J,Wu T,et al.Loss-of-function mutations in co-chaperone BAG3 destabilize small HSPs and cause cardiomyopathy.J ClinInvest.2017;127(8):3189-3200.
37.Liggett SB,Mialet-Perez J,Thaneemit-Chen S,et al.A polymorphismwithin a conserved beta(1)-adrenergic receptor motif alters cardiac functionand beta-blocker response in human heart failure.Proc Natl Acad Sci US.2006;103(30):11288-11293.
38.O'Connor CM,Fiuzat M,Carson PE,et al.Combinatorial pharmacogeneticinteractions of bucindolol and beta1,alpha2C adrenergic receptorpolymorphisms.PloS one.2012;7(10):e44324.
39.Aleong RG,Sauer WH,Robertson AD,Liggett SB,Bristow MR.Adrenergicreceptor polymorphisms and prevention of ventricular arrhythmias withbucindolol in patients with chronic heart failure.Circ Arrhythm andelectrophysiol.2013;6(1):137-143.
40.Landrum MJ,Lee JM,Riley GR,et al.ClinVar:public archive ofrelationships among sequence variation and human phenotype.Nucleic AcidsRes.2014;42(Database issue):D980-985.
41.Mueller SC,Backes C,Haas J,et al.Pathogenicity prediction of non-synonymous single nucleotide variants in dilated cardiomyopathy.BriefBioinform.2015;16(5):769-779.
42.Campuzano O,Allegue C,Fernandez A,Iglesias A,Brugada R.Determiningthe pathogenicity of genetic variants associated with cardiacchannelopathies.Sci Rep.2015;5:7953.
43.Boycott KM,Vanstone MR,Bulman DE,MacKenzie AE.Rare-diseasegenetics in the era of next-generation sequencing:discovery totranslation.Nat Rev Genet.2013;14(10):681-691.
44.Villard E,Perret C,Gary F,et al.A genome-wide association studyidentifies two loci associated with heart failure due to dilatedcardiomyopathy.Eur Heart J.2011;32(9):1065-1076.
45.Norton N,Li D,Rieder MJ,et al.Genome-wide studies of copy numbervariation and exome sequencing identify rare variants in BAG3 as a cause ofdilated cardiomyopathy.Am J Hum Genet.2011;88(3):273-282.
46.Franceschelli S,Rosati A,Lerose R,De Nicola S,Turco MC,PascaleM.Bag3 gene expression is regulated by heat shock factor 1.J CellPhysiol.2008;215(3):575-577.
47.Gerhard GS,Fisher,S F,Feldman AM.Genetic Testing for InheritedCardiac Diseases in Underserved Populations of Non-European Ancestry:DoubleDisparity.JAMA Cardiol.2018;published online February 28,2018.
48.Taylor AL.Racial differences and racial disparities:thedistinction matters.Circulation.2015;131(10):848-850.
49.Landry LG,Rehm,H.L.Association of racial/ethnic categories withthe ability of genetic tests to detect a cause of cardiomyopathy.JAMACardiol.2018.doi:10.1001/jamacardio.2017.5333.
50.Dellefave-Castillo LM,Puckelwartz,M.J.,McNally,E.M.Reducintracial/ethnic disparities in cardiovascular genetic testing.JAMACardiol.2018;Published on line Frebruary 28,2018.
等效方案
仅通过常规实验,本领域技术人员将认识到或能够确定本文所述的本发明的特定实施方案的许多等同方案。这些等同方案旨在由所附权利要求书涵盖。
- 优化BAG3基因治疗
- 密码子优化的天花粉蛋白基因在基因治疗中的应用
