双色荧光双重检测的微流控芯片及方法
文献发布时间:2023-06-19 11:37:30
技术领域
本发明属于核酸检测技术领域,具体涉及用于核酸检测的微流控芯片及方法。
背景技术
癌症是全球死亡的主要原因之一,并给患者带来极大的痛苦。传统的检测手段多是采用计算机断层扫描(CT),核磁共振、放射性检测、病理检测和血液检查等,这些方法大多使用的仪器庞大,操作繁琐,费时费力,灵敏度低,特异性差。此外,在大多数情况下,传统的检测技术仅可以检测到较大的肿瘤,往往在确诊时,患者已经是癌症的中期或晚期,无法进行早期诊断,贻误治疗时机。
为了实现肿瘤的早诊断、早治疗,更多的研究人员专注于检测肿瘤标志物,肿瘤标志物(Tumor Marker)是反映肿瘤存在的化学类物质。它们或不存在于正常成人组织而仅见于胚胎组织,或在肿瘤组织中的含量大大超过在正常组织里的含量,它们的存在或量变可以提示肿瘤的性质,借以了解肿瘤的组织发生、细胞分化、细胞功能,以帮助肿瘤的诊断、分类、预后判断以及治疗指导。肿瘤标志物检测具有的优势在于:敏感性高,能早期检测出肿瘤患者;特异性好,能准确鉴别肿瘤/非肿瘤患者;有器官特异性,方便对肿瘤的定位;血清中水平与肿瘤体积大小、临床分期相关,用以判断预后;半衰期短,可反映肿瘤的动态变化,监测治疗效果、复发和转移测定方法精密度、准确性高,操作方便。
miRNA是一类本身不具备编码蛋白质功能的内生性RNA,约有18-25个核苷酸长度的内源性单链小分子RNA。研究表明某些miRNA的异常表达与肿瘤发生、肿瘤分期和肿瘤治疗密切相关,可明确检测血清中miRNA的存在。所有这些发现表明,miRNA可用作肿瘤标志物,对恶性疾病的早期诊断具有积极的临床意义。
目前,广泛应用的miRNA分析方法,包括实时逆转录聚合酶链反应(PCR),RNA印迹技术(Northern blotting)和miRNA微阵列技术等在一定程度上可以满足检测要求。然而,这些方法需要转录和扩增,这既费时又费力,一些方法需要昂贵的试剂盒和复杂的处理,并且检测通量较低。因此,需要建立灵敏,快速,低成本且易于操作的miRNA检测系统。
发明内容
本发明的目的是提供一种对miRNA进行检测的微流控芯片及方法,能够同时对同一份检测样品进行不同肿瘤标志物的双色荧光双重检测,极大提高了检测的灵敏度和精度,实现肿瘤标志物快速、高通量检测,为肿瘤早期诊断提供有效的检测手段。
为了实现上述目的,本发明采用第一种技术方案是:双色荧光双重检测的微流控芯片,包括盖片和基片,所述的盖片为双层结构,包括阀门控制层和微流道层;所述阀门控制层用于控制所述微流道层液体流道的开启和闭合;所述微流道层包括多个检测单元,每个检测单元包括两条微流道;所述微流道的一端设有进样孔,另一端设有微腔和出样孔;所述的基片上,与所述微流道对应的位置修饰有纳米级氧化石墨烯或石墨烯材料,与所述微腔对应的位置修饰有戊二醛。
作为本发明的一种优选方式,所述的进样孔包括探针进样孔和样品进样孔,所述两条微流道分别与两个不同的探针进样孔连接,与同一个样品进样孔连接。
作为本发明的一种优选方式,两条微流道分别与两个不同的微腔连接,所述两个微腔之间不连通。
作为本发明的一种优选方式,两条微流道与同一个微腔连接。
作为本发明的一种优选方式,所述的阀门控制层包括若干控制液体进入和流出所述微流道的阀门、进/出水口,以及连接所述进/出水口与阀门之间的流道。
作为本发明的一种优选方式,所述基片上修饰的纳米级氧化石墨烯或石墨烯材料上,铺设带有荧光基团或者经荧光染色的探针。
本发明还提供一种双色荧光双重检测方法,包括:
关闭微流道与微腔之间的阀门;
通过两个不同的探针进样孔,分别向两条微流道内注入不同的DNA探针,使其充满流道,孵育0.5-2h;
通过出样口排出多余的液体,并用PBS冲洗微流道,去除没有吸附在基片上的单链DNA;
对流道中的DNA探针的荧光信号进行检测;
打开微流道与微腔之间的阀门,关闭出样口及DNA进样孔处的阀门,然后从样品进样孔注入待测样本,使用氮气同时将其推入到两条流道中;
待测样品与微流道内的DNA探针反应后经微流道流入微腔内;
对流道内和进入微腔内的液体进行荧光检测;
根据不同的荧光颜色和荧光强度,判断待测样本中是否含目标miRNA。
进一步优选地,将流道内液体荧光的检测结果与DNA探针的荧光信号进行对比,或者根据微腔中荧光强度,判断待测样本中目标miRNA的含量。
作为本发明的一种优选方式,所述的DNA探针的3’端修饰有NH
进一步优选地,所述NDA探针采用荧光染料进行染色,或者在DNA探针的5’端修饰荧光基团。
本发明与现有技术相比,具有的有益效果是:本发明结合纳米氧化石墨烯和戊二醛的发展,将它们通过自主装技术组装到载玻片上,与高通量的双层微流控芯片技术相集成,能同时检测不同的肿瘤标志物。该芯片可以通过控制阀门来控制流量,可控性强,配合不同的荧光标记技术,从而达到miRNAs的快速、灵敏,准确的双色双重检测。
附图说明
图1为本发明提供的一种用于miRNA双色双重荧光检测的微流控芯片实验原理图;
图2为本发明提供的红绿双色双重荧光检测微流控芯片的立体透视图;
图3为本发明提供的红绿双色双重荧光检测微流控芯片的结构正视图;
图4为本发明提供的红绿双色双重荧光检测微流控芯片的微流道层结构示意图
图5为本发明提供的红绿双色双重荧光检测微流控芯片的阀门控制层结构示意图;
图6为本发明提供的蓝绿双色双重荧光检测微流控芯片的立体透视图;
图7为本发明提供的蓝绿双色双重荧光检测微流控芯片的结构正视图;
图8为本发明提供的蓝绿双色双重荧光检测微流控芯片的微流道层结构示意图;
图9为本发明提供的蓝绿双色双重荧光检测微流控芯片的阀门控制层结构示意图。
具体实施方式
为了便于理解本发明,下面结合附图和具体实施例,对本发明进行更详细的说明。附图中给出了本发明的较佳的实施例。但是,本发明可以以许多不同的形式来实现,并不限于本说明书所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。
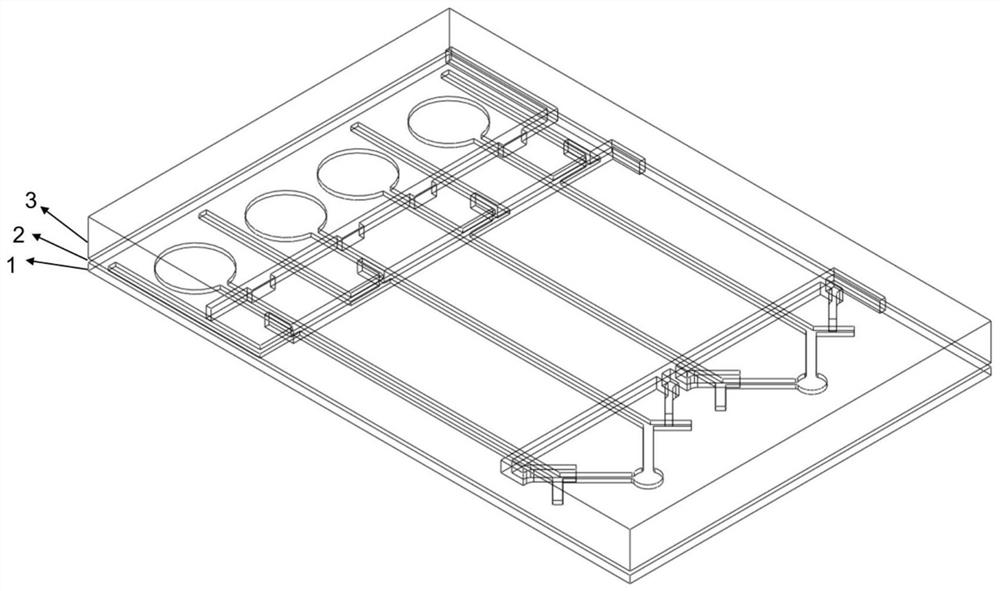
本发明提供的第一个实施例是:红绿双色荧光双重检测的微流控芯片,其结构如图2所示,该微流控芯片自下而上依次由:修饰了石墨烯和戊二醛的载玻片基底1、微流道层2和阀门控制层3组成。其中微流道层2和阀门控制层3采用聚二甲基硅氧烷(PDMS)和与之配对的固化剂,按照10:1比例混合制备而成,该材料具有良好的生物相容性和化学惰性。 微流道层2主要作用是用来固定DNA探针和样品检测,如图3和4所示,微流道层2包括多个检测单元,在一张芯片上可以实现高通量检测。其中每一个检测单元包括第一流道11、第二流道16。第一流道11和第二流道16的结构相同,均呈 “Y”字形,并且两者互为镜像。在第一流道11和第二流道16的一端分别设有DNA探针进样孔13和样品进样孔15。样品进样孔15设置在第一流道11和第二流道16之间,并与第一流道11和第二流道16连通,该样品进样孔15为第一流道11和第二流道16的共用进样孔,通过该孔可以将同一份待测样品同时加入到两个流道内分别进行检测。
在第一流道11和第二流道16的另一端,分别连接有第一微腔4和第二微腔5。第一微腔4和第二微腔5彼此分离,互不连通。两条微流道靠近微腔的一端旁边分别设有一个出样孔6。阀门控制层3主要作用是利用流体压力来控制下层微流道层2中流体走向。如图5所示,与其下方的微流道层2对应的,阀门控制层3上也有多个控制单元。其中每一个控制单元分别包括两个微腔控制阀门8、两个出样控制阀门9和2个进样控制阀门14。两个微腔控制阀门8设置在两个微腔和两条微流道之间对应的位置,两个出样控制阀门9设置在两个出样孔6与微流道之间对应的位置,两个进样控制阀门14设置在两个DNA探针进样孔13与微流道之间对应的位置。两个微腔控制阀门8通过微流道连接于第一进/出水口7;两个出样控制阀门9通过微流道连接于第二进/出水口10;两个进样控制阀门14通过微流道连接于第三进/出水口12。通过进/出水口向微流道内注入和抽出超纯水,并配合氮气,可以控制各个阀门的关闭和开启,从而控制下层微流道内流体的走向。
如图2所示,载玻片基底1位于微流道层2的下方,其与微流道对应的位置修饰(铺设)有纳米氧化石墨烯材料,纳米石墨烯材料上铺设荧光染色的DNA探针。纳米石墨烯具有较好的生物相容性,低的生物毒性,还具有很强的化学发光增敏作用。纳米石墨烯尺寸均小于14nm,猝灭能力随尺寸的减小而降低,所以纳米石墨烯猝灭能力很弱,不猝灭20bp长度的DNA单链所带的荧光基团的荧光。由于π-π键的作用,它依旧保留了单链吸附,双链解吸附的特性。载玻片基底1与微腔对应的位置修饰有戊二醛,用于固定3’端修饰有NH
本实施例中提供的红绿双色荧光双重检测的微流控芯片的检测方法和原理如图1所示,具体描述如下:
1、采用吖啶橙(AO)染料与3’端修饰了NH
2、通过微注射泵将适量的超纯水注入第一进/出水口7,然后持续注入氮气,将微腔控制阀门8压下,阻断微流道内的液体流向微腔中;
3、从两个DNA探针进样孔13分别注入1uL 不同碱基序列的DNA探针(3’端NH
7、从样品进样孔15注入1uL待检测样品,使用氮气同时将其推入到第一流道11和第二流道16中,同一种样本同时采用两种不同DNA探针进行检测;
8、待测样品与微流道内的DNA探针反应后经微流道流入微腔内;
9、对流道内和进入微腔内的液体进行荧光检测;根据不同的荧光颜色和荧光强度,判断待测样品中是否含目标miRNA;
10、将流道内液体荧光的检测结果与DNA探针的荧光信号进行对比,或者根据微腔中荧光强度,判断待测样品中目标miRNA的含量。
样本中如果有与DNA探针互补的miRNA,两者就会形成双链,双链会在石墨烯基底上解吸附,分别被冲到两个微腔中,双链DNA-miRNA杂合体通过氨基和醛基的化学反应固定在修饰有戊二醛的基底上。
石墨烯基底部分Y型微流道中,由于双链解吸附,形成双链后绿光的荧光值降低,产生“从有到无”的现象;红光的荧光值产生了一个“由无到有”的现象,红色的荧光值升高进入微腔后双链被戊二醛基底吸附,微腔中也出现了红色荧光“由无到有”的现象。微流道中绿色和红色的荧光值发生相反的变化,通过观察荧光的变化,来判断待测样品中是否含有目标miRNA,从而实现对miRNA进行红绿双色双重荧光检测的目的。
另外,通过对流道内液体的荧光检测,结合步骤5测得的DNA探针的荧光强度,对比双链形成前后,荧光信号强度的变化,可以判断计算出待测样品中目标miRNA的含量。同时,根据微腔中荧光强度值也可以判断计算出目标miRNA的含量,两个计算结果相互印证,从而实现对待测样品中miRNA的准确定量。
本发明提供的第二个实施例是:蓝绿双色荧光双重检测的微流控芯片,其结构如图6所示,该微流控芯片自下而上依次由:修饰了石墨烯和戊二醛的载玻片基底19、微流道层20和阀门控制层21组成。其中微流道层20和阀门控制层21采用聚二甲基硅氧烷(PDMS)和与之配对的固化剂,按照10:1比例混合制备而成,该材料具有良好的生物相容性和化学惰性。 微流道层20主要作用是用来固定DNA探针和样品检测,如图7和8所示,微流道层20包括多个检测单元,在一张芯片上可以实现高通量检测。其中每一个检测单元包括第一流道28、第二流道33。第一流道28和第二流道33的结构相同,均呈 “Y”字形,并且两者互为镜像。在第一流道28和第二流道33的一端分别设有DNA探针进样孔30和样品进样孔32。样品进样孔32设置在第一流道28和第二流道33之间,并与第一流道28和第二流道33连通,该样品进样孔32为第一流道28和第二流道33的共用进样孔,通过该孔可以将同一份待测样品同时加入到两个流道内分别进行检测。
在第一流道28和第二流道33的另一端,共同连接有一个微腔22。两条微流道靠近微腔的一端旁边设有出样孔23。阀门控制层21主要作用是利用流体压力来控制下层微流道层20中流体走向。如图9所示,与其下方的微流道层20对应的,阀门控制层21上也有多个控制单元。其中每一个控制单元分别包括两个微腔控制阀门25、两个出样控制阀门26和2个进样控制阀门31。两个微腔控制阀门25设置在微腔22和两条微流道之间对应的位置,两个出样控制阀门26设置在两个出样孔23与流道之间对应的位置,两个进样控制阀门31设置在两个DNA探针进样孔30与两条流道之间对应的位置。两个微腔控制阀门25通过微流道连接于第一进/出水口24;两个出样控制阀门26通过微流道连接于第二进/出水口27;两个进样控制阀门31通过微流道连接于第三进/出水口30。通过进/出水口向微流道内注入和抽出超纯水,并配合氮气,可以控制各个阀门的开启和关闭,从而控制下层微流道内流体的走向。
如图6所示,载玻片基底19位于微流道层20的下方,其与微流道对应的位置修饰(铺设)有纳米氧化石墨烯材料,纳米石墨烯材料上铺设荧光修饰的DNA探针。纳米石墨烯具有较好的生物相容性,低的生物毒性,还具有很强的化学发光增敏作用。纳米石墨烯尺寸均小于14nm,猝灭能力随尺寸的减小而降低,所以纳米石墨烯猝灭能力很弱,不猝灭20bp长度的DNA单链所带的荧光基团的荧光。由于π-π键的作用,它依旧保留了单链吸附,双链解吸附的特性。
载玻片基底19与微腔22对应的位置修饰有戊二醛,用于固定3’端修饰有NH
本实施例中提供的蓝绿双色荧光双重检测的微流控芯片的检测方法和原理如图1所示,具体描述如下:
1、分别用不同激发波长的荧光基团FAM 和Cy3,对3’端修饰有NH
2、通过微注射泵将适量的超纯水注入第一进/出水口24,然后持续注入氮气,将微腔控制阀门25压下,阻断微流道内的液体流向微腔中;
3、从两个DNA探针进样孔30分别注入1uL 不同碱基序列的DNA探针(3’端NH
4、孵育完成之后,从出样口23将多余的液体抽干,并且用PBS冲洗,将没有吸附在基底上的单链DNA探针冲洗干净。此时,DNA探针已经依靠石墨烯的大π键吸附被固定在了基底上,不同的流道内DNA探针带有不同激发波长的荧光基团;
5、对流道中结合在基地上的DNA探针的荧光信号进行检测;
6、然后,关闭氮气,从第一进/出水口24抽出超纯水,打开微腔控制阀门25,同时,通过向第二进/出水口27和第三进/出水口29注入适量超纯水,然后持续注入氮气,将出样控制阀门26、进样控制阀门31压下,阻断相应的流道;
7、从样品进样孔32注入1uL待检测样品,使用氮气同时将其推入到第一流道28和第二流道33中,同一种样本同时采用两种不同DNA探针进行检测;
8、待测样品与微流道内的DNA探针反应后经微流道流入微腔内;
9、对流道内和进入微腔内的液体分别进行荧光检测;根据不同的荧光颜色和荧光强度,判断待测样品中是否含目标miRNA;
10、将流道内液体的荧光检测结果与DNA探针的荧光信号进行对比,判断待测样品中目标miRNA的含量。
样本中如果有与DNA探针互补的miRNA,两者就会形成双链,双链会在石墨烯衬底上解吸附,同时被冲到微腔22中,双链DNA-miRNA杂合体通过氨基和醛基的化学反应固定在戊二醛基底上,使用不同波长的激光器在同一微腔中检测不同荧光基团的荧光强度,完成双色检测。
石墨烯衬底部分Y型微流道中,由于双链解吸附,被冲到微腔中,因此,在双链形成前后,相应的荧光值降低;由于微腔处的戊二醛衬底吸附双链,荧光值产生了一个“由无到有”的现象,荧光值升高。通过观察微流道和微腔内荧光强度的变化,来判断待测样品中是否含有目标miRNA,蓝绿两种不同的荧光颜色用来区分不同的miRNA。
另外,通过对流道内液体的荧光检测结果,结合步骤5测得的DNA探针的荧光强度,对比双链形成前后,荧光信号强度的变化,可以判断计算出待测样本中目标miRNA的含量。同时,根据微腔中荧光强度值也可以判断计算出目标miRNA的含量,两个计算结果相互印证,从而实现对待测样品中miRNA的准确定量。
两者发出不同颜色的荧光,从而对不同的miRNA进行蓝绿双色双重荧光检测。
本发明的微流控芯片具有的优点为:
1、双层芯片的设计更好的控制液体流向,在同一个芯片上进行集成,完成检测;
2、Y型流道设计可以在同一个流道比较反应前后荧光值变化,表征更加直观准确;
3、衬底上同时集成两种不同的材料,生物相容性好,荧光检测灵敏度高;
4、红绿双色双重检测芯片适应于AO修饰的DNA探针分子,使用同一种染剂对不同的DNA探针分子染色,最后分别固定在不同的微腔中,进行检测,纳米氧化石墨烯吸附单链,发绿光,形成双链后荧光值降低;戊二醛吸附双链,发红光,形成双链后荧光值升高;可以同时进行荧光表征,达到了双重检测的效果,使检测结果更可信;
5、蓝绿双色双重检测芯片适应于不同激发波长荧光基团标记的DNA探针,不同种类的荧光基团修饰不同种类的DNA探针分子,最后固定在同一个微腔中,采用不同波长的激光进行荧光检测,荧光值在形成双链前后均有变化,完成双色双重检测;
6、DNA探针进样口和样本进样口分开,一次加样可以同时进行两种检测,提高了检测效率;
7、该实验方案实验原理简单,易操作,检测灵敏度高,耗时短,性能稳定,成本低;
8、高通量的微流控芯片可以对多种miRNA进行同时检测。
- 双色荧光双重检测的微流控芯片及方法
- 一种多色荧光微流控芯片检测方法和实现此方法的微流控芯片
