一种花色调节基因MaGT、其应用及快速验证其功能的方法
文献发布时间:2023-06-19 11:40:48
技术领域
本发明属于植物分子生物学技术领域,具体涉及一种花色调节基因MaGT、其应用及快速验证其功能的方法。
背景技术
葡萄风信子(Muscari spp.)是一种以稀有的蓝色花色和麝香气味著称的重要观赏球根花卉。被广泛应用于花坛、花镜和庭院盆栽。基因组学和生物信息学领域的迅猛发展大大推进了我们对其花组织重要农艺性状的认识。然而这些海量的序列和表达信息并不能完全揭示基因功能,在本源植物中过表达和抑制目标基因仍然是功能研究的中重要策略。然而,葡萄风信子现有的转基因体系繁琐困难,童期漫长(3–5年),极大限制了在本源植物花组织中检验目标基因功能的效率。
迄今为止,还没有一例成功在葡萄风信子花组织中基因转化和功能验证的报道。不论是农杆菌侵染、基因枪,还是病毒诱导的瞬时沉默技术,均未能在葡萄风信子和其近源植物中有效表达,并获得稳定、可重复的转基因效果。虽然基于体细胞胚胎发生途径,可以通过农杆菌介导法获得携带GUS报告基因的稳定转化植株,但没有转基因植株后续花器官性状的相关报道。即使忽略童期,这种传统的遗传转化方法也需要耗时6–8个月才能获得转基因植株。借助模式植物体系虽然较为便捷,但对于那些物种特异性基因,采用异源模式植物体系不仅只适合‘正向遗传学’研究,还可能由于基因背景差异获得误导性的结果。
综上所述,基于器官发生途径的遗传转化方法是获得稳定转化植株和分析转基因功能的常规策略,在缩短多年生植物成花周期和提前预估花器官花色、花型、香气、大小等方面具有巨大潜力。
但目前还未有人将葡萄风信子花被片的发生途径应用于转基因花卉的获得和快速外源基因功能评估,且未有花青素3-O-葡萄糖基转移酶基因(MaGT) 具有调节葡萄风信子花色功能的报道。
发明内容
本发明的目的之一,是提供一种花色调节基因MaGT,所述花色调节基因 MaGT的核苷酸序列如SEQ ID NO:1所示。
本发明的目的之二,是提供由所述花色调节基因MaGT编码的蛋白质,其特征在于,所述蛋白质的氨基酸序列如SEQ ID NO:2所示。
本发明的目的之三,是提供一种所述花色调节基因MaGT的RNAi表达载体。
本发明的目的之四,是提供一种含有所述RNAi表达载的宿主菌。
本发明的目的之五,是提供所述花色调节基因MaGT在调节植物花色中的应用,所述植物为葡萄风信子。
进一步的,所述应用具体是:通过降低葡萄风信子中所述花色调节基因 MaGT的表达、降低葡萄风信子中所述蛋白的活性或减少葡萄风信子中所述蛋白的含量,得到花青苷含量下降和花色表型变浅的葡萄风信子。
本发明的目的之六,是提供一种快速验证所述花色调节基因MaGT功能的方法,包括以下步骤:
S1、将转色期葡萄风信子花蕾置于添加0.45μM 2,4-二氯苯氧乙酸和8.88 μM 6-苄基腺嘌呤的MS培养基上连续培养,直到再生出花被片;
S2、将GUS基因导入葡萄风信子花被片,筛选携带并稳定表达外源GUS 基因的葡萄风信子花被片;
S3、将MaGT的RNAi干扰载体整合到S2的葡萄风信子花被片中,获得转基因葡萄风信子花被片,与未转基因对照花色表型进行比较,确定MaGT基因对花色的调节功能。
与现有技术相比,本发明具有如下有益效果:
1、本发明中的花色调节基因MaGT转录表达水平降低,导致花青苷含量下降和花色表型变浅,显示该基因具有调节花色的作用,可用于葡萄风信子育种,培育出花色浅的新品种。
2、本发明的快速验证花色调节基因MaGT功能的方法,只需要3-4个月,比现有的葡萄风信子基因过表达和沉默方法更快速易行。虽然本发明以葡萄风信子为例,但该策略也可以应用于其他植物,加快花卉的基因功能研究进程。
附图说明
图1为葡萄风信子体外花被片再生;(a)四种不同发育阶段的外植体体外再生器官类型,第一行为培养前,第二行为培养后。在含有0.45μM 2,4-D和8.88 μM 6-BA的MS培养基上连续培养11周后,未开放的白色幼龄花蕾再生出叶片(I),转色期花蕾再生出花被片(II),完全着色、即将绽放的花蕾再生出畸形花被状结构(III),完全开放的小花再生出叶片(IV)。(b)不同浓度外源6-BA对外植体再生器官类型的影响。转色期花蕾外植体在添加0.45μM 2,4-D和不同浓度 6-BA的MS培养基上连续培养11周。随着6-BA浓度从0.00μM逐渐增加到 17.76μM,再生器官情况依次为无法诱导任何器官、只能产生愈伤组织、再生营养芽、再生花被片、再生畸形叶片。(c)从葡萄风信子花蕾上离体再生花被片。葡萄风信子幼龄和成熟花序(I),用于花器官诱导的转色期花蕾外植体(II,III), 外植体膨大变绿(IV),外植体产生愈伤组织(V),花原基产生(VI),再生花被片颜色出现变化(VII),完全着色的再生花被片(VIII),花被片状组织(IX)。a,b和 cII-IX中的标尺:100μm,cI中的标尺:0.5cm
图2为葡萄风信子再生和田间花被片结构特征和花青素成分;(a)再生花被片横截面;(b)田间花被片横截面;(c)再生花被片原生质体;(d)田间花被片原生质体;(e)花青素高效液相色谱图。
图3为农杆菌介导的花器官发生系统转化方法流程图。
图4为GUS报告基因在葡萄风信子转基因花被片中的过量表达;(a)以 pFGC5941为骨架,构建携带CaMV35S启动子驱动的GUS报告基因的植物表达载体,选择标记基因为Basta;从未完全展开的未转化和抗性花被片中提取总 RNA,反转录获得cDNA,然后以cDNA为模板,以Actin为内参,采用半定量和实时定量PCR方法评估GUS基因的转录表达情况(c,d);转基因和非转基因花瓣中GUS蛋白活性(e);每个柱形图代表来自3次独立重复的平均值±标准差。用t检验进行转基因花被片和未转化对照的两两比对,‘**’和‘***’分别代表二者存在显著(P≤0.01)或极显著差异(P≤0.001)。Control:未转基因花被片, GUS1-3:过表达GUS基因的转基因花被片。通过花器官发生途径,农杆菌介导法转化获得转基因葡萄风信子花被片(f)。经过预培养和与携带 CaMV35S::GUS的根癌农杆菌共培养后,花蕾外植体膨大变绿(Ⅰ)。共培养3 天的花蕾外植体表现出GUS瞬时表达活性(Ⅵ),接种于选择培养基上的外植体花梗周围出现BIA
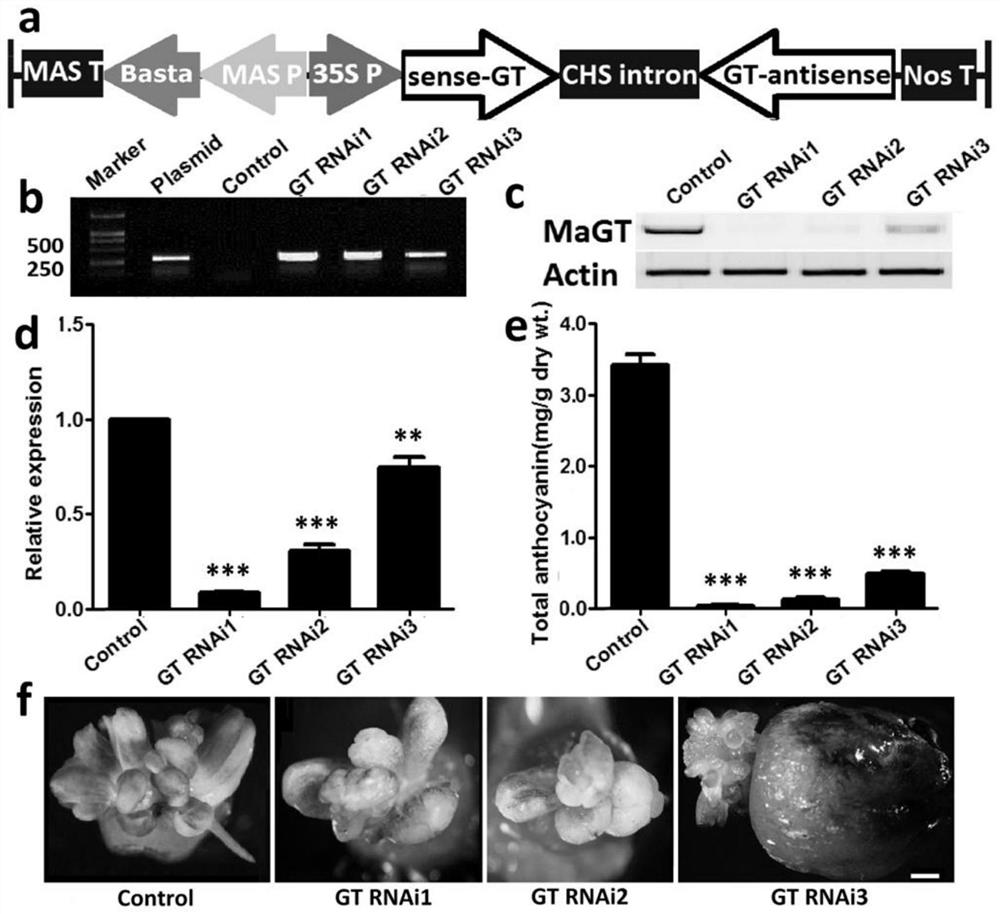
图5为MaGTRNAi干扰表达载体稳定转化葡萄风信子花被;用于转化的 pFGC-MaGT1RNAi植物表达载体T-DNA示意图(a)。以未转基因花被片为阴性对照,植物表达载体质粒为阳性对照,转基因花被片基因组DNA为模板,PCR 扩增256bp的MaGT基因片段(b)。取完全成熟前的幼嫩花被片提取总RNA,以Actin为内参基因,采用半定量(c)和实时定量(d)PCR方法检测MaGT1 基因的mRNA表达情况。转基因和未转化花被片的花青素含量(e)和表型比较(f)。每个柱形图代表来自3次独立重复的平均值±标准差。用t检验进行转基因花被片和未转化对照的两两比对,**和***分别代表二者存在显著(P≤0.01) 或极显著性差异(P≤0.001)。Control:未转基因花被片,GT RNAi1-3:3份不同的转基因花被片中内源MaGT1基因表达情况。
具体实施方式
下面结合附图和具体实施例对本发明进行详细说明,但不应理解为本发明的限制。如未特殊说明,下述实施例中所用的技术手段为本领域技术人员所熟知的常规手段,下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1、快速验证花色调节基因MaGT功能的方法
1、植物材料
葡萄风信子亚美尼亚(M.armeniacum)五年生鳞茎,从浙江虹越种业有限公司购得,在陕西省杨凌示范区西北农林科技大学试验田种植。
2、葡萄风信子体外花被片再生
分别从葡萄风信子幼龄和成熟花序(图1c)上采集4个不同发育阶段的小花蕾外植体(图1aI-IV),将外植体在75%(v/v)乙醇中表面消毒30s,0.1%HgCl2 脱菌5min,无菌水冲洗2次。无菌外植体在MS培养基中添加3%(w/v)蔗糖、 0.3%(w/v)植物凝胶、0.45μM 2,4-二氯苯氧乙酸(2,4-dichlorophenoxyacetic acid, 2,4-D)和不同浓度的6-苄基腺嘌呤(6-benzyladenine,6-BA)(0.00、1.11、2.22、4.44、 8.88、13.32、17.76μM)的花诱导培养基上培养,每2周继代一次。培养基在121℃高压灭菌20min,调节pH至6.0。培养条件为21℃,光照强度25μmol m
3、农杆菌菌株和植物表达载体
携带CaMV35S启动子::GUS基因的pFGC5941载体构建参考Yuan等建立的方法(YuanSW,Wu XL,Liu ZH,Luo HB,Huang RZ.Abiotic stresses and phytohormones regulateexpression of FAD2 gene in Arabidopsis thaliana.J Integr Agr.2012;11(01):62–72.)。为构建MaGT1 RNAi植物表达载体,根据MaGT1 cDNA序列(GenBank No.MK652470)设计特异性引物,MaGT RNAi-F和MaGT RNAi-R。然后在正向引物RNAi-F的5′端分别添加NcoⅠ和PacⅠ酶切位点和保护碱基获得MaGT RNAi-F1和MaGT RNAi-F2,同时在反向引物RNAi-R的3′端分别添加AscⅠ和XbalⅠ酶切位点和保护碱基获得MaGT RNAi R1和 MaGT RNAi-R2),分别扩增MaGT1正义和反义序列。将酶切后的MaGT1重复片段分别插入pFGC5941载体的AscⅠ/NcoⅠ和PacⅠ/XbalⅠ酶切位点之间,获得植物RNAi表达载体pFGC-MaGT1 RNAi。最后将所有载体用冻融法导入农杆菌菌株LBA4404。将携带目标载体的农杆菌单菌落在添加60μgml
表1本发明所用引物列表
4、农杆菌介导的植物遗传转化
从葡萄风信子幼年花序上采集转色期花蕾外植体(图1aII),表面消毒后接种于预培养基中[MS培养基+0.45μM 2,4-D+8.88μM 6-BA+3%(w/v)蔗糖+0.3% (w/v)植物凝胶]。预培养5天后,将外植体转移到含有20mL1/2MS液体培养基的离心管中,80MHz超声造伤处理5min。然后将超声处理后的外植体转移到含有目的质粒的农杆菌重悬液(OD
5、转基因植物的分子分析
随机采集未转基因对照和推定的转基因花被片进行分子检测。采用 TIANampGenomic DNA kit(TIANGEN Biotech Co.,Ltd.,Beijing,China),根据操作说明书,从100mg花被片中提取基因组DNA。以基因组DNA为模板,以转化植株所用质粒DNA为阳性对照,未转基因再生花被片DNA为阴性对照,根据目标基因序列设计特异性引物(表1),利用rTaq酶(Takara Biotechnology, Dalian,China),对转基因花被片中的目的序列(GUS或Basta基因片段)进行PCR 检测。采用半定量PCR和实时定量PCR方法分析目标基因在转基因材料中的转录表达情况。根据Liu等的方法(Liu H,Lou Q,Ma J,Su B,Gao Z,Liu Y. Cloningand functional characterization of dihydroflavonol 4-reductase gene involvedin anthocyanin biosynthesis of grape hyacinth.Int J Mol Sci. 2019;20(19):4743),提取每个植物样品总RNA、反转录合成cDNA。半定量 PCR方法反应条件如下:94℃预变性3min,94℃变性30s,55℃退火30s, 72℃延伸30s,25个循环,最后72℃最后延伸5min。实时定量PCR引物和内参基因MaActin序列见表1。每次试验至少进行三次独立的生物学重复。
6、GUS定性定量分析
GUS组织化学染色方法参考Liu等的方法,荧光定量分析参考Jefferson的方法(Jefferson RA, Kavanagh TA,Bevan MW.GUS fusions:beta-glucuronidase as asensitive and versatile gene fusion marker in higher plants.EMBO J.1987;6(13):3901–3907)。以1mM 4-MUG(4-methyl umbelliferylβ-D-glucuronide)(Sigma-Aldrich, Shanghai,China)为底物,对未转化对照和转基因花被片进行GUS蛋白活性检测。荧光值用Hitachi850荧光分光光度计(Hitachi,Tokyo,Japan)记录。蛋白质浓度参考Bradford方法计算(Bradford MM.A rapid and sensitive method for thequantitation of microgram quantities of protein utilizing the principle ofprotein-dye binding.Anal Biochem.1976;72(1–2):248–254)。
7、形态观察
参考之前报道的方法(Qi Y,Lou Q,Li H,Yuan J,Liu Y,Wang Y.Anatomical andbiochemical studies of bicolored flower development in Muscari latifolium.Protoplasma.2013;250(6):1273–1281),徒手切片获得花被片横截面,酶解法提取花被片原生质体。原生质体制备方法如下,首先将充分着色的花被片用刮胡刀片切成0.5mm的小段,迅速浸入含有1.3%(w/v)纤维素酶R-10(Yakult,Japan) 和0.3%(w/v)离析酶R-10(Yakult,Japan)的解离液中。从反应混合物中分离纯化解离出的原生质体。将新鲜的切片和解离出的原生质体立即置于载玻片上,在光学显微镜(Eclipse 50i,Nikon,Japan)下观察记录。
8、花青素分析
花青素的提取和定量方法参考前期报道(Lou Q,Wang L,Liu H,Liu Y.Anthocyanin profiles in flowers of grape hyacinth.Molecules.2017;22(5):688)。将转基因和未转基因花被片置于甲醇∶水∶甲酸∶三氟乙酸溶液(70:27:2:1,v/v) 中,4℃过夜萃取花青素。将部分提取液中加入等体积6M HCl,90℃处理获得花青苷水解产物。采用高效液相色谱法,以氯化飞燕草素标准品(Sigma,St.Louis, Mo,USA)为参照计算花青素含量。每次试验至少进行三次独立的生物学重复。
9、数据分析
均值和标准差(SD)至少从3次独立试验中获得。利用SPSS 20.0软件(SPSS Inc.,Chicago,USA),采用单因素方差分析比较不同外植体年龄和外源激素浓度对离体花诱导的影响以及不同条件参数对转化效果的影响。采用t检验分析再生和大田、转基因和对照花被片之间的差异。
结果:
(1)外植体年龄和细胞分裂素对葡萄风信子离体花器官发生至关重要
将葡萄风信子小花蕾接种在含有固定浓度外源生长素(0.45μM 2,4-D)和分别添加6种不同浓度的细胞分裂素6-BA(0-17.76μM)的MS培养基上,连续培养11周后统计不同激素组合下外植体花器官再生的情况。结果表明,在只含有2,4-D的培养基上,外植体无法再生出任何器官(图1b,表2)。添加6-BA能够显著促进花器官的形成。当6-BA和2,4-D摩尔比例从2.5增加到19.7时,花被片发生效从0%增加到36.8%(图1b,表2)。随着6-BA浓度的进一步增加,再生器官逐渐变粗、畸形,生长缓慢或停滞(图1b,表2)。因此,选择0.45μM 2,4-D和8.88μM 6-BA的外源激素组合进行后续研究。
众所周知,源自花器官的外植体更容易离体诱导花器官再生。前期研究中,发明人一直未能从任何来自葡萄风信子营养器官的外植体中获得再生花器官 (数据未显示)。因此,本研究按发育阶段将花蕾分为4个时期(图1a):时期Ⅰ,未开始着色的幼龄花蕾,时期Ⅱ,转色期花蕾,时期Ⅲ,完全着色、未开放的花蕾,时期Ⅳ,完全开放的小花。当接种于添加0.45μM 2,4-D和8.88μM 6-BA 的花诱导培养基时,时期Ⅰ的外植体只诱导出叶片,时期Ⅱ和Ⅲ的花蕾成功再生出花被片和/或加粗的花瓣状结构(图1a)。花被片再生率以时期Ⅱ的外植体最高(57%)(表3)。时期Ⅳ的外植体大多数继续发育成膨大的果实,少部分逐渐褐化死亡(图1a)。因此,以时期Ⅱ的转色期花蕾为外植体进行后续研究。
表2外源6-BA对葡萄风信子花被再生的影响
注:外植体在含有0.45μM 2,4-D和不同浓度6-BA的MS培养基上培养11 周后统计再生花被片数量;采用Tukey多重检验比较不同均值之间的差异性(P< 0.05)。*加厚、畸形、生长缓慢的再生器官(图1b)。
表3不同发育阶段外植体花被再生频率。
注:外植体在含有0.45μM 2,4-D和不同浓度6-BA的MS培养基上培养11 周后统计再生花被片数量;采用Tukey多重检验比较不同均值之间的差异性(P< 0.05)。*加厚、畸形、生长缓慢的再生器官(图1b)。
(2)葡萄风信子离体花被片再生
转色期花蕾体外消毒后,接种在添加0.45μM 2,4-D和8.88μM 6-BA的花诱导培养基上。培养五天后,外植体膨大并变为绿色(图1cIV)。随后小花梗基部周围细胞脱分化并形成愈伤组织群(图1cV)。愈伤组织进一步形成花原基并在培养5周后开始形成肉眼可见的花被片(图1cVI)。经过6周的培养,花原基不断扩增,花被片逐渐增多(图1cVII)。这些花被片逐渐增长、舒展,并从顶部开始向基部变为紫蓝色,最后发育成完全着色、稍微内卷的花被片或较厚的花瓣状结构(图1cVIII,IX)。解剖结构表明,虽然再生花被片尺寸较小,但基本结构与田间采集的花被片结构相似。都由排列紧致的上下表皮,无色的海绵组织和紫蓝色的栅栏组织组成(图2a,b)。不同深浅的紫色和蓝色原生质体叠加产生相同的紫蓝色表型(图2c,d)。花青素分析显示,二者花青素成分非常相似(图 2e)。
(3)通过花器官再生途径获得过量表达GUS报告基因的转基因葡萄风信子花被片
利用花被片离体再生体系,结合农杆菌介导的遗传转化法(图3),将葡萄糖醛酸酶报告基因(Glucuronidase reporter gene,GUS)导入葡萄风信子花组织。
首先,将转色期花蕾与携带CaMV35S::GUS的根癌农杆菌共培养3天(图 4a)。为了确定瞬时转化效率,对共培养后的60个花蕾外植体进行GUS组织化学染色检测,其中92%的外植体出现不同程度的蓝色染色情况(图4fVI),而未共培养的对照花蕾则几乎没有出现蓝色斑点。同时,将农杆菌侵染的外植体转移到含有Cef的培养基上培养7天,以便杀死过量生长的农杆菌。随后将外植体转接于含有0.5mg l
(4)干扰内源MaGT表达使葡萄风信子花被片中花青素含量降低,花色变浅
为了验证葡萄风信子花青素合成和修饰基因花青素3-O-葡萄糖基转移酶(Anthocyanidin 3-O-glucosyltransferase,MaGT)的功能,同时检验农杆菌介导的花器官转化方法是否适用于“反向”基因功能研究。构建了MaGT1 RNAi干扰表达载体(图5a),采用同样的方法进行遗传转化(图3)。首先,经过共培养和抑菌培养后,将花蕾外植体转接到筛选培养基上,获得BIA
本发明所产生的意义还应重声或者补充如下:
本发明建立了一种葡萄风信子离体花被片再生体系,既可以提高遗传转化效率,又能在花中早期进行基因功能验证。比现有的所有葡萄风信子基因过表达或沉默方法更简单易行。虽然本研究以葡萄风信子为例,但该思路也适用于其他多年生观赏植物。
本发明中的花色调节基因MaGT转录表达水平降低,导致花青苷含量下降和花色表型变浅,显示该基因具有调节花色的作用,可用于葡萄风信子育种,培育出花色浅的新品种。
尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例作出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
序列表
<110> 西北农林科技大学
<>
<120> 一种花色调节基因MaGT、其应用及快速验证其功能的方法
<>
<160> 18
<>
<170> SIPOSequenceListing 1.0
<>
<210> 1
<211> 1338
<212> DNA
<213> 葡萄风信子
<>
<400> 1
atgatcccct tccttcagct cgccatcgcc ttggccaaca tcggccaccg catctccttc 60<>
atctgcaccc ctcgcaacat cctgcagctc cgccccaaag tccccgacca tctcctctcc 120<>
ctcgtatcct tcgtaagctt ccccttgcac cggctcgaag gcctccccga ggaagccgag 180<>
gcgaccaccg ggctcacgtg ggagactcgg ctgctcatag aggcatacga tctgcttcaa 240<>
gacccgatca aggggttcct ggccgactcg tcgccagact ggctcgttta cgacttcatc 300<>
gcaccgtggg ctggaaggat cgccaaggat tgcggcgtgg ggacggtcta cttctccgtc 360<>
ttccaccctt ccaagctcgc cttctacccg gccgttgaag aacggctgcg atactggaag 420<>
acgccggaga gcatgacgac gaagcctgac tggatcccct tcccttcgaa ggtggccttc 480<>
aagctgcacg aggcgcggtt catgcatcgg gcctttgggg ttgcggccgc cgccggccgt 540<>
gggcggaatg cgacggaatt agaatccgat gtgctggccg tgaggggttg ctatgagaat 600<>
gggggagagt atctggagct gctcccgaaa ttgcgcccga atgcggtgat tcccgtggga 660<>
ttgcttcccc cggtgccgga gaaagagagt tccaccaaag atgatggcta ctggagcggc 720<>
atattcggat ggctcgatga gcagcagcct cgttccgtcg ttttcgtgag ctttgggagc 780<>
gagtacaagc tcagccaaac tgaagtgcaa gagatagcct ctggactgga gcaatctggc 840<>
ctgccgttcc tgtggactct gaggaagccg ctctggctaa ccggcgacga catcggcgag 900<>
gccctgccgg ccggattcct ggaccgtacc aagggccgag gctttgttgc ggctggctgg 960<>
gctccgcagc tggaaatctt ggcccatcct tccattggcg gatccttgtt tcattcgggg 1020<>
tggggatcca ttgtggagac tctcagatac ggacatgtgc tcatactcct gccctttgtg 1080<>
tgcgaccagg gcctgaacgc taggttcctc gtcgagaagg ggttgggcgt tgaggttgag 1140<>
agaaatgaag acggttcctt cactggggtt gatgtcgccc gggctctgac cacggcgatg 1200<>
gtctccgatg aaggggaggc gttgagggac aaagcgagag aggcggcgac tgtttttgcc 1260<>
gatcaaccac tccacgatga gtacgtaaag aagttcgccg atcacctcct cgctgctcgc 1320<>
aacaagccgg acgcgtag 1338<>
<>
<210> 2
<211> 445
<212> PRT
<213> 葡萄风信子
<>
<400> 2
Met Ile Pro Phe Leu Gln Leu Ala Ile Ala Leu Ala Asn Ile Gly His <>
1 5 10 15 <>
Arg Ile Ser Phe Ile Cys Thr Pro Arg Asn Ile Leu Gln Leu Arg Pro <>
20 25 30 <>
Lys Val Pro Asp His Leu Leu Ser Leu Val Ser Phe Val Ser Phe Pro <>
35 40 45 <>
Leu His Arg Leu Glu Gly Leu Pro Glu Glu Ala Glu Ala Thr Thr Gly <>
50 55 60 <>
Leu Thr Trp Glu Thr Arg Leu Leu Ile Glu Ala Tyr Asp Leu Leu Gln <>
65 70 75 80 <>
Asp Pro Ile Lys Gly Phe Leu Ala Asp Ser Ser Pro Asp Trp Leu Val <>
85 90 95 <>
Tyr Asp Phe Ile Ala Pro Trp Ala Gly Arg Ile Ala Lys Asp Cys Gly <>
100 105 110 <>
Val Gly Thr Val Tyr Phe Ser Val Phe His Pro Ser Lys Leu Ala Phe <>
115 120 125 <>
Tyr Pro Ala Val Glu Glu Arg Leu Arg Tyr Trp Lys Thr Pro Glu Ser <>
130 135 140 <>
Met Thr Thr Lys Pro Asp Trp Ile Pro Phe Pro Ser Lys Val Ala Phe <>
145 150 155 160 <>
Lys Leu His Glu Ala Arg Phe Met His Arg Ala Phe Gly Val Ala Ala <>
165 170 175 <>
Ala Ala Gly Arg Gly Arg Asn Ala Thr Glu Leu Glu Ser Asp Val Leu <>
180 185 190 <>
Ala Val Arg Gly Cys Tyr Glu Asn Gly Gly Glu Tyr Leu Glu Leu Leu <>
195 200 205 <>
Pro Lys Leu Arg Pro Asn Ala Val Ile Pro Val Gly Leu Leu Pro Pro <>
210 215 220 <>
Val Pro Glu Lys Glu Ser Ser Thr Lys Asp Asp Gly Tyr Trp Ser Gly <>
225 230 235 240 <>
Ile Phe Gly Trp Leu Asp Glu Gln Gln Pro Arg Ser Val Val Phe Val <>
245 250 255 <>
Ser Phe Gly Ser Glu Tyr Lys Leu Ser Gln Thr Glu Val Gln Glu Ile <>
260 265 270 <>
Ala Ser Gly Leu Glu Gln Ser Gly Leu Pro Phe Leu Trp Thr Leu Arg <>
275 280 285 <>
Lys Pro Leu Trp Leu Thr Gly Asp Asp Ile Gly Glu Ala Leu Pro Ala <>
290 295 300 <>
Gly Phe Leu Asp Arg Thr Lys Gly Arg Gly Phe Val Ala Ala Gly Trp <>
305 310 315 320 <>
Ala Pro Gln Leu Glu Ile Leu Ala His Pro Ser Ile Gly Gly Ser Leu <>
325 330 335 <>
Phe His Ser Gly Trp Gly Ser Ile Val Glu Thr Leu Arg Tyr Gly His <>
340 345 350 <>
Val Leu Ile Leu Leu Pro Phe Val Cys Asp Gln Gly Leu Asn Ala Arg <>
355 360 365 <>
Phe Leu Val Glu Lys Gly Leu Gly Val Glu Val Glu Arg Asn Glu Asp <>
370 375 380 <>
Gly Ser Phe Thr Gly Val Asp Val Ala Arg Ala Leu Thr Thr Ala Met <>
385 390 395 400 <>
Val Ser Asp Glu Gly Glu Ala Leu Arg Asp Lys Ala Arg Glu Ala Ala <>
405 410 415 <>
Thr Val Phe Ala Asp Gln Pro Leu His Asp Glu Tyr Val Lys Lys Phe <>
420 425 430 <>
Ala Asp His Leu Leu Ala Ala Arg Asn Lys Pro Asp Ala <>
435 440 445 <>
<>
<210> 3
<211> 23
<212> DNA
<213> 人工序列
<>
<400> 3
gctgccgttc ctgtggactc tga 23<>
<>
<210> 4
<211> 22
<212> DNA
<213> 人工序列
<>
<400> 4
gcctctctcg ctttgtccct ca 22<>
<>
<210> 5
<211> 33
<212> DNA
<213> 人工序列
<>
<400> 5
ggggccatgg gctgccgttc ctgtggactc tga 33<>
<>
<210> 6
<211> 30
<212> DNA
<213> 人工序列
<>
<400> 6
ggcgcgccgc ctctctcgct ttgtccctca 30<>
<>
<210> 7
<211> 32
<212> DNA
<213> 人工序列
<>
<400> 7
ggttaattaa ctgccgttcc tgtggactct ga 32<>
<>
<210> 8
<211> 30
<212> DNA
<213> 人工序列
<>
<400> 8
gctctagagc ctctctcgct ttgtccctca 30<>
<>
<210> 9
<211> 17
<212> DNA
<213> 人工序列
<>
<400> 9
cccgatgaca gcgacca 17<>
<>
<210> 10
<211> 19
<212> DNA
<213> 人工序列
<>
<400> 10
tcaacttccg taccgagcc 19<>
<>
<210> 11
<211> 17
<212> DNA
<213> 人工序列
<>
<400> 11
aacggcaaga aaaagca 17<>
<>
<210> 12
<211> 16
<212> DNA
<213> 人工序列
<>
<400> 12
gcgaggtcgc aaaatc 16<>
<>
<210> 13
<211> 20
<212> DNA
<213> 人工序列
<>
<400> 13
gcgtggtgat gtggagtatt 20<>
<>
<210> 14
<211> 18
<212> DNA
<213> 人工序列
<>
<400> 14
tggtatcggt gtgagcgt 18<>
<>
<210> 15
<211> 21
<212> DNA
<213> 人工序列
<>
<400> 15
ccaccaaaga tgatggctac t 21<>
<>
<210> 16
<211> 19
<212> DNA
<213> 人工序列
<>
<400> 16
gcttgtactc gctcccaaa 19<>
<>
<210> 17
<211> 22
<212> DNA
<213> 人工序列
<>
<400> 17
aacattcaga aagagtccac cc 22<>
<>
<210> 18
<211> 22
<212> DNA
<213> 人工序列
<>
<400> 18
gcttaccagc aaagatcaac cg 22<>
<>
<>
<>
- 一种花色调节基因MaGT、其应用及快速验证其功能的方法
- 利用玉米花色素苷调节基因Lc快速培育不育水稻的方法
