一种耐甲氧西林金黄色葡萄球菌的突变菌及其应用
文献发布时间:2023-06-19 11:47:31
技术领域
本发明涉及分子生物学及微生物领域,具体而言,涉及一种耐甲氧西林金黄色葡萄球菌的突变菌及其应用。
背景技术
骨髓炎是一类由致病微生物(包括化脓性细菌、分支杆菌及真菌等)引起的骨皮质、骨髓、骨膜及其周围软组织的感染性疾病。
据报道,在发展中国家,骨髓炎的发病率占总人群的0.2%。随着我国逐渐进入老龄化社会、伴随糖尿病发病率的上升、创伤意外的增加,骨髓炎的发生率仍有上升趋势。在所有骨髓炎患者中,约37%患者存在因骨不愈合的并发症,更有14%的患者面临截肢的风险,可见骨髓炎已成为威胁人类健康的重大疾病之一。因此,如何实现骨髓炎的有效防治,是关系到国计民生的重要公共卫生问题。
金黄色葡萄球菌是骨髓炎发生发展的最重要致病菌,约占所有致病菌的30%。值得关注的是,目前已有超过50%金黄色葡萄球菌对β-内酰胺类抗生素产生了耐药性(如:耐甲氧西林金黄色葡萄球菌MRSA)。
发明内容
本发明的目的在于提供一种耐甲氧西林金黄色葡萄球菌的突变菌及其应用。本发明提供的耐甲氧西林金黄色葡萄球菌突变菌其具有较低的胞外多糖合成能力以及较低的生物膜代谢能力,但该突变菌对头孢西丁抗生素敏感;该突变菌可以通过内源性生态治疗的策略用于治疗因耐甲氧西林金黄色葡萄球菌感染引起的相关疾病,本发明为此类疾病的治疗提供了一种新的治疗思路。
本发明是这样实现的:
一方面,本发明提供一种耐甲氧西林金黄色葡萄球菌的突变菌。其yycG基因的表达受到抑制。
生物膜是黏附于有生命或无生命物体表面被细菌胞外大分子包裹的有组织的细菌群体结构,具有1、阻滞抗生素渗透;2、促进耐药菌株的产生;3、改变细菌生长微环境等作用。因此金黄色葡萄球菌生物膜形成能力与其耐药性的产生有着密切的联系。
细胞间多糖粘附素(polysaccharide intercellular adhesion,PIA)作为金黄色葡萄球菌生物膜胞外多糖的重要组成部分,与生物膜的表型变化有着密切关系。ica基因参与编码PIA合成的糖基转移酶,是参与PIA合成的重要基因。通过ica基因的调控作用使得PIA在金黄色葡萄球菌表面锚定并发挥生物学功能,使得细菌获得粘附性,并逐渐形成生物膜。
本发明的研究发现,yycG转录体系与金黄色葡萄球菌生物膜形成有关。该体系可调控糖基转移酶ica基因表达,影响胞外多糖合成代谢,改变生物膜基质含量,调控细菌对抗生素的敏感性。
本发明通过抑制耐甲氧西林金黄色葡萄球菌的yycG基因的表达,使得耐甲氧西林金黄色葡萄球菌的胞外多糖合成能力和生物膜形成能力降低,其更为显著的是,yycG基因表达受到抑制后,耐甲氧西林金黄色葡萄球菌对头孢西丁抗生素敏感,其耐药性大大地降低。此类突变菌具有广泛的用途,其重要的用途之一便是通过内源性生态治疗的策略将此类突变菌用于治疗因耐甲氧西林金黄色葡萄球菌感染引起的相关疾病,且本发明的研究也显示,将该突变菌用于治疗此类疾病,可以取得较好的治疗效果,这对本领域技术人员来说是不曾预料的,本发明可为治疗该类疾病提供一种新的治疗思路和策略。
可选地,在本发明的一些实施方案中,所述耐甲氧西林金黄色葡萄球菌的突变菌的保藏编号为CCTCC NO:M 2020227。
上述突变菌株的yycG基因表达受到抑制,其具有较低的胞外多糖合成能力以及较低的生物膜代谢能力,但其头孢西丁抗生素敏感;该突变菌可以通过内源性生态治疗的策略用于治疗因耐甲氧西林金黄色葡萄球菌感染引起的相关疾病。
采用本发明的突变菌治疗通过内源性生态治疗的策略用于治疗因耐甲氧西林金黄色葡萄球菌感染引起的相关疾病的方法可以参考如下:
将本发明的突变菌株递送至感染病灶,使其成为优势菌株,进而抑制野生型耐甲氧西林金黄色葡萄球菌的生物膜形成,以达到控制感染的目的。
本发明将能够将反义RNA表达载体导入所述野生型耐甲氧西林金黄色葡萄球菌内,获得反义RNA过表达的突变菌株,使得感染病灶的优势菌株为该突变株。由于该突变株的生物膜的成膜能力明显受到反义RNA的抑制,从而抑制感染病灶中金黄色葡萄球菌生物膜形成,以达到控制感染的目的。
另一方面,本发明提供如上任一项所述的耐甲氧西林金黄色葡萄球菌的突变菌在制备用于治疗耐甲氧西林金黄色葡萄球菌感染引起的相关疾病的药物中的应用。
可选地,在本发明的一些实施方案中,所述疾病为骨髓炎。
本发明提供的耐甲氧西林金黄色葡萄球菌的突变菌其应用治疗的疾病包括但不限于骨髓炎,其他由耐甲氧西林金黄色葡萄球菌突变菌引起的疾病,也可以采用本发明的耐甲氧西林金黄色葡萄球菌突变菌进行治疗。
另一方面,本发明提供一种治疗疾病的药物,其含有如上任一项所述的耐甲氧西林金黄色葡萄球菌突变菌,所述疾病由耐甲氧西林金黄色葡萄球菌感染引起。
另一方面,本发明提供一种制备如上任一项所述的耐甲氧西林金黄色葡萄球菌的突变菌的方法,其包括:抑制野生型耐甲氧西林金黄色葡萄球菌的yycG基因的表达。
本领域技术人员应当容易地理解到,在本发明公开的基础上,本领域技术容易想到采用本领域常规的基因编辑方式例如包括但不限于RNA干扰技术以使yycG基因的表达受到抑制,得到本发明的耐甲氧西林金黄色葡萄球菌突变菌。
可选地,在本发明的一些实施方案中,采用RNA干扰技术抑制yycG基因的表达。
可选地,在本发明的一些实施方案中,采用RNA干扰技术抑制yycG基因的表达包括:将能够表达出反义RNA的反义RNA表达载体导入所述野生型耐甲氧西林金黄色葡萄球菌内。
所述反义RNA能够特异性结合yycG基因的正义链mRNA并形式双链RNA结构。
可选地,在本发明的一些实施方案中,所述反义RNA的碱基序列如SEQ ID NO.1所示。
本发明研究证实SEQ ID NO.1所示的反义RNA可特异性的结合于yycG基因的正义链mRNA,形成双链结构,加速mRNA的降解,抑制mRNA的转录翻译过程,从而下调yycG基因的表达量,使得耐甲氧西林金黄色葡萄球菌表现出胞外多糖合成能力以及生物膜代谢能力降低的特异性,并且对头孢西丁抗生素的敏感性显著上升,进而为使用此抗生素治疗该菌引起的疾病提供了基础。
可选地,在本发明的一些实施方案中,所述反义RNA表达载体的骨架为pDL278,其含有表达所述反义RNA的表达序列。
所述表达序列的碱基序列如SEQ ID NO.2所示。
可选地,在本发明的一些实施方案中,所述表达序列位于所述pDL278质粒载体的BamHI和EcoRI酶切位点之间。
另一方面,本发明提供制备如上任一项所述的耐甲氧西林金黄色葡萄球菌突变菌的试剂,其能够被导入野生型耐甲氧西林金黄色葡萄球菌并抑制yycG基因的表达。
可选地,在本发明的一些实施方案中,所述试剂为反义RNA。
可选地,在本发明的一些实施方案中,所述反义RNA的碱基序列如SEQ ID NO.1所示。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
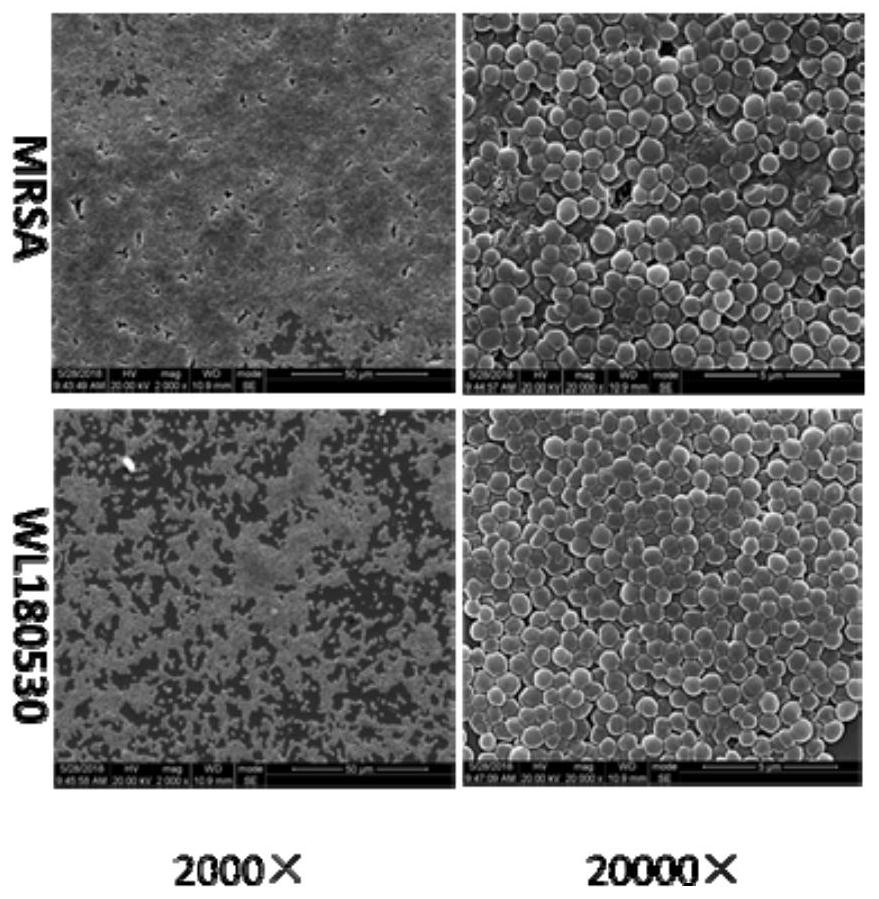
图1为本发明实验例1提供的菌株的扫描电镜结果图。
图2为本发明实验例1提供的菌株的生长曲线图,短线为野生株,圆形为突变株。
图3为本发明实验例1提供的菌株染色结果图。
图4为本发明实验例1提供的菌株染色吸光度值比较示意图。
图5为本发明实验例2提供的菌株蛋白实验结果图;图中ATCC29213为甲氧西林敏感的金黄色葡萄球菌标准株。
图6为本发明实验例2提供的菌株糖基转移酶相关基因表达量比较图。
图7为本发明实验例2提供的菌株yycG基因表达量比较图。
图8为本发明实验例1提供的菌株在小鼠体内的致病能力比较。
具体实施方式
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。因此,以下对在附图中提供的本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实施例1
本实施例提供了一种耐甲氧西林金黄色葡萄球菌突变菌,该突变菌的保藏编号为CCTCC NO:M 2020227。
该突变菌是yycG基因以及YycG蛋白表达下降的耐甲氧西林金黄色葡萄球菌(Methicillin-resistant staphylococcus aureus,MRSA)突变株;具有抗壮观霉素抗性、胞外多糖合成能力、生物膜合成能力降低以及头孢西丁抗生素敏感性增加的特性。
实施例2
本实施例提供了一种如实施例1中提供的耐甲氧西林金黄色葡萄球菌突变菌的制备方法,包括以下步骤:
1.1根据耐甲氧西林金黄色葡萄球菌的yycG基因序列,设计反义RNA序列,碱基序列如SEQ ID No.1所示;并设计特异引物序列(含酶切位点:BamHI/EcoRI),以yycG基因的反义RNA序列为模板扩增获得表达该反义RNA的反义RNA表达序列(SEQ ID No.2)。
SEQ ID No.1:
ucguguuaaauaccaugcgauauguuuuuaacuuuucagguuuacuuggugcaaaaacaugcgucguacgaucaauuguaucuuuguuugugaugauaucuguguaugguugcauaucuuuuuucacugcugcuaaugcaucuaaaaaguaaucauuuuucguuguaguuguuaauuuuacguaaucauggcggucuuuacuaauagcauaaagcacgauauuaucaucagcaucaugaucuaugaccaaacgauugaaauugaaaugauuugguacuuucgcauucauguucaguacuuggccaagauauguugauaacgguaaaucauacguaaaaucgaauaauguaaaaucacugcucaaaucaggaaucaucaaguuaugaucacgacgaacauguuccacggacuucacuucuuuauuuuucaaagguuucgucagcuuauucacauuagaaaccgucgcgaucguaccuucuggaugaucauuuuucgaaugaauaaucugaaauggcguaauaguuguauccauuuuggcugucauaggugucguuaaagguuucguuucacucuucuuacuaucuguauugucgacauuugcaauaucaggagaaaaguuccauaccauauaugucaauacgacacucaucaagacgaguagugcuaaaaugacagauuuaauauguuccuuauuauucau。
SEQ ID No.2:
其中,下划线为酶切位点。
1.2将pDL278质粒载体分别用BamHI和EcoRI进行双酶切,并回收获得线性片段,将其与上述步骤获得的经同样双酶切后的反义RNA表达序列通过连接酶连接得到pDL278-ASyycG重组质粒,即金黄色葡萄球菌yycG基因的反义RNA表达载体;
1.3将野生型耐甲氧西林金黄色葡萄球菌(中国四川省成都市的四川大学华西医院病原微生物检验科获取的骨髓炎病灶分离的耐甲氧西林金黄色葡萄球菌)接种于胰蛋白胨大豆肉汤(TSB)培养基中,传代过夜厌氧培养代用;
1.4取2μL的干反义RNA表达载体pDL278-ASyycG重组质粒,加入到含有50μL的野生型耐甲氧西林金黄色葡萄球菌菌液的500μL的TSB液体培养基中进行转化,TSB液体培养基中含有终浓度为1μg/mL的金黄色葡萄球菌感受肽;
1.5步骤1.4中转化后的菌液于37℃的条件下厌氧培养150min,得到转化菌液;
1.6将厌氧培养的转化菌液接种于带有壮观霉素的TSB平板(含有终浓度为480μg/mL的红霉素),37℃厌氧培养48h,并传代得到实施例1的野生型耐甲氧西林金黄色葡萄球菌突变菌株(编号:WL180530,后文称为突变菌株或WL180530、或突变菌株WL180530);
该突变菌株于2020年6月19日保藏于中国典型培养物保藏中心(CCTCC)。地址:中国.武汉.武汉大学;拉丁文学名:Staphylococcus aureus;名称:Staphylococcus aureusWS20200617;保藏编号为CCTCC NO:M 2020227。
需要说明的是,虽然实施例中使用的是特定来源的野生型甲氧西林金黄色葡萄球菌菌株作为基础来构建突变菌株,但在其他的实施例中,也可以采用普通的其他来源的野生型甲氧西林金黄色葡萄球菌菌株构建本发明的突变菌株,所得到的突变菌株也具有与实施例1突变菌株相同的技术效果。
实验例1
检测实施例1提供的突变菌株的菌落形态、生长性能以及生物膜形成能力。
(1)通过扫描电镜观察实施例1提供的突变菌株与野生型耐甲氧西林金黄色葡萄球菌(MRSA)的菌落形态。结果见图1。
从图1的结果可以看出,野生型耐甲氧西林金黄色葡萄球菌(MRSA)生物膜细菌胞外基质包裹细菌菌体;而突变菌株(WL180530)缺乏胞外基质结构。
(2)测定突变菌株WL180530与野生型耐甲氧西林金黄色葡萄球菌的生长曲线。
生长曲线的测定方法:
将过夜复苏的菌株按照1:20加入新鲜的培养基,37℃厌氧培养24h;每小时将吸取200μL加入96孔板,在595nm测定吸光度值,绘制生长曲线。结果如图2所示,可以看出,突变菌株(WL180530)的生长性能低于野生型菌株。
(3)测定突变菌株WL180530与野生型耐甲氧西林金黄色葡萄球菌菌株的成膜能力。实验的步骤为:将菌株稀释成5×10
染色结果和吸光度测定结果如图3和图4所示;从图3可以看出,突变菌株WL180530的染色能力明显低于野生型耐甲氧西林金黄色葡萄球菌菌株,说明突变菌株WL180530的生物膜形成能力下降;从图4的吸光度值可以看出突变菌株WL180530的吸光度值显著低于野生型耐甲氧西林金黄色葡萄球菌菌株;进一步说明突变菌株WL180530的生物膜形成能力下降。
实验例2
检测实施例1提供的突变菌株的yycG基因表达情况。
(1)提取突变菌株WL180530和野生型耐甲氧西林金黄色葡萄球菌菌株的YycG蛋白,并进行SDS-PAGE试验和western blot实验。蛋白提取步骤:将过夜复苏的菌株按照1:20加入10mL新鲜的培养基,37℃厌氧培养至对数生长中期,4℃离心收集菌体溶于溶菌酶溶液,超声破壁后离心收集上清总蛋白。
结果如图5所示,从图5可以看出,突变菌株WL180530的YycG蛋白条带较窄,说明其蛋白表达量下降。
(2)对突变菌株WL180530和野生型耐甲氧西林金黄色葡萄球菌yycG基因以及糖基转移酶相关基因icaA/D的表达量进行检测,表达量的检测用SYBR Green I嵌合荧光法进行Real-time PCR扩增。采用ABI PRISM 7300按照两步法进行PCR扩增程序进行。引物序列如表1所示。
表1荧光定量PCR引物表
从图6可以看出,突变菌株WL180530中的icaA以及icaD等糖基转移酶相关基因表达下降,突变菌株WL180530中yycG基因表达量明显下降。
实验例3
抑菌环实验检测突变菌株对抗生素的敏感性,从图7可以看出,突变菌株WL180530对抗生素头孢西丁敏感性增加。
实验例4
大鼠胫骨骨髓炎模型比较突变株致病力:雌性SD大鼠,采用10%的水合氯醛按照200g/mL的剂量进行腹腔注射麻醉,麻醉成功后仰卧位固定。对大鼠的右侧胫骨进行备皮准备,常规消毒铺巾。取小腿上段1/3的前内侧进行长约1cm的切口,暴露胫骨皮质,用0.1cm直径的克氏针进行钻孔准备,暴露骨髓腔。暴露完成后分别将40μL对数生长中期的MRSA标准株的菌液(MRSA组)和40μLASyycGMRSA突变株菌液(WL20180530组)分别注射浸润到不同分组的大鼠胫骨髓腔内。注射完成后骨蜡封闭骨髓腔,并逐层关闭皮肤切口。观察四周后,全麻下行胫骨Micro-CT检测。从图8可以看出,突变菌株WL180530组骨质缺损明显减小,说明突变菌株WL180530的致病力减弱。
以上所描述的实施例是本发明一部分实施例,而不是全部的实施例。本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
序列表
<110> 四川大学华西医院
<120> 一种耐甲氧西林金黄色葡萄球菌的突变菌及其应用
<160> 8
<170> SIPOSequenceListing 1.0
<210> 1
<211> 700
<212> RNA
<213> 2 Ambystoma laterale x Ambystoma jeffersonianum
<400> 1
ucguguuaaa uaccaugcga uauguuuuua acuuuucagg uuuacuuggu gcaaaaacau 60
gcgucguacg aucaauugua ucuuuguuug ugaugauauc uguguauggu ugcauaucuu 120
uuuucacugc ugcuaaugca ucuaaaaagu aaucauuuuu cguuguaguu guuaauuuua 180
cguaaucaug gcggucuuua cuaauagcau aaagcacgau auuaucauca gcaucaugau 240
cuaugaccaa acgauugaaa uugaaaugau uugguacuuu cgcauucaug uucaguacuu 300
ggccaagaua uguugauaac gguaaaucau acguaaaauc gaauaaugua aaaucacugc 360
ucaaaucagg aaucaucaag uuaugaucac gacgaacaug uuccacggac uucacuucuu 420
uauuuuucaa agguuucguc agcuuauuca cauuagaaac cgucgcgauc guaccuucug 480
gaugaucauu uuucgaauga auaaucugaa auggcguaau aguuguaucc auuuuggcug 540
ucauaggugu cguuaaaggu uucguuucac ucuucuuacu aucuguauug ucgacauuug 600
caauaucagg agaaaaguuc cauaccauau augucaauac gacacucauc aagacgagua 660
gugcuaaaau gacagauuua auauguuccu uauuauucau 700
<210> 2
<211> 700
<212> DNA
<213> 2 Ambystoma laterale x Ambystoma jeffersonianum
<400> 2
tcgtgttaaa taccatgcga tatgttttta acttttcagg tttacttggt gcaaaaacat 60
gcgtcgtacg atcaattgta tctttgtttg tgatgatatc tgtgtatggt tgcatatctt 120
ttttcactgc tgctaatgca tctaaaaagt aatcattttt cgttgtagtt gttaatttta 180
cgtaatcatg gcggtcttta ctaatagcat aaagcacgat attatcatca gcatcatgat 240
ctatgaccaa acgattgaaa ttgaaatgat ttggtacttt cgcattcatg ttcagtactt 300
ggccaagata tgttgataac ggtaaatcat acgtaaaatc gaataatgta aaatcactgc 360
tcaaatcagg aatcatcaag ttatgatcac gacgaacatg ttccacggac ttcacttctt 420
tatttttcaa aggtttcgtc agcttattca cattagaaac cgtcgcgatc gtaccttctg 480
gatgatcatt tttcgaatga ataatctgaa atggcgtaat agttgtatcc attttggctg 540
tcataggtgt cgttaaaggt ttcgtttcac tcttcttact atctgtattg tcgacatttg 600
caatatcagg agaaaagttc cataccatat atgtcaatac gacactcatc aagacgagta 660
gtgctaaaat gacagattta atatgttcct tattattcat 700
<210> 3
<211> 20
<212> DNA
<213> 2 Ambystoma laterale x Ambystoma jeffersonianum
<400> 3
gattatgtaa tgtgcttgga 20
<210> 4
<211> 20
<212> DNA
<213> 2 Ambystoma laterale x Ambystoma jeffersonianum
<400> 4
actactgctg cgttaataat 20
<210> 5
<211> 20
<212> DNA
<213> 2 Ambystoma laterale x Ambystoma jeffersonianum
<400> 5
atggtcaagc ccagacagag 20
<210> 6
<211> 23
<212> DNA
<213> 2 Ambystoma laterale x Ambystoma jeffersonianum
<400> 6
cgtgttttca acatttaatg caa 23
<210> 7
<211> 20
<212> DNA
<213> 2 Ambystoma laterale x Ambystoma jeffersonianum
<400> 7
cggggcgttc aaaagacttt 20
<210> 8
<211> 21
<212> DNA
<213> 2 Ambystoma laterale x Ambystoma jeffersonianum
<400> 8
tctgaacctt tgaacacacg t 21
- 一种耐甲氧西林金黄色葡萄球菌的突变菌及其应用
- 一种烟酰胺磷酸核糖转移酶突变体、包含该突变体的重组表达载体和重组菌及应用
