一种抗肿瘤药物组合物以及提高化合物的溶解度的方法
文献发布时间:2023-06-19 11:54:11
技术领域
本发明制药技术领域,具体地涉及一种含磷取代基的喹啉类抗肿瘤药物组合物以及涉及提高该肿瘤药物组合物中的原料药的溶解度的方法。
背景技术
化合物1是一种含磷取代基的喹啉类抗肿瘤药物,主要作用于肝细胞生长因子受体(hepatocyte growth factor receptor,HGFR或mesenchymal–epithelial transitionfactor,c-Met)和血管内皮生长因子2(vascular endothelial growth factor 2,VEGFR2或KDR)的新型多靶点受体酪氨酸激酶抑制剂。化合物1是c-Met和VEGFR2双重抑制剂,能有效地同时阻断c-Met和VEGFR2这两种在肿瘤中发挥不同作用的信号通路,从而具有独特的药理作用和临床应用前景。化合物1具有广谱抗肿瘤效果,对胃癌、前列腺癌骨转移、甲状腺髓样癌、非小细胞肺癌、肝癌、肾癌等肿瘤的动物模型中显示出优良的抗肿瘤效果和安全范围。
化合物1的化学名称为:1-[[4-[2-氟-4-[[1-[(4-氟苯基)氨基甲酰基]环丙烷羰基]氨基]苯氧基]-6-甲氧基-7-喹啉基]氧甲基]哌啶基]甲基磷酸二乙酯。
化合物1的化学结构如下式1所示。
在临床研究中发现,现有的化合物1的制剂溶解度差,在人体内的生物利用度低且个体差异大,导致临床效果不稳定。为了解决这一问题,发明人对化合物1作了进一步的研究。
发明内容
针对现有技术存在的问题,申请人进行了深入的研究,以提高化合物1的溶解度和生物利用度。
为了实现本发明的目的,本发明提供一种抗肿瘤药物组合物,所述药物组合物包括式1所示的化合物以及药物学上可接受的酸;
在本发明所述药物组合物的一种实施方式中,所述组合物还包括包覆式1所示的化合物的表面的包覆层。包覆层的材料是可以是本领域常用的药学上可接受的药用辅料,例如二氧化硅、二氧化钛、羟丙甲纤维素、羟丙基纤维素、滑石粉、聚乙二醇、聚乙烯醇或它们中一种或多种的组合;优选地,所述包覆层的材料选自二氧化硅。
将原料药与药学上可接受的酸进行隔离的主要原因是化合物1的原料药在酸性条件下稳定性较差,与酸长时间接触后容易降解,而通过包覆层的隔离的作用,可以保障化合物1在制备和存储过程中的稳定性。在这些包覆层材料中,二氧化硅粒径小、比表面积大,容易吸附在颗粒表面而起到将酸与原料药进行隔离的作用。因此,二氧化硅可作为理想的包覆层的材料。
在本发明的药物组合物中,药物组合物中的药学上可接受的酸能够使式1所示的化合物在pH≤3.0的水中具有0.5mg/ml以上,优选1.0mg/ml以上的饱和溶解度。根据临床考察,以不超过200mg化合物1的剂量的临床最大用量计,在一般临床服药方式中,会以100ml-200ml的温水送服,在pH=3.0的水中化合物1具有0.5mg/ml的饱和溶解度就能达到提高生物利用度的预期,从而满足临床需求。当pH值增大时,化合物1在水中的饱和溶解度太小,难以满足临床需求。因此,出于临床疗效的考虑,组合物中的药学上可接受的酸能够使式1所示的化合物在pH≤3.0的水中具有0.5mg/ml以上,优选具有1.0mg/ml以上的饱和溶解度。
在本发明的药物组合物中,所述药学上可接受的酸可以是无机酸,也可以是有机酸,只要其适用作药用辅料即可。同时,在本发明中,对酸的形态也没有限制,可以是固态酸,也可以是液态酸。为了实现本发明的目的,对于酸的选择,一个要求是在相同的酸浓度下,酸的pH值越低越好。理论上,在水中溶解后pH值为3.0以下的酸都可用。虽然强酸(例如,盐酸、醋酸等)的效果更好,但强酸一般不适合用作药物辅料。在本发明中,可以使用的酸包括但不限于无机酸例如磷酸等,有机酸例如海藻酸、枸橼酸、富马酸、谷氨酸、酒石酸、苹果酸等。在这些酸中,优选使用枸椽酸,主要原因包括:(1)枸橼酸在水中的溶解速率快,且只需要添加少量枸橼酸就可以使水的pH值降到3.0以下。考虑到活性药物化合物1进入胃后,胃排空速度快,因此一种需要能够快速溶解,迅速降低胃液pH的药学上可接受的酸,从这个角度而言,枸橼酸符合这一要求。(2)枸橼酸使用广泛,是经FDA认证的允许用量较大的药用辅料,具有很高的安全性。
在本发明的药物组合物中,从理论上来说,只要在处方中添加酸,即可对式1所示的化合物在体内的溶解和吸收产生促进作用。为了更好地适应胃的环境以及达到理想的生物利用度,原料药式1所示的化合物与所述药学上可接受的酸的添加比例优选为以重量计的1∶2~1∶6,更优选为1∶4。具体的添加比例会因酸的种类而有所区别。
在本发明的药物组合物中,所述药学上可接受的辅料可以是本领域适用于化合物1的制剂的各种药用辅料,例如用作片剂的填充剂、崩解剂、润滑剂等。在本发明所述药物组合物一种优选实施方案中,所述药学上可接受的辅料选自微晶纤维素、乳糖、交联聚维酮、羟丙基纤维素、硬脂酸镁、聚维酮、交联羧甲基纤维素钠、羧甲基淀粉钠中的一种或多种,采用这些辅料有利于药物的做成合适的剂型且有利于经胃肠道给药。
鉴于式1所示的化合物的特性以及使本发明所述的药物组合物更适于胃肠道给药,本发明的组合物可以制成片剂、胶囊剂、颗粒剂、丸剂或散剂等固体制剂。
因此,本发明的另一方面提供了一种提高式1所示的化合物在水中的溶解度的方法,所述方法包括在式1所示的化合物中添加药学上可接受的酸。
在本发明制备所述的药物组合物方法的一种实施例中,所述方法包括:在加入所述药学上可接受的酸之前,在将式1所示的化合物进行湿法制粒后添加包覆材料,混合,以将式1所示的化合物进行包覆;其中,所述包覆材料选自二氧化硅、二氧化钛、羟丙甲纤维素、羟丙基纤维素、滑石粉、聚乙二醇、聚乙烯醇中的至少一种,优选二氧化硅。通过包覆层的隔离作用,可以将原料药化合物1与药学上可接受的酸进行隔离。
为了更好地实现本发明的目的,所添加的药学上可接受的酸需要能够使式1所示的化合物在pH≤3.0的水中具有0.5mg/ml以上,优选1.0mg/ml以上的饱和溶解度。优选地,式1所示的化合物与所述药学上可接受的酸的添加比例为1∶2~1∶6,更优选1∶4。
发明人在对抗肿瘤药物化合物1的研究过程中发现,化合物1的原料药(API)的溶解度呈pH依赖性,化合物1在酸性条件下溶解度远远高于在中性及碱性条件下的溶解度。化合物1为抗肿瘤药物,其更多地应用于年纪较大的中老年患者肿瘤患者,而中老年人的消化系统(胃)的pH值普遍偏高。根据研究文献记载,中老年人胃液的pH值可达pH4-6,更不利于本品的溶解。在《老年人常见消化疾病的诊治进展》中,铁振军对60岁以上老年人胃液酸度测定,证明大多数老年人胃酸浓度低于青年人,胃液的pH值可达pH4以上。
本发明通过在药物组合物中加入适用作辅料的酸,可以使药物有效成分进入胃液之后,释放出酸,从而降低胃液的pH值,提高胃液的酸性。胃液pH值的降低为药物化合物1的溶解提供了有利的环境,从而促进了药物的溶解和吸收,提高了活性药物在体内的生物利用度。
附图说明
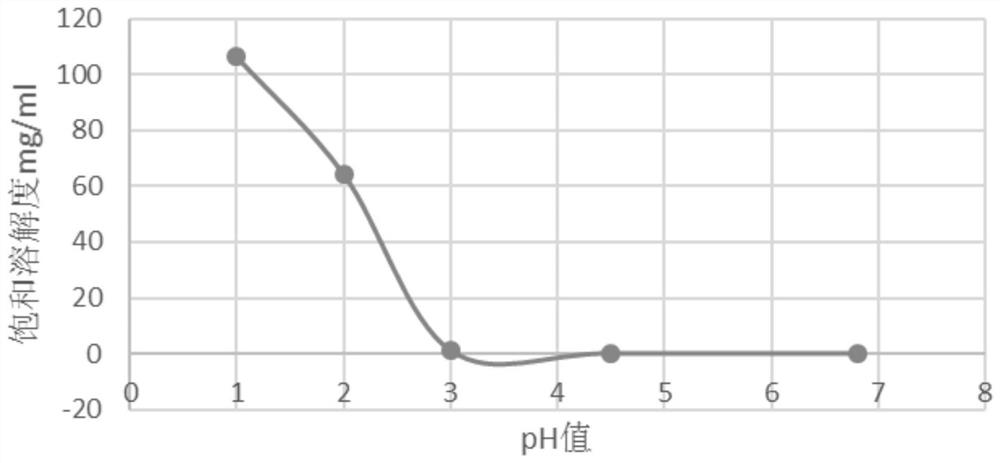
图1是表示药物溶液的pH值与式1所示化合物1的饱和溶解度关系的曲线;
图2是示出小鼠血药浓度随时间变化的曲线图。
具体实施方式
下面通过实施例和对比例进一步说明本发明,这些实施例只是用于说明本发明,本发明不限于以下实施例。凡是对本发明技术方案进行修改或者等同替换,而不脱离本发明技术方案的范围,均应涵盖在本发明的保护范围中。
实施例1
药物组合物的体外溶解度测定实验
本发明通过在原料药(化合物1)中加入酸,提高药物在具有不同pH值的溶解介质中的溶解度。下面就几种酸对化合物1的饱和溶解度的影响进行研究。
表1化合物1在具有不同pH值的介质中的饱和溶解度
将溶解介质的pH与药物的饱和溶解度的关系制作成曲线,如图1所示。
从图1可以看出,在pH值为3处,原料药化合物1在溶解介质中的溶解度已经变得很小。根据临床考察,以不超过200mg化合物1的剂量的临床最大用量计,一般在临床服药方式会以100ml-200ml温水送服,故在pH3.0的介质中化合物1具有1mg/ml的饱和溶解度即可满足临床需求。pH值增大时,化合物1的饱和溶解度太小,难以满足临床需求。
另外,发明人进一步测试了在pH值为3.1至pH值为4.0的数值范围内溶解介质的pH与药物的饱和溶解度的关系,结果如下表2所示。
表2
由表1、表2和图1可以看出,化合物1在酸性条件下溶解度较高,且随着pH值的降低,溶解度呈现增大的趋势,由此可知化合物1的溶解度具有明显的pH依赖性。
下面的表3列出了几种常见的酸辅料在100ml的水中溶解并调节至3.0附近的pH值时所用的酸的量。在选取测试所用的pH值过程中,发明人发现日常饮料可口可乐的pH为约2.4,因此在测量所用酸量是基于pH=2.40时的测量结果。
表3
由表1、表2和表3可知,所用的多种酸溶液以及图1的曲线可以推测,在处方中,本发明列出的其他药学上可接受的酸也能实现提高抗肿瘤药物化合物1的体内生物利用度的目的。从表3可以看到,为了使水的pH值降低至2.40,需要添加的酒石酸和富马酸的用量均超过口服最大用量,需要考虑其安全性。另外,增加谷氨酸的量也能使pH值降至3.0以下,但是由于谷氨酸溶解速度慢,不适合实际的临床需求。
药物在不同pH的药代动力学研究实验
本实验使用的药物处方A如下表4所示。
表4处方A的组成
实验1
将化合物1的样品加入0.9%NaCl注射液中,涡旋5min,搅拌5min后,用1N HCl调pH到2.0,超声30min后,再用1N NaOH调pH到3.0,超声10min,得浓度为5mg/ml的白色混悬液。后经口灌胃至犬,动物样本数6只。分别于给药前及给药后15min、30min、1h、1.5h、2h、3h、4h、6h、8h、24h、48h取血浆样品检测。
实验2
将化合物1的样品研磨后,加入0.9%NaCl注射液中,搅拌5min,超声20min,得浓度为5mg/ml的白色混悬液。后经口灌胃至犬,动物样本数3只。分别于给药前及给药后15min、30min、1h、2h、3h、4h、6h、8h、24h、48h取血浆样品检测。
表5犬药代结果对比
由表5可知,处方A在溶液中加入一定量的盐酸后(调节pH值不大于3.0),化合物1的样品在犬体内的生物利用度有较明显的提升,且个体差异更小。
实施例2
发明人以枸橼酸为例,研究了在片剂中添加枸橼酸后对化合物1的生物利用度的影响。在该实验中,设计了三种片剂处方:处方A、处方A
表6
采用由处方A、处方A
分别取处方A、处方A
采用处方A与处方A
表7血药浓度-时间数据(10mg/kg小鼠)
根据表7绘制药物化合物1的平均血药浓度与时间关系的曲线,具体的曲线见图2。
由表7和图2可知,处方A与处方A
一般认为,聚山梨酯80作为表面活性剂可能会促进化合物1在体内的吸收,但本实验的数据(表6和表7)证明了聚山梨酯80并不会影响化合物1的体内吸收,为处方C中去除聚山梨酯80,避免聚山梨酯80的使用提供了依据。
在确定处方中的几种辅料对化合物1在动物体内的药代动力学未有显著影响的前提下,对根据处方A和处方C制备的片剂在犬体内的药代动力学进行对比研究,结果见表8。
表8处方A与处方C的犬药代动力学实验结果对比
由表8可知,在相同剂量下,处方C(添加了枸橼酸)较处方A的C
另外,综合表7和表8的数据,可以证明片剂中增加的辅料枸橼酸是影响化合物1在动物体内的生物利用度的关键参数。因此,本发明通过化合物1与酸的结合,可以有效增加化合物1在体内的溶解度和生物利用度,有利于提高药物的临床应用效果。基于上面公开的内容,可以推断,当药学上可接受的酸用在胶囊剂、颗粒剂、丸剂或散剂等固体制剂中时,也能够产生提高化合物1在体内的溶解度和生物利用度。
实施例3
表9处方C和处方D的组成
处方D的制备过程如下:
预处理:化合物1的原料药微粉化;无水枸橼酸过40目,备用。
预混:化合物1的原料药、微晶纤维素101、一水乳糖、交联羧甲基纤维素钠递加混合,过40目筛3次混合,得混合粉末。
制粒:向混合粉末中加入10%的羟丙基纤维素水溶液,过20目筛制粒,得湿颗粒。
干燥:湿颗粒放入60℃烘箱中,烘干至物料水分小于3.0%,得干颗粒。
整粒:干颗粒过20目筛,整粒。
总混:干颗粒与二氧化硅递加混合,后加入羧甲淀粉钠、微晶纤维素102、无水枸橼酸、硬脂酸镁,混合均匀。
压片:11mm圆形浅凹冲压片。
对由处方C和处方D得到的片剂的稳定性进行测试,测试结果分别如表10和表11所示。
表10处方C(化合物1的原料药与柠檬酸直接混合制粒)的稳定性
表11处方D(化合物1的原料药制粒后外加二氧化硅、枸橼酸)稳定性
从表10和表11可以看出,在化合物1的原料药制粒后加入二氧化硅对原料药进行包覆以将原料药与酸隔离的片剂中,其杂质状况明显优于未添加二氧化硅的处方C。其主要原因在于,二氧化硅吸附在制料后的原料药颗粒表面,形成包覆层,起到将原料药与酸进行隔离的作用。从实验数据可以判断,化合物1的原料药与酸直接接触时,稳定性较差,而通过对原料药颗粒的外表面进行包覆,将原料药与酸隔离开,不仅可以提高化合物1的溶解度,还可以提高药物在存储和运输过程中的稳定性。
- 一种抗肿瘤药物组合物以及提高化合物的溶解度的方法
- 在主液晶中的溶解度得到提高的氟化的苯基噻吩系聚合性介晶化合物、其制造方法及包含其的聚合性液晶组合物
