特异性检测HTLV-II前病毒DNA的引物及其应用
文献发布时间:2023-06-19 11:55:48
技术领域
本发明属于分子生物检测领域,更具体涉及对HTLV-II前病毒DNA的检测。
背景技术
HTLV-II病毒,是人类T淋巴细胞白血病病毒(Human T-cell Lymphotropicvirus,HTLV)的一种,也被称为人嗜T淋巴病毒II型于1982年首次从多毛细胞白血病患者中分离得到[1]。HTLV-II属于逆转录病毒科肿瘤病毒亚科哺乳类C型病毒,基因组全长8.95kb,电镜下呈球形颗粒,直径约为80~130nm。
人嗜T淋巴病毒II型(HTLV-II)和人嗜T淋巴病毒I型(HTLV-I)是密切相关的逆转录病毒,且具有相似的基因组结构,共有约60~70%的核苷酸序列同源[2]。由于它们与肿瘤形成、神经病理学、转化原发性人类T淋巴细胞的能力有关,近年来一直在进行深入研究。
HTLV-II和HTLV-I具有相似的生物学特性和常见的传播方式,在体外均可有效地使T淋巴细胞转化和永生化,并可在受感染的动物体内存活。然而这两种病毒的临床表现却存在显著差异,HTLV-I能引起多种疾病,如成人T细胞白血病(ATL)[3,4]、热带痉挛性下肢瘫(TSP)[5]和多发硬化症(MS)、不明原因的脉管炎(KW)等。相比之下,HTLV-II的致病性要低得多,只有少数病例报告为变异型毛细胞白血病和与神经系统感染性疾病。此外,HTLV-II感染还与偶发性的类HAM/TSP的脊髓病病例有关[6-8],但与淋巴增生性疾病的发展无明确关系。迄今为止,显示携带HTLV-Ⅱ与特定疾病相关的个体数量有限,因此无法在流行病学上令人信服地证明HTLV-II在人类疾病中的确切病因作用。
HTLV-II主要在北美和西欧静脉注射吸毒者中流行[9-11],并且在一些美洲印第安人和非洲侏儒部落中也可以发现地方性感染[12-14]。与HTLV-Ⅰ的多种传播途径相似,HTLV-II也可通过受感染的血液、精液、阴道液、直肠分泌物、母乳和器官移植传播,但主要方式是通过静脉注射传播。现有的HTLV-II的检测方法包括外周血或骨髓细胞学检查、血清HTLV-II抗体检测、病毒颗粒及抗原检测和脑脊液检查等,但这些方法操作繁琐,灵敏性和特异性不高,容易出现假阳性。
实时荧光定量PCR(qPCR)技术的发展实现了PCR从定性到定量的飞跃,而且其特异性强、灵敏度高、检测方法简便快速、能有效检测出低拷贝的目的DNA片段。
qPCR技术有两种方法:染料法和TaqMan探针法。染料法如SYBR GreenⅠ染料可与双链DNA的小沟结合,当被激发后可以产生荧光信号,但由于任何双链都可以与其非特异性结合产生非特异性信号,因此会造成不准确的结果。TaqMan探针法的探针具有5’端荧光报告基团和3’端淬灭基团,完整的探针受到激发光后会发生荧光共振能量转移,因此检测不到信号;只有当DNA复制时,探针被水解,报告基团和淬灭基团分离,才可以检测到荧光,因此荧光信号的强弱就代表了模板的数量,由于被释放的荧光基团数目和PCR产物数量是一对一的关系,因此用该技术可对模板进行准确定量。虽然 SYBR Green和TaqMan技术在扩增效率上差别不是很大[15],但TaqMan技术因为特异性更高、敏感性更强,更适用于微量模板的检测和定量[16]。
随着PCR技术的发展,第三代PCR技术—数字PCR实现了样品的绝对定量。它可以避过标准品的使用,利用有限稀释、终点PCR和泊松分布实现核酸浓度的直接定量 [17]。基于微滴的数字PCR—微滴式数字PCR(ddPCR)可以实现痕量核酸的高灵敏检测,灵敏度可达单个核酸分子;并具有优秀的准确度、精密度和重复性[18],能够有效区分浓度差异微小的样品。
实时荧光定量PCR和数字PCR对引物的要求较高,特别是对非特异性反应和引物二聚体要求严格。
在本专利中,我们设计并合成了只扩增HTLV-Ⅱpol基因序列的特异性引物/探针,此引物/探针可同时适用于qPCR和ddPCR检测技术。另外,利用此引物,我们开发了一套TaqMan qPCR技术,可以检测样本中的HTLV-Ⅱ前病毒。此检测方法特异性强、精密度和准确度高,并可以稳定检测到各类样本中的极低含量的HTLV-Ⅱ基因。
发明内容
本发明的目的是提供HTLV-II前病毒DNA特异性的引物和/或探针,以及可用于检测样本中HTLV-II前病毒DNA的TaqMan qPCR和ddPCR方法,此方法适用于检测样本中是否存在HTLV-II前病毒DNA。
术语“HTLV-II”是人嗜T淋巴病毒II型,也被称为人类T淋巴细胞白血病病毒II型,是一种逆转录RNA病毒。该病毒的RNA感染宿主后经逆转录合成相应的DNA并整合进入宿主基因组DNA。
术语“HTLV-II前病毒DNA”是指HTLV-II病毒感染宿主细胞后,逆转录合成并整合到宿主基因组上的DNA。本发明中,“HTLV-II基因片段”或“HTLV-II片段”可以互换使用,用于指HTLV-II前病毒DNA的片段。
本发明一方面提供特异性检测HTLV-II前病毒DNA的引物对,所述引物对包括正向引物5'-GCATCAAGCATTCTACCCATATAC-3'(SEQ ID NO:1)和反向引物5'-GAAGGTTAGGACAGTCTAGTAGATA-3'(SEQ ID NO:2)。
本发明的另一方面提供特异性检测HTLV-II前病毒DNA的引物和探针组合,所述引物对包括正向引物和反向引物,其中正向引物是5'- GCATCAAGCATTCTACCCATATAC-3'(SEQID NO:1),所述反向引物是5'- GAAGGTTAGGACAGTCTAGTAGATA-3'(SEQ ID NO:2);所述探针的序列为5'- CTGGTCGAGAGAACC-3'(SEQ ID NO:3),该探针的5’端标记报告荧光基团,3’端标记淬灭基团。
在一些实施方案中,所述荧光探针的5’端标记的报告荧光基团为FAM,3’端标记的淬灭基团为NFQ-MGB或TAMRA。
本发明的另一方面提供上述引物对或引物和探针组合在检测样本中HTLV-II前病毒 DNA中的应用。
本发明的另一方面提供上述引物对或引物和探针组合在制备用于检测样本中HTLV- II前病毒DNA的试剂中的应用。
在一些实施方案中,所述检测是通过qPCR检测或通过ddPCR检测。
如本领域技术人员所知,qPCR又称实时定量PCR(Real-time Quantitative PCR),是在PCR反应体系中加入荧光基团,利用荧光信号积累实时监测PCR进程,最后可以通过标准曲线对未知模板进行定量分析。在qPCR检测中,Ct值表示循环阈值,即每个反应管内的荧光信号达到设定阈值时所经历的循环数。由于每个模板的Ct值与该模板的起始含量的对数存在线性关系,起始拷贝数越多,Ct值越小。利用连续稀释的已知起始含量的标准品可作出标准曲线,其中横坐标代表起始含量的对数,纵坐标代表Ct值,或者纵坐标代表起始含量的对数,横坐标代表Ct值。只要获得未知样品的Ct值,即可从标准曲线上计算出该样品的含量。qPCR在本领域中属于成熟技术,利用现有的仪器进行qPCR检测时,可以直接从仪器的输出结果中获得样本的Ct值。
在qPCR检测中,可以使用荧光探针或荧光染料获取荧光信号。常见的荧光探针例如可以是TaqMan荧光探针,其中PCR扩增时在加入一对引物的同时加入一个特异性的荧光探针,该探针为一寡核苷酸,两端分别标记一个报告荧光基团和一个淬灭荧光基团。探针完整时,报告基团发射的荧光信号被淬灭基团吸收;PCR扩增时,Taq酶的5'-3' 外切酶活性将探针酶切降解,使报告荧光基团和淬灭荧光基团分离,从而荧光监测系统可接收到荧光信号,即每扩增一条DNA链,就有一个荧光分子形成,实现了荧光信号的累积与PCR产物形成完全同步。在一些实施方案中,报告荧光基团可以是例如FAM,淬灭基团可以是例如NFQ-MGB或TAMRA。本领域技术人员知道其它报告荧光基因和相应的淬灭荧光基团也可以用于本发明。
在qPCR检测中,还可以使用荧光染料获取荧光信号,例如可以在PCR反应体系中,加入过量荧光染料,荧光染料非特异性地掺入DNA双链后,发射荧光信号,而不掺入链中的染料分子不会发射任何荧光信号,从而保证荧光信号的增加与PCR产物的增加完全同步。常用的荧光染料例如可以是SYBR荧光染料、磺酰罗丹明(Texas Red)、异硫氰酸荧光素(FITC)、羟基荧光素(FAM)、四氯荧光素(TET)、JOE、VIC、 ROX和NED等。
数字PCR检测也是本领域技术人员公知的,简言之,数字PCR(也可称单分子 PCR)包括PCR扩增和荧光信号分析,在PCR扩增阶段,将样品稀释到单分子水平并平均分配到几十至几万个单元中进行反应,在扩增结束后对每个反应单元的荧光信号进行采集。最后通过直接计数或泊松分布公式计算得到样品的原始浓度或含量。数字PCR 包括微流控数字PCR和微滴式数字PCR(droplet digital PCR,ddPCR),微滴式数字 PCR以微滴为反应单元,利用油包水体系将扩增体系分散至上万个甚至上百万个独立的“扩增室”,从而将每个模板中的分子分散至独立的扩增体系中,每个包含反应所需的酶、离子、引物和探针,在扩增中每个孔均进行平行的扩增反应,在反应完成后对单个反应孔中每个油滴的荧光信号进行检测,由于目标分子在极度分散的体系中满足泊松分布,从而借助阳性油滴数计算出样品中的目的分子数,实现目标序列的绝对定量。微滴式数字PCR在96孔板中即可完成,单管中可包含上万个均质的反应体系,是一种高通量的检测方式,其荧光探针可以使用分子信标或Taqman探针,本发明中,用于qPCR的荧光基团和荧光探针同样也可用于ddPCR。本领域技术人员熟知如何进行不同的数字 PCR检测。
本发明的另一方面提供特异性检测样本中HTLV-II前病毒DNA的试剂盒,该试剂盒包括上述引物对,或包括上述引物和探针组合。
在一些实施方案中,所述试剂盒中还包括进行qPCR检测或ddPCR检测所需要的任意一种或更多种试剂。
在一些实施方案中,所述进行qPCR检测所需要的任意一种或更多种试剂包括选自下述组分的一种或更多中组分:qPCR反应液(例如qPCR Master Mix(2X),其中包括 qPCR反应所需要的酶等必须成分)、水(例如无核酸酶高纯水)、对照品。其中对照品可以是阳性对照品,例如HTLV-II前病毒标准品,如含HTLV-II前病毒DNA的质粒 DNA,和/或阴性对照品。其中阳性对照品还可以是具有HTLV-II前病毒DNA的质粒 DNA、基因组DNA或细胞。其中阴性对照品可以是无HTLV-II前病毒DNA的质粒 DNA、基因组DNA、细胞或水。
在另一些实施方案中,所述进行ddPCR检测所需要的任意一种或更多种试剂包括选自下述组分的一种或更多中组分:ddPCR反应液(例如ddPCR Supermix),水(例如无核酸酶高纯水)。
本发明的另一方面提供检测样本中HTLV-II前病毒DNA的方法,包括使用上述的引物和探针组合,对从样本提取的DNA进行qPCR检测或ddPCR检测,根据qPCR检测或ddPCR检测结果定性检测或定量检测样本中是否存在HTLV-II前病毒DNA。从样本提取的DNA可以例如是基因组DNA。
本发明的另一方面提供检测样本中HTLV-II前病毒DNA的方法,包括以下步骤:
(1)提取样本中的DNA;
(2)使用特异性扩增HTLV-II前病毒DNA的引物和探针组合,例如上述的引物和探针组合,对HTLV-II前病毒DNA标准品和样本DNA进行qPCR检测,其中HTLV-II 前病毒DNA标准品是用含有HTLV-II前病毒DNA片段的DNA配制的不同给定浓度的样品;
(3)用HTLV-II前病毒DNA标准品的qPCR检测结果制作标准曲线,拟合线性方程,其中R
(4)结果判定:如果样本DNA的qPCR结果中出现明显的扩增曲线;且样本 DNA的qPCR的Ct值小于浓度最低点的Ct值,则为阳性结果,即样本中存在HTLV-II 前病毒DNA;如果无明显扩增曲线,或者有明显扩增曲线,但Ct值大于标准曲线浓度最低点的Ct值,则为阴性结果,即样本中不存在HTLV-II前病毒DNA。
在一些实施方案中,所提取的是样本中的基因组DNA。所述样本DNA可以是样本基因组DNA。从样本中提取基因组DNA的方法是本领域公知的,例如可以用DNA提取试剂盒提取基因组DNA。
在一些实施方案中,上述步骤(3)中制作标准曲线时,以HTLV-II前病毒DNA标准品的Ct值为纵坐标(Y),以HTLV-II前病毒DNA标准品的DNA浓度的对数为横坐标(X),拟合线性方程。
在一些实施方案中,上述HTLV-II前病毒DNA标准品包含至少6个用含有HTLV- II前病毒DNA片段的DNA配制的不同给定浓度的样品。HTLV-II前病毒DNA标准品的数量可以是6个、7个、8个或更多个。HTLV-II前病毒DNA标准品例如可以用含 HTLV-II前病毒DNA片段的质粒DNA与水混合配制而成。
拟合标准曲线时,如R
浓度最高点是指用上述方法可稳定检测到的浓度的最高限,在本发明中也可称为检测上限或定量上限。可稳定检测到的浓度的最低限即为浓度最低点,在本发明中也可称为检测下限或定量下限。
判断是否出现明显扩增曲线的方法是本领域技术人员公知的,例如当ΔRn vsCycle 模式下的曲线为S形时,可确定出现明显扩增曲线。
在一些实施方案中,qPCR的反应体系为PCR Master Mix(2×)10μL,特异性扩增HTLV-II前病毒DNA的引物/探针(20×)1μL,DNA样品+无核酸酶高纯水9μL。其中 DNA样品可以是样本DNA、DNA标准品、或其它对照品、阴性对照品或质控品。
在一些实施方案中,qPCR反应的程序为首先50℃,2min以激活UDG;其次95℃,10min激活DNA聚合酶;然后按下列参数进行40个PCR反应:95℃,15秒;60℃, 1min。在一些实施方案中,在Applied Biosystems ABI 7500Real Time PCR仪上完成 qPCR反应。
本发明还提供检测样本中HTLV-II前病毒DNA的ddPCR方法,包括以下步骤:
(1)提取样本DNA;
(2)使用特异性扩增HTLV-II前病毒DNA的引物和探针组合,例如上述的引物和探针组合,对样本DNA进行ddPCR检测;
(3)读取荧光信号并进行分析,以定量HTLV-II前病毒DNA拷贝数;优选地,可以在ddPCR QuantaSoft上读取HTLV-II前病毒DNA拷贝数结果。
在一些实施方案中,所述结果判定也可以是定量检测样品中的HTLV-II前病毒DNA,或者可以进一步包括定量检测样品中的HTLV-II前病毒DNA。所述定量检测可以包括例如根据样本DNA的Ct值和拟合的标准曲线,确定样本DNA中HTLV-II前病毒DNA的浓度。
本发明中,样本可以是器官、组织、全血、细胞或体液样品。
本发明中,样本可以来源于人或任何动物,例如小鼠、大鼠、兔、猴等动物。
在一些实施方案中,本发明的方法是在体外进行的。
在一些实施方案中,本发明的方法是非诊断性的,例如可以检测生物制品如疫苗中是否存在HTLV-II前病毒DNA。
本申请中,术语“HTLV-II阳性的”、“含有HTLV-II前病毒DNA的”,“受HTLV-II感染的”或者类似的表述,是指受到HTLV-II感染的,基因组DNA中含有 HTLV-II前病毒DNA的细胞或含有这些细胞的组织、器官。
本发明提供了新的HTLV-II检测手段,应用实时荧光定量PCR(qPCR)或ddPCR 技术检测整合于宿主基因组中的HTLV-II前病毒DNA片段,并提供针对该DNA片段的特异引物和/或探针。本发明的引物、探针和方法能够大大提高检测样本中HTLV-II的灵敏性和特异性,可用于追踪并定性或定量检测样本中HTLV-II前病毒DNA,用于检测样本是否感染人HTLV-II病毒,避免目前已有的HTLV-II检测手段的不足之处。
附图说明
图1是TaqMan-qPCR简易实验流程。
图2是含HTLV-II片段的质粒DNA构建图。
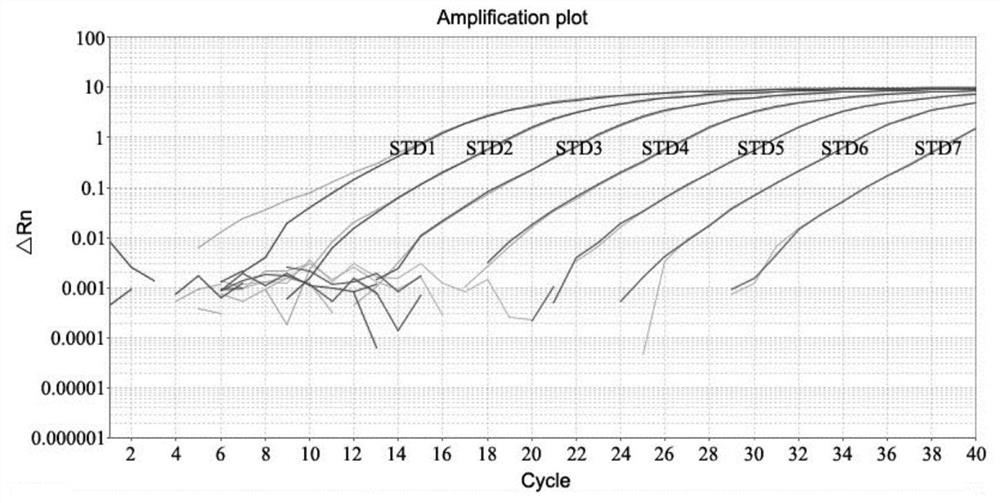
图3是用HTLV-II特异性引物/探针对标准浓度样品进行qPCR检测的扩增曲线图。
图4是标准曲线图。图中标准曲线以各标准浓度样品的Ct值为纵坐标(Y),以标准浓度样品的浓度的对数为横坐标(X),横坐标的数值进行了log数值转换,但仍以标准浓度样品的浓度原值标示。
图5是精密度和准确度验证扩增曲线图。
图6是灵敏度验证扩增曲线图。
图7是稀释线性扩增曲线图。
图8是特异性验证扩增曲线图。
图9HTLV-II ddPCR检测结果图。
下面通过实施例,并结合附图,对本发明的技术方案作进一步详细的说明,但本发明不限于下面的实施例。
本实施例中的qPCR实验方法均为Taqman qPCR方法,提及的序列均以从5’端到 3’端的方式表示。
1.1引物设计
根据人HTLV-II的pol基因序列设计并合成引物及荧光标记的探针,引物信息如下表1:
表1引物设计相关信息表
该探针的5’端标记报告荧光基团FAM,3’端标记淬灭基团NFQ-MGB。
1.2质粒DNA的构建
将200bp的HTLV-II Pol基因的片段克隆入pUC57载体中,得到含HTLV-II片段的质粒DNA,用作标准品,克隆位点为XbaⅠ和BamHⅠ,其构建图如图2所示。该标准品被制备成冻干粉备用。
质粒DNA的稀释:取4μg上述质粒DNA标准品的冻干粉,瞬时离心后加10μL的 DEPC-water,配置成0.4μg/μL的储备液,-80℃保存。取10μL原液,加10μL水,配置成0.2μg/μL的工作液备用。
1.3实验所用耗材和仪器
耗材和仪器如表2所示:
表2耗材与仪器信息表
在以下实验中,以含HTLV-II片段的质粒DNA配制标准曲线,建立鉴别各类样本是否感染HTLV-II的检测方法,并以该方法进行标准曲线与定量范围、准确度与精密度、稀释线性、特异性等全面方法学验证,实验流程参见附图1。
2.1荧光定量PCR反应条件
使用Taqman-qPCR方法,以质粒DNA为模板,加入
表3 qPCR板加样配比表
表4 qPCR反应条件表
如无特别说明,下述实验均按照本2.1节中的反应体系、反应条件和说明进行qPCR检测。
2.2样品配制
2.2.1标准浓度样品配制及标准曲线制作
对含HTLV-II片段的质粒DNA进行梯度稀释获得标准浓度样品,并用表1所示的HTLV-II特异性引物和探针进行qPCR检测,直至可稳定检测到的最低限为0.2fg/μL,设为检测下限(或称定量下限);可检测到的最高限,为200000/μL,设为检测上限 (或称定量上限);高于检测上限的浓度也可以被检测到,但有可能影响定量检测的准确性或增加出现假阳性结果的可能性。标准浓度样品共包含7个标准浓度样品,如下表 5所示。用这些标准浓度样品进行qPCR检测后,以标准浓度样品的Ct值为纵坐标 (Y),以标准浓度样品的浓度的对数为横坐标(X),拟合成标准曲线,得到标准曲线回归方程及相关系数。每个样品设置两个复孔。
表5标准浓度样品配制表
2.2.2方法学验证样本的配制
将含HTLV-II片段的质粒DNA稀释至不同浓度做为板质控样本、精密度准确度样本、稀释线性样本、特异性样本,其中板质控样本用于评估一个批次内PCR实验是否接受。以下为各种样本配制表:
表6板质控样本配制表
表7精密度准确度样本配制表
表8稀释线性样本配制表
表9特异性样本配制表
其中表6中P-HQC、P-MQC、P-LQC分别为高、中、低三个浓度的质控样品。表7 中LLOQ为定量下限(Lower limit of quantification),LQC为低浓度质控(Low Qualitycontrol),与表6中P-LQC相同,HQC为高浓度质控(High Quality control),与表6中P-HQC相同,MQC为中浓度质控(MiddleQuality control),与表6中P-MQC 相同,ULOQ为定量上限(ULOQ,Upper limit of quantification)。
2.3精密度准确度样本检测
取含HTLV-II片段的质粒DNA,分别配制定量下限(LLOQ)、低浓度质控 (LQC)、高浓度质控(HQC)、中浓度质控(MQC)及定量上限(ULOQ)等5个浓度的样品,具体配制如2.2.2。用如表1所示的HTLV-II特异性引物和探针进行qPCR检测,考察不同浓度样品的批内及批间的精密度和准确度。接受标准参考药典中生物样品定量分析方法验证指导原则[19-21],如表10所示。
表10精密度、准确度检测接受标准
其中准确度即RE%,计算公式:RE%=(C
其中精密度即CV%,计算公式:CV%=标准偏差/平均值×100%(下同)。
2.4稀释线性检测
使用无RNase/DNase水梯度稀释含HTLV-II片段的质粒DNA,进行一定比例稀释后,用表1所示的引物和探针进行进行qPCR,每组设置两个复孔,每个浓度重复3次,接受标准如下:
表11稀释线性检测接受标准
2.5特异性检测
取含HTLV-II片段的质粒DNA配置成LQC样品,用表1所示的引物和探针进行进行qPCR实验并计算其RE%值,每组设置两个复孔,接受标准如下:
表12特异性检测接受标准
3.1HTLV-II前病毒DNA qPCR检测的标准曲线
HTLV-II前病毒DNA标准浓度样品qPCR扩增曲线见图3。以各标准品Ct值为纵坐标(Y),以标准曲线浓度的对数为横坐标(X),拟合成标准曲线,如图4所示。
标准曲线横坐标仍以标准品原值标示。标准曲线回归方程为y=-4.039+33.51,相关系数 R
3.2HTLV-II特异性引物qPCR检测的精密度准确度和灵敏性
用表1所示的引物和探针对LLOQ、LQC、HQC、MQC和ULOQ样品进行qPCR 检测,考察不同浓度样品的批内及批间的精密度和准确度,扩增曲线如图5所示。结果发现:HTLV-II引物可以稳定检测到1fg含有HTLV-II片段的质粒DNA,并且精密度准确度样品的批内CV为4.3%~30%,批间CV为3.6%~19.4%,均在-75%~150%之间;批内RE为-2.3%~51.6%,批间RE为-0.6%~39.2%,符合接受标准(表13)。
表13精密度准确度检测结果表
为了进一步验证该反应体系的灵敏性,将标准曲线浓度最低点的样品再次进行10倍和100倍稀释,并用表1的引物和探针进行qPCR检测,扩增曲线如图6所示。发现 10倍稀释后的样本同样可以被检测到,即灵敏性可以达到0.1fg/5μL或31.3copy。证明 HTLV-II特异性引物qPCR检测方法具有较高的精密度与准确度且该方法具备较高的灵敏性。
为了进一步验证HTLV-II特异性引物及qPCR实验方法的精确性和有效性,用无RNase/DNase水稀释含有HTLV-II片段的质粒DNA至0.2ng/μL后,再以无 RNase/DNase水对其分别进行20倍、400倍和8000倍的梯度稀释,如2.4节所述,用表 1的引物和探针进行TaqMan qPCR检测,扩增曲线如图7所示。结果表明:所有浓度来源的稀释样品回算浓度后,其CV为0.4%~3.7%,均≤60%,证明HTLV-II特异性引物 qPCR能够精确检测到样本中的HTLV-II基因组DNA(表14)。
表14稀释线性检测结果表
3.3HTLV-II特异性引物qPCR检测方法的特异性
用无RNase/DNase水稀释含有HTLV-II片段的质粒DNA至0.2ng/μL后,再以无RNase/DNase水将其稀释至LQC(即浓度为2fg/5μL),用表1的引物和探针进行 TaqMan qPCR检测,扩增曲线如图8所示。结果显示:LQC组别可以在定量范围内检测到信号,而无RNase/DNase水组别测定值均低于检测下限。该HTLV-II引物能够特异性地识别含HTLV-II DNA的样本(表15)。
表15特异性检测结果表
(1)打开QX200 droplet reader,预热30min;
(2)配制定量反应体系(20μL):
ddPCR supermix(10μL)+引物/探针(1μL)+样本(质粒,9μL)
(3)微滴形成:在DG8 cartridge的两排分别加入20μL反应体系以及70μL微滴生成油(DG oil),盖上胶垫,并置于微滴生成仪中形成微滴。
(4)ddPCR检测:吸取40μL微滴加入96孔板,封膜后置于PCR仪,并按照95℃,10min;94℃,30s,40循环;98℃,10min的程序进行反应。结束后将96孔板置于微滴读取仪中,设置Tm值及荧光信号,读取信号并分析。
(5)结果分析:数值结果直接在QuantaSoft上读取。
ddPCR检测HTLV-II具有高敏感性
为了验证HTLV-II引物对ddPCR检测方法的适用性,将构建的含HTLV-II片段的质粒HTLV-II质粒(TaqMan qPCR方法中所使用的质粒)进行10倍梯度稀释,稀释后的质粒(S1~S4)作为样本进行ddPCR检测,数值结果根据阳性微滴的比例,结合泊松分布的原理进行定量计算。如图9所示,本发明的引物探针对可以用于HTLV-II引物的 ddPCR检测,并具有比TaqMan qPCR方法更高的敏感性,可以检测到0.39copy/μL的 HTLV-II前病毒。
以人HTLV-II特异性序列设计并合成的引物、标记探针,结合TaqMan qPCR实验技术,可以特异性检测不同类型样本DNA是否存在HTLV-II基因,实验过程简单、方便,准确度高,灵敏性和特异性强。
HTLV-II可通过受感染的血液、精液、阴道液、直肠分泌物、母乳和器官移植传播,但主要方式是通过静脉注射传播。目前,尚无有效的治疗药物,因此只能通过HTLV-II 筛查进行必要预防。从根本上说,治愈所有传染病的良方在预防感染方面。感染HTLV-II 是一种慢性破坏性疾病,因此对人员进行相关的HTLV-II筛查很有必要。
目前除了传统的细胞学检查外,对HTLV-II的检测多采用间接免疫荧光法(IFA)、明胶颗粒凝集反应(GPA)、酶联免疫吸附试验(ELISA)及蛋白印迹试验(WB)等。但是基于抗原、抗体的免疫检测具有操作繁琐、过程不易标准化、灵敏度低、假阳性高、成本高等缺点。国内相关检测技术及检测试剂稀少,因此需要新的检测方法的出现解决上述问题。
在本发明中,我们设计并合成了人特异性序列HTLV-II的引物、探针,利用 TaqManqPCR和ddPCR技术,可以对样本中的HTLV-II基因进行特异性检测。基于对引物和TaqManqPCR技术进行特异性、稀释线性、精密度和准确度等的验证,证明本方法可以灵敏地检测样本的HTLV-II基因组DNA。不同于其它有不足或缺陷的检测手段,我们的方法具有很高的精确度和重复性,而且灵敏度高。因此,我们的HTLV-II引物及TaqMan PCR技术可以应用于检测各类样本中的HTLV-II,并进行精确定量。
本发明的HTLV-II特异性引物还可以适用于数字PCR检测技术,且具有更高的敏感性,适用于检测珍贵样本、含量较少的样本或成分复杂的样本。因此,本方法尤其适合治疗和预防用生物制品,包括但不限于细胞、抗体和疫苗等产品的生物安全性检测。
本发明的实施方式并不限于上述实施例所述,在不偏离本发明的精神和范围的情况下,本领域普通技术人员可以在形式和细节上对本发明做出各种改变和改进,而这些均被认为落入了本发明的保护范围。
参考文献
1.Kalyanaraman V S,Sarngadharan M G,Robertguroff M,et al.A newsubtype of human T- cell leukemia virus(HTLV-II)associated with a T-cellvariant of hairy cell leukemia[J]. Science,1982,218(4572):571-573.
2.Feuer G,Green P L.Comparative biology of human T-cell lymphotropicvirus type 1 (HTLV-1)and HTLV-2[J].Oncogene,2005,24(39):5996-6004.
3.Matsuoka M.Human T-cell leukemia virus typeⅠ(HTLV-Ⅰ)infection andthe onset of adult T-cell leukemia(ATL)[J].Retrovirology,2005,2(1):27.
4.Tabei S Z.Human T Lypmphotrophic Virus(HTLV1)Related Diseases[J].iranian Red Crescent Medical Journal,2011,13(6):374-376.
5.Manns A,Wilks R J,Murphy E L,et al.A prospective study oftransmission by transfusion of HTLV-Ⅰand risk factors associated withseroconversion[J].international Journal of Cancer,1992,51(6):886-891.
6.Hjelle B,Torrez-Martinez N,Mills R,et al.Chronic neurodegenerativedisease associated with HTLV-Ⅱinfection[J].Lancet,1992,339(8794):645-646.
7.Dooneief G,Marlink R,Bell K,et al.Neurologic consequences of HTLV-Ⅱinfection in injection-drug users[J].Neurology,1996,46(6):1556.
8.Murphy E L,Fridey J,Smith J W,et al.HTLV-associated myelopathy in acohort of HTLV-Ⅰand HTLV-Ⅱ-infected blood donors[J].Neurology,1997,48(2):315-320.
9.Toro C,Berta Rodés,Bassani S,et al.Molecular epidemiology of HTLV-2infection among intravenous drug users in Spain[J].Journal of ClinicalVirology,2005,33(1):0-70.
10.Lee H,Swanson P,Shorty V,et al.High rate of HTLV-Ⅱinfection inseropositive i.v. drug abusers in New Orleans[J].ScⅠence,1989,244(4903):471-475.
11.Khabbaz R F,Hartel D,LaⅠrmore M,et al.Human T Lymphotropic VirusTypeⅡ (HTLV-Ⅱ)infection in a Cohort of New York intravenous Drug Users:AnOld infection?[J]. Journal of infectious Diseases,1991,163(2):252-256.
12.Lairmore M D,Jacobson S,Gracia F,et al.isolation of human T-celllymphotropic virus type 2 from Guaymiindians in Panama.[J].Proceedings of theNational Academy of Sciences, 1990,87(22):8840-8844.
13.Heneine W,Kaplan J E,Gracia F,et al.HTLV-Ⅱendemicity amongGuaymiindians in Panama.[J].N Engl J Med,1991,324(8):565.
14.Levine P H,Jacobson S,Elliott R,et al.HTLV-Ⅱinfection in Floridaindians[J].AiDS Research and Human Retroviruses,1993,9(2):123-127.
15.Tajadini M,Panjehpour M,Javanmard S H.Comparison of SYBR Green andTaqManmethods in quantitative real-time polymerase chain reaction analysis offour adenosine receptor subtypes[J].Advanced Biomedical Research,3,1(2014-02-28),2014,3(1):85.
16.Becker M,Nitsche A,Neumann C,et al.Sensitive PCR method for thedetection and real-time quantification of human cells in xenotransplantationsystems[J].BRITISH JOURNAL OF CANCER,2002,87(11):1328-1335.
17.Sykes,P.J.,Neoh,S.H.,Brisco,M.J.,Hughes,E.,&Morley,A.A..(1992).Quantitation of targets for pcr by use of limiting dilution.BioTechniques,13(3),444-449.
18.Dong,Lianhua,Meng,Ying,Wang,Jing,&Liu,Yingying..Evaluation ofdroplet digital pcr for characterizing plasmid reference material used forquantifying ammonia oxidizers anddenitrifiers.Analytical&BioanalyticalChemistry,406(6),1701-1712.
19.Lee HC,An SG,Lee HW,Park JS,Cha KS,Hong TJ,et al.Safety and effectof adipose tissue-derived stem cell implantation in patients with criticallimb ischemia:a pilot study.Circ J.2012;76(7):1750-60.
20.Nguyen PK,Riegler J,Wu JC.Stem cell imaging:from bench tobedside.Cell Stem Cell. 2014;14(4):431-44.
21.Wu Y,Zhao RC.The role of chemokines in mesenchymal stem cellhoming to myocardium.Stem Cell Rev.2012;8(1):243-50。
序列表
<110> 上海爱萨尔生物科技有限公司
<120> 特异性检测HTLV-II前病毒DNA的引物及其应用
<160> 3
<170> SIPOSequenceListing 1.0
<210> 1
<211> 24
<212> DNA
<213> Artificial Sequence(人工序列)
<400> 1
gcatcaagca ttctacccat atac 24
<210> 2
<211> 25
<212> DNA
<213> Artificial Sequence(人工序列)
<400> 2
gaaggttagg acagtctagt agata 25
<210> 3
<211> 15
<212> DNA
<213> Artificial Sequence(人工序列)
<400> 3
ctggtcgaga gaacc 15
- 特异性检测HTLV-II前病毒DNA的引物及其应用
- 特异性检测HIV-2前病毒DNA的引物及其应用
