免疫细胞的分析方法及细胞分析装置
文献发布时间:2023-06-19 11:55:48
【技术领域】
本发明涉及免疫细胞的分析方法及细胞分析装置。
【背景技术】
免疫细胞是在生物体的免疫系发挥中心的作用的细胞。免疫细胞还与癌、自身免疫疾病等的各种疾病关联,在这些疾病中,知晓调节免疫细胞的活性或功能的治疗法。例如,在癌的领域中,关注施用免疫检查点抑制剂而活化由癌细胞抑制的T细胞的治疗法。在自身免疫疾病的领域中,由免疫抑制剂的施用进行抑制成为疾病的原因的免疫细胞的功能的治疗法。在这些疾病中,为了进行治疗方针的决定及治疗效果的监测,正确地掌握患者的免疫细胞的活性、特别免疫细胞的刺激应答性的重要性升高。
近年,作为免疫细胞的刺激应答性的指标之一,关注测定免疫突触(immunological synapse:IS)。IS是在免疫细胞与目标细胞接触之时,在该接触面在免疫细胞形成的结构体。知晓IS形成能与免疫细胞的细胞因子分泌能相关。IS的形成在免疫细胞和目标细胞的接触后在数分钟至数十分钟发生,被看作是免疫细胞的活化初期的重要的过程。
知晓由免疫细胞和免疫刺激因子及异物的接触,在免疫细胞形成与IS同样的结构体。在专利文献1中记载了向固定化抗CD3抗体的板接种从末梢血单核细胞(PBMC)调制的T细胞克隆,通过添加抗CD28抗体,进行由抗体的刺激及与板底面的接触的结果,在T细胞克隆上发生CD3分子及CD28分子的定位。在专利文献1中,将在T细胞克隆上发生的目标分子(CD3及CD28)的定位检测为相当于IS的结构体。具体而言,通过将从板回收的T细胞克隆用与CD3及CD28结合的荧光标记抗体免疫染色而用流式细胞仪测定,评价检测细胞上的CD3分子及CD28分子的定位,免疫细胞的免疫刺激应答性。
【现有技术文献】
【专利文献】
专利文献1:美国专利申请公开第2018/0292385号说明书
【发明的概要】
【发明要解决的课题】
在记载在专利文献1的方法中,测定到如从PBMC调制的T细胞克隆一样的单离的免疫细胞。在由此方法进行受试者的免疫细胞的分析时,例如,以从受试者采集的血液中所含的免疫细胞作为分析对象。但是,血液中的血细胞成分的明细是红细胞占90%以上,白细胞等的免疫细胞是数%。这样,由于在血液中红细胞与免疫细胞相比压倒性地多,有免疫细胞以外的血细胞影响免疫细胞的IS形成的担忧。为了排除这样的影响,有预先从血液分离及单离免疫细胞的必要。
但是,从血液等的生物体试样分离及单离免疫细胞的作业烦琐且耗时间。另外,由作业者在免疫细胞的回收率上发生偏差。再者,由于由在免疫细胞的分离及单离中使用的试剂及离心分离等的物理的处理损伤免疫细胞而免疫细胞的质及功能可降低,有无法正确地测定免疫细胞的活性的担忧。因此,需求不要求从生物体试样分离及单离免疫细胞的工序的免疫细胞的分析方法。
【用于解决课题的手段】
本发明人通过向从受试者采集的全血添加免疫刺激因子,在全血中刺激免疫细胞而确认是否形成了目标分子的定位。于是,本发明人令人惊讶地发现,即使在全血中刺激免疫细胞时,在免疫细胞中也形成了目标分子的定位,可对其进行检测。
本发明的一实施方式提供免疫细胞的分析方法,其包括:将含免疫细胞的全血和免疫刺激因子在体外混合,对免疫细胞的目标分子进行标记的工序,通过检测标记,取得免疫细胞中的目标分子的定位相关信息的工序。
本发明的一实施方式提供免疫细胞的分析方法,其包括通过检测具有被标记的目标分子的免疫细胞的标记,取得免疫细胞中的目标分子的定位相关信息的工序。在此方法中,含被标记的目标分子的免疫细胞是通过将含免疫细胞的全血和免疫刺激因子在体外混合,对全血中所含的免疫细胞的目标分子进行标记而调制的细胞。
本发明的一实施方式提供细胞分析装置,其具备:导入免疫细胞、与免疫细胞的目标分子结合的捕获体和可发生能检测的光学信号的标记物质的复合体的导入部,拍摄从导入部供给的复合体的摄像部,基于由摄像部拍摄的图像而取得免疫细胞中的目标分子的定位相关信息的解析部。在此装置中,免疫细胞是通过将含免疫细胞的全血和免疫刺激因子在体外混合,在免疫细胞中生成目标分子的定位而得到的细胞。
本发明的一实施方式提供细胞分析装置,其具备:导入免疫细胞、与免疫细胞的目标分子结合的捕获体和可发生能检测的光学信号的标记物质的复合体的导入部,向从导入部供给的复合体照射光,检测从复合体发生的光学信号的检测部,基于检测的光学信号而取得免疫细胞中的目标分子的定位相关信息的解析部。在此装置中,免疫细胞是通过将含免疫细胞的全血和免疫刺激因子在体外混合,在免疫细胞中生成目标分子的定位而得到的细胞。
【发明的效果】
根据本发明,由于变得无需从生物体试样分离及单离免疫细胞的工序,缩短分析所耗的时间。另外,由于最小限度抑制对免疫细胞的损伤,可防免疫细胞的质及功能的降低,更正确地对免疫细胞的状态进行分析变得可能。
【附图的简单的说明】
【图1】是对分析对象的免疫细胞中的目标分子的标记的例进行说明的模式图。
【图2】是显示细胞分析装置的构成的图。
【图3】是显示测定装置的构成的图。
【图4】是显示摄像部的构成的图。
【图5】是显示摄像机的光接收面上的区域的模式图。
【图6】是显示信息处理装置的构成的图。
【图7】是显示受试体的测定处理及解析处理的流程图。
【图8】是显示测定数据的图像的一例。
【图9】是显示基于测定数据的测量过程的模式图。
【图10】是显示解析处理的流程图。
【图11】是显示实施方式1(a、b及c)及实施方式2(d)涉及的解析处理的2D散点图。
【图12】是显示作为摄像部的变形例的检测部的构成的图。
【图13】是用于对从共刺激分子的分布状态不同的细胞得到的荧光信号的脉冲数据进行说明的模式图。
【图14】是用于对从荧光信号的脉冲数据得到的解析用参数的2D散点图进行说明的模式图。
【图15A】是显示未添加免疫刺激因子(抗CD28抗体)的全血中的免疫细胞(T细胞)的分布的2D散点图。
【图15B】是显示添加抗CD28抗体的全血中的T细胞的分布的2D散点图。
【图16A】是显示未添加抗CD28抗体的全血中的T细胞中的CD28及CD3的表达分布的图像的一例。
【图16B】是显示添加抗CD28抗体的全血中的T细胞中的CD28及CD3的表达分布的图像的一例。
【图17】是显示CD28定位的T细胞相对于全血中的T细胞的比例(CD28定位阳性率)的坐标图。
【图18】是显示CD28定位的T细胞相对于全血或从全血单离的末梢血单核细胞(PBMC)中的T细胞的比例(CD28定位阳性率)的坐标图。
【图19】是显示CD28定位的T细胞相对于未添加抗CD28抗体的全血或从全血单离的PBMC中的T细胞的比例(CD28定位阳性率)的坐标图。
【图20A】是显示CD28定位的T细胞克隆相对于全血或向板添加的T细胞克隆的比例(CD28定位阳性率)的坐标图。
【图20B】是显示CD28定位的T细胞克隆相对于全血或向板添加的T细胞克隆的比例(CD28定位阳性率)的坐标图。
【图21】是显示CD28定位的T细胞克隆相对于全血或向板添加的T细胞克隆的比例(CD28定位阳性率)的坐标图。
【图22】是显示CD28定位的T细胞克隆相对于全血或向板添加的T细胞克隆的比例(CD28定位阳性率)的坐标图。
【图23】是显示2D散点图中表示CD3阴性并且CD56阳性的免疫细胞及CD3阳性并且CD56阴性的免疫细胞的点出现的区域的模式图。
【图24】是显示添加人B细胞或未添加的全血中的T细胞及NK细胞的分布的2D散点图。
【图25】是显示全血中的T细胞中的CD3及F肌动蛋白的表达分布、及全血中的NK细胞中的CD56及F肌动蛋白的表达分布的图像的一例。
【图26A】是显示F肌动蛋白定位的T细胞相对于全血中的T细胞的比例(F-肌动蛋白定位阳性率)的坐标图。
【图26B】是显示F肌动蛋白定位的NK细胞相对于全血中的NK细胞的比例(F-肌动蛋白定位阳性率)的坐标图。
【具体实施方式】
[1.免疫细胞的分析方法]
(在免疫细胞生成目标分子的定位的工序)
在本实施方式的免疫细胞的分析方法(以下,称为“方法”)中,对经以下的工序而得到的免疫细胞进行分析的:将含免疫细胞的全血和免疫刺激因子在体外混合,对该免疫细胞的目标分子进行标记的工序。接下来对于此目标分子的标记工序进行说明。
全血只要是从人或非人哺乳动物采集的血液即可。作为全血,可举出例如末梢血、脐带血等,优选为末梢血。根据需要,也可向全血添加抗凝固剂及/或鳌合剂。作为抗凝固剂,可举出例如肝素、柠檬酸或柠檬酸盐等。作为鳌合剂,可举出例如EDTA(乙二胺四乙酸,ethylene diamine tetraacetic acid)盐。
免疫细胞是指担负作为识别自身和非自身而排除非自身的机构的免疫系统的细胞。在本实施方式的方法中,作为分析的对象的免疫细胞(以下,也称为“分析对象的免疫细胞”),可从公知的免疫细胞任意地选择。分析对象的免疫细胞可为1个细胞,优选为实质上由多个同种免疫细胞构成的亚集团(亚组)。在现有技术领域中,免疫细胞因其功能及/或形态分类为各种亚组。作为免疫细胞的亚组,可举出例如淋巴细胞、粒细胞、单核细胞等的亚组。淋巴细胞进一步分类为T细胞、天然杀手(NK)细胞、及B细胞的亚组。粒细胞进一步分类为嗜中性粒细胞、嗜酸性粒细胞、及嗜碱性粒细胞的亚组的
分析对象的免疫细胞可为从受试者采集的全血中原来所含的免疫细胞,也可为从外部添加到全血中的免疫细胞。作为分析对象的免疫细胞,优选与细胞性免疫相关的免疫细胞,可举出例如T细胞、NK细胞等。在它们之中,也特别优选T细胞。
作为T细胞,可举出辅助性T细胞(也称为CD4
在本说明书中,“免疫刺激因子”是指可作用于免疫细胞而诱导该免疫细胞的活化的物质。免疫细胞的活化是指例如,免疫细胞的增殖、运动性的亢进、细胞因子分泌等。作为免疫刺激因子,可举出例如,免疫刺激抗体、免疫刺激肽、主要组织适合性分子(Majorhistocompatibility molecule:以下,也称为“MHC分子”)等。另外,也可使用存在于异体细胞、抗原呈递细胞及肿瘤细胞上的免疫刺激因子。免疫刺激因子可为1种,也可将2种以上组合。免疫刺激因子也可以与和免疫细胞不同的物质结合或复合的形态使用。例如,可举出MHC分子和抗原肽的复合体的形态、固定于珠、容器等的非生物材料上的形态、向抗原呈递细胞上呈递的形态等。
在本说明书中,“免疫刺激抗体”是指可特异性地刺激免疫细胞而诱导免疫细胞的活化的抗体。免疫刺激抗体可举出例如抗CD28抗体、抗CD3抗体、抗TCRα/β抗体、抗CD40L(CD40 ligand)抗体、抗OX40抗体、抗CD2抗体、抗CD137抗体、抗CTLA4(cytolytic Tlymphocyte associated antigen-4)抗体、抗PD-1(programmed cell death-1)抗体、抗ICOS(inducible co-stimulatory molecule)抗体、抗整联蛋白抗体(抗CD2抗体)等,但不限于这些。在本实施方式中,优选抗CD28抗体及抗CD3抗体。这些免疫刺激抗体可为1种单独,或也可将2种以上组合使用。免疫刺激抗体也可在固定化于后述的非生物材料的异物上的状态下使用。
在本说明书中,抗体只要是不特别限定,就也可为单克隆抗体及多克隆抗体之任一者。另外,抗体也可为Fab、F(ab')2等的抗体片段、单链抗体、及它们的衍生物。
在本说明书中,“免疫刺激肽”是指可刺激免疫细胞而诱导免疫细胞的活化的肽。在肽中也含蛋白质。免疫刺激肽是例如抗原肽(结核菌的抗原肽等)。抗原肽可为1种单独,或也可将2种以上组合使用。抗原肽也可以与呈递到MHC分子上的MHC分子的复合体的形态使用。
在本说明书中,“主要组织适合性分子”(MHC分子)是指担负在器官、组织及细胞的同种移植时引起最强的排斥反应的别抗原性的分子。在人中HLA分子、在小鼠中H-2分子相当于MHC分子。在MHC分子中,有类I分子和类II分子。I类MHC分子在几乎全部的有核细胞中表达,形成在细胞内产生的肽和复合体,将其呈递给CTL(CD8
在本实施方式中,在免疫刺激因子是MHC分子或MHC分子和抗原肽的复合体时,该MHC分子也可为I类MHC分子及II类MHC分子之任一者。MHC分子或MHC分子和抗原肽的复合体也可以例如,存在于抗原呈递细胞、肿瘤细胞等的细胞膜的形态使用。
在本说明书中,“免疫刺激”含使免疫细胞和免疫刺激因子接触。免疫细胞和免疫刺激因子的接触的形态不特别限定,可举出例如,免疫细胞上的分子和免疫刺激因子的结合、缔合或复合体形成、由免疫细胞的免疫刺激因子的收取等。与免疫刺激因子接触的免疫细胞上的分子可为后述的目标分子,也可为与目标分子不同的分子。
在优选的实施方式中,免疫刺激含使与免疫刺激因子接触的免疫细胞和异物接触。其中“异物”是指与分析对象的免疫细胞不同的物质。通常,由于全血收容在容器而使用,通过将全血和免疫刺激因子在体外混合,进行免疫细胞和免疫刺激因子的接触、及,与该免疫刺激因子接触的免疫细胞和作为异物的容器的内表面的接触的两方。
与分析对象的免疫细胞不同的物质可为非生物材料,也可为生物材料。非生物材料的异物不特别限定,也可为例如管、多孔板、皿等的容器、载玻片、珠等。优选为收容采集的全血的容器。生物材料的异物不特别限定,也可为例如,对目标分子进行标记的免疫细胞以外的血细胞、异体细胞、抗原呈递细胞、肿瘤细胞等。对目标分子进行标记的免疫细胞以外的血细胞可举出例如红细胞、不是分析对象的免疫细胞等。例如,对目标分子进行标记的免疫细胞、即分析对象的免疫细胞是T细胞之时,NK细胞、粒细胞、单核细胞、B细胞等与不是分析对象的免疫细胞相对应。异体细胞是指非自身的细胞,只要是来源于与采集本实施方式的方法中使用的全血的个体不同的个体的细胞即可。分析对象的免疫细胞以外的血细胞、异体细胞、抗原呈递细胞及肿瘤细胞也可为株化细胞。异体细胞及肿瘤细胞也可处于含它们的组织的形态。
在本实施方式中,通过将含免疫细胞的全血和免疫刺激因子在体外混合,该免疫细胞被免疫刺激而在免疫细胞中目标分子的定位生成。即,目标分子的标记工序包括将含免疫细胞的全血和免疫刺激因子在体外混合而在免疫细胞中生成目标分子的定位的工序。将全血和免疫刺激因子在体外混合的方法只要是全血中的免疫细胞和免疫刺激因子变得能接触,就不特别限定。例如,也可向采集的全血添加免疫刺激因子。在免疫刺激因子存在于与免疫细胞不同的物质上时,也可使含免疫细胞的全血和该物质在体外接触。此时,全血中的免疫细胞与免疫刺激因子接触的同时,还与和免疫细胞不同的物质接触。
免疫刺激因子的量可对应于免疫刺激因子的种类而适宜确定。在本实施方式中,只要是可使免疫细胞充分地活化的量,就不特别限定。
在本实施方式中,由免疫刺激因子的刺激时间不特别限定,作为上限,例如不足6小时、优选3小时以下,更优选为2小时以下。作为刺激时间的下限,例如2分钟以上、优选5分钟以上、更优选为10分钟以上。其中,刺激时间是指例如,在体外混合含免疫细胞的全血和免疫刺激因子至标记该免疫细胞的目标分子的时间。在优选的实施方式中,刺激时间是自将含免疫细胞的全血和免疫刺激因子在体外混合起至固定该免疫细胞的时间。
通过免疫刺激全血中所含的免疫细胞,促进该免疫细胞中目标分子的定位的生成。在本说明书中,“目标分子”是在免疫细胞表达的分子,是指可由免疫刺激改变免疫细胞中的分布的分子。“目标分子的定位”是指通过目标分子在免疫刺激的免疫细胞的一部分集聚而形成的目标分子的集团。作为免疫细胞中的目标分子的定位生成的部位,优选免疫细胞的细胞膜的一部分。作为目标分子,可举出例如构成免疫突触的分子等。作为构成免疫突触的分子,可举出例如表面抗原、结构蛋白质的聚合物等。本实施方式的方法可以由免疫刺激的目标分子的定位作为指标,评价免疫细胞的免疫刺激应答性。
免疫突触是指在免疫细胞形成的表面,对活化发挥作用的分子复合体。知晓受体(例如,T细胞受体(TCR)或NK细胞受体)、该受体的辅助因子(例如CD3)、各种共刺激分子(例如CD28)、结构蛋白质(例如肌动蛋白)、接附分子(例如整联蛋白)及信号分子集聚在细胞表面的一部分而形成免疫突触。通过以免疫细胞作为目标的细胞和免疫细胞接触而可在免疫细胞形成IS。另外,不限于此,也可由与诱导IS形成的分子(例如,免疫刺激因子)、非生物材料等的接触形成。在本说明书中,“目标分子的定位”和“免疫突触”是同义。IS与其他细胞或非生物材料等的接触被解除,成为免疫细胞单独的状态之后,也在细胞上存续短暂期间(30分钟左右)。
表面抗原是具有细胞外结构域的蛋白质。表面抗原也可具有细胞内结构域、膜贯通结构域(trans-membrane domain)等。表面抗原可存在于细胞膜上的蛋白质、糖链、脂质及它们的组合。表面抗原的种类只要是存在能与表面抗原结合的捕获物质,或者可制造那样的捕获物质,就不特别限定。优选的表面抗原是构成免疫细胞中的免疫突触的分子。作为表面抗原,可举出例如CD3、CD28、TCRα/β、CD40L、OX40、CTLA4、PD-1及ICOS等。表面抗原也可为共刺激分子。共刺激分子是免疫细胞的表面抗原的一种。例如,T细胞的共刺激分子是除了经TCR的抗原特异性的信号之外,可向T细胞给用于活化T细胞的辅助信号的分子。NK细胞的共刺激分子是除了经NK细胞的活化受体的目标细胞的配体特异性的信号之外,可向NK细胞给用于活化NK细胞的辅助信号的分子。作为共刺激分子,可举出例如CD28、OX40、CD40L、CTLA4、PD-1、ICOS等。
结构蛋白质是指关于生物体内细胞、器官等的结构或形态的维持及调节的蛋白质。作为结构蛋白质,可举出例如肌动蛋白、微管蛋白等。在本实施方式中,作为结构蛋白质的聚合物,优选构成细胞骨架的蛋白质的聚合物,特别优选F肌动蛋白。F肌动蛋白在免疫刺激的免疫细胞中,细胞质侧的细胞膜的一部分定位。
免疫细胞中的目标分子的定位的生成由与免疫刺激因子接触的免疫细胞和异物的接触促进。在本实施方式中,优选在全血和免疫刺激因子在体外的混合后,进行使免疫细胞和与该免疫细胞不同的物质接触的工序。此工序例如,可通过将含免疫细胞的全血及免疫刺激因子的混合物离心分离、搅拌、或者静置来进行。由此,分析对象的免疫细胞可与该分析对象的免疫细胞以外的血细胞、及收容全血的容器的内表面接触。接触可在例如2分钟以上120分钟以下的范围进行即可。
全血的搅拌也可为颠倒混合、移液器吸吐、利用搅拌器的搅拌等之任一者。优选为颠倒混合。颠倒混合可以手动方法进行,也可使用旋转器进行。
离心分离的旋转速度或离心加速度不特别限定,优选不损伤免疫细胞的程度的稳的条件。例如,离心分离可举出在将全血分离为血浆成分及细胞成分的条件下进行。此时,细胞成分分离为含白细胞等的免疫细胞的层(血沉棕黄层)和含红细胞的层。由此,在血沉棕黄层中,分析对象的免疫细胞可与其他白细胞有效接触。其他白细胞是指血沉棕黄层中所含的不是分析对象的免疫细胞。接触后,也可搅拌分离的全血。
在本实施方式中,通过将含免疫细胞的全血和免疫刺激因子在体外混合,该免疫细胞之中,在对免疫刺激示应答性的细胞中,目标分子的定位生成。例如CD28分子在未免疫刺激的T细胞中,通常,均一地分布于细胞膜上。一方面,T细胞由与作为免疫刺激因子的抗CD28抗体及异物接触免疫刺激,则CD28分子处于向与细胞膜上的抗CD28抗体接触的位置定位的倾向。
在本实施方式中,优选在对免疫细胞的目标分子进行标记的工序和取得后述的免疫细胞中的目标分子的定位相关信息的工序之间,固定全血中所含的免疫细胞。在免疫细胞生成的目标分子的定位存续短暂期间,通过进行固定处理,可更确实地保持生成的目标分子的定位。
免疫细胞的固定可通过向与免疫刺激因子混合的全血添加固定剂来进行。作为固定剂,通常在细胞或组织的免疫染色中使用的试剂即可,可举出例如多聚甲醛、低级醇等。也可使用市售的细胞固定液。
在本实施方式中,优选在对免疫细胞的目标分子进行标记的工序和取得后述的免疫细胞中的目标分子的定位相关信息的工序之间,溶解全血中所含的红细胞。如上所述,由于全血中红细胞相比免疫细胞极其多,通过使红细胞溶解,可更正确地对免疫细胞进行测定。为了降低对在免疫细胞生成的目标分子的定位的影响,在优选的实施方式中,在固定全血中所含的免疫细胞的工序和取得后述的免疫细胞中的目标分子的定位相关信息的工序之间,溶解全血中所含的红细胞。
红细胞的溶解可通过向与免疫刺激因子混合的全血添加溶血剂来进行。作为溶血剂,只要是破坏红细胞的细胞膜而使其溶血,但实质上不损伤免疫细胞的试剂即可。作为这样的溶血剂,可举出例如氯化铵、表面活性剂及它们的混合物等。作为表面活性剂,优选阳离子性表面活性剂、非离子性表面活性剂或它们的组合。含溶血剂的试剂被市售。例如,也可使用白细胞分类用试剂等,血液检查领域公知的血细胞测定用试剂。
在本实施方式中,也可根据需要,进行免疫细胞的细胞膜的透过处理。由此,捕获体及标记物质可进入免疫细胞内,可对处于细胞内部的目标分子进行标记。另外,细胞核的标记也变得可能。细胞膜的透过处理本身是公知的,可举出例如使用皂苷、Triton(商标)X-100、Tween(商标)20等的表面活性剂的方法。在使用含表面活性剂的溶血剂时,可同时进行红细胞的溶解和免疫细胞的细胞膜的透过处理。
在本实施方式的方法中,优选在将含免疫细胞的全血和免疫刺激因子在体外混合之后,对该免疫细胞的目标分子进行标记。
在优选的实施方式中,通过将免疫细胞的目标分子、与该目标分子结合的捕获体和可发生能检测的光学信号的标记物质结合,对目标分子进行标记。此时,通过标记物质经捕获体与目标分子间接结合,该目标分子被标记。
作为目标分子的标记的具体性操作,向含受由免疫刺激因子的免疫刺激的免疫细胞的全血添加与目标分子结合的捕获体和可发生能检测的光学信号的标记物质即可。即,在本实施方式的方法中,在无为了目标分子的标记而从免疫刺激后的全血单离免疫细胞的必要,可削减作业中要求的工序数及时间的方面有利。
与目标分子结合的捕获体(以下,也简称为“捕获体”)可对应于目标分子的种类而适宜确定。优选的捕获体是能与目标分子特异性地结合的物质,可举出例如抗体、适体、受体分子、配体分子等。在目标分子是F肌动蛋白时,也可作为该捕获体,使用鬼笔环肽。鬼笔环肽是由与F肌动蛋白特异性地结合的7氨基酸构成的肽。
作为可发生能检测的光学信号的标记物质(以下,也简称为“标记物质”),优选荧光物质。荧光物质可从藻红蛋白(PE)、别藻蓝蛋白(APC)、异硫氰酸荧光素(FITC)、若丹明、Alexa Fluor(注册商标)、花青苷系染料等的公知的荧光染料、及,绿色荧光蛋白(GFP)等的公知的荧光蛋白质等适宜选择。
标记物质优选与捕获体直接或间接结合。作为标记物质和捕获体的直接的的结合,可举出例如,将捕获体用标记物质标记。物质的标记方法本身是在现有技术中公知的。例如,也可使用交联剂等调制将捕获体和标记物质共价结合的分子(标记捕获体)。在捕获体是抗体等的蛋白质时,也可使用市售的荧光标记试剂盒等进行标记。或者,在针对目标分子的标记抗体被市售时,也可使用。通过标记物质直接结合的捕获体与目标分子结合,目标分子被标记。
作为标记物质和捕获体的间接的结合,可举出例如,经可使标记物质和捕获体与捕获体特异性地结合的物质结合。此时,可与捕获体特异性地结合的物质优选被标记物质标记。作为可与捕获体特异性地结合的物质,可举出例如抗体、适体等。在捕获体是抗体时,优选使用与捕获体特异性地结合的标记抗体。此时,捕获体作为第一抗体与目标分子结合,与捕获体特异性地结合的标记抗体作为第二抗体与和目标分子结合的捕获体结合。由此,标记物质与捕获体间接结合而目标分子被标记。
或者,也可使用生物素修饰的捕获体和固定标记物质的亲和素类。此时,经生物素和亲和素类的特异性结合而标记物质可与和目标分子结合的捕获体间接结合。再者,亲和素类是指亲和素、链霉亲和素及它们的衍生物。
在本实施方式中,也可根据需要,对免疫细胞的细胞核进行标记。在免疫细胞的细胞膜被透过处理时,细胞核可由能对核酸进行染色的荧光染料染色。作为这样的荧光染料,可举出例如Hoechst33342、Hoechst33258、4',6-二脒-2-苯基吲哚-二氢氯化物(DAPI)等。
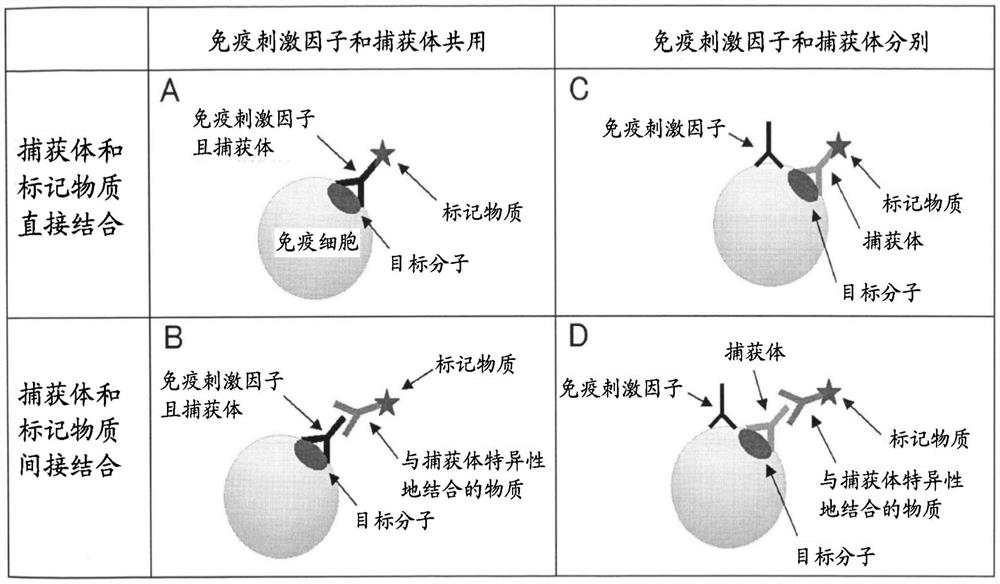
在本实施方式中,上述的免疫刺激因子也可作为与目标分子结合的捕获体共用。在本说明书中,免疫刺激因子作为“捕获体共用”是指免疫刺激因子作为与目标分子结合的捕获体也发挥功能,在免疫细胞的刺激及目标分子的捕获的两方中使用。作为这样的免疫刺激因子,优选免疫刺激抗体。通过使用作为捕获体共用的免疫刺激因子,可同时进行免疫细胞中的目标分子的定位的生成、及目标分子的捕获。另外,在作为捕获体共用的免疫刺激因子被标记物质标记时,可同时进行免疫细胞中的目标分子的定位的生成、目标分子的捕获及标记。
参照图1,对于本实施方式的方法中的目标分子的捕获及标记的例进行说明。在图1中,免疫刺激因子、捕获体及与该捕获体特异性地结合的物质均作为抗体表示,但本发明不限于此。图1的小图A及B显示免疫刺激因子作为捕获体共用的情况。在小图A中,标记物质与免疫刺激因子(捕获体)直接结合。此时,由免疫刺激因子和免疫细胞的接触生成目标分子的定位的同时,由该免疫刺激因子捕获目标分子。再者,由于标记物质与免疫刺激因子相直接结合,目标分子被标记。在小图B中,标记物质与免疫刺激因子(捕获体)间接结合。此时,由与免疫刺激因子的接触生成目标分子的定位的同时,由该免疫刺激因子捕获目标分子。进而,通过以被标记物质标记的与捕获体特异性地结合的物质作为第二抗体与捕获体结合,目标分子被标记。
小图C及D显示免疫刺激因子和捕获体是分别的分子的情况。再者,在小图C及D中,例示与免疫刺激因子接触的免疫细胞上的分子是与目标分子不同的分子的情况,本发明不限定于此例。在小图C中,标记物质与捕获体直接结合。此时,首先,由免疫刺激因子和免疫细胞的接触生成目标分子的定位。进而,定位的目标分子结合有捕获体。其中,由于标记物质与捕获体相直接结合,目标分子被捕获的同时被标记。在小图D中,标记物质与捕获体间接结合。此时,首先,由免疫刺激因子和免疫细胞的接触生成目标分子的定位。进而,定位的目标分子结合有捕获体。再者,通过以被标记物质标记的与捕获体特异性地结合的物质作为第二抗体与捕获体结合,目标分子被标记。
(取得目标分子的定位相关信息的工序)
在本实施方式的分析方法中,对由标记上述的目标分子的工序得到的免疫细胞进行分析。具体而言,通过检测标记,取得免疫细胞中的目标分子的定位相关信息。
在本实施方式中,优选检测从标记物质发生的光学信号,基于检测的光学信号而取得免疫细胞中的目标分子的定位相关信息。光学信号的检测手段不特别限定,优选能对各细胞进行分析的手段。作为这样的光学信号的检测手段,可举出例如流式细胞仪(FCM)及成像流式细胞仪(IFC)等。在优选的实施方式中,使用FCM或IFC检测光学信号。
在用FCM或IFC进行光学信号的检测时,可以含免疫刺激因子、捕获体及标记物质的全血作为直接测定用试样使用。即,在使用FCM或IFC的本实施方式的方法中,在无为了标记的免疫细胞的分析而从免疫刺激及标记处理后的全血单离免疫细胞的必要,从而可削减作业中要求的工序数及时间的方面有利。
FCM是通过向在液中流动的细胞照射光,检测从各细胞发出的散射光信号及/或荧光信号,能测定细胞集团中的各细胞的尺寸,蛋白质的表达量的分布等的装置。IFC是具备CCD摄像机等的摄像部的流式细胞仪,且能取得在液中流动的细胞的图像的装置。更具体而言,IFC可在数秒钟至数分钟的短时间,从数千个至数百万个细胞的各自取得荧光信号、散射光信号、荧光图像及透射光图像而定量测定。可由图像处理提取1个1个细胞的信息。
在本实施方式中,FCM及IFC不特别限定,也可使用市售的FCM或IFC。另外,FCM及IFC的光源不特别限定,可适宜选择适宜于荧光物质的激发的波长的光源。作为光源,使用例如,蓝色半导体激光、红色半导体激光、氩激光、He-Ne激光、汞弧光灯等。
在本实施方式中,优选由IFC检测从标记物质发生的光学信号,基于检测的光学信号而取得免疫细胞中的目标分子的定位相关信息。如后所述,如果由IFC,可基于拍摄的细胞的荧光图像及透射光图像而得到含荧光信号面积值、总荧光信号强度、细胞的尺寸、长宽比等的多重参数。
在本实施方式中,也可作为免疫细胞中的目标分子的定位相关信息,取得例如,目标分子的定位生成的免疫细胞的数。目标分子的定位生成的免疫细胞的数,例如,可基于检测的光学信号而取得反映免疫细胞中的被标记的目标分子的分布的值,基于取得的值而进行计数。作为反映被标记的目标分子的分布的值,例如,在标记物质是荧光物质时,可举出与目标分子间接结合自的标记物质的荧光信号的脉宽、脉冲的高度及脉冲面积等。
例如,在目标分子是CD28时,在未免疫刺激的免疫细胞中,由于CD28通常均一地分布于细胞膜,脉宽变大,并且脉冲的高度变低。一方面,在免疫刺激的免疫细胞中,CD28在细胞膜上的指定的位置定位之时,与未免疫刺激的免疫细胞相比,脉宽变小,并且脉冲的高度变高。
标记物质是荧光物质,在使用IFC检测荧光信号时,也可基于荧光信号而取得各细胞的荧光图像,基于该荧光图像而对目标分子的定位生成的免疫细胞进行计数。例如,作为反映被标记的目标分子的分布的值,也可基于各细胞的荧光图像而取得荧光信号面积值。其中,“荧光信号面积值”是指在各细胞的荧光图像中构成显示荧光信号的区的像素(象素)的数。构成显示荧光信号的区的各像素具有与荧光信号相对应的像素值。在自细胞的荧光图像的荧光信号面积值的取得中,也可取得具有比指定的像素值(例如背景)高的像素值的像素的数。
例如,在目标分子是CD28时,在未免疫刺激的免疫细胞中,由于CD28通常均一地分布于细胞膜,荧光信号面积值变高。一方面,在免疫刺激的免疫细胞中,CD28在细胞膜上的指定的位置定位之时,与未免疫刺激的免疫细胞相比,荧光信号面积值变低。
在本实施方式中,在某1个免疫细胞的荧光信号面积值比指定的阈值低时,可判定为该免疫细胞是目标分子的定位生成的免疫细胞。另外,在某1个免疫细胞的荧光信号面积值比指定的阈值高时,可判定为该免疫细胞是目标分子的定位未生成的免疫细胞。从而,通过从用IFC测定的免疫细胞组的数据提取荧光信号面积值比指定的阈值低的免疫细胞组的数据,可对目标分子的定位生成的免疫细胞进行计数。再者,某1个免疫细胞的荧光信号面积值与指定的阈值相同之时,判定为该免疫细胞可为目标分子的定位生成的免疫细胞,也可为判定为目标分子的定位未生成的免疫细胞。
荧光信号面积值的指定的阈值不特别限定,可适宜设定。例如,也可通过将从添加免疫刺激因子的全血和未添加的全血调制的试样由IFC测定,蓄积荧光信号面积值的数据,依经验设定指定的阈值。
也可通过目标分子的定位生成的免疫细胞的数除以测定的免疫细胞的总数,算出目标分子定位的免疫细胞相对于全血中的免疫细胞的比例(以下,也称为“定位阳性率”)。在本实施方式中,也可以定位阳性率作为免疫细胞中的目标分子的定位相关信息取得。
定位阳性率被认为是全血中所含的指定的免疫细胞亚组的免疫刺激应答性的指标。从而,在本实施方式中,也可基于定位阳性率而判定全血中所含的免疫细胞亚组的免疫刺激应答性。作为指定的免疫细胞亚组,优选T细胞亚组或NK细胞亚组。例如,在受试者的全血中所含的指定的免疫细胞亚组的定位阳性率比指定的阈值低时,可判定为该指定的免疫细胞亚组的免疫刺激应答性低。另外,在受试者的全血中所含的指定的免疫细胞亚组的定位阳性率比指定的阈值高时,可判定为该指定的免疫细胞亚组的免疫刺激应答性高。再者,受试者的全血中所含的指定的免疫细胞亚组的定位阳性率与指定的阈值相同之时,该指定的免疫细胞亚组的免疫刺激应答性可判定为低,也可判定为高。
定位阳性率的指定的阈值不特别限定,可适宜设定。定位阳性率还可因受试者的疾病、健康状态等而改变。例如,也可通过将使从健康的受试者采集的全血和免疫刺激因子在体外混合而调制的试样由IFC测定,蓄积定位阳性率的数据,依经验设定指定的阈值。
在由IFC测定的试样中,除了免疫细胞以外,也含溶解的红细胞的残骸(红细胞影)等的不是分析对象的粒子。其中,粒子是指存在于测定试样中的有形成分,可举出例如,细胞、红细胞影、血小板凝集等。在使用IFC的本实施方式中,也可为了区别分析对象的免疫细胞和该免疫细胞以外的粒子,取得各细胞的透射光图像及荧光图像,基于它们的图像而对分析对象的免疫细胞进行计数。例如,也可从各细胞的透射光图像取得细胞的尺寸及长宽比。也可从各细胞的荧光图像取得总荧光信号强度。
在本说明书中,“细胞的尺寸”是在各细胞的透射光图像中检测到显示比指定的阈值低的像素值的细胞膜的区域,反映检测的被细胞膜包围的细胞的图像的象素数。细胞的“长宽比”是反映透射光图像中的细胞粒子的图像的纵和横的长度(象素数)的比。例如,细胞的尺寸及/或长宽比比指定的阈值小的粒子不是细胞,可看作红细胞影等的碎片而除外。
在本说明书中,“总荧光信号强度”是构成各细胞的荧光图像中显示荧光信号的区的各像素的像素值的积分值。例如,总荧光信号强度比指定的阈值小的粒子可看作未被标记的细胞、即分析对象的免疫细胞以外的细胞而除外。
[2.细胞分析装置]
在本发明的范围中,也含细胞分析装置。对于本发明的此实施方式涉及的实施方式而参照附图而同时说明。再者,以下的说明全部是例示,本发明不限定于此说明。
<细胞分析装置的实施方式1>
参照图2,细胞分析装置1具备测定装置2和信息处理装置3。测定装置2将含捕获体及标记物质结合的免疫细胞的试样由流式细胞术法光学测定。信息处理装置3对利用测定装置2的测定结果进行解析,向显示部320显示解析结果。本实施方式不仅限定于此例,也可为例如,测定装置2及信息处理装置3被一体构成的装置。
参照图3,测定装置2具有导入部201、摄像部203、信号处理部210、CPU204、通信接口205和存储器206。信号处理部210具有模拟信号处理部211、A/D转换器212、数字信号处理部213和存储器214。
在此实施方式中,导入部201具备容器和泵(未图示)。容器中的试样由泵与鞘液一同供给于摄像部203的流动池203c(参照图4)。导入部201根据CPU204的指示而向摄像部203供给试样。在实施方式1中,测定的试样如以下一样调制。通过向收容在容器中的人末梢血添加抗CD28抗体而进行离心分离,向末梢血中的免疫细胞给免疫刺激。在此例中,目标分子是CD28,抗CD28抗体作为捕获体共用。固定末梢血中的细胞,使红细胞溶血之后,使用与抗CD28抗体结合的PE标记第二抗体而对免疫细胞进行标记。但是,本发明不限定于此例。
摄像部203对于从导入部201供给的试样照射激光,拍摄含标记的免疫细胞的粒子,将生成的透射光图像和荧光图像的图像信息作为电信号输出到模拟信号处理部211。模拟信号处理部211根据CPU204的指示而扩增从摄像部203输出的电信号,输出到A/D转换器212。
A/D转换器212将由模拟信号处理部211扩增的电信号变换为数字信号,输出到数字信号处理部213。数字信号处理部213根据CPU204的指示而对于从A/D转换器212输出的数字信号而实施指定的信号处理,生成测定数据。生成的测定数据收纳在存储器214。
收纳在存储器214的测定数据含基于试样中的各粒子通过流动池203c时发生的透射光及荧光的透射光图像及荧光图像。
CPU204向通信接口205输出收纳在存储器214的测定数据。CPU204经通信接口205而从信息处理装置3接收控制信号,根据该控制信号而控制测定装置2的各部。
通信接口205向信息处理装置3发送从CPU204输出的测定数据,接收从信息处理装置3输出的控制信号。存储器206作为CPU204的作业区域使用。
参照图4,摄像部203具备光源203a、203b、流动池203c、聚光透镜203d、203e、物镜203f、光学单元203g、聚光透镜203h和摄像机203i。
在此实施方式中,光源203a是半导体激光。从光源203a照射的光是波长λ1的激光。聚光透镜203d对从光源203a照射的光进行聚光而导入到流动池203c中的试样。从光源203a照射的波长λ1的光照射到通过流动池203c的内部的试样中的各粒子,由此,从粒子发生波长λ1的透射光。
光源203b是半导体激光源。从光源203b照射的光是波长λ2的激光。在此实施方式中,波长λ2是约488nm。聚光透镜203e对从光源203b照射的光进行聚光而导入到流动池203c中的试样。从光源203b照射的波长λ2的光照射到通过流动池203c的内部的试样中的各粒子。向被PE标记的免疫细胞照射光之时,从PE发生波长λ3的荧光。
物镜203f对波长λ1的透射光及波长λ3的荧光进行聚光。光学单元203g具有组合2个二向色镜的构成。光学单元203g的2个二向色镜将波长λ1的透射光及波长λ3的荧光以互相不同的角度反射,在后述的摄像机203i的光接收面203ia(参照图5)上分离。聚光透镜203h对波长λ1的透射光及波长λ3的荧光进行聚光。摄像机203i接收波长λ1的透射光及波长λ3的荧光,以流动池203c中的试样的图像信息作为电信号,输出到模拟信号处理部211。摄像机203i可为TDI(Time Delay Integration)摄像机。通过使用TDI摄像机,可取得精度更高的图像信息。
如图5所示,摄像机203i在光接收面203ia上的光接收区域203ib、203ic中各自接收波长λ1的透射光及波长λ3的荧光。光接收面203ia是配在摄像机203i的CMOS像传感器等的摄像元件的光接收面。照射到光接收面203ia的光的位置根据试样在流动池203c的移动,如以箭头表示,各自在光接收区域203ib、203ic内移动。这样,由于由光学单元203g而2个光在光接收面203ia上分离,CPU204可从摄像机203i输出的图像信号提取与各光相对应的信号。
参照图6,信息处理装置3由本体300、输入部310和显示部320构成。本体300具备CPU(Central Processing Unit)301、ROM(Read Only Memory)302、RAM(Random AccessMemory)303、硬盘304、读取装置305、输入输出接口306、图像输出接口307和通信接口308。
CPU301执行收纳在ROM302的计算机程序及加载到RAM303上的计算机程序。在收纳在ROM302的计算机程序中,含BIOS(Basic Input Output System)。RAM303在记录在ROM302及硬盘304的计算机程序的读取中使用。在RAM303执行这些计算机程序之时,也作为CPU301的作业区域利用。
在硬盘304中收纳在OS(Operating System)及应用程序等,用于被CPU301执行的各种计算机程序及计算机程序的执行中使用的数据。另外,在硬盘304中收纳从测定装置2接收的测定数据。
在硬盘304中收纳基于测定数据而测量含试样中所含的免疫细胞的数、细胞的尺寸、长宽比、荧光信号面积值、总荧光信号强度等的解析用参数,向显示部320显示用于进行对试样的解析的程序或解析结果的显示程序。通过收纳这些程序,进行后述的解析处理或显示处理。即,向CPU301赋予由这些程序执行后述的图7b的处理的功能。
读取装置305由CD-ROM驱动器、DVD-ROM驱动器、USB端口、SD卡读取器、CF卡读取器、记忆棒读取器、固态硬盘、软盘驱动器等构成。读取装置305可读取记录在CD、DVD等的可移动型记录介质的计算机程序及数据。
向输入输出接口306连接由鼠标、键盘等构成的输入部310,使用者使用输入部310输入对于信息处理装置3的指示。图像输出接口307与由显示器等构成的显示部320连接,向显示部320输出对应于图像数据的影像信号。显示部320基于输入的影像信号而显示图像。
信息处理装置3由通信接口308从测定装置2发送的测定数据的接收变得可能。接收的测定数据收纳在硬盘304。
图7是显示测定装置2的CPU204和信息处理装置3的CPU301的控制的流程图。图7a是显示由测定装置2的CPU204的控制处理的流程图,图7b是显示由信息处理装置3的CPU301的控制处理的流程图。
关于信息处理装置3的CPU301的控制处理,参照图7b。CPU301经输入部310而有自使用者的测定开始指示(步骤S11:YES),向测定装置2发送测定开始信号(步骤S12)。接下来,CPU301判定是否接收测定数据(步骤S13)。未接收测定数据(步骤S13:NO)、待机处理。
关于测定装置2的CPU204的控制处理,参照图7a。当CPU204从信息处理装置3接收测定开始信号(步骤S21:YES)时,进行试样的测定(步骤S22)。在测定处理(步骤S22)中,与从导入部201向流动池203c鞘液一同,供给含被标记的免疫细胞的试样,在流动池203c中形成了被鞘液包裹的试样的流。向形成的试样的流照射自光源203a、203b的激光光束,在流动池203c形成光束点。当试样中的各粒子通过光束点时,发生透射光及荧光。发生的透射光及荧光由摄像机203i各自拍摄而变换为电信号。
这些电信号利用A/D转换器212变换为数字信号,由数字信号处理部213实施信号处理。由此,每个通过流动池203c的复合体得到了含透射光图像及荧光图像的测定数据。测定数据收纳在存储器214。当试样的测定结束时,CPU204向信息处理装置3发送由测定处理生成的测定数据(步骤S23),结束处理。
参照再图7b,当信息处理装置3的CPU301从测定装置2接收测定数据时(步骤S13:YES)、向硬盘304收纳测定数据,基于涉及的测定数据而进行测量处理,取得解析用参数(步骤S14)。进而,CPU301使用解析用参数进行解析处理(步骤S15)。接下来,CPU301向显示部320显示在S14中取得的解析结果(步骤S16)。其后,处理结束。
参照图8~图10,进一步对于信息处理装置3的CPU301基于测定数据而进行的解析处理(图7b的步骤S14)的一例进行说明。图8显示对被标记的免疫细胞进行测定而得到的测定数据之中,透射光图像、荧光图像(CD28)及它们的重合(Merge)图像。如图8a的荧光图像中所示,在未给免疫刺激时,CD28显示均一地分布于免疫细胞的细胞膜上的倾向。如图8b的荧光图像中所示,在给免疫刺激时,CD28显示在免疫细胞的细胞膜上的一部分定位的倾向。不旨在受理论约束,认为显示CD28定位的细胞膜部分显示免疫突触。
CPU301基于图7a的步骤S22中拍摄的全部粒子的透射光图像及荧光图像而进行测量处理,取得解析用参数(图7b的步骤S14)。作为解析用参数,可举出例如,细胞的尺寸(象素数)、细胞的长宽比、细胞中的显示荧光信号的区(荧光信号面积值:象素数)、该区内的总荧光信号强度、它们的比等,但不限于这些。图9显示信息处理装置3的CPU301显示的透射光图像及荧光图像(参照图8b)的测量处理(图7b的步骤S14)的模式图。得到的测定数据收纳在硬盘304。再者,细胞的尺寸、长宽比、荧光信号面积值及总荧光信号强度的各用语的含意如上所述。
图10是显示信息处理装置3的CPU301的步骤S15中的解析处理(参照图7b)的流程图。CPU301制成图7b的将由步骤S14测量的解析用参数各自分配到X轴和Y轴的2维直方图(2D散点图)而提取与存在于指定的范围内的点相对应的细胞的测定数据而进行解析。再者,接下来说明的解析处理不过是一例,在本实施方式中,也可使用不同的解析处理。
在步骤S51中,CPU301制成在X轴分配细胞尺寸,在Y轴分配细胞的长宽比的2D散点图(参照图11a)。2D散点图中显示的点之一1个与测定的各粒子相对应。CPU301提取处于2D散点图中的表示为R1的指定的区域(以下,称为“指定的范围(R1)”)的细胞的测定数据。指定的范围(R1)是在细胞尺寸(X轴)中反映细胞单独的尺寸的指定的范围选通,并且在长宽比(Y轴)中反映细胞单独存在的指定的范围选通的区域。由此,来源于比细胞小的红细胞影等的碎片、比单独的细胞大的细胞的凝集块的数据除外。
在此实施方式中,在2D散点图中显示的点,关联在图7a的步骤S22中测定的各粒子的测定数据。在由使用者指定在2D散点图中显示的点时,CPU301从硬盘304读取与该点相对应的粒子的测定数据(透射光图像及/或荧光图像),显示于显示部320。
在步骤S52中,CPU301对于步骤S51中提取的细胞的测定数据而制成在X轴分配总荧光信号强度,在Y轴分配荧光图像的清晰度(图像的鲜明性)的2D散点图(图11b)。CPU301还提取处于2D散点图中的表示为R2的指定的区域(以下,称为“指定的范围(R2)”)的细胞的测定数据。范围(R2)是在总荧光信号强度(X轴)中反映指定的CD28表达量的范围选通,在清晰度(Y轴)中反映指定的图像的清晰度的范围选通的区域。由此,提取表达指定量的CD28的细胞的数据,不表达指定量的CD28的细胞的数据除外。
在此例中,制成图11b中所示的2D散点图,但也可不制成此2D散点图。例如,也可仅基于总荧光信号强度而提取表达指定量的CD28的细胞的数据。具体而言,通过从步骤S51中提取的细胞的测定数据提取总荧光信号强度比指定的值高的数据,提取表达指定量的CD28的细胞的数据。
在步骤S53中,CPU301对于步骤S52中提取的测定数据而制成在X轴分配细胞的总荧光信号强度,在Y轴分配显示荧光信号的区的2D散点图(图11c)。CPU301对处于2D散点图中的表示为R3的指定的区域(以下,称为“指定的范围(R3)”)的测定数据数进行计数。范围(R3)是在细胞的总荧光信号强度(X轴)中在反映指定的CD28表达量的范围选通,在荧光信号面积值(Y轴)中反映CD28的定位的指定的范围选通的区域。在此实施方式中,与范围(R3)内的点相对应的细胞有生成CD28的定位的倾向。从而,通过对范围(R3)内的点进行计数,CD28的定位生成的免疫细胞被计数。
在步骤S54中,CPU301也可对图11c的2D散点图整体显示的点的数(与处于图11b的范围(R2)的点的数相对应)进行计数,算出范围(R3)内的点的数相对于范围(R2)内的点的数的比例([范围(R3)内的点数]/[范围(R2)内的点数])。由此,算出CD28的定位生成的免疫细胞相对于表达指定量的CD28的免疫细胞的比例。由上述的解析处理得到的各范围内的点数及比例等解析结果显示于显示部320。
<细胞分析装置的实施方式2>
代替实施方式1的解析处理的步骤S53而CPU301也可对于步骤S52中提取的测定数据而制成在X轴分配荧光信号面积值,在Y轴分配细胞的尺寸的2D散点图(图11d)。CPU301也可对处于2D散点图中的表示为R4的指定的区域(以下,称为“指定的范围(R4)”)的测定数据数进行计数。范围(R4)在荧光信号面积值(X轴)中反映CD28的定位的指定的范围选通,并且在细胞的尺寸(Y轴)中反映细胞单独的尺寸的指定的范围选通。通过对范围(R4)中的测定数据进行计数,对于免疫刺激应答性的免疫细胞的数被计数。在此实施方式中,与处于范围(R4)的点相对应的细胞有生成CD28的定位的倾向。从而,通过对范围(R4)内的点进行计数,CD28的定位生成的免疫细胞被计数。
代替实施方式1的解析处理的步骤S54而CPU301也可对图11d的2D散点图整体显示的点的数(与处于图11b的范围(R2)的点的数相对应)进行计数,算出范围(R4)内的点的数相对于范围(R2)内的点的数的比例([范围(R4)内的点数]/[范围(R2)内的点数])。由此,算出CD28的定位生成的免疫细胞相对于表达指定量的CD28的免疫细胞的比例。由上述的解析处理得到的各范围内的点数及比例等解析结果显示于显示部320。
<细胞分析装置的实施方式3>
在测定数据的解析中,也可不使用2D散点图而进行关于免疫细胞中的目标分子的定位的分析。例如,代替实施方式1的解析处理的步骤S53而CPU301也可对于步骤S52中提取的细胞的测定数据而制成在X轴分配荧光信号面积值的等级值,在Y轴分配度数的直方图而显示于显示部320。代替实施方式1的解析处理的步骤S54而CPU301也可从此直方图算出步骤S52中提取的测定数据的荧光信号面积值的平均值、中位值及最频值的至少1个。也可使用得到的值进一步进行解析。例如,也可对从受试者的全血来源的试样得到的荧光信号面积值的最频值和从健康者的全血来源的试样得到的荧光信号面积值的标准化的最频值进行比较。在此解析中,在显示受试者的上述最频值的等级值比显示健康者的标准化的最频值的等级值小时,可判定为在受试者的全血中的免疫细胞中,相比健康者的全血中的免疫细胞,CD28的定位生成。
<细胞分析装置的实施方式4>
在实施方式1~3的解析处理中例示基于拍摄的图像数据的解析,可从图像数据以外的测定数据进行关于免疫细胞中的目标分子的定位的分析。作为摄像部203的变形例,参照例如图12,摄像部203也可为具备光源203a、203b、流动池203c、聚光透镜203d、203e、203j、二向色镜203k、荧光光接收部203l和前方散射光接收部203m的检测光学信号的检测部。
光源203b是半导体激光源。从光源203b照射的光是波长λ2的激光。在此实施方式中,波长λ2是约488nm。聚光透镜203e对从光源203b照射的光进行聚光而导入到流动池203c中的试样。从光源203b照射的波长λ2的光照射到通过流动池203c的内部的试样中的各粒子。向被PE标记的免疫细胞照射光之时,从PE发生波长λ3的荧光。聚光透镜203j对波长λ1的透射光及波长λ3的荧光进行聚光。波长λ1的前方散射光由二向色镜203k反射而由前方散射光接收部203m接收。波长λ3的荧光透过二向色镜203k而由荧光光接收部203l接收。作为荧光光接收部203l及前方散射光接收部203m,可使用雪崩光电二极管、光电二极管或光电子倍增管。
在此例中,在图7a的步骤S22中得到的光学信号是前方散射光信号及荧光信号。另外,在图7b的步骤S14中,作为解析用参数得到了“脉宽(W)”、“脉冲面积(A)”及“脉冲的高度(H)”。参照图13,对于这些解析用参数进行说明。
图13是各自显示CD28均一地分布于细胞膜上的细胞(图13a)和CD28定位于细胞膜上的细胞(图13b)以光束点作为箭头方向通过之间检测的荧光信号的模式图(图13c及d)。
在本说明书中,在如图13c及d中所示的荧光强度的脉冲中,超作为阈值的基线而得到了荧光信号的时间称为“脉宽(W)”,在荧光强度中显示脉冲的峰时的荧光强度称为“脉冲的高度(H)”。“脉冲面积(A)”是指基线和荧光信号强度曲线之间的面积。
在此例中,在图13a的细胞和图13b的细胞中相同的量的CD28在细胞膜上表达,图13c和图13d的脉冲面积(A)成为相等的值。其中,脉宽(W)及脉冲高度(H)由CD28的分布图案相异。与CD28均一地分布于细胞膜上时相比(图13a),在CD28在细胞膜上定位时(图13b)、其脉宽(W)变小,一方面,脉冲的高度(H)变高(图13c及d)。
图14是在此实施方式4中,对多个免疫细胞进行测定而制成2D散点图时的模式图。图14a是在X轴分配脉冲的高度(H),在Y轴分配脉宽(W)的2D散点图,图14b是在X轴分配脉冲的高度(H),在Y轴分配脉冲面积(A)的2D散点图。
如上所述,在共刺激分子均一地分布于细胞膜上时,与共刺激分子在细胞膜上定位时相比,其脉宽(W)显示变大的倾向,脉冲的高度(H)显示变低的倾向。因此,在图14a中所示的2D散点图中,进入到被虚线的圆点包围的区域的数据是反映CD28均一地分布于细胞膜上的细胞的数据。一方面,显示进入到被实线的四角形包围的区域的数据是反映CD28在细胞膜上定位的细胞的数据的倾向。在图14b中所示的2D散点图中,进入到被虚线的四角形包围的区域的数据是反映CD28均一地分布于细胞膜上的细胞的数据。一方面,显示进入到被实线的四角形包围的区域的数据是反映CD28在细胞膜上定位的细胞的数据的倾向。
如实施方式4中例示,不仅是基于拍摄的图像数据的解析处理,由如上所述的基于光学信号的解析处理也被认为可对免疫细胞中的目标分子的定位进行分析。
再者,其中示的解析用参数及解析处理不过是一例,可为从测定数据测量不同的解析用参数,也可另外对于测量的解析用参数进行不同的解析处理。例如,脉冲面积只要是反映脉冲的时间曲线下面积的值,就也可为近似值,对于时间积分值无限定。脉冲面积可为脉宽和峰的高度的积,也可为从脉宽和峰的高度求出的三角形的面积。另外,在测量时间积分值的形态中,底边可以不是基线,可适宜设定。例如,也可以从基线超越指定的阈值的值作为底边。
接下来,将本发明由实施例详细地说明,但本发明不限定于这些实施例。
【实施例】
【实施例1:全血中的免疫细胞的免疫刺激应答性的测定】
通过向从受试者采集的全血(末梢血)作为免疫刺激因子添加抗CD28抗体,刺激全血中的免疫细胞(T细胞)而取得该免疫细胞上的CD28的定位相关信息。作为对照,对于未添加免疫刺激因子的全血中的免疫细胞进行测定。
【1.测定】
(1)刺激的免疫细胞的测定
从5名的受试者(健康自愿者)采集全血。将各受试者的全血(200μL)分取到管,添加小鼠抗人CD28抗体(#302914Clone:CD28.2:BioLegend公司)而稳搅拌。将含抗体的全血以200×g于室温离心分离2分钟而形成血沉棕黄层。通过使血沉棕黄层在CO
(2)未刺激的免疫细胞的测定
除了未添加小鼠抗人CD28抗体以外,与上述(1)同样地,对上述的健康自愿者的全血(200μL)中所含的免疫细胞进行处理,使用IFC进行测定。
【2.数据解析】
进行在由IFC的测定中得到的含刺激的免疫细胞的全血的测定数据和含未刺激的免疫细胞的全血的测定数据的多重参数解析。简言之,基于用IFC取得的各细胞的透射光图像及荧光图像(CD28)而进行图像解析,取得细胞的尺寸、细胞的长宽比、荧光信号面积值及总荧光信号强度。首先,基于各细胞的透射光图像的数据而制成在X轴取细胞尺寸,在Y轴取细胞的长宽比的2D散点图(未图示)。为了除去红细胞影等的碎片的测定数据,选择处于此2D散点图的指定的范围(细胞)内的点,以与选择的各点相对应的测定数据作为细胞的测定数据提取。
接下来,基于范围(细胞)内的测定数据而制成在X轴取总荧光信号强度,在Y轴取荧光信号面积值的2D散点图(未图示)。在此2D散点图中,选择处于总荧光信号强度是指定的值以上的范围(T细胞)内的点。以与选择的各点相对应的测定数据作为免疫细胞(CD28阳性T细胞)的测定数据提取。对于提取的测定数据而制成在X轴取总荧光信号强度,在Y轴取荧光信号面积值的2D散点图。进而,从范围(T细胞)内的测定数据,提取荧光信号面积值低的细胞集团的测定数据。具体而言,在制成的2D散点图中,选择处于指定的范围(IS area2)内的点,以与选择的各点相对应的测定数据作为免疫刺激应答性T细胞的测定数据提取。再者,IS是Immunological Synapse(免疫突触)的略语。
基于范围(T细胞)内的测定数据而制成的2D散点图的一例示于图15A(未刺激的免疫细胞)及图15B(刺激的免疫细胞)。图15A及B中,被长方形包围的区域是范围(IS area2)。另外,图15A及B中,与被椭圆包围的区域内的各点相对应的细胞的图像的一例示于图16A及B。对处于范围(T细胞)内及范围(IS area2)内的点进行计数,由以下的式算出CD28定位的T细胞相对于全血中的T细胞的比例(CD28定位阳性率)。对于各受试者的T细胞的CD28定位阳性率示于图17。
[CD28定位阳性率(%)]={[范围(IS area2)内的点数]/[范围(T细胞)内的点数]}×100
【3.结果及考察】
如从图16A得知,在未给由抗CD28抗体的免疫刺激的T细胞中,CD28分子均一地分布于细胞膜上。与此相比,如从图16B得知,在给免疫刺激的T细胞中,CD28分子在细胞膜上的一部分定位。认为,CD28的荧光图像中的显示此定位的部分显示形成的免疫突触。在图15A及B的2D散点图中,显示荧光信号面积值小的值的细胞有形成免疫突触的倾向。从而,选通荧光信号面积值小的区域而显示表示免疫刺激应答性的免疫细胞出现的区域(范围(ISarea2))。当对图15A(未刺激的免疫细胞)和图15B(刺激的免疫细胞)进行比较时,得知在图15B中,在选通的区域(范围(IS area2))细胞显著地出现。
图17显示,在从任何受试者采集的全血中,无刺激时均显示CD28定位阳性率非常地低的值。一方面,在有刺激时CD28定位阳性率升高,与无刺激时相比见到显著的差异。以上结果表明,可由作为试样使用全血的本实施方式的方法检测显示免疫刺激应答性的免疫细胞(显示IS形成能的免疫细胞)。另外表明,可基于检测结果而评价免疫细胞的免疫刺激应答性(IS形成能)。
【实施例2:使用全血的本实施方式的方法和使用单离的PBMC的以往方法的比较(1)】
以CD28定位阳性率作为指标比较作为试样而使用全血的本实施方式的方法和作为试样而使用从全血单离的PBMC(末梢血单核细胞)的以往方法。
【1.测定】
(1)全血中的免疫细胞的测定
从健康自愿者采集全血。使用采集的全血的一部分(200μL),与实施例1同样地进行用抗人CD28抗体刺激的免疫细胞及未刺激的免疫细胞的测定。
(2)PBMC中的免疫细胞的测定
取上述的全血的一部分(200μL),由使用Ficoll的密度梯度离心法单离PBMC。将单离的PBMC分取到管,添加与实施例1相同的抗人CD28抗体,以200×g于室温离心分离2分钟而使细胞沉降。通过使细胞在CO
【2.数据解析】
与实施例1同样地进行在由IFC的测定中得到的数据的多重参数解析。算出CD28定位的T细胞相对于全血或单离的PBMC中的T细胞的比例(CD28定位阳性率)。结果示于图18。
【3.结果及考察】
图18显示,在无刺激时,在PBMC及全血中的T细胞的CD28定位阳性率显示同程度的值。一方面,在有刺激时,在PBMC中的T细胞的CD28定位阳性率显示比全血显著地低的值。这被认为,提示起因于从全血分离及单离PBMC的工序的免疫细胞的质及功能的变化。在本实施方式的方法中,由于不进行分离及单离PBMC的工序,变得无法影响起因于所述工序的质及功能。从而表明,本实施方式的方法比使用PBMC的以往方法测定的精度提升。
【实施例3:使用全血的本实施方式的方法和使用单离的PBMC的以往方法的比较(2)】
以噪声信号作为指标比较作为试样而使用全血的本实施方式的方法和作为试样而使用从全血单离的PBMC(末梢血单核细胞)的以往方法。
【1.测定及数据解析】
与实施例1同样地,使用从5名的受试者采集的全血,不添加抗CD28抗体地对全血中的T细胞进行测定,算出CD28定位阳性率。另外,与实施例2同样地,从自4名的受试者采集的全血单离PBMC,不添加抗CD28抗体地对PBMC中的T细胞进行测定,算出CD28定位阳性率。结果示于图19。
【2.结果及考察】
图19显示,当对在无刺激的条件下的全血及PBMC中的T细胞的CD28定位阳性率进行比较时,在PMBC中见到数据的偏差或噪声信号。这被认为,从全血分离及单离PBMC的工序向免疫细胞的质及功能提示影响。一方面,在使用全血的本实施方式的方法中,由于不进行分离及单离PBMC的工序,降低起因于所述工序的数据的偏差或噪声信号。从而表明,本实施方式的方法比使用PBMC的以往方法测定的精度提升。
【实施例4:全血中的免疫刺激对目标分子的定位及测定的影响】
作为分析对象的免疫细胞,使用T细胞克隆,进行由本实施方式的方法及以往方法的测定,对T细胞克隆的CD28定位阳性率进行比较。
【1.T细胞克隆的调制】
向含1μg/mL LEAF(商标)纯化抗人CD3抗体(317315:Biolegend公司)、10ng/mL重组型人IL-2(rhIL-2)(202-IL-500:R&D systems公司)、0.2μg/mL植物凝血素-L(PHA)(L4144-5MG:SIGMA公司)及2%人血清(H4522-100ML:SIGMA公司)的Yssel's培养基(400102:Gemini Bio-Products公司)接种5×10
【2.测定】
(1)由本实施方式的方法的T细胞克隆的测定
向从健康自愿者采集的全血(200μL)添加用Hoechst标记的T细胞克隆(5×10
(2)由以往方法的T细胞克隆的测定
向48孔板接种用Hoechst标记的T细胞克隆(5×10
【3.数据解析】
与实施例1同样地进行在由IFC的测定中得到的数据的多重参数解析。算出CD28定位的T细胞克隆相对于全血或向板添加的T细胞克隆的比例(CD28定位阳性率)。结果示于图20A及B。图中,“P”表示使用板的以往方法的条件,“B”表示使用全血的本实施方式的方法的条件。
【4.结果及考察】
如从图20A及B得知,T细胞克隆的CD28定位阳性率在向全血中添加T细胞克隆时和向板中接种T细胞克隆时之间确认不到显著的差异。至此,认为全血中所含的免疫细胞以外的血细胞成分由免疫刺激影响目标分子的定位及测定。但是表明,在本实施方式的方法中,即使在全血中进行免疫刺激,也与以往方法同样地,可检测显示免疫刺激应答性的免疫细胞(显示IS形成能的免疫细胞)。
【实施例5:溶血剂的探讨】
使用2种溶血剂而进行由本实施方式的方法及以往方法的测定,对免疫细胞的CD28定位阳性率进行比较。作为分析对象的免疫细胞,使用实施例4的T细胞克隆。
【1.测定】
(1)由本实施方式的方法的T细胞克隆的测定
除了使用溶血剂1(0.8%氯化铵)或溶血剂2(0.41%氯化铵及0.2%表面活性剂)之外,与实施例4同样地,将添加到全血的T细胞克隆用IFC测定。溶血剂1及2均是作为溶血用试剂市售的制品。
(2)由以往方法的T细胞克隆的测定
与实施例4同样地,将接种到48孔板的T细胞克隆用IFC测定。
【2.数据解析】
与实施例1同样地进行在由IFC的测定中得到的数据的多重参数解析。算出CD28定位的T细胞克隆相对于全血或向板添加的T细胞克隆的比例(CD28定位阳性率)。结果示于图21。图中,“P”表示使用板的以往方法的条件,“B”表示使用全血的本实施方式的方法的条件。另外,“1”表示使用溶血剂1,“2”表示使用溶血剂2。
【3.结果及考察】
如从图21得知,在使用溶血剂1及2之任一者时,在T细胞克隆的CD28定位阳性率上也确认不到显著的差异。这表明,在本实施方式的方法中,当使用市售的溶血用试剂时,可检测显示免疫刺激应答性的免疫细胞(显示IS形成能的免疫细胞)。
【实施例6:免疫细胞和与免疫细胞不同的物质的接触方法的探讨】
在至此的实施例中,使免疫刺激的免疫细胞和由全血的离心分离形成的红细胞层接触,探讨其他接触方法是否也可实施本实施方式的方法。作为分析对象的免疫细胞,使用实施例4的T细胞克隆。
【1.免疫细胞和与免疫细胞不同的物质的接触】
(1)由离心分离的接触
向从健康自愿者采集的全血(200μL)添加用Hoechst标记的T细胞克隆(5×10
(2)由旋转的接触
向从健康自愿者采集的全血(200μL)添加用Hoechst标记的T细胞克隆(5×10
(3)由静置的接触
向从健康自愿者采集的全血(200μL)添加用Hoechst标记的T细胞克隆(5×10
【2.测定】
接触面的提供后,向含T细胞克隆的全血添加含4%PFA的固定液,对免疫细胞的细胞膜进行固定化处理。接下来,添加与实施例1相同的溶血剂而进行溶血处理。其后,使用与实施例1相同的PE标记山羊抗小鼠IgG抗体、APC标记小鼠抗人CD3抗体及Hoechst而对细胞及细胞核进行染色。与实施例1同样地,将染色的细胞用IFC测定。
【2.数据解析】
与实施例1同样地进行在由IFC的测定中得到的数据的多重参数解析。算出CD28定位的T细胞克隆相对于全血或向板添加的T细胞克隆的比例(CD28定位阳性率)。结果示于图22。
【3.结果及考察】
如从图22得知,由离心分离、旋转及静置之任一者的接触方法,CD28定位阳性率也显示与未刺激的T细胞克隆相比显著地高的值。由于由旋转及静置,CD28定位阳性率也增加,提示与收容全血的管的内壁面的接触也贡献于对免疫细胞的免疫刺激。这表明,在本实施方式的方法中,由任何接触方法也可检测显示免疫刺激应答性的免疫细胞(显示IS形成能的免疫细胞)。
【实施例7:全血中的免疫细胞的免疫刺激应答性的测定】
通过向从受试者采集的全血(末梢血)添加具有免疫刺激因子的异体细胞(人B细胞),刺激全血中的免疫细胞(T细胞及NK细胞)而取得作为该免疫细胞的结构蛋白质的F肌动蛋白的定位相关信息。作为对照,对于未添加异体细胞的全血中的免疫细胞进行测定。
【1.测定】
(1)免疫刺激的免疫细胞的测定
将健康人自愿者血(200μL)分取到管,其中作为异体细胞,添加人B细胞(理化学研究所、制品编号HEV0032)。对得到的全血试样进行离心分离而形成血沉棕黄层。10分钟以上的反应后,用含4%PFA的固定液固定化处理试样中的免疫细胞的细胞膜。接下来,向固定化的细胞添加溶血剂,进行溶血处理。其后,使用Alexa488-小鼠抗人CD3抗体、PE-Cy7-小鼠抗人CD56抗体、及Alexa674-鬼笔环肽而对细胞进行染色。使用IFC(ImageStreamX MarkIIImaging Flow Cytometer:Amnis公司)测定染色的细胞。
(2)未免疫刺激的免疫细胞的测定
将健康人自愿者血(200μL)分取到管,由离心分离形成血沉棕黄层。2分钟以上的反应后,用含4%PFA的固定液固定化处理试样中的免疫细胞的细胞膜。接下来,向固定化的细胞添加溶血剂,进行溶血处理。其后,使用Alexa488-小鼠抗人CD3抗体、PE-Cy7-小鼠抗人CD56抗体、及Alexa674-鬼笔环肽而对细胞进行染色。使用IFC(ImageStreamX MarkIIImaging Flow Cytometer:Amnis公司)测定染色的细胞。
【2.数据解析】
进行在由IFC的测定中得到的含刺激的免疫细胞的全血的测定数据和含未刺激的免疫细胞的全血的测定数据的多重参数解析。简言之,基于用IFC取得的各细胞的透射光图像及荧光图像(CD3、CD56及F肌动蛋白)而进行图像解析,取得细胞的尺寸、细胞的长宽比、荧光信号面积值及总荧光信号强度。首先,基于各细胞的透射光图像的数据而制成在X轴取细胞尺寸,在Y轴取细胞的长宽比的2D散点图(未图示)。为了除去红细胞影等的碎片的测定数据,选择处于此2D散点图的指定的范围(细胞)内的点,以与选择的各点相对应的测定数据作为细胞的测定数据提取。
接下来,基于范围(细胞)内的测定数据而制成在X轴取从荧光图像(CD3)取得的总荧光信号强度,在Y轴取从荧光图像(CD56)取得的总荧光信号强度的2D散点图(参照图24)。在此2D散点图中,将CD3总荧光信号强度在指定的值以上,并且CD56总荧光信号强度处于指定的值以下的范围内的点定义为CD3阳性并且CD56阴性的免疫细胞(以下,该免疫细胞也称为“CD3
基于从CD3
同样地基于CD3-CD56
基于范围(T细胞)或范围(NK细胞)内的测定数据而制成的2D散点图的一例示于图24。图中,刺激(-)表示未免疫刺激的免疫细胞的分布,刺激(+)表示免疫刺激的免疫细胞的分布。图中,被长方形包围的区域是范围(F-肌动蛋白IS)。另外,图24中,与被椭圆包围的区域内的各点相对应的细胞的图像的一例示于图25。对处于范围(T细胞)内及范围(F-肌动蛋白IS01)内的点进行计数,由以下的式算出F肌动蛋白定位的T细胞相对于全血中的T细胞的比例(F-肌动蛋白定位阳性率)。同样地对处于范围(NK细胞)内及范围(F-肌动蛋白IS01)内的点进行计数,由以下的式算出F肌动蛋白定位的NK细胞相对于全血中的NK细胞的比例(F-肌动蛋白定位阳性率)。T细胞及NK细胞的F-肌动蛋白定位阳性率示于图26A及B。
[F-肌动蛋白定位阳性率(%)]={[范围(F-肌动蛋白IS)内的点数]/[范围(T细胞)内的点数]}×100
[F-肌动蛋白定位阳性率(%)]={[范围(F-肌动蛋白IS)内的点数]/[范围(NK细胞)内的点数]}×100
【3.结果及-考察】
在未给与含人B细胞株的免疫刺激因子的接触的T细胞及NK细胞中,F肌动蛋白分子均一地分布于细胞膜上。与此相比得知,在给所述免疫刺激时,F肌动蛋白分子在T细胞及NK细胞的膜上的一部分定位。被认为,显示此定位的部分显示形成的免疫突触(参照图25)。在2D散点图中,在Y轴显示反映细胞中的F肌动蛋白荧光信号的面积值的信息,在X轴显示反映细胞中的F肌动蛋白的总荧光信号值的信息(参照图24)。其中,由于显示定位面积小的值的细胞有形成IS的倾向,选通此区域而显示显示免疫刺激应答性的免疫细胞出现的区域。参照图24而得知,当对无刺激及有刺激的2D散点图进行比较时,在有刺激时,在选通区细胞显著地出现。图26A及B显示,在无刺激时,全血中的T细胞及NK细胞的IS阳性率显示非常地低的值。与无刺激时相比,在有刺激时,全血中的T细胞及NK细胞的IS阳性率的值显著地增加。
以上结果表明,可由使用本实施例的全血的方法检测显示免疫刺激应答性的免疫细胞(表示显示IS形成能的免疫细胞的免疫细胞),可基于检测结果而评价免疫细胞的免疫刺激应答性(IS形成能)。
【符号的说明】
1:细胞分析装置
2:测定装置
3:信息处理装置
300:本体
310:输入部
320:显示部。
- 免疫细胞的分析方法及细胞分析装置
- 一种基于单细胞的免疫细胞分型定量分析方法
