向细胞导入物质的装置
文献发布时间:2023-06-19 11:55:48
技术领域
本公开涉及在体外向细胞导入物质的装置。
背景技术
作为向细胞导入物质的代表性方法,除了电穿孔、脂质转染、基因枪(gene gun)等经典方法以外,还包括显微注射、等离子体注射、激光注射等方法。
作为最近开发的方法,已知有例如利用压力变化的方法(专利文献1)。具体而言,是重复进行对动物细胞加压的工序和随后进行的减压的工序,从而向动物细胞内导入物质的方法。
另外,包括如下方法:在细胞内导入物质存在于细胞附近的状态下,不使用电喷雾,而使不包含细胞内导入物质的给定等效球直径的液滴与细胞碰撞,从而向动物细胞内导入物质(专利文献2)。
这些方法均是有用的,但作为向细胞导入物质的技术,不断地要求能够以高效率在短时间内简便地进行的技术。
现有技术文献
专利文献
专利文献1:日本特开2011-67176号公报
专利文献2:日本特开2010-252644号公报
发明内容
发明要解决的课题
本公开的课题至少在于提供能够以高效率在短时间内简便地进行在体外向细胞导入物质的装置。
解决课题的方法
[1]一种在体外向细胞导入物质的装置,其具备容纳部和驱动部,所述容纳部容纳包含细胞和物质的溶液,所述驱动部用于对该溶液加压,
在该加压中,从加压开始至压力达到最大压力的时间为2.0毫秒以下。
[2]根据[1]所述的装置,其中,所述从加压开始至压力达到最大压力的时间为0.05毫秒以上。
[3]根据[1]或[2]所述的装置,其中,所述最大压力为0.10MPa以上。
[4]根据[1]~[3]中任一项所述的装置,其中,所述最大压力为0.35MPa以上。
[5]根据[1]~[4]中任一项所述的装置,其中,所述最大压力为35MPa以下。
[6]根据[1]~[5]中任一项所述的装置,其中,所述最大压力为33MPa以下。
[7]根据[1]~[6]中任一项所述的装置,其中,所述容纳部包含气体。
[8]根据[1]~[7]中任一项所述的装置,其中,所述物质是包含基因的DNA。
[9]一种在体外制备导入了物质的细胞的方法,该方法包括:
在容纳包含细胞和物质的溶液的容纳部中,对该溶液进行加压的工序,
在该加压中,从加压开始至压力达到最大压力的时间为2.0毫秒以下。
[10]根据[9]所述的方法,其中,所述从加压开始至压力达到最大压力的时间为0.05毫秒以上。
[11]根据[9]或[10]所述的方法,其中,所述最大压力为0.10MPa以上。
[12]根据[9]~[11]中任一项所述的方法,其中,所述最大压力为0.35MPa以上。
[13]根据[9]~[12]中任一项所述的方法,其中,所述最大压力为35MPa以下。
[14]根据[9]~[13]中任一项所述的方法,其中,所述最大压力为33MPa以下。
[15]根据[9]~[14]中任一项所述的方法,其中,所述容纳部包含气体。
[16]根据[9]~[15]中任一项所述的方法,其中,所述物质是包含基因的DNA。
发明的效果
本公开至少可以起到能够以高效率在短时间内简便地进行向细胞导入物质的效果。
附图说明
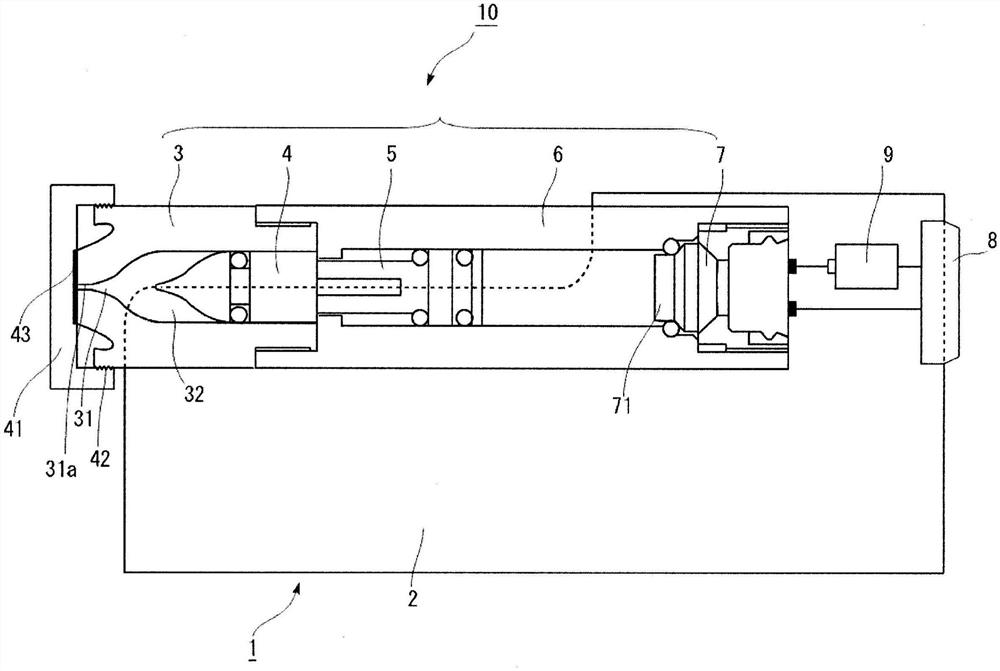
图1是示出一个实施方式的注入器的示意结构的图。
符号说明
1····注射器
2····外壳
3····针筒部
4····柱塞
5····活塞
6····注射器主体
7····驱动部
8····按钮
9····电池
10····注射器装配体
31····喷嘴部
31a····射出口
32····容纳部
41····盖
42····固定部
43····封闭部
71····点火器
具体实施方式
一个实施方式是在体外向细胞导入物质的装置,其具备容纳部和驱动部,所述容纳部容纳包含细胞和物质的溶液,所述驱动部用于对该溶液加压,在该加压中,从加压开始至压力达到最大压力的时间为2.0毫秒以下。以下,也将该装置记载为“本实施方式的装置”。
细胞中被导入物质的区域可以是其细胞质,也可以是细胞核,优选的一个方式是细胞核。这里,被导入物质的区域为细胞核的方式是指通过本实施方式的装置的工作而将物质直接导入细胞核的方式,而不是通过利用本实施方式的装置在物质导入细胞质后进行培养(例如,1天、2天的培养等)而使该物质从细胞质转移至细胞核的方式。
在本实施方式中,被导入物质的细胞没有特别限制,可以是原核细胞,也可以是真核细胞,一个优选的方式为真核细胞。另外,可以是动物细胞,也可以是植物细胞,一个优选的方式为动物细胞。另外,可以是粘附性细胞,也可以是悬浮性细胞。此外,可以是确立细胞株,也可以是原代培养细胞。
动物细胞的来源动物没有特别限制,可以举出例如经研究机构等处理的细胞的来源动物。可以列举例如:人、小鼠、大鼠、豚鼠、仓鼠(例如,中国仓鼠等)、果蝇、猴(例如,非洲绿猴等)等。
植物细胞的来源植物没有特别限制,可以列举例如:种子植物、蕨类植物、苔藓植物、藻类等。种子植物可以是被子植物,也可以是裸子植物,被子植物可以是单子叶植物,也可以是双子叶植物。
本实施方式中的物质没有特别限制,可以举出例如生物分子。作为生物分子,只要是在被导入细胞时在该细胞中发挥功能的分子即可,没有特别限制。另外,该生物分子可以是天然产物,也可以是人工合成的物质。可以列举例如:核酸或其衍生物;核苷、核苷酸、或它们的衍生物;氨基酸、肽、蛋白质、或它们的衍生物;脂质或其衍生物;糖类或其衍生物;金属离子;低分子化合物或其衍生物;抗生素;维生素或其衍生物等。只要是核酸即可,可以是DNA,也可以是RNA。DNA也可以是包含基因的DNA。在为包含基因的DNA的情况下,由于其导入目标是细胞的细胞质和/或细胞核,因此可以期待通过对导入了该基因的细胞进行培养等而使该基因表达。
对于物质而言,只要该物质稳定存在、且没有对被导入的细胞本身或细胞的功能造成破坏等不良影响,则既可以是游离的形式,也可以是固定于纳米粒子等载体的形式,可以经过了修饰,包含溶剂,其形式没有特别限定。
在物质为包含基因的DNA的情况下,可以是以表达盒、表达载体中包含该基因的形式设计的DNA。进一步,例如,可以在适合于被导入DNA的细胞种类的启动子的控制下配置基因。
即,例如,在物质为生物分子的情况下,在所有方式中均可以使用公知的基因工程的方法等进行准备。
作为分析向细胞导入的物质的比例的方法的例子,可以列举:使用发出荧光的分子本身作为本实施方式的物质、使用以荧光分子标记的物质并以荧光强度为指标进行分析的公知的方法。
在对于包含细胞和物质的溶液的加压中,从加压开始至压力达到最大压力的时间为2.0毫秒以下。
这里,上述压力是指容纳部内的压力。其测定方法没有特别限制,例如,在使用后述的实施例中记载的注入器进行测定的情况下,可以通过后述的“容纳部内压的测定方法”一栏中记载的方法进行测定。
对于从加压开始至压力达到最大压力的时间而言,一个优选的方式中为2.0毫秒以下,另一个优选的方式中为1.0毫秒以下,另一个优选的方式中为0.5毫秒以下。上述时间为上述范围内时,可期待能够有效地向细胞导入物质。另外,其下限没有特别限制,通常大于0,例如为0.05毫秒以上。
另外,对于上述最大压力而言,一个优选的方式中为0.10MPa以上,另一个优选的方式中为0.20MPa以上,另一个优选的方式中为0.35MPa以上。在为0.10MPa以上的情况下,向细胞导入物质时细胞发生变形,可期待有效地导入物质。
另外,一个优选的方式中为35MPa以下,另一个优选的方式中为34MPa以下,另一个优选的方式中为33MPa以下。在超过35MPa时,可能使细胞死亡,在为35MPa以下时,可期待在不使细胞死亡的情况下向细胞导入物质。
在本实施方式的一个优选的方式中,从增大向细胞导入物质的效率的观点考虑,本实施方式的装置的容纳部包含气体。作为上述气体,可以示例出空气。另外,可以示例出氮、氧、臭氧、二氧化碳、氢、一氧化碳,还可以示例出其中任意两种以上的混合气体。
另外,在一个优选的方式中,上述气体为不包含微生物等的气体。
上述空气可以是通常被使用的空气,其组成没有特别限定。可以举出例如:约8成的氮与约2成的氧的混合气体。
在本实施方式中,上述气体的体积相对于上述容纳部的容积的比例只要不妨害向细胞导入物质即可,没有特别限定,一个优选的方式中为10%以上,另一个优选的方式中为20%以上,另一个优选的方式中为30%以上,另一个优选的方式中为40%以上,另一个优选的方式中为50%以上,另一个优选的方式中为60%以上,另一个优选的方式中为70%以上,另一个优选的方式中为80%以上,另一个优选的方式中为90%以上。另一方面,上限例如为95%以下。
容纳包含细胞和物质的溶液的容纳部的结构、材料只要能够耐受加压即可,没有特别限制。在一个优选的方式中,容纳部进一步包含气体的情况也相同。
驱动部的结构、材料没有特别限制。加压例如可以利用压缩气体的压力被释放时所产生的压力,也可以利用由点火装置点火的火药的燃烧所产生的压力。另外,也可以是利用压电元件等的电能、弹簧等的机械能作为加压能量的压力,还可以是利用了通过将这些形式的能量适当组合而生成的加压能量的压力。
作为加压,在采用利用由点火装置点火的火药的燃烧所产生的压力的方式的情况下,作为火药,例如可以是包含锆和高氯酸钾的火药(ZPP)、包含氢化钛和高氯酸钾的火药(THPP)、包含钛和高氯酸钾的火药(TiPP)、包含铝和高氯酸钾的火药(APP)、包含铝和氧化铋的火药(ABO)、包含铝和氧化钼的火药(AMO)、包含铝和氧化铜的火药(ACO)、包含铝和氧化铁的火药(AFO)中的任一种火药、或者包含其中多种的组合的火药。作为这些火药的特征,其燃烧产物即使在高温状态下为气体,在常温下也不含气体成分,因此点火后燃烧产物立即凝结。
作为本实施方式的装置的例子,可举出注入器。以下,对其详细情况进行说明。
对于作为本实施方式的装置的例子的注入器而言,容纳部中并非从最初就容纳有包含细胞和物质的溶液,而是通过经由具有射出口的喷嘴将该溶液抽吸至容纳部内而容纳。这样,通过采用需要向容纳部进行填充操作的构成,可以容纳包含期望的细胞和期望的物质的溶液。因此,在该注入器中,针筒部是以可装卸的方式构成的。需要说明的是,在将气体容纳于容纳部内的情况下,可以通过在容纳了该溶液之后抽吸气体而容纳,也可以在先通过抽吸气体而容纳之后再容纳该溶液。另外,喷嘴前端的射出口被封闭、以使包含细胞和物质的溶液不被射出。封闭构件、封闭方法只要能够不使包含细胞和物质的溶液被射出即可,没有特别限制。在容纳部包含气体的方式中,以使包含细胞和物质的溶液、以及气体均不被射出的方式进行封闭。封闭构件、封闭方法只要能够不使包含细胞和物质的溶液被射出即可,没有特别限制。
以下,作为注入器的例子,参照附图对注射器1(无针注射器)进行说明。需要说明的是,各实施方式中的各构成及它们的组合等为一个例子,在不脱离本发明主旨的范围内可以适当进行构成的增加、省略、置换、以及其它变更。本发明并不受实施方式的限定,仅受权利要求的范围的限定。这对于后述的实施例也是同样的。需要说明的是,作为表示注射器1在长度方向上的相对位置关系的用语,使用“前端侧”及“基端侧”。该“前端侧”表示靠近后述的注射器1的前端、即靠近射出口31a的位置,该“基端侧”表示在注射器1的长度方向上与“前端侧”相反侧的方向、即驱动部7侧的方向。另外,本示例是利用由点火装置点火的火药的燃烧能对容纳包含细胞和物质的溶液的容纳部进行加压的示例,但本实施方式并不限定于此。
(注射器1的结构)
图1是示出注射器1的示意结构的图,也是注射器1的沿其长度方向的剖面图。注射器1是通过将注射器装配体10安装于外壳(注射器外壳)2而构成的,所述注射器装配体10是将由针筒部3和柱塞4构成的子装配体、以及由注射器主体6、活塞5及驱动部7构成的子装配体装配成一体而得到的。
如上所述,注射器装配体10以相对于外壳2可自由装卸的方式构成。注射器装配体10中包含的针筒部3与柱塞4之间形成的容纳部32中填充有包含细胞和物质的溶液,并且,该注射器装配体10是在每次进行向细胞导入物质时用完即抛弃的单元。另一方面,在外壳2侧包含电池9,所述电池9对注射器装配体10的驱动部7中包含的点火器71供给电力。来自电池9的电力供给如下地进行:通过由使用者进行按下设于外壳2的按钮8的操作,经由布线在外壳2侧的电极与注射器装配体10的驱动部7侧的电极之间进行来自电池9的电力供给。需要说明的是,以在将注射器装配体10安装于外壳2时外壳2侧的电极与注射器装配体10的驱动部7侧的电极会自动地接触的方式设计了两电极的形状及位置。另外,外壳2是只要电池9残留有能够向驱动部7供给的电力就可以重复使用的单元。需要说明的是,对于外壳2而言,在电池9没电的情况下,可以仅更换电池9而继续使用外壳2。另外,喷嘴31的前端的射出口31a通过封闭部43进行了封闭、以使包含细胞和物质的溶液不被射出。封闭部43固定于盖41。另外,盖41经由固定部42而固定于针筒部3。
本公开的其它实施方式是在体外制备导入了物质的细胞的方法,该方法包括:在容纳包含细胞和物质的溶液的容纳部中,对该溶液进行加压的工序,在该加压中,从加压开始至压力达到最大压力的时间为2.0毫秒以下。
其详细情况援引已经说明过的在体外向细胞导入物质的装置的说明。
实施例
以下记载了实施例,但所有实施例均不是被解释为限定性含义的实施例。
在以下的实施例中,首先,记载了气体的体积相对于容纳部的容积的比例为0的情况的实施例,然后,记载了容纳部包含气体的情况的实施例。
[容纳部内压的测量方法]
在以下的实施例中,使用图1中记载的注入器作为向细胞导入物质的装置,在该注入器的容纳部内进行了物质的导入。如下所述地进行了从加压开始至压力达到最大压力的时间和该最大压力的测定。
向容纳部填充蒸馏水100μl(气体的体积相对于容纳部的容积的比例为0),并安装于注入器。经由特氟龙(注册商标)树脂制作的夹具将容纳部的喷嘴前端与压电元件(Muller公司制、M60-1L-M3)连接。压电元件信号通过数字示波器(Tektronics公司制、TBS2102)获取。获取数字示波器的数据的时机由来自设备电源的触发信号进行控制。根据设备的初始启动时间和显示出最大峰值的时间,计算出从加压开始至压力达到最大压力的时间。另外,最大压力以数值的形式进行数字输出,因此采用其中最大的值。需要说明的是,通过该测定方法得到的压力与容纳部内的压力相同,可以以利用该测定方法得到的压力作为容纳部内的压力。
将结果示于表1。需要说明的是,所有测定均独立地进行了2~3次。在表1中,对于从加压开始至压力达到最大压力的时间,示出了其平均值,对于最大压力,示出了其最小值(※1)和最大值(※2)。
[表1]
[实施例1]向确立细胞株(粘附性细胞)的细胞核内导入质粒DNA
人胚肾细胞293(HEK293细胞)在试验前一天之前进行传代培养,详细而言,在37℃、二氧化碳5%下,用加入胎牛血清10%、青霉素-链霉素的杜氏改良Eagle培养基(DMEM)(NACALAI TESQUE公司)进行了传代培养。使用TrypLE Express(GIBCO)回收细胞,用杜氏改良Eagle培养基(DMEM)调整为5×10
向细胞悬浮液100μl中加入Cy3标记质粒DNA溶液(Mirus)1.25μg并充分混合,准备了包含HEK293细胞和Cy3标记质粒DNA的溶液。由注入器的喷嘴向该注入器的容纳部吸入该溶液100μl(气体的体积相对于容纳部的容积的比例为0)。这里,使用该注入器作为将Cy3标记质粒DNA导入细胞的装置,其为图1中记载的注入器。在本实施例中,该注入器被设定成ZPP为110mg的条件,在容纳部的喷嘴侧,通过紧固地安装盖而以使容纳部内处于密封状态的状态下进行了点火操作。由此,向HEK293细胞导入包含Cy3标记质粒DNA的溶液。在该条件下,在对于包含HEK293细胞和Cy3标记质粒DNA的溶液的加压中,从加压开始至压力达到最大压力的时间为0.135毫秒,该最大压力为(※1)29.30MPa、(※2)32.03MPa。
然后,将容纳部从注入器取下,通过将其内容物从喷嘴推入1.5ml的管内而进行回收。以1200×g离心分离3分钟,使细胞形成为粒料,使用含有DAPI的封片剂(Invitrogene)制备了载玻片。利用荧光显微镜(Keyence)进行观察,通过肉眼观察对经DAPI染色后的细胞的核的数量、以及DAPI和Cy3合并在一起的细胞的核的数量进行计数,计算出了Cy3的细胞核内导入率。
[实施例2、实施例3、实施例4]
除了如表2所示地变更了火药量以外,在与实施例1同样的条件下进行。将其结果与实施例1的结果一并示于表2。
根据该事实可以确认,使用注入器作为本实施方式的装置,可以向HEK293细胞(粘附性细胞)的细胞核内导入Cy3标记质粒DNA。另外,本领域技术人员据此可以理解,在使用了包含基因的DNA作为物质的情况下,通过对导入了该基因的细胞进行培养等,能够使该基因表达。
[表2]
[实施例5]向确立细胞株(粘附性细胞)的细胞内导入葡聚糖
通过与实施例1相同的方法对HEK293细胞进行传代培养,回收了细胞。用杜氏改良Eagle培养基(DMEM)调整为适当的细胞浓度(5~10×10
向细胞悬浮液30μl中加入用PBS溶解为20μg/μl的异硫氰酸荧光素-葡聚糖(FITC-葡聚糖)(4.5kDa)(SIGMA aldrich)5μl、即100μg的量,并充分混合,准备了包含HEK293细胞和FITC-葡聚糖的溶液。由注入器的喷嘴向该注入器的容纳部吸入该溶液30μl(气体的体积相对于容纳部的容积的比例为0)。这里,使用该注入器作为将FITC-葡聚糖导入细胞的装置,其与实施例1同样地为图1中记载的注入器。在本实施例中,该注入器被设定成ZPP为45mg的条件,在容纳部的喷嘴侧,通过紧固地安装盖而在使容纳部内处于密封状态的状态下进行了点火操作。由此,向HEK293细胞导入包含FITC-葡聚糖的溶液。在该条件下,在对于包含HEK293细胞和FITC-葡聚糖的溶液的加压中,从加压开始至压力达到最大压力的时间为0.091毫秒,该最大压力为(※1)9.380MPa、(※2)14.06MPa。
然后,将容纳部从注入器取下,通过将其内容物从喷嘴推入1.5ml的管内而进行回收。
然后,加入500μl的PBS,充分混合,以1200×g离心分离3分钟。将该操作进一步重复2次,进行了细胞的清洗。
在用PBS制备为0.2%的Triton X-100(NACALAI TESQUE公司)(w/v)(0.2%TritonX-100溶液)500μl中使粒料悬浮,用涡旋混合器(Scientific Industries)充分混合15秒钟。然后,在室温下静置10分钟,破坏了细胞膜。以22,400×g离心分离15分钟,分取上清150μl,加入MICRO WELL PLATE(AS ONE公司)的1个孔中。进一步分取150μl,加入另1个孔中。
如下所述地进行了荧光强度的测定。即,利用电晕多光栅酶标仪(HITACHI),使用吸收波长480nm、荧光波长520nm的滤光器测定了FITC的荧光。
需要说明的是,空白对照使用了0.2%Triton X-100溶液。
[比较例5]
除了未实施利用注入器的点火操作以外,与实施例5同样地进行。
比较例5的荧光强度(a.u.)为76,与此相对,实施例5的荧光强度(a.u.)为321.5。根据该事实可以确认,使用注入器作为本实施方式的装置,可以向确立细胞株(粘附性细胞)的细胞内导入FITC-葡聚糖。
[实施例6、实施例7]
除了如表3所示变更了火药量以外,在与实施例5同样的条件下进行。将其结果与实施例5的结果一并示于表3。
[实施例8]
除了下述以外,与实施例5同样地进行。即,用杜氏改良Eagle培养基(DMEM)将细胞浓度调整为10×10
[比较例6~8]
除了未实施利用注入器的点火操作以外,分别与实施例6~8同样地进行。
将其结果示于表3。根据该事实可以确认,使用注入器作为本实施方式的装置,可以向确立细胞株(粘附性细胞)的细胞内导入FITC-葡聚糖。
[表3]
[参考例5-1]向破坏了细胞膜的确立细胞株(粘附性细胞)的细胞内导入葡聚糖
通过与实施例1相同的方法对HEK293细胞进行传代培养,回收了细胞。用杜氏改良Eagle培养基(DMEM)调整为10×10
在本参考例中,与实施例5不同,在使用注入器的操作之前,使用Triton X-100在作为细胞内外的分隔壁的细胞膜上预先开孔,从而形成了即使在细胞内导入FITC-葡聚糖也不会停留在细胞内的状况。如果本参考例的荧光强度相对于实施例5中得到的荧光强度显著变小,则可从不同于实施例5及比较例5的结果的另外的方面表明这是由于物质导入使用了注入器的操作而引起的。
由注入器的喷嘴向该注入器的容纳部吸入细胞悬浮液30μl(气体的体积相对于容纳部的容积的比例为0)。该注入器与实施例1同样地为图1中记载的注入器。进一步吸入3μl的2%Triton X-100,并静置约5分钟后,加入用PBS溶解为20μg/μl的异硫氰酸荧光素-葡聚糖(FITC-葡聚糖)(4.5kDa)(SIGMA aldrich)5μl、即100μg的量,并充分混合。
在本实施例中,该注入器被设定成ZPP为75mg的条件,在容纳部的喷嘴侧,通过紧固地安装盖而在使容纳部内处于密封状态的状态下进行了点火操作。在该条件下,在对于包含HEK293细胞和FITC-葡聚糖的溶液的加压中,从加压开始至压力达到最大压力的时间为0.129毫秒,该最大压力为(※1)17.58MPa、(※2)19.53MPa。
然后,将容纳部从注入器取下,通过将其内容物从喷嘴推入1.5ml的管内而进行回收。
然后,与实施例5同样地清洗细胞,进行了荧光强度的测定。
[参考例5-2]
除了未实施利用注入器的点火操作以外,与参考例5-1同样地进行。
[参考例5-3]
这是未进行用Triton X-100破坏细胞膜的处理、而使用注入器进行了点火操作的试验例,是与实施例7实质上相同的试验例。
[参考例5-4]
这是未进行用Triton X-100破坏细胞膜的处理、而且也未使用注入器进行点火操作的试验例,是与比较例7实质上相同的试验例。
将结果示于表4。根据该事实可以确认,使用注入器作为本实施方式的装置,可以向确立细胞株(粘附性细胞)的细胞内导入FITC-葡聚糖。
另外,在参考例5-2和参考例5-4中确认了,无论有无Triton X-100处理,荧光强度均没有显著差异。另一方面,根据参考例5-1的结果可以确认,即使在进行点火操作的情况下,通过使用Triton X-100在作为细胞内外的分隔壁的细胞膜上预先开孔,也可以如参考例5-2、参考例5-4那样,使荧光强度相比于参考例5-3显著减小。
[表4]
[实施例9]向原代细胞(悬浮性细胞)的细胞内导入葡聚糖
通过常规方法从活体小鼠(BALB/c、8周龄、雌、CLEA Japan)中采集脾脏组织,用PBS清洗2次。接着,在10cm的盘(FALCON)中转移至PBS,使用完成了UV灭菌的镊子从组织中回收细胞。将细胞悬浮液的全部量转移至15ml锥形管(FALCON)并静置2分钟,将上清转移至另外的15ml锥形管(FALCON)。以1000×g离心分离5分钟,在10ml的PBS中使粒料再悬浮,进行了同样的离心分离。使粒料在1ml的PBS中再悬浮,测定细胞数,用PBS调整为适当的细胞浓度(10×10
然后,除了设定成ZPP为75mg的条件以外,通过与实施例5同样的方法进行。因此,在该条件下,在对于包含小鼠脾脏细胞和FITC-葡聚糖的溶液的加压中,从加压开始至压力达到最大压力的时间为0.129毫秒,该最大压力为(※1)17.58MPa、(※2)19.53MPa。
[比较例9]
除了未实施利用注入器的点火操作以外,与实施例9同样地进行。
其结果是,比较例9的荧光强度(a.u.)为67.5,与此相对,实施例9的荧光强度(a.u.)为317.5。
根据该事实可以确认,使用注入器作为本实施方式的装置,可以向原代细胞(悬浮性细胞)的细胞内导入FITC-葡聚糖。
以下,记载容纳部包含气体的情况的实施例。
[实施例10]向确立细胞株(粘附性细胞)的细胞内导入质粒DNA
与实施例1同样地回收HEK293细胞,制备了包含5.5×10
然后,将容纳部从注入器取下,通过将其内容物从喷嘴推入1.5ml的管内而进行回收。
然后,加入PBS(磷酸缓冲生理盐水、NACALAI TESQUE公司)500μl并充分混合,以1200×g离心分离3分钟。将该操作进一步重复2次,进行了细胞的清洗。
在200μl的PBS中使粒料再悬浮,通过移液将其充分混合。然后,通过细胞滤网/带盖圆管(FALCON)筛分单一细胞,在流式细胞仪BD FACS CantII(BD公司)中使用检测Cy3的荧光的过滤器来分离细胞,计算出Cy3标记质粒DNA的细胞内导入率。
[比较例10]
除了未实施利用注入器的点火操作以外,与实施例10同样地进行。
将结果示于表5。根据该事实可以确认,通过容纳部包含空气,而且随着空气的体积相对于容纳部的容积的比例增大,可以更高效地向HEK293细胞(粘接性确立细胞株)的细胞内导入Cy3标记质粒DNA。
[表5]
[实施例11]向确立细胞株(粘附性细胞)的细胞内导入葡聚糖
除了在细胞的悬浮中使用了包含100μg异硫氰酸荧光素-葡聚糖(FITC-葡聚糖)(4.5kDa)的DMEM以外,与实施例10同样地进行。另外,在流式细胞仪中使用检测FITC的荧光的过滤器来分离细胞,计算出了FITC-葡聚糖(4.5kDa)的细胞内导入率。
[比较例11]
除了未实施利用注入器的点火操作以外,与实施例11同样地进行。
[实施例12]
除了将火药量变更为45mg以外,在与实施例11同样的条件下进行。
[比较例12]
除了未实施利用注入器的点火操作以外,与实施例12同样地进行。与比较例11实质上为相同的试验例。
将结果示于表6。根据该事实可以确认,通过容纳部包含空气,而且随着空气的体积相对于容纳部的容积的比例增大,能够更高效地向HEK293细胞(粘接性确立细胞株)的细胞内导入FITC-葡聚糖。
[表6]
- 聚集装置及聚集方法、微小物体聚集结构体的制造装置、微生物的聚集除去装置、被检测物质的检测装置、被分离物质的分离装置以及被导入物质的导入装置
- 向具有细胞壁的细胞导入外来物质的方法
