用于纯化胰岛素类似物的色谱方法
文献发布时间:2023-06-19 11:55:48
技术领域
本发明总体上涉及蛋白质纯化方法的领域。特别地,提供用于纯化非糖基化胰岛素类似物的色谱方法。
背景技术
已在各种微生物表达系统中生产胰岛素、胰岛素类似物和/或衍生物的重组形式。诸如大肠杆菌、酿酒酵母(S.cerevisiae)的生物体已经用于重组人胰岛素及其衍生物的商业生产中。蛋白质或蛋白质前体可能源自酵母表达系统,已观察到高表达水平与糖基化蛋白质前体增加之间的相关性。因此,对更有效的将非糖基化蛋白质与糖基化蛋白质分离的方法的需求变得更加明显。由于这些系统的缺点,诸如表达水平低、下游纯化困难等,优先将甲基营养型酵母巴斯德毕赤酵母(Pichia pastoris)用作蛋白质表达系统。在美国专利第6,800,606号中,提及了巴斯德毕赤酵母表达系统的数个优势,例如高表达、低生产成本和高密度培养。
然而,巴斯德毕赤酵母表达系统的主要缺点之一是作为杂质而存在于最终产物中的重组蛋白翻译后修饰,这对纯化非常具有挑战性。尽管已知有许多的蛋白质翻译后修饰,但翻译后修饰的最常见形式是糖基化(Hart G.W,Glycosylation,Curr.Opin.Cell.Biol1992;4:1017)。取决于表达系统,糖基化可以是N-连接的或O-连接的(Gemmill T R等人,Overview of N-and O-linked oligosaccharide structures found in various yeastspecies,Biochemica et Biophysica Acta,1999;1426:227)。糖基化影响蛋白质构象的稳定性、免疫原性、清除率、对蛋白质水解的防止,并且改善蛋白质溶解度(Walsh G,Biopharmaceutical benchmarks 2006,Nature Biotechnology,2006;24:769)。
美国专利第6,180,757号涉及使用含钙(Ca
Biocon Limited的美国专利第8,802,816号涉及将产物与杂质分离和/或从杂质中纯化产物的方法,该方法得到纯度为96%的纯化的异源重组甘精胰岛素。
Biocon Limited的美国专利公开第20120178900号公开了用于纯化门冬胰岛素(insulin Aspart)、Atisoban、甘精胰岛素(insulin Glargine)和赖脯胰岛素(insulinLispro)的RP-HPLC方法。该方法包括将RP-HPLC和离子对试剂与有机改性剂组合使用。
发明目的
本发明的目的是提供一种获得基本上不含单糖基化变体、二糖基化变体或三糖基化变体的至少99.95%纯的非糖基化甘精胰岛素和非糖基化赖脯胰岛素的方法。这是通过使用两个反相HPLC步骤的组合来实现的,其中第一步在较低的pH下使用辛烷磺酸(OSA)作为优选的离子对试剂进行,并且第二步在高pH下使用高氯酸钠或四丁基硫酸氢铵(TBAB)作为优选的离子对试剂进行。第一步和第二步可以以相反的顺序进行,以实现去除至少99.95%的甘精胰岛素或赖脯胰岛素的糖基化变体。
发明内容
本发明涉及一种纯化非糖基化胰岛素类似物如甘精胰岛素和赖脯胰岛素的方法,该方法从包含甘精胰岛素和赖脯胰岛素的非糖基化、单糖基化和多糖基化变体的复杂混合物中通过实现去除至少99.95%的所述糖基化变体来纯化所述非糖基化胰岛素类似物。
纯化方法包括连续进行的反相高效液相色谱(RP-HPLC)两个步骤。在一种可能的方法中,在离子对试剂(优选辛烷磺酸(OSA))与有机改性剂(优选乙腈)组合存在的条件下,在酸性pH下,用所述复杂混合物进行第一步RP-HPLC,得到包含部分纯化的非糖基化胰岛素类似物的第一混合物,其中胰岛素类似物的糖基化变体的水平显著降低。在碱性pH下,第一混合物与离子对试剂和有机改性剂(优选乙腈)组合进行第二步RP-HPLC,得到至少99.95%纯的非糖基化胰岛素类似物。
在第二种可能的方法中,在碱性pH下,将所述复杂混合物与离子对试剂和有机改性剂(优选乙腈)结合进行第一步RP-HPLC,得到包含部分纯化的非糖基化胰岛素类似物的第一混合物,其中胰岛素类似物的糖基化变体的水平显著降低。在离子对试剂(优选辛烷磺酸(OSA))与有机改性剂(优选乙腈)组合存在的条件下,在酸性pH下,用第一混合物进行第二步RP-HPLC,得到至少99.95%纯的非糖基化胰岛素类似物。
胰岛素类似物可以是甘精胰岛素或赖脯胰岛素。当胰岛素类似物为甘精胰岛素时,在碱性pH条件下用于RP-HPLC的离子对试剂优选为高氯酸钠。当胰岛素类似物是赖脯胰岛素时,在碱性pH条件下用于RP-HPLC的离子对试剂优选为TBAB。
胰岛素类似物的糖基化形式的去除是通过基于低pH的RP-HPLC和基于高pH的RP-HPLC的组合来实现的。结果,去除了至少99.95%的甘精胰岛素和赖脯胰岛素的糖基化变体。
该概述不旨在确定所要求保护的主题的必要特征,也不旨在用于确定或限制所要求保护的主题的范围。
附图说明
以下附图构成本说明书的一部分,并且被包括以进一步阐明本公开的各方面。通过参考附图并结合本文呈现的具体实施方式的详细描述,可以更好地理解本公开。
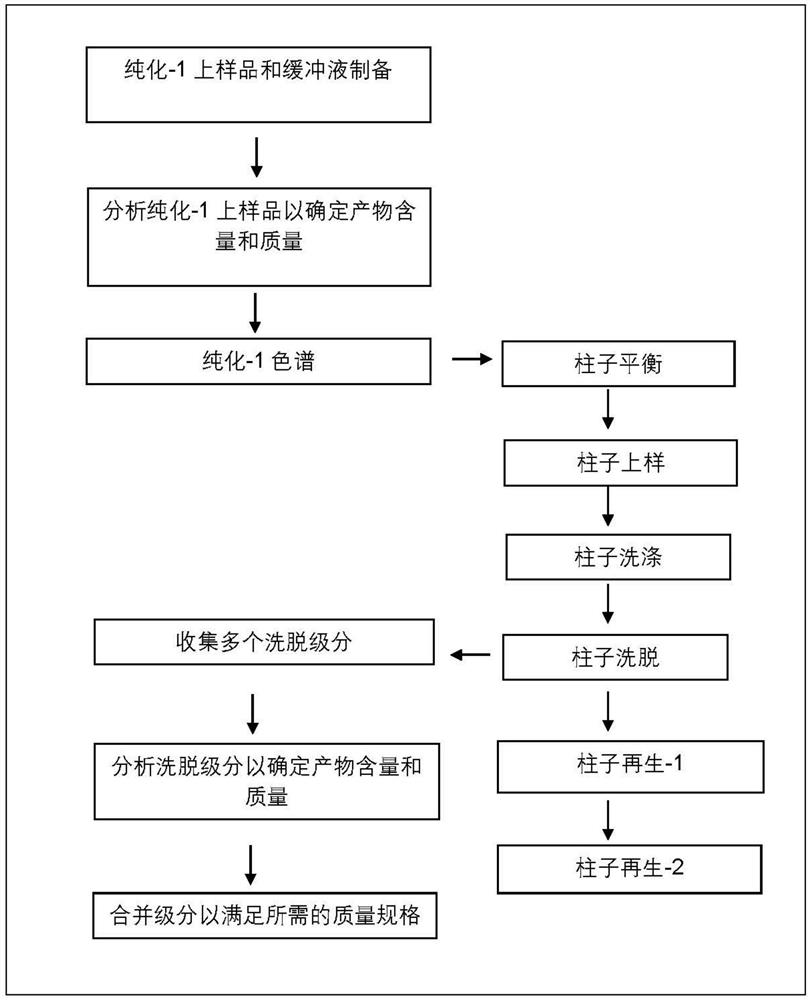
图1表示纯化步骤-1的方法流程图。
图2表示纯化步骤-2的方法流程图。
图3A表示用低pH色谱然后高pH色谱纯化甘精胰岛素的方法的反相纯化-1终末产物的UV和TIC色谱图。
图3B表示用低pH色谱然后高pH色谱纯化甘精胰岛素的方法的反相纯化-2终末产物的UV和TIC色谱图。
图4A、4B表示用低pH色谱然后高pH色谱纯化赖脯胰岛素的方法的反相纯化-1终末产物的质谱数据-UV和TIC色谱图。
图5是用低pH色谱然后高pH色谱纯化赖脯胰岛素的方法的反相纯化-2终末产物的UV和TIC色谱图。
图6A和6B表示用高pH色谱然后低pH色谱纯化甘精胰岛素的方法的反相纯化-1终末产物和反相纯化-2终末产物的质谱数据。
图7A、7B、7C是用高pH色谱然后低pH色谱纯化赖脯胰岛素的方法的反相纯化-1终末产物的UV和TIC色谱图。
图8A、8B、8C是用高pH色谱然后低pH色谱纯化赖脯胰岛素的方法的反相纯化-2终末产物的UV和TIC色谱图。
具体实施方式
本领域技术人员将意识到,可以对本文描述的发明进行除具体描述的之外的变化和修改。应当理解,本文描述的发明包括所有这样的变化和修改。本发明还包括在本说明书中单独地或共同地提及或指出的所有这些步骤、特征、组成和方法以及所述步骤或特征中的任意两个或更多个的任意和所有组合。
定义:
为了方便起见,在进一步描述本发明之前,在此收集了说明书中采用的某些术语和实例。本领域技术人员应当根据本公开的其余部分来阅读并理解这些定义。除非另有定义,否则本文中使用的所有技术和科学术语具有与本领域普通技术人员通常理解的相同含义。除非在特定情况下另有限制,整个说明书中使用的术语如下定义。
本公开不限于本文所述的具体实施方式的范围,本文中所述的具体实施方式仅旨在举例说明的目的。
如本文所述,功能等效的过程和方法显然在本公开的范围内。
术语“去糖基化的”特别是指通过纯化过程已从糖蛋白中去除糖实体(聚糖)的蛋白质。
术语“糖基化的”特别是指碳水化合物部分(如甘露糖、聚甘露糖和核糖)与蛋白质的A链或B链的氨基酸或A和B链两者中的氨基酸连接的蛋白质。术语“糖基化蛋白”包括单糖基化蛋白以及多糖基化蛋白。
术语“非糖基化的”特别是指糖部分(聚糖)不与蛋白质的任何链连接的蛋白质。
术语“甘精胰岛素”特别是指速效和长效人类胰岛素类似物,其与人胰岛素的不同之处在于,胰岛素A链第21位的氨基酸天冬酰胺被甘氨酸取代,并且在B链的C末端添加了两个精氨酸。
术语“赖脯胰岛素”特别是指速效人胰岛素类似物,其在化学上不同于人胰岛素。在赖脯胰岛素中,在B28位的氨基酸脯氨酸被赖氨酸取代,在B29位的赖氨酸被脯氨酸取代。
术语“RP-HPLC”特别是指反相高效液相色谱,其涉及基于疏水性的分子分离。
术语“下游纯化”是指从生产过程中产生的相关杂质和废物中回收和纯化生物合成药物产品。
本发明涉及通过去除至少99.95%多种形式的单糖基化和多糖基化胰岛素类似物来纯化非糖基化胰岛素类似物的方法。所述方法是通过被认为更好地理解最终产物中存在的杂质的性质而优化的下游纯化技术对产物进行的选择性纯化。
对非糖基化胰岛素类似物进行纯化的纯化方法是连续采用的两种色谱技术(称为纯化步骤-1和纯化步骤-2)的组合影响的结果。用于纯化非糖基化胰岛素类似物的两个色谱步骤均为柱色谱法,优选RP-HPLC或疏水相互作用色谱。使用上述色谱的优势是非糖基化胰岛素类似物的级分的纯度提高。纯化的终末产物基本上(至少99.95%)不含糖基化变体。优选地,在非糖基化胰岛素的纯化级分中,胰岛素类似物的糖基化形式的浓度小于0.05%;从而,将糖基化变体去除到低于定量(BLOQ)的水平。
本发明进一步涉及通过化学方法结合质谱技术例如电喷雾和用于鉴定的基质辅助激光解吸电离来鉴定胰岛素类似物的各种糖型,特别是甘精胰岛素和赖脯胰岛素。
在本发明中,在低pH下进行的纯化步骤使用辛烷磺酸作为优选的离子对试剂,优选在色谱的反相模式下使用辛烷磺酸(OSA)的钠盐。OSA是具有与磺酸基团(SO3-)连接的8个碳原子长的疏水链的阳离子对试剂。OSA在酸性pH下与蛋白质样品相互作用,并改变结合化学,从而提高了糖基化蛋白质和非糖基化蛋白质之间的分离度。
已证明本发明在从非糖基化胰岛素分离糖基化胰岛素方面特别有利。优选地,在纯化的非糖基化胰岛素的级分中糖基化胰岛素的浓度小于0.05%。
现在将通过工作实例来说明本公开,该工作实例旨在说明本公开的工作,而并非旨在限制性地暗示对本公开范围进行任何限制。
在本发明的实施方式中,提供了从包含非糖基化和糖基化胰岛素类似物的混合物中纯化非糖基化胰岛素类似物的方法。
在一种实施方式中,胰岛素类似物是甘精胰岛素。在另一种实施方式中,胰岛素类似物是赖脯胰岛素。
在一种实施方式中,糖基化胰岛素类似物可以是单糖基化的、二糖基化的、三糖基化的、多糖基化的及其混合物。
在一种实施方式中,本发明的纯化方法导致从包含非糖基化和糖基化胰岛素类似物的混合物中去除至少99.95%的胰岛素类似物的糖基化形式。在优选的实施方式中,去除百分数是99.96、99.97、99.98、99.99和100。
在一种实施方式中,本发明的纯化方法导致分离出糖基化甘精胰岛素≤0.05%的非糖基化甘精胰岛素。在优选的实施方式中,本发明的纯化方法导致分离出糖基化甘精胰岛素≤0.05%、0.04%、0.03%、0.02%、0.01%或0%的非糖基化甘精胰岛素。
在一种实施方式中,本发明的纯化方法导致分离出糖基化赖脯胰岛素≤0.05%的非糖基化赖脯胰岛素。在优选的方式中,本发明的纯化方法导致分离出糖基化赖脯胰岛素≤0.05%、0.04%、0.03%、0.02%、0.01%或0%的非糖基化赖脯胰岛素。
在一种实施方式中,提供了一种从包含非糖基化和糖基化甘精胰岛素的混合物中纯化非糖基化甘精胰岛素的方法,所述方法由第一步骤和第二步骤组成,其中,所述第一步骤包括在离子对试剂与乙腈(有机改性剂)存在的条件下,在酸性pH下,对包含糖基化和非糖基化甘精胰岛素的混合物进行RP-HPLC,得到包含部分纯化的非糖基化甘精胰岛素的第一混合物;其中,所述第二步骤包括在离子对试剂与乙腈(有机改性剂)存在的条件下,在碱性pH下,对来自第一步骤的第一混合物进行RP-HPLC,得到至少99.95%纯的非糖基化甘精胰岛素。在优选的实施方式中,第一步骤中的离子对试剂是辛烷磺酸,更优选是OSA的钠盐,而第二步骤中的离子对试剂是高氯酸钠。在一种实施方式中,第一步骤的pH范围为3.5-3.9,而第二步骤的pH范围为8.3-8.7。
在一种实施方式中,提供了一种从包含非糖基化和糖基化赖脯胰岛素的混合物中纯化非糖基化赖脯胰岛素的方法,所述方法由第一步骤和第二步骤组成,其中,所述第一步骤包括在离子对试剂与乙腈(有机改性剂)存在的条件下,在酸性pH下,对包含糖基化和非糖基化赖脯胰岛素的混合物进行RP-HPLC,得到包含部分纯化的非糖基化赖脯胰岛素的第一混合物;其中,所述第二步骤包括在离子对试剂与乙腈(有机改性剂)存在的条件下,在碱性pH下,对来自第一步骤的第一混合物进行RP-HPLC,得到至少99.95%纯的非糖基化赖脯胰岛素。在优选的实施方式中,第一步骤中的离子对试剂是辛烷磺酸,更优选是OSA的钠盐,而第二步骤中的离子对试剂是TBAB。在一种实施方式中,第一步骤的pH范围为3.5-3.9,而第二步骤的pH范围为8.3-8.7。
在一种实施方式中,提供了一种从包含非糖基化和糖基化甘精胰岛素的混合物中纯化非糖基化甘精胰岛素的方法,所述方法由第一步骤和第二步骤组成,其中,所述第一步骤包括在离子对试剂与乙腈(有机改性剂)存在的条件下,在碱性pH下,对包含糖基化和非糖基化甘精胰岛素的混合物进行RP-HPLC,得到包含部分纯化的非糖基化甘精胰岛素的第一混合物;其中,所述第二步骤包括在离子对试剂与乙腈(有机改性剂)存在的条件下,在酸性pH下,对来自第一步骤的第一混合物进行RP-HPLC,得到至少99.95%纯的非糖基化甘精胰岛素。在优选的实施方式中,第一步骤中的离子对试剂是高氯酸钠,而第二步骤中的离子对试剂是辛烷磺酸,优选辛烷磺酸的钠盐。在一种实施方式中,第一步骤的pH范围为8.3-8.7,而第二步骤的pH范围为3.5-3.9。
在一种实施方式中,提供了一种从包含非糖基化和糖基化赖脯胰岛素的混合物中纯化非糖基化赖脯胰岛素的方法,所述方法由第一步骤和第二步骤组成,其中,所述第一步骤包括在离子对试剂与乙腈(有机改性剂)存在的条件下,在碱性pH下,对包含糖基化和非糖基化赖脯胰岛素的混合物进行RP-HPLC,得到包含部分纯化的非糖基化赖脯胰岛素的第一混合物;其中,所述第二步骤包括在离子对试剂与乙腈(有机改性剂)存在的条件下,在酸性pH下,对来自第一步骤的第一混合物进行RP-HPLC,得到至少99.95%纯的非糖基化赖脯胰岛素。在优选的实施方式中,第一步骤中的离子对试剂是TBAB,第二步骤中的离子对试剂是辛烷磺酸,优选辛烷磺酸的钠盐。在一种实施方式中,第一步骤的pH范围为8.3-8.7,而第二步骤的pH范围为3.5-3.9。
在一种实施方式中,提供了至少99.95%不含甘精胰岛素的糖基化变体的非糖基化甘精胰岛素。在一种实施方式中,提供了至少99.96%不含甘精胰岛素的糖基化变体的非糖基化甘精胰岛素。在一种实施方式中,提供了至少99.97%不含甘精胰岛素的糖基化变体的非糖基化甘精胰岛素。在一种实施方式中,提供了至少99.98%不含甘精胰岛素的糖基化变体的非糖基化甘精胰岛素。在一种实施方式中,提供了至少99.99%不含甘精胰岛素的糖基化变体的非糖基化甘精胰岛素。在一种实施方式中,提供了100%不含甘精胰岛素的糖基化变体的非糖基化甘精胰岛素。
在一种实施方式中,提供了至少99.95%不含赖脯胰岛素的糖基化变体的非糖基化赖脯胰岛素。在一种实施方式中,提供了至少99.96%不含赖脯胰岛素的糖基化变体的非糖基化赖脯胰岛素。在一种实施方式中,提供了至少99.97%不含赖脯胰岛素的糖基化变体的非糖基化赖脯胰岛素。在一种实施方式中,提供了至少99.98%不含赖脯胰岛素的糖基化变体的非糖基化赖脯胰岛素。在一种实施方式中,提供了至少99.99%不含赖脯胰岛素的糖基化变体的非糖基化赖脯胰岛素。在一种实施方式中,提供了100%不含赖脯胰岛素的糖基化变体的非糖基化赖脯胰岛素。
实施例
甘精胰岛素的纯化,其中进行基于低pH的RP-HPLC然后进行基于高pH的RP-HPLC
低pH值下的纯化步骤-1如图1的流程图所示。纯化步骤-1的详细信息如下
固定相的详细信息:
a.介质:Kromasil
b.高度:25.0±1.0cm
c.线速度:所有色谱步骤≤360cm/h
流动相的详细信息:
a.流动相A:100mM乙酸钠+0.05%(w/v)辛烷磺酸(OSA),pH 3.7±0.1(使用冰乙酸调节pH)
b.流动相B:100.0%乙腈
c.纯化循环过程中流动相A和B的温度:20-30℃
上样准备:
a.将前一步中获得的上样浓缩物用纯水和乙酸的混合物以≥1.0:10.0的比例稀释。
b.稀释后,将样品通过1.2μm过滤器、0.45μm过滤器,然后通过0.22μm过滤器过滤。
c.用于1.2μm过滤的过滤器由聚丙烯(PP)制成,用于0.45/0.22μm过滤的过滤器由聚醚砜(PES)材料制成。
d.上样品中的产物浓度预期在1.0g/L至2.0g/L的范围内。
用于纯化的工艺条件:
a.以≤360cm/h的线速度,使用90.0%(A):10.0%(B)的流动相以4至5CV(柱体积)平衡柱子。
b.以≤360cm/h的线速度,以每升Kromasil 4-12g甘精胰岛素的量上样至柱子。
c.上样后,以≤360cm/h的线速度,使用85.0%(A):15.0%(B)的流动相以4至5CV(柱体积)洗涤柱子。
d.以≤360cm/h的线速度,使用24-31%B的线性梯度以超过25CV从柱子上洗脱出产物。
e.在洗脱过程中,根据280nm吸光度(UV)的增加进行可变体积级分收集。持续收集直到UV
f.根据洗脱级分的纯度水平,分析并合并洗脱级分,并将制备的洗脱池储存在2-8℃。
g.洗脱以去除残留的蛋白质(如果有)后,以≤360cm/h的线速度,使用50.0%的1M乙酸和50.0%的乙腈以向上流动方向通过2CV,然后使用30.0%的1M乙酸和70.0%的乙腈通过1V,使柱子再生。
不同的相对保留时间(RRT)的结果如表1中的列表数据所示。根据数据,糖基化蛋白质减少了约4.5倍,即从上样品的约2.6%减少至洗脱池(EP)中的约0.6%。
表1:低pH下纯化步骤-1的结果
注意:分析方法的LOQ(定量限)为0.04%,LOD(检测限)为0.02%,BLOD-低于检测限
将来自纯化步骤-1的洗脱池进行纯化步骤-2,从糖基化蛋白中进一步纯化非糖基化蛋白。
高pH下的纯化步骤-2如图2的流程图所示。纯化步骤-2的详细信息如下
固定相的详细信息:
a.介质:Kromasil
b.高度:25.0±1.0cm
c.线速度:所有色谱步骤≤360cm/h
流动相的详细信息:
a.流动相A:100mM Tris+50mM高氯酸钠,pH 8.5±0.1(使用冰乙酸调节pH)
b.流动相B:100.0%乙腈
c.纯化循环过程中流动相A和B的温度:20-30℃
上样准备:
a.将纯化步骤-1中获得的洗脱池(EP)用纯水以1.0:2.0的比例稀释。
b.使用2.5M Tris将稀释后的样品pH值调节至8.5±0.1。
c.调节pH值后,将样品通过1.2μm、0.45μm、然后通过0.22μm过滤。
d.用于1.2μm过滤的过滤器由聚丙烯(PP)制成,用于0.45/0.22μm过滤的过滤器由聚醚砜(PES)材料制成。
e.上样品中的产物浓度预期在1.0g/L至2.0g/L的范围内。
用于纯化的工艺条件:
a.以≤360cm/h的线速度,使用90.0%(A):10.0%(B)的流动相以4至5CV(柱体积)平衡柱子。
b.以≤360cm/h的线速度,以每升Kromasil 4-12g甘精胰岛素的量上样至柱子。
c.上样后,以≤360cm/h的线速度,使用80.0%(A):20.0%(B)的流动相以4至5CV(柱体积)洗涤柱子。
d.以≤360cm/h的线速度,使用25-29%B的线性梯度以超过25CV从柱子上洗脱出产物。
e.在洗脱过程中,根据280nm吸光度(UV)的增加进行可变体积级分收集。持续收集直到UV降至基线。从柱上洗脱蛋白质所需的体积为2.0-3.0CV。
f.收集级分后,使用冰乙酸将级分pH调节为4.0±0.1。预期乙酸消耗量为15.0%-25.0%(V/V)。
g.根据洗脱级分的纯度水平,分析并合并洗脱级分,并将制备的洗脱池储存在2-8℃下。
h.洗脱以去除残留的蛋白质(如果有)后,以≤360cm/h的线速度,使用50.0%纯水和50.0%乙腈以向上流动方向通过3CV,使柱子再生。
结果如表2中的列表数据所示。根据数据,糖基化蛋白质从上样品中的约0.5%降至洗脱池中的0.00%。
表2:高pH下纯化步骤-2的结果
注意:分析方法的LOQ为0.04%,LOD为0.02%
通过参考以下实施例可以获得更全面的理解,这些实施例仅出于说明的目的而提供,并不旨在限制本公开的范围。
实验1
将含有浓度为40mg/ml的人甘精胰岛素的酶反应终末产物调节至5%乙腈,0.5M乙酸,并用纯水稀释至1.31mg/ml,用作上样样品。预装的反相Kromasil 100-13-C8柱子(1*25cm)用于纯化甘精胰岛素。最初用90%的100mM乙酸钠+0.05%OSA缓冲液(pH 3.7±0.1)和10%乙腈以约5个柱体积平衡柱子。将样品以每升树脂约8.0g人甘精胰岛素的结合量上样到柱子上。用85%的100mM乙酸钠+0.05%OSA缓冲液(pH 3.7±0.1)和15%的乙腈以约4个柱体积洗涤松散结合的蛋白质。用25-32%乙腈梯度与100mM乙酸钠+0.05%OSA缓冲液(pH 3.7±0.1)洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用2个柱体积的50%1M乙酸和50%乙腈,然后1个柱体积的30%1M乙酸和70%乙腈,洗脱紧密结合的蛋白。整个单元操作以360cm/h的线性流速进行。使用YMC Co.Ltd制造的C18柱子通过分析方法来分析上样样品、洗脱级分和洗脱池。结果在下表3中列出。
表3实验1的结果
实验2
将含有浓度为40mg/ml的人甘精胰岛素的酶反应终末产物调节至5%乙腈,0.5M乙酸,并用纯水稀释至1.37mg/ml,用作上样样品。预装的反相Kromasil 100-13-C8柱子(1*25cm)用于纯化甘精胰岛素。最初用90%的100mM乙酸钠+0.05%OSA缓冲液(pH 3.7±0.1)和10%乙腈以约5个柱体积平衡柱子。将样品以每升树脂约8.0g人甘精胰岛素的结合量上样到柱子上。用85%的100mM乙酸钠+0.05%OSA缓冲液(pH 3.7±0.1)和15%的乙腈以约4个柱体积洗涤松散结合的蛋白质。用25-32%乙腈梯度与100mM乙酸钠+0.05%OSA缓冲液(pH 3.7±0.1)洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用2个柱体积的50%1M乙酸和50%乙腈,然后1个柱体积的30%1M乙酸和70%乙腈,洗脱紧密结合的蛋白。整个单元操作以360cm/h的线性流速进行。通过YMC C18方法分析上样样品、洗脱级分和洗脱池。结果在下表4中列出。
表4实验2的结果
实验3
将含有浓度为40mg/ml的人甘精胰岛素的酶反应终末产物调节至5%乙腈,0.5M乙酸,并用纯水稀释至1.42mg/ml,用作上样样品。预装的反相Kromasil 100-13-C8柱子(1*25cm)用于纯化甘精胰岛素。最初用90%的100mM乙酸钠+0.05%OSA缓冲液(pH 3.7±0.1)和10%乙腈以约5个柱体积平衡柱子。将样品以每升树脂约7.6g人甘精胰岛素的结合量上样到柱子上。用85%的100mM乙酸钠+0.05%OSA缓冲液(pH 3.7±0.1)和15%的乙腈以约4个柱体积洗涤松散结合的蛋白质。用25-32%乙腈梯度与100mM乙酸钠+0.05%OSA缓冲液(pH 3.7±0.1)洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用2个柱体积的50%1M乙酸和50%乙腈,然后1个柱体积的30%1M乙酸和70%乙腈,洗脱紧密结合的蛋白。整个单元操作以360cm/h的线性流速进行。使用YMC Co.Ltd制造的C18柱子通过分析方法来分析上样样品、洗脱级分和洗脱池。结果在下表5中列出。
表5实验3的结果
实验4
将含有浓度为18mg/ml的人甘精胰岛素的酶反应终末产物调节至5%乙腈,0.5M乙酸,并用纯水稀释至1.5mg/ml,用作上样样品。预装的反相Kromasil 100-13-C8柱子(1*25cm)用于纯化甘精胰岛素。最初用90%的100mM乙酸钠+0.05%OSA缓冲液(pH 3.7±0.1)和10%乙腈以约5个柱体积平衡柱子。将样品以每升树脂约10.0g人甘精胰岛素的结合量上样到柱子上。用85%的100mM乙酸钠+0.05%OSA缓冲液(pH 3.7±0.1)和15%的乙腈以约4个柱体积洗涤松散结合的蛋白质。用25-32%乙腈梯度与100mM乙酸钠+0.05%OSA缓冲液(pH 3.7±0.1)洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用2个柱体积的50%1M乙酸和50%乙腈,然后1个柱体积的30%1M乙酸和70%乙腈,洗脱紧密结合的蛋白。整个单元操作以360cm/h的线性流速进行。使用YMC Co.Ltd制造的C18柱子通过分析方法分析上样样品、洗脱级分和洗脱池。结果在下表6中列出。
表6实验4的结果
实验5
将含有浓度为18mg/ml的人甘精胰岛素的酶反应终末产物调节至5%乙腈,0.5M乙酸,并用纯水稀释至1.6mg/ml,用作上样样品。预装的反相Kromasil 100-13-C8柱子(2.1*25cm)用于纯化甘精胰岛素。最初用90%的100mM乙酸钠+0.05%OSA缓冲液(pH 3.7±0.1)和10%乙腈以约5个柱体积平衡柱子。将样品以每升树脂约10g人甘精胰岛素的结合量上样到柱子上。用85%的100mM乙酸钠+0.05%OSA缓冲液(pH 3.7±0.1)和15%的乙腈以约4个柱体积洗涤松散结合的蛋白质。用25-32%乙腈梯度与100mM乙酸钠+0.05%OSA缓冲液(pH3.7±0.1)洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用2个柱体积的50%1M乙酸和50%乙腈,然后1个柱体积的30%1M乙酸和70%乙腈,洗脱紧密结合的蛋白。整个单元操作以360cm/h的线性流速进行。使用YMC Co.Ltd制造的C18柱子通过分析方法来分析上样样品、洗脱级分和洗脱池。结果在下表7中列出。
表7实验5的结果
实验6
将含有浓度为32mg/ml的人甘精胰岛素的酶反应终末产物调节至5%乙腈,0.5M乙酸,并用纯水稀释至1.5mg/ml,用作上样样品。预装的反相Kromasil 100-13-C8柱子(2.1*25cm)用于纯化甘精胰岛素。最初用90%的100mM乙酸钠+0.05%OSA缓冲液(pH 3.7±0.1)和10%乙腈以约5个柱体积平衡柱子。将样品以每升树脂约10g人甘精胰岛素的结合量上样到柱子上。用85%的100mM乙酸钠+0.05%OSA缓冲液(pH 3.7±0.1)和15%的乙腈以约4个柱体积洗涤松散结合的蛋白质。用25-32%乙腈梯度与100mM乙酸钠+0.05%OSA缓冲液(pH3.7±0.1)洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用2个柱体积的50%1M乙酸和50%乙腈,然后1个柱体积的30%1M乙酸和70%乙腈,洗脱紧密结合的蛋白。整个单元操作以360cm/h的线性流速进行。使用YMC Co.Ltd制造的C18柱子通过分析方法来分析上样样品、洗脱级分和洗脱池。结果在下表8中列出。
表8实验6的结果
实验7
将含有浓度为16mg/ml的人甘精胰岛素的酶反应终末产物调节至5%乙腈,0.5M乙酸,并用纯水稀释至1.5mg/ml,用作上样样品。预装的反相Kromasil 100-13-C8柱子(2.1*25cm)用于纯化甘精胰岛素。最初用90%的100mM乙酸钠+0.05%OSA缓冲液(pH 3.7±0.1)和10%乙腈以约5个柱体积平衡柱子。将样品以每升树脂约10g人甘精胰岛素的结合量上样到柱子上。用85%的100mM乙酸钠+0.05%OSA缓冲液(pH 3.7±0.1)和15%的乙腈以约4个柱体积洗涤松散结合的蛋白质。用25-32%乙腈梯度与100mM乙酸钠+0.05%OSA缓冲液(pH3.7±0.1)洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用2个柱体积的50%1M乙酸和50%乙腈,然后1个柱体积的30%1M乙酸和70%乙腈,洗脱紧密结合的蛋白。整个单元操作以360cm/h的线性流速进行。使用YMC Co.Ltd制造的C18柱子通过分析方法来分析上样样品、洗脱级分和洗脱池。结果在下表9中列出。
表9实验7的结果
实验8
将含有浓度为36mg/ml的人甘精胰岛素的酶反应终末产物调节至5%乙腈,0.5M乙酸,并用纯水稀释至1.6mg/ml,用作上样样品。包装有Kromasil 100-13-C8树脂的Novosep不锈钢柱(5*25cm)用于纯化甘精胰岛素。最初用90%的100mM乙酸钠+0.05%OSA缓冲液(pH3.7±0.1)和10%乙腈以约5个柱体积平衡柱子。将样品以每升树脂约9g人甘精胰岛素的结合量上样到柱子上。用85%的100mM乙酸钠+0.05%OSA缓冲液(pH 3.7±0.1)和15%的乙腈以约4个柱体积洗涤松散结合的蛋白质。用25-32%乙腈梯度与100mM乙酸钠+0.05%OSA缓冲液(pH 3.7±0.1)洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用2个柱体积的50%1M乙酸和50%乙腈,然后1个柱体积的30%1M乙酸和70%乙腈,洗脱紧密结合的蛋白。整个单元操作以360cm/h的线性流速进行。使用YMC Co.Ltd制造的C18柱子通过分析方法来分析上样样品、洗脱级分和洗脱池。结果在下表10中列出。
表10实验8的结果
实验9
将含有浓度为32mg/ml的人甘精胰岛素的酶反应终末产物调节至5%乙腈,0.5M乙酸,并用纯水稀释至1.7mg/ml,用作上样样品。包装有Kromasil 100-13-C8树脂的Novosep不锈钢柱(5*25cm)用于纯化甘精胰岛素。最初用90%的100mM乙酸钠+0.05%OSA缓冲液(pH3.7±0.1)和10%乙腈以约5个柱体积平衡柱子。将样品以每升树脂约9g人甘精胰岛素的结合量上样到柱子上。用85%的100mM乙酸钠+0.05%OSA缓冲液(pH 3.7±0.1)和15%的乙腈以约4个柱体积洗涤松散结合的蛋白质。用25-32%乙腈梯度与100mM乙酸钠+0.05%OSA缓冲液(pH 3.7±0.1)洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用2个柱体积的50%1M乙酸和50%乙腈,然后1个柱体积的30%1M乙酸和70%乙腈,洗脱紧密结合的蛋白。整个单元操作以360cm/h的线性流速进行。使用YMC Co.Ltd制造的C18柱子通过分析方法来分析上样样品、洗脱级分和洗脱池。结果在下表11中列出。
表11实验9的结果
实验10
将含有浓度为32mg/ml的人甘精胰岛素的酶反应终末产物调节至5%乙腈,0.5M乙酸,并用纯水稀释至1.7mg/ml,用作上样样品。包装有Kromasil 100-13-C8树脂的Novosep不锈钢柱(5*25cm)用于纯化甘精胰岛素。最初用90%的100mM乙酸钠+0.05%OSA缓冲液(pH3.7±0.1)和10%乙腈以约5个柱体积平衡柱子。将样品以每升树脂约11g人甘精胰岛素的结合量上样到柱子上。用100mM乙酸钠+0.05%OSA缓冲液(pH 3.7±0.1)和15%的乙腈以约4个柱体积洗涤松散结合的蛋白质。用25-32%乙腈梯度与85%100mM乙酸钠+0.05%OSA缓冲液(pH 3.7±0.1)洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用2个柱体积的50%1M乙酸和50%乙腈,然后1个柱体积的30%1M乙酸和70%乙腈,洗脱紧密结合的蛋白。整个单元操作以360cm/h的线性流速进行。使用YMC Co.Ltd制造的C18柱子通过分析方法来分析上样样品、洗脱级分和洗脱池。结果在下表12中列出。
表12实验10的结果
下表13中详述了在低pH下反相纯化-1的实验数据汇总。
人甘精胰岛素的第一反相纯化步骤使用低pH缓冲液与离子对试剂辛烷磺酸(OSA)结合,将糖基化变体减少68-90%,从而将纯度从上样品中的约60%增加至洗脱池(EP)中的>97%。
表13在低pH下反相纯化-1的实验数据汇总
使用第二反相纯化步骤消除了之前的糖基化杂质,该第二反相纯化步骤采用高pH将甘精胰岛素的纯度增加至>99.5%。
实验11
将含有浓度为2.8mg/ml的人甘精胰岛素和约29%乙腈的反相纯化-1终末产物用2M Tris调节至pH8.5,并用纯水稀释,获得含10%乙腈的浓度为1.3mg/ml的最终甘精胰岛素,用作上样样品。预装的反相Kromasil 100-13-C8柱子(1*25cm)用于纯化甘精胰岛素。最初用90%的100mM Tris+50mM高氯酸钠缓冲液(pH 8.5±0.1)和10%乙腈以5个柱体积平衡柱子。将样品以每升树脂约6.5g人甘精胰岛素的结合量上样到柱子上。用80%的100mMTris+50mM高氯酸钠缓冲液(pH 8.5±0.1)和20%乙腈以约4个柱体积洗涤松散结合的蛋白质。用25-29%乙腈梯度与100mM Tris+50mM高氯酸钠缓冲液(pH 8.5±0.1)以超过25个柱体积洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用4个柱体积的50%纯水和50%乙腈,洗脱紧密结合的蛋白。整个单元操作以360cm/h的线性流速进行。使用YMC Co.Ltd制造的C18柱子通过分析方法来分析上样样品、洗脱级分和洗脱池。结果在下表14中列出。
表14实验11的结果
实验12
将含有浓度为2.8mg/ml的人甘精胰岛素和约29%乙腈的反相纯化-1终末产物用2M Tris调节至pH8.5,并用纯水稀释,获得含10%乙腈的浓度为1.3mg/ml的最终甘精胰岛素,用作上样样品。预装的反相Kromasil 100-13-C8柱子(1*25cm)用于纯化甘精胰岛素。最初用90%的100mM Tris+50mM高氯酸钠缓冲液(pH 8.5±0.1)和10%乙腈以5个柱体积平衡柱子。将样品以每升树脂约6.6g人甘精胰岛素的结合量上样到柱子上。用80%的100mMTris+50mM高氯酸钠缓冲液(pH 8.5±0.1)和20%乙腈以约4个柱体积洗涤松散结合的蛋白质。用25-29%乙腈梯度与100mM Tris+50mM高氯酸钠缓冲液(pH 8.5±0.1)以超过25个柱体积洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用4个柱体积的50%纯水和50%乙腈,洗脱紧密结合的蛋白。整个单元操作以360cm/h的线性流速进行。使用YMC Co.Ltd制造的C18柱子通过分析方法来分析上样样品、洗脱级分和洗脱池。结果在下表15中列出。
表15实验12的结果
实验13
将含有浓度为2.8mg/ml的人甘精胰岛素和约29%乙腈的反相纯化-1终末产物用2M Tris调节至pH8.5,并用纯水稀释,获得含10%乙腈的浓度为1mg/ml的最终甘精胰岛素,用作上样样品。预装的反相Kromasil 100-13-C8柱子(1*25cm)用于纯化甘精胰岛素。最初用90%的100mM Tris+50mM高氯酸钠缓冲液(pH 8.5±0.1)和10%乙腈以5个柱体积平衡柱子。将样品以每升树脂约9g人甘精胰岛素的结合量上样到柱子上。用80%的100mM Tris+50mM高氯酸钠缓冲液(pH 8.5±0.1)和20%乙腈以约4个柱体积洗涤松散结合的蛋白质。用25-29%乙腈梯度与100mM Tris+50mM高氯酸钠缓冲液(pH 8.5±0.1)以超过25个柱体积洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用4个柱体积的50%纯水和50%乙腈,洗脱紧密结合的蛋白。整个单元操作以360cm/h的线性流速进行。使用YMCCo.Ltd制造的C18柱子通过分析方法来分析上样样品、洗脱级分和洗脱池。结果在下表16中列出。
表16实验13的结果
实验14
将含有浓度为2.9mg/ml的人甘精胰岛素和约29%乙腈的反相纯化-1终末产物用2M Tris调节至pH8.5,并用纯水稀释,获得含10%乙腈的浓度为1mg/ml的最终甘精胰岛素,用作上样样品。预装的反相Kromasil 100-13-C8柱子(1*25cm)用于纯化甘精胰岛素。最初用90%的100mM Tris+50mM高氯酸钠缓冲液(pH 8.5±0.1)和10%乙腈以5个柱体积平衡柱子。将样品以每升树脂约9g人甘精胰岛素的结合量上样到柱子上。用80%的100mM Tris+50mM高氯酸钠缓冲液(pH 8.5±0.1)和20%乙腈以约4个柱体积洗涤松散结合的蛋白质。用25-29%乙腈梯度与100mM Tris+50mM高氯酸钠缓冲液(pH 8.5±0.1)以超过25个柱体积洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用4个柱体积的50%纯水和50%乙腈,洗脱紧密结合的蛋白。整个单元操作以360cm/h的线性流速进行。使用YMCCo.Ltd制造的C18柱子通过分析方法来分析上样样品、洗脱级分和洗脱池。结果在下表17中列出。
表17实验14的结果
实验15
将含有浓度为3.8mg/ml的人甘精胰岛素和约29%乙腈的反相纯化-1终末产物用2M Tris调节至pH8.5,并用纯水稀释,获得含10%乙腈的浓度为0.5mg/ml的最终甘精胰岛素,用作上样样品。预装的反相Kromasil 100-13-C8柱子(1*25cm)用于纯化甘精胰岛素。最初用90%的100mM Tris+50mM高氯酸钠缓冲液(pH 8.5±0.1)和10%乙腈以5个柱体积平衡柱子。将样品以每升树脂约7g人甘精胰岛素的结合量上样到柱子上。用80%的100mM Tris+50mM高氯酸钠缓冲液(pH 8.5±0.1)和20%乙腈以约4个柱体积洗涤松散结合的蛋白质。用25-29%乙腈梯度与100mM Tris+50mM高氯酸钠缓冲液(pH 8.5±0.1)以超过25个柱体积洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用4个柱体积的50%纯水和50%乙腈,洗脱紧密结合的蛋白。整个单元操作以360cm/h的线性流速进行。使用YMCCo.Ltd制造的C18柱子通过分析方法来分析上样样品、洗脱级分和洗脱池。结果在下表18中列出。
表18实验15的结果
实验16
将含有浓度为3.8mg/ml的人甘精胰岛素和约29%乙腈的反相纯化-1终末产物用2M Tris调节至pH8.5,并用纯水稀释,获得含10%乙腈的浓度为1.2mg/ml的最终甘精胰岛素,用作上样样品。预装的反相Kromasil 100-13-C8柱子(1*25cm)用于纯化甘精胰岛素。最初用90%的100mM Tris+50mM高氯酸钠缓冲液(pH 8.5±0.1)和10%乙腈以5个柱体积平衡柱子。将样品以每升树脂约6g人甘精胰岛素的结合量上样到柱子上。用80%的100mM Tris+50mM高氯酸钠缓冲液(pH 8.5±0.1)和20%乙腈以约4个柱体积洗涤松散结合的蛋白质。用25-29%乙腈梯度与100mM Tris+50mM高氯酸钠缓冲液(pH 8.5±0.1)以超过25个柱体积洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用4个柱体积的50%纯水和50%乙腈,洗脱紧密结合的蛋白。整个单元操作以360cm/h的线性流速进行。使用YMCCo.Ltd制造的C18柱子通过分析方法来分析上样样品、洗脱级分和洗脱池。结果在下表19中列出。
表19实验16的结果
实验17
将含有浓度为3.4mg/ml的人甘精胰岛素和约29%乙腈的反相纯化-1终末产物用2M Tris调节至pH8.5,并用纯水稀释,获得含10%乙腈的浓度为1.2mg/ml的最终甘精胰岛素,用作上样样品。预装的反相Kromasil 100-13-C8柱子(1*25cm)用于纯化甘精胰岛素。最初用90%的100mM Tris+50mM高氯酸钠缓冲液(pH 8.5±0.1)和10%乙腈以5个柱体积平衡柱子。将样品以每升树脂约4g人甘精胰岛素的结合量上样到柱子上。用80%的100mM Tris+50mM高氯酸钠缓冲液(pH 8.5±0.1)和20%乙腈以约4个柱体积洗涤松散结合的蛋白质。用25-29%乙腈梯度与100mM Tris+50mM高氯酸钠缓冲液(pH 8.5±0.1)以超过25个柱体积洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用4个柱体积的50%纯水和50%乙腈,洗脱紧密结合的蛋白。整个单元操作以360cm/h的线性流速进行。使用YMCCo.Ltd制造的C18柱子通过分析方法来分析上样样品、洗脱级分和洗脱池。结果在下表20中列出。
表20实验17的结果
实验18
将含有浓度为4.2mg/ml的人甘精胰岛素和约29%乙腈的反相纯化-1终末产物用2M Tris调节至pH8.5,并用纯水稀释,获得含10%乙腈的浓度为1.5mg/ml的最终甘精胰岛素,用作上样样品。预装的反相Kromasil 100-13-C8柱子(2.1*25cm)用于纯化甘精胰岛素。最初用90%的100mM Tris+50mM高氯酸钠缓冲液(pH 8.5±0.1)和10%乙腈以5个柱体积平衡柱子。将样品以每升树脂约6g人甘精胰岛素的结合量上样到柱子上。用80%的100mMTris+50mM高氯酸钠缓冲液(pH 8.5±0.1)和20%乙腈以约4个柱体积洗涤松散结合的蛋白质。用25-29%乙腈梯度与100mM Tris+50mM高氯酸钠缓冲液(pH 8.5±0.1)洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用4个柱体积的50%纯水和50%乙腈,洗脱紧密结合的蛋白。整个单元操作以360cm/h的线性流速进行。使用YMC Co.Ltd制造的C18柱子通过分析方法来分析上样样品、洗脱级分和洗脱池。结果在下表21中列出。
表21实验18的结果
实验19
将含有浓度为4.2mg/ml的人甘精胰岛素和29%乙腈的反相纯化-1终末产物用2MTris调节至pH 8.5,并用纯水稀释,获得含10%乙腈的浓度为1.5mg/ml的最终甘精胰岛素,用作上样样品。预装的反相Kromasil100-13-C8柱子(2.1*25cm)用于纯化甘精胰岛素。最初用90%的100mM Tris+50mM高氯酸钠缓冲液(pH8.5±0.1)和10%乙腈以5个柱体积平衡柱子。将样品以每升树脂约9g人甘精胰岛素的结合量上样到柱子上。用80%的100mM Tris+50mM高氯酸钠缓冲液(pH 8.5±0.1)和20%乙腈以约4个柱体积洗涤松散结合的蛋白质。用25-29%乙腈梯度与100mM Tris+50mM高氯酸钠缓冲液(pH 8.5±0.1)以超过25个柱体积洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用4个柱体积的50%纯水和50%乙腈,洗脱紧密结合的蛋白。整个单元操作以360cm/h的线性流速进行。使用YMCCo.Ltd制造的C18柱子通过分析方法来分析上样样品、洗脱级分和洗脱池。结果在下表22中列出。
表22实验19的结果
实验20
将含有浓度为4.5mg/ml的人甘精胰岛素和29%乙腈的反相纯化-1终末产物用2MTris调节至pH 8.5,并用纯水稀释,获得含10%乙腈的浓度为1.8mg/ml的最终甘精胰岛素,用作上样样品。预装的反相Kromasil100-13-C8柱子(2.1*25cm)用于纯化甘精胰岛素。最初用90%的100mM Tris+50mM高氯酸钠缓冲液(pH8.5±0.1)和10%乙腈以5个柱体积平衡柱子。将样品以每升树脂约8g人甘精胰岛素的结合量上样到柱子上。用80%的100mM Tris+50mM高氯酸钠缓冲液(pH 8.5±0.1)和20%乙腈以约4个柱体积洗涤松散结合的蛋白质。用25-29%乙腈梯度与100mM Tris+50mM高氯酸钠缓冲液(pH 8.5±0.1)以超过25个柱体积洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用4个柱体积的50%纯水和50%乙腈,洗脱紧密结合的蛋白。整个单元操作以360cm/h的线性流速进行。使用YMCCo.Ltd制造的C18柱子通过分析方法来分析上样样品、洗脱级分和洗脱池。结果在下表23中列出。
表23实验20的结果
下表24中详述了在高pH下反相纯化-2的实验数据汇总。
甘精胰岛素的第二反相纯化步骤使用高pH缓冲液与离子对试剂高氯酸钠结合,将之前的糖基化变体减少至低于检测水平,从而将纯度从上样品中的>96%增加至洗脱池中的>99.5%。
表24在高pH下反相纯化-2的实验数据汇总
注意:分析方法的LOQ为0.04%,LOD为0.02%
下表25和26中分别详述了反相纯化步骤1和2的终末产物的质量特征和基于质量的可能ID(Probable mass based ID)。反相纯化-1终末产物和反相纯化-2终末产物的质谱数据UV和TIC色谱图分别如图3A和图3B所示。
表25反相纯化步骤-1终末产物的糖型的质量特征和基于质量的可能ID。
表26反相纯化步骤-2终末产物的质量特征和基于质量的可能ID。
赖脯胰岛素的纯化,其中进行基于低pH的RP-HPLC然后进行基于高pH的RP-HPLC
低pH值下的纯化步骤-1如图1的流程图所示。纯化步骤-1的详细信息如下
固定相的详细信息:
d.介质:Daisopak
e.高度:25.0±1.0cm
f.线速度:所有色谱步骤≤360cm/h
流动相的详细信息:
d.流动相A:400mM柠檬酸三钠-柠檬酸缓冲液+0.1%(w/v)辛烷磺酸(OSA)+50mMGuCl(氯化胍),pH 3.85±0.1。
e.流动相B:100.0%乙腈
f.纯化循环过程中流动相A和B的温度:25-30℃
上样准备:
e.将前一步中获得的上样浓缩物用纯水和乙酸的混合物以≥1.0:10.0的比例稀释。
f.稀释后,将样品通过1.2μm过滤器、0.45μm过滤器,然后通过0.22μm过滤器过滤。
g.用于1.2μm过滤的过滤器由聚丙烯(PP)制成,用于0.45/0.22μm过滤的过滤器由聚醚砜(PES)材料制成。
h.上样品中的产物浓度在1.0g/L至2.0g/L的范围内。
用于纯化的工艺条件:
h.以≤360cm/h的线速度,使用90.0%(A):10.0%(B)的流动相以5至10CV(柱体积)平衡柱子。
i.以≤360cm/h的线速度,以每升树脂5-7.5g赖脯胰岛素的容量上样至柱子。
j.上样后,以≤360cm/h的线速度,使用78.0%(A):22.0%(B)的流动相以4至5CV(柱体积)洗涤柱子。
k.以≤220cm/h的线速度,使用24-28%B的线性梯度以超过20CV从柱子上洗脱出产物。
l.在洗脱过程中,根据280nm吸光度(UV)的增加进行可变体积级分收集。持续收集直到UV
m.根据洗脱级分的纯度水平,分析并合并洗脱级分,并将制备的洗脱池储存在2-8℃。
n.洗脱以去除残留的蛋白质(如果有)后,以≤360cm/h的线速度,使用50.0%1M乙酸和50.0%乙腈以向上流动方向通过2CV,然后使用30.0%1M乙酸和70.0%乙腈通过1V,使柱子再生。
结果如表27中的列表数据所示。根据数据,糖基化蛋白质减少了约3倍,即从上样品的约4%减少至洗脱池(EP)中的约1.0%。
表27:低pH下纯化步骤-1的结果
注意:分析方法的LOQ为0.05%,LOD为0.03%
将来自纯化步骤-1的洗脱池进行纯化步骤-2,从糖基化蛋白中进一步纯化非糖基化蛋白。
高pH下的纯化步骤-2如图2的流程图所示。纯化步骤-2的详细信息如下
固定相的详细信息:
a.介质:Phenomenex
b.高度:25.0±1.0cm
c.线速度:所有色谱步骤≤360cm/h
流动相的详细信息:
a.流动相A:100mM Tris+50mM咪唑+0.2%(w/v)四丁基硫酸氢铵(TBAB),pH 7.5±0.1(使用冰乙酸调节pH)
b.流动相B:100.0%乙腈
c.纯化循环过程中流动相A和B的温度:26-30℃
上样准备:
a.将纯化步骤-1中获得的洗脱池(EP)用纯水以1.0:2.0的比例稀释。
b.使用2.0M Tris将稀释后的样品pH值调节至7.5±0.1。
c.调节pH值后,将样品通过1.2μm、0.45μm、然后通过0.22μm过滤。
d.用于1.2μm过滤的过滤器由聚丙烯(PP)制成,用于0.45/0.22μm过滤的过滤器由聚醚砜(PES)材料制成。
e.上样品中的产物浓度预期在1.0g/L至2.0g/L的范围内。
用于纯化的工艺条件:
a.以≤360cm/h的线速度,使用90.0%(A):10.0%(B)的流动相以5至10CV(柱体积)平衡柱子。
b.以≤360cm/h的线速度,以每升树脂5-8.5g赖脯胰岛素的容量上样至柱子。
c.上样后,以≤360cm/h的线速度,使用80.0%(A):20.0%(B)的流动相以4至5CV(柱体积)洗涤柱子。
d.以≤360cm/h的线速度,使用25-29%B的线性梯度以超过13CV从柱子上洗脱出产物。
e.在洗脱过程中,根据280nm吸光度(UV)的增加进行可变体积级分收集。持续收集直到UV降至基线。从柱上洗脱蛋白质所需的体积为2.0-3.0CV。
f.根据洗脱级分的纯度水平,分析并合并洗脱级分,并将制备的洗脱池储存在2-8℃。
g.洗脱以去除残留的蛋白质(如果有)后,以≤360cm/h的线速度,使用50.0%纯水和50.0%乙腈以向上流动方向通过3CV,然后使用30%3M乙酸和70.0%乙腈,使柱子再生。
结果如表28中的列表数据所示。根据数据,糖基化蛋白质从上样品中的约0.5%降至洗脱池中的BLOQ。
表28:高pH下纯化步骤-2的结果
注意:分析方法的LOQ为0.05%,LOD为0.03%;BLOQ:低于定量水平
通过参考以下实施例可以获得更全面的理解,这些实施例仅出于说明的目的而提供,并不旨在限制本公开的范围。
实验21
将含有浓度为12.7mg/ml的人赖脯胰岛素的酶反应终末产物用冰乙酸然后用10%乙腈调节至pH<3.5,并用纯水稀释至1.16mg/ml,用作上样样品。预装的反相Daisopak 200-10-C18柱子(1*25cm)用于纯化赖脯胰岛素。最初用90%的400mM柠檬酸三钠-柠檬酸缓冲液+0.1%(w/v)OSA+50mM GuCl缓冲液(pH3.85±0.1)和10%乙腈以约10个柱体积平衡柱子。将样品以每升树脂约5.6g人赖脯胰岛素的结合量上样到柱子上。用78%的400mM柠檬酸三钠-柠檬酸缓冲液+0.1%(w/v)OSA+50mM GuCl缓冲液(pH 3.85±0.1)和22%乙腈以约4个柱体积洗涤松散结合的蛋白质。以220cm/h的流速,用24-28%乙腈梯度与400mM柠檬酸三钠-柠檬酸缓冲液+0.1%(w/v)OSA+50mM GuCl缓冲液(pH 3.85±0.1)以超过20个柱体积洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用4个柱体积的70%3M乙酸和30%乙腈洗脱紧密结合的蛋白。除了洗脱相以外,整个单元操作以360cm/h的线性流速进行。使用Waters.Ltd制造的C18柱子通过分析方法来分析上样样品、洗脱级分和洗脱池。结果在下表29中列出。
表29实验19的结果
实验22
将含有浓度为12.7mg/ml的人赖脯胰岛素的酶反应终末产物用冰乙酸然后用10%乙腈调节至pH<3.5,并用纯水稀释至1.16mg/ml,用作上样样品。预装的反相Daisopak 200-10-C18柱子(1*25cm)用于纯化赖脯胰岛素。最初用90%的400mM柠檬酸三钠-柠檬酸缓冲液+0.1%(w/v)OSA+50mM GuCl缓冲液(pH3.85±0.1)和10%乙腈以约10个柱体积平衡柱子。将样品以每升树脂约7.4g人赖脯胰岛素的结合量上样到柱子上。用78%的400mM柠檬酸三钠-柠檬酸缓冲液+0.1%(w/v)OSA+50mM GuCl缓冲液(pH 3.85±0.1)和22%乙腈以约4个柱体积洗涤松散结合的蛋白质。以220cm/h的流速,用24-28%乙腈梯度与400mM柠檬酸三钠-柠檬酸缓冲液+0.1%(w/v)OSA+50mM GuCl缓冲液(pH 3.85±0.1)以超过20个柱体积洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用4个柱体积的70%3M乙酸和30%乙腈洗脱紧密结合的蛋白。除了洗脱相以外,整个单元操作以360cm/h的线性流速进行。使用Waters.Ltd制造的C18柱子通过分析方法来分析上样样品、洗脱级分和洗脱池。结果在下表30中列出。
表30实验22的结果
实验23
将含有浓度为10.8mg/ml的人赖脯胰岛素的酶反应终末产物用冰乙酸然后用10%乙腈调节至pH<3.5,并用纯水稀释至1.42mg/ml,用作上样样品。预装的反相Daisopak 200-10-C18柱子(1*25cm)用于纯化赖脯胰岛素。最初用90%的400mM柠檬酸三钠-柠檬酸缓冲液+0.1%(w/v)OSA+50mM GuCl缓冲液(pH3.85±0.1)和10%乙腈以约10个柱体积平衡柱子。将样品以每升树脂约6.7g人赖脯胰岛素的结合量上样到柱子上。用78%的400mM柠檬酸三钠-柠檬酸缓冲液+0.1%(w/v)OSA+50mM GuCl缓冲液(pH 3.85±0.1)和22%乙腈以约4个柱体积洗涤松散结合的蛋白质。以220cm/h的流速,用24-28%乙腈梯度与400mM柠檬酸三钠-柠檬酸缓冲液+0.1%(w/v)OSA+50mM GuCl缓冲液(pH 3.85±0.1)以超过20个柱体积洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用4个柱体积的70%3M乙酸和30%乙腈洗脱紧密结合的蛋白。除了洗脱相以外,整个单元操作以360cm/h的线性流速进行。使用Waters.Ltd制造的C18柱子通过分析方法来分析上样样品、洗脱级分和洗脱池。结果在下表31中列出。
表31实验23的结果
实验24
将含有浓度为10.8mg/ml的人赖脯胰岛素的酶反应终末产物用冰乙酸然后用10%乙腈调节至pH<3.5,并用纯水稀释至1.06mg/ml,用作上样样品。预装的反相Daisopak 200-10-C18柱子(1*25cm)用于纯化赖脯胰岛素。最初用90%的400mM柠檬酸三钠-柠檬酸缓冲液+0.1%(w/v)OSA+50mM GuCl缓冲液(pH3.85±0.1)和10%乙腈以约8个柱体积平衡柱子。将样品以每升树脂约6.7g人赖脯胰岛素的结合量上样到柱子上。用78%的400mM柠檬酸三钠-柠檬酸缓冲液+0.1%(w/v)OSA+50mM GuCl缓冲液(pH 3.85±0.1)和22%乙腈以约4个柱体积洗涤松散结合的蛋白质。以220cm/h的流速,用24-28%乙腈梯度与400mM柠檬酸三钠-柠檬酸缓冲液+0.1%(w/v)OSA+50mM GuCl缓冲液(pH 3.85±0.1)以超过20个柱体积洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用4个柱体积的70%3M乙酸和30%乙腈洗脱紧密结合的蛋白。除了洗脱相以外,整个单元操作以360cm/h的线性流速进行。使用Waters.Ltd制造的C18柱子通过分析方法来分析上样样品、洗脱级分和洗脱池。结果在下表32中列出。
表32实验24的结果
下表33中详述了在低pH下反相纯化-1的实验数据汇总。
表33在低pH下反相纯化-1的实验数据汇总
人赖脯胰岛素的反相纯化步骤-1使用低pH缓冲液与离子对试剂辛烷磺酸(OSA)结合,将糖基化变体减少70-95%,从而将纯度从上样品中的约58%增加至洗脱池中的>83%。
实验25
将含有浓度为2.4mg/ml的人赖脯胰岛素和约26.4%乙腈的反相纯化-1终末产物用2M Tris调节至pH7.5,并用纯水稀释,获得含10%乙腈的浓度为0.82mg/ml的最终赖脯胰岛素,用作上样样品。预装的反相Phenomenex 100-10-C8柱子(1*25cm)用于纯化赖脯胰岛素。最初用90%的100mM Tris+200mM咪唑+0.2%(w/v)TBAB缓冲液(pH 7.5±0.1)和10%乙腈以10个柱体积平衡柱子。将样品以每升树脂约8g人赖脯胰岛素的结合量上样到柱子上。用80%的100mM Tris+200mM咪唑+0.2%(w/v)TBAB缓冲液(pH7.5±0.1)和20%乙腈以约4个柱体积洗涤松散结合的蛋白质。用24-29%乙腈梯度与100mM Tris+200mM咪唑+0.2%(w/v)TBAB缓冲液(pH 7.5±0.1)以超过13个柱体积洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用2个柱体积的50%的100mM Tris+200mM咪唑+0.2%(w/v)TBAB缓冲液(pH 7.5±0.1)和50%乙腈,然后2个柱体积的30%3M乙酸和70%乙腈,洗脱紧密结合的蛋白。整个单元操作以360cm/h的线性流速进行。使用Waters.Ltd制造的C18柱子通过分析方法来分析上样样品、洗脱级分和洗脱池。结果在下表34中列出。
表34实验25的结果
实验26
将含有浓度为1.3mg/ml的人赖脯胰岛素和约26.4%乙腈的反相纯化-1终末产物用2M Tris调节至pH7.5,并用纯水稀释,获得含10%乙腈的浓度为0.5mg/ml的最终赖脯胰岛素,用作上样样品。预装的反相Phenomenex 100-10-C8柱子(1*25cm)用于纯化赖脯胰岛素。最初用90%的100mM Tris+200mM咪唑+0.2%(w/v)TBAB缓冲液(pH 7.5±0.1)和10%乙腈以5个柱体积平衡柱子。将样品以每升树脂约5.6g人赖脯胰岛素的结合量上样到柱子上。用80%的100mM Tris+200mM咪唑+0.2%(w/v)TBAB缓冲液(pH7.5±0.1)和20%乙腈以约4个柱体积洗涤松散结合的蛋白质。用24-29%乙腈梯度与100mM Tris+200mM咪唑+0.2%(w/v)TBAB缓冲液(pH 7.5±0.1)以超过13个柱体积洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用2个柱体积的50%的100mM Tris+200mM咪唑+0.2%(w/v)TBAB缓冲液(pH 7.5±0.1)和50%乙腈,然后2个柱体积的30%3M乙酸和70%乙腈,洗脱紧密结合的蛋白。整个单元操作以360cm/h的线性流速进行。使用Waters.Ltd制造的C18柱子通过分析方法来分析上样样品、洗脱级分和洗脱池。结果在下表35中列出。
表35实验26的结果
下表36中详述了在高pH下反相纯化-2(实验25-26)的实验数据汇总。
表36在高pH下反相纯化-2的实验数据汇总
注意:分析方法的LOQ为0.04%,LOD为0.02%
赖脯胰岛素的第二反相纯化步骤-2使用高pH缓冲液与离子对试剂四丁基硫酸氢铵结合,将之前的糖基化变体减少至低于检测水平,从而将纯度从上样品中的>84%增加至洗脱池中的>95%。
下表37(实验21)和38(实验22)中详述了反相纯化步骤-1的终末产物的质量特征和基于质量的可能ID,其中下表39(实验25)和40(实验26)中详述了反相纯化步骤-2的终末产物的质量特征和基于质量的可能ID。反相纯化-1终末产物的质谱数据UV和TIC色谱图分别如图4A(实验21)和图4B(实验22)所示,反相纯化-2终末产物的质谱数据UV和TIC色谱图分别如图5A(实验25)和图5B(实验26)所示。
表37反相纯化步骤-1终末产物(实验21,图4A所示)的糖型的质量特征和基于质量的可能ID。
表38反相纯化步骤-1终末产物(实验22,图4B所示)的糖型的质量特征和基于质量的可能ID。
表39反相纯化步骤-2终末产物(实验25,图5所示)的糖型的质量特征和基于质量的可能ID。
表40反相纯化步骤-2终末产物(实验26)的糖型的质量特征和基于质量的可能ID。
甘精胰岛素的纯化,其中进行基于高pH的RP-HPLC然后进行基于低pH的RP-HPLC
高pH下的纯化步骤-1如图1的流程图所示。纯化步骤-1的详细信息如下
固定相的详细信息:
a.介质:Kromasil
b.高度:25.0±1.0cm
c.线速度:所有色谱步骤≤360cm/h
流动相的详细信息:
a.流动相A:100mM Tris+50mM高氯酸钠,pH 8.5±0.1(使用冰乙酸调节pH)
b.流动相B:100.0%乙腈
c.纯化循环过程中流动相A和B的温度:20-30℃
上样准备:
a.将前一步中获得的上样浓缩物用0.5M Tris和0.7M精氨酸的混合物以≥1.0:10.0的比例稀释。
b.使用乙酸将稀释后的样品pH值调节至8.5±0.1。
c.调节pH值后,将样品通过1.2μm、0.45μm,然后通过0.22μm过滤。
d.用于1.2μm过滤的过滤器由聚丙烯(PP)制成,用于0.45/0.22μm过滤的过滤器由聚醚砜(PES)材料制成。
e.上样品中的产物浓度预期在1.0g/L至2.0g/L的范围内。
用于纯化的工艺条件:
a.以≤360cm/h的线速度,使用90.0%(A):10.0%(B)的流动相以5至10CV(柱体积)平衡柱子。
b.以≤360cm/h的线速度,以每升树脂9-10g甘精胰岛素的量上样至柱子。
c.上样后,以≤360cm/h的线速度,使用80.0%(A):20.0%(B)的流动相以4至5CV(柱体积)洗涤柱子。
d.以≤360cm/h的线速度,使用25-30%B的线性梯度以超过25CV从柱子上洗脱出产物。
e.在洗脱过程中,根据280nm吸光度(UV)的增加进行可变体积级分收集。持续收集直到UV降至基线。从柱上洗脱蛋白质所需的体积为2.0-3.0CV。
f.收集级分后,使用冰乙酸将级分pH调节为4.0±0.1。预期乙酸消耗量为15.0%-25.0%(V/V)。
g.根据洗脱级分的纯度水平,分析并合并洗脱级分,并将制备的洗脱池储存在2-8℃。
h.洗脱以去除残留的蛋白质(如果有)后,以≤360cm/h的线速度,使用50.0%纯水和50.0%乙腈以向上流动方向通过3CV,使柱子再生。
结果如表41中的列表数据所示。根据数据,糖基化蛋白质减少了约9倍,即从上样品的约4.0%减少至洗脱池中的约0.25%。
表41:高pH下纯化步骤-1的结果
注意:分析方法的LOQ为0.04%,LOD为0.02%
将来自纯化步骤-1的洗脱池进行纯化步骤-2,从糖基化蛋白中进一步纯化非糖基化蛋白。
低pH值下的纯化步骤-2如图2的流程图所示。纯化步骤-2的详细信息如下
固定相的详细信息:
a.介质:Kromasil
b.高度:25.0±1.0cm
c.线速度:所有色谱步骤≤360cm/h
流动相的详细信息:
a.流动相A:100mM乙酸钠+0.05%(w/v)辛烷磺酸(OSA),pH 3.7±0.1(使用冰乙酸调节pH)
b.流动相B:100.0%乙腈
c.纯化循环过程中流动相A和B的温度:26-30℃
上样准备:
a.将前一步中获得的洗脱池用冰乙酸调节pH至3.7±0.1,并用纯水以≥1.0:1.5的比例稀释。
b.稀释后,将样品通过1.2μm过滤器、0.45μm过滤器,然后通过0.22μm过滤器过滤。
c.用于1.2μm过滤的过滤器由聚丙烯(PP)制成,用于0.45/0.22μm过滤的过滤器由聚醚砜(PES)材料制成。
d.上样品中的产物浓度预期在1.0g/L至2.0g/L的范围内。
用于纯化的工艺条件:
a.以≤360cm/h的线速度,使用90.0%(A):10.0%(B)的流动相以10CV(柱体积)平衡柱子。
b.以≤360cm/h的线速度,以每升树脂6-7.5g甘精胰岛素的量上样至柱子。
c.上样后,以≤360cm/h的线速度,使用85.0%(A):15.0%(B)的流动相以4至5CV(柱体积)洗涤柱子。
d.以≤360cm/h的线速度,使用24-31%B的线性梯度以超过25CV从柱子上洗脱出产物。
e.在洗脱过程中,根据280nm吸光度(UV)的增加进行可变体积级分收集。持续收集直到UV
f.根据洗脱级分的纯度水平,分析并合并洗脱级分,并将制备的洗脱池储存在2-8℃。
g.洗脱以去除残留的蛋白质(如果有)后,以≤360cm/h的线速度,使用50.0%1M乙酸和50.0%乙腈以向上流动方向通过2CV,然后使用30.0%1M乙酸和70.0%乙腈通过1V,使柱子再生。
结果如表42中的列表数据所示。根据数据,糖基化蛋白质从上样品中的约0.3%降至洗脱池中的BLOQ水平。
表42:低pH下纯化步骤-2的结果
注意:分析方法的LOQ为0.04%,LOD为0.02%
将来自纯化步骤-1的洗脱池进行纯化步骤-2,从糖基化蛋白中进一步纯化非糖基化蛋白。
实验27
将含有浓度为10mg/ml的人甘精胰岛素的酶反应终末产物调节至pH为8.5,调节至10%乙腈,并用0.5M Tris+0.7M精氨酸稀释至1.91mg/ml,用作上样样品。预装的反相Kromasil 100-13-C8柱子(1*25cm)用于纯化甘精胰岛素。最初用90%的100mM Tris+50mM高氯酸钠缓冲液(pH 8.5±0.1)和10%乙腈以10个柱体积平衡柱子。将样品以每升树脂约9g人甘精胰岛素的结合量上样到柱子上。用80%的100mM Tris+50mM高氯酸钠缓冲液(pH8.5±0.1)和20%乙腈以约4个柱体积洗涤松散结合的蛋白质。用25-30%乙腈梯度与100mM乙酸钠+50mM高氯酸钠缓冲液(pH 8.5±0.1)洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用4个柱体积的50%纯水和50%乙腈,洗脱紧密结合的蛋白。整个单元操作以360cm/h的线性流速进行。使用YMC Co.Ltd制造的C18柱子通过分析方法来分析上样样品、洗脱级分和洗脱池。结果在表43中列出:
*当在高pH下进行纯化-1时,使用L-精氨酸和Tris制备上样品以确保更好的溶解度。用于上样品制备的精氨酸对纯化机理没有任何影响。该步骤的所有其他方面均保持不变,包括缓冲液组成和其他输入参数。
表43实验27的结果
实验28
将含有浓度为10mg/ml的人甘精胰岛素的酶反应终末产物调节至pH为8.5,调节至10%乙腈,并用0.5M Tris+0.7M精氨酸*稀释至1.91mg/ml,用作上样样品。预装的反相Kromasil 100-13-C8柱子(1*25cm)用于纯化甘精胰岛素。最初用90%的100mM Tris+50mM高氯酸钠缓冲液(pH 8.5±0.1)和10%乙腈以5个柱体积平衡柱子。将样品以每升树脂约9.3g人甘精胰岛素的结合量上样到柱子上。用80%的100mM Tris+50mM高氯酸钠缓冲液(pH8.5±0.1)和20%乙腈以约4个柱体积洗涤松散结合的蛋白质。用25-30%乙腈梯度与100mM乙酸钠+50mM高氯酸钠缓冲液(pH 8.5±0.1)洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用4个柱体积的50%纯水和50%乙腈,洗脱紧密结合的蛋白。整个单元操作以360cm/h的线性流速进行。使用YMC Co.Ltd制造的C18柱子通过分析方法来分析上样样品、洗脱级分和洗脱池。结果在表44中列出:
*当在高pH下进行纯化-1时,使用L-精氨酸和Tris制备上样品以确保更好的溶解度。用于上样品制备的精氨酸对纯化机理没有任何影响。该步骤的所有其他方面均保持不变,包括缓冲液组成和其他输入参数。
表44实验28的结果
实验29
将含有浓度为10mg/ml的人甘精胰岛素的酶反应终末产物调节至pH为8.5,调节至10%乙腈,并用0.5M Tris+0.7M精氨酸*稀释至1.91mg/ml,用作上样样品。预装的反相Kromasil 100-13-C8柱子(2.1*25cm)用于纯化甘精胰岛素。最初用90%的100mM Tris+50mM高氯酸钠缓冲液(pH 8.5±0.1)和10%乙腈以5个柱体积平衡柱子。将样品以每升树脂约9.75g人甘精胰岛素的结合量上样到柱子上。用80%的100mM Tris+50mM高氯酸钠缓冲液(pH 8.5±0.1)和20%乙腈以约4个柱体积洗涤松散结合的蛋白质。用25-30%乙腈梯度与100mM乙酸钠+50mM高氯酸钠缓冲液(pH 8.5±0.1)洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用4个柱体积的50%纯水和50%乙腈,洗脱紧密结合的蛋白。整个单元操作以360cm/h的线性流速进行。使用YMC Co.Ltd制造的C18柱子通过分析方法来分析上样样品、洗脱级分和洗脱池。结果在表45中列出:
*当在高pH下进行纯化-1时,使用L-精氨酸和Tris制备上样品以确保更好的溶解度。用于上样品制备的精氨酸对纯化机理没有任何影响。该步骤的所有其他方面均保持不变,包括缓冲液组成和其他输入参数。
表45实验29的结果
表46在高pH下反相纯化-1的实验数据汇总
人甘精胰岛素的第一反相纯化步骤使用高pH缓冲液与离子对试剂高氯酸钠结合,将糖基化变体减少90-93%,从而将纯度从上样品中的约56%增加至洗脱池中的>85%。
使用第二反相纯化步骤消除了之前的糖基化杂质,该第二反相纯化步骤采用低pH将甘精胰岛素的纯度增加至≥99.5%。
实验30
将含有浓度为约5.06mg/ml的人甘精胰岛素和约28.8%乙腈的反相纯化-1终末产物用乙酸调节至pH3.7,并用纯水稀释,获得含10%乙腈的浓度为约1.69mg/ml的最终甘精胰岛素,用作上样样品。预装的反相Kromasil 100-13-C8柱子(1*25cm)用于纯化甘精胰岛素。最初用90%的100mM乙酸钠+0.05%OSA缓冲液(pH 3.7±0.1)和10%乙腈以约10个柱体积平衡柱子。将样品以每升树脂约6.9g人甘精胰岛素的结合量上样到柱子上。用85%的100mM乙酸钠+0.05%OSA缓冲液(pH 3.7±0.1)和15%的乙腈以约4个柱体积洗涤松散结合的蛋白质。用24-31%乙腈梯度与100mM乙酸钠+0.05%OSA缓冲液(pH 3.7±0.1)洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用2个柱体积的50%1M乙酸和50%乙腈,然后1个柱体积的30%1M乙酸和70%乙腈,洗脱紧密结合的蛋白。整个单元操作以360cm/h的线性流速进行。使用YMC Co.Ltd制造的C18柱子通过分析方法来分析上样样品、洗脱级分和洗脱池。结果在下表47中列出。
表47实验30的结果
实验31
将含有浓度为约5.49mg/ml的人甘精胰岛素和约28.8%乙腈的反相纯化-1终末产物用乙酸调节至pH3.7,并用纯水稀释,获得含10%乙腈的浓度为约1.96mg/ml的最终甘精胰岛素,用作上样样品。预装的反相Kromasil 100-13-C8柱子(1*25cm)用于纯化甘精胰岛素。最初用90%的100mM乙酸钠+0.05%OSA缓冲液(pH 3.7±0.1)和10%乙腈以约10个柱体积平衡柱子。将样品以每升树脂约7.0g人甘精胰岛素的结合量上样到柱子上。用85%的100mM乙酸钠+0.05%OSA缓冲液(pH 3.7±0.1)和15%的乙腈以约4个柱体积洗涤松散结合的蛋白质。用24-31%乙腈梯度与100mM乙酸钠+0.05%OSA缓冲液(pH 3.7±0.1)洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用2个柱体积的50%1M乙酸和50%乙腈,然后1个柱体积的30%1M乙酸和70%乙腈,洗脱紧密结合的蛋白。整个单元操作以360cm/h的线性流速进行。使用YMC Co.Ltd制造的C18柱子通过分析方法来分析上样样品、洗脱级分和洗脱池。结果在下表48中列出。
表48实验31的结果
实验32
将含有浓度为约4.3mg/ml的人甘精胰岛素和约28.6%乙腈的反相纯化-1终末产物用乙酸调节至pH3.7,并用纯水稀释,获得含10%乙腈的浓度为约1.5mg/ml的最终甘精胰岛素,用作上样样品。预装的反相Kromasil 100-13-C8柱子(1*25cm)用于纯化甘精胰岛素。最初用90%的100mM乙酸钠+0.05%OSA缓冲液(pH 3.7±0.1)和10%乙腈以约5个柱体积平衡柱子。将样品以每升树脂约7.5g人甘精胰岛素的结合量上样到柱子上。用85%的100mM乙酸钠+0.05%OSA缓冲液(pH 3.7±0.1)和15%的乙腈以约4个柱体积洗涤松散结合的蛋白质。用24-31%乙腈梯度与100mM乙酸钠+0.05%OSA缓冲液(pH 3.7±0.1)洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用2个柱体积的50%1M乙酸和50%乙腈,然后1个柱体积的30%1M乙酸和70%乙腈,洗脱紧密结合的蛋白。整个单元操作以360cm/h的线性流速进行。使用YMC Co.Ltd制造的C18柱子通过分析方法来分析上样样品、洗脱级分和洗脱池。结果在下表49中列出。
表49实验32的结果
下表50中详述了在低pH下反相纯化-1的实验数据汇总。
表50在低pH下反相纯化-2的实验数据汇总
注意:分析方法的LOQ为0.04%,LOD为0.02%
下表51和52中分别详述了反相纯化步骤1和2的终末产物的质量特征和基于质量的可能ID。反相纯化-1终末产物和反相纯化-2终末产物的质谱数据UV和TIC色谱图分别如图6A和图6B所示。
表51反相纯化步骤-1终末产物(实验27)的糖型的质量特征和基于质量的可能ID。
表52反相纯化步骤-2终末产物(实验30)的糖型的质量特征和基于质量的可能ID。
赖脯胰岛素的纯化,其中进行基于高pH的RP-HPLC然后进行基于低pH的RP-HPLC
高pH下的纯化步骤-1如图1的流程图所示。纯化步骤-1的详细信息如下
固定相的详细信息:
a.介质:Daisopak
b.高度:25.0±1.0cm
c.线速度:所有色谱步骤≤360cm/h
流动相的详细信息:
a.流动相A:100mM Tris+200mM咪唑+0.2%四丁基硫酸氢铵(TBAB),pH 7.5±0.1(使用冰乙酸调节pH)
b.流动相B:100.0%乙腈
c.纯化循环过程中流动相A和B的温度:20-30℃
上样准备:
a.将前一步中获得的上样浓缩物调节pH至7.5±0.1,并用纯水以≥1.0:10.0的比例稀释。
b.将样品通过1.2μm、0.45μm,然后通过0.22μm过滤。
c.用于1.2μm过滤的过滤器由聚丙烯(PP)制成,用于0.45/0.22μm过滤的过滤器由聚醚砜(PES)材料制成。
d.上样品中的产物浓度预期在1.0g/L至2.0g/L的范围内。
用于纯化的工艺条件:
a.以≤360cm/h的线速度,使用90.0%(A):10.0%(B)的流动相以5至10CV(柱体积)平衡柱子。
b.以≤360cm/h的线速度,以每升树脂9-10g赖脯胰岛素的量上样至柱子。
c.上样后,以≤360cm/h的线速度,使用80.0%(A):15.0%(B)的流动相以4至5CV(柱体积)洗涤柱子。
d.以≤360cm/h的线速度,使用24-29%B的线性梯度以超过13CV从柱子上洗脱出产物。
e.在洗脱过程中,根据280nm吸光度(UV)的增加进行可变体积级分收集。持续收集直到UV降至基线。从柱上洗脱蛋白质所需的体积为2.0-3.0CV。
f.根据洗脱级分的纯度水平,分析并合并洗脱级分,并将制备的洗脱池储存在2-8℃。
g.洗脱以去除残留的蛋白质(如果有)后,以≤360cm/h的线速度,使用50.0%流动相A和50.0%乙腈以向上流动方向通过2CV,然后使用30%3M乙酸和70.0%乙腈,使柱子再生。
结果如表53中的列表数据所示。根据数据,糖基化蛋白质减少了约3倍,即从上样品的约4.0%降至洗脱池(EP)中的约1.0%。
表53:高pH下纯化步骤-1的结果
注意:分析方法的LOQ为0.05%,LOD为0.03%
将来自纯化步骤-1的洗脱池进行纯化步骤-2,从糖基化蛋白中进一步纯化非糖基化蛋白。
低pH值下的纯化步骤-2如图2的流程图所示。纯化步骤-2的详细信息如下
固定相的详细信息:
a.介质:Daisopak
b.高度:25.0±1.0cm
c.线速度:所有色谱步骤≤360cm/h
流动相的详细信息:
a.流动相A:400mM柠檬酸三钠-柠檬酸缓冲液+0.1%(w/v)辛烷磺酸(OSA)+50mMGuCl,pH3.85±0.1。
b.流动相B:100.0%乙腈
c.纯化循环过程中流动相A和B的温度:26-30℃
上样准备:
a.将前一步中获得的洗脱池用冰乙酸调节pH至4.0±0.1,并用纯水以≥1.0:1.5的比例稀释。
b.稀释后,将样品通过1.2μm过滤器、0.45μm过滤器,随后通过0.22μm过滤器过滤。
c.用于1.2μm过滤的过滤器由聚丙烯(PP)制成,用于0.45/0.22μm过滤的过滤器由聚醚砜(PES)材料制成。
d.上样品中的产物浓度预期在0.8g/L至1.0g/L的范围内。
用于纯化的工艺条件:
a.以≤360cm/h的线速度,使用90.0%(A):10.0%(B)的流动相以5至10CV(柱体积)平衡柱子。
b.以≤360cm/h的线速度,以每升树脂7-8g赖脯胰岛素的量上样至柱子。
c.上样后,以≤360cm/h的线速度,使用78.0%(A):22.0%(B)的流动相以4至5CV(柱体积)洗涤柱子。
d.以≤220cm/h的线速度,使用24-28%B的线性梯度以超过20CV从柱子上洗脱出产物。
e.在洗脱过程中,根据280nm吸光度(UV)的增加进行可变体积级分收集。持续收集直到UV
f.根据洗脱级分的纯度水平,分析并合并洗脱级分,并将制备的洗脱池储存在2-8℃。
g.洗脱以去除残留的蛋白质(如果有)后,以≤360cm/h的线速度,使用70.0%1M乙酸和30.0%乙腈以向上流动方向通过4CV,使柱子再生。
结果如表54中的列表数据所示。根据数据,糖基化蛋白质从上样品中的约0.3%降至洗脱池中的BLOQ水平。
表54:低pH下纯化步骤-2的结果
注意:分析方法的LOQ为0.05%,LOD为0.03%
实验33
将含有浓度为13mg/ml的人赖脯胰岛素的酶反应终末产物调节pH至7.5和10%乙腈,然后用纯水稀释至1.45mg/ml,用作上样样品。预装的反相Daisopak 200-10-C18柱子(2*25cm)用于纯化赖脯胰岛素。最初用90%的100mM Tris+200mM咪唑+0.2%(w/v)TBAB缓冲液(pH 7.5±0.1)和10%乙腈以10个柱体积平衡柱子。将样品以每升树脂约7.3g人赖脯胰岛素的结合量上样到柱子上。用75%的100mM Tris+200mM咪唑+0.2%(w/v)TBAB缓冲液(pH 7.5±0.1)和15%乙腈以约4个柱体积洗涤松散结合的蛋白质。用24-29%乙腈梯度与100mM Tris+200mM咪唑+0.2%(w/v)TBAB缓冲液(pH 7.5±0.1)以超过13个柱体积洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用2个柱体积的50%的100mM Tris+200mM咪唑+0.2%(w/v)TBAB缓冲液(pH 7.5±0.1)和50%乙腈,然后2个柱体积的30%3M乙酸和70%乙腈,洗脱紧密结合的蛋白。整个单元操作以360cm/h的线性流速进行。使用Waters.Ltd制造的C18柱子通过分析方法来分析上样样品、洗脱级分和洗脱池。结果在表55中列出:
表55实验33的结果
实验34
将含有浓度为13mg/ml的人赖脯胰岛素的酶反应终末产物调节pH至7.5和10%乙腈,然后用纯水稀释至1.45mg/ml,用作上样样品。预装的反相Daisopak 200-10-C18柱子(2*25cm)用于纯化赖脯胰岛素。最初用90%的100mM Tris+200mM咪唑+0.2%(w/v)TBAB缓冲液(pH 7.5±0.1)和10%乙腈以5个柱体积平衡柱子。将样品以每升树脂约7.3g人赖脯胰岛素的结合量上样到柱子上。用75%的100mM Tris+200mM咪唑+0.2%(w/v)TBAB缓冲液(pH7.5±0.1)和15%乙腈以约4个柱体积洗涤松散结合的蛋白质。用24-29%乙腈梯度与100mMTris+200mM咪唑+0.2%(w/v)TBAB缓冲液(pH 7.5±0.1)以超过13个柱体积洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用2个柱体积的50%的100mMTris+200mM咪唑+0.2%(w/v)TBAB缓冲液(pH 7.5±0.1)和50%乙腈,然后2个柱体积的30%3M乙酸和70%乙腈,洗脱紧密结合的蛋白。整个单元操作以360cm/h的线性流速进行。使用Waters.Ltd制造的C18柱子通过分析方法来分析上样样品、洗脱级分和洗脱池。结果在表56中列出:
表56实验34的结果
实验35
将含有浓度为13mg/ml的人赖脯胰岛素的酶反应终末产物调节pH至7.5和10%乙腈,然后用纯水稀释至1.45mg/ml,用作上样样品。预装的反相Daisopak 200-10-C18柱子(2*25cm)用于纯化赖脯胰岛素。最初用90%的100mM Tris+200mM咪唑+0.2%(w/v)TBAB缓冲液(pH 7.5±0.1)和10%乙腈以5个柱体积平衡柱子。将样品以每升树脂约7.3g人赖脯胰岛素的结合量上样到柱子上。用75%的100mM Tris+200mM咪唑+0.2%(w/v)TBAB缓冲液(pH7.5±0.1)和15%乙腈以约4个柱体积洗涤松散结合的蛋白质。用24-29%乙腈梯度与100mMTris+200mM咪唑+0.2%(w/v)TBAB缓冲液(pH 7.5±0.1)以超过13个柱体积洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用2个柱体积的50%的100mMTris+200mM咪唑+0.2%(w/v)TBAB缓冲液(pH 7.5±0.1)和50%乙腈,然后2个柱体积的30%3M乙酸和70%乙腈,洗脱紧密结合的蛋白。整个单元操作以360cm/h的线性流速进行。使用Waters.Ltd制造的C18柱子通过分析方法来分析上样样品、洗脱级分和洗脱池。结果在表57中列出:
表57实验35的结果
表58在高pH下反相纯化-1的实验数据汇总
人赖脯胰岛素的第一反相纯化步骤使用高pH缓冲液与离子对试剂四丁基硫酸氢铵结合,将糖基化变体减少65-75%,从而将纯度从上样品中的约58%增加至洗脱池中的>82%。
使用第二反相纯化步骤消除了之前的糖基化杂质,该第二反相纯化步骤采用低pH将赖脯胰岛素的纯度增加至≥95%。
实验36
将含有浓度为约3mg/ml的人甘精胰岛素和约28.3%乙腈的反相纯化-1终末产物用乙酸调节至pH 4.0,并用纯水稀释,获得含10%乙腈的浓度为约1.06mg/ml的最终赖脯胰岛素,用作上样样品。预装的反相Daisopak 200-10-C18柱子(1*25cm)用于纯化赖脯胰岛素。最初用90%的400mM柠檬酸三钠-柠檬酸缓冲液+0.1%(w/v)OSA+50mM GuCl(pH 3.85±0.1)和10%乙腈以约10个柱体积平衡柱子。将样品以每升树脂约7.5g人赖脯胰岛素的结合量上样到柱子上。用78%的400mM柠檬酸三钠-柠檬酸缓冲液+0.1%(w/v)OSA+50mM GuCl(pH 3.85±0.1)和22%乙腈以约4个柱体积洗涤松散结合的蛋白质。以220cm/h的线性流速,用24-28%乙腈梯度与400mM柠檬酸三钠-柠檬酸缓冲液+0.1%(w/v)OSA+50mM GuCl(pH3.85±0.1)以超过20个柱体积洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用4个柱体积的30%1M乙酸和70%乙腈,洗脱紧密结合的蛋白。除了洗脱以外,整个单元操作以360cm/h的线性流速进行。使用Waters.Ltd制造的C18柱子通过分析方法来分析上样样品、洗脱级分和洗脱池。结果在下表59中列出。
表59实验36的结果
实验37
将含有浓度为约3mg/ml的人赖脯胰岛素和约28.8%乙腈的反相纯化-1终末产物用乙酸调节至pH 4.0,并用纯水稀释,获得含10%乙腈的浓度为约1.06mg/ml的最终赖脯胰岛素,用作上样样品。预装的反相Daisopak 200-10-C18柱子(1*25cm)用于纯化赖脯胰岛素。最初用90%的400mM柠檬酸三钠-柠檬酸缓冲液+0.1%(w/v)OSA+50mM GuCl(pH 3.85±0.1)和10%乙腈以约10个柱体积平衡柱子。将样品以每升树脂约7.2g人赖脯胰岛素的结合量上样到柱子上。用78%的400mM柠檬酸三钠-柠檬酸缓冲液+0.1%(w/v)OSA+50mM GuCl(pH 3.85±0.1)和22%乙腈以约4个柱体积洗涤松散结合的蛋白质。以220cm/h的线性流速,用24-28%乙腈梯度与400mM柠檬酸三钠-柠檬酸缓冲液+0.1%(w/v)OSA+50mM GuCl(pH3.85±0.1)以超过20个柱体积洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用4个柱体积的30%1M乙酸和70%乙腈,洗脱紧密结合的蛋白。除了洗脱以外,整个单元操作以360cm/h的线性流速进行。使用Waters.Ltd制造的C18柱子通过分析方法来分析上样样品、洗脱级分和洗脱池。结果在下表60中列出。
表60实验37的结果
实验38
将含有浓度为约2.3mg/ml的人赖脯胰岛素和约28.6%乙腈的反相纯化-1终末产物用乙酸调节至pH4.0,并用纯水稀释,获得含10%乙腈的浓度为约0.83mg/ml的最终赖脯胰岛素,用作上样样品。预装的反相Daisopak 200-10-C18柱子(1*25cm)用于纯化赖脯胰岛素。最初用90%的400mM柠檬酸三钠-柠檬酸缓冲液+0.1%(w/v)OSA+50mM GuCl(pH 3.85±0.1)和10%乙腈以约5个柱体积平衡柱子。将样品以每升树脂约8.0g人赖脯胰岛素的结合量上样到柱子上。用78%的400mM柠檬酸三钠-柠檬酸缓冲液+0.1%(w/v)OSA+50mM GuCl(pH 3.85±0.1)和22%乙腈以约4个柱体积洗涤松散结合的蛋白质。以220cm/h的线性流速,用24-28%乙腈梯度与400mM柠檬酸三钠-柠檬酸缓冲液+0.1%(w/v)OSA+50mM GuCl(pH3.85±0.1)以超过20个柱体积洗脱结合的蛋白。根据280nm吸光度的增加,收集多个0.25柱体积的级分。用4个柱体积的30%1M乙酸和70%乙腈,洗脱紧密结合的蛋白。除了洗脱以外,整个单元操作以360cm/h的线性流速进行。使用Waters.Ltd制造的C18柱子通过分析方法来分析上样样品、洗脱级分和洗脱池。结果在下表61中列出。
表61实验38的结果
表62在低pH下反相纯化-2的实验数据汇总
注意:分析方法的LOQ为0.05%,LOD为0.03%
下表63(实验33)、64(实验34)和65(实验35)中分别详述了反相纯化步骤-1的终末产物的质量特征和基于质量的可能ID。下表66(实验36)、67(实验37)和68(实验38)中分别详述了反相纯化步骤-2的终末产物的质量特征和基于质量的可能ID。反相纯化-1终末产物的质谱数据UV和TIC色谱图分别如图7A(实验33)、图7B(实验34)和图7C(实验35)所示。反相纯化-2终末产物的质谱数据UV和TIC色谱图分别如图8A(实验36)、图8B(实验37)和图8C(实验38)所示。
表63反相纯化步骤-1终末产物(实验33,图7A所示)的糖型的质量特征和基于质量的可能ID。
表64反相纯化步骤-1终末产物(实验34,图7B所示)的糖型的质量特征和基于质量的可能ID。
表65反相纯化步骤-1终末产物(实验35,图7C所示)的糖型的质量特征和基于质量的可能ID。
表66反相纯化步骤-2终末产物(实验36,图8A所示)的糖型的质量特征和基于质量的可能ID。
表67反相纯化步骤-2终末产物(实验37,图8B所示)的糖型的质量特征和基于质量的可能ID。
表68反相纯化步骤-2终末产物(实验38,图8C所示)的糖型的质量特征和基于质量的可能ID。
结论
如在实施例中详述的,本发明涉及两步纯化方法,该方法通过采用在一个步骤中的离子对试剂(优选OSA)与在另一个步骤的基于碱性pH的洗脱剂的构思,将非糖基化胰岛素类似物与糖基化胰岛素类似物分离,从而实现去除约99.95%的胰岛素类似物的糖基化形式。
- 用于纯化胰岛素类似物的色谱方法
- 用于纯化低分子肝素的阴离子交换色谱填料,其制备方法,其填充的色谱柱及纯化方法
