用于医学成像的装置和方法
文献发布时间:2023-06-19 11:57:35
技术领域
本发明涉及医学成像的领域,特别是使用信号处理和电磁计算技术来检测在组织内部的异常的存在和位置并将这样的异常分类。
背景
医学成像技术例如超声、计算机断层扫描(CT)、磁共振成像(MRI)和核医学成像是用于对人体的内部特征成像的极其强大的技术,但遭受限制它们的适用性的许多缺点。例如,这些技术需要昂贵的设备,且因此在农村或偏远的保健中心通常是不可得到的。实际上,根据世界卫生组织(WHO),世界上多于一半的人口无法获得诊断成像。此外,存在对用于各种疾病的检测和连续监测的低成本和安全的成像系统的一般需要。由于限制对电离辐射(例如X射线)的暴露的需要,大多数目前可用的医学成像系统不能用于频繁的监测。此外,MRI和其他大型医学成像系统的庞大和静态结构以及高成本常常阻止它们用于监测需要在定期和短期基础上进行活动监测的疾病,并且它们为了现场成像和评估目的而由护理人员使用是不切实际的。
此外,常规医学成像工具通常不适合于紧急现场诊断。例如,脑中风是全世界的残疾和死亡的主要原因之一。根据澳大利亚中风基金会组织,在2017年,每九分钟55,831个澳大利亚人遭受危及生命的中风,以及在不采取行动的情况下,这个数字到2050年时为止将增加到每四分钟一次中风。类似地,在脑损伤的情况下,快速诊断对挽救患者常常是必不可少的。严重的脑损伤包括分别由外力(例如跌倒或事故)或内部事件(例如中风或肿瘤)引起的创伤性和获得性脑损伤。众所周知,患有脑损伤的患者需要立即的医药治疗。从脑损伤开始起,每秒数百万脑细胞死亡,造成永久性损伤且在一些情况下造成死亡。因此,需要用于这样的损伤的快速现场诊断的快速和便携的诊断系统。
电磁成像是用于医学应用的有吸引力的技术,并且有潜力来以成本有效和安全的方式创建人体的内部的视觉表示。从电磁工程视角看,人体是以具有不同介电特性的特征和组织为特征的电磁异质介质。此外,与健康组织相比,受伤组织具有介电特性电容率和电导率的不同值。当与邻近的健康组织相比具有高电容率值的受伤组织暴露于在微波频率处的电磁波时,波的大部分朝着辐射源被反射回。微波医学成像系统可用于将电磁波传输到待成像的对象例如人头中。由于电磁特性的变化而由在头内(例如,特别是在脑内的出血或凝块部位处)的受损组织反射的微波信号由系统接收和测量,并且表示被测信号的数据可以被处理以估计异常的位置和/或介电特性,并且生成头的显示受损组织的二维或三维图像。
数据处理步骤在电磁成像系统中起至关重要的作用。已经采用各种成像技术来从散射电磁信号的测量值检测医学目标。这些技术试图通过对非线性方程(断层扫描)求解来估计组织的介电特性(非线性方程没有唯一的解,并且该解可以不连续地依赖于输入数据),或者使用基于时域雷达的技术来找到目标的位置。由于基于断层扫描技术的耗时性质,它们几乎专有地可适用于单频或窄带多频信号,且因此不适合于在快速诊断被需要的医疗紧急情况(例如脑损伤检测)中使用。可选地,在基于雷达的成像中,成像域的散射剖面被映射到二维或三维图像上。这种方法在为了高分辨率而使用超宽频带时是更可适用的,因为所需的数据处理比断层扫描更简单和更快。然而,当前的雷达成像方法例如共焦、空间-时间波束形成MIST和自适应波束形成成像方法利用基于延迟叠加(DAS)的处理技术,其容易受到可能导致错误检测的外层反射和内层折射的影响。此外,在不同频率下穿过组织的信号穿透的变化限制了这些延迟计算的有效性,并因此限制了因而得到的图像的准确度。鉴于这些困难,需要快速成像方法,其不遭受断层扫描技术的非唯一且在计算上昂贵的解决方案或由于人体的异质多层结构的多次反射和折射而导致的不准确处理。
因此需要克服或减轻现有技术的一个或更多个困难或者至少提供有用的替代方案。
概述
根据本发明的一些实施例,提供了一种用于医学成像的方法,该方法包括:
(i)接收表示在多个不同信号频率下来自受验者的身体部分的组织的电磁信号散射的单静态或多静态测量值的散射数据,其中电磁信号从一个或更多个天线发射,并且相应的散射信号由一个或更多个天线测量;
(ii)处理散射数据以计算在受验者的在身体部分内的组织的多个散射位置中的每一个处以及对于多个频率中的每一个的电场功率值;
(iii)对于每个散射位置,合计计算出的对于多个频率和多个天线在该散射位置处的电场功率值以生成在身体部分内的组织的图像;以及
(iv)基于在身体部分内的组织的模型与所生成的图像的比较来迭代地更新该模型,直到终止标准被满足为止,其中已更新的模型作为受验者的在身体部分内的组织的图像被输出。
在一些实施例中,测量值是多静态测量值,其中电磁信号选择性地从布置在身体部分周围的多个天线中的每一个发射,并且相应的散射信号由多个天线中的每一个测量。
身体部分可以是头,且组织包括受验者的脑组织。
在一些实施例中,该方法包括:
(v)使用机器学习来处理受验者的简历数据(biodata)以从模板库中选择基础模板作为对受验者的最佳匹配,其中模板表示相应受验者的身体部分的组织的相应模型,并且受验者的简历数据至少表示受验者的年龄、性别、体重和种族;
(vi)通过用几何法变换选定模板的空间坐标以匹配受验者的身体部分的测量值来处理选定基础模板和受验者的身体部分的外部尺寸和/或形状的测量值,以生成表示受验者的身体部分组织的模型的模板数据。
在一些实施例中,处理散射数据的步骤包括以下步骤:
(vii)标准化散射数据并从散射数据去除杂波(clutter);以及
(viii)处理标准化的和杂波去除的散射数据以计算电场功率值。
在一些实施例中,从散射数据去除杂波包括确定被测电磁信号的平均值,并在每个频率下从每个信号测量值减去平均值以从散射数据去除强反射和杂波。
在一些实施例中,该方法包括通过将身体部分的被测散射参数除以在没有身体部分的情况下并且在成像域由具有匹配介质或普通身体部分模型(average body partphantom)的介电特性的材料填充的情况下的成像域的被测散射参数来校准散射数据。
在一些实施例中,该方法包括通过以下方式将在身体部分内的异常组织分类为出血性的或缺血性的:将频域信号转换为时域信号并将时域信号映射到相应的图形,确定图形的节点度(node degree)和度序列(degree sequence)特性,计算图度互信息(graphdegree mutual information)以评估图形的相似性,以及用图度互信息特征及其相应类别标签的训练集训练分类器,并将分类器应用于为受验者的在身体部分内的组织计算的图形。
在一些实施例中,该方法包括比较相应对的对置天线的信号以识别在受验者的脑的不同半球的信号之间的显著差异,这些差异指示在半球之一中的异常。
根据本发明的一些实施例,提供了一种计算机可读存储介质,该计算机可读存储介质具有存储在其上的处理器可执行指令,处理器可执行指令当由医学成像系统的至少一个处理器执行时使至少一个处理器执行上述方法中的任一个。
根据本发明的一些实施例,提供了一种用于医学成像的装置,该装置包括被配置为执行上述方法中的任一个的部件。
根据本发明的一些实施例,提供了一种用于医学成像的装置,该装置包括:
(i)输入端,该输入端接收表示在多个不同信号频率下来自受验者的身体部分的组织的电磁信号散射的单静态或多静态测量值的散射数据,其中电磁信号从一个或更多个天线发射,并且相应的散射信号由一个或更多个天线测量;
(ii)图像生成部件,该图像生成部件被配置为:
-处理散射数据以计算在受验者的在身体部分内的组织的多个散射位置中的每一个处以及对于多个频率中的每一个的电场功率值;
-对于每个散射位置,合计计算出的对于多个频率和多个天线在该散射位置处的电场功率值以生成在身体部分内的组织的图像;以及
-基于在身体部分内的组织的模型与所生成的图像的比较来迭代地更新该模型,直到终止标准被满足为止,其中已更新的模型作为受验者的在身体部分内的组织的图像被输出。
在一些实施例中,测量值是多静态测量值,其中电磁信号选择性地从布置在身体部分周围的多个天线中的每一个发射,并且相应的散射信号由多个天线中的每一个测量。
在一些实施例中,身体部分是头,且组织包括受验者的脑组织。
在一些实施例中,装置包括模板生成器以:
使用机器学习来处理受验者的简历数据以从模板库中选择基础模板作为对受验者的最佳匹配,其中模板表示相应受验者的身体部分的组织的相应模型,并且受验者的简历数据至少表示受验者的年龄、性别、体重和种族;以及
通过用几何法变换选定模板的空间坐标以匹配受验者的身体部分的测量值来处理选定基础模板和受验者的身体部分的外部尺寸和/或形状的测量值,以生成表示受验者的身体部分组织的模型的模板数据。
本文还描述了一种用于对受验者的身体部分的组织成像的方法,该方法包括:
(i)使用机器学习来处理受验者的简历数据以从模板库中选择模板作为对受验者的最佳匹配,其中模板表示相应受验者的身体部分的组织的相应模型,并且受验者的简历数据至少表示受验者的年龄、性别、体重和种族;
(ii)通过用几何法变换选定模板的空间坐标以匹配受验者的身体部分的测量值来处理选定模板和受验者的身体部分的外部尺寸和/或形状的测量值,以生成表示受验者的身体部分组织的模型的模板数据;
(iii)接收表示在多个不同信号频率下来自受验者的身体部分组织的微波散射的多静态测量值的散射数据;
(iv)标准化散射数据并从散射数据去除杂波;
(v)处理标准化的和杂波去除的散射数据以计算在受验者的身体部分组织的多个散射位置中的每一个处以及对于多个频率中的每一个的电场功率密度;
(vi)对于每个散射位置,合计在多个频率上在该散射位置处计算出的电场功率密度以生成受验者的身体部分组织的图像;以及
(vii)基于受验者的身体部分的组织的模型与所生成的图像的比较来迭代地更新该模型,直到终止标准被满足为止,其中已更新的模型作为至少受验者的身体部分组织的图像被输出。
在一些实施例中,受验者的身体部分是受验者的头。
在本文还描述了一种用于对受验者的脑组织成像的方法,该方法包括:
(i)使用机器学习来处理受验者的简历数据以从模板库中选择模板作为对受验者的最佳匹配,其中模板表示相应受验者的头组织的相应模型,并且受验者的简历数据至少表示受验者的年龄、性别、体重和种族;
(ii)通过用几何法变换选定模板的空间坐标以匹配受验者的头的测量值来处理选定模板和受验者的头的外部尺寸和/或形状的测量值,以生成表示受验者的头组织的模型的模板数据;
(iii)接收表示在多个不同信号频率下来自受验者的脑组织的微波散射的多静态测量值的散射数据;
(iv)标准化散射数据并从散射数据去除杂波;
(v)处理标准化的和杂波去除的散射数据以计算在受验者的脑组织的多个散射位置中的每一个处以及对于多个频率中的每一个的电场功率密度;
(vi)对于每个散射位置,合计在多个频率上在该散射位置处计算出的电场功率密度以生成受验者的脑组织的图像;以及
(vii)基于受验者的头的组织的模型与所生成的图像的比较来迭代地更新该模型,直到终止标准被满足为止,其中已更新的模型作为至少受验者的脑组织的图像被输出。
在本文还描述了一种用于受验者的医学成像的方法,该方法包括:
(i)接收表示在多个不同信号频率下来自受验者的组织的电磁信号散射的多静态测量值的散射数据;
(ii)处理散射数据以计算在受验者的组织的多个散射位置中的每一个处以及对于多个频率中的每一个的电场功率密度;
(iii)对于每个散射位置,合计在多个频率上在该散射位置处计算出的电场功率密度以生成受验者的组织的图像;以及
(iv)基于受验者的组织的模型与所生成的图像的比较来迭代地更新该模型,直到终止标准被满足为止,其中已更新的模型作为受验者的组织的图像被输出。
在一些实施例中,组织包括受验者的脑组织。
附图简述
仅作为例子参考附图在下文中描述本发明的一些实施例,其中:
图1是根据本发明的实施例的电磁医学成像系统的示意图;
图2是图1的系统的分析部件的框图;
图3是根据本发明的实施例的电磁医学成像方法的流程图;
图3a是图3的成像方法的校准过程的校准模型的框图;
图3b是用于校准过程的填充有耦合介质的天线阵列的示意图;
图4a和4b是图3的成像方法的模板生成过程的流程图;
图5是示出在图3的成像方法中从患者特定头模板生成融合图像的流程图;
图6是成像方法的MRI到EM转换过程的流程图;
图7是图3的成像方法的图像生成过程的流程图;
图8是图2的分析部件的波束成像(beamography)部件的功能框图;
图9是图7的图像生成过程的波束成像过程的流程图;
图10是示出微波信号从发射天线到成像域内的发射、微波信号在成像域内的散射以及由接收天线对散射信号的检测的示意图;
图11至19示出了成像方法的分类过程的不同部分或子过程,如下:
图11是分类过程的在分类和定位之前的数据处理和分析步骤的流程图;
图12是图11的步骤之后的分类的流程图;
图13是图11之后的定位步骤的流程图;
图14是由系统生成的时间序列信号的图形;
图15是由系统生成的频域信号的图形;
图16a和16b分别是微波信号的图形和它的复杂网络图形;
图17是示出信号的微分最大权重对穿过中风目标的示意图;
图18是分类过程的定位步骤的流程图;
图19包括杜克中风脑模型(Duke Stroke brain model)的出血模型的图像;
图20示出了成像方法的图像融合过程;以及
图21是受验者的由天线包围的头的示意性横截面平面图,其示出了用于识别受验者的脑的哪个半球包含感兴趣特征(例如血团)的过程步骤:两个候选交叉点(L0,R0)分别在左半球和右半球中;横越L0和R2天线到R1的第5个天线是远离L0和R0的相邻天线;另一方面,几乎横越R0到L1的第13个天线与第5个天线间隔开,以及L2天线远离L0和R0。
详细描述
本文描述的电磁成像系统和方法能够以安全的方式快速生成在对象内的内部结构的图像。尽管所描述的系统和方法是为了检测和表征在人类受验者中(特别是在人脑内)的内伤和/或疾病的主要目的而被开发并且在本文中在该上下文中被描述,但是应当理解,该系统和方法的许多方面可以应用于人体的其他部分、其他活生物以及甚至非生命或无生命的对象。
如图1所示,用于医学成像且特别是用于检测脑损伤的系统包括包含天线阵列的天线组件或平台102、向量网络分析器(VNA)或收发器104以及分析部件106。在所描述的实施例中,如图1所示,天线组件或平台102放置在人类受验者的头上,该受验者的脑将被成像。天线平台102包括布置在受验者周围的天线的阵列,使得阵列的每个天线可以被选择性地激励以将电磁波或微波频率的信号辐射到受验者的头内并穿过受验者的头以被散射,并且相应的散射信号由阵列的所有天线——包括发射相应信号的天线——检测。为了参考的方便,顺序地使阵列的每个天线发射相应的微波信号并使用所有天线来接收相应的散射信号的整个过程被称为“扫描”。
如对本领域中的技术人员明显的,向量网络分析器(VNA)104如上所述激励天线,并记录来自天线的相应信号作为数据(在本文被称为“散射”数据),该数据以在本领域中被称为“散射参数”或“S参数”的形式表示散射微波的振幅和相位。VNA 104将该数据发送到分析部件106用于处理,以生成被成像对象的内部特征(例如脑凝块、出血部位和其他特征)的图像,并将这些特征分类(例如作为脑凝块或出血部位)。在所描述的实施例中,具有大于100dB的大动态范围和低于-100dBm的本底噪声(noise floor)的VNA被用来激活天线以在0.5到4GHz的整个频带上发射电磁信号,并从那些天线接收散射信号。
尽管所述实施例的分析部件106(如图1所示)是以计算机的形式,但是在其他实施例中情况不需要是这样。如图2所示,分析部件106是如图2所示的64位英特尔架构计算机系统,并且由分析部件106执行的过程被实现为一个或更多个软件模块202的编程指令,该一个或更多个软件模块202存储在与计算机系统相关联的非易失性(例如硬盘或固态驱动器)存储装置204上。然而将明显的是,例如,这些过程的至少一些部分可以可选地被实现为一个或更多个专用硬件部件,例如专用集成电路(ASIC)和/或一个或更多个现场可编程门阵列(FPGA)的配置数据。
分析部件106包括标准计算机部件,包括都通过总线216互连的随机存取存储器(RAM)206、至少一个处理器208和外部接口210、212、214。外部接口包括通用串行总线(USB)接口210(其中至少一个连接到键盘218和诸如鼠标219的定点设备)、将分析部件106连接到诸如互联网220的通信网络的网络接口连接器(NIC)212以及连接到诸如LCD面板显示器222的显示设备的显示适配器214。
分析部件106还包括多个标准软件模块226至230,包括操作系统224,例如Linux或Microsoft Windows。在所描述的实施例中,分析部件106还包括在http://www.apache.org可得到的诸如Apache的web服务器软件226、在http://www.php.net可得到的诸如PHP的脚本语言支持228或Microsoft ASP以及从http://www.mysql.com可得到的诸如MySQL的结构化查询语言(SQL)支持230,其允许数据被存储在SQL数据库232中并从SQL数据库232被检索。
web服务器226、脚本语言模块228和SQL模块230一起为分析部件106提供允许具有配备有标准web浏览器软件的标准计算设备的互联网220用户访问分析部件106、特别是向数据库232提供数据和从数据库232接收数据的一般能力。
然而,本领域中的技术人员将理解,由分析部件106向这样的用户提供的特定功能由web服务器226可访问的脚本(包括实现过程的一个或更多个软件模块202)以及还有任何其他支持脚本和数据234(包括标记语言(例如HTML、XML)脚本、PHP(或ASP)和/或CGI脚本、图像文件、样式表和诸如此类)提供。
如图3所示,本文描述的系统执行医学成像方法,其在本文也被称为用于脑成像的方法。该方法通过在步骤302为天线平台116生成校准数据开始。由系统执行的图像重建和分类过程依赖于从天线收集的高保真数据。然而,在任何真实情形中,该系统使用与不同的适配器和天线巴伦(balun)连接的具有不同长度和弯曲剖面的射频(RF)电缆。此外,由于:1)制造变化/误差,以及2)天线被嵌入的介质的不稳定介电特性,天线本身总是稍微不同。在系统内的不同RF通道(包括电缆、适配器和天线)当中的这样的不确定的变化引入振幅和相位中的信号差异,并最终产生降低成像重建/分类的检测、分辨率和可靠性的测量误差。
为了减轻这些变化和失真的影响,该系统包括频域校准部件和相应的数据校准过程以消除或至少减少测量误差。在实践中,校准过程理想地紧挨在受验者的每次扫描之前被执行,但是可以可选地不太经常、例如仅在每天开始时被执行。
假设VNA 104在它的所有N个端口上被很好地校准,系统的校准模型采用特定的传输线误差模型和天线不确定性矩阵,如图3a所示。在左侧上的传输线误差模型表示从每个VNA端口连接到相应天线元件的同轴电缆和级联适配器。因为同轴线(和适配器)在可以忽略的插入损耗的情况下具有良好的传输质量,这些电缆当中的最大差异主要由它们的弯曲剖面和有效物理长度误差(ΔL
在该模型中,每个通道有三个误差参数,第一误差起因于同轴电缆和适配器(ΔL),以及其他两个误差[G(f),θ(f)]起因于天线元件及其巴伦。在实现下面描述的图像重建/分类过程之前,下面的校准过程为了校正所测量的S参数的目的而确定这些误差参数。
步骤#1:对于每个RF通道,将反射对象放置成与天线元件直接接触,以使它的辐射孔无效并产生短路反射。(对于基于孔的天线,例如开端式波导,短路配置可以通过与指定辐射孔重叠的理想E边界条件来实现;对于基于共振的天线,例如偶极天线或蝶形天线,可以通过键合直接连接到它的馈电段的通孔来产生短路配置,使得天线不共振)。
然后,记录来自N端口VNA 104的S
∠S
令P
步骤#2:在成像域内插入均匀和低损耗耦合介质,如在图3b中示意性所示的。该耦合介质的形状应当与天线阵列的形状匹配,并且它的电容率值应当接近被成像对象的平均值,在所描述的实施例中,被成像对象是人头。然后,使用N端口VNA 104来记录S
S
S
其中U(f)表示在特定传播模型中的天线元件的耦合系数,其与单独天线的特性无关。它是与天线互耦不同的概念。耦合系数比的值(|U
其中
前面提到的校准过程确定在系统中的不同RF通道之间的相位和振幅差异。如果通道1被命名为参考通道,则下面的变换函数用于校正由后处理算法使用的测量数据。
在步骤302生成了天线阵列的校准数据之后,该系统可以用于扫描待成像的对象。为了促进该过程,执行如图4所示的模板生成过程400以通过机器学习来生成对象的输入模板416。
模板生成(400)
模板生成过程400基于关于对象的外部和已知特性以及从基于MRI和/或CT的信息的大量样本学习的结构来估计关于对象的内部信息。这样的目的是在所描述的实施例中提供不同头组织的空间分布的地图(map)。如图4所示,模板生成过程400在步骤402通过获取表示头表面的数据和受验者的简历数据来开始,受验者的头将由系统扫描。特别地,受验者的年龄、性别和体重(除了种族和身高以外,如果可得到的话)由用户确定并输入到系统内。在步骤406,系统生成表示受验者的头的外部形状的受验者头数据。在所描述的实施例中,这通过使用3D摄像机108来完成,如图1所示,以生成受验者的头的三维(3D)表面。假发帽或类似物可以用来保持受验者的头发向下。可选地,可以使用天线阵列本身以测量受验者的头的外边界来估计受验者头数据。
在步骤408,系统使用受验者的简历数据和受验者的头的3D被扫描表面来提供基础模板。使用下面的三个选项之一来进行选择:
1.使用实际受验者的头的先前扫描作为模板;
2.使用模板库并通过最近邻来找到与当前受验者最接近的头(基于患者简历数据和头表面);或者
3.使用机器学习来直接预测最可能的头(基于患者简历数据和头表面)。
在选项1中,使用受验者的先前脑扫描。通过执行组织分割和然后组织特性分配(将电容率和电导率的值分配到通过组织分割识别的不同组织)来将扫描数据转换成合适的电磁格式。
在选项2中,系统从头模板的数据库中自动选择相应的头模板,该头模板数据库要么本地存储在系统上,要么经由互联网远程地被访问,使得所存储的头模板(其简历数据和表面与受验者的简历数据最紧密地匹配)被选择为受验者的初始头模板。在所描述的实施例中,这使用本领域中的技术人员已知的标准机器学习方法例如回归或最近邻分类来完成。
在选项3中,所开发的机器学习模型将头的表面和简历数据当作输入并直接学习和预测模板头而没有模板库。这通过训练机器学习模型例如深度神经网络以学习头可以采用的值以及这些值如何根据输入而变化来工作。这可以通过前馈深度神经网络或者通过生成性模型例如生成性对抗网络(GAN)或变分自动编码器(VAE)来实现。
模板的准备
在所描述的实施例中,头模板从MRI数据生成,因为这为建模以及高分辨率组织分布提供大的数据源。在MRI中,不同的强度值基于它们的磁特性对应于不同的组织。这需要转换成用于电磁成像的可用格式,并且MRI到EM转换如下被执行:
1)首先将MRI/CT数据分割到不同的组织内。扫描的方向和强度首先被标准化(例如,通过偏置场校正),且然后脑被分割成脑区域和非脑区域。接下来,基于强度值并使用多组织分割算法例如模糊C均值聚类或FAST来将脑区域分割成三种组织类型(灰的、白的和CSF(脑脊液)),并类似地将非脑区域分割成颅骨区域和皮肤区域。也可以使用深度神经网络方法,例如3D U-Net,并且可以利用多种模式来改善分割。
2)基于在成像的期望频率下的介电特性的表来将组织值分配到不同的组织。
每个模板表示人头的二维或三维模型,定义头的各种组织——包括皮肤、颅骨、脑脊液(CSF)、脑的白质和灰质——的空间和介电特性(电容率和电导率值)。这有效地形成具有对应于相应组织的介电特性(电容率和电导率)的值的像素(2D)或体素(3D)的地图。
在确定了受验者头的三维形状和相应的基础头模板后,在步骤408选择的基础头模板被变换或“翘曲(warped)”,使得它的外表面与受验者的头的被测形状匹配。在所描述的实施例中,这首先通过根据下面的基于表面的配准过程使在基础头模板和真实患者的头表面之间的标志点翘曲来完成。
首先,患者的解剖标志或“基准点”的位置:鼻根点(NAS)以及左耳前点和右耳前点(相应地,LPA和RPA)被确定。这可以使用数字化器或者通过在这三个位置上手动地放置标记并使用基于计算机视觉的标记检测来实现,或者它们可以使用系统的计算机接口来手动地被标记。这些解剖标志或“基准点”使被扫描的表面能够变换成标准化坐标,其中正X、Y和Z将分别经过NAS、LPA和头的顶部。
标志定位:不是遵循在EEG中使用的10-20或10-5的流行配置,而是生成一组更密集的标志,其中标志点基于基准点和3D头表面被提取。从基准点创建几个平面,且在平面和头表面之间的交叉点给出标志位置。所选择的标志点的数量取决于期望密度和准确度,且通常较大数量的点允许有较高的准确度。标志定位的这个过程自动被执行。
翘曲是从经由标志点呈现的被测表面映射到头的例子以便预测被测头的解剖结构的过程。在所描述的实施例中,这使用薄板样条(TPS)翘曲来完成,尽管在其他实施例中弹性翘曲方法可以用作替代方案。然后,因而得到的数据被重新采样到统一的网格,并被转换成用于成像算法的适当格式(例如,转换成CAD模型)。
为了便于将模板与从实际受验者生成的数据一起使用,在模板和患者之间需要一致的坐标(即,体素需要在3D空间中的同一位置上,使得它们可以直接被比较)。在所描述的实施例中,这通过使天线传感器位置与基准点匹配(使用3D摄像机108)来实现。
“选项3”的机器学习模型被迭代地训练以预测头,并且存在需要被优化的相关误差或成本函数。这个成本是在机器学习模型的所预测的模板和真实患者头之间的差异。良好的模型将预测具有低成本的模型,即它预测与真实头非常相似的模板头。然后,可以将该模型应用于在训练数据集中没有的新的未见过的头。
如上所述的准确头模板的生成允许本文所述的成像和分类过程生成脑的更清晰和更高质量的图像,并显著提高脑中风诊断的准确度。
返回到图3的流程图,在步骤306,受验者的头由系统扫描。也就是说,分析部件106指示VNA 104顺序地激励在天线平台(头戴式装置)116内部的天线阵列的天线,使得它们以微波信号的形式生成电磁波并将电磁波发射到受验者的头内并穿过受验者的头,使得它们可以由在受验者的头内的特征散射,并且由在天线平台102内部的天线阵列的每个天线检测到的散射信号和相应的信号被发送到VNA 104用于处理以生成相应的S参数。
本文描述的系统和过程的检测能力、图像分辨率和准确度取决于天线阵列的性能,并且系统的紧凑性和便携性取决于天线阵列和天线组件102的尺寸和重量,天线阵列是天线组件102的一部分。天线阵列是具有宽带和单向电磁特性、具有高前后比(FBR)、同时也是紧凑的具有低剖面的单独天线元件的阵列。这些电磁特性确保EM波进入人头组织内的高穿透深度,导致高信噪比(SNR),其增强来自在脑内部的感兴趣特征(例如中风)的有用反射信号。下面描述的天线组件102及其成像天线阵列满足这些要求。
天线阵列可以以几种形式——包括作为柔性阵列或匹配加载波导阵列——中的任一种被提供。
为了避免在接收到的微波信号中的强杂波效应(其可能引起在最终图像中的伪像),通过以电介质加载的锥形或波状波导天线的形式提供天线来最小化或至少减少天线的相互耦合和头皮肤/毛发反射。
天线具有在它们的端部与被成像头之间的适当柔性耦合垫。此外,它们应该部分地或全部由有损去耦介质包围。为了在天线和头之间的最佳匹配,在天线内部的耦合介质以及在天线和头之间的垫由混合材料(环氧树脂加铝粉或者用于耦合介质的聚酯树脂加铝粉以及用于柔性垫的氰基树脂CR-V加陶瓷粉)形成以具有适当的介电特性(40-50的介电常数和在0.7GHz下小于0.1的损耗角正切),而围绕天线的去耦介质由混合材料(氰基树脂CR-S或氰基树脂CR-U与石墨粉和碳粉)组成,以便具有大于60的高介电常数和在0.7GHz下大于1的高损耗角正切。整个天线阵列应该由吸收器围绕,以保护系统免受周围环境的影响并吸收来自被成像头的任何杂散散射场。天线阵列可以是固定的或可移动的。在后一种情况下,成像域在大小方面将是可变的,且在这种情况下,合适的工具例如位置传感器应该用于确定如数据处理和成像过程所需的天线的确切位置。
为了成功的图像重建,需要知道布置在受验者的头周围的天线的相对位置以确定散射微波信号的相应时间延迟。当头戴式装置由受验者戴着时,天线阵列通常变得与受验者的头共形,但是天线仍然可以具有相对于受验者的头的不同的定向和距离。鉴于此,系统使用从模板生成过程的步骤406获取的受验者的头的3D轮廓和已知的天线阵列配置来计算每个天线的空间位置和定向,特别地,每个成像天线的激励端口,并且这构成被提供到本文描述的s参数处理的先验信息。
确定天线阵列的相对距离和定向的过程包括使用在步骤406找到的基准点,特别是中心点,即Nasion,以在系统被操作之前将头戴式装置与正确的位置对准。因为在头戴式装置中的天线配置的信息是已知的,因此通过使用在步骤406获取的3D头表面,每个天线的相对距离及其朝着受验者的头的定向被确定。
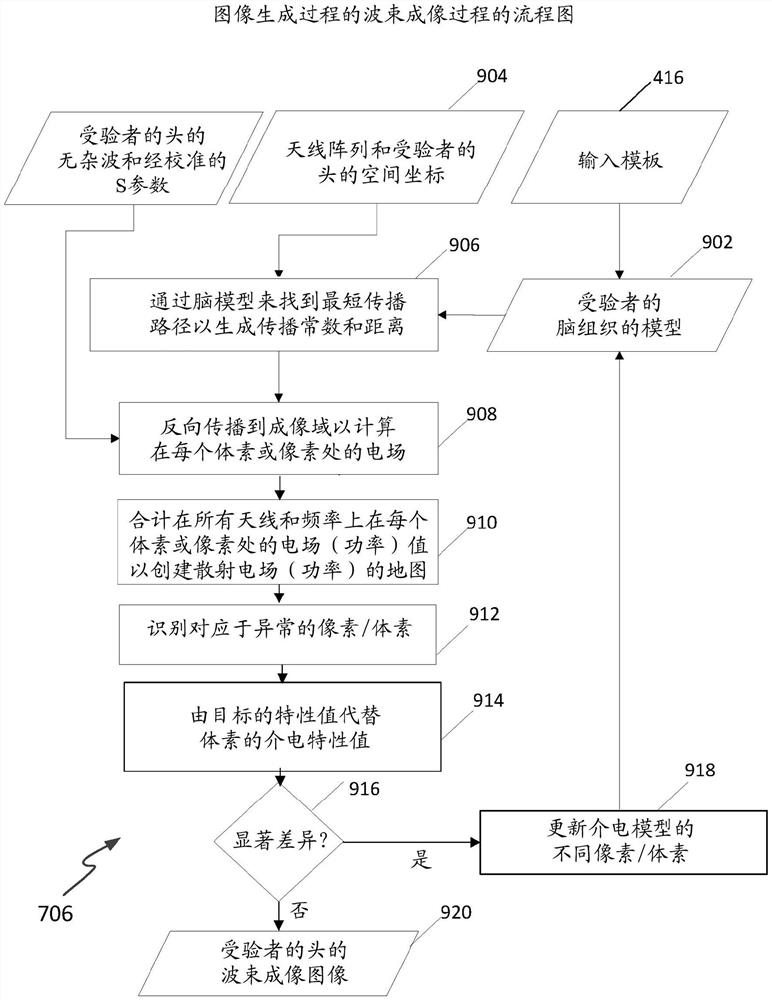
图像生成306/308
在步骤306扫描了头之后,使用组合雷达波束形成和断层扫描的益处且因此发明人称为“波束成像”的图像生成过程308来处理因而得到的散射数据以生成患者的头的一个或更多个二维或三维图像。特别是,这个新过程的使用减少了处理散射数据和生成图像所需的时间,这在紧急情况下是重要益处。
作为概述,由系统执行的图像生成或“波束成像”过程308利用围绕被成像对象的成像天线的被测多静态散射参数来生成二维或三维图像。它还在成像域或者填充有匹配介质或者包含模拟普通人头的模型时利用天线的被测散射参数来校准从受验者的头测量的信号。
平均迹线减法(其中平均被测值(在所有信号上)从在每个频率样本处的每个信号减去)用于从散射数据去除强反射和杂波。作为先验信息,使用最短路径查找技术和健康受验者的所估计的电容率模型(模板)来估计如由每个天线相对于被成像域的每个体素看到的在被成像域内部的波传播路径的有效介电特性。
然后,通过考虑对象的所估计的介电特性以估计在域内部的组织的功率强度来将处理后的数据虚拟地反向传播到被成像域。通过使用来自健康模板的所估计的介电特性和简化的格林函数(Green’s function)来以每个频率步长创建在被成像域内的散射功率强度的空间分布(为了方便起见,在本文也被称为“地图”或“剖面”)。功率强度的针对不同频率的空间分布然后被叠加以生成揭露在被成像域中的异常(如果有的话)的图像。为了确定异常的介电特性,迭代计算过程用于更新健康模板的介电电容率值,并且已更新的特性又用于重新计算功率强度。每对连续迭代步骤的功率强度的比较和电容率地图的更新继续,直到合适的准确度标准被满足为止(例如,当在连续迭代之间的值的差小于阈值时)。
a)校准702
现在更详细地描述图像生成或波束成像过程308。如图7所示,图像生成过程308在步骤702通过使用成像域的被测散射参数校准受验者的头的被测散射参数来开始;即,在没有受验者的头的情况下以及在成像域由具有匹配介质或普通头模型的介电特性的材料填充的情况下。校准过程还减轻例如由于天线制造和组装变化或误差而导致的在天线之间的任何失配的影响。
通过将在成像域中的来自受验者的头的散射的散射参数Smn除以来自背景匹配介质(或校准对象,例如模拟头)的散射参数
其中,m和n是接收机和发射机指数,以及Na表示成像天线的数量。
在一些实施例中,使用数据的对数,如下:
使用散射参数的对数允许数据的振幅和相位差而不是它的实部和虚部被比较。以这种方式,对受验者的头的介电特性的检索有用的相位变化信息被保留。此外,来自不同天线的散射数据变得对称,并适合于在成像过程的下一步骤中的杂波去除。
b)杂波去除704
受验者的头(或待成像的其他医学对象)的外层的介电特性之间的对比使波的大部分被反射回到发射天线,并且这些反射通常足够强以掩蔽来自更深层组织的反射。因此,来自外层的反射应该被去除或者至少被显著减轻以允许在被成像对象内的感兴趣特征的检测。例如可以通过任何合适的方法——包括本领域中的技术人员已知的标准方法,例如平均迹线减法、空间滤波、子空间投影、微分方法或混合杂波抑制——来减轻反射。在所描述的实施例中,在步骤704利用平均减法和微分方法的组合来从经校准的数据去除强反射或“杂波”,如下。
如果在每个天线和对象的外层(即受验者的头的皮肤)之间的距离是恒定的,那么由外部反射产生的信号的贡献对所有天线将是相似的,并且这些反射可以通过从接收到的信号去除恒定值来被分离。从接收到的信号减去计算出的平均值的平均减法过程可以有效地减轻在这种情形中的反射。然而,使用波导天线,提供在天线和受验者的头的皮肤之间的均匀距离通常是不切实际的。虽然如此,下面描述的杂波去除过程可以应用于来自具有到皮肤的相似距离例如0-10mm的天线的信号。特别地,天线信号基于它们到皮肤(或者如果待成像的对象不是人头,则到外层)的距离来被分类,并且在每个类别Ci中的所有接收到的信号的平均值在每个频率步长处从天线的相应信号减去:
其中,
c)波束形成706
通过消除边界反射,可以将被成像域考虑为均匀介质。在步骤706,无杂波和经校准的散射参数通过频域波束形成器,如图8所示,以根据位置对接收到的信号成像。在波束成像过程中,如图9所示,通过对麦克斯韦方程(Maxwell’s equation)求解来计算在被成像区域中的散射功率强度,并通过合计在所有频率样本和天线位置上的计算出的功率强度来估计总功率。作为在健康和不健康组织之间的显著电容率对比的结果,在因而得到的图像中的高能级的区域对应于不健康组织。
在图10中示出成像域的示意性表示,其中电磁波从发射机n传播到具有未知介电特性(电导率ε和电容率σ)的对象。然后,来自在被成像域内部的不同点散射体的散射场由在成像域的边界外部的天线m测量。
在波束成像过程706中,通过估计在散射体的位置处的电场来计算在点散射体p的位置处的电场Ep。为此目的,在每个接收天线处的目标响应与入射场相关,并合成地反向传播到被成像域。在散射体的位置处的电场然后被计算如下:
其中G是点散射体的二维或三维格林函数,r=|rnp|+|rpm|是从发射天线到点散射体并接着到接收天线的距离,以及γ是波通过的介质的传播常数,并通过下式被计算:
其中
点散射体电场Ep不同于在常规电磁估计(E
E
以及
E
在离散射体的远场距离r(r>2D2/λ,其中D是点散射体的直径,以及λ是在被成像域内部的有效波长)处的电场表现为球面波,并且均匀平面波方程被控制。因此,对应于方程(4)的麦克斯韦方程是:
对应于ansatz的径向部分G(r)的微分方程是贝塞尔微分方程(Besseldifferential equation):
其中复数形式的解由下式给出:
其分别是第一类和第二类的i阶汉克尔函数(Hankel function),以及J和N分别是第一类和第二类的贝塞尔函数。由于第二类的贝塞尔函数(也被称为诺依曼函数(Neumannfunction))的奇异性的存在,汉克尔函数是奇异的。
在杂波去除之后,一阶(i=1)贝塞尔函数是主导模式,并提供最佳解。因此,可以通过将来自方程(12)的格林函数分配到方程(4)中来计算点散射体场:
E
其中贝塞尔函数J1(γr)可以用它的多项式近似代替:
当成像域由匹配介质填充时,点散射体场
其中γb是背景的传播常数,以及
在点散射体场的计算中,散射场被考虑为反射波,其叠加在背景介质中的前向波上。因此,与散射体相关联的反射系数可以被定义为:
其中*表示共轭运算。因此,由于由第n个天线发射并由第m个天线接收的波引起的在点散射体的位置处的散射场由下式给出:
在多静态成像配置(其中Na天线既充当发射机又充当接收机)中,计算由在每个散射体的位置处的所有天线产生的总功率密度(“密度”,因为它是每像素面积或体素体积计算的)以估计任何异常的位置。为此目的,通过合计在被成像对象内部的来自在对象周围的不同发射机和接收机的所估计的电场来计算总功率密度,如下:
入射场En通常被选择为1(伏特/米),因此,它在方程(18)中的计算中被忽略。为了补偿离散观察点的缺乏,对于不同频率的不同散射剖面被叠加以生成电磁功率图像,如下:
其中,Na和Nf分别是天线的数量和频率样本。
在点散射体处的平均电场也可以通过下式被计算:
在这种情况下,平均场
为了完整起见,也可通过将三重求和算子改变为在方程(19)和(20)中的二重求和来在单静态测量配置中使用所述过程,如下:
所描述的过程还可以用于通过使用在被成像对象周围的3D天线阵列配置来生成3D图像。在这种情况下,点散射体位置rp表示在被成像对象的体积中的3D向量。可以通过在2D成像平面上方和/或下方添加天线的更多环或者通过沿着z方向移动天线以扫描整个对象来创建3D天线阵列。在任一布置中,内插技术用于生成对象的3D图像或多层图像。
尽管上述过程没有提供介电特性的详细图像,但是它确实显示了介电特性中的对比的区域,这对于重要散射体及其近似位置的快速检测是足够的。如果需要,该过程可以被扩展以生成详细图像,如下所述。
波束成像过程706的一个重要方面涉及在方程(19)和(20)中使用的传播常数的计算。可在传播模型中使用成像域的平均介电特性。然而,为了创建异质对象例如人体的更准确的图像,需要在成像域中的介电特性的更准确的所估计的空间分布。
由于在分散和异质环境中的电磁波的多次反射和折射,根据发射机-接收机相对于被成像对象的位置,波穿过不同的组织并沿着不同的路径而行进。在同质环境中,该路径可以被计算为从每个发射机到点散射体以及从点散射体到每个接收机的直接(直)路径(最短路径)。然而在异质介质中,电磁波以最小传播时间或最小延迟沿着路径而行进。因此,在步骤906可以通过找到在被成像对象内部的具有最小传播时间(t=γr/ω)的路径来找到波传播路径,提供在方程(19)和(20)中的传播常数和距离的所需值。为此目的,包括被成像对象的解剖和介电特性的模板被认为是有益的。该模板可以是从其他成像模式(例如MRI和/或CT设备)的图像提取的被成像对象的实际健康模型,或者是使用被成像的3D头轮廓412的近似模型。
然后利用最短路径查找方法来找到在模板内部的波传播路径。在该过程的所述实施例中,利用狄杰克斯特拉算法(Dijkstra algorithm)。通过将从体素v传播到它的相邻体素u的波的传播时间(tuv)定义为成本函数,最短路径查找算法通过模型来找到具有最小成本(传播时间)的路径。作为结果,由每个发射-接收天线对γmn(rp)看到的被成像域的位置特定传播常数被估计。然后通过合计沿着从发射机n到接收机m的传播路径的所有体素的γrs来计算在方程(19)和(20)中利用的传播距离参数γr,如下:
其中,γuv和ruv分别是传播常数和从体素v到它的相邻体素u的距离。因此,成像过程的主方程是:
另一方面涉及更新(例如,健康的)受验者的脑组织的模型(最初从初始模板生成或作为初始模板)以估计在被成像对象内的异常的介电特性。由方程(22)或(23)创建的图像显示重要散射体(异常)的位置。因此,可以通过改变对应于异常位置的体素的特性值来简单地更新在初始步骤中使用的健康模型。在这种情况下,可以使用任何合适的技术例如找到局部最大值、阈值化、微分(减去后续图像)、聚类和诸如此类来确定异常的位置。在一些实施例中,利用阈值化过程,其中生成由方程(22)或(23)生成的图像的直方图,并且将直方图的标准偏差视为阈值T。然后根据下列条件确定异常的位置:
如果I(体素)>T,那么体素∈“不健康组织”,否则体素∈“健康组织”
在找到不健康组织的位置之后,通过由目标的特性值代替与在模型中的异常的位置对应的体素的电容率和电导率值来更新介电模型。可选地,优化技术可用于根据下式来递增地改变健康组织的值:
ε
然后在已更新的模板上执行最短路径查找过程以计算新的位置特定传播常数。新的传播常数然后被代入方程(22)或(23)内以估计对象的新散射剖面。这个迭代过程重复,直到已更新的值相对于它们在前一迭代中的值没有明显改变为止,如图9所示,指示误差已经达到小的值。
迭代循环的可选的停止标准是比较计算出的和在天线中的所测量的电磁能量。当天线n向被成像对象发射电场时,电场在被成像域中被散射并由所有天线接收。因此,由在对象周围的天线接收的总电场是来自在该域中的不同散射体的散射电场的总和。因此,可以将由所有天线测量的总能量与计算出的散射能量进行比较,以找到在所利用的模板和实际被测对象之间的能量失配ΔS,如下:
其中Np是在被成像域中的散射点的数量。然后可以利用迭代过程以通过优化来最小化能量失配ΔS。
作为总结,波束成像过程可以由以下步骤表示,如在图9的流程图中所示的:
步骤906:健康对象的输入模板416(在所描述的实施例的上下文中,是对象的头)定义对象的可更新模型902的初始值;该模型902和天线相对于受验者的头的位置904被处理以通过最短路径查找方法来计算对象的位置特定传播常数
步骤908:对象的经校准和经杂波去除的散射参数被反向传播到成像域以估计在成像域内的每个像素(或体素,如果是3D)处的电场
步骤910:每个像素(或体素)处的电场功率密度(在所有天线上被合计)被计算并在每个发射频率上被合计,以生成对象的功率密度地图或图像(即,表示在对象内的散射电场功率的空间分布)
步骤912:确定任何异常(重要散射体)的像素/体素位置(例如,通过使用阈值化技术)
步骤914:复制模型902,并且通过替换对应于异常位置的像素/体素的值来更新该模型的副本
步骤916:执行测试以确定在两个模型之间是否存在任何显著差异;如果该测试确定在模型之间存在显著差异,则该过程分支到下面的步骤918
步骤918:该过程循环回以通过使用已更新的模型来在步骤906重新计算传播常数和距离
否则,如果在步骤916的测试确定在当前模型902和最近更新的模型之间没有显著差异,则后者被输出作为对象的波束成像图像920。
将明显的是,在步骤916的测试定义了迭代循环的终止或退出标准,且因此波束成像过程706是迭代过程。
在步骤910生成的功率密度图显示在脑中的异常的位置。例如,出血性中风在高强度的情况下表现为清晰的,而凝块表现为与其邻近组织相比的最低强度区域。可疑区域的高强度是它是出血区域的指标,而缺失的异常或当中风的症状持续时的低强度指示血凝块。
受验者的头的最终波束成像图像920可以仅表示被成像区域的电容率和/或电导率,或者它可以被更新以包括定义一个或更多个感兴趣组织特性(例如水含量)的位置和/或一个或更多个相关标签(例如,组织是否是异常的等)的数据。
d)优化
如果需要,可以通过减少频率样本的数量来加速波束成像过程706,假定这可以在不损害(或过度损害)图像质量的情况下完成。为此目的,可以在频域中应用奈奎斯特定理(Nyquist theorem)以找到用于重建采样的最大频率步长(以及因而频率样本的最小数量)。鉴于接收到的信号的时间限制特征,在频域中应用奈奎斯特定理。
根据奈奎斯特定理,为了理论上能够恢复整个数据,采样步长δf应小于1/2τ,其中τ是时间限制信号的时间宽度。如果奈奎斯特标准未被满足(欠采样),数据的一部分将被遗漏,引起所重建的信号的重叠并导致具有不正确的和/或多个目标的图像。过采样(以高于奈奎斯特速率的速率采样)可以提高分辨率并避免重叠,但需要用于测量和用于处理的额外时间。通过考虑接收到的信号的时间宽度等于数据采集时间并根据信号带宽B,样本的最小数量可以被计算为:
在成像过程中使用最小数量的样本显著减少处理时间,同时保持准确的成像。
本文描述的波束成像过程706与标准微波断层扫描明显不同,标准微波断层扫描通常需要解决不适定的(ill-posed)逆问题来估计组织的介电特性。与时域方法(例如共焦、空间-时间波束形成MIST和自适应波束形成成像方法)相比,本文描述的波束成像过程706在计算上较不密集,并且在频域中执行它的所有计算,使它变得更不受噪声和由多层结构产生的多次反射的影响。
受验者的头的最终波束成像图像920显示在脑中的任何异常。例如,出血性中风在高强度的情况下表现为清晰的,而凝块表现为与其邻近组织相比的最低强度区域。可疑区域的高强度是它是出血区域的指标,而缺失的异常或当中风的症状持续时的低强度指示血凝块。图像可以仅表示被成像区域的电容率和/或电导率,它可以被更新以包括定义一个或更多个感兴趣组织特性(例如水含量)的位置和/或一个或更多个相关标签(例如,组织是否是异常的等)的数据。
分类312
确定中风是否由出血或凝块引起以及找出它的位置对急性中风的诊断和治疗很重要,且也是在中风后管理中的关键问题。一般来说,从电磁头扫描系统识别中风亚型是基于图像重建算法。然而,基于图像的方法是耗时的且具有低准确度。下面描述了应用于电磁扫描系统以从缺血性中风(IS)识别颅内出血(ICH)并找出中风位置的新颖的复杂网络方法。该分类基于使用图度互信息(graph degree mutual information,GDMI)来评估在ICH和IS组之间的差异,其中每个受验者由多通道天线接收信号组成。每个信号被转换成图形以避免不同的信号振幅。然后,在每对图度特征之间的关系通过互信息被计算,并被输入到支持向量机以从ICH识别ICH。在为IS识别ICH时实现95%的准确度。关于定位,应用加权图以提取在天线对之间从发射机到接收机的强度特征。最大加权对将穿过目标。用于图形特征提取和分类或定位的执行时间小于一分钟,其适合于中风紧急治疗系统。
1.方法的概述
图11是在分类和定位之前的数据处理和分析步骤的流程图。在这种情况下,系统工作流程可以被总结如下:
1.如图1(a)所示,从天线阵列接收多通道输入信号,其中通道的默认数量N是16。
2.从每个天线接收的散射信号是频域信号(振幅和相位)或时间序列,其中样本点的数量大于700。
3.如果输入不已经是时间序列,则逆FFT用于将这些信号转换成多通道时间序列。
4.接下来,使用在G.Zhu、Y.Li和P.P.Wen的“Epileptic seizure detection inEEGs signals using a fast weighted horizontal visibility algorithm”(Computermethods and programs in biomedicine,第115卷,64-75页,2014年)中描述的快速加权水平可见度算法(FWHVA)来将多通道时间序列映射到NxN=16×16=256个图形。
5.如图16(b)所示,提取度序列和加权强度序列。
6.最后,输出特征:度和强度分别用于分类和定位。
图12是图11的过程之后的分类过程的流程图。
图13是图11的过程之后的定位过程的流程图。
2.详细的分类方法
为了补充指示患者是否有中风的输出图像920,执行分类过程以使用S参数来评估中风类型。此外,如下所述的模板和融合的脑图像可以用于提高准确度。一般来说,特征可以通过相关、相干或同步算法被计算,并被转发到通用分类器(例如SVM或随机森林)或者通过深度学习神经网络被转发以将受验者识别为ICH、IS或健康的。
在所描述的实施例中,复杂网络方法在步骤312用于使用所测量的S参数来评估中风类型。分类过程312不仅能够区分开ICH、IS和健康的人,而且能够找出中风位置。
图12是分类过程312的流程图。散射场数据(S参数)在频域中从N个天线被收集,导致N×N个信号。然后,逆FFT将N
其中e
在每个图形被构建之后,节点度和度序列特征用于表征该图形。节点v
一旦构建了图形,就计算在每对图形之间的图度互信息。互信息(MI)通常用于测量随机变量对另一个变量的相互依赖性。给定两个离散变量X和Y,X和Y的互信息由下式给出:
其中p(x)是X的概率密度,以及p(x,y)是X和Y的联合概率分布函数。通常,如果X和Y是相依的,则MI较高。在所描述的实施例中,不是计算复杂的图形之间的互信息,而是系统使用在本文被称为图度互信息(GDMI)的更简单和更快的方法,其比较两个图形的度序列。给定两个度序列,两个HVG、Gx、Gy的DSx、DSy,两个图形的图度互信息(GDMI)被测量如下:
GDMI(Gx,Gy)=MI(DSx,DSy) (3)
如果Gx和Gy是相似的,则相应的GDMI(Gx;Gy)较高;否则,如果Gx和Gy是不同的,则该值较低。
在将图度序列的每个组合输入到方程(3)内之后,获得N
为了将中风类型(出血/凝块)分类,使用支持向量机(SVM)分类器。SVM成功地用于将与嗜酒者和睡眠EEG信号相关联的HVG特征分类。它们可以通过选择不同的核函数来既执行线性空间辨别又执行非线性分类,这些核函数可以是线性的、多项式核、径向基函数(RBF)或反曲的。所描述的实施例使用具有RBF核的SVM算法。训练集首先用于使用多类SVM来学习在两种中风类型的特征之间的决策超平面,并且可选地学习健康情况,然后被应用来根据新的测量值将中风类型分类。
分类过程312是快速和可靠的,因为它标准化不同头尺寸的数据。目前,使用通用计算机,计算速度小于一分钟(挂钟时间)。如下所述,分类过程312还可以基于所生成的时间序列和天线交叉点来找出中风。
3.详细的定位方法
为了执行定位,发明人注意到包含中风的脑具有在所发射/接收的信号中的不平衡。假设头横越主轴和次轴(即,横越分离脑的左和右的矢状面以及横越分离脑的前和后的中心冠状面)是近似对称的,横越这些对称线的对称天线对在健康的头内应该具有相似信号。如果对称天线对测量不同的信号,这指示异常,例如中风,且这个观察可用于便于定位。
图17示出了具有天线信号对和中风1702的由16元件电磁成像天线阵列围绕的脑的横截面。由于仅仅一个信号穿过中风,来自天线对(1-7)的信号将与它的对称对(1-11)明显不同。然而,1-13和1-5天线对应该具有相似的接收信号。最大权重对将横越中风目标。给定16元件天线阵列,脑的两个近似对称轴对应于发源于天线1、5、9和13的信号。
为了执行定位,计算加权水平可见度图(w-HVG)。时间序列到未加权图转换但具有初始权重项的过程如上所述,且因而得到的图形被表示为G(V,E,W)。在节点v
加权图以强度的概念为特征,其中节点v
对于具有T个节点的加权图,它的平均强度被定义为:
微分加权强度被定义为:
其中,
可以使用下面的方程(9)来检测从第i个天线穿过中风目标的天线对,其中“%”指模运算符。注意,不考虑邻近的天线,因为从它们获得的信息少于从更远地间隔的天线获得的信息。
当输入信号包含来自脑模板的信号时,可以通过计算几何方法来获得中风的真实位置。首先,可以基于方程(10)用天线位置的四个点(x1,y1)、(x2,y2)、(x3,y3)和(x4,y4)来计算交叉点。
然而,方程(9)无法足以识别哪个半球具有目标,所以检测血癖是在左半球还是在右半球中的一种自然方法是通过比较来自左半球信号的特征(例如振幅、平均度或强度)和来自右半球信号的特征。然而,由于头并不总是完全对称的,这种方法可能很少提供完美的答案。为了解决这个困难,本文描述的过程使用对置的一对天线5(左半球)和13(右半球)来检测交叉点是否应该被放置在左边或右边。相关的过程步骤可被描述如下:
(a)基于方程(10)和(11)来计算左交叉点L0(lx,ly)。
(b)基于方程(10)和(11)来计算右交叉点R0(rx,ry)。
(c)画一条从天线5到在右侧上的天线R1的线段,天线R1不是第13个天线。线段具有到与第13个天线隔开的L0的最小距离。
(d)拾取R1的邻近天线R2,R2到天线5的线段远离L0和R0。
(e)计算从第5个天线分别到R1和R2的微分加权节点w5r,其中w5
(f)类似地,对于天线13,运行步骤c至e以获得从第13个天线分别到两个相邻天线L1和L2的微分加权节点w13。
(g)如果w5
图21是由天线围绕的受验者的头的示意性横截面平面图,示出了过程步骤(a)至(g)。在(5,R1,R2)之间的微分加权节点与在(13,L1,L2)之间的微分加权节点显著不同,为出血位置提供两个可能的候选(L0或R0)。按照上面的步骤,可以确定出血位于左半球中(在L0而不是R0处)。
图19是定位过程的流程图。定位过程的输出是包含天线对及其相应的所分配权重的集合。每个权重对应于信号通过异常(例如中风)的概率,其中较大的值指示在天线对之间的信号以高概率通过中风。因此,定位过程可以确定其信号穿过异常的那些天线对,并且这可以用于使临床医生确定脑模板内的真实位置。
通过将信号与脑模板组合,可以使用几何方法来计算中风的真实位置。给定根据高微分加权节点值DW而包含异常的两个独立天线对,确定在天线对之间的交叉点以找出中风/异常。也就是说,中风位置可以作为在位置(x1,y1)和(x2,y2)处的天线对之间的线与在位置(x3,y3)和(x4,y4)处的天线对之间的线的交叉点被发现。如图19所示,对于3个天线对的例子,这种交叉方法可以扩展到额外的天线对。定位的输出是基于脑模板和高度加权的天线对集合的在脑中的真实位置。
局部区域断层扫描314
作为最后的验证,使用融合图像310作为初始图像,微分方程断层扫描可以在步骤314用于局部区域断层扫描。特别地,在标题为“Atomographic imaging system andprocess”的国际专利申请号PCT/AU2018/050425中描述的微分方程断层扫描方法用于确定由波束成像过程308在不同频率下识别的可疑区域的精确介电特性,且然后这些所确定的特性用于确定异常的类型。例如,较高的介电特性(主要是电容率)指示出血,而较低的值指示凝块。在所描述的方法中,融合图像被更新以包括由微分方程断层扫描方法确定的可疑区域的更准确的介电特性。
如在该专利申请中所述的,主要由于对格林函数的需要,标准的基于积分的微波断层扫描遭受计算限制。这些限制阻止图像重建过程的快速性,而快速性是中风检测中紧急医疗需求的重要需求。为了应对这些限制,通常利用明显的近似。这些近似包括将成像天线考虑为点源(这使得问题变得欠定),假设沿着域的坐标轴之一的均匀性,以及需要背景匹配介质。这些近似导致具有某个水平的误差的仅仅二维图像的重建。为了减轻上面提到的限制和作为结果的挑战,在这个项目中利用在波和第三麦克斯韦方程上建立的基于微分方程的微波断层扫描。所提出的方法独立于格林函数及其相应的限制。该方法可以通过解决线性和所确定的问题来快速重建真实三维图像而没有对上述近似的任何需要。
如果因而得到的分类不同于由分类器312给出的分类,则本领域中的技术人员已知的“矛盾证明”方法被应用来获得可靠的决策。按照这种方法,断层扫描过程再次被执行,但是这一次以分类器输出开始。相对于导致第一个不同答案的初始收敛速率来比较成本函数在局部区域断层扫描的第二次执行中的收敛速率。达到较低误差程度的收敛速率最有可能是正确的诊断。然而,在两种方法收敛到相同的误差级别的情况下,使用另一优化方法,例如牛顿法、共轭梯度法或对比源法。
在任何情况下,使用修改的积分断层扫描过程316来验证该决策,如下所述。
全局断层扫描316
最后在步骤316,基于修改的基于积分的断层扫描的全局断层扫描过程被应用于初始脑模板以验证在整个脑(包括可疑区域)中的介电特性。
常规的基于积分的断层扫描方法可以被分类为三种类型,取决于它们是否基于玻恩近似(Born approximation)、牛顿迭代法(扭曲玻恩近似)或对比源反演(CSI)。由于高准确度和低计算成本的期望特性,基于CSI的方法正吸引对EM断层扫描的更多兴趣。传统的CSI方法包括两个优化步骤:第一步骤优化对比源,而第二步骤基于来自步骤1的最佳对比源来优化对比度函数。最佳对比度函数提供成像区域的电容率和电导率信息,这是所需的最终解。
根据基于CSI的方法的很多研究,发明人发现步骤1中的对比源的优化比步骤2中的对比度函数的优化容易得多。因此,在本文描述的过程中,仅使用共轭梯度法来优化对比源。在最佳对比源被获得之后,脑模板用于使用FDTD/MOM正向解算器来计算总电场。因为对比源是对比度函数和总电场的乘积,计算出的电场可用于从优化的对比源提取对比度函数。
该方法的公式化和程序可被总结如下:
1.通过使用共轭梯度法来重建对比源。
其中w是对比源,G是格林函数,以及S是接收到的信号(S参数)。
2.使用脑模板和FDTD/MoM解算器来计算总电场:
E
其中E
3.通过使用w和E
其中χ是包含电容率和电导率信息的脑的对比度函数。
所描述的过程提供了三个主要优点:
1.与对比度函数的优化相比,对比源的优化更快地且以更大的准确度收敛;
2.使用脑模板计算的总电场通常可用于表示当异常组织(例如出血或凝块)出现时的电场。因此,在中风情况下电场的优化不是必需的。
3.通过使用对比源和脑模板的电场提取对比度函数是简单和稳定的。
上述方法使用单个频率来重建脑的电特性。然而,由于生物组织的分散特征,多频方法提供关于生物组织的电特性的更多信息。因此,发明人还开发了基于多个频率的全局断层扫描方法。特别地,已经开发了基于多频的四种方法,如下所述。
1.微分求和与平均法(DSMM)
第一种方法是合计在不同频率下的所重建的电导率并计算平均值。假设在频率f
χ
其中χ
其中,N是频率样本的数量。
2.相关系数方法(CCM)
所描述的相关系数方法可用于估计两组信号的相似性。接近于1的相关系数的值指示与原始信号之间的高相似性,而接近于0的值指示不相似性。该方法计算在患者和模板的所重建的电导率分布之间的相关系数地图。包含中风的区域将呈现高的不相似性(低相关系数),而没有中风的区域将呈现高相似性(高相关系数)。所重建的对比度分布的相关系数被计算为:
其中s和s
3.基于微分熵的方法(DEM)
熵是随机变量的不确定性的度量。当实验的结果是等概率的(换句话说,概率分布是均匀的)时,熵的最大值被获得。相反,最小熵值暗示某个事件已经出现。因此,熵值也可以用来衡量在两组信号之间的相似性。在患者的所重建的对比度和相应模板头之间的低熵值暗示中风区域,而高熵值暗示正常区域。在由本文描述的系统使用的方法中,Rényi熵在阶数50的情况下被使用。微分对比度的Rényi熵被计算为:
其中,
4.混合方法
基于使用上述DSMM、CCM和DEM的结果,发明人发现不同的方法具有它们自己的优点和缺点。特别是,DSMM能够以可期望的形状重建来找出中风的位置,然而,当与来自CCM和DEM的结果比较时,伪影簇是严重的。CCM能够去除伪影簇;然而,中风的位置可能移动,且因此准确的定位不能被实现。最后,DEM能够在抑制伪影簇的同时准确地找出中风位置;然而,中风区域的形状遭受失真。鉴于上述内容,发明人已经开发了组合这三种方法的混合方法,使得每种方法的优点可以被提供。这些混合方法中的最简单的方法合计从每种方法获得的结果以根据下式提供混合图像:
图像融合(310)
返回到图3的流程图,为了提供来自系统的单个输出图像以帮助脑中风或外伤的诊断,在步骤310,图像融合过程310生成受验者头的合成图像。融合过程组合头模板、波束成像图像和基于多频雷达/断层成像的图像的互补特征,如图20所示。融合使头模板的头边界和高分辨率细节能够与波束成像的目标检测和基于断层扫描的方法的介电特性估计/细化组合。
几种技术可以用于图像融合。一种方法涉及基于小波或多尺度特征来组合图像。在基于多尺度变换的融合中,一个图像的高频分量(属于有用的图像细节,例如“边缘”)通过多尺度变换被提取,且然后与另一图像组合(例如通过替换、添加或选择方法)以生成融合图像。其他方法基于训练机器学习模型来处理在图像内的特征,并决定哪些特征是要保持的有用特征。这可以通过模型例如人工神经网络(ANN)来实现。存在用于图像融合的许多其他方法。每种融合方法具有它自己的对融合过程有利的优点。例如,基于多尺度变换的方法适合于多光谱图像,并产生具有更详细特征的更好的频率分辨率输出。ANN由于它们在不经受复杂计算工作量的情况下融合图像的能力而对图像融合是有吸引力的。然而,由于分辨率的限制或对高质量训练数据的要求等,单一技术的使用可能是不可取的。因此,虽然使用单一方法产生有希望的结果,但是组合各种技术的优点的方法对于更有效的融合是可取的。
在本文描述的系统中,优选地使用用于图像融合的混合过程,其涉及几种不同的融合方法来处理图像、提取重要特征和从不同的头成像模式(即,波束成像、断层扫描)去除噪声。来自不同的单独融合技术的结果然后被组合以构建融合图像。集成过程组合来自各种方法的结果,并确保最终融合图像继承每种融合方法的优点。与原始图像相比,它定量和定性地提高了融合图像的质量。此外,为了进一步提高融合图像的准确度,在该融合策略中还使用患者特定的头模板。当来自波束成像和断层扫描的输入显示由电磁信号照射的内部组织的信息时,头模板基于患者的实际3D头表面来提供外部头层的信息。更重要地,模板中还包含脑组织的相对分布。因此,它可以与从波束成像和断层扫描提取的特征结合来使用,以增强在最终融合图像中的内部脑组织的视觉表示。
许多修改对本领域中的技术人员将是明显的,而不偏离本发明的范围。
- 医学成像装置和用于运行医学成像装置的方法
- 用于检查对象的体积的医学成像装置和医学成像方法
