工程化的遗传调节物
文献发布时间:2023-06-19 12:02:28
相关申请的交叉引用
本申请要求2018年10月2日提交的美国临时申请No.62/740,156的权益,其公开内容以其整体通过引用合并于此。
技术领域
本公开内容是用于使用包含两个或更多个人工转录因子的遗传调节物调节基因表达的组合物和方法的领域。
发明背景
通过使用工程化的转录因子已经实现了疾病相关基因的抑制或激活。已充分证明了设计和使用工程化的锌指转录因子(ZFP-TF)的方法(参见例如美国专利号6,534,261),并且也已经描述了转录激活子,如效应子转录因子(TALE-TF)和基于的成簇的规则间隔的短回文重复序列Cas的转录因子(CRISPR-Cas-TF)也已被描述(参见综述Kabadi和Gersbach(2014)Methods69(2):188-197)。例如,也已显示抑制基因表达的工程化TF(阻遏物(repressor))有效治疗三核苷酸病症(disorder),例如亨廷顿病(Huntingtin’s disease)(HD)(参见,例如美国专利号8,956,828和美国专利公开号2015/0335708)以及诸如阿尔茨海默氏病(Alzheimer’s disease)(AD)之类的tauopathies(参见美国公开号20180153921)。
然而,仍然需要另外的方法和组合物,其为基因表达的调节提供增强的活性和/或特异性。
发明概述
本文公开了包含两个或更多个人工转录因子的遗传调节物以及制备和使用这些遗传调节物用于治疗和/或预防疾病的方法。特别地,遗传调节物组合物包含多个(两个或更多个)人工转录因子,其中每个人工转录因子包含DNA结合结构域和功能结构域。令人惊讶且出乎意料的是,与包含单个人工转录因子(包括相同剂量或2倍剂量)的组合物相比和/或与使用多个人工TF的任何预期累加效果相比,由多个人工转录因子组成的遗传调节物在以下一种或多种中提供了意想不到的协同作用:特异性和/或活性。包含多个人工转录因子的遗传调节物调节基因表达并限制脱靶事件,从而实现治疗效果,例如抑制突变亨廷顿病(Htt)基因表达用于治疗亨廷顿病(HD)、抑制突变C9orf72等位基因用于治疗肌萎缩性侧索硬化症(amyotrophic lateral sclerosis)(ALS)、抑制朊病毒(prion)蛋白表达用于治疗朊病毒疾病(prion disease);抑制α-突触核蛋白(synuclein)用于治疗synucleinopathies,例如帕金森氏病(PD)和/或路易体(Lewy bodies)痴呆(DLB)和/或抑制MAPT基因表达,用于治疗tau病变(tauopathy),例如AD、FTD、PSP、CBD和/或癫痫发作。因此,本文提供了用于体外、离体和体内调节基因表达的方法和组合物。
在一方面,本文描述了遗传调节物,其包含两个或更多个(多个)人工转录因子,其中当与每个个体人工转录因子单独施用时的基因表达水平相比,所述遗传调节物以较高水平(约1至10或更高倍)调节基因表达(激活或抑制)。因此,与单个转录因子相比以及与使用转录因子的组合的基因调节的预期(例如累加)水平相比,遗传调节物表现出协同作用。在某些实施方案中,遗传调节物包含2、3、4、5或更多个人工转录因子,每个人工转录因子包含(i)任何DNA结合结构域(例如,锌指蛋白(ZFP)、TAL效应子结构域、CRISPR/Cas系统的sgRNA等),其结合12个或更多(例如12、13、14、15、16、17、18、19、20、21、22、23、24、25或更多个)核苷酸的靶位点和(ii)功能结构域(例如,转录激活结构域,转录抑制结构域,来自DNMT蛋白的结构域,组蛋白脱乙酰基酶(histone deacetylase)等),使得遗传调节物调节基因表达。
如本文所述的人工转录因子的DNA结合结构域可以结合任何所选靶基因中至少12个核苷酸(连续或非连续)的任何靶位点。此外,人工转录因子的DNA结合结构域可以结合相同、不同或重叠的靶位点。在某些实施方案中,DNA结合结构域结合不同的,不重叠的靶标。或者,在一些实施例中,至少两个DNA结合结构域结合重叠的靶位点。在其他实施方案中,DNA结合结构域结合彼此约800个碱基对内的靶位点。在其他实施方案中,DNA结合结构域结合彼此约10,000(或更多)个碱基对内的靶位点。仍在进一步的实施方案中,DNA结合结构域结合在转录起始位点(TSS)的任一侧附近(例如,在0至约600个碱基对之内(或其之间的任何值内)),包括待调节靶基因的0-约300个碱基对(或其之间的任何值)、0至大约200(或其之间的任何值)或0-大约100个碱基对(或其之间的任何值)。人工转录因子的一些或全部DNA结合结构域结合双链靶标(例如,内源基因)中的有义链;一些或全部可以结合反义链;或者一个或更多个可以结合有义链,而一个或更多个可以结合反义链。
本文所述的组合物可以靶向任何基因用于调节(例如,抑制)。在某些实施方案中,靶基因是tau(MAPT)基因或Htt基因。在一些实施方案中,靶标是突变C9orf72基因。在其他非限制性实施方案中,靶基因是SNCA基因、SMA基因、ATXN1基因、ATXN2基因、ATXN3基因、ATXN7基因、PRNP基因、Ube3a-ATS编码基因、DUX4基因、PGRN基因、MECP2基因、FMR1基因、CDKL5基因、LRKK2基因、APOE基因、RHO基因或其中想要调节基因表达的任何基因。DNA结合结构域的任何组合都可以用于本文所述的遗传调节物中(例如,ZFP、TALE和/或sgRNA的任何组合,重叠和/或不重叠的靶位点,与TSS的接近性,结合的有义或反义链,等)。
在某些实施方案中,遗传调节物的人工转录因子的一个或更多个DNA结合结构域包含ZFP以形成ZFP-TF。本文所述的任何锌指蛋白可包括1、2、3、4、5、6个或更多个锌指,每个锌指均具有识别螺旋,该识别螺旋与所选靶序列(例如,基因)中的靶子位点结合。靶子位点可以是连续的或不连续的。在某些实施方案中,遗传调节物包含多个ZFP-TF,例如多个ZFP-TF阻遏物。ZFP可以结合所选基因中的任何靶位点。
在其他实施方案中,遗传调节物的人工转录因子的一个或更多个DNA结合结构域包含TAL效应子结构域蛋白(TALE),以形成TALE-TF,其中重复可变双残基(RVD)区域与12个或更多核苷酸的所选靶位点结合。在一些实施方案中,至少一种RVD具有非特异性DNA结合特征。仍在进一步的实施方案中,本文所述的遗传调节物的人工转录因子的一个或更多个DNA结合结构域包含与所选靶序列结合的单个指导RNA(以形成CRISPR/Cas-TF系统)。DNA结合结构域可以全部是相同类型的,或者可以包括具有不同DNA结合结构域的人工转录因子。因此,本文所述的遗传调节物的两个或更多个人工转录因子可以是相同类型的(例如,所有ZFP-TF、所有TAL-TF、所有CRISPR/Cas-TF)或可以包括不同类型人工转录因子的组合(例如ZFP-TF、TALE-TF、CRISPR/Cas-TF等)。
本文所述的人工转录因子(ZFP-TF、TALE-TF、CRISPR/Cas-TF等)可包含与DNA结合结构域可操作连接的一个或更多个功能结构域。功能结构域可包含例如转录激活结构域或转录抑制结构域。通过选择与DNA结合结构域一起使用的激活结构域或抑制结构域,此类分子可用于激活或抑制靶基因的表达。在本文所述的遗传调节物的任何人工TF中,功能结构域(例如,激活结构域或抑制结构域)可以是野生型的(例如,P65、KRAB、KOX)。在某些实施方案中,功能结构域包含密码子多样化的抑制结构域,以防止顺式连接的ZFP之间的重组(例如,nKOX、mKOX、cKOX)。遗传调节物的人工TF可以包括相同或不同的功能结构域(例如,野生型和或修饰的(例如,密码子多样化的)抑制结构域的不同组合)。在某些实施方案中,功能或调节结构域可以在组蛋白翻译后修饰中起作用。在一些情况下,功能结构域是组蛋白乙酰基转移酶(HAT)、组蛋白脱乙酰基酶(HDAC)、组蛋白甲基化酶,或将组蛋白SUMO化(sumolyate)或生物素化的酶或其他酶结构域,该酶或酶结构域允许翻译后组蛋白修饰调节的基因阻遏(gene repression)(Kousarides(2007)Cell 128:693-705)。在其他实施方案中,人工转录因子包含DNMT结构域(例如,DNMT1、DNMT3A、DNMT3B、DNMT3L)。
在一些实施方案中,本发明的方法和组合物可用于治疗真核生物。在某些实施方案中,功能性(调节性)结构域的活性受外源性小分子或配体的调节,使得在缺少外源性配体的情况下不会发生与细胞转录机器(machinery)的相互作用。此类外部配体控制ZFP-TF、CRISPR/Cas-TF或TALE-TF与转录机器的相互作用程度。调节结构域可以可操作地连接一个或更多个ZFP、sgRNA/dCas或TALE的一个或更多个部分的任何部分,包括在一个或更多个ZFP、sgRNA/dCas或TALE之间的部分,一个或更多个ZFP、sgRNA/dCas或TALE外部部分及其任何组合。在优选的实施方案中,调节结构域导致靶基因的基因表达被抑制。
在某些实施方案中,包含两个或更多个人工转录因子的遗传调节物是阻遏物,并且与野生型表达水平相比,将靶基因的表达抑制至少50%至100%(或其之间的任何值)。在一些实施方案中,与野生型表达水平相比,遗传阻遏物将靶基因的表达抑制至少75%。仍在进一步的实施方案中,遗传调节物为阻遏物,并且与基因受单个遗传调节物(人工转录因子)调节时的表达水平相比,将表达抑制至少10%至100%。在其他实施方案中,遗传调节物是激活剂,并且与野生型表达水平和/或当基因受单个遗传调节物调节时的表达水平相比,将基因表达激活约1至5倍或更多(包括多达100倍或更多)(参见Perez-Pinera等人(2013)Nat Method 10(3):239-42)。本文所述的任何遗传调节物可进一步降低脱靶基因调节(例如,高于约50%或约75%或约90%或约100%的脱靶调节)。
本文所述的遗传调节物可以以任何形式,包括以多核苷酸和/或蛋白质形式提供给受试者,以及以包含此类多核苷酸和/或蛋白质的药物组合物的形式提供。
在一些方面,使用一个或更多个多核苷酸以多核苷酸形式提供遗传调节物(或其组分,例如人工转录因子的一个或更多个DNA结合结构域)。在某些实施方案中,单个多核苷酸用于递送遗传调节物的所有人工转录因子,而在其他实施方案中,两个或更多个多核苷酸(相同或不同类型)用于以任何组合或顺序递送多个人工转录因子。在某些实施方案中,多核苷酸是基因递送载体,其包含本文所述的任何多核苷酸(例如,编码遗传调节物(阻遏物))。在某些实施方案中,载体是腺病毒载体(例如,Ad5/F35载体),包括整合能力的慢病毒载体(LV)或整合缺陷的慢病毒载体,或腺病毒相关病毒载体(adenovirus associatedviral vector)(AAV)。在某些实施方案中,遗传调节物被携带在至少一种AAV载体(或其假型(pseudotype)或变体)上,所述载体包括但不限于一个或更多个AAV1、AAV2、AAV3、AAV4、AAV5、AAV6、AAV8、AAV 8.2、AAV9、AAV rh10,这些载体的假型(例如,作为AAV2/8、AAV2/5、AAV2/6、AAV2/9等),包括但不限于本领域已知的AAV载体变体(例如美国专利号9,585,971和7,198,951;美国公开号20170119906)。在一些实施方案中,AAV载体是能够穿过血脑屏障的AAV变体(例如,美国专利号9,585,971)。在一些实施方案中,人工转录因子由一种或多种多顺反子(multi-cistronic)多核苷酸(例如,AAV载体或mRNA)携带,即编码本文描述的遗传调节物的至少两个或更多个人工转录因子的多核苷酸。在一些实施方案中,单个多顺反子多核苷酸(例如,AAV载体或mRNA)编码本文所述的遗传调节物的所有人工转录因子。在多顺反子多核苷酸中,编码序列可以通过自切割肽或IRES序列分开。
在某些实施方案中,本文所述的遗传调节物的两个或更多个人工转录因子由一种或多种载体编码,所述载体包括病毒和非病毒基因递送载体(例如,作为mRNA、质粒、AAV载体、慢病毒载体、Ad载体),其编码如本文所述的遗传调节物。在一些实施方案中,本文所述的遗传调节物的两个或更多个人工转录因子由分开的载体编码。在一些实施方案中,本文所述的遗传调节物的两个或更多个人工转录因子的组分(例如sgRNA)与其他组分(例如Cas)分开编码。在某些实施方案中,多核苷酸是mRNA。在一些方面,mRNA可以被化学修饰(参见例如Kormann等人,(2011)Nature Biotechnology 29(2):154-157)。在其他方面,mRNA可包含帽(例如ARCA帽(参见美国专利号7,074,596和8,153,773))。在进一步的实施方案中,mRNA可以包含未修饰的和修饰的核苷酸的混合物(参见美国专利公开号2012/0195936)。仍在进一步的实施方案中,mRNA可以是多顺反子,例如,包括通过序列,如IRES或自切割肽连接的两个或更多个转录因子。
本发明还提供了用于在有需要的受试者中调节(例如,抑制)基因表达的方法和用途,包括通过向受试者提供一种或多种多核苷酸、一种或多种基因递送媒介物(vehicle)和/或包含本文所述的遗传调节物的药物组合物。在某些实施方案中,本文所述的组合物用于抑制受试者中的基因表达,包括用于治疗和/或预防与基因的异常表达有关的疾病(例如,tau病变中的tau,用于治疗ALS的突变C9orf72、HD中的突变Htt;用于治疗朊病毒病症的朊病毒基因;用于治疗PD的α-突触核蛋白和/或如上所述的其他基因)。因此,在某些实施方案中,本文所述的组合物用于抑制受试者中的tau表达,包括用于治疗和/或预防AD,而在其他实施方案中,本文所述的组合物用于抑制受试者中的htt表达,包括用于治疗和/或预防HD(例如,通过减少受试者中突变Htt的量)。在某些实施方案中,本文所述的组合物用于抑制受试者中的突变C9Orf72(例如,扩增的)表达,包括用于治疗和/或预防ALS。在某些实施方案中,本文所述的组合物用于抑制受试者中朊病毒的表达,包括用于治疗和/或预防朊病毒疾病。仍在进一步的实施方案中,本文所述的组合物用于抑制受试者中α-突触核蛋白的表达,包括用于治疗和/或预防PD。
本文所述的组合物在持续的时间段内(例如,约4周、约3个月、约6个月至约一年或更长时间)降低基因表达水平,并且可用于受试者的任何部分。在某些实施方案中,该组合物用于脑中(包括但不限于额皮层叶(frontal cortical lobe),包括例如前额皮质(prefrontal cortex)、顶皮层叶(parietal cortical lobe)、枕皮层叶(occipitalcortical lobe);颞皮层叶(temporal cortical lobe)包括例如内嗅皮层(entorhinalcortex)、海马、脑干、纹状体(striatum)、丘脑(thalamus)、中脑(midbrain)、小脑(cerebellum))和脊髓(包括但不限于腰(lumbar)、胸(thoracic)和颈(cervical)区域)。
本文所述的组合物可以通过任何施用方式提供给受试者,所述施用方式包括但不限于静脉内、肌内、脑室内(intracerebroventricular)、鞘内(intrathecal)、颅内(intracranial)、静脉内、眼眶(眶后(RO))和/或脑池内(intracisternal)施用。递送可以至受试者的任何部分,包括静脉内、肌内、口服、粘膜等。在某些实施方案中,可以通过任何合适的方式包括通过使用套管或其他任何递送技术递送至任何脑部分,例如海马或内嗅皮层。提供阻遏物广泛递送至受试者脑中的任何AAV载体,包括通过顺行(anterograde)和逆行(anterograde)轴突运输至未直接施用该载体的脑部区域(例如,递送至基底核(putamen)导致递送至其他结构,如皮层、黑质(substantia nigra)、丘脑等)。在某些实施方案中,所述受试者是人类,在其他实施方案中,所述受试者是非人类灵长类动物或啮齿动物。施用可以是单剂量,同时给予的多次施用或多次施用(施用之间的任何时间)。
此外,在本文描述的任何方法中,遗传调节物可以以提供期望效果的任何浓度(剂量)递送。在优选的实施方案中,遗传调节物通过使用腺相关病毒(AAV)载体以约10,000至约500,000个载体基因组/细胞(或其之间的任何值)递送。在一些实施方案中,遗传调节物-AAV以约10,000至约100,000,或约100,000至约250,000,或约250,000至约500,000的载体基因组(VG)/细胞(或其之间的任何值)的剂量递送。在某些实施方案中,使用慢病毒载体以约250至约1,000(或其之间的任何值)之间的感染复数(MOI)递送阻遏物。在其他实施方案中,使用质粒载体以约0.01-约1,000ng/约100,000个细胞(或其之间的任何值)递送遗传调节物。在一些实施方案中,使用约0.01至约1、约1至约100、约100至约500ng或约500至约1000ng/约100,000个细胞(或其之间的任何值)的质粒载体递送遗传调节物。在其他实施方案中,遗传调节物作为mRNA以约0.01至约3000ng/约100,000个细胞(或其之间的任何值)的形式被递送。在其他实施方案中,使用约1-300μL的固定体积的腺相关病毒(AAV)载体将遗传调节物以大约1E11-1E14 VG/mL递送至脑实质(brain parenchyma)。在其他实施方案中,使用约0.1-25mL之间的固定体积的腺相关病毒(AAV)载体将阻遏物以约1E11-1E14 VG/mL递送至CSF。
在另一方面,本文提供了制备包含两个或更多个(协同)人工转录因子(TF)的组合物的方法。在某些实施方案中,所述方法包括筛选靶向所选基因的多个人工转录因子(例如,ZFP-TF)其单独或组合对基因表达的影响;和鉴定人工ZFP-TF的协同组合。使用已知技术进行筛选。另请参见实施例。在某些实施方案中,所述方法包括以下步骤:选择(i)两个或更多个人工转录因子,其结合相距约1-600个碱基对(或其之间的任何值)的靶位点和/或(ii)选择两个或更多个人工转录因子,其中TF的功能结构域与靶基因结合时,彼此之间分开约1-600个碱基对(或其之间的任何值)。在某些实施方案中,所述方法包括以周期性方式筛选协同人工TF,其结合靶序列中的靶位点,例如,被跨越靶位点中约80-100个核苷酸(或其之间的任何值)隔开的靶位点,包括但不限于被约80个碱基对隔开的靶位点(例如,被约0-80个碱基对;约160至240个碱基对;约320至400个碱基对或约480至560个碱基对隔开的靶位点)和/或被约100个碱基对隔开的靶位点(例如,被约0至约100个碱基对;约200至约300个碱基对;或约400至约500个碱基对隔开的靶位点)。在某些实施方案中,靶位点被0至约80(或其之间的任何值)隔开;0至约100(或其之间的任何值);约160至240(或其之间的任何值);约200至约300(或其之间的任何值);约220至约300(或其之间的任何值);约300到大约0到约80(或其之间的任何值),大约160到约220(或其之间的任何值),大约260到约400(或其之间的任何值),或大约500到约600(或其之间的任何值)个碱基对分开。
在某些方面,本文描述的任何方法包括筛选其功能结构域以周期性方式彼此隔开(例如,被靶基因中跨越约80-100个核苷酸(或其之间的任何值)的间隔所隔开的功能结构域)的协同人工TF,包括但不限于这样的协同TF,其中功能结构域被约80个碱基对隔开(例如,功能结构域被约0至约80个碱基对;约160至约240个碱基对;约320至约400个碱基对或约480至约560个碱基对隔开)和/或功能结构域被约0至约100个碱基对;约200至约300个碱基对;或约400至约500个碱基对)隔开的约100个碱基对靶位点隔开。在某些实施方案中,功能结构域被约为0至80(或其之间的任何值)、约160至220(或其之间的任何值)、约260至400(或其之间的任何值)或约500至600(或任意的地域)个碱基对彼此分开。仍在进一步的实施方案中,所述方法包括筛选这样的协同人工TF,其结合在转录起始位点(TSS)的任一侧上约800个碱基对(或其之间的任何值)内,优选在TSS的任一侧上约600个碱基对内,甚至更优选在TSS的约300个碱基对之内的靶位点。在某些实施方案中,TF结合TSS和TSS的+200(或其之间的任何值)之间的靶位点。该方法可以进一步包括筛选与相同反义(-)或有义(+)链或不同链(任一种方向+/-)结合的协同TF。本发明的方法鉴定出人工TF与单个TF相比显示出大于约1倍、约2倍、约3倍、约4倍、约5倍、约6倍、约7倍、约8倍或更多倍的协同作用(活性和/或特异性的增加)(和/或预期的累加效应)。
因此,本文提供了使用本文所述的方法和组合物治疗和/或预防与一种或多种基因的不期望表达相关的病症的方法。在一些实施方案中,所述方法包括其中可以使用病毒载体、非病毒载体(例如,质粒)和/或其组合来递送多核苷酸和/或蛋白质(或包含多核苷酸和/或蛋白质的药物组合物)的组合物。如本文所述的组合物(蛋白质、多核苷酸、细胞和/或包含这些蛋白质、多核苷酸和/或细胞的药物组合物)的施用导致治疗(临床)效果,包括但不限于改善或消除与病症(例如,HD、AD、ALS、其他tau病变或癫痫发作)相关的任何临床症状以及CNS细胞(例如,神经元、星形胶质细胞(astrocyte)、髓磷脂(myelin)等)的功能和/或数量增加。在某些实施方案中,本文所述的组合物和方法使基因表达降低(与不接受本文所述的遗传调节物的对照相比)至少约30%或约40%,优选至少约50%,甚至更优选至少约70%,或至少约80%,或约90%,或大于90%。在一些实施方案中,达到至少约50%的降低。在本文所述的方法中使用任何组合物,该方法可以在受试者的一个或更多个细胞(例如,HD、ALS或AD神经元)中产生约50%或更高、约55%或更高、约60%或更高、约65%或更高、约70%或更高、约75%或更高、约85%或更高、约90%或更高、约92%或更高、大约95%或更高的靶等位基因(例如Htt、朊病毒、SNCA、tau或C9ORF72)抑制。
因此,在其他方面,本文描述了在受试者中预防和/或治疗与不想要基因表达(例如,HD、AD、ALS)相关的疾病的方法,该方法包括使用一个或更多个AAV载体将等位基因的调节物向受试者施用。在某些实施方案中,AAV编码遗传调节物,并通过任何递送方法包括但不限于脑室内(intracerebroventricular)、鞘内或脑池内递送而被施用给CNS(脑和/或CSF)。在其他实施方案中,将编码遗传调节物的AAV直接施用于受试者的薄壁组织(parenchyma)(例如,海马和/或内嗅皮层)。在其他实施方案中,编码遗传调节物的AAV通过静脉内(IV)施用。在本文描述的任何方法中,施用可以一次(单次施用)、同时多次施用进行,或者可以每次施用相同或不同的剂量进行多次(两次施用之间的任何时间)。当多次施用时,可以使用相同或不同剂量和/或施用方式的递送媒介物(例如,通过IV和/或ICV施用的不同AAV载体)。在一些实施方案中,所述方法包括这样的方法,其在受试者中,例如患有AD的受试者的AD神经元中,或患有HD的受试者的HD神经元中,或患有ALS的受试者的ALS神经元中减少突变蛋白的聚集(例如,减少特征为tau聚集的神经原纤维缠结(neurofibrillary tangle)(NFT);减少突变Htt聚集;减少源自C9ORF72基因ALS中扩增的GGGGCC的不完整RNA转录物的蛋白聚集物(aggregate));减少神经元或神经元群体(例如,HD或AD神经元或HD或AD神经元群体)中凋亡的方法;减少核病灶(foci)的方法,其包括ALS神经元中扩增的GGGGCC基因座的不完整RNA转录物;减少神经元过度兴奋(hyperexcitability)的方法;减少淀粉样蛋白β诱导的毒性(例如突触缺失(synapseloss)和/或神经营养不良)的方法;和/或在HD或AD受试者中减少一种或多种认知功能丧失的方法,其全部与未接受该方法的受试者相比,或与在接受该方法之前的受试者本身相比。因此,本文所述方法可导致HD或Taopathies的生物标志物和/或症状减少,包括以下一种或多种:神经毒性、神经胶质增生(gliosis)、营养不良性神经突(dystrophic neurites)、脊柱丧失(spine loss)、兴奋性毒性(excitotoxicity)、皮质和海马收缩、树突状tau积聚、认知(例如,啮齿动物模型中的八臂迷宫(radial arm maze)和Morris水迷宫、恐惧调节等)和/或运动障碍。
在一些方面,提供了用于在细胞中减少病原性种类(例如,tau、Htt、C9ORF72、朊病毒、SNCA编码的蛋白)的量的本发明的方法和组合物。在一些实施方案中,该方法导致过度高度磷酸化的tau减少。在一些情况下,过度高度磷酸化的tau的减少导致可溶性或颗粒状tau减少。在其他实施方案中,与未按照本发明的方法和/或组合物进行治疗的细胞或受试者相比,致病性tau种类的减少降低了tau聚集并引起神经原纤维缠结(NFT)减少。在进一步的实施方案中,提供了在细胞中逆转所观察到的NFT量的方法。仍在进一步的实施方案中,本发明的方法和组合物引起受试者的脑内内致病性tau种类(NFT、过度高度磷酸化的tau)的传播减慢。在一些实施方案中,致病性tau在脑中的传播被停止,并且在其他实施方案中,致病性tau在脑中的传播被逆转。在进一步的实施方案中,脑中与淀粉样蛋白β斑块相关的营养不良性神经突数量被减少。在一些实施方案中,营养不良性神经突数量被减少到在年龄匹配的野生型脑中发现的水平。在进一步的实施方案中,本文提供了用于在受试者脑中减少与淀粉样β斑块相关的过度高度磷酸化的tau的方法和组合物。仍在进一步的实施方案中,本文所述的组合物(Htt阻遏物)和方法在HD受试者中提供治疗益处,例如通过在受试者中减少细胞死亡、降低细胞凋亡、增加细胞功能(代谢)和/或减少运动缺乏。在一些实施方案中,本文提供了用于减少与突变C9ORF72扩增相关的后果的方法和组合物。与这种扩增相关的病理学(从野生型人类基因组中的大约30个拷贝到fALS患者中的数百个甚至数千个)似乎与DNA中异常结构的形成以及一些类型的RNA介导的毒性有关(Taylor(2014)Nature507:175)。扩增的GGGGCC的不完整RNA转录物会在fALS患者细胞中形成核病灶,并且同样这些RNA也可能经历重复相关的非ATP依赖性翻译,导致产生易于聚集的三种蛋白质(Gendron等人(2013)Acta Neuropathol 126:829)。在一些实施方案中,本文提供了用于减少与α-突触核蛋白的聚集相关的后果的方法和组合物。与这种聚集相关的病理学似乎与突触核蛋白病(如PD和路易体痴呆(dementia with Lewy bodies)(DLB))中α-突触核蛋白的错误折叠和聚集有关。在其他实施方案中是用于减少与突变朊病毒菌株的形成相关的后果的方法和组合物。
在一些实施方案中,在施用于受试者后,将编码如本文所述的遗传调节物(例如,遗传阻遏物)的两个或更多个人工转录因子的序列(例如,ZFP-TF、TALE-TF或CRISPR/Cas-TF)插入(整合)到基因组中,而在其他实施方案中,编码遗传调节物的两个或更多个人工转录因子的序列是游离(episomally)存在的。或者,可以将编码人工转录因子中一个或多个的序列整合到基因组中,而编码其余一种或多种人工转录因子的序列可以游离存在。在一些情况下,将编码TF融合体的核酸插入(例如,通过核酸酶介导的整合)在包含启动子的安全港位点(safe harbor site),从而内源启动子驱动表达。在其他实施方案中,将阻遏物(TF)供体序列(通过核酸酶介导的整合)插入安全港位点,并且该供体序列包含驱动阻遏物表达的启动子。在一些实施方案中,编码遗传调节物的序列在递送后在染色体外(episomally)(游离地)存在,并且可以包括异源启动子。该启动子可以是组成型或诱导型启动子。在一些实施方案中,启动子序列被广泛表达,而在其他实施方案中,启动子是组织或细胞/类型特异性的。在优选的实施方案中,启动子序列对神经元细胞是特异性的。在其他优选的实施方案中,所选择的启动子的特征在于其具有低表达。优选启动子的非限制性实例包括神经特异性启动子NSE、CMV、突触蛋白、CAMKiia和MECP。普遍存在的启动子的非限制性实例包括CAS和Ubc。进一步的实施方案包括如美国专利公开号20150267205中所述的自调节启动子的使用。
还提供了试剂盒,其包含本文所述的一种或多种组合物(例如,遗传调节物、多核苷酸、药物组合物和/或细胞)以及这些组合物的使用说明。试剂盒包含一种或多种遗传调节物(例如,阻遏物)和/或包含本文所述调节物(或其组分)的组分和/或编码调节物(或其组分)的多核苷酸。试剂盒可进一步包含细胞(例如,神经元)、试剂(例如,用于检测和/或定量由靶基因编码的蛋白质,例如在CSF中的)和/或使用说明书,包括本文所述的方法。
因此,本文描述了包含两个或更多个人工转录因子(TF)的组合物,每个人工转录因子包含DNA结合结构域和功能结构域(例如,转录激活结构域,转录抑制结构域,DNMT蛋白,如DNMT1、DNMT3A、DNMT3B、DNMT3L,组蛋白脱乙酰基酶(HDAC),组蛋白乙酰转移酶(HAT)、组蛋白甲基化酶,或将组蛋白SUMO化或生物素化的酶或其他酶结构域,该酶或酶结构域允许翻译后组蛋白修饰调节的基因阻遏),其中人工转录因子在细胞中协同调节(激活或抑制)基因表达。靶基因可以是tau(MAPT)基因、Htt基因、突变Htt基因、突变C9orf72基因、SNCA基因、SMA基因、ATXN2基因、ATXN3基因、PRP基因、Ube3a-ATS编码基因、DUX4基因、PGRN基因、MECP2基因、FMR1基因、CDKL5基因和/或LRKK2。该细胞可以是分离的或在活的受试者中。与野生型表达水平(和/或未经处理的对照)相比,本文所述的协同TF组合物可表现出靶基因的1、2、3、4、5、6、7、8倍或更多倍的调节。DNA结合结构域可以结合12个或更多个核苷酸的靶位点,并且可以是锌指蛋白(ZFP)、TAL效应子结构域和/或CRISPR/Cas系统的sgRNA。所述组合物的两个或更多个人工转录因子可以:(i)结合所选靶基因中至少12个核苷酸的任何靶位点;(ii)结合彼此在10,000个或更多碱基对内的靶位点;(iii)结合在待调节的靶基因的转录起始位点(TSS)的任一侧上的0至300个碱基对内的靶位点;和/或(iv)结合双链靶标中的有义和/或反义链。与野生型表达水平相比,基因调节(例如,抑制)可以是至少50%至100%。功能结构域的活性可能受到外源小分子或配体的调节,因此在缺少外源配体的情况下不会与细胞的转录机器发生相互作用。本文还描述了包含一种或多种协同TF组合物的药物组合物。
还提供了包含一种或多种组合物和/或编码一种或多种组合物的协同TF的多核苷酸的细胞(例如,分离的或在活的受试者中)。细胞可以包括神经元、神经胶质细胞、室管膜(ependymal)细胞、肝细胞、神经上皮细胞,任选地为HD或AD神经元或神经胶质细胞,或肝细胞。编码协同TF的多核苷酸可以稳定地整合到细胞的基因组中和/或可以游离存在。与不接受遗传调节物的对照相比,或与接受协同组合物的单个TF的细胞或受试者相比,所述组合物可以使基因表达减少30%、40%、50%或更多。
还提供了在患有中枢神经系统(CNS)疾病或病症的受试者(例如,受试者的神经元中)中调节基因表达的方法,该方法包括:向需要施用的受试者施用本文所述的一种或多种组合物。CNS疾病或病症可能是亨廷顿氏病(HD)(通过抑制Htt)、肌萎缩性侧索硬化症(ALS)(通过抑制C9orf基因)、朊病毒病(通过抑制朊病毒基因)、帕金森氏病(PD)(通过抑制α-突触核蛋白表达)、路易小体痴呆症(DLB)(通过抑制α-突触核蛋白表达)和/或tau病变(通过抑制MAPT),任选地其中CNS疾病或病症的生物标志物、病原性种类种类和/或症状可通过基因调节而减少(例如,神经毒性、神经胶质增生、营养不良性神经突、脊柱丧失、兴奋性毒性、皮质和海马体收缩、树突状tau积累、认知缺陷、运动缺陷、与淀粉样蛋白β斑块相关的营养不良性神经突、tau致病种类、mHtt聚集体、过度高度磷酸化的tau、可溶性tau、颗粒状tau、tau聚集和/或神经原纤维缠结(NFT)减少)。可以使用一种或多种多核苷酸(例如,非病毒或病毒载体)(向细胞或受试者)提供包含协同人工转录因子的组合物。非病毒载体包括质粒和/或单或多顺反子mRNA载体。可用于递送一种或多种组合物的病毒载体包括一种或多种:腺病毒载体、慢病毒载体(LV)和/或腺病毒相关病毒载体(AAV)。在这些方法中的任何一种中,基因表达在受试者的脑中可以减少4周、3个月、6个月至一年或更长时间。此外,可以使用静脉内、肌内、脑室内、鞘内、颅内、粘膜、口服、静脉内、眼眶和/或脑池内施用,包括但不限于受试者的额皮层叶、顶叶皮层、枕叶皮层;颞叶皮层、海马、脑干、纹状体、丘脑、中脑、小脑和/或脊髓。所述组合物可使用以下递送:(i)10,000-500,000个载体基因组/细胞的腺相关病毒(AAV)载体;(ii)MOI在250至1,000之间的慢病毒载体;(iii)0.01-1,000ng/100,000个细胞的质粒载体;和/或(iv)0.01-3000ng/100,000个细胞的mRNA(单个mRNA或多顺反子)。所述方法可以包括以10,000至100,000,或100,000至250,000,或250,000至500,000个载体基因组(VG)/细胞的剂量;对脑实质以1E11-1E14 VG/mL,1-300μL的固定体积,和/或对CSF以1E11-1E14 VG/mL,0.5-10mL的固定体积递送AAV载体(携带协同TF组合物)。
还提供了制备包含如本文所述的协同人工转录因子的组合物的方法,该方法包括:对靶向到所选基因的两个或更多个人工转录因子中的单个或组合筛选它们对基因表达的影响;和鉴定人工ZFP-TF的协同组合。所筛选的两个或更多个人工转录因子可以:(i)结合靶位点和/或包含相距1-600个碱基对的功能结构域;(ii)结合相距约1到80;160至220;260至400;或500至600个碱基对的靶位点;(iii)包含彼此分开相隔约1至80;260至400;或500至600个碱基对的功能结构域;(iv)结合在转录起始位点(TSS)任一侧上400个碱基对之内的靶位点;和/或(v)结合同一反义(-)或有义(+)链或任一方向的不同链。通过这些方法获得的协同人工TF比单个TF可能具有高至少2倍的活性。
附图简述
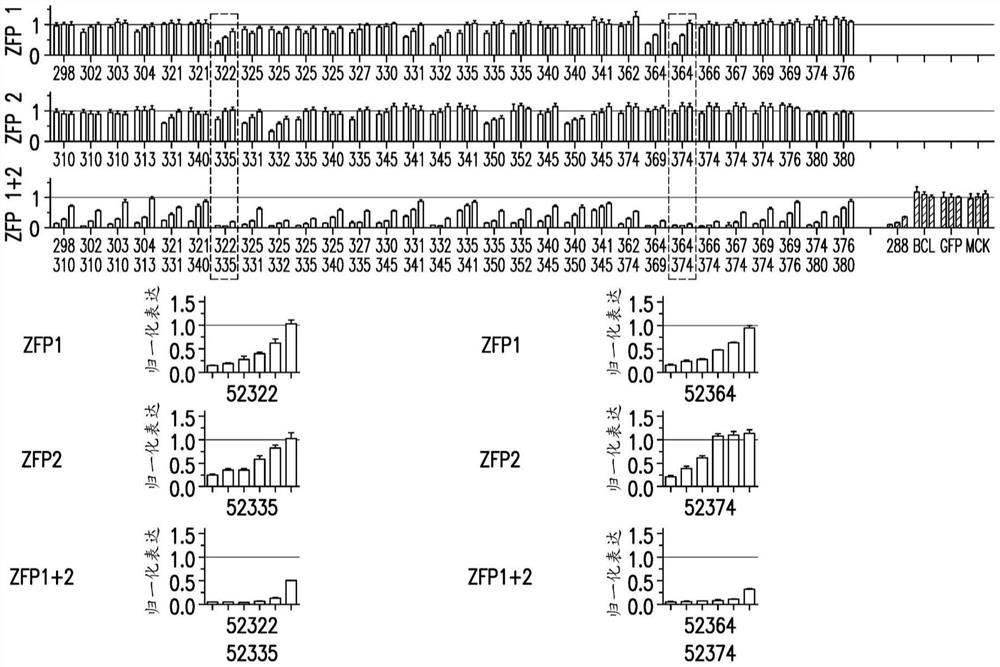
图1描绘了在用编码人工转录因子(例如ZFP阻遏物)的mRNA转染的Neuro2A细胞中,所示ZFP-TF抑制tau(MAPT)基因的示例性结果。上面两个图(“ZFP 1”和ZFP 2”)显示了单独使用时指示的ZFP-TF的结果(另请参见美国公开号20180153921)。第三个图(“ZFP 1+2”)显示了当两个指示的ZFP以单个转染的相同剂量一起使用时的结果。对照显示在第三个图的右侧(ZFP 52288为阳性对照,其也靶向MAPT(参见表1)(“288”);靶向BCL11A(“BCL”)的阴性对照ZFP;GFP(“GFP”);以及模拟转染对照(“MCK”))。上面三个图显示每个ZFP-TF在3种不同剂量(从左到右为30、10和3ng mRNA)的tau抑制。阴影图还在阴影区域下方以扩展形式显示(左侧显示的ZFP 52322、ZFP 52335和ZFP 52322和52335和右侧显示的ZFP 52364、ZFP52374和ZFP 52364和52374)。显示了ZFP-TF的6种不同剂量(从左至右为300、100、30、10、3和1ng mRNA)的tau抑制。
图2是描述使用两个或更多个ZFP-TF阻遏物的令人惊讶的协同效应以及用于推导协同作用得分的方法的图。左图显示了在指示水平的ZFP阻遏物进行瞬时mRNA转染后,Neuro2A细胞中的正常tau表达。中间图显示了如果以2倍剂量转染更强的单一阻遏物52322其预期归一化tau阻遏作用的插入(interpolated)水平(蓝线,倒三角形),以解释在组合反应中转染的mRNA额外量的潜在影响。右面图显示了非预期的协同作用及其得分,其计算为使用ZFP组合时预期的抑制(倒三角形)与观察到的抑制作用的比率(圆圈)。
图3描绘了在用编码ZFP阻遏物的mRNA转染的Neuro2A细胞中,指示的ZFP-TF抑制tau(MAPT)基因的示例性结果,以及每种组合的相应协同作用得分。上面两个图(“ZFP 1”和ZFP 2”)显示了单独使用时指示的ZFP-TF的结果(另请参见美国公开号20180153921)。对照显示在第三个图的右侧(ZFP 52288为阳性对照,其也靶向MAPT(参见表1)(“288”);靶向BCL11A(“BCL”)的阴性对照ZFP;GFP(“GFP”);以及模拟转染的对照(“MCK”))。下面的图显示了协同作用得分,其描述了对指示ZFP阻遏物对的协同作用。
图4描绘了示例性结果的概述,其示出了在抑制结构域之间的多种间隔处的协同效应;ZFP-TF阻遏物之间的靶位点间隔;距TSS的靶位点距离;和ZFP-TF阻遏物结合的链。上面左图显示了在ZFP-TF阻遏物的抑制(KRAB)结构域之间指定距离处的协同效应,其中每个Krab结构域位置是C末端锌指的最后一个靶向碱基的位置。下面左图显示了在距TSS多种指示距离处的协同效应,其中TSS距离被计算为从TSS到两个ZFP-TF阻遏物之间缺口(gap)的中心位置的距离。上面右图显示了协同效应,其中ZFP-TF阻遏物结合由所示碱基对缺口隔开的靶位点。下面右图显示了当单个ZFP-TF阻遏物结合指定的DNA链时的协同效应(+/+,两个ZFP-TF均靶向有义链;-/-,两个ZFP-TF均靶向反义链;+/-或-/+,一个ZFP-TF靶向有义链,而另一个靶向反义链)。
图5描绘了使用所示的ZFP-TF阻遏物(表1中所示的ZFP设计)抑制tau表达。对于单个ZFP-TF(上图),每个图显示使用的8种剂量(从左到右分别为1000、300、100、30、10、3、1、0.3ng mRNA)。对于包含两个所示ZFP-TF的遗传调节物,每个图显示使用的8种剂量(从左至右分别为300、100、30、10、3、1、0.3、0.1ng mRNA)。所有6个单一ZFP-TF阻遏物也被共转染并以8种剂量(从左至右分别为100、30、10、3、1、0.3、0.1、0.03ng mRNA)评估tau抑制。每种剂量反应曲线的EC50指示在右上方。
图6A至图6B描绘了使用所示ZFP的脱靶效应和tau抑制水平。图6A显示了脱靶事件:52335抑制了2个非靶基因并激活了一个脱靶基因;52389激活了一个脱靶位点;而且一对52335和52389激活了一个脱靶位点和抑制了一个脱靶位点。图6B是描绘在施用所示ZFP-TF后tau抑制的图。对于单个ZFP-TF(左图和中图),每个图显示使用的8种剂量(从左到右分别为1000、300、100、30、10、3、1、0.3ng mRNA)。对于包含两个所示ZFP-TF的遗传调节物(右图),该图显示了使用的8种剂量(从左到右分别为300、100、30、10、3、1、0.3、0.1ng mRNA)。qPCR分析表明,包含两个ZFP-TF阻遏物的阻遏物比单个阻遏物对tau的抑制作用更高(0.012x野生型水平)。
图7A至图7C描绘了使用多顺反子mRNA在Neuro2A细胞中的tau抑制,以协同ZFP-TF对给药后的抑制动力学,以及在瞬时递送ZFP遗传调节物后tau基因座的长期沉默。图7A显示了使用连接的(多顺反子)和未连接的人工TF的抑制,这些TF带有Kox抑制结构域的密码子多样化变体(在连接结构内的N端、中间或C端位置分别被指定为nKox、mKox和cKox)。如上图所示,使用以mRNA形式施用的所示对来显示结果。上图是示意图,其显示了通过三顺反子结构与所示的密码子多样化的抑制结构域(nKOX、mKOX、cKOX)连接的三个ZFP的潜在构型,以及通过病毒切割肽T2A和P2A的连接(linkage)。中间的图显示了在300、100、30、10、3、1、0.3和0.1ng mRNA剂量下未连接的mRNA对tau抑制的结果(下图从左至右),下面的图显示了在600、200、60、20、6、2、0.6和0.1ng mRNA的剂量下使用双-顺反子mRNA,包括所示的接头和抑制结构域对tau抑制的结果(每个图中从左到右)。图7B显示了mRNA转染后所示时间上的tau表达水平。上图是显示在转染后24小时收获的包含ZFP-TF 52322/52335的阻遏物的典型抑制数据的图。下图显示了在所示时间点(24小时、48小时、64小时、72小时和136小时)的时间进程(time course)内6种剂量处(300、100、30、10、3和1ng mRNA;在每个图中从左到右)的tau抑制作用。在最右下方的图中还显示了阴性转染对照(靶向BCL11A(“B”)的对照ZFP;GFP(“G”);以及模拟转染的对照(“M”))。图7C显示了瞬时ZFP递送后转染后1、4、7天,Neuro2A细胞中tau的表达水平(对于单因子,在900/300/100ng mRNA处进行3剂量mRNA转染,而在300/100/30ng mRNA处进行三重转染,各自为57890-KRAB、52322-DNMT3A和57930-DNMT3L)。在抑制生长的低血清培养基中培养细胞以阻止细胞分裂。
图8A至图8C是描绘从对照和经过处理的非人类灵长类动物(NHP)受试者提取的体内样品的tau表达和ZFP水平的图。图8A显示了来自对照受试者(NHP01、NHP02和NHP03)的结果。图8B显示了由单个AAV2/9载体携带的遗传阻遏物65918(“918”)和57890(“890”)处理的NHP受试者(NHP04、NHP05和NHP06)的结果,其中阻遏物(918和890)的表达受突触蛋白(SYN1)启动子(“SYN1.918-890”)驱动。图8C显示了由单个AAV2/9载体携带的遗传阻遏物65918(“918”)和57890(“890”)处理的受试者(NHP07和NHP08)的结果,其中阻遏物(918和890)的表达受CMV启动子(“CMV.918-890”)驱动(左图)。每个图中的上面的小图(plot)显示了归一化的tau抑制百分数,而下面的小图显示了ZFP水平(拷贝数/ng mRNA)。
图9A至图9C描绘了人iPS神经元中的Tau抑制。图9A显示当组合使用时,活性较低的ZFP的组合表现出协同作用(比较相比于两种化合物一起使用时的活性用单一化合物处理的细胞中三种蛋白质的活性。用包含受Syn1启动子调节的ZFP-TF的AAV6处理人iPS衍生的神经元,其中在19天后分析细胞。用1E5 VG/细胞处理细胞,进行5-7次生物学重复,注意,****表示显著性,其中p<0.0001。图9B描绘了转录组的变化,其中ZFP-TF用作单一遗传调节物导致对MAPT基因的轻微抑制,而当将两个ZFP-TF一起使用时,对MAPT表达的抑制则大得多。小图在左上角描绘了上调或下调的基因数量,其中这些报告的截止值(cut off)向上或向下变化>2倍。在这些实验中,评估了19,959个编码转录物。“659 18n”表示包含nKOX变体的65918ZFP-TF。“57890m”表示包含mKOX变体的57890ZFP-TF。图9C描述了利用其他ZFP-TF组合发现的结果。“65920n”表示包含nKOX变体的65920ZFP-TF。“57890m”与以上相同。
图10描绘了在转染了编码ZFP阻遏物的mRNA的Neuro2A细胞中,示例性ZFP-TF(命名为A至K)对小鼠朊病毒(Prnp)基因的抑制结果,以及每种组合的相应协同作用得分。上面两个图(“ZFP 1”和ZFP 2”)显示了单独使用时所示的ZFP-TF的结果。下面图显示了协同作用得分,该得分描述了对所示ZFP阻遏物对的协同效应(计算为以组合中其剂量的2倍测试时利用较强ZFP获得的表达水平与利用ZFP组合获得的表达水平的比率)。
图11描绘了概述,其显示了在抑制结构域之间的多种间隔处靶向小鼠朊病毒基因的130种ZFP-TF组合的协同效应;ZFP-TF阻遏物之间的靶位点间隔;和距TSS的靶位点距离。上面的图显示了协同效应,其中ZFP-TF阻遏物结合被所示碱基对缺口隔开的靶位点。中间的图显示了在ZFP-TF阻遏物的抑制(KRAB)结构域之间所示距离处的协同效应,其中每个KRAB结构域位置是C末端锌指的最后一个靶向碱基的位置。下面的图显示了在距TSS多个指示距离处的协同效应,其中TSS距离计算为从TSS到两个ZFP-TF阻遏物之间缺口的中心位置的距离。
图12描绘了在用编码ZFP阻遏物的mRNA转染的SK-N-MC细胞中示例性ZFP-TF(命名为hA至hJ)对人朊病毒(PRNP)基因的抑制结果以及每种组合的相应协同作用得分。上面两个图(“ZFP 1”和ZFP 2”)显示了单独使用时所示ZFP-TF的结果。下面的两个图显示了协同作用得分,该得分描述了对所示ZFP阻遏物对的协同效应(计算为以组合中其剂量的2倍测试时利用较强ZFP获得的表达水平:利用ZFP组合获得的表达水平的比率)。
图13描绘了概述,其显示了在抑制结构域之间的多种间隔处靶向人朊病毒基因的130种ZFP-TF组合的协同效应;ZFP-TF阻遏物之间的靶位点间隔;和距TSS的靶位点距离。上面的图显示了协同效应,其中ZFP-TF阻遏物结合被所示碱基对缺口隔开的靶位点。中间的图显示了在ZFP-TF阻遏物的抑制(KRAB)结构域之间所示距离处的协同效应,其中每个KRAB结构域位置是C末端锌指的最后一个靶向碱基的位置。下面的图显示了在距TSS多个指示距离处的协同效应,其中TSS距离计算为从TSS到两个ZFP-TF阻遏物之间缺口的中心位置的距离。
图14描绘了在用编码ZFP阻遏物的mRNA转染的SK-N-MC细胞中示例性ZFP-TF(命名为sA至sJ)对人α-突触核蛋白(SNCA)基因的抑制结果以及每种组合的相应协同作用得分。上面的两个图(“ZFP 1”和ZFP 2”)显示了单独使用时所示ZFP-TF的结果。下面的两个图显示了协同作用得分,该得分描述了对所示ZFP阻遏物对的协同效应(计算为以组合中其剂量的2倍测试时利用较强ZFP获得的表达水平:利用ZFP组合获得的表达水平的比率)。
图15描绘了概述,其显示了在抑制结构域之间的多种间隔处靶向α-突触核蛋白基因的132种ZFP-TF组合的协同效应;ZFP-TF阻遏物之间的靶位点间隔;和距TSS的靶位点距离。上面的图显示了协同效应,其中ZFP-TF阻遏物结合被所示碱基对缺口隔开的靶位点。中间的图显示了在ZFP-TF阻遏物的抑制(KRAB)结构域之间所示距离处的协同效应,其中每个KRAB结构域位置是C末端锌指的最后一个靶向碱基的位置。下面的图显示了在距TSS多个指示距离处的协同效应,其中TSS距离计算为从TSS到两个ZFP-TF阻遏物之间缺口的中心位置的距离。
发明详述
本文公开了用于以高特异性调节靶基因的基因表达的组合物和方法。本文所述的遗传调节物包括至少两种人工转录因子,与单个人工转录因子相比,它们提供了协同(大于累加)效应。特别地,本文所述的组合物和方法用于调节(例如,抑制或激活)任何靶基因的表达。这些遗传调节物可用于在体内修饰基因表达,从而减少或消除与靶基因不想要表达有关的疾病的影响和/或症状。例如,本文所述的阻遏物可用于减少或消除患有tau病变(例如,AD)或HD的受试者的脑中tau或突变Htt的聚集,并减轻疾病的症状。
通用(general)
除非另有说明,否则本文公开的方法的实践以及组合物的制备和用途采用本领域技术范围内的分子生物学、生物化学、染色质结构和分析、计算化学、细胞培养、重组DNA和相关领域中的常规技术。这些技术在文献中已得到充分解释。参见,例如,Sambrook等人,MOLECULAR CLONING:ALABORATORY MANUAL,第2版,Cold Spring Harbor LaboratoryPress,1989和第3版,2001;Ausubel等人,CURRENT PROTOCOLS IN MOLECULAR BIOLOGY,John Wiley&Sons,New York,1987和周期性更新;the series METHODS IN ENZYMOLOGY,Academic Press,San Diego;Wolffe,CHROMATIN STRUCTURE AND FUNCTION,第3版,Academic Press,San Diego,1998;METHODS IN ENZYMOLOGY,第304卷,“Chromatin”(P.M.Wassarman和A.P.Wolffe,编辑),Academic Press,San Diego,1999;和METHODS INMOLECULAR BIOLOGY,Vol.119,“Chromatin Protocols”(P.B.Becker,编辑)Humana Press,Totowa,1999。
定义
术语“核酸”、“多核苷酸”和“寡核苷酸”可互换使用,并且是指线性或环状构象(conformation)以及单链或双链形式的脱氧核糖核苷酸或核糖核苷酸聚合物。为了本公开的目的,这些术语不应被解释为对聚合物长度的限制。该术语可涵盖天然核苷酸的已知类似物,以及在碱基、糖和/或磷酸盐部分(例如,硫代磷酸酯骨架)中修饰的核苷酸。通常,特定核苷酸的类似物具有相同的碱基配对特异性,即A的类似物将与T碱基配对。
术语“多肽”,“肽”和“蛋白质”可互换使用,是指氨基酸残基的聚合物。该术语还适用于这样的氨基酸聚合物,其中一个或更多个氨基酸是相应天然存在的氨基酸的化学类似物或修饰的衍生物。
“结合”是指大分子之间(例如,蛋白质和核酸之间)的序列特异性非共价相互作用。并非所有结合相互作用的成分都必须是序列特异性的(例如,与DNA骨架中的磷酸酯残基接触),只要相互作用在整体上是序列特异性的即可。这种相互作用通常以10
“结合蛋白”是能够非共价结合至另一分子的蛋白质。结合蛋白可以与例如DNA分子(DNA结合蛋白)、RNA分子(RNA结合蛋白)和/或蛋白质分子(蛋白质结合蛋白)结合。在蛋白质结合蛋白的情况下,它可以结合自身(以形成同型二聚体、同型三聚体等)和/或可以结合不同蛋白质或更多个蛋白质(proteins)的一个或更多个分子。结合蛋白可以具有一种以上的结合活性。例如,锌指蛋白具有DNA结合、RNA结合和蛋白质结合活性。
“锌指DNA结合蛋白”(或结合结构域)是蛋白质或较大蛋白质内的结构域,其通过一个或更多个锌指以序列特异性方式结合DNA,所述锌指是结合结构域内的氨基酸结合结构域序列区域,其结构通过锌离子的配位(coordination)得以稳定。术语锌指DNA结合蛋白通常缩写为锌指蛋白或ZFP。
“TALE DNA结合结构域”或“TALE”是包含一个或更多个TALE重复结构域/单元的多肽。重复结构域参与TALE与其同源(cognate)靶DNA序列的结合。单个“重复单元”(也称为“重复”)长度通常为33-35个氨基酸,并且与天然存在的TALE蛋白内的其他TALE重复序列表现出至少一些序列同源性。参见,例如,美国专利号8,586,526。
“TtAgo”被认为是参与基因沉默的原核Argonaute蛋白。TtAgo来源于嗜热栖热菌(Thermus thermophilus)。参见,例如,Swarts等人,(2014)Nature507(7491):258-261,G.Sheng等人,(2013)Proc.Natl.Acad.Sci.U.S.A.111,652)。“TtAgo系统”是所需的所有组件,包括,例如,由TtAgo酶切割的指导DNA。“重组”是指两个多核苷酸之间遗传信息的交换过程,包括但不限于通过非同源末端连接(NHEJ)和同源重组捕获供体。为了本公开的目的,“同源重组(HR)”是指这样的交换的特殊形式,其例如在通过同源性指导的修复机制在细胞中修复双链断裂期间发生。此过程需要核苷酸序列同源性,使用“供体”分子对“靶”分子(即经历双链断裂的分子)进行模板修复,被称为“非交叉基因转换”或“短程基因转换(shorttract gene conversion)”,因为它导致遗传信息从供体转移到靶标。不希望受到任何特定理论的束缚,这种转移可能涉及在断裂的靶标和供体之间形成的异源双链DNA的错配校正和/或“合成依赖性链退火”,其中供体用于重新合成遗传信息,其将成为靶标和/或相关过程的一部分。这种专门的HR通常导致靶分子序列的改变,使得供体多核苷酸的部分或全部序列被掺入到靶多核苷酸中。
DNA结合结构域如sgRNA、锌指结合结构域或TALE DNA结合结构域可以被“工程化”以结合预定的核苷酸序列,例如通过设计与所选靶位点结合的sgRNA或通过工程化(改变一个或更多个氨基酸)天然存在的锌指蛋白的识别螺旋区或通过工程化TALE蛋白的RVD。因此,工程化锌指蛋白或TALE是非天然存在的蛋白质。用于工程化DNA结合结构域的方法的非限制性实例是设计和选择。“设计的”锌指蛋白或TALE是自然界中不存在的蛋白质,其设计/组成主要来自合理的标准(Rational criteria)。合理的设计标准包括应用替代规则和计算机化算法,以处理存储现有ZFP设计信息和结合数据的数据库中的信息。“所选”锌指蛋白或TALE是自然界中不存在的蛋白,其产生主要来自经验过程,如噬菌体展示、相互作用陷阱或杂交选择。参见,例如,美国专利号8,586,526;6,140,081;6,453,242;6,746,838;7,241,573;6,866,997;7,241,574;和6,534,261;也参见国际专利公开号WO 03/016496。
术语“序列”是指任何长度的核苷酸序列,其可以是DNA或RNA;可以是线性、环状或分支的,可以是单链或双链的。术语“供体序列”是指插入基因组中的核苷酸序列。供体序列可以具有任何长度,例如长度在2至10,000个核苷酸之间(或其之间或其上的任何整数值),优选地长度在约100至1,000个核苷酸之间(或其之间的任何整数),更优选地长度在约200至500个核苷酸之间。
“靶位点”或“靶序列”是限定结合分子将结合的核酸的一部分的核酸序列,条件是存在充足的结合条件。
“外源”分子是通常不存在于细胞中但可以通过一种或多种遗传、生化或其他方法引入细胞中的分子。关于细胞的特定发育阶段和环境条件来确定“细胞中的正常存在”。因此,例如,仅在肌肉的胚胎发育期间存在的分子是相对于成年肌肉细胞的外源性分子。类似地,相对于非热激细胞,由热激诱导的分子是外源分子。外源分子可包括例如功能失常的内源分子的功能版本或功能正常的内源分子的功能失常版本。
外源分子尤其可以是小分子,如通过组合化学过程产生的小分子,或者是大分子,如蛋白质、核酸、碳水化合物、脂质、糖蛋白、脂蛋白、多糖,上述分子的任何修饰的衍生物,或包含一种或多种上述分子的任何复合物。核酸包括DNA和RNA,可以是单链或双链的;可以是线性的、分支的或环状的;并且可以是任何长度。核酸包括能够形成双链体的那些核酸以及三链体形成核酸。参见,例如,美国专利号5,176,996和5,422,251。蛋白质包括但不限于DNA结合蛋白、转录因子、染色质重塑因子、甲基化DNA结合蛋白、聚合酶、甲基化酶、脱甲基酶、乙酰化酶、脱乙酰基酶、激酶、磷酸酶、整合酶、重组酶、连接酶、拓扑异构酶、旋转螺(gyrase)和解旋酶(helicase)。
外源分子可以是与内源分子相同类型的分子,例如外源蛋白质或核酸。例如,外源核酸可包含引入细胞中的感染性病毒基因组、质粒或附加体,或细胞中通常不存在的染色体。将外源分子引入细胞的方法是本领域技术人员已知的,并且包括但不限于脂质介导的转移(即脂质体,包括中性和阳离子脂质)、电穿孔、直接注射、细胞融合、粒子轰击、磷酸钙共沉淀、DEAE-葡聚糖介导的转移和病毒载体介导的转移。外源分子也可以是与内源分子相同类型的分子,但其来源不同于细胞来源。例如,可以将人核酸序列引入最初源自小鼠或仓鼠的细胞系。
相反,“内源”分子是在特定环境条件下在特定发育阶段通常存在于特定细胞中的分子。例如,内源核酸可以包含染色体、线粒体、叶绿体或其他细胞器的基因组,或天然存在的游离核酸。另外的内源分子可以包括蛋白质,例如转录因子和酶。
“融合”分子是其中两个或更多个亚基分子优选共价连接的分子。亚基分子可以是相同化学类型的分子,或者可以是不同化学类型的分子。第一类融合分子的实例包括但不限于融合蛋白(例如,ZFP或TALE DNA结合结构域与一个或更多个激活结构域之间的融合)和融合核酸(例如,核酸编码上文融合蛋白的酸)。第二类融合分子的实例包括但不限于三链体形成核酸与多肽之间的融合,以及小沟结合物与核酸之间的融合。该术语还包括其中多核苷酸组分与多肽组分结合以形成功能分子的系统(例如,其中单个指导RNA与功能结构域结合以调节基因表达的CRISPR/Cas系统)。
融合蛋白在细胞中的表达可因融合蛋白向细胞递送或编码融合蛋白的多核苷酸向细胞(其中多核苷酸被转录,并且转录物被翻译,以产生融合蛋白)递送而产生。细胞中蛋白质的表达也涉及反式剪接、多肽切割和多肽连接。用于多核苷酸和多肽递送至细胞的方法在本公开的其他地方提出。
“多聚化结构域”(也称为“二聚化结构域”或“蛋白质相互作用结构域”)是在ZFPTF或TALE TF的氨基、羧基或氨基和羧基末端区域掺入的结构域。这些结构域允许多个ZFPTF或TALE TF单元进行多聚化,从而使三核苷酸重复结构域的较大片段(tract)相对于具有野生型长度数的较短片段优先被多聚化ZFP TF或TALE TF结合。多聚化结构域的实例包括亮氨酸拉链。多聚化结构域也可以受小分子调节,其中多聚化结构域呈现适当的构象,以仅在存在小分子或外部配体的情况下才允许与另一个多聚化结构域相互作用。以这种方式,外源配体可用于调节这些结构域的活性。
为了本公开的目的,“基因”包括编码基因产物的DNA区域(见下文),以及调节基因产物产生的所有DNA区域,无论这种调节序列是否与编码和/或转录序列相邻。因此,基因包括但不必限于启动子序列、终止子、翻译调节序列如核糖体结合位点和内部核糖体进入位点、增强子、沉默子、绝缘子、边界元件、复制起点、基质附着位点和基因座控制区。
“基因表达”是指将基因中包含的信息转换成基因产物。基因产物可以是基因的直接转录产物(例如,mRNA、tRNA、rRNA、反义RNA、核酶、结构RNA或任何其他类型的RNA)或通过mRNA翻译产生的蛋白质。基因产物还包括通过如加帽、聚腺苷酸化、甲基化和编辑等过程修饰的RNA,以及通过例如甲基化、乙酰化、高度磷酸化的、泛素化、ADP-核糖基化、肉豆蔻化和糖基化修饰的蛋白质。
基因表达的“调节”是指基因活性的变化。表达的调节可包括但不限于基因激活和基因阻遏。基因组编辑(例如切割、改变、失活、随机突变)可用于调节表达。基因失活是指与不包括如本文所述的ZFP或TALE蛋白的细胞相比,基因表达的任何降低。因此,基因失活可以是部分或完全的。
“遗传调节物”是指改变一个或更多个基因的表达和/或序列的任何分子。遗传调节物的非限制性实例包括与靶基因结合并改变其表达的转录因子(如本文所述的人工转录因子)和修饰靶基因的序列的核酸酶,其依次改变其表达(例如,通过插入和/或缺失使靶失活)。因此,遗传调节物可以是遗传阻遏物(其抑制和/或灭活基因表达)或遗传激活物。
“目的区域”是细胞染色质的任何区域,如例如,其中期望结合外源分子的基因内或附近的非编码序列。结合可以出于靶向DNA切割和/或靶向重组的目的。例如,目的区域可以存在于染色体、附加体、细胞器基因组(例如线粒体、叶绿体)或感染性病毒基因组中。目的区域可以在基因的编码区域内、在转录的非编码区域内,如例如前导序列、尾随序列或内含子,或在非转录区域内,在编码区域的上游或下游。目的区域长度可以小至单个核苷酸对,或多达2,000个核苷酸对,或任何整数值的核苷酸对。
“真核”细胞包括但不限于真菌细胞(如酵母)、植物细胞、动物细胞、哺乳动物细胞和人类细胞(例如,T细胞)。
术语“可操作连接”和“可操作地连接”(或“可操作地连接”)是对于两个或更多个组分(如序列元件)的并列而互换使用的,其中这样排列组分,使得两个组分正常地起作用并允许这样的可能性,其中至少一个组分可以介导施加在至少一个其他组分上的功能。举例来说,如果转录调控序列响应一种或多种转录调控因子的存在或不存在来控制编码序列的转录水平,转录调控序列,如启动子则是可操作地连接编码序列。转录调控序列通常与编码序列顺式可操作地连接,但不必直接与其相邻。例如,增强子是可操作地连接编码序列的转录调控序列,即使它们不连续。
关于融合多肽,术语“可操作地连接”可以指这样的事实,即如果没有如此连接的话,每个组分在与其他组分的连接中执行相同的功能。例如,对于其中ZFP或TALE DNA结合结构域与激活结构域融合的融合分子,如果在融合多肽中,ZFP或TALE DNA结合结构域和激活结构域部分能够结合其靶位点和/或其结合位点,而激活结构域能够上调基因表达,那么ZFP或TALE DNA结合结构域与激活结构域处于可操作的连接中。与能够调节基因表达的结构域融合的ZFP统称为“ZFP-TF”或“锌指转录因子”,而与能够调节基因表达的结构域融合的TALE统称为“TALE-TF”或“TALE转录因子”。当其中ZFP DNA结合结构域与切割结构域(“ZFN”或“锌指核酸酶”)融合的融合多肽时,如果在融合多肽中,ZFP DNA结合结构域部分能够结合其靶位点和/或其结合位点,而切割结构域能够在靶位点附近切割DNA,则ZFP DNA结合结构域和切割结构域处于可操作的连接中结合结构域。当其中TALE DNA结合结构域与切割结构域(“TALEN”或“TALE核酸酶”)融合的融合多肽时,如果在融合多肽中,TALE DNA结合结构域和切割结构域部分能够结合其靶位点和/或其结合位点,而切割结构域能够在靶位点附近切割DNA,则TALE DNA结合结构域和切割结构域处于可操作的连接中。结合结构域对于其中Cas DNA结合结构域(例如,单个指导RNA)与激活结构域融合的融合分子,如果在融合多肽中,Cas DNA结合结构域和激活结构域部分能够结合其靶位点和/或其结合位点,而激活结构域能够上调基因表达,则Cas DNA结合结构域和激活结构域处于可操作的连接中。结合结构域当其中Cas DNA结合结构域与切割结构域融合的融合多肽时,如果在融合多肽中,Cas DNA结合结构域部分能够结合其靶位点和/或其结合位点,而切割结构域能够在靶位点附近切割DNA,结合结构域则该Cas DNA结合结构域和切割结构域处于可操作的连接中。
蛋白质、多肽或核酸的“功能片段”是蛋白质、多肽或核酸,其序列与全长蛋白质、多肽或核酸不同,但仍保留与全长蛋白质、多肽或核酸相同的功能。功能片段可具有与相应的天然分子更多、更少或相同数目的残基,和/或可包含一个或更多个氨基酸或核苷酸取代。确定核酸功能(例如,编码功能,与另一种核酸杂交的能力)的方法是本领域众所周知的。类似地,确定蛋白质功能的方法是众所周知的。例如,可以通过例如滤膜结合、电泳迁移率改变或免疫沉淀测定法确定多肽的DNA结合功能。DNA切割可以通过凝胶电泳来测定。参见Ausubel等人,上文。蛋白质与另一种蛋白质相互作用的能力可以,例如通过遗传和生化的免疫共沉淀、双杂交测定或互补来确定。参见,例如,Fields等人,(1989)Nature 340:245-246;美国专利号5,585,245和国际专利公开号WO 98/44350。
“载体”能够将基因序列转移至靶细胞。通常,“载体构建体”、“表达载体”和“基因转移载体”是指能够指导目的基因表达并且可以将基因序列转移至靶细胞的任何核酸构建体。因此,该术语包括克隆和表达媒介物,以及整合载体。
“报道(reporter)基因”或“报道序列”是指产生易于测量(优选尽管不一定在常规测定中)的蛋白质产物的任何序列。合适的报道基因包括但不限于编码介导抗生素抗性(例如,氨苄青霉素抗性、新霉素抗性、G418抗性、嘌呤霉素抗性)的蛋白质的序列,编码有色或荧光或发光蛋白(例如,绿色荧光蛋白,增强型绿色荧光蛋白、红色荧光蛋白、荧光素酶)的序列和介导增强的细胞生长和/或基因扩增的蛋白(例如,二氢叶酸还原酶)。表位标签包括例如FLAG、His、myc、Tap、HA或任何可检测的氨基酸序列的一个或更多个拷贝。“表达标签”包括编码可与所需基因序列可操作连接的报道基因的序列,以监测目的基因的表达。
术语“协同作用”和“累加”用于指实现的基因调节作用。当两个或更多个人工转录因子以高于单个人工转录因子的水平和/或两个或更多个人工转录因子一起使用的预期(“累加”)调节水平调节基因表达时,该调节被认为表现出协同作用。“协同作用”包括功能协同作用,其中单个组分在给定剂量下均具有活性,而协同协同作用中,遗传模块的单个人工转录因子中的至少一种在给定剂量下没有活性。协同作用可以通过任何合适的方法来确定,例如,通过(1)计算当使用组合时,最强单一人工转录因子的相同剂量下靶基因的预期归一化表达与观察到的归一化基因表达之比,或者(2)确定用较强的ZFP-TF(在组合中使用其剂量的2倍)获得的表达水平与通过ZFP组合获得的表达水平之比。
遗传调节物
本文所述的遗传调节物包括两个或更多个人工转录因子(例如,阻遏物或激活剂),每个人工转录因子(TF)包含DNA结合结构域和一个或更多个功能结构域。与单个转录因子相比,本文所述的遗传调节物表现出协同效应,包括对特异性(限制或消除脱靶基因的调节)和/或活性(调节的量)的协同效应。因此,协同作用是与单个TF相比,活性和/或特异性超过约1倍、约2倍、约3倍、约4倍、约5倍、约6倍、约7倍、约8倍或更多的任何增加(和/或预期的累加效应)。
在本文所述的任何组合物中,两个或更多个人工转录因子可以结合靶位点(通过TF的DNA结合结构域),其隔开约1至约600个碱基对(或其之间其之间的任何值),优选隔开约1至约300个(或其之间的任何值)碱基对,甚至更优选隔开约1至约100个(或其之间的任何值)碱基对。在某些实施方案中,协同TF组合物的组分结合靶位点,所述靶位点隔开约1至约80(或其之间的任何值),约160至约220(或其之间的任何值),约260至约400(或其之间的任何值),或约500到约600(或其之间的任何值)个碱基对。参见例如图4;11;13;和15。
在本文所述的任何组合物中,两个或更多个人工转录因子的功能结构域(例如,转录激活或抑制结构域,如KRAB或DNMT)(通过TF的DNA结合结构域)被定位彼此隔开约1至约600个(或其之间的任何值)碱基对,优选隔开约1至约300个(或其之间的任何值)碱基对,甚至更优选隔开约1至约100个(或其之间的任何值)碱基对。在某些实施方案中,协同TF组合物的功能结构域被定位以使得它们彼此隔开约1至约80(或其之间的任何值其之间),约160至约220(或其之间的任何值其之间),约260至约400(或其之间的任何值),或约500到约600(或其之间的任何值)个碱基对。参见,例如,图4;图11;图13;和图15。
本文所述的协同组合物可结合靶基因中任何地方的靶位点,包括但不限于编码序列和邻近或远侧控制元件(例如,增强子、启动子等)。在某些方面,组合物的TF结合转录起始位点(TSS)的任一侧上0-600个碱基对(或其之间的任何值)内的靶位点。在某些实施方案中,TF结合TSS和TSS的+200(或其之间的任何值)之间的靶位点。参见,例如图4;图11;图13;和图15。
此外,本文所述组合物的两个或更多个TF可以结合靶位点(例如,内源基因)的相同和/或不同链。在某些实施方案中,协同组合物包含与相同反义(-)或有义(+)链结合的TF。在其他实施方案中,协同组合物包含结合不同链(在任一方向上+/-)的TF。参见,例如,图4;图11;图13;和图15。
DNA结合结构域
任何多核苷酸或多肽DNA结合结构域可用于本文公开的组合物和方法中,例如DNA结合蛋白(例如,ZFP或TALE)或DNA结合多核苷酸(例如,单向指导RNA)。遗传调节物的DNA结合结构域可以靶向任何目的基因,包括在疾病或病症中异常表达的一个或更多个基因。DNA结合结构域识别的两个或更多个靶位点可以重叠或不重叠。两个DNA结合结构域的靶位点可以间隔多达约600个或更多个碱基对,并且距靶基因的转录起始位点(在任一侧)可以有多达300个或更多个碱基对。另外,当靶向双链DNA(如内源基因组)时,人工转录因子的DNA结合结构域可靶向相同或不同的链(一个或更多个靶向正链和/或一个或更多个靶向负链)。此外,相同或不同的DNA结合结构域可用于本发明的遗传调节物。因此,描述了任何基因的遗传调节物(阻遏物)。
在某些实施方案中,至少一个DNA结合结构域包含锌指蛋白。选择靶位点;用于设计和构建融合蛋白(和编码其的多核苷酸)的ZFP和方法对于本领域技术人员而言是已知的,并且详细描述于美国专利号6,140,081;5,789,538;6,453,242;6,534,261;5,925,523;6,007,988;6,013,453;6,200,759;和国际专利公开号WO 95/19431;以及国际专利公开号WO 95/19431;WO 96/06166;WO 98/53057;WO 98/53057;WO 98/54311;WO 00/27878;WO01/60970;WO 01/88197;WO 02/099084;WO 98/53058;WO 98/53059;WO 98/53060;WO 02/016536;和WO 03/016496。
ZFP DNA结合结构域包括至少一个锌指,但是可以包括多个锌指(例如,2、3、4、5、6或更多个指)。通常,ZFP包括至少三个指。某些ZFP包括四个、五个或六个指,而一些ZFP包括8、9、10、11个或12个或更多个指。包括三个指的ZFP通常会识别包括9个或10个核苷酸的靶位点;包括四个指的ZFP通常会识别包括12至14个核苷酸的靶位点;而具有六个指的ZFP可以识别包括18至21个核苷酸的靶位点。ZFP也可以是融合蛋白,其包括一个或更多个功能(调节)结构域,该结构域可以是转录激活或抑制结构域或其他结构域,如DNMT结构域。DNA结合结构域与至少一个调节(功能)结构域融合,并且可以被视为“ZFP-TF”架构。
与天然存在的锌指蛋白相比,工程化的锌指结合结构域可以具有新的结合特异性。工程化方法包括但不限于合理设计和各种选择。合理的设计包括,例如,使用包含三联体(或四联体)核苷酸序列和单个锌指氨基酸序列的数据库,其中每个三联体或四联体核苷酸序列与结合特定三联体或四联体序列的锌指的一个或更多个氨基酸序列相关联。参见,例如,共有的美国专利号6,453,242和6,534,261和8/772,453,通过引用整体并入本文。
另外,如这些和其他参考文献中所公开的,可以使用任何合适的接头序列,包括例如长度为5个或更多个氨基酸的接头将锌指结构域和/或多指锌指蛋白连接在一起。对于长度为6个或更多个氨基酸的示例性接头序列,还参见美国专利号6,479,626;6,903,185和7,153,949。本文所述的蛋白质可以包括蛋白质的单个锌指之间的合适接头的任何组合。
ZFP可以与一个或更多个转录调节子(例如,抑制结构域)可操作地结合(连接)以形成ZFP-TF(例如,阻遏物)。相对于其他非预期的切割位点(称为脱靶位点),例如通过如美国专利公开号20180087072中所述的ZFP骨架的突变,方法和组合物还可用于提高ZFP对其预期靶标的特异性。因此,本文所述的遗传调节物可在其一个或更多个DNA结合结构域骨架区域中包含突变和/或在其转录调控结构域中包含一个或更多个突变。这些ZFP可以包含ZFP DNA结合结构域(“ZFP骨架”)中的氨基酸突变,该突变可以与DNA骨架上的磷酸盐发生非特异性相互作用,但它们不包含DNA识别螺旋的变化。因此,本发明包括ZFP骨架中阳离子氨基酸残基的突变,其对于核苷酸靶标特异性不是必需的。在一些实施方案中,ZFP骨架中的这些突变包括将阳离子氨基酸残基突变为中性或阴离子氨基酸残基。在一些实施方案中,ZFP骨架中的这些突变包括将极性氨基酸残基突变为中性或非极性氨基酸残基。在优选的实施方案中,在相对于DNA结合螺旋的位置(-5)、(-9)和/或位置(-14)处发生突变。在一些实施方案中,锌指可在(-5)、(-9)和/或(-14)处包含一个或更多个突变。在进一步的实施方案中,多指锌指蛋白中的一个或更多个锌指可以包含(-5)、(-9)和/或(-14)处的突变。在一些实施方案中,将(-5)、(-9)和/或(-14)的氨基酸(例如精氨酸(R)或赖氨酸(K))突变为丙氨酸(A)、亮氨酸(L)、Ser(S)、Asp(N)、Glu(E)、Tyr(Y)和/或谷氨酰胺(Q)。
备选地,DNA结合结构域可以源自核酸酶。例如,归巢核酸内切酶和大范围核酸酶(meganuclease)如I-SceI、I-CeuI、PI-PspI、PI-Sce、I-SceIV、I-CsmI、I-PanI、I-SceII、I-PpoI、I-SceIII、I-CreI、I-TevI、I-TevII和I-TevIII是已知的。也参见美国专利号5,420,032;美国专利号6,833,252;Belfort等人,(1997)Nucleic Acids Res.25:3379-3388;Dujon等人,(1989)Gene 82:115-118;Perler等人,(1994)Nucleic Acids Res.22,1125-1127;Jasin(1996)Trends Genet.12:224–228;Gimble等人,(1996)J.Mol.Biol.263:163-180;Argast等人,(1998)J.Mol.Biol.280:345-353和New England Biolabs目录。另外,归巢核酸内切酶和大范围核酸酶的DNA结合特异性可以被工程化以结合非天然靶位点。参见,例如,Chevalier等人,(2002)Molec.Cell 10:895-905;Epinat等人,(2003)Nucleic AcidsRes.31:2952-2962;Ashworth等人,(2006)Nature 441:656-659;Paques等人,(2007)Current Gene Therapy 7:49-66;美国专利公开号2007/0117128。
在某些实施方案中,DNA结合结构域包含天然存在或工程化的(非天然存在的)TAL效应子(TALE)DNA结合结构域。参见,例如,美国专利号8,586,526,通过引用整体并入本文。在某些实施方案中,TALE DNA结合蛋白包含与tau靶位点的12、13、14、15、16、17、18、19、20或更多个连续核苷酸结合,如美国公开号20180153921中所示。与tau靶位点结合的TALEDNA结合蛋白的RVD可能是天然存在的或非天然存在的RVD。参见,美国专利号8,586,526和9,458,205。
已知黄单胞菌(Xanthomonas)属的植物致病细菌在重要的农作物中引起许多疾病。黄单胞菌的致病性取决于保守的III型分泌(T3S)系统,该系统将超过25种不同的效应蛋白注入植物细胞。在这些注射的蛋白质中是模仿植物转录激活剂并操纵植物转录组的转录激活剂样效应物(TALE)(参见Kay等人,(2007)Science 318:648-651)。这些蛋白质含有DNA结合结构域和转录激活结构域。被最充分表征的TALE之一是来自Xanthomonascampestgris pv.Vesicatoria的AvrBs3(参见Bonas等人,(1989)Mol Gen Genet 218:127-136和WO2010079430)。TALE含有一个串联重复序列的集中(centralized)结构域,每个重复序列含有约34个氨基酸,这是这些蛋白质的DNA结合特异性的关键。另外,它们含有核定位序列和酸性转录激活结构域(综述参见Schornack S等人,(2006)J Plant Physiol 163(3):256-272)。此外,已经在植物致病性细菌青枯雷尔氏菌(Ralstonia solanacearum)中发现了两个基因,分别称为brg11和hpx17,它们与R.solanacearum biovar 1菌株GMI1000和biovar 4菌株RS1000中黄单胞菌的AvrBs3家族同源(参见Heuer等人,(2007)Appl andEnvir Micro 73(13):4379-4384)。这些基因在核苷酸序列上彼此具有98.9%的同一性,但在hpx17的重复结构域中因缺失1,575bp而不同。然而,两种基因产物与黄单胞菌的AvrBs3家族蛋白具有少于40%的序列同一性。
这些TALE的特异性取决于在串联重复序列(repeat)中发现的序列。重复序列包含约102bp,并且重复序列通常彼此具有91-100%的同源性(Bonas等人,同上)。重复序列的多态性通常位于12和13位,并且在12和13位的高变二残基的同一性与TALE靶序列中连续核苷酸的同一性之间存在一一对应的关系(参见Moscou和Bogdanove(2009)Science 326:1501和Boch等人,(2009)Science 326:1509-1512)。在实验上,已确定了这些TALE的DNA识别代码,以使12和13位的HD序列导致与胞嘧啶(C)结合,NG与T结合,NI与A、C、G或T结合,NN与A或G结合并且NG与T结合。这些DNA结合重复序列已被组装成具有新的重复序列组合和数量的蛋白质,以制造能够与新序列相互作用的人工转录因子。另外,通过引用整体并入本文的美国专利号8,586,526和美国专利公开号2013/0196373描述了具有N-帽多肽、C-帽多肽(例如,+63、+231或+278)和/或新型(非典型)RVD的TALE。
在美国专利号8,586,526和9,458,205中描述了示例性的TALE,通过引用整体并入本文。
在某些实施方案中,DNA结合结构域包括二聚化和/或多聚化结构域,例如卷曲螺旋(CC)和二聚化锌指(DZ)。参见美国专利公开号2013/0253040。
仍在进一步的实施方案中,DNA结合结构域包含CRISPR/Cas系统的单向指导RNA,例如20150056705中公开的sgRNA。
最近出现了关于古细菌和许多细菌中存在RNA介导的基因组防御途径的有力证据,该防御途径被假设与真核RNAi途径平行(对于综述,参见Godde和Bickerton,2006.J.Mol.Evol.62:718-729;Lillestol等人,2006.Archaea 2:59-72;Makarova等人,2006.Biol.Direct 1:7.;Sorek等人,2008.Nat.Rev.Microbiol.6:181-186)。已知被称为CRISPR-Cas系统或原核RNAi(pRNAi),该途径被认为源自两个在进化上且通常是在物理上关联的基因位点:CRISPR(聚簇的规则间隔的短回文重复序列)基因座,其编码系统的RNA组分,以及编码蛋白质的cas(CRISPR相关的)基因座(Jansen等人,2002.Mol.Microbiol.43:1565-1575;Makarova等人,2002.Nucleic Acids Res.30:482-496;Makarova等人,2006.Biol.Direct 1:7;Haft等人,2005.PLoS Comput.Biol.1:e60)。微生物宿主中的CRISPR基因座包含CRISPR相关(Cas)基因以及能够编程CRISPR介导的核酸切割特异性的非编码RNA元件的组合。单个Cas蛋白与真核RNAi机制的蛋白质组分没有显著的序列相似性,但是具有类似的预测功能(例如,RNA结合、核酸酶、解旋酶等)(Makarova等人,2006.Biol.Direct 1:7)。CRISPR相关(cas)基因通常与CRISPR重复间隔子阵列结合。已经描述了多于四十个不同的Cas蛋白家族。在这些蛋白质家族中,Cas1在不同的CRISPR/Cas系统中似乎无处不在。cas基因和重复序列结构的特定组合已被用于定义8种CRISPR亚型(大肠杆菌(E.coli)、Y.pest、N.meni、D.vulg、T.neap,H;mari,A;pern和M.tube),其中一些与编码重复相关神秘蛋白(RAMP)的其他基因模块结合。单个基因组中可能存在多于一种CRISPR亚型。CRISPR/Cas亚型的零星分布提示该系统在微生物进化过程中会受到水平基因转移的影响。
最初描述于化脓性链球菌(S.pyogenes)中的II型CRISPR是表征最充分的系统之一,并在四个连续步骤中进行了靶向DNA双链断裂。首先,从CRISPR基因座转录两个非编码RNA,即pre-crRNA阵列和tracrRNA。第二,tracrRNA与pre-crRNA的重复区域杂交,并将pre-crRNA的加工介导为含有单个间隔区序列的成熟crRNA,其中在Cas9蛋白存在下,双链特异性RNase III进行加工。第三,成熟的crRNA:tracrRNA复合物在crRNA上的间隔子与靶DNA上邻近原间隔子(protospacer)相邻基序(PAM)(其为靶识别的额外要求)的原间隔子之间通过Watson-Crick碱基配对将Cas9引导至靶DNA。此外,tracrRNA还必须存在,因为它与crRNA在3′端碱基配对,并且这种结合触发Cas9活性。最后,Cas9介导靶DNA的切割,以在原间隔子内产生双链断裂。CRISPR/Cas系统的活动包括三个步骤:(i)在称为‘适应’的过程中,将外来DNA序列插入CRISPR阵列以防止将来的攻击,(ii)相关蛋白的表达以及阵列的表达和加工,随后是(iii)外来核酸的RNA介导的干扰。因此,在细菌细胞中,一些所谓的“Cas”蛋白参与CRISPR/Cas系统的天然功能。
已经在许多不同的细菌中发现了II型CRISPR系统。Fonfara等人((2013)Nuc AcidRes 42(4):2377-2590)对公开可用基因组的BLAST搜索在347种细菌中发现了Cas9直系同源物(ortholog)。此外,该小组利用化脓性链球菌、变形链球菌(S.mutans)、嗜热链球菌(S.therophilus)、空肠弯曲杆菌(C.jejuni)、脑膜炎奈瑟氏球菌(N.meningitides)、多杀性巴氏杆菌(P.multocida)和弗朗西丝菌(F.novicida)的Cas9直系同源物证明了DNA靶标的体外CRISPR/Cas切割。因此,术语“Cas9”是指包含DNA结合结构域和两个核酸酶结构域的RNA指导的DNA核酸酶,其中编码Cas9的基因可以源自任何合适的细菌。
Cas9蛋白具有至少两个核酸酶结构域:一个核酸酶结构域类似于HNH核酸内切酶,而另一个类似于Ruv核酸内切酶结构域。HNH型结构域似乎负责切割与crRNA互补的DNA链,而Ruv结构域则切割非互补链。可以对Cas 9核酸酶进行工程改造,使得只有一个核酸酶结构域有功能,产生Cas切口酶(参见Jinek等人,(2012)Science 337:816)。可以通过酶的催化结构域中氨基酸的特定突变或通过截短部分或全部结构域使其不再有功能来产生切口酶。由于Cas 9包含两个核酸酶结构域,因此可以在任一结构域上采用此方法。通过使用两个这样的Cas 9切口酶可以在靶DNA中实现双链断裂。切口酶将各自切割DNA的一条链,而两个酶的使用将产生双链断裂。
可以通过使用工程化的“单向指导RNA”(sgRNA)来避免对crRNA-tracrRNA复合物的需求,该工程化的“单向指导RNA”包含通常由crRNA和tracrRNA退火形成的发夹(参见Jinek等人,同上和Cong等人,(2013)Sciencexpress/10.1126/science.1231143)。在热原链球菌(S.pyrogenes)中,工程化的tracrRNA:crRNA融合体,或sgRNA在Cas结合的RNA与靶DNA之间形成双链RNA:DNA异二聚体时,指导Cas9切割靶DNA。包含Cas9蛋白和含有PAM序列的工程化sgRNA的该系统已用于RNA指导的基因组编辑(参见Ramalingam等人,Stem Cellsand Development 22(4):595-610(2013)),并且已用于斑马鱼胚胎体内基因组编辑(参见Hwang等人,(2013)Nature Biotechnology 31(3):227),其编辑效率类似于ZFN和TALEN。
CRISPR基因座的主要产物似乎是含有入侵者靶向序列的短RNA,并且基于其在途径中的假定作用而被称为引导RNA或原核沉默RNA(psiRNA)(Makarova等人,2006.Biol.Direct 1:7;Hale等人,2008.RNA,14:2572-2579)。RNA分析表明CRISPR基因座转录物在重复序列内被切割,释放约60-70nt的RNA中间体,其含有单个入侵者靶向序列和侧翼重复片段(Tang等人,2002.Proc.Natl.Acad.Sci.99:7536-7541;Tang等人,2005.Mol.Microbiol.55:469-481;Lillestol等人,2006.Archaea 2:59-72;Brouns等人,2008.Science 321:960-964;Hale等人,2008.RNA,14:2572-2579)。在古生热球菌(Pyrococcus furiosus)中,这些中间RNA被进一步加工成丰富的,稳定的
可以通过使用工程化的“单向指导RNA”(sgRNA)来避免对crRNA-tracrRNA复合物的需求,该工程化的“单向指导RNA”包含通常由crRNA和tracrRNA退火形成的发夹(参见Jinek等人,(2012)Science 337:816和Cong等人,(2013)Sciencexpress/10.1126/science.1231143)。在热原链球菌中,工程化的tracrRNA:crRNA融合体,或sgRNA在Cas结合的RNA与靶DNA之间形成双链RNA:DNA异二聚体时,指导Cas9切割靶DNA。包含Cas9蛋白和含有PAM序列的工程化sgRNA的该系统已用于RNA指导的基因组编辑(参见Ramalingam等人,同上),并且已用于斑马鱼胚胎体内基因组编辑(参见Hwang等人,(2013)NatureBiotechnology 31(3):227),其编辑效率类似于ZFN和TALEN。
可以将嵌合或sgRNA工程化以包含与任何所需靶标互补的序列。在一些实施方案中,指导序列的长度为约或大于约5、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50、75或更多的核苷酸。在一些实施方案中,指导序列的长度小于约75、50、45、40、35、30、25、20、15、12或更少的核苷酸。在某些实施方案中,sgRNA包含与tau靶位点的12、13、14、15、16、17、18、19、20或更多个连续核苷酸结合的序列,如美国公开号20180153921中所示。在一些实施方案中,RNA包含与靶标互补的22个碱基,形式为G[n19],然后是化脓性链球菌CRISPR/Cas系统使用的NGG或NAG形式的原间隔物相邻基序(PAM)。因此,在一种方法中,可以通过(i)将ZFN异二聚体的识别序列与相关基因组(人、小鼠或特定的植物物种)的参考序列进行比对;(ii)鉴定ZFN半位点之间的间隔区;(iii)鉴定最接近间隔区的基序G[N20]GG的位置(当多于一个基序与间隔区重叠时,选择相对于间隔区居中的基序);(iv)使用该基序作为sgRNA的核心,利用目的基因中已知的ZFN靶标来设计sgRNA。该方法有利地依赖于已证明的核酸酶靶标。或者,可以通过简单地鉴定符合G[n20]GG公式的合适靶序列,将sgRNA设计为靶向任何目标区域。sgRNA可以与互补区一起包含另外的核苷酸,以延伸到sgRNA的tracrRNA部分的尾部区域(参见Hsu等人,(2013)NatureBiotech doi:10.1038/nbt.2647)。尾部可以是+67至+85个核苷酸,或两者之间的任何数目,优选长度为+85个核苷酸。也可以使用截短的sgRNA,“tru-gRNA”(参见Fu等人,(2014)Nature Biotech 32(3):279)。在tru-gRNA中,互补区域的长度减少到17或18个核苷酸。
此外,还可以利用备选的PAM序列,其中PAM序列可以是使用化脓性链球菌Cas9的NAG,其作为NGG的备选(Hsu 2013,同上)。另外的PAM序列也可能包括缺少初始G的那些序列(Sander和Joung(2014)Nature Biotech 32(4):347)。除了化脓链球菌编码的Cas9 PAM序列之外,还可以使用对来自其他细菌来源的Cas9蛋白具有特异性的其他PAM序列。例如,以下显示的PAM序列(改编自Sander和Joung,同上和Esvelt等人,(2013)Nat Meth 10(11):1116)对这些Cas9蛋白具有特异性:
因此,可以根据以下指导方针选择化脓性链球菌CRISPR/Cas系统使用的合适的靶序列:[n17、n18、n19或n20](G/A)G。或者,PAM序列可以遵循指导方针G[n17、n18、n19、n20](G/A)G。对于源自非化脓性链霉菌的Cas9蛋白,如果化脓性链霉菌PAM序列中备选的PAM被替代,则可使用相同的指导方针。
最优选的是选择具有最高特异性可能性的靶序列,其避免潜在的脱靶序列。这些不想要的脱靶序列可以通过考虑以下属性来鉴定:i)靶序列中的相似性,其后是已知与所利用的Cas9蛋白一起起作用的PAM序列;ii)与所期望的靶序列具有少于三个错配的相似靶序列;iii)与ii)中类似的靶序列,其中错配都位于PAM远端区域而不是PAM近端区域(一些证据表明,紧邻PAM或紧邻PAM的核苷酸1-5,有时称为‘种子’区域(Wu等人,(2014)NatureBiotech doi:10.1038/nbt2889)对于识别至关重要,因此,具有定位于在种子区域中错配的推定脱靶位点最不可能被sg RNA识别);和iv)相似的靶序列,其中错配不连续间隔或间隔超过四个核苷酸(Hsu 2014,同上)。因此,通过使用以上这些标准,通过分析使用任何CRIPSR/Cas系统的基因组中潜在的脱靶位点的数目,可以鉴定sgRNA的合适靶序列。
在一些实施方案中,使用CRISPR-Cpf1系统。在弗朗西丝菌属中鉴定到的CRISPR-Cpf1系统是2类CRISPR-Cas系统,其可在人细胞中介导强大的DNA干扰。尽管Cpf1和Cas9在功能上是保守的,但它们在许多方面都不同,包括其指导RNA和底物特异性(参见Fagerlund等人(2015)Genom Bio 16:251)。Cas9和Cpf1蛋白之间的主要区别是Cpf1不利用tracrRNA,因此仅需要crRNA。FnCpf1 crRNA长42–44个核苷酸(19个核苷酸的重复序列和23–25个核苷酸的间隔区),并含有单个茎环,其可以耐受保留二级结构的序列变化。此外,Cpf1 crRNA明显短于Cas9所需的
在一些实施方案中,可以使用其他Cas蛋白。一些示例性的Cas蛋白包括Cas9、Cpf1(也称为Cas12a)、C2c1、C2c2(也称为Cas13a)、C2c3、Cas1、Cas2、Cas4、CasX和CasY;并且包括其工程化和天然变体(Burstein等人(2017)Nature 542:237-241),例如HF1/spCas9((Kleinstiver等人(2016)Nature 529:490-495;Cebrian-Serrano和Davies(2017)MammGenome(2017)28(7):247-261);分割型Cas9系统(Zetsche等人(2015)Nat Biotechnol 33(2):139-142),基于内含肽-外显肽(intein-extein)系统的反式剪切Cas9(Troung等人(2015)Nucl Acid Res 43(13):6450-8);小-SaCas9(Ma等人(2018)ACS Synth Biol 7(4):978-985)。因此,在本文所述的方法和组合物中,应理解,术语“Cas”包括所有天然的和工程化的Cas变体蛋白。因此,如本文所用,“CRISPR/Cas系统”是指任何CRISPR/Cas系统,包括核酸酶、切口酶和/或转录因子系统。
在某些实施方案中,Cas蛋白可以是天然存在的Cas蛋白的“功能衍生物”。天然序列多肽的“功能衍生物”是具有与天然序列多肽相同的定性生物学特性的化合物。“功能衍生物”包括但不限于天然序列的片段和天然序列多肽及其片段的衍生物,只要它们具有与相应的天然序列多肽相同的生物学活性。本文考虑的生物学活性是功能衍生物将DNA底物水解成片段的能力。术语“衍生物”涵盖多肽的氨基酸序列变体、共价修饰及其融合体。在一些方面,功能性衍生物可包含天然存在的Cas蛋白的单一生物学特性。在其他方面,功能衍生物可以包含天然存在的Cas蛋白的生物学特性的子集。Cas多肽或其片段的合适衍生物包括但不限于Cas蛋白或其片段的突变体、融合体、共价修饰。包括Cas蛋白或其片段以及Cas蛋白或其片段的衍生物的Cas蛋白可以从细胞获得或通过化学合成或通过这两种方法的组合而获得。所述细胞可以是这样的细胞,其天然产生Cas蛋白的细胞,或者是这样的细胞,其天然产生Cas蛋白并经遗传改造以产生较高表达水平的内源Cas蛋白或由外源导入的核酸(所述核酸编码与内源Cas相同或不同的Cas)产生Cas蛋白。在一些情况下,该细胞不天然产生Cas蛋白,而是经过遗传改造以产生Cas蛋白。
例如,在美国公开号2015/0056705中公开了靶向特定基因(包括安全港基因)的示例性CRISPR/Cas核酸酶系统。
因此,核酸酶包含DNA结合结构域与切割DNA的核酸酶结构域组合,所述DNA结合结构域与期望向其中插入供体(转基因)的任何基因中的靶位点特异性结合。
功能结构域
DNA结合结构域可以与一个或更多个功能结构域融合或以其他方式与之结合,以形成如本文所述的人工转录因子。在某些实施方案中,所述方法采用融合分子,所述融合分子包含至少一个DNA结合分子(例如,ZFP、TALE或单向导RNA)和异源调节(功能)结构域(或其功能片段)。
在某些实施方案中,遗传调节物的人工转录因子的功能结构域包含转录调节结构域。常见结构域包括,例如,转录因子结构域(激活子、阻遏物、共激活子、共阻遏物)、沉默子、癌基因(oncogene)(例如,myc、jun、fos、myb、max、mad、rel、ets、bcl、myb、mos家庭成员等);DNA修复酶及其相关因子和修饰剂;DNA重排酶及其相关因子和修饰剂;染色质相关蛋白及其修饰剂(例如激酶、乙酰基酶和脱乙酰基酶);和DNA修饰酶(例如甲基转移酶,如DNMT家族的成员(例如DNMT1、DNMT3A、DNMT3B、DNMT3L等、拓扑异构酶、解旋酶、连接酶、激酶、磷酸酶、聚合酶、核酸内切酶)及其相关因子和修饰剂。参见例如美国公开号2013/0253040,其通过引用整体并入本文。
用于实现激活的合适的结构域包括HSV VP16激活结构域(参见,例如,Hagmann等人,J.Virol.71,5952-5962(1997))核激素受体(参见,例如,Torchia等人,Curr.Opin.Cell.Biol.10:373-383(1998));核因子κB的p65亚基(Bitko&Barik,J.Virol.72:5610-5618(1998)和Doyle&Hunt,Neuroreport8:2937-2942(1997));Liu等人,Cancer Gene Ther.5:3-28(1998))或人工嵌合功能结构域,如VP64(Beerli等人,(1998)Proc.Natl.Acad.Sci.USA95:14623-33),和degron(Molinari等人,(1999)EMBO J.18,6439-6447)。另外的示例性激活结构域包括Oct 1、Oct-2A、Sp1、AP-2和CTF1(Seipel等人,EMBO J.11,4961-4968(1992)以及p300、CBP、PCAF、SRC1 PvALF、AtHD2A和ERF-2。参见例如,Robyr等人,(2000)Mol.Endocrinol.14:329-347;Collingwood等人,(1999)J.Mol.Endocrinol.23:255-275;Leo等人,(2000)Gene 245:1-11;Manteuffel-Cymborowska(1999)Acta Biochim.Pol.46:77-89;McKenna等人,(1999)J.SteroidBiochem.Mol.Biol.69:3-12;Malik等人,(2000)Trends Biochem.Sci.25:277-283;和Lemon等人,(1999)Curr.Opin.Genet.Dev.9:499-504。另外的示例性激活结构域包括但不限于OsGAI、HALF-1、C1、AP1、ARF-5、-6、-7和-8、CPRF1、CPRF4、MYC-RP/GP和TRAB1。参见,例如Ogawa等人,(2000)Gene 245:21-29;Okanami等人,(1996)Genes Cells1:87-99;Goff等人,(1991)Genes Dev.5:298-309;Cho等人,(1999)Plant Mol.Biol.40:419-429;Ulmason等人,(1999)Proc.Natl.Acad.Sci.USA96:5844-5849;Sprenger-Haussels等人,(2000)Plant J.22:1-8;Gong等人,(1999)Plant Mol.Biol.41:33-44;和Hobo等人,(1999)Proc.Natl.Acad.Sci.USA96:15,348-15,353。
可用于制造遗传阻遏物的示例性抑制结构域包括但不限于KRABA/AB、KOX、TGF-β诱导型早期基因(TIEG)、v-erbA、SID、MBD2、MBD3、DNMT家族的成员(例如DNMT1、DNMT3A、DNMT3B、DNMT3L等)、Rb和MeCP2。参见,例如,Bird等人,(1999)Cell 99:451-454;Tyler等人,(1999)Cell 99:443-446;Knoepfler等人,(1999)Cell 99:447-450;和Robertson等人,(2000)Nature Genet.25:338-342。另外的示例性抑制结构域包括,但不限于ROM2和AtHD2A。参见,例如,Chem等人,(1996)Plant Cell 8:305-321;和Wu等人,(2000)PlantJ.22:19-27。
在一些情况下,该结构域参与染色体的表观遗传调控。在一些实施方案中,该结构域是组蛋白乙酰转移酶(HAT),例如A型,核定位的,如MYST家族成员MOZ、Ybf2/Sas3、MOF和Tip60、GNAT家族成员Gcn5或pCAF、p300家族成员CBP、p300或Rtt109(Berndsen和Denu(2008)Curr Opin Struct Biol18(6):682-689)。在其他情况下,该结构域是组蛋白脱乙酰基酶(HDAC),例如I类(HDAC-1、2、3和8),II类(HDAC IIA(HDAC-4、5、7和9)、HDAC IIB(HDAC6和10)),IV类(HDAC-11),III类(也称为sirtuins(SIRT);SIRT1-7)(参见Mottamal等人,(2015)Molecules 20(3):3898-3941)。在一些实施方案中使用的另一个结构域是组蛋白高度磷酸化的酶或激酶,其中实例包括MSK1、MSK2、ATR、、ATM、DNA-PK、Bub1、VprBP、IKK-α、PKCβ1、Dik/Zip、JAK2、PKC5、WSTF和CK2。在一些实施方案中,使用甲基化结构域并且可以选自诸如以下的组:Ezh2、PRMT1/6、PRMT5/7、PRMT 2/6、CARM1、set7/9、MLL、ALL-1、Suv 39h、G9a、SETDB1、Ezh2、Set2、Dot1、PRMT 1/6、PRMT 5/7、PR-Set7和Suv4-20h。在一些实施方案中也可以使用参与磺酰基化(sumoylation)和生物素化的结构域(Lys9、13、4、18和12)(综述参见Kousarides(2007)Cell 128:693-705)。
通过本领域技术人员众所周知的克隆和生化缀合方法来构建融合分子。融合分子包含DNA结合结构域和功能结构域(例如,转录激活或抑制结构域)。融合分子还任选地包含核定位信号(如例如,其来自SV40培养基T抗原)和表位标签(例如,FLAG和血凝素)。设计融合蛋白(和编码它们的核酸),使得翻译读框被保留在融合组分之间。
通过本领域技术人员已知的生化缀合方法来构建一方面功能结构域(或其功能片段)的多肽组分与另一方面的非蛋白质DNA结合结构域(例如,抗生素、嵌入剂、小沟结合物、核酸)之间的融合体。参见,例如,Pierce Chemical Company(Rockford,IL)目录。已经描述了在小沟结合剂和多肽之间进行融合的方法和组合物。Mapp等人,(2000)Proc.Natl.Acad.Sci.USA97:3930-3935。同样地,包含与多肽组分功能结构域结合的sgRNA核酸组分的CRISPR/Cas TF和核酸酶也是本领域技术人员已知的并且在本文中进行了详细描述。
如本领域技术人员已知的,融合分子可以与药学上可接受的载体一起配制。参见,例如,Remington’s Pharmaceutical Sciences,第17版,1985年;和共同拥有国际专利公开号WO 00/42219。
融合分子的功能组分/结构域可以选自一旦融合分子经由其DNA结合结构域与靶序列结合就能够影响基因转录的多种不同组分中的任一种。因此,功能组分可以包括但不限于各种转录因子结构域,如激活剂、阻遏物、共激活剂、共阻遏物和沉默子。
在某些实施方案中,融合分子包含DNA结合结构域和核酸酶结构域以产生功能实体,该功能实体能够通过其工程化的(ZFP或TALE或sgRNA)DNA结合结构域识别其预期的核酸靶标并产生核酸酶(例如,锌指核酸酶或TALE核酸酶或CRISPR/Cas核酸酶),引起DNA通过核酸酶活性在DNA结合位点附近被切割。这种切割导致tau基因失活(抑制)。因此,遗传阻遏物也包括核酸酶。
因此,本文所述的方法和组合物是广泛适用的,并且可以涉及任何目的核酸酶。核酸酶的非限制性实例包括大范围核酸酶、TALEN和锌指核酸酶。核酸酶可包含异源DNA结合和切割结构域(例如,锌指核酸酶;TALEN;具有异源切割域的大范围核酸酶DNA结合结构域、与核酸酶结构域结合的sgRNA),或者结合结构域可以改变天然存在的核酸酶的DNA结合结构域以结合选定的靶位点(例如,已被设计以结合与同源结合位点不同的位点的大范围核酸酶)。
核酸酶结构域可以源自任何核酸酶,例如任何核酸内切酶或核酸外切酶。可以与如本文所述的DNA结合结构域融合的合适的核酸酶(切割)结构域的非限制性实例包括来自任何限制酶的结构域,例如IIS型限制酶(例如,FokI)。在某些实施方案中,切割结构域是需要二聚化以用于切割活性的切割半结构域。参见,例如,美国专利号8,586,526;8,409,861;和7,888,121,通过引用整体并入本文。通常,如果融合蛋白包含切割半结构域,则需要两个融合蛋白进行切割。或者,可以使用包含两个切割半结构域的单一蛋白质。两个切割半结构域可以源自相同的核酸内切酶(或其功能片段),或者每个切割半结构域均可以源自不同的核酸内切酶(或其功能片段)。另外,两个融合蛋白的靶位点优选地相对于彼此布置,使得两个融合蛋白与它们各自的靶位点的结合使切割半结构域彼此在空间方向上放置,其允许切割半结构域以形成功能性切割结构域,例如通过二聚化。
核酸酶结构域也可以源自具有切割活性的任何大范围核酸酶(归巢内切核酸酶)结构域也可以与本文所述的核酸酶一起使用,包括但不限于I-SceI、I-CeuI、PI-PspI、PI-Sce、I-SceIV、I-CsmI、I-PanI、I-SceII、I-PpoI、I-SceIII、I-CreI、I-TevI、I-TevII和I-TevIII。
在某些实施方案中,核酸酶包含致密TALEN(cTALEN)。这些是将TALE DNA结合结构域与TevI核酸酶结构域连接的单链融合蛋白。根据TALE DNA结合结构域相对于大范围核酸酶(例如,TevI)核酸酶结构域的定位,融合蛋白可以充当定位于TALE区的切口酶,或者可以产生双链断裂(参见Beurdeley等人)(2013)Nat Comm:1-8DOI:10.1038/ncomms2782)。
在其他实施方案中,TALE核酸酶是megaTAL。这些mega TAL核酸酶是包含TALE DNA结合结构域和大范围核酸酶切割结构域的融合蛋白。大范围核酸酶切割结构域作为单体具有活性,并且不需要二聚作用来实现活性。(参见Boissel等人,(2013)Nucl Acid Res:1-13,doi:10.1093/nar/gkt1224)。
另外,大范围核酸酶的核酸酶结构域也可表现出DNA结合功能。任何TALEN可以与另外的TALEN(例如,具有一个或更多个mega-TAL的一个或更多个TALEN(cTALEN或FokI-TALEN))和/或ZFN组合使用。
另外,与野生型相比,切割结构域可包括一个或更多个改变,例如用于形成减少或消除脱靶切割效应的专性异二聚体(obligate heterodimer)。参见,例如,美国专利号7,914,796;8,034,598;和8,623,618,通过引用整体并入本文。
如本文所述的核酸酶可在双链靶标(例如,基因)中产生双链或单链断裂。单链断裂(“切口”)的产生描述于例如美国专利号8,703,489和9,200,266中,其通过引用并入本文,其描述了核酸酶结构域之一的催化结构域的突变如何产生切口酶。
因此,核酸酶(切割)结构域或切割半结构域可以是保留切割活性或保留多聚(例如,二聚化)以形成功能性切割结构域的能力的蛋白质的任何部分。
或者,可以使用所谓的“分裂酶(split-enzyme)”技术在核酸靶位点处体内组装核酸酶(参见例如美国专利公开号2009/0068164)。此类分裂酶的组分可以在单独的表达构建体上表达,或可以在一个开放阅读框中连接,在该阅读框中,单个组分是例如通过自切割2A肽或IRES序列分开的。组分可以是单独的锌指结合结构域或大范围核酸酶核酸结合结构域的结构域。
如在美国公开号2009/0111119中所述,可在使用前例如在基于酵母的染色体系统中筛选核酸酶的活性。可以使用本领域已知的方法容易地设计核酸酶表达构建体。
融合蛋白(或其组分)的表达可以在组成型启动子或诱导型启动子的控制下,例如在棉子糖和/或半乳糖的存在下被激活(去抑制)的半乳糖激酶启动子。优选启动子的非限制性实例包括神经系统特异性启动子NSE、CMV、Synapsin、CAMKiia和MECP。普遍存在的启动子的非限制性实例包括CAS和Ubc。进一步的实施方案包括如美国专利公开号2015/0267205中所述使用自我调节启动子(通过包含DNA结合结构域的高亲和力结合位点)。
递送
可以通过任何合适的方式,包括例如注射蛋白质,经由mRNA和/或使用表达构建体(例如,质粒、慢病毒载体、AAV载体、Ad载体等)将本文所述的蛋白质和/或多核苷酸(例如,遗传调节物)和包含所述蛋白质和/或多核苷酸的组合物递送至靶细胞。在优选的实施方案中,使用AAV载体递送阻遏物,所述AAV载体包括但不限于AAV2/6或AAV2/9(参见美国专利号7,198,951),即美国专利号9,585,971中所述的AAV载体。
如本文所述,递送包含锌指蛋白的蛋白的方法描述于例如美国专利号6,453,242;6,503,717;6,534,261;6,599,692;6,607,882;6,689,558;6,824,978;6,933,113;6,979,539;7,013,219;和7,163,824,其全部公开内容通过引用整体并入本文。
可以使用任何载体系统,包括但不限于质粒载体、逆转录病毒载体、慢病毒载体、腺病毒载体、痘病毒载体;疱疹病毒载体和腺相关病毒载体等。也参见,美国专利号8,586,526;6,534,261;6,607,882;6,824,978;6,933,113;6,979,539;7,013,219;和7,163,824,通过引用整体并入本文。此外,将显而易见的是,这些载体中的任何一个可包含一个或更多个DNA结合蛋白编码序列。因此,当将一种或多种调节物(例如,阻遏物)引入细胞中时,编码蛋白质组分和/或多核苷酸组分的序列可以被携带在同一载体或不同载体上。当使用多个载体时,每个载体可包含编码一个或更多个调节物(例如,阻遏物)或其组分的序列。在优选的实施方案中,载体系统是AAV载体,例如AAV6或AAV9或在美国专利号9,585,971或美国公开号20170119906中描述的AAV变体。
常规的基于病毒和非病毒的基因转移方法可用于将编码工程化的调节物的核酸引入细胞(例如,哺乳动物细胞)和靶组织中。此类方法还可用于将编码此类阻遏物(或其组分)的核酸体外向细胞施用。在某些实施方案中,施用编码阻遏物的核酸用于体内或离体基因治疗用途。非病毒载体递送系统包括DNA质粒、裸核酸以及与诸如脂质体或泊洛沙姆(poloxamer)的递送载体络合的核酸。病毒载体传递系统包括DNA和RNA病毒,它们在递送至细胞后具有游离基因组或整合基因组。有关基因治疗程序的综述,参见Anderson,Science256:808-813(1992);Nabel&Felgner,TIBTECH 11:211-217(1993);Mitani&Caskey,TIBTECH 11:162-166(1993);Dillon,TIBTECH11:167-175(1993);Miller,Nature 357:455-460(1992);Van Brunt,Biotechnology 6(10):1149-1154(1988);Vigne,RestorativeNeurology and Neuroscience 8:35-36(1995);Kremer&Perricaudet,British MedicalBulletin51(1):31-44(1995);Haddada等人,Current Topics in Microbiology andImmunology Doerfler和
核酸的非病毒递送的方法包括电穿孔、脂转染、显微注射、基因枪(biolistics)、病毒体、脂质体、免疫脂质体、聚阳离子或脂质:核酸缀合物、裸露的DNA、裸露的RNA、人工病毒体以及试剂增强的对DNA吸收。使用例如Sonitron 2000系统(Rich-Mar)的Sonoporation也可以用于递送核酸。在优选的实施方案中,一种或多种核酸作为mRNA被递送。还优选使用带帽的mRNA以增加翻译效率和/或mRNA稳定性。特别优选的是ARCA(防反向帽类似物)帽或其变体。参见美国专利号7,074,596和8,153,773,其通过引用并入本文。
另外的示例性核酸递送系统包括由Amaxa Biosystems(Cologne,Germany)、Maxcyte,Inc.(Rockville,Maryland)、BTX Molecular Delivery Systems(Holliston,MA)和Copernicus Therapeutics Inc,(参见例如美国专利号6,008,336)提供的那些核酸递送系统。脂质转染描述于例如美国专利号5,049,386;4,946,787;和4,897,355)并且脂转染试剂在市场上出售(例如,Transfectam
脂质:核酸复合物,包括靶向脂质体,如免疫脂质复合物的制备,是本领域技术人员众所周知的(参见,例如,Crystal,Science 270:404-410(1995);Blaese等人,CancerGene Ther.2:291-297(1995);Behr等人,Bioconjugate Chem.5:382-389(1994);Remy等人,Bioconjugate Chem.5:647-654(1994);Gao等人,Gene Therapy 2:710-722(1995);Ahmad等人,Cancer Res.52:4817-4820(1992);美国专利号4,186,183;4,217,344;4,235,871;4,261,975;4,485,054;4,501,728;4,774,085;4,837,028;和4,946,787)。
其他递送方法包括使用将待递送的核酸包装到EnGeneIC递送媒介物(EDV)中。使用双特异性抗体将这些EDV特异性地递送至靶组织,在所述双特异性抗体中抗体的一个臂对靶组织具有特异性,而另一臂对EDV具有特异性。抗体将EDV带到靶细胞表面,然后通过内吞作用将EDV带入细胞。一旦进入细胞,内容物就被释放(参见MacDiarmid等人,(2009)Nature Biotechnology 27(7):643)。
使用基于RNA或DNA病毒的系统来递送编码工程化的ZFP、TALE或CRISPR/Cas系统的核酸利用了高度进化的过程,可将病毒靶向体内的特定细胞并将病毒有效载荷(payload)运输至细胞核。病毒载体可直接施用于患者(体内),或它们可用于体外治疗细胞,而修饰的细胞施用于患者(离体)。用于递送ZFP、TALE或CRISPR/Cas系统的常规基于病毒的系统包括但不限于用于基因转移的逆转录病毒、慢病毒、腺病毒、腺伴随、疫苗和单纯疱疹病毒载体。使用逆转录病毒、慢病毒和腺相关病毒基因转移方法可以将其整合到宿主基因组中,这通常会导致插入的转基因长期表达。另外,已经在许多不同的细胞类型和靶组织中观察到高转导效率。
逆转录病毒的向性(tropism)可以通过掺入外来包膜蛋白,扩大靶细胞的潜在靶标群体来改变。慢病毒载体是能够转导或感染非分裂细胞并通常产生高病毒滴度的逆转录病毒载体。逆转录病毒基因转移系统的选择取决于靶组织。逆转录病毒载体包含顺式作用的长末端重复序列,其具有对多达6-10kb的外来序列的包装能力。最小的顺式作用LTR足以用于载体的复制和包装,然后其用于将治疗性基因整合到靶细胞中以提供永久性转基因表达。广泛使用的逆转录病毒载体包括基于小鼠白血病病毒(MuLV)、长臂猿(gibbon ape)白血病病毒(GaLV)、猿猴免疫缺陷病毒(SIV)、人免疫缺陷病毒(HIV)及其组合的载体(参见,例如Buchscher等人,J.Virol.66:2731-2739(1992);Johann等人,J.Virol.66:1635-1640(1992);Sommerfelt等人,Virol.176:58-59(1990);Wilson等人,J.Virol.63:2374-2378(1989);Miller等人,J.Virol.65:2220-2224(1991);国际专利公开号WO 1994/026877)。
在其中优选瞬时表达的应用中,可以使用基于腺病毒的系统。基于腺病毒的载体能够在许多细胞类型中具有很高的转导效率,并且不需要细胞分裂。使用这样的载体,已经获得了高滴度和高水平的表达。该载体可以在相对简单的系统中大量产生。腺相关病毒(“AAV”)载体也用于例如在核酸和肽的体外生产中,以及在体内和离体基因治疗程序中,用靶核酸转导细胞(参见,例如,West等人,Virology 160:38-47(1987);美国专利号4,797,368;国际专利公开号WO 93/24641;Kotin,Human Gene Therapy 5:793-801(1994);Muzyczka,J.Clin.Invest.94:1351(1994)。重组AAV载体的构建在许多出版物中都有描述,包括美国专利号5,173,414;Tratschin等人,Mol.Cell.Biol.5:3251-3260(1985);Tratschin等人,Mol.Cell.Biol.4:2072-2081(1984);Hermonat&Muzyczka,PNAS 81:6466-6470(1984);和Samulski等人,J.Virol.63:03822-3828(1989)。
目前至少有六种病毒载体方法可用于临床试验中的基因转移,其利用了涉及通过插入辅助细胞系中的基因对缺陷载体进行互补以产生转导剂的方法。
pLASN和MFG-S是已经在临床试验中使用的逆转录病毒载体的实例(Dunbar等人,Blood 85:3048-305(1995);Kohn等人,Nat.Med.1:1017-102(1995);Malech等人,PNAS 94:22 12133-12138(1997))。PA317/pLASN是基因治疗试验中使用的第一个治疗载体(Blaese等人,Science 270:475-480(1995))。对于MFG-S包装的载体,已经观察到50%或更高的转导效率。(Ellem等人,Immunol Immunother.44(1):10-20(1997);Dranoff等人,Hum.GeneTher.1:111-2(1997)。
重组腺相关病毒载体(rAAV)是基于有缺陷的和非致病性细小病毒(parvovirus)腺伴随2型病毒的有前途的备选基因递送系统。所有载体均来自仅保留AAV的质粒,该AAV大约位于转基因表达盒两侧的145bp反向末端重复序列中。由于整合到转导细胞的基因组中,有效的基因转移和稳定的转基因递送是该载体系统的关键特征。(Wagner等人,Lancet351:9117 1702-3(1998),Kearns等人,Gene Ther.9:748-55(1996))。也可以根据本发明使用其他AAV血清型,包括AAV1、AAV3,AAV4,AAV5,AAV6,AAV8,AAV 8.2,AAV9和AAV rh10,以及假型AAV(如AAV2/8,AAV2/5,AAV2/9和AAV2/6)。根据本发明也可以使用能够穿过血脑屏障的新型AAV血清型(参见例如美国专利号9,585,971)。在优选的实施方案中,使用AAV9载体(包括AAV9的变体和假型)。
复制缺陷的重组腺病毒载体(Ad)可以高滴度产生并且容易感染许多不同的细胞类型。大多数腺病毒载体经过工程改造,以使转基因替代Ad E1a,E1b和/或E3基因;随后,复制缺陷载体在反式提供缺失基因功能的人293细胞中繁殖。Ad载体可以在体内转导多种类型的组织,包括非分裂的,分化的细胞,如在肝、肾和肌肉中发现的那些细胞。常规的Ad载体具有大的承载能力。在临床试验中使用Ad载体的实例涉及多核苷酸疗法,用于通过肌肉注射进行抗肿瘤免疫(Sterman等人,Hum.Gene Ther.7:1083-9(1998))。在临床试验中使用腺病毒载体进行基因转移的其他实例包括Rosenecker等人,Infection 24:1 5-10(1996);Sterman等人,Hum.Gene Ther.9:7 1083-1089(1998);Welsh等人,Hum.Gene Ther.2:205-18(1995);Alvarez等人,Hum.Gene Ther.5:597-613(1997);Topf等人,Gene Ther.5:507-513(1998);Sterman等人,Hum.Gene Ther.7:1083-1089(1998)。
包装细胞用于形成能够感染宿主细胞的病毒颗粒。这样的细胞包括包装腺病毒的293细胞和包装逆转录病毒的ψ2细胞或PA317细胞。基因治疗中使用的病毒载体通常由生产者细胞系产生,该生产者细胞系将核酸载体包装成病毒颗粒。载体通常含有包装和随后整合入宿主(如果适用)所需的最小病毒序列,被编码待表达的蛋白质的表达盒取代的其他病毒序列。缺失的病毒功能由包装细胞系反式提供。例如,用于基因治疗的AAV载体通常仅具有来自AAV基因组的反向末端重复(ITR)序列,其是包装和整合到宿主基因组中所需要的。病毒DNA在细胞系中包装,该细胞系含有编码其他AAV基因(即rep和cap)但缺少ITR序列的辅助质粒。该细胞系还被腺病毒作为辅助(helper)感染。辅助病毒促进AAV载体的复制和AAV基因从辅助质粒的表达。由于缺少ITR序列,因此没有大量包装辅助质粒。腺病毒的污染可以通过例如腺病毒比AAV对其更敏感的热处理来减少。
在许多基因治疗应用中,期望以高度特异性将基因治疗载体递送至特定组织类型。因此,可以通过将配体表达为与病毒外表面上的病毒外壳蛋白的融合蛋白来修饰病毒载体以对给定的细胞类型具有特异性。选择该配体以对已知存在于目的细胞类型上的受体具有亲和力。例如,Han等人,Proc.Natl.Acad.Sci.USA 92:9747-9751(1995)报道,可以对Moloney小鼠白血病病毒进行修饰以表达与gp70融合的人调节蛋白(heregulin),并且该重组病毒感染表达人表皮生长因子受体的某些人乳腺癌细胞。此原理可以扩展到其他病毒靶细胞对,其中所述靶细胞表达受体,而病毒表达包含细胞表面受体的配体的融合蛋白。例如,丝状噬菌体可以被工程化以展示对几乎任何选择的细胞受体具有特异结合亲和力的抗体片段(例如,FAB或Fv)。尽管以上描述主要适用于病毒载体,但是相同的原理可以适用于非病毒载体。可以将此类载体工程化以包含有利于特定靶细胞摄取的特异摄取序列。
基因治疗载体可通过施用给个体患者,通常通过全身性施用(例如,静脉内、腹膜内、肌内、皮下、鞘内、脑池内、脑室内或颅内输注,包括直接注射入脑内,包括递送至脑的任何区域,如海马、皮层、纹状体等)或局部应用,如下所述。或者,可以将载体离体递送至细胞,如从个体患者移植的细胞(例如,淋巴细胞、骨髓穿刺、组织活检)或通用供体造血干细胞,然后通常在选择已经掺入载体的细胞后将细胞重新植入患者。
在某些实施方案中,本文所述的组合物(例如,多核苷酸和/或蛋白质)直接在体内递送。可以将组合物(细胞、多核苷酸和/或蛋白质)直接施用到中枢神经系统(CNS)中,包括但不限于直接注射到脑或脊髓中。脑的一个或更多个区域可能是目标区域,包括但不限于海马、黑质、Meynert基底核(NBM)、纹状体和/或皮层。或者或除了CNS递送,可以全身性施用组合物(例如,静脉内、腹膜内、心内、肌内、皮下、鞘内、脑池内、脑室内和/或颅内输注)。用于将本文所述的组合物直接递送至受试者(包括直接递送至CNS)的方法和组合物包括但不限于经由针头组件的直接注射(例如,立体定向注射)。这样的方法例如在涉及将组合物(包括表达载体)递送至脑的美国专利号7,837,668和8,092,429和美国专利公开号2006/0239966中有所描述,通过引用整体并入本文。
待施用的有效量将根据患者的不同和施用的方式和施用的位点而不同。因此,有效量最好由施用该组合物的医师确定,并且适当的剂量可以由本领域的普通技术人员容易地确定。在允许足够的时间进行整合和表达后(例如,通常为4-15天),对治疗性多肽的血清或其他组织水平的分析以及与施用前的初始水平的比较将确定所施用的量是否过低还是在正确的范围内或过高。初次和随后施用的合适方案也是可变的,但是典型的是初次施用,随后必要时进行后续施用。随后的施用可以以可变的间隔进行施用,范围从每天到每年到每几年一次。在某些实施方案中,
为了使用腺相关病毒(AAV)载体将ZFP直接递送至人脑,可以应用每个纹状体1x10
用于诊断、研究或用于基因治疗的离体细胞转染(例如,通过将转染的细胞再输注到宿主生物中)是本领域技术人员众所周知的。在优选的实施方案中,从受试者生物中分离细胞,用至少一种调节物(例如,阻遏物)或其组分转染,然后重新输注回受试者生物(例如,患者)中。在优选的实施方案中,使用AAV9递送调节物(例如,阻遏物)的一种或多种核酸。在其他实施方案中,调节物(例如,阻遏物)的一种或多种核酸作为mRNA递送。还优选使用带帽的mRNA以增加翻译效率和/或mRNA稳定性。特别优选的是ARCA(防反向帽模拟)帽或其变体。参见美国专利号7,074,596号和8,153,773,通过引用将其全部内容并入本文。适用于离体转染的各种细胞类型是本领域技术人员众所周知的(对于如何从患者中分离和培养细胞的讨论,参见,例如,Freshney等人,Culture of Animal Cells,A Manual of BasicTechnique(第3版,1994年))以及其中引用的参考文献)。
在一个实施方案中,干细胞在离体程序中用于细胞转染和基因治疗。使用干细胞的优势在于,它们可以在体外分化为其他细胞类型,或者可以引入哺乳动物(如细胞的供体)中,其中将它们移植到骨髓中。使用细胞因子如GM-CSF、IFN-γ和TNF-α在体外将CD34+细胞分化为临床上重要的免疫细胞类型的方法是已知的(参见Inaba等人,J.Exp.Med.176:1693-1702(1992))。
使用已知方法分离干细胞用于转导和分化。例如,通过用结合不想要的细胞,如CD4+和CD8+(T细胞)、CD45+(panB细胞)、GR-1(粒细胞)和Iad(分化的抗原呈递细胞)的抗体淘洗(panning)骨髓细胞以从骨髓细胞中分离干细胞(参见Inaba等人,J.Exp.Med.176:1693-1702(1992))。
在一些实施方案中,也可以使用已经被修饰的干细胞。例如,已经制成对凋亡具有抗性的神经元干细胞可以用作治疗组合物,其中所述干细胞还含有本发明的ZFP TF。可以例如通过在干细胞中使用BAX或BAK特异性TALEN或ZFN敲除BAX和/或BAK(参见美国专利号8,597,912),或例如再次使用胱天蛋白酶-6特异性ZFN在胱天蛋白酶中被破坏的那些产生对细胞凋亡的抗性。可用已知调节靶基因的ZFP TF或TALE TF转染这些细胞。
含有治疗性ZFP核酸的载体(例如,逆转录病毒、腺病毒、脂质体等)也可以直接施用于生物体以在体内转导细胞。或者,可以施用裸露的DNA。通过通常用于使分子与血液或组织细胞最终接触的任何途径进行施用,包括但不限于注射、输注、局部应用和电穿孔。施用此类核酸的合适方法是可获得的,并且是本领域技术人员众所周知的,并且尽管可以使用一种以上的途径来施用特定的组合物,但是特定的途径通常可以提供比另一种途径更直接和更有效的反应。
例如在美国专利号5,928,638中公开了将DNA引入造血干细胞的方法。可用于将转基因引入造血干细胞(例如CD34+细胞)的载体包括35型腺病毒。
适用于将转基因引入免疫细胞(例如T细胞)的载体包括非整合型慢病毒载体。参见,例如,Ory等人,(1996)Proc.Natl.Acad.Sci.USA 93:11382-11388;Dull等人,(1998)J.Virol.72:8463-8471;Zuffery等人(1998)J.Virol.72:9873-9880;Follenzi等人,(2000)Nature Genetics 25:217-222。
药学上可接受的载体部分取决于所施用的特定组合物以及用于施用该组合物的特定方法。因此,如下所述,可获得各种各样的合适的药物组合物制剂(参见,例如,Remington’s Pharmaceutical Sciences,第17版,1989)。
如上所指出,所公开的方法和组合物可用于任何类型的细胞,包括但不限于原核细胞、真菌细胞、古细菌细胞、植物细胞、昆虫细胞、动物细胞、脊椎动物细胞、哺乳动物细胞和人类细胞。用于蛋白质表达的合适细胞系是本领域技术人员已知的,包括但不限于COS、CHO(例如,CHO-S、CHO-K1、CHO-DG44、CHO-DUXB11)、VERO、MDCK、WI38、V79、B14AF28-G3、BHK、HaK、NS0、SP2/0-Ag14、HeLa、HEK293(例如,HEK293-F、HEK293-H、HEK293-T)、perC6、昆虫细胞(如烟夜蛾(Spodoptera fugiperda))(Sf),以及真菌细胞,如酿酒酵母(Saccharomyces)、Pischia和裂殖酵母(Schizosaccharomyces)。也可以使用这些细胞系的后代、变体和衍生物。在优选的实施方案中,将方法和组合物直接递送至例如纹状体中的脑细胞。
CNS疾病的模型
CNS疾病的研究可以在诸如非人类灵长类动物的动物模型系统中进行(例如,帕金森氏病(Johnston和Fox(2015)Curr Top Behav Neurosci 22:221-35);肌萎缩性侧索硬化症(Jackson等人,(2015)J.Med Primatol:44(2):66-75)、亨廷顿舞蹈病(Yang等人,(2008)Nature 453(7197):921-4);阿尔茨海默氏病(Park等人,(2015)Int J Mol Sci 16(2):2386-402);癫痫发作(Hsiao等人,(2016)E Bio Med 9:257-77)、canines(例如MPS VII(Gurda等人,(2016)Mol Ther 24(2):206-216);阿尔茨海默氏病(Schutt等人,(2016)JAlzheimers Dis 52(2):433-49);癫痫发作(Varatharajah等人,(2017)Int J NeuralSyst 27(1):1650046)和小鼠(例如癫痫发作(Kadiyala等人,(2015)Epilepsy Res 109:183-96);阿尔茨海默氏病(Li等人,(2015)JAlzheimers Dis Parkin 5(3)doi 10:4172/2161-0460),(综述:Webster等人,(2014)Front Genet 5art 88,doi:10.3389f/gene.2014.00088)。这些模型即使在没有可以完全概括CNS疾病的动物模型的情况下也可以使用,因为它们可能有助于研究疾病的特定症状组。这些模型可能有助于确定治疗方法和组合物的功效和安全性谱(遗传阻遏物)。
应用
如本文所述的包含多个人工转录因子的遗传调节物(例如,阻遏物)可用于其中想要特异性调节基因表达的任何应用。这些应用包括治疗方法,其中使用病毒(例如,AAV)或非病毒载体将至少一种遗传调节物施用于受试者,并将其用于调节受试者内靶基因的表达。调节可以采取抑制的形式,例如,抑制导致疾病状态的基因表达(例如,HD中的Htt、ALS中的突变体C9ORF72、PD和DLB中的SNCA、AD中的tau、朊病毒中的PRNP)。或者,当内源细胞基因的表达的激活或增加的表达可以改善疾病状态时,调节可以是激活的形式。如上所指出,对于此类应用,将编码本文所述的遗传调节物的核酸与药学上可接受的载体一起配制为药物组合物。
单独或与其他合适的组分(例如脂质体、纳米颗粒或本领域已知的其他组分)组合的遗传调节物或编码它们的载体可以被制成气溶胶(aerosol)制剂(即,它们可以被“雾化”)以通过吸入施用。可以将气溶胶制剂放入加压的可接受的推进剂中,如二氯二氟甲烷、丙烷、氮气等。适用于肠胃外如例如通过静脉内、肌内、皮内和皮下途径施用的制剂,包括水性和非水性等渗无菌注射溶液,其可以含有抗氧化剂、缓冲剂、抑菌剂和致使形成与预期接受者的血液等渗的制剂的溶质,以及水性和非水性无菌悬浮液,其包括悬浮剂、增溶剂、增稠剂、稳定剂和防腐剂。组合物可以例如通过静脉内输注、口服、局部、腹膜内、膀胱内、眶后(RO)、颅内(例如,脑的任何区域,包括但不限于海马和/或皮层)或鞘内施用。化合物的制剂可以存在于单位剂量或多剂量密封的容器中,如安瓿和小瓶。注射溶液和悬浮液可以由上述种类的无菌粉剂、颗粒剂和片剂制备。
施用于患者的剂量应随着时间的推移足以在患者中提供有益的治疗反应。剂量由所用特定遗传调节物的功效和Kd、靶细胞和患者的状况以及待治疗患者的体重或表面积决定。剂量的大小还由在特定患者中伴随特定化合物或载体施用的任何不良副作用的存在、性质和程度决定。
以下实施例涉及本公开的示例性实施方案,其中所述遗传调节物包含结合靶基因的至少两个锌指蛋白。应当理解,这仅出于示例的目的,并且可以使用任何靶基因的遗传调节物(例如,阻遏物),包括但不限于TALE-TF、CRISPR/Cas系统、其他ZFP、ZFN、TALEN、其他CRISPR/Cas系统、具有工程化DNA结合结构域的内切核酸酶(大范围核酸酶)。显而易见的是,使用本领域技术人员已知的方法可以容易地获得这些调节物以如下文所例示结合靶位点。类似地,以下实施例涉及其中递送媒介物是任何AAV载体的示例性实施方案,但是显而易见的是任何病毒(Ad、LV等)或非病毒(质粒、mRNA等)都可以用于递送本文所述的调制器。
在整个说明书和实施方案中,词语“具有(have)”和“包含(comprise)”或诸如“具有(has)”、“具有(having)”、“包含(comprises)”或“包含(comprising)”的变体将被理解为暗示包含所述整数或整数组,而不意味着排除任何其他整数或整数组。本文提及的所有出版物和其他参考文献通过引用整体并入本文。尽管本文引用了许多文件,但是该引用并不意味着承认这些文件中的任何文件构成了本领域公知常识的一部分。如本文所用,术语“约(approximately)”或“约(about)”如应用于一个或更多个目的值是指类似于所述参考值的值。在某些实施方案中,该术语指的是在任一方向(大于或小于)上落入所述参考值10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或更少的范围内,除非另有说明或从上下文中可以明显看出。
实施例
实施例1:
实施例1:协同ZFP-TF阻遏物
通过单独和以各种组合筛选ZFP-TF的组(panel)来鉴定包含协同ZFP-TF阻遏物的组合物。
A.Tau(MAPT)
如美国公开号20180153921中所述,进行了约185个锌指蛋白的筛选。还测试了包含ZFP和抑制结构域的ZFP-TF,并发现抑制了表达。此外,将单个ZFP的抑制与组合和测试的各种对进行了比较。
如下评估ZFP阻遏物单个或成对在小鼠Neuro2A(N2A)细胞中对tau的抑制作用。简而言之,将3种不同剂量(约30、10或3ng)的许多不同的单个ZFP-TF和成对组合的ZFP-TF编码mRNA转染到约100,000个Neuro2A细胞中。ZFP TF被转染到小鼠Neuro2a细胞中。约24小时后,提取总RNA,并使用实时RT-qPCR监测MAPT和两个参考基因(ATP5b、RPL38)的表达。
基于初始筛选的结果(在图1的顶部3个图中显示),选择了4种ZFP-TF52322、52335、52364、52374及其成对组合进行进一步研究,其中有6种不同的剂量(300、100、30、10、3和1ng)的单个或ZFP-TF组合转染到N2A细胞中,并如上所述进行分析。还通过比较单个ZFP-TF与包含多个ZFP-TF的遗传调节物之间的抑制水平来评估协同作用。协同作用得分计算为最强的单个ZFP-TF或调节物在相同核酸剂量下预期的归一化tau表达与使用ZFP或调节物组合时观察到的归一化tau表达之比。
如图1的底部图所示,包含两个ZFP-TF阻遏物的遗传调节物比相同剂量下的单个ZFP-TF抑制tau表达明显更多。
此外,如图2和3所示,使用包含多个ZFP-TF的ZFP-TF抑制基因表达提供了令人惊讶的协同作用,观察到的抑制是两个ZFP一起的预期抑制水平的2-10倍或更多。
表1和2示出了在各种研究中使用的示例性设计。
表1:示例性的MAPT ZFP设计
还基于以下方面评估了包含上述两个人工转录因子的遗传调节物的协同作用:(1)抑制(KRAB)结构域之间的距离(以核苷酸为单位);(2)与转录起始位点(TSS)结合的靶位点的距离;(3)两个ZFP-TF之间靶位点的距离;(4)单个ZFP-TF结合的链,如下。协同作用得分计算为最强的单个ZFP-TF或调节物在相同核酸剂量下预期的归一化tau表达与使用ZFP或调节物组合时观察到的归一化tau表达之比。评估了所示30ng剂量下368对(由组合43个单个制成)的协同作用。
如图4所示,使用以下容易实现协同作用(抑制):在两个靶位点或抑制结构域之间多达600个碱基对的距离处的两个ZFP-TF;ZFP-TF具有的在两个靶位点之间的中心距离在TSS的200个碱基对(3′或5′)内;并且不管靶序列的哪条链结合ZFP-TF。
随后,进行了研究以进一步评估包括协同作用的至少两个人工转录因子的遗传阻遏物。鉴定了一组活跃的单个ZFP-TF,并在所有配对组合的完整矩阵(full matrix)中进行了测试,还对一起递送的所有6个ZFP-TF进行了测试。
图5中显示了示例性鉴定的单、配对和多种组合的结果,并证实了通过以几乎任何组合来组合两个或更多个ZFP-TF容易地实现协同作用。其中共同递送所有6种ZFP-TF的实验导致最大水平的tau降低和最低的EC50,比最有力的ZFP对52322-52335低约3倍。
B.小鼠朊病毒(Prnp)
基本上如上所述,还筛选了靶向小鼠Prnp基因的ZFP-TF的协同作用。简而言之,将3种不同剂量(单个ZFP-TF分别为200、60、20ng,配对组合为100、30和10ng)的编码32种不同的单个ZFP-TF和这些ZFP-TF的130种不同配对组合的mRNA转染到Neuro2A细胞中。24小时后,提取总RNA,并使用实时RT-qPCR监测Prnp和两个参考基因(ATP5b、EIF4A)的表达。协同作用计算为在组合中以其剂量的2倍测试时,强度较高的ZFP所获得的表达水平与ZFP组合所获得的表达水平之比。
在下表A中显示了对所测试的130种ZFP-TF组合显示协同作用的结果。
表A:整体协同小鼠Prnp
因此,在超过75%的测试组合中观察到协同效应(与单个TF相比),在超过40%的测试组合中观察到大于2倍的协同效应。
另外,图10以图形方式示出了与单个ZFP-TF相比,8种示例性ZFT-TF组合的协同效应。所示的示例性ZFP-TF被命名为A到K。
还基于以下方面评估了小鼠朊病毒ZFP-TF的130种组合的协同效应:(1)抑制(KRAB)结构域之间的距离(以核苷酸为单位);(2)与转录起始位点(TSS)结合的靶位点的距离;(3)两个ZFP-TF之间靶位点的距离。如上所述计算协同作用。
如图11所示,使用以下容易实现协同效应(抑制):在两个靶位点之间或在抑制结构域之间的多达600个碱基对的距离处的两个ZFP-TF;并且ZFP-TF具有的在两个靶位点之间的中心距离在TSS的600个碱基对(3′或5′)内。
C.人朊病毒(PRNP)
基本上如上所述,还筛选了靶向人PRNP基因的ZFP-TF的协同效应。简而言之,将3种不同剂量(单个ZFP-TF分别为200、60、20ng,配对组合为100、30和10ng)的编码32种不同的单个ZFP-TF和这些ZFP-TF的130种不同配对组合的mRNA转染到SK-N-MC细胞中。24小时后,提取总RNA,并使用实时RT-qPCR监测PRNP和两个参考基因(ATP5b、EIF4A)的表达。协同作用计算为在组合中以其剂量的2倍测试时,强度较高的ZFP所获得的表达水平与ZFP组合所获得的表达水平之比。
在下表B中显示了测试的130种ZFP-TF组合的协同效应的结果。
表B:整体协同人PRNP
因此,在超过66%的测试组合中观察到协同效应(与单个TF相比),在超过23%的测试组合中观察到大于2倍的协同效应。
另外,图12以图形方式示出了与单个ZFP-TF相比,8种示例性ZFT-TF组合的协同效应。所示的示例性ZFP-TF被命名为hA至hJ。
还基于以下方面评估了人朊病毒ZFP-TF的130种组合的协同效应:(1)抑制(KRAB)结构域之间的距离(以核苷酸为单位);(2)与转录起始位点(TSS)结合的靶位点的距离;和(3)两个ZFP-TF之间靶位点的距离。如上所述计算协同作用。
如图13所示,使用以下容易实现协同效应(抑制):在两个靶位点之间或在抑制结构域之间的多达600个碱基对的距离处的两个ZFP-TF;并且ZFP-TF具有的在两个靶位点之间的中心距离在TSS的600个碱基对(3′或5′)内。
D.人α-突触核蛋白(SNCA)
基本上如上所述,还筛选了靶向人SNCA的ZFP-TF的协同效应。简而言之,将3种不同剂量(单个ZFP-TF分别为200、60、20ng,配对组合为100、30和10ng)的编码30种不同的单个ZFP-TF和这些ZFP-TF的132种不同配对组合的mRNA转染到SK-N-MC细胞中。24小时后,提取总RNA,并使用实时RT-qPCR监测SNCA和两个参考基因(ATP5b、EIF4A)的表达。协同作用计算为在组合中以其剂量的2倍测试时,强度较高的ZFP所获得的表达水平与ZFP组合所获得的表达水平之比。
在下表C中显示了测试的132种ZFP-TF组合的协同效应的结果。
表C:整体协同人SNCA
因此,在超过66%的测试组合中观察到协同效应(与单个TF相比),在超过17%的测试组合中观察到大于2倍的协同效应。
另外,图14以图形方式示出了与单个ZFP-TF相比8种示例性ZFT-TF组合的协同效应。所示的示例性ZFP-TF被命名为sA至sJ。
还基于以下方面评估了人α-突触核蛋白ZFP-TF的132种组合的协同效应:(1)抑制(KRAB)结构域之间的距离(以核苷酸为单位);(2)与转录起始位点(TSS)结合的靶位点的距离;和(3)两个ZFP-TF之间靶位点的距离。如上所述计算协同作用。
如图15所示,使用以下容易实现协同效应(抑制):在两个靶位点之间或在抑制结构域之间的多达600个碱基对的距离处的两个ZFP-TF;并且ZFP-TF具有的在两个靶位点之间的中心距离在TSS的600个碱基对(3′或5′)内。
实施例2:脱靶效应
还如下分析了脱靶效应。首先,将实施例1中鉴定的52335和52389对用于整体微阵列分析(global microarray profiling)中。简而言之,将约300ng的每个ZFP-TF编码mRNA分别以生物学方式上一式四份单个或组合转染到150k Neuro2A细胞中。约24小时后,通过制造商的方案(Affymetrix Genechip MTA1.0)提取并处理了总RNA。稳健的多阵列平均值(RMA)用于归一化每个探针组的原始信号。使用带有“基因水平差异表达分析(Gene LevelDifferential Expression Analysis)”选项的Transcriptome Analysis Console 3.0(Affymetrix)进行分析。将ZFP转染的样品与已用不相关的ZFP-TF(不与MAPT靶位点结合)处理过的样品进行比较。报告了转录物(探针组)的变化调用(call),相对于对照,其平均信号差异大于2倍,且P值<0.05(单向ANOVA分析,每个探针组的未配对T检验)。
如图6A所示,单个ZFP-TF 52335抑制了2个非靶基因并激活了一个基因;单个ZFP-TF 52389激活了一个基因;而ZFP-TF与52335和52389的组合激活了一个脱靶位点并抑制了一个脱靶位点。另外,如图6B所示,包含两个ZFP-TF阻遏物的遗传调节物比单个阻遏物(0.012x野生型水平)抑制tau的水平更高,这表明在不增加脱靶数量的情况下可以实现靶上(on-target)抑制的大幅增加。
实施例3:递送
还如下分析了多顺反子递送和密码子多样化的抑制结构域。产生了mRNA,其编码单个ZFP-TF(未连接)或与携带多个人工转录因子的mRNA(连接)的多顺反子(通过自切割肽序列,T2A和P2A隔开)。此外,ZFP-TF包含Kox抑制结构域的野生型或密码子多样化变体(在连接的体系结构中的N端、中间或C端位置分别命名为nKox、mKox和cKox),以避免递送载体中的重复序列。
将mRNA以以下剂量转染到Neuro2A细胞中:未连接的mRNA以约300、100、30、10、3、1、0.3和01ng mRNA的剂量转染,并且双顺反子mRNA以约600、200、60、20、6、2、0.6和0.1ngmRNA的剂量转染。在约24小时后测量Tau基因表达水平。
如图7A所示,无论Kox结构域变体或顺反子结构如何,连接和未连接的构建体均将基因表达有效地抑制到相似的大小和EC50。
还产生了包含编码遗传阻遏物的多核苷酸的AAV载体。递送媒介物携带单个ZFP-TF(未连接)或多顺反子(连接),所述多顺反子中一个AAV载体携带遗传调节物的两个或更多个人工转录因子。与mRNA一样,单顺反子和多顺反子AAV载体都抑制tau表达,这表明可以使用编码本文所述的遗传阻遏物的所有组分的单个AAV载体。
还测试了基因调节(抑制)随时间流逝的动力学。特别地,在mRNA转染后约24、48、64、72和136小时评估基因表达(tau)水平。如图7B所示,在转染后约72小时或更长时间未检测到抑制。
此外,还在多个时间点评估了其他功能结构域(DMNT)的作用。如下产生了三种ZFP融合蛋白:可操作地连接KRAB抑制结构域(57890-K)的ZFP57890;可操作地连接DNMT3A功能结构域(52322-D3A)的ZFP 52322和可操作连接DNMT3L功能结构域的ZFP 57930,并且分别以约900、300或100ng的剂量单独或以约300、100或30ng的剂量一起转染到N2A细胞中。在约24、96或168小时后收获细胞并评估基因表达水平。
如图7C所示,三重转染在转染后长达约168小时内给出了强大的抑制水平,而任何单一ZFP调节物的递送均无法在超过24小时后抑制tau表达。
实施例4:体内非人灵长类动物研究
将如本文所述的遗传阻遏物在食蟹猴(M.fascicularis)中进行测试,以观察在灵长类动物(非人灵长类动物(NHP)模型)中tau表达的抑制。食蟹猴被安置在配备有自动浇水系统的不锈钢笼中。该研究符合Final Rules of the Animal Welfare Act regulations(Code of Federal Regulations,Title 9)和Guide for the Care and Use ofLaboratory Animals,Institute of Laboratory Animal Resources,Commission onLife Sciences,National Research Council,第8版的所有适用部分。
基本上如美国公开号20180153921中所述,将遗传阻遏物克隆到具有SYN1启动子或CMV启动子的AAV载体(AAV2/9,或其变体)中。所使用的AAV载体包括:具有驱动如本文所述的驱动遗传调节物的表达的SYN1启动子(其包含65918和57990(SYN918-890))的载体,以及具有驱动遗传调节物的表达的CMV启动子(其包含65918和57990(CMV918-890))的载体。
如下表中所示治疗NHP受试者:
表4
在实验中,将包含hSYN1或CMV驱动的ZFP TF的AAV9载体以约6E11 vg/半球的方式向左递送,并以6E11 vg/半球的方式向右半球递送。动物在左侧接受约60μL单剂量的测试样品,在右半球接受约60μL的单剂量。对于所有测试样品,剂量浓度约为1E13 vg/mL。
28天后,处死动物,取出脑并将其置于冰冷的PBS中的冠状脑基质中。将脑切成3mm的冠状切片厚度(分为约17个切片)。将一些脑切片(右半球和左半球)存储在10%中性缓冲的福尔马林中,用于组织病理学和原位杂交分析。将所有其他脑切片(右半球和左半球)放在RNAlater(Qiagen)中,并冷藏约24小时,其后根据预定义的脑模板收集2-3毫米mm直径的切片(punches)。处理切片用于qRT-PCR和生物分布分析。另外,收集CSF用于tau蛋白分析。
包含海马和内嗅皮层区域的切片用于通过qRT-PCR分析tau、ZFP、神经胶质和神经元细胞标志物以及管家基因的mRNA表达水平。结果显示,AAV将ZFP-TF递送至海马区域,导致tau表达降低。
在输注后28天对受试者进行尸检,取出脑,沿鼻尾状通路切成3mm的冠状动脉块,并从每个块收集针对多个脑区域(包括海马和内嗅皮层)的穿孔活检。使用qRT-PCR评估来自不同脑切片的74个切片中tau的表达、持家基因(ATP5b、EIF4a2和GAPDH)和ZFP表达水平。
如图8所示,与对照(媒介物)受试者相比,在接受包含如本文所述的至少两个人工调节因子的遗传调节物的受试者中,tau表达被显著抑制。
研究表明,本发明的遗传调节物在灵长类脑中体内调节基因表达(包括在治疗水平上)。
数据表明本文所述的遗传阻遏物是高度活跃的,独立于间隔(靶位点之间多达约600bp,与TSS多达约300个或更多的碱基对)的饱和抑制达到了多达3.5个ZFP对数的剂量水平。此外,遗传阻遏物是高度特异性的,因为很少或没有被鉴定到脱靶。最后,遗传阻遏物可以以mRNA形式或使用病毒载体(例如,AAV,例如AAV9)递送,并在体外和体内表现出高活性和特异性。
实施例5:人iPS神经元中的ZFP-TF活性
AAV2/6以约1E5VG/细胞用于感染人iPS来源的神经元(iCell Neurons,CellularDynamics International Inc)。约19天后,提取总RNA,并使用实时RT-qPCR评估人MAPT、ZFP-KRAB和三个参考基因(ATP5b、EIF4a2、GAPDH)的表达。
还以1E5 VG/细胞在人iPS来源的神经元中评估了ZFP-TF特异性(iCell Neurons,Cellular Dynamics International Inc)。使用每种处理的5-7个生物学重复,其由约1e5VG/细胞的AAV6 ZFP-TF组成。感染后约19天后,按照制造商的方案(Affymetrix HumanClariom S Pico)提取并处理总RNA。稳健的多阵列平均值(RMA)用于归一化每个探针组的原始信号。使用带有“Gene Level Differential Expression Analysis”选项的Transcriptome Analysis Console4.0(Affymetrix)进行分析。将ZFP转染的样品与已用不相关的ZFP-TF(不与MAPT靶位点结合)处理过的样品进行比较。报告了转录物(探针组)的变化调用,相对于对照,其平均信号差异大于2倍,并且FDR P值<0.05(单向ANOVA分析,每个探针组的未配对T检验)。
结果表明,特定的ZFP-TF组合在抑制人类细胞中MAPT的表达中显示出协同活性。
出于所有目的,通过引用将本文中提及的所有专利、专利申请和出版物整体并入本文。
尽管出于清楚理解的目的以示例和实施例的方式详细地提供了公开,但是对于本领域技术人员显而易见的是,在不脱离本公开的精神或范围的情况下,可以进行各种改变和修改。因此,前述描述和实施例不应解释为限制性的。
- 工程化的遗传调节物
- 工程化抗原递呈细胞、免疫调节组合物及应用
