细胞靶标的空间上定向的量子条形编码
文献发布时间:2023-06-19 12:07:15
技术领域
本发明涉及组织染色和分子病理学领域,并且更具体地,涉及在三维组织样品内对细胞靶标进行标记和条形编码的领域。
背景技术
适当的组织功能需要细胞的空间定位和定向。细胞接触允许信息以预期的方式从一个细胞传递到另一个细胞。病变组织通常可表征为细胞的空间定位不正确,或者其他细胞的发育和功能所需的某些细胞类型遭到破坏。支持2D和3D空间定位的技术提供了可用于了解细胞和细胞成分的正常功能的信息,以及缺乏这种功能为何会导致疾病的临床表现的信息。当前,获得组织、生物膜或细胞的空间(2D或3D)信息的主要手段要求对已结合了标记的抗体或其他类型探针的细胞进行显微镜检查。时间、成本和标记试剂的可用性是生物样品高通量成像的重要障碍。可区分的荧光标记的数量非常有限:通常一次3个或4个,并且通过迭代染色最多达40个或50个。同位素标记允许多达40种选择,但是成本很高。使用荧光团和同位素进行细胞成像的技术仍在开发中。然而,利用核酸序列标签或化学加合物(通过质谱法检测)可以将空间分析提高到一个新的水平。这些标记的使用可能潜在地允许在没有显微镜的情况下对组织或细胞进行成像。这使成像脱离了显微镜领域,并且进入加标签和空间识别领域。本发明是具有基本上无限数量的标记(代码)的方法,所述标记(代码)可以以很少的成本产生以用于组织或另一2D或3D样品中的核酸和蛋白质靶标。
发明内容
本发明是一种在2D表面或3D空间中标记和检测靶标的方法。所述方法在样品中的每个靶标上组装唯一的核酸或质量条形码。唯一条形码对靶标的身份及其位置进行编码。为了从子代码组装每个条形码,对样品的一部分进行照射,以使子代码仅附接到样品的一部分。根据需要将样品细分为多个区域,使得每个区域都具有与之相关联的唯一条形码。条形码可以通过测序或质谱法读取并进行解释。
在一些实施例中,本发明是一种同时检测组织样品中靶标的存在和空间位置的方法,所述方法包括:通过反应性基团将锚定物共价附接到组织样品中的靶标;在锚定物上,通过包括以下各项的方法从一组子代码组装代码:使样品与第一子代码接触,并且允许第一子代码在组织样品的第一部分中共价附接到锚定物,从而在第一部分上形成代码;使样品与第二子代码接触,并且允许第二子代码在组织样品的第二部分中共价附接到锚定物,所述第二部分与第一部分不重叠,从而在第二部分上形成代码;重复所述一对步骤i-ii一次或多次,其中在每次重复中,在第一步骤中接触的组织样品的部分与在第二步骤中接触的组织样品的部分不重叠;并且所添加的子代码附接到现有子代码并扩展现有代码,从而形成标识组织样品的每个部分的代码;以及读取在步骤iii.中组装在锚定物上的代码,从而检测靶标的存在以及靶标在组织样品中的位置。在代码组装步骤中只能使用两个或两个以上的子代码。
在一些实施例中,锚定物是可以包含聚A结合序列、随机序列和靶标特异性序列中的一个或多个的核酸。在一些实施例中,锚定物是适体。
子代码也可以是核酸。在一些实施例中,锚定物通过交联共价附接到靶标。子代码也可以通过交联共价附接到锚定物和其他子代码。在一些实施例中,在共价附接之前,子代码通过与锚定物和其他子代码互补的区域与锚定物和其他子代码杂交。可以例如通过在包含盐缓冲液、去污剂和溶剂中的一种或多种的溶液中洗涤来去除未交联的子代码。交联可以通过选自声辐射、光束(激光)、太赫兹频率束、X射线的辐射来进行照射完成。激光器可以由执行代码的计算机来操作,所述代码参考照射组织样品的部分的照射时间,以及此时接触组织样品的子代码的序列。
在一些实施例中,子代码通过声辐射附接到锚定物和其他子代码,所述声辐射促进化学反应。
在一些实施例中,靶标是蛋白质。锚定物中的反应性基团可以是通过胸苷-赖氨酸加成而附接到靶标蛋白质的胸苷。
在一些实施例中,子代码通过退火引物附接到公共连接基(linker)或现有子代码。子代码可通过连接(ligation)共价链接,所述连接可在锰离子存在的情况下通过聚合酶(例如,易错聚合酶或Taq聚合酶)进行链延伸之前进行。
在一些实施例中,读取代码包括扩增代码并对代码进行测序。在一些实施例中,读取代码包括特异性抗体与靶标的结合,其中抗体联结到引物,以用于读取所述代码。抗体和引物可以通过借助于附接到相同的固体支持物而联结。所述读取可以利用与锚定物或最后一个子代码至少部分互补的引物。
在一些实施例中,将包括不同反应性基团的多个锚定物附接到组织样品。锚定物可以包括在电场存在的情况下与靶标起反应的反应性基团。子代码可以包含非核苷酸实体,因此可以通过质谱法读取代码。
所组装的代码可以是线性或支化聚合物。
在一些实施例中,组织样品被包埋在稳定化基质中,诸如琼脂糖或水凝胶或对交联中使用的波长透明的另一种基质中。
在一些实施例中,将子代码共价附接到组织样品的部分包括掩蔽组织样品的其余部分的步骤。
附图说明
图1展示了用于检测组织样品中靶标的存在和位置的工作流程。
图2展示了组织样品中的原位空间代码的顺序组装。
图3展示了在样品内形成唯一地址的过程。
图4展示了用抗体检测在空间上标记的蛋白质靶标。
图5展示了使用夹板从子代码组装代码的方法。
具体实施方式
定义
以下定义有助于理解本公开。术语“样品”是指包含或假定包含要分析的靶标的任何组合物。术语“组织样品”是指具有三维结构的样品。这包括从个体、例如器官或肿瘤活检组织中分离的固体组织的样品。所述术语还包括环境样品,例如微生物生物膜,并且还包括从取自个体的细胞(包括福尔马林固定的石蜡包埋组织(FFPET))建立的体外培养物样品。
术语“核酸”是指核苷酸(例如,核糖核苷酸和脱氧核糖核苷酸,天然的和非天然的两者)的聚合物,包括DNA、RNA和它们的子分类诸如cDNA、mRNA等。核酸可以是单链的或双链的,并且通常将会含有5’-3’磷酸二酯键,但在一些情况下,核苷酸类似物可以具有其他链接。核酸可包括天然出现的碱基(腺嘌呤、鸟嘌呤、胞嘧啶、尿嘧啶和胸苷)以及非天然碱基。非天然碱基的一些示例包括在例如Seela等人.,(1999)Helv.Chim.Acta82:1640。非天然碱基可具有特定功能,例如,增加核酸双链体的稳定性、抑制核酸酶消化或阻断引物延伸或链聚合。
术语“多核苷酸”和“寡核苷酸”可互换使用。多核苷酸是单链或双链的核酸。寡核苷酸是有时用来描述较短的多核苷酸的术语。寡核苷酸通过本领域已知的任何合适方法制备,例如,通过牵涉如以下文献中所述的直接化学合成的方法制备:Narang等人.(1979)Meth.Enzymol.68:90-99;Brown等人.(1979)Meth.Enzymol.68:109-151;Beaucage等人.(1981)Tetrahedron Lett.22:1859-1862;Matteucci等人.(1981)J.Am.Chem.Soc.103:3185-3191。寡核苷酸也可以通过在2016年4月21日提交的标题为“Devices and methodsfor oligonucleic acid library synthesis(用于寡核苷酸文库合成的装置和方法)”的美国申请序列号15/135,434和2016年2月3日提交的标题为“Methods and devices for denovo oligonucleic acid assembly(用于从头寡核苷酸组装的方法和装置)”的美国申请序列号15/015,059中描述的喷墨印刷方法来制备。
术语“引物”是指单链寡核苷酸,它与靶标核酸中的序列(“引物结合位点”)杂交并且能够用作在适用于合成的条件下沿着核酸的互补链启动该合成的点。
术语“连接”是指将两条核酸链接合的缩合反应,其中一个分子的5’-磷酸酯基团与另一个分子的3’-羟基基团反应。连接典型是由连接酶或拓扑异构酶催化的酶促反应。连接可将两条单链接合以创建一个单链分子。连接也可将每个属于一个双链分子的两条链接合,从而将两个双链分子接合。连接也可将一个双链分子的两条链与另一个双链分子的两条链接合,从而将两个双链分子接合。连接也可将一个双链分子内的一条链的两端接合,从而修复该双链分子内的缺口。
如本文所使用,术语“代码”是指组装在样品中的靶标分子上并且标记所述靶标分子的两个或更多个寡核苷酸或非核苷酸实体(“子代码”)的序列。如本文所使用,术语“子代码”是指可以与其他这样的实体链接以组装代码的寡核苷酸或非核苷酸实体。术语“条形码”和“核酸条形码”是指由核酸组成的代码。条形码序列可以被检测和识别。可将条形码并入各种核酸中。条形码足够长,例如2个、5个、20个核苷酸,使得在样品中,条形码和包含它们的核酸可以彼此区分开。
术语“交联”是指在两种聚合物之间形成共价键的化学反应,其需要外部刺激,诸如各种波长的辐射能量(热、光、超声)或pH值变化。
术语“量子条形编码”或“QBC”是指可以用唯一的核酸代码标记细胞混合物中单个细胞中的一个或多个靶标的过程。所述过程包括从细胞或组织上(或之中)的原位子代码逐步组装唯一代码的步骤。QBC的一个实例在2016年4月15日提交的美国申请序列号13/981,711中进行描述。
术语“靶标”和“靶标分子”是指通过本文描述的方法检测或定量的感兴趣的分子。靶标可以是核酸或蛋白质。术语靶标包括靶标分子的全部变体,例如,一种或多种突变变体和野生型变体。术语“靶序列”是指样品中待检测或定量的核酸序列。
术语“扩增”是指制备靶标核酸的另外的拷贝的方法。扩增可具有超过一个循环,例如,指数式扩增的多个循环。扩增可仅具有一个循环(制备靶标核酸的单个拷贝)。该拷贝可具有另外的序列,例如,用于扩增的引物中存在的那些。扩增也可产生仅一条链的拷贝(线性扩增)或优先产生一条链的拷贝(不对称PCR)。
术语“测序”是指任何测定核酸中核苷酸序列的方法。
本发明是一种对二维或三维样品中的靶标的位置信息进行迭代编码使得可以在以后的分析中确定这个区域的内容的过程。位置信息可以以核酸代码的形式进行编码,例如可以通过常规测序方法确定的DNA序列。位置信息也可以以化学代码的形式进行编码,例如,作为可以通过质谱法解码的化学加合物序列。
当前,获得组织、生物膜或细胞的空间(2D或3D)信息的主要手段要求对已结合了标记的探针或抗体的细胞进行显微镜检查。可区分的荧光标记的数量非常有限:通常一次3个或4个,并且通过迭代染色最多达40个或50个。同位素标记允许多达40种同位素,但是成本很高。本发明是一种用新颖的模块化代码在空间上标记靶标的方法。所述方法提供了可以在单个实验中检测到的基本上无限数量的标记(代码)。所述方法允许检测DNA并定性且定量地检测RNA和蛋白质靶标。
测量靶标(例如,mRNA或蛋白质)的空间分布的一种替代性方法包括将固定的组织样品直接退火到条形码逆转录(RT)引物阵列并执行转录,然后进行测序和计算重建,参见Stahl、PL等人(2016),Visualization and analysis of gene expression in tissuesections by spatial transcriptomics,Science,353:78-82。这种方法的主要缺点是渗漏,例如引物在其网格位置之外的退火。本发明通过利用可以以微米级分辨率聚焦在期望区上的激光克服了这个问题。
在所述新方法中使用的组织样品是源自生物体、受试者或患者的组织的片段。在一些实施例中,所述样品可以包括例如通过生物活检或手术切除而取自生物体或患者的固体组织或实体肿瘤的片段。在一些实施例中,为了促进本发明的方法,可以将组织样品捕获在惰性基质(例如琼脂糖凝胶基质)中,参见Andersson等人(2006),Analysis of proteinexpression in cell microarrays:a tool for antibody-based proteomics,J.Histochem.Cytochem.54(12):1413-23.Epub 2006年9月6日)。组织样品也可以埋入水凝胶中,所述水凝胶是由亲水性聚合物组成的三维网络,所述亲水性聚合物通过共价键交联或通过物理分子内和分子间吸引力保持在一起。参见Hoffman A.S.(2001),Hydrogels forbiomedical applications,Ann NY Acad Sci.,944:62-73。在一些实施例中,水凝胶是3D结构,其由通过甲醛与细胞分子链接的聚合物(例如丙烯酰胺或双丙烯酰胺)的网络组成。在一些实施例中,通过将引发剂添加到组织样品中来引发聚合。参见例如Chung、K.等人,(2013).Structural and molecular interrogation of intact biologicalsystems.Nature,497(7449),332。在一些实施例中,在聚合过程之后,将非蛋白质分子(例如脂质)洗去或洗脱(例如通过电泳),将靶标分子(例如蛋白质和核酸)留在原地。凝胶或基质必须对用于通过下文进一步描述的方法使代码交联或以其他方式附接的频率透明。在一些实施例中,基质不可透过可见光,但是可透过本发明方法中使用的其他类型的辐射。
在一些实施例中,根据当前的医疗实践,组织样品被保存为临床患者样品。在一些实施例中,样品在-20℃或更低温度,例如在-80℃被新鲜冷冻。在其他实施例中,通过用福尔马林固定并包埋在石蜡(FFPE)中来保存临床组织样品。在这样的实施例中,根据本领域已知的方法,样品需要用热或去污剂进行脱石蜡。
在一些实施例中,组织样品是微生物菌落或生物膜。唯一的要求是,样品对于用来使代码交联的辐射的电磁频率是透明的,这将在下文进一步讨论。
在一些实施例中,锚定物是与核酸靶标特异性结合(杂交)的核酸。在这些实施例中,锚定物包括与靶标核酸(DNA或RNA)互补的区域。在一些实施例中,为了实现特异性靶标识别,锚定物与组织样品中的核酸靶标至少部分互补。在一些实施例中,靶标是mRNA。在一些实施例中,锚定物包括poly-T或poly-dT、poly-U或poly-dU序列,或能够与poly-A序列形成稳定杂交体的任何其他均聚物序列。在一些实施例中,锚定物包括随机序列。在一些实施例中,锚定物是聚A结合序列、随机序列和靶标特异性序列中的两个或更多个的组合。
在一些实施例中,锚定物是选择用于与非核酸靶标特异性结合的核酸适体,参见Oliphant、AR等人(1989),“Defining the sequence specificity of DNA-bindingproteins by selecting binding sites foom random-sequence oligonucleotides:analysis of yeast GCN4 proteins(”,Mol.Cell.Biol.,9(7):2944-2949。通过称为SELEX的过程制备和改善核酸适体的方法在以下文献中进行描述:例如美国专利号5,475,096、5,270,163、5,567,588、5,660,985、5,580,737、5,496,938、9,382,533、8,975,026、8,975,388、8,404,840、7,964,356和7,947,447。适体可以通过化学SELEX过程以化学方式链接到靶标,如美国专利号5,705,337中所描述。适体可包括在核糖、磷酸和碱基位置具有取代物的修饰的核苷酸(美国专利号5,580,737)。可以使适体包括能够结合并光交联到其靶标的光反应性官能团(photo-SELEX),参见美国专利号5,763,177、6,001,577、6,291,184、6,458,539和8,409,795。
核酸锚定物进一步包括允许在锚定物上进行代码组装的互补区域。在一些实施例中,互补区域是用于第一子代码,使得第一子代码直接退火到锚定物,并且如本文所描述添加额外的子代码。在其他实施例中,互补区域是用于退火引物,所述退火引物退火到锚定物和第一子代码,并且如本文所描述添加额外的子代码。
在一些实施例中,锚定物不与靶标互补,即,靶标不是核酸。在一些实施例中,锚定物与组织样品中的所有可用靶标结合。例如,锚定物可以是在不具有结合特异性的情况下附接到样品中的多种或全部蛋白质的核酸。在没有特异性识别的情况下,结合是通过核苷酸与氨基酸之间的促进的化学反应来完成的。在一些实施例中,核酸通过辐射直接附接到蛋白质。在一些实施例中,UV辐射(例如,以或大约250nm的波长)在胸苷与赖氨酸的ε-氨基之间产生光加成。参见Saito I.和Matsuura T.(1985),Chemical aspects of UV-inducedcrosslinking of proteins to nucleic acids。Photoreactions with lysine andtryptophan,Acc.Chem.Res,1985,18(5),第134-141页。在一些实施例中,锚定寡核苷酸包括可光活化的核苷酸,其允许与发射多种波长的激光进行高效交联。Hafner、M.等人(2010),Transcriptome-wide Identification of RNA-Binding Protein and MicroRNATarget Sitesby PAR-CLIP,Cell 141-129。在一些实施例中,锚定寡核苷酸包括一个或多个具有选自4-硫尿苷、5-溴尿苷、5-碘尿苷和6-硫鸟苷的修饰碱基的光活化核苷酸。
本发明包括使用由子代码组成的代码。在一些实施例中,子代码为核酸。本发明提供了合成核酸子代码库,每个子代码具有可区别于其他子代码的唯一序列。子代码是与组织样品中的任何核酸序列均不形成稳定键的序列。因此,在一些实施例中,选择子代码序列以使其与感兴趣的基因组的任何区域不互补,例如,从中获取组织样品的生物体的基因组或正在询问组织样品其存在的靶标传染因子的基因组。
在将第一子代码附接到锚定物之后,将一个或多个额外的子代码以有序的方式连结在一起,以形成附接到锚定物的代码。将子代码添加到代码的一个或多个步骤包括掩蔽和交联以标识子代码的空间位置的步骤。如本文所描述,附接步骤包括弱结合,随后在未掩蔽的部分中进行交联并洗去掩蔽部分中的未交联的子代码。
在一些实施例中,退火引物在每一轮中杂交并且交联到两个寡核苷酸子代码,从而允许联结所述子代码并且然后通过连接而连结。酶促连接可利用DNA连接酶或RNA连接酶,例如T4 DNA连接酶、T4 RNA连接酶、嗜热栖热菌(Thermus thermophilus)(Tth)连接酶、水生栖热菌(Thermus aquaticus)(Taq)DNA连接酶或激烈热球菌(Pyrococcus furiosus)(Pfu)连接酶。非酶或化学连接可利用活化剂和还原剂,诸如碳二亚胺、溴化氰(BrCN)、咪唑、1-甲基咪唑/碳二亚胺/胱胺、N-氰基咪唑、二硫苏糖醇(DTT)和紫外线。
在其他实施例中,使用CLICK化学方法将子代码链接在一起。(El-Sagheer等人(PNAS,108:28,11338-11343,2011)。
在一些实施例中,与退火引物的结合在需要在连接之前通过核酸聚合酶填充的子代码之间留下一个或多个核苷酸的间隙。在一些实施例中,在连接之前进行磷酸化步骤。在一些实施例中,聚合酶是容易出错或低保真度的DNA聚合酶。容易出错的聚合酶掺入了核苷酸变异(错误),所述变异在代码之间不同并且包括在代码之间的额外的多样性。在一些实施例中,聚合酶是Ohmori等人(2001),TheY-family of DNA polymerases,Mol.Cell,8:7-8中描述的Y族DNA聚合酶。Y族聚合酶的特征在于缺乏可检测的3′→5′校对核酸外切酶活性,并且以低保真度和较弱的合成力在体外复制未受损的DNA。在一些实施例中,聚合酶是细菌、或古细菌或真核容易出错的聚合酶。在一些实施例中,聚合酶是Taq聚合酶。在一些实施例中,通过存在Mn
在一些实施例中,将子代码添加到联结到锚定物的夹板寡核苷酸(图5)。夹板联结到锚定物(A),并且任选地,联结到表位特异性条形码(ESB)。夹板包括用于子代码(SC)退火的着陆垫(大的开放式正方形)。因为子代码具有不同的序列,所以不会将整个子代码退火到夹板。子代码具有一个或多个唯一的序列(小的开放式正方形)。在本文所描述的退火步骤、交联步骤和洗涤步骤之后,通过如本文所描述的连接或CLICK化学方法将子代码链接。在一些实施例中,在被链接之前,需要通过核酸聚合酶来扩展子代码。在一些实施例中,聚合酶是容易出错的聚合酶,其在代码内产生额外的多样性。在一些实施例中,最后一个子代码附接到扩增引物结合位点(AMP)。
在一些实施例中,子代码是非核酸实体。可以通过电磁辐射以有序的方式彼此链接的任何化学部分都在本发明的范围内。电磁辐射包括微波、太赫兹、X射线和伽马射线。在一些实施例中,使用声波。在一些实施例中,使用声波来促进单体到聚合物的转化,例如通过生热。在一些实施例中,子代码被组装成线性聚合物代码。在其他实施例中,子代码组装成分支聚合物代码。
非核苷酸子代码的实例包括糖实体、具有可区分质量的侧基的小的可定义的有机物、几种不同的众所周知的聚合物中的任何一个的单体亚基。其中亚基之间的键比亚基内的键更容易断裂的任何小的有机部分(亚基)都可以用作子代码。虽然可以使用不具有后一种特征的单体,但当亚基间单体在质谱法过程中更容易相互产生而不是分解时,效率会提高。单体与聚合物的连接过程是通过基于光子的加速键形成来进行的。
在一些实施例中,锚定物和子代码在整个组织样品中自由扩散。在其他实施例中,使用电场将锚定物和子代码中的一个或两者引入组织样品中。
在一些实施例中,将锚定物附接到靶标,将子代码附接到锚定物或将子代码彼此附接涉及杂交后的交联。在一些实施例中,杂交能够将锚定物定位到靶标,但是不足以形成键,例如可以经受严格洗涤的键。在一些实施例中,在杂交步骤和交联步骤(在下文中描述)之后,仅杂交但未交联的锚定物或子代码以及子代码的任何未杂交的锚定物在洗涤步骤中被洗去。在一些实施例中,洗涤步骤包括使样品与洗涤缓冲液接触,所述洗涤缓冲液包括盐缓冲液(例如柠檬酸钠(SSC))、去污剂(例如SDS)和非质子溶剂(例如DMSO)中的一种或多种。
在一些实施例中,在现有代码中将锚定物附接到组织样品、将子代码附接到锚定物或将子代码附接到子代码利用光反应性基团。在一些实施例中,使用一个以上的光反应性基团,每个基团对独特的波长具有反应性,包括光束、太赫兹频率束和X射线。在一些实施例中,附接是通过用声波辐射进行的,其中声波促进反应性基团之间的化学反应。
在一些实施例中,可以使用LED光源。例如,可以使用发射适当波长的光的光源(例如365nm(XeLED-NilUV-R3-365,Xenopus Electronix))来照射组织。照射可以用于实验性地确定合适的持续时间和距离,例如从2em处持续30秒。组织的非照射部分可以例如用铝箔或任何其他阻光材料来阻挡。在一些实施例中,可以使用由金属卤化物灯(X-Cite,LumenDynamics)发射的穿过20倍显微镜物镜的UV光。取决于要形成的化学键,UV能量的范围可以是50-10mW,持续十秒到一分钟。
在一些实施例中,基于质谱法的测量系统通过基于质谱法的测序来确定聚合物蛋白质附接点的序列。
在一些实施例中,交联是光交联。光交联可以使用一定波长的激光来完成。在锚定物包含在存在激光照射的情况下与靶标起反应的反应性基团的实施例中,利用在存在不同波长的光照射的情况下发生反应的不同的反应性基团,将多个锚定物附接到多个靶标。
在一些实施例中,通过掩蔽将组织样品的部分分离。当子代码正被附接到其余的(未掩蔽的)组织样品时,组织样品的一部分被掩蔽。掩蔽可以通过光刻中使用的标准掩蔽系统来完成。虚拟掩蔽或光刻可以通过可寻址激光系统来进行,所述激光系统在技术界已经很成熟。
在一些实施例中,利用数字微镜装置(DMD)通过无掩模方法来引导激光,Singh-Gasson等人(1999),Maskless fabrication of light-directed oligonucleotidemicroarrays using a digital micromirror array,Nature Biotechnology 17:974。在这个实施例中,组织样品形成可寻址阵列,其中子代码被交联到2D样品中的可寻址区。
在一些实施例中,所述方法利用激光仪器。激光器具有精确地聚焦在组织样品的区上的优点,使得条形码可以与所述区精确地相关联并且不具有现有技术方法所经历的渗漏。本领域中可用的典型激光器能够达到微米级的分辨率,从而能够分辨出显微镜载玻片上多达1,000,000至2,500,000个斑点。
在一些实施例中,激光器是可编程激光器。使用可编程激光器,可以将组织样品制成虚拟可寻址阵列。在所述阵列中,通过可编程激光器将每个位置与这个位置的照射时间以及此时添加(交联)到代码的子代码代码的序列相关。随后对条形码的核酸序列的分析揭示了子代码链,所述子代码链被转换成条形码在由可编程激光器在组织样品上形成的虚拟可寻址阵列内的位置。
此外,每个条形码直接或间接地与靶标特异性序列相关联。在一个实施例中,条形码直接组装在与作为核酸的靶标互补的锚定物上。在这个实施例中,对条形码进行测序还包括对靶标核酸的测序。在另一个实施例中,作为蛋白质的靶标被与表位特异性条形码(ESB)相关联的抗体识别。ESB是与靶标特异性抗体相关联的核酸序列。在这个实施例中,对条形码进行测序还包括对实际上与靶标蛋白质相关联的ESB进行测序。因此,使用其中放置有条形码的可寻址阵列使得能够确定阵列内和组织样品内的每个带条形码靶标的坐标。
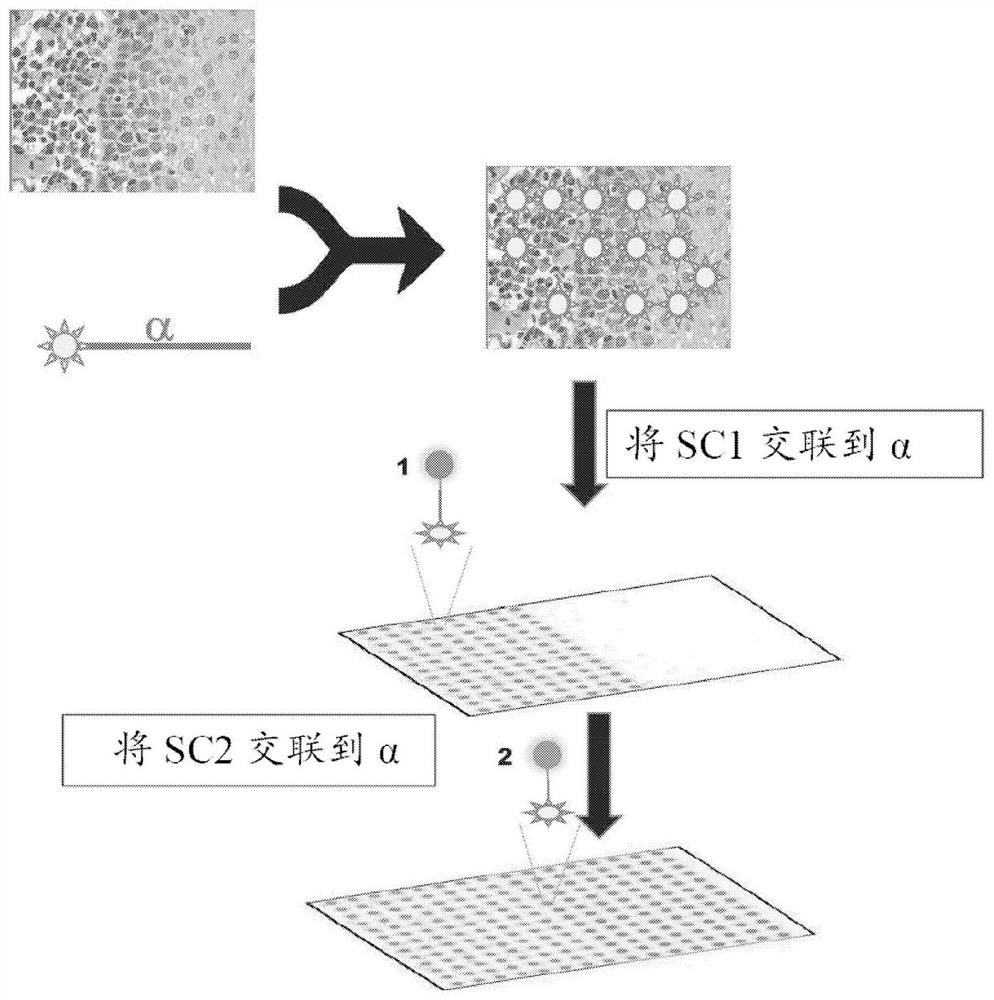
代码与组织样品中的位置相关。通过由可执行代码引导的可编程激光器的照射,代码以时间顺序的方式附接到组织样品的每个部分中的靶标,以使附接特定代码的时间和代码系列与此时处理(例如,用激光照射)的样品部分相关。(图1:在步骤1首先将子代码1添加到锚定物“左”半部分并且从而标识左半部分,然后在步骤2首先将子代码2添加到锚定物“右”半部分并且从而标识右半部分)。代码是从两个或更多个子代码组装成的,如下文更详细描述的。图2示出了组装代码1-1、1-2、2-1和2-2以及随后的代码1-1-1、1-1-2等的图。在贴标记过程结束时,样品内的每个靶标(例如蛋白质或核酸)都用特定于样品内靶标位置的代码标记。组装的代码对于组织样品的每个部分都是唯一的,并且充当组织样品的这个部分的位置或空间标识物。代码的长度反映了样品内的分辨率(最小可区分区域的大小)。
在一些实施例中,代码是核酸,并且读取代码包括对核酸进行测序。在一些实施例中,组装的代码的5′端是附接到锚定物的近端,而3′端是远端。在其他实施例中,组装的代码的3′端是附接到锚定物的近端,而5′端是远端。
在一些实施例中,组装的代码包括通用域,其包含用于代码的下游分析的元素。在一些实施例中,通用域包括引物(例如扩增引物或测序引物)的结合位点。
在一些实施例中,代码在测序之前被扩增。在这样的实施例中,扩增引物结合到组装代码内的引物结合位点。引物结合位点是在所有子代码之间至少部分共享的序列。在一些实施例中,引物结合位点在代码的远端(距靶标最远)。远端可以是扩增引物可结合并启动第一轮扩增的3′端。在一些实施例中,引物结合位点在代码的近端(距靶标最近)。近端可以是扩增引物可结合并启动第一轮扩增的3′端。在一些实施例中,扩增使用与锚定物(锚定物包括引物结合位点的至少一部分)至少部分互补的引物。
在一些实施例中,扩增用作所述方法的靶标识别步骤。在一些实施例中,样品中的每个靶标(即样品中的每个蛋白质)在空间上被标记。特定蛋白质靶标的检测可以用抗体来完成。可以从任何合适的来源获得抗体,包括重组表达的抗体和从多种动物物种获得的抗体。可以从商业来源获得各种各样的预制抗体和定制抗体。在一些实施例中,抗体联结到核酸。在一些实施例(图4)中,抗体和扩增引物两者都缀合到滑动支持物的相同颗粒。在一些实施例中,引物直接缀合到抗体。在本发明的方法中包括将核酸附接到包括抗体的蛋白质的任何合适方法,参见例如Gullberg等人,PNAS 101(22):228420-8424(2004);Boozer等人,Analytical Chemistry,76(23):6967-6972(2004)以及Kozlov等人,Biopolymers 5:73(5):621-630(2004)。在一些实施例中,如Nolan,Nature Methods 2,11-12(2005)中所描述,使用蝌蚪将抗体-锚定物附接到核酸。在一些实施例中,使用SpyTag-SpyCatcher技术将抗体缀合到核酸,其中抗体和核酸包括SpyTag和SpyCatcher,参见Reddington和Howarth(2015),Secrets of a covalent interaction for biomaterials and Biotechnology,SpyTag and SpyCatcher,Current Opinion in Chemical Biology 2015,29:94-99。在其他实施例中,引物直接缀合到抗体,并且也直接缀合到固体支持物颗粒或捕获部分(例如生物素)。
抗体的结合用于递送扩增引物并且能够扩增空间代码。尽管代码(或锚定物)包括与引物至少部分互补的引物结合位点,但是互补性不足以实现引物退火和引物延伸两者。为了使引物延伸发生,抗体必须与靶标结合(图4)。没有抗体结合,代码不会被扩增,也不会被检测到。因此,仅附接到感兴趣的靶标的空间代码被扩增和检测。
本发明包括通过核酸测序读取代码、锚定物和直接或间接地读取关于靶标的任何信息的步骤。测序可通过本领域已知的任何方法执行。尤其有利的是能够读取循环靶标分子的高通量单分子测序。此类技术的示例包括SOLiD平台(ThermoFisher Scientific,Foster City,Cal.)、基于荧光的Heliscope测序仪(Helicos Biosciences,Cambridge,Mass.)、利用SMRT的Pacific BioSciences平台(Pacific Biosciences,Menlo Park,Cal.)或利用纳米孔技术的平台诸如Oxford Nanopore Technologies(Oxford,UK)或RocheSequencing Solutions(Roche Genia,Santa Clara,Cal.)制造的那些平台,通过可逆终止子合成测序(SBS)(Illumina,San Diego,Cal.)和牵涉或不牵涉合成测序的任何其它现有或未来DNA测序技术进行测序。测序步骤可利用平台特异性测序引物。这些引物的结合位点可以例如通过作为最终子代码或用于在测序之前扩增代码的扩增引物的一部分而引入到代码中。
在一些实施例中,代码是两个或更多个非核酸化学实体的组合,并且代码的读取包括通过飞行时间(TOF)确定的质谱法进行的分析。在这个实施例中,编码是通过光子使能的亚基聚合进行的。虽然可以通过高通量测序读出核酸,但是需要其他方法来确定聚合或缀合的非核苷酸化学部分的序列。这是蛋白质质谱测序中的一个良好表征的过程。这里启用的过程只是将其概括为聚合物亚基的读取。其他聚合物亚基的优点在于,人们可能会意外地发现聚合物亚基比氨基酸基聚合物更容易通过质谱法区分。
在一些实施例中,本发明包括同时检测多个靶标分子(多重测定)。例如,可以将多个抗体-锚定物添加到组织样品。同样,可以将多个核酸锚定物添加到组织样品。多个核酸锚定物可能不共享互补区域,以防止锚定物之间的体外相互作用。包括部分互补性的互补性可以通过实验或使用诸如BLAST之类的软件来排除。
本发明方法可以检测和区分组织样品内潜在的数百万个独特位置。较长的条形码(已通过多轮组装形成)可以区分更多的位置。可用于交联的多个反应性基团的使用允许区分组织样品内的更多位置。对于每个反应性基团,强度可以变化,从而将每个组有效地分成多达三个单独的组。以下计算使得本领域技术人员能够确定在给定的组织样品中实现期望的空间分辨率所需的条形码数量(以及代码组装的轮次)。
如果使用5个不同的波长,则在一轮中,在3D中区分的位置数为5
本发明包括使代码序列与组织样品的部分相关以便获得靶标在组织样品内的位置的步骤。在一些实施例中,组织样品被定向成使得最大的信息内容能够从研究者最感兴趣的组织区中获取。所述组织将定向在凝胶基质内,从而允许激光寻址和询问样品。在一些实施例中,组织样品用位置标识物来标识。例如,可以通过与已知核酸代码缀合的珠子引入位置(基准)标识物。代码用作预编程的地址。可以用手或通过机器人放置来引入标识物。在其他实施例中,可以通过用也包括已知核酸代码的互补探针靶向已知序列来引入这样的位置标识物。将代码交联到样品中的已知点会创建位置标识物。
在本发明的上下文中,关于特定代码的位置信息是从样品的部分受到照射从而导致代码附接到样品的时间获得的。(图2)
在一些实施例中,本发明是一种在三维或二维样品中同时检测靶标的存在和空间位置的方法。组织样品可以是2D或3D真核(动物、人、植物或真菌)组织样品(例如在显微镜载玻片上)或原核样品,诸如具有2D或3D结构的微生物生物膜。样品需要是透明的或变得透明,以便可由本发明中使用的激光系统寻址。
在第一步骤中,将样品与锚定物接触,所述锚定物附接到组织样品中的靶标。靶标可以是蛋白质或核酸(RNA或DNA)。因此,锚定物是核酸探针、非特异性核酸或蛋白质特异性核酸适体。在一些实施例中,锚定物以特异性结合一个靶标(例如,适体、核酸探针或抗体)。在其他实施例中,锚定物非特异性地结合多个靶标。适体的结合条件已在例如Deng等人(2014),Aptamer binding assays for proteins:The thrombin example-A review,Analytica Chim.837:11-15中进行了描述。核酸探针的结合条件是用于原位杂交(ISH)的条件,参见Wilkinson、E.G.编辑(1999),In Situ Hybridization:A Practical Approach(Practical Approach Series)第2版,Oxford University Press。
锚定物包括反应性基团,例如光反应性基团或可通过辐射活化的另一类型的基团。通过具有激活反应性基团的波长的辐射将锚定物交联到靶标。
锚定物用作代码组装的位点。代码在每个锚定分子上原位组装。代码是通过两轮或更多轮组装从两个或更多个子代码组装成的。组装涉及子代码的结合和交联,然后去除(洗涤)未链接的子代码。在每一轮组装过程中,一部分组织样品被掩蔽,使得在掩蔽的部分中不会发生交联。(图1)。使样品与第一子代码(例如,1)接触,从而允许子代码1在组织样品的第一部分中附接到锚定物。第二部分被掩蔽。接下来,使样品与第二子代码(例如,2)接触,从而允许子代码2在组织样品的第二部分中附接到锚定物,所述第二部分与第一部分不重叠。(图1)。现在,第一部分被掩蔽。例如,第一和第二部分可以是显微镜载玻片的左半部分和右半部分。在下一轮中,使样品与下一个子代码(例如1或2)接触,以允许子代码在组织样品的第三部分中附接到子代码A和B,所述第三部分与第一和第二部分部分重叠,从而在第三部分上形成两部分代码(例如11和21)(图2)。第四部分被掩蔽。接下来,使样品与下一个子代码(例如1或2)接触,以允许子代码在组织样品的第四部分中附接到子代码1和2,所述第四部分与第一和第二部分部分重叠但与第三部分不重叠,从而在第四部分上形成两部分代码(12和22)。第三部分被掩蔽。例如,第三和第四部分可以是显微镜载玻片的上半部分和下半部分。因此,组织样品被分为四个区,每个区具有唯一的地址。任选地,可以重复所述步骤,使得可以添加更多的子代码,并且可以将组织样品进一步划分为多个区,每个区具有由唯一代码(即,子代码的唯一组合)标识的唯一地址。例如,在随后的步骤中,暴露和掩蔽样品的部分以实现子代码添加,从而创建更长的代码(例如111、211、112、212等),每个代码对应于样品的较小部分。(图2-3)。读取组装的代码以确定每个锚定物在组织样品中的空间位置。
图1展示了用于检测组织样品中靶标的存在和位置的工作流程。在这个实例中,锚定物被缀合到第一子代码。锚定物包括反应性基团(在这个图中为光反应性基团),使得锚定物可以交联到靶标。使组织切片形式的组织样品与缀合到反应性基团的锚定分子(α)接触,从而用锚定分子装饰组织样品中的每个靶标(例如,每种蛋白质)。
子代码可以通过与其他子代码互补的区域彼此附接(即,附接到来自前一轮的子代码)。在一些实施例中,子代码彼此不退火,而是退火到两个相邻子代码都退火的退火引物。在其他实施例中,子代码退火到夹板寡核苷酸。然而,在每个实施例中,需要进行交联以在两个子代码之间形成稳定的键,所述子代码为退火引物或子代码和夹板。未交联的子代码在洗涤步骤中被洗去。
图2展示了组织样品中的原位空间代码的顺序组装。在每一轮中,部分切片被掩蔽,而在其余的活性部分中,添加下一个子代码分子。如图所示,掩蔽的部分和活性部分不是连续的。如图所示,在每个地址处,组装了由2个并且然后3个子代码组成的代码。核酸子代码的附接可以包括核酸链延伸、间隙填充和连接中的一种或多种。例如,如果使用退火引物,则核酸端部可以彼此直接相邻退火,从而使得相邻核酸(例如子代码)的5′端和3′端连接。在其他实施例中,核酸的端部之间存在间隙。所述间隙通过核酸聚合酶的链延伸来填充。延伸链的3′端与相邻核酸(例如子代码)的5′端连接。
在一些实施例中,锚定物非特异性地结合到靶标。例如,样品中的每种蛋白质都可以通过核苷酸-氨基酸交联结合到寡核苷酸锚定物。在这种情景下检测感兴趣的蛋白质需要单独的检测步骤。例如,锚定物缀合的蛋白质靶标可以用抗体来检测。抗体缀合到核酸,所述核酸与在靶标分子(锚定物缀合的蛋白质)上组装的代码相互作用,从而检测出靶标分子。如图4所示,抗体缀合到与锚定区域(α)互补的可延伸的寡核苷酸(γ)。寡核苷酸的延伸使得能够复制或复制和扩增代码(条形区域)。仅当抗体结合到其靶标以确保检测特异性时,才会发生复制和扩增。抗体的结合条件是在流式细胞术或免疫组织化学中用抗体对组织进行染色的条件,参见S.Hockfield等人,Selected Methods for Antibody andNucleic Acid Probes,Cold Spring Harbor Lab Press(1993)。在一些实施例中,检测是定性的,使得扩增子的存在指示靶标的存在。在一些实施例中,检测是定量的,例如,扩增的不同独特条形码的数量指示组织样品中包括(表达)靶标蛋白质的细胞的数量。在一些实施例中,检测是定量的,例如具有相同条形码的扩增子的量指示组织样品中特定细胞中靶标蛋白质的量(表达水平)。
尽管已经参考特定实施例详细描述了本发明,但对本领域技术人员显而易见的是,可以在本发明的范围内进行各种修改。因此,本发明的范围不应当由本文所描述的实例限制,而应当由下文呈现的权利要求书限制。
- 细胞靶标的空间上定向的量子条形编码
- 空间上可寻址的分子条形编码
