治疗与S1P1受体有关的病况的方法
文献发布时间:2023-06-19 12:07:15
技术领域
提供了在治疗鞘氨醇1-磷酸盐亚型1(S1P
鞘氨醇-1-磷酸盐(S1P)受体1-5构成具有七个跨膜结构域的G蛋白偶联受体家族。这些受体称为S1P
鉴于对在治疗S1P
已作为重要的新化合物出现,参见PCT专利申请序号PCT/US2009/004265,所述申请特此以引用的方式全文并入。化合物1或其药学上可接受的盐、溶剂合物或水合物是意图用于治疗鞘氨醇1-磷酸盐亚型1(S1P
许多S1P
需要有效地治疗需要用化合物1或其药学上可接受的盐、溶剂合物或水合物进行治疗的个体,或更特别地,需要用于确定个体是否可以为这种治疗的反应者的方法。本公开满足此需要并且还提供相关优点。
对贯穿本申请的任何参考文献的引用不应被解释为承认这种参考文献是本申请的现有技术。
发明内容
提供了一种确定个体是否为用(R)-2-(7-(4-环戊基-3-(三氟甲基)苄基氧基)-1,2,3,4-四氢环戊二烯并[b]吲哚-3-基)乙酸(化合物1)或其药学上可接受的盐、溶剂合物或水合物治疗的反应者的方法,包括以下步骤:
在向所述个体投与化合物1或其药学上可接受的盐、溶剂合物或水合物的第一时间段之后测定个体对化合物1或其药学上可接受的盐、溶剂合物或水合物的反应性,
其中如果所述个体在投与的所述第一时间段之后已达到阈作用,则所述个体是反应者。
还提供了一种用于从需要体重管理的多个个体中选择用于用化合物1或其药学上可接受的盐、溶剂合物或水合物进行治疗的个体的方法,包括:
在向所述个体投与化合物1或其药学上可接受的盐、溶剂合物或水合物的第一时间段之后测定个体对化合物1或其药学上可接受的盐、溶剂合物或水合物的反应性;以及
如果所述个体在投与的所述第一时间段之后已达到阈作用,则选择用于用化合物1或其药学上可接受的盐、溶剂合物或水合物进行治疗的个体。
还提供了一种用于治疗有需要的个体中的鞘氨醇1-磷酸亚型1(S1P
向所述个体投与治疗有效量的化合物1或其药学上可接受的盐、溶剂合物或水合物,
其中所述个体先前已根据本文描述的方法被确定为反应者或选择用于治疗。
还提供了一种用于治疗有需要的个体中的鞘氨醇1-磷酸亚型1(S1P
向所述个体投与治疗有效量的化合物1或其药学上可接受的盐、溶剂合物或水合物;
根据本文描述的方法确定所述个体是反应者还是被选择用于治疗;以及
如果所述个体被标识为反应者则继续投与所述化合物1或其药学上可接受的盐、溶剂合物或水合物,或者
如果所述个体未被标识为反应者则修改给所述个体的所述化合物1或其药学上可接受的盐、溶剂合物或水合物的投与。
还提供了一种用于治疗有需要的个体中的鞘氨醇1-磷酸亚型1(S1P
在第一时间段内所述向个体投与化合物1或其药学上可接受的盐、溶剂合物或水合物;
如果所述个体在所述第一时间段之前达到至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%或95%的粪便钙卫蛋白降低则继续在第二时间段内投与化合物1。
还提供了一种用于治疗有需要的个体中的鞘氨醇1-磷酸亚型1(S1P
在第一时间段内所述向个体投与化合物1或其药学上可接受的盐、溶剂合物或水合物;
如果所述个体在所述第一时间段之前达到至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%或95%的C反应蛋白降低则继续在第二时间段内投与化合物1。
还提供了一种用于治疗有需要的个体中的鞘氨醇1-磷酸亚型1(S1P
在第一时间段内所述向个体投与化合物1或其药学上可接受的盐、溶剂合物或水合物;
如果所述个体在所述第一时间段之前未达到至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%或95%的粪便钙卫蛋白降低则中断在第二时间段内投与化合物1。
还提供了一种用于治疗有需要的个体中的鞘氨醇1-磷酸亚型1(S1P
在第一时间段内所述向个体投与化合物1或其药学上可接受的盐、溶剂合物或水合物;
如果所述个体在所述第一时间段之前未达到至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%或95%的C反应蛋白降低则中断在第二时间段内投与化合物1。
将在专利公开进行时更详细地阐述本文所公开的本发明的这些和其他方面。
附图说明
图1示出了安全人群中观察到的淋巴细胞计数(10
图2示出了安全人群中观察到的中性粒细胞计数(10
图3示出了安全人群中作为在时间点之前相对于基线的变化的心电图(ECG)心率(bpm)。
图4示出了针对艾曲莫德(化合物1的L-精氨酸盐)、奥扎尼莫德、
图5示出了针对艾曲莫德(化合物1的L-精氨酸盐)、奥扎尼莫德、
图6A-B示出了安慰剂、艾曲莫德1mg和艾曲莫德2mg随时间对(A)粪便钙卫蛋白和(B)C反应蛋白水平的影响。P值对安慰剂:*P≤0.05,**P≤0.001。BL,基线;CRP,C反应蛋白;IQR,四分位数间距;Wk,周。
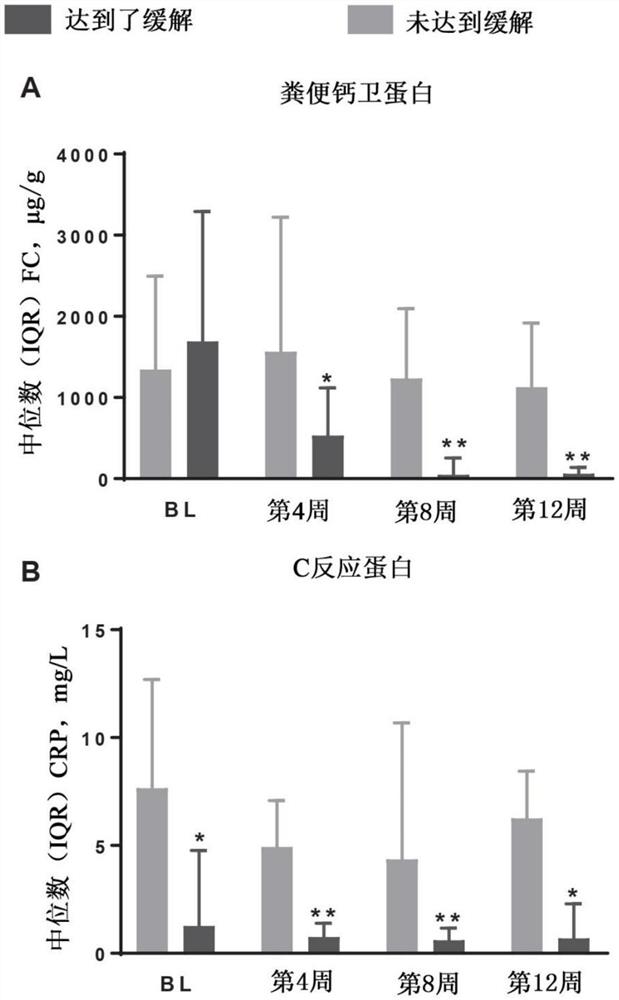
图7A-B示出了在第12周达到和未达到缓解的患者中的艾曲莫德2mg随时间对(A)粪便钙卫蛋白和(B)C反应蛋白水平的影响。P值比较达到了缓解的患者与未达到缓解的患者的关系:*P≤0.005,**P≤0.0001。BL,基线;CRP,C反应蛋白;IQR,四分位数间距;Wk,周。
具体实施方式
如本说明书中所使用,以下字词和短语一般意图具有如下文所阐述的含义,除使用其的上下文另外指示的方面外。
化合物1:如本文所使用,“化合物1”意指(R)-2-(7-(4-环戊基-3-(三氟甲基)苄基氧基)-1,2,3,4-四氢环戊二烯并[b]吲哚-3-基)乙酸,包括其结晶形式。作为非限制性实例,化合物1可如描述于WO 2010/011316(以全文引用的方式并入本文中)中的无水非溶剂化结晶形式存在。作为另一个非限制性实例,化合物1的L-精氨酸盐可如描述于WO 2010/011316和WO2011/094008(其中的每一者以全文引用的方式并入本文中)中的无水非溶剂化结晶形式存在。作为另一个非限制性实例,化合物1的钙盐可如描述于WO 2010/011316(以全文引用的方式并入本文中)中的结晶形式存在。
投与:如本文所使用,“投与”意指提供化合物或其它疗法、救治或治疗,使得个体内化化合物。
开处方:如本文所使用,“开处方”意指订购、授权或推荐使用药物或其他疗法、救治或治疗。在一些实施例中,医护从业者可口头建议、推荐或批准对个体使用化合物、给药方案或其它治疗。在这种情况下,医护从业者可或可不提供对化合物、给药方案或治疗的处方。此外,医护从业者可或可不提供所推荐的化合物或治疗。例如,医护从业者可建议个体在何处获得化合物而非提供化合物。在一些实施例中,医护从业者可向个体提供化合物、给药方案或治疗的处方。例如,医护从业者可向个体提供书面或口头处方。处方能够写在纸上或在诸如计算机文件的电子介质上,例如,在手持计算机设备上。例如,医护从业者能够将一张纸或电子媒体变换成对化合物、给药方案或治疗的处方。此外,处方能够(口头)阐述、传真(书面)或经由互联网电子提交到药房或配药处。在一些实施例中,能够给予个体化合物或治疗的样品。如本文所使用,给予化合物样品构成化合物的隐含处方。世界上的不同健康护理系统使用用于开处和/或投与化合物或治疗的不同方法,并且本公开涵盖这些方法。
处方可包括例如个体的姓名和/或身份信息,如出生日期。此外,例如,处方可包括:药物名称、药物强度、剂量、投与频率、投与途径、待分配的数量或量、再配药数量、医师姓名、医师签名等。此外,例如,处方能够包括DEA号或州号。
医护从业者能够包括例如医师、护士、护士从业者或其它相关医护专业人员,其能够开处或投与用于治疗鞘氨醇1-磷酸盐亚型1(S1P
预防(PREVENT/PREVENTING/PREVENTION):如本文所使用,术语“预防(prevent/preventing/prevention)”如预防鞘氨醇1-磷酸盐亚型1(S1P
治疗(treat/treating/treatment):如本文所使用,术语“治疗(treat/treating/treatment)”意指向已显示疾病或病况的至少一种症状或先前已显示疾病或病况的至少一种症状的个体投与疗法。例如,“治疗”能够包括减轻、缓和或改善疾病或病况症状,防止其它症状,改善症状的潜在代谢病因,抑制疾病或病况,例如使疾病或病况的发展停滞,缓解疾病或病况,致使疾病或病况消退,缓解由疾病或病况所导致的病况,或使疾病或病况的症状停止。例如,关于病征的术语“治疗”意指与该特定病征相关联的一种或多种症状的严重性降低。因此,治疗障碍不一定意味着与障碍相关的所有症状的严重性降低,并且不一定意味着与障碍相关的一种或多种症状的严重性完全降低。
耐受:如本文所使用,如果对个体投与一定剂量的化合物不会导致不可接受的不良事件或不可接受的不良事件的组合,那么称个体“耐受”所述剂量的化合物。所属领域的技术人员将理解,耐受是一种主观的量度,并且一个个体可耐受的东西可能对另一个个体不耐受。例如,一个个体可能不能够耐受头痛,而第二个个体可能结果头痛可耐受但无法耐受呕吐,但对于第三个个体而言,单独的头痛或单独的呕吐是可耐受的,但所述个体不能够耐受头痛与呕吐的组合,即使每一个的严重程度比单独经历时小。
不良事件:如本文所使用,“不良事件”是与用化合物1或其药学上可接受的盐、溶剂合物或水合物治疗相关的不良医学事件发生。在一个实施例中,不良事件是选自:白细胞减少症、便秘、腹泻、恶心、腹痛、嗜中性白细胞减少症、呕吐、背痛和月经异常。在一个实施例中,不良事件是心传导阻滞,例如,一度房室心传导阻滞。在一个实施例中,不良事件是急性心率降低。在一个实施例中,不良事件是异常肺功能测试结果,如低于80%的FEV1,FVC。在一个实施例中,不良事件是异常肝功能测试,如升高的ALT&AST>2X ULN。在一个实施例中,不良事件是黄斑水肿。
需要治疗和有需要的:如本文所使用,“需要治疗”和“有需要的”在涉及治疗时可互换使用,以意指由护理人员(例如,就人类而言,医师、护士、护士从业人员等;就动物而言,兽医,包括非人类哺乳动物)作出的个体或动物需要或将受益于治疗的判断。此判断是基于护理人员的专业知识领域内的多种因素而作出的,但包括以下知识:个体或动物由于可由本发明的化合物治疗的疾病、病况或病症而生病或将生病。因此,本发明的化合物能够以保护性或预防性方式使用;或者本发明的化合物能够用于减轻、抑制或改善疾病、病症或障碍。
个体:如本文所使用,“个体”意指任何动物,包括哺乳动物,优选小鼠、大鼠、其它啮齿动物、兔子、狗、猫、猪、牛、绵羊、马或灵长类动物,并且最优选人类。在一些实施例中,人类个体称为“患者”。
急性心率降低:如本文所使用,“急性心率降低”意指心率从正常的窦性心律降低到,例如,每分钟搏动10次或更多次(bpm),如小于约5bpm,例如小于约4bpm或小于约3bpm或小于2bpm,即在投与药物后数小时(例如1-3小时)内达到最大值,并且之后心率恢复到给药前的值。
正常窦性心律:如本文所使用,“正常窦性心律”意指个体在未进行治疗时的窦性心律。对正常窦性心律的评价在医师的能力范围内。正常窦性心律将通常产生60-100bpm范围内的心率。
剂量:如本文所使用,“剂量”意指在一个特定时间给予个体的用于治疗或预防疾病或病症的化合物1或其药学上可接受的盐、溶剂合物或水合物的量。
禁食个体:如本文所使用,“禁食个体”意指未进食任何食物的个体,即在投与化合物1或其药学上可接受的盐、水合物或溶剂合物之前,已禁食至少6-8小时,如约8小时,并且所述个体不吃任何食物且在投与化合物1或其药学上可接受的盐、水合物或溶剂合物之后继续禁食至少1小时。在某些实施例中,个体还可在禁食期间避免摄取某些非食物物质。例如,在某些实施例中,个体在禁食期间不摄取任何补充剂和/或药物。在某些实施例中,个体在禁食期间不摄取任何高卡路里液体。在某些实施例中,个体在禁食期间不摄取除水以外的任何液体。在某些实施例中,个体可摄取少量低卡路里饮料,如茶、咖啡或稀果汁。
梅奥诊所评分(MCS):如本文所使用,“梅奥诊所评分”或“MCS”意指经设计以测定溃疡性结肠炎疾病活性的仪器并且由至多4个分项评分组成:大便频率、直肠出血、柔性直肠乙状结肠镜检查的结果和医师的总体评估,每个分量的范围是0至3(0=正常,1=轻度,2=中度,3=重度)。因此,总评分在0至12范围内,其中较高评分指示较严重疾病。6分梅奥评分是基于每天使用电子病历收集的大便频率和直肠出血PRO得出的,并且不包括内窥镜检查的结果和医师的总体评估。3分梅奥评分是基于大便频率、直肠出血和内窥镜检查的结果,并且总评分范围是0至9。2分梅奥评分是基于直肠出血和内窥镜检查的结果,并且总评分范围是0至6。医师的总体评估认可了MCS的其它三个标准检查结果,个体每天的腹部不适和一般健康状况的记录和其它观察结果,如身体检查结果和个体的表现。
轻度至中度活动性溃疡性结肠炎:如本文所使用,“轻度至中度活动性溃疡性结肠炎”意指特征在于4组分MCS为4至10的溃疡性结肠炎。
中度至重度活动性溃疡性结肠炎:如本文所使用,“中度至重度活动性溃疡性结肠炎”意指特征在于3分量MCS为4至9,包括内窥镜评分≥2且直肠出血评分≥1的溃疡性结肠炎。3分量MCS使用完整MCS的4组分中的3分量(内窥镜检查结果、直肠出血和大便频率)。
临床缓解:如本文所使用,关于溃疡性结肠炎的“临床缓解”意指3分量梅奥诊所评分如下:内窥镜评分(使用柔性直肠乙状结肠镜检查)为0或1,直肠出血评分为≤1,并且大便频率评分为0或1,相对于基线分项评分降低≥1分。在一些实施例中,关于溃疡性结肠炎的“临床缓解”意指3分量梅奥诊所评分如下:内窥镜评分(使用柔性直肠乙状结肠镜检查)为0或1,直肠出血评分为0,并且大便频率评分为0或1,相对于基线分项评分降低≥1分。
临床反应:如本文所使用,关于溃疡性结肠炎的“临床反应”意指3分量梅奥诊所评分降低了≥2分,并且相对于基线降低≥30%、同时直肠出血评分降低≥1或绝对直肠出血评分为0或1。
内窥镜改善:如本文所使用,关于溃疡性结肠炎的“内窥镜改善”是指特征在于梅奥内窥镜分项评分(使用柔性直肠乙状结肠镜检查的结果)≤1分的溃疡性结肠炎。
内窥镜缓解:如本文所使用,关于溃疡性结肠炎的“内窥镜缓解”意指特征在于梅奥诊所评分=0的柔性直肠乙状结肠镜检查结果的溃疡性结肠炎。
直肠出血的改善:如本文所使用,关于溃疡性结肠炎的“直肠出血的改善”意指相对于基线变化<0。
组织学愈合:如本文所使用,关于溃疡性结肠炎的“组织学愈合(histologichealing)”意指在吉布斯指数(Geboes Index)上的评分<3.1。
组织学缓解:如本文所使用,关于溃疡性结肠炎的“组织学缓解(histologicremission/histological remission)”意指在吉布斯指数上的评分<2.0。
粘膜愈合:如本文所使用,“粘膜愈合”是内窥镜改善和组织学缓解。
大便频率的改善:如本文所使用,关于溃疡性结肠炎的“大便频率的改善”意指相对于基线变化<0。
5-氨基水杨酸盐:如本文所使用,“5-氨基水杨酸盐”意指一类药物,其包括例如
免疫抑制剂:如本文所使用,“免疫抑制剂”意指一类药物,其包括例如
糖皮质类固醇:如本文所使用,“糖皮质类固醇”意指一类药物,其包括例如
TNFα拮抗剂:如本文所使用,“TNFα拮抗剂”或“肿瘤坏死因子-α拮抗剂”意指一类药物,其包括例如
整联蛋白受体拮抗剂:如本文所使用,“整联蛋白受体拮抗剂”意指一类药物,其包括例如
药物组合物:如本文所使用,“药物组合物”意指包含至少一种活性成分(如化合物1)的组合物;包括但不限于化合物1的盐、溶剂合物和水合物,由此所述组合物适于研究哺乳动物(例如但不限于人类)的特定有效结果。本领域普通技术人员将理解和了解适合于根据技术人员的需要确定活性成分是否具有期望的有效结果的技术。
激动剂:如本文所使用,“激动剂”意指与G蛋白偶联受体(如S1P
拮抗剂:如本文所使用,“拮抗剂”意指与激动剂(如内源性配体)在同一位点竞争性结合到受体的部分,但其不激活由受体活性形式引发的细胞内反应,并且从而可抑制激动剂或部分激动剂的细胞内反应。在不存在激动剂或部分激动剂的情况下,“拮抗剂”不会减少基线细胞内应答。
水合物:如本文所使用,“水合物”意指本发明的化合物或其盐,其进一步包括通过非共价分子间力结合的化学计量或非化学计量的量的水。
安全人群:如本文所使用,“安全人群”意指接受研究药物的所有随机受试者。
溶剂合物:如本文所使用,术语“溶剂合物”意指本发明的化合物或其盐,其进一步包括通过非共价分子间力结合的化学计量或非化学计量的量的溶剂。优选的溶剂是挥发性、无毒和/或可接受的以微量向人投与。
根据本发明的化合物可任选地呈药学上可接受的盐存在,所述盐包括由药物学上可接受的无毒酸(包括无机酸和有机酸)制备的药物学上可接受的酸加成盐。代表性的酸包括但不限于乙酸、苯磺酸、苯甲酸、樟脑磺酸、柠檬酸、乙烯磺酸、二氯乙酸、甲酸、富马酸、葡萄糖酸、谷氨酸、马尿酸、氢溴酸、盐酸、羟乙基磺酸、乳酸、马来酸、苹果酸、扁桃酸、甲磺酸、粘液酸、硝酸、草酸、双羟萘酸、泛酸、磷酸、琥珀酸、硫酸、酒石酸、草酸、对甲苯磺酸等,如Berge等人,《药物科学期刊(Journal of Pharmaceutical Sciences)》,66:1-19(1977)列出的那些药学上可接受的盐,其以全文引用的方式并入本文中。
酸加成盐可作为化合物合成的直接产物获得。在替代方案中,可将游离碱溶解在含有适当酸的合适溶剂中,并且通过蒸发溶剂或以其他方式分离盐和溶剂来分离盐。本发明的化合物可使用本领域技术人员已知的方法与标准低分子量溶剂形成溶剂合物。
应当理解,当提及化合物1时使用短语“药学上可接受的盐、溶剂合物和水合物”或短语“药学上可接受的盐、溶剂合物和水合物”时,其包括化合物1的药学上可接受的溶剂合物和/或水合物、化合物1的药学上可接受的盐以及化合物1的药学上可接受的盐的药学上可接受的溶剂合物和/或水合物。还应理解,当提及作为盐的化合物1时使用短语“药学上可接受的溶剂合物和水合物”或短语“药学上可接受的溶剂合物和水合物”时,其包括此类盐的药学上可接受的溶剂合物和/或水合物。
所属领域的技术人员将显而易见的是,本文所描述的剂型可包含化合物1或其药学上可接受的盐或溶剂合物或水合物作为活性成分。此外,化合物1的各种水合物和溶剂合物和其盐将可用作制备药物组合物的中间体。在本文提到的那些之外的制备和鉴定合适的水合物和溶剂合物的典型方法是本领域技术人员熟知的;参见例如Polymorphism inPharmaceutical Solids,ed.Harry G.Britain,Vol.95,Marcel Dekker,Inc.,New York,1999中K.J.Guillory,“Generation of Polymorphs,Hydrates,Solvates,and AmorphousSolids,”的第202-209页。因此,本公开的一个方面涉及开处方和/或投与化合物1的水合物和溶剂合物和/或其药学上可接受的盐的方法,其可通过所属领域已知的方法来分离和表征,如热重分析(TGA)、TGA-质谱法、TGA-红外光谱法、粉剂X射线衍射(XRPD)、卡尔飞世尔(Karl Fisher)滴定、高分辨率X射线衍射等。有几个商业实体提供常规鉴别溶剂合物和水合物的快速和有效的服务。提供这些服务的示例公司包括威明顿医药技术公司(Wilmington PharmaTech)(特拉华州威明顿市),Avantium技术公司(AvantiumTechnologies)(阿姆斯特丹)和Aptuit公司(康涅狄格州格林威治)。
本公开包括存在于本发明化合物、盐、溶剂合物和水合物中的原子的所有同位素。同位素包括那些具有相同原子数但不同质量数的原子。本发明的一个方面包括本发明化合物、盐、溶剂合物和水合物中的一个或多个原子的每一组合,其用具有相同原子数但不同质量数的原子替换。一个此实例是将在本发明化合物、盐、溶剂合物和水合物之一中发现的天然最丰富的同位素(如
本发明的化合物可转化为“前药”。术语“前药”意指用所属领域已知的特定化学基团修饰的化合物,并且当投与个体时,其经历生物转化以得到母体化合物。因此,前药可视为本发明的化合物,其含有一种或多种以短暂方式使用的专门的无毒保护基团,以改变或消除化合物的特性。在一个普遍的方面,“前药”方法用于促进口服吸收。在T.Higuchi和V.Stella,《作为新颖递送系统的前药(Pro-drugs as Novel Delivery Systems)》《美国化学会会议论文集(A.C.S.Symposium Series)》第14卷;和在《药物设计中的生物可逆载体(Bioreversible Carriers in Drug Design)》,Edward B.Roche编,美国药学协会和帕加马出版社(American Pharmaceutical Association and Pergamon Press),1987中进行了深入的论述,两者都以全文引用的方式并入本文中。
当在本文所公开的方法中使用整数时,可在整数之前插入术语“约”。
在整个说明书中,除非上下文另有要求,否则词语“包括”或诸如“包含”的变型将被理解为暗示包括所述步骤或元件或整数或步骤或元件或整数的组,但不排除任何其他步骤或元素或整数或元素或整数的组。
在整个说明书中,除非另外特别说明或上下文另有要求,否则提及单个步骤、物质组成、步骤组或物质组合物组应考虑包括一个和多个(即一个或更多个)那些步骤、物质组合物、步骤组或物质组合物组。
除非另外具体说明,否则本文中所描述的每一实施例将被加以必要修正以适用每一和每个其它实施例。
本领域技术人员将理解,除了具体描述的那些之外,本文描述的发明易于进行变化和修改。应理解,本发明包括所有这些变化和修改。除非另外特别说明,否则本发明还包括本说明书中单独或共同提及或指出的所有步骤、特征、组合物和化合物,以及任何和所有组合或所述步骤或特征中的任何两个或更多个。
本发明不受本文中所描述的具体实施例的范围限制,所述具体实施例意图仅出于示例的目的。如本文所述,功能等同的产品、组合物和方法显然在本发明的范围内。
应了解,为了清楚起见,在单独实施例的上下文中所描述的本发明的某些特征还可提供于单一实施例中的组合中。相反,为了简洁起见,在单一实施例的上下文中所描述的本发明的各种特征也可单独地或以任何合适的子组合形式提供。例如,叙述开处方和/或投与化合物1或其药学上可接受的盐、溶剂合物或水合物的方法可分成两种方法;叙述开处方化合物1或其药学上可接受的盐、溶剂合物或水合物的一种方法以及叙述投与化合物1或其药学上可接受的盐、溶剂合物或水合物的另一种方法。另外,例如,可将叙述开处方化合物1或其药学上可接受的盐、溶剂合物或水合物的处方的方法以及叙述投与化合物1或其药学上可接受的盐、溶剂合物或水合物的本发明的单独方法组合成叙述和/或投与化合物1或其药学上可接受的盐、溶剂合物或水合物的单一方法。
提供了一种确定个体是否为用(R)-2-(7-(4-环戊基-3-(三氟甲基)苄基氧基)-1,2,3,4-四氢环戊二烯并[b]吲哚-3-基)乙酸(化合物1)或其药学上可接受的盐、溶剂合物或水合物治疗的反应者的方法,包括以下步骤:
在向所述个体投与化合物1或其药学上可接受的盐、溶剂合物或水合物的第一时间段之后测定个体对化合物1或其药学上可接受的盐、溶剂合物或水合物的反应性,
其中如果所述个体在投与的所述第一时间段之后已达到阈作用,则所述个体是反应者。
还提供了一种用于从需要体重管理的多个个体中选择用于用化合物1或其药学上可接受的盐、溶剂合物或水合物进行治疗的个体的方法,包括:
在向所述个体投与化合物1或其药学上可接受的盐、溶剂合物或水合物的第一时间段之后测定个体对化合物1或其药学上可接受的盐、溶剂合物或水合物的反应性;以及
如果所述个体在投与的所述第一时间段之后已达到阈作用,则选择用于用化合物1或其药学上可接受的盐、溶剂合物或水合物进行治疗的个体。
还提供了一种用于治疗有需要的个体中的鞘氨醇1-磷酸亚型1(S1P
向所述个体投与治疗有效量的化合物1或其药学上可接受的盐、溶剂合物或水合物,
其中所述个体先前已根据本文描述的方法被确定为反应者或选择用于治疗。
还提供了一种用于治疗有需要的个体中的鞘氨醇1-磷酸亚型1(S1P
向所述个体投与治疗有效量的化合物1或其药学上可接受的盐、溶剂合物或水合物;
根据本文描述的方法确定所述个体是反应者还是被选择用于治疗;以及
如果所述个体被标识为反应者则继续投与所述化合物1或其药学上可接受的盐、溶剂合物或水合物,或者
如果所述个体未被标识为反应者则修改给所述个体的所述化合物1或其药学上可接受的盐、溶剂合物或水合物的投与。
在一些实施例中,修改化合物1或其药学上可接受的盐、溶剂合物或水合物的投与包括降低化合物1或其药学上可接受的盐、溶剂合物或水合物的投与剂量和/或频率。
在一些实施例中,修改化合物1或其药学上可接受的盐、溶剂合物或水合物的投与包括提高化合物1或其药学上可接受的盐、溶剂合物或水合物的投与剂量和/或频率。
在一些实施例中,修改所述化合物1或其药学上可接受的盐、溶剂合物或水合物的投与包括中断所述化合物1或其药学上可接受的盐、溶剂合物或水合物的开处方或投与。
还提供了用于治疗有需要的个体中的鞘氨醇1-磷酸亚型1(S1P
在第一时间段内所述向个体投与化合物1或其药学上可接受的盐、溶剂合物或水合物;
如果所述个体在所述第一时间段之前达到至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%或95%的粪便钙卫蛋白降低则继续在第二时间段内投与化合物1。
还提供了一种用于治疗有需要的个体中的鞘氨醇1-磷酸亚型1(S1P
在第一时间段内所述向个体投与化合物1或其药学上可接受的盐、溶剂合物或水合物;
如果所述个体在所述第一时间段之前达到至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%或95%的C反应蛋白降低则继续在第二时间段内投与化合物1。
还提供了一种用于治疗有需要的个体中的鞘氨醇1-磷酸亚型1(S1P
在第一时间段内所述向个体投与化合物1或其药学上可接受的盐、溶剂合物或水合物;
如果所述个体在所述第一时间段之前未达到至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%或95%的粪便钙卫蛋白降低则中断在第二时间段内投与化合物1。
还提供了一种用于治疗有需要的个体中的鞘氨醇1-磷酸亚型1(S1P
在第一时间段内所述向个体投与化合物1或其药学上可接受的盐、溶剂合物或水合物;
如果所述个体在所述第一时间段之前未达到至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%或95%的C反应蛋白降低则中断在第二时间段内投与化合物1。
在一些实施例中,阈作用是对粪便钙卫蛋白的测定。
在一些实施例中,通过粪便钙卫蛋白水平来测定反应性。
在一些实施例中,通过粪便钙卫蛋白水平的降低来测定反应性。
在一些实施例中,通过小于约1000、975、950、925、900、875、850、825、800、775、750、725、700、675、650、625、600、575、550、525、500、475、450、425、400、375、350、325、300、275、250、200、175、174、173、172、171、170、169、168、167、166、165、164、163、162、161、160、159、158、157、156、155、154、153、152、151、150、149、148、147、146、145、144、143、142、141、140、139、138、137、136、135、134、133、132、131、130、129、128、127、126、125、124、123、122、121、120、119、118、117、116、114、113、112、111、110、109、108、107、106、105、104、103、102、101、100、99、98、97、96、95、94、93、92、91、90、89、88、87、86、85、84、83、82、81、80、79、78、77、76、75、74、73、72、71、70、69、68、67、66、65、64、63、62、61、60、59、58、57、56、55、54、53、52、51、50、49、48、47、46、45、44、43、42、41或40ug/g的粪便钙卫蛋白水平来测定反应性。
在一些实施例中,通过对粪便钙卫蛋白的测定确定个体为反应者。
在一些实施例中,在治疗期间个体中粪便钙卫蛋白水平降低。
在一些实施例中,阈作用是对C反应蛋白的测定。
在一些实施例中,通过C反应蛋白水平来测定反应性。
在一些实施例中,通过C反应蛋白水平的降低来测定反应性。
在一些实施例中,通过小于约5、4.75、4.5、4.25、4、3.75、3.5、3.25、3、2.75、2.5、2.25、2、1.75、1.5或1mg/L的C反应蛋白水平来测定反应性。
在一些实施例中,通过对C反应蛋白的测定来确定个体为反应者。
在一些实施例中,在治疗期间个体中C反应蛋白水平降低。
在一些实施例中,第一时间段的治疗是约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23或24周的治疗。
在一些实施例中,在约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23或24周的治疗时测定反应。
在一些实施例中,所述方法进一步包括监测个体的活动性感染。
在一些实施例中,所述方法进一步包括如果个体出现活动性感染则中断投与。
在一些实施例中,活动性感染是严重的活动性感染。
在一些实施例中,所述方法进一步包含在投与化合物1或其药学上可接受的盐、水合物或溶剂合物期间监测不良事件,并且任选地中断或终止化合物1或其药学上可接受的盐、水合物或溶剂合物的投与。
在一些实施例中,治疗进一步包含监测投与期间的心率、监测投与期间的肺功能或监测投与期间的肝功能。
在一些实施例中,治疗进一步包含监测投与期间的心率。
在一些实施例中,治疗进一步包含监测投与期间的肺功能。
在一些实施例中,治疗进一步包含监测投与期间的肝功能。
在一些实施例中,所述方法降低由鞘氨醇1-磷酸盐亚型1(S1P
在一些实施例中,不良事件是严重不良事件。
在一些实施例中,严重不良事件是选自白细胞减少症、便秘、腹泻、恶心、腹痛、嗜中性白细胞减少症、呕吐、背痛和月经异常。
在一些实施例中,所述方法不导致严重不良事件。
在一些实施例中,投与化合物1而未引起心率降低超过6bpm。
在一些实施例中,投与化合物1而没有在其它S1P受体调节剂的情况下所见的心率的首剂效应。在一些实施例中,投与化合物1而没有在其它S1P受体调节剂的情况下所见的AV传导的首剂效应。
在一些实施例中,先前向个体投与至少一种选自以下的药剂:TNF拮抗剂、整联蛋白拮抗剂和免疫抑制剂。
在一些实施例中,先前对个体投与维多珠单抗。
在一些实施例中,个体对至少一种药剂反应不足、丧失反应或不耐受。
在一些实施例中,个体在过去的3个月中表现出对选自口服5-氨基水杨酸盐、皮质类固醇、免疫抑制剂、TNFα拮抗剂和整联蛋白拮抗剂中的至少一种药剂反应不足、丧失反应或不耐受。在一些实施例中,个体在过去的6个月中表现出对选自口服5-氨基水杨酸盐、皮质类固醇、免疫抑制剂、TNFα拮抗剂和整联蛋白拮抗剂中的至少一种药剂反应不足、丧失反应或不耐受。在一些实施例中,个体在过去的9个月中表现出对选自口服5-氨基水杨酸盐、皮质类固醇、免疫抑制剂、TNFα拮抗剂和整联蛋白拮抗剂中的至少一种药剂反应不足、丧失反应或不耐受。在一些实施例中,个体在过去的1年中表现出对选自口服5-氨基水杨酸盐、皮质类固醇、免疫抑制剂、TNFα拮抗剂和整联蛋白拮抗剂中的至少一种药剂反应不足、丧失反应或不耐受。在一些实施例中,个体在过去的2年中表现出对选自口服5-氨基水杨酸盐、皮质类固醇、免疫抑制剂、TNFα拮抗剂和整联蛋白拮抗剂中的至少一种药剂反应不足、丧失反应或不耐受。在一些实施例中,个体在过去的3年中表现出对选自口服5-氨基水杨酸盐、皮质类固醇、免疫抑制剂、TNFα拮抗剂和整联蛋白拮抗剂中的至少一种药剂反应不足、丧失反应或不耐受。在一些实施例中,个体在过去的4年中表现出对选自口服5-氨基水杨酸盐、皮质类固醇、免疫抑制剂、TNFα拮抗剂和整联蛋白拮抗剂中的至少一种药剂反应不足、丧失反应或不耐受。在一些实施例中,个体在过去的5年中表现出对选自口服5-氨基水杨酸盐、皮质类固醇、免疫抑制剂、TNFα拮抗剂和整联蛋白拮抗剂中的至少一种药剂反应不足、丧失反应或不耐受。
在一些实施例中,化合物1或其药学上可接受的盐、水合物或溶剂合物不与食物一起投与。
在一些实施例中,个体在被投与化合物1或其药学上可接受的盐、水合物或溶剂合物之前已禁食。
在一些实施例中,治疗包含诱导和/或维持临床反应;改善粘膜的内窥镜外观;和/或诱导和/或维持临床缓解。
在一些实施例中,在投与之前,个体的3分量梅奥诊所评分为至少6。
在一些实施例中,所述方法导致个体的3分量梅奥诊所评分改善。在一些实施例中,所述方法导致个体的2分量梅奥诊所评分改善。在一些实施例中,所述方法导致个体的总梅奥诊所评分改善。
在治疗发炎性肠病的方法的一些实施例中,例如溃疡性结肠炎,如中度至重度活动性溃疡性结肠炎,治疗导致内窥镜改善,例如改善粘膜的内窥镜外观。
在治疗发炎性肠病的方法的一些实施例中,例如溃疡性结肠炎,如中度至重度活动性溃疡性结肠炎,治疗诱导临床缓解。在治疗发炎性肠病的方法的一些实施例中,例如溃疡性结肠炎,如中度至重度活动性溃疡性结肠炎,治疗维持临床缓解。在治疗发炎性肠病的方法的一些实施例中,例如溃疡性结肠炎,如中度至重度活动性溃疡性结肠炎,治疗诱导且维持临床缓解。
在治疗发炎性肠病的方法的一些实施例中,例如溃疡性结肠炎,如中度至重度活动性溃疡性结肠炎,治疗诱导临床反应。在治疗发炎性肠病的方法的一些实施例中,例如溃疡性结肠炎,如中度至重度活动性溃疡性结肠炎,治疗维持临床反应。在治疗发炎性肠病的方法的一些实施例中,例如溃疡性结肠炎,如中度至重度活动性溃疡性结肠炎,治疗诱导且维持临床反应。
在一些实施例中,治疗使个体中的淋巴细胞计数减少至少40%。在一些实施例中,治疗使个体中的淋巴细胞计数减少至少45%、50%、55%、60%或65%。
在治疗发炎性肠病的方法的一些实施例中,例如溃疡性结肠炎,如中度至重度活动性溃疡性结肠炎,治疗导致不含皮质类固醇的缓解。
在治疗发炎性肠病的方法的一些实施例中,例如溃疡性结肠炎,如中度至重度活动性溃疡性结肠炎,治疗导致内窥镜缓解。
在治疗发炎性肠病的方法的一些实施例中,例如溃疡性结肠炎,如中度至重度活动性溃疡性结肠炎,治疗导致直肠出血改善。
在治疗发炎性肠病的方法的一些实施例中,例如溃疡性结肠炎,如中度至重度活动性溃疡性结肠炎,治疗导致组织学愈合。
在治疗发炎性肠病的方法的一些实施例中,例如溃疡性结肠炎,如中度至重度活动性溃疡性结肠炎,治疗导致组织学愈合。
在治疗发炎性肠病的方法的一些实施例中,例如溃疡性结肠炎,如中度至重度活动性溃疡性结肠炎,治疗导致组织学缓和。
在治疗发炎性肠病的方法的一些实施例中,例如溃疡性结肠炎,如中度至重度活动性溃疡性结肠炎,治疗导致粘膜愈合。
在治疗发炎性肠病的方法的一些实施例中,例如溃疡性结肠炎,如中度至重度活动性溃疡性结肠炎,治疗导致大便频率。
在治疗发炎性肠病的方法的一些实施例中,例如溃疡性结肠炎,如中度至重度活动性溃疡性结肠炎,治疗进一步包括监测粪便钙卫蛋白的水平。在一些实施例中,钙卫蛋白是正在投与化合物1或其药学上可接受的盐、水合物或溶剂合物的患者中临床和/或内窥镜结果的替代标志物。在一些实施例中钙卫蛋白的水平降低指示患者正在对治疗起反应。
在治疗发炎性肠病的方法的一些实施例中,例如溃疡性结肠炎,如中度至重度活动性溃疡性结肠炎,治疗进一步包括监测C反应蛋白(CRP)的水平。在一些实施例中,CRP是正在投与化合物1或其药学上可接受的盐,水合物或溶剂合物的患者中临床和/或内窥镜结果的替代标志物。在一些实施例中CRP的水平降低指示患者正在对治疗起反应。
在一些实施例中,治疗是减轻溃疡性结肠炎的体征和/或症状。在一些实施例中,治疗是减轻溃疡性结肠炎的体征。在一些实施例中,治疗是减轻溃疡性结肠炎的症状。在一些实施例中,治疗是减轻克罗恩氏病的体征和/或症状。在一些实施例中,治疗是减轻克罗恩氏病的体征。在一些实施例中,治疗是减轻克罗恩氏病的症状。
在一些实施例中,治疗是诱导和/或维持临床缓解。在一些实施例中,治疗是诱导和维持临床缓解。在一些实施例中,治疗是诱导和/或维持临床缓解和/或临床反应。在一些实施例中,治疗是诱导和维持临床缓解和临床反应。在一些实施例中,治疗是诱导临床缓解和/或临床反应。在一些实施例中,治疗是维持临床缓解和/或临床反应。在一些实施例中,治疗是诱导临床缓解和临床反应。在一些实施例中,治疗是维持临床缓解和临床反应。在一些实施例中,治疗是诱导和/或维持临床缓解和/或粘膜愈合。在一些实施例中,治疗是诱导和维持临床缓解和粘膜愈合。在一些实施例中,治疗是诱导和维持粘膜愈合。在一些实施例中,治疗是诱导和维持临床缓解。在一些实施例中,治疗是诱导临床缓解。在一些实施例中,治疗是诱导粘膜愈合。在一些实施例中,治疗是维持临床缓解。在一些实施例中,治疗是维持粘膜愈合。在一些实施例中,治疗是在诱导反应者中实现和/或维持临床缓解。在一些实施例中,治疗是在诱导反应者中实现和维持临床缓解。在一些实施例中,治疗是在诱导反应者中实现临床缓解。在一些实施例中,治疗是在诱导反应者中维持临床缓解。在一些实施例中,治疗是诱导和/或维持临床反应。在一些实施例中,治疗是诱导和维持临床反应。在一些实施例中,治疗是诱导临床反应。在一些实施例中,治疗是维持临床反应。在一些实施例中,治疗是诱导内窥镜改善。在一些实施例中,治疗是维持内窥镜改善。在一些实施例中,治疗是实现内窥镜改善。在一些实施例中,治疗是改善内窥镜缓解。在一些实施例中,治疗是维持内窥镜缓解。在一些实施例中,治疗是诱导组织学愈合。在一些实施例中,治疗是维持组织学愈合。在一些实施例中,治疗是改善大便频率。在一些实施例中,治疗是维持大便频率的改善。在一些实施例中,治疗是改善粘膜的内窥镜外观。在一些实施例中,治疗是维持粘膜的内窥镜改善。在一些实施例中,治疗是改善诱导期间粘膜的内窥镜外观。在一些实施例中,治疗消除对皮质类固醇使用的需要。在一些实施例中,治疗允许减少皮质类固醇的使用。在一些实施例中,治疗允许使用较低剂量的皮质类固醇。在一些实施例中,治疗是实现不含皮质类固醇的缓解。在一些实施例中,治疗是维持不含皮质类固醇的缓解。在一些实施例中,治疗是改善直肠出血。在一些实施例中,治疗是维持直肠出血的改善。在一些实施例中,治疗是提高内窥镜分项评分。在一些实施例中,治疗是维持内窥镜分项评分的提高。
在一些实施例中,已使用2分量梅奥诊所评分来诊断溃疡性结肠炎。例如,在一些实施例中,已使用范围为0至9的直肠出血和内窥镜检查结果的评分来诊断溃疡性结肠炎。在一些实施例中,已使用3分量梅奥诊所评分来诊断溃疡性结肠炎。例如,在一些实施例中,已使用范围为0至9的大便频率、直肠出血和内窥镜检查结果的评分来诊断溃疡性结肠炎。在一些实施例中,已使用总梅奥评分来诊断溃疡性结肠炎。例如,在一些实施例中,已使用范围为0至12的大便频率、直肠出血、内窥镜检查结果和医师总体评估的评分来诊断溃疡性结肠炎。
在一些实施例中,使用2分量梅奥诊所评分测定溃疡性结肠炎的改善。在一些实施例中,使用3分量梅奥诊所评分测定溃疡性结肠炎的改善。在一些实施例中,使用总梅奥评分测定溃疡性结肠炎的改善。在一些实施例中,通过临床缓解来测定溃疡性结肠炎的改善。在一些实施例中,通过淋巴细胞减少来测定溃疡性结肠炎的改善。在一些实施例中,通过内窥镜改善来测定溃疡性结肠炎的改善。在一些实施例中,通过6分梅奥评分来测定溃疡性结肠炎的改善。例如,在一些实施例中,通过大便频率和直肠出血来测定溃疡性结肠炎的改善。在一些实施例中,溃疡性结肠炎的改善在统计学上是显著的。
在一些实施例中,不推荐在患有活动性、重度感染的个体中使用化合物1。在一些实施例中,不推荐在患有活动性感染的个体中使用化合物1。在一些实施例中,不推荐在患有重度感染的个体中使用化合物1。在一些实施例中,不推荐在患有活动性、重度感染的个体中使用化合物1,直到感染受到控制。在一些实施例中,不推荐在患有活动性感染的个体中使用化合物1,直到感染受到控制。在一些实施例中,不推荐在患有重度感染的个体中使用化合物1,直到感染受到控制。在一些实施例中,在活动性感染期间未开始投与化合物1。在一些实施例中,监测个体感染。在一些实施例中,如果个体出现感染,那么停止化合物1的投与。在一些实施例中,如果感染变得严重,那么停止化合物1的投与。在一些实施例中,如果个体出现感染,那么中断化合物1的投与。在一些实施例中,不向患有感染的个体投与化合物1。在一些实施例中,在活动性感染期间不投与化合物1。在一些实施例中,在活动性感染期间未开始投与化合物1;监测个体在投与期间是否出现感染;且如果感染变得严重,那么停止投与。在一些实施例中,感染是轻度的。在一些实施例中,感染是中度的。在一些实施例中,感染是重度的。在一些实施例中,感染是严重的。在一些实施例中,感染是严重的不良事件。在一些实施例中,感染是呼吸道感染。
在一些实施例中,投与化合物1而未引起严重不良事件。在一些实施例中,投与化合物1而未引起与心率有关的严重不良事件。在一些实施例中,投与化合物1而未引起与心率变化有关的严重不良事件。在一些实施例中,投与化合物1而未引起与升高的心率有关的严重不良事件。在一些实施例中,投与化合物1而未引起与心动过缓有关的严重不良事件。在一些实施例中,投与化合物1而未引起与AV阻断有关的严重不良事件。在一些实施例中,投与化合物1而未引起与AV传导有关的严重不良事件。在一些实施例中,投与化合物1而未引起心动过缓。在一些实施例中,投与化合物1而未引起AV阻滞。在一些实施例中,在治疗的第一天投与化合物1而未引起超过轻度的心率降低(例如>10bpm)。在一些实施例中,投与化合物1而没有在其它S1P受体调节剂的情况下所见的首剂效应。在一些实施例中,投与化合物1而没有在其它S1P受体调节剂的情况下所见的首剂心血管效应。在一些实施例中,投与化合物1而没有心率的症状变化。在一些实施例中,投与化合物1而没有心律的症状变化。在一些实施例中,化合物1无需调定即可投与以避免在其它S1P受体调节剂的情况下所见的首剂效应。
在一些实施例中,投与化合物1而不增加肝功能测试(LFT)。在一些实施例中,投与化合物1而不引起LFT升高。在一些实施例中,投与化合物1而不使ALT增加。在一些实施例中,投与化合物1而不使AST增加。在一些实施例中,投与化合物1而不使ALT增加>3X ULN。在一些实施例中,投与化合物1而不使ALT增加>2.5X ULN。在一些实施例中,投与化合物1而不使ALT增加>2X ULN。在一些实施例中,投与化合物1而不使ALT增加>1.5X ULN。在一些实施例中,投与化合物1而不使AST增加>3X ULN。在一些实施例中,投与化合物1而不使AST增加>2.5X ULN。在一些实施例中,投与化合物1而不使AST增加>2X ULN。在一些实施例中,投与化合物1而不使AST增加>1.5X ULN。在一些实施例中,投与化合物1而不使胆红素增加。在一些实施例中,投与化合物1而不使胆红素增加>3X ULN。在一些实施例中,投与化合物1而不使胆红素增加>2.5X ULN。在一些实施例中,投与化合物1而不使胆红素增加>2X ULN。在一些实施例中,投与化合物1而不使胆红素增加>1.5X ULN。在一些实施例中,投与化合物1而不使gamma-glutamyl转移酶(GGT)增加。投与化合物1而不使GGT增加>3X ULN。在一些实施例中,投与化合物1而不使GGT增加>2.5X ULN。投与化合物1而不使GGT增加>2X ULN。在一些实施例中,投与化合物1而不使GGT增加>1.5X ULN。
在一些实施例中,投与化合物1而未引起肺功能测试异常。在一些实施例中,投与化合物1而未引起黄斑水肿。
在一些实施例中,个体对用于治疗发炎性肠病的另一种药剂反应不足、丧失反应、不耐受,或表现出依赖性。在一些实施例中,个体对用于治疗发炎性肠病的另一种药剂反应不足。在一些实施例中,个体对用于治疗发炎性肠病的另一种药剂丧失反应。在一些实施例中,个体对用于治疗发炎性肠病的另一种药剂不耐受。在一些实施例中,个体需要连续的类固醇疗法。在一些实施例中,另一种药剂是选自以下的至少一种药剂:肿瘤坏死因子(TNF)拮抗剂、皮质类固醇、整联蛋白拮抗剂和免疫抑制剂以及氨基水杨酸盐。
在一些实施例中,个体对常规疗法反应不足、丧失反应或不耐受。在一些实施例中,个体对常规疗法反应不足。在一些实施例中,个体对常规疗法丧失反应。在一些实施例中,个体对常规疗法不耐受。在一些实施例中,常规疗法是选自:至少一种选自以下的药剂:肿瘤坏死因子(TNF)拮抗剂、皮质类固醇、整联蛋白拮抗剂和免疫抑制剂以及氨基水杨酸盐。
在一些实施例中,先前已对个体投与皮质类固醇和/或氨基水杨酸盐。在一些实施例中,先前已对个体投与肿瘤坏死因子(TNF)拮抗剂、整联蛋白拮抗剂和/或免疫抑制剂。
在一些实施例中,皮质类固醇是口服皮质类固醇。在一些实施例中,TNF拮抗剂是TNF-α阻断剂在一些实施例中,氨基水杨酸盐是5-氨基水杨酸盐。在一些实施例中,整联蛋白拮抗剂被称为整联蛋白受体拮抗剂。在一些实施例中,TNF拮抗剂被称为TNF阻断剂。在一些实施例中,免疫抑制剂被称为免疫调节剂。在一些实施例中,先前常规疗法被称为先前治疗。
已显示对S1P
内皮S1P
在一个实施例中,本发明涵盖作为S1P
使用化合物1的1期研究以0.1mg、0.35mg、1mg、3mg和5mg的单一剂量进行。化合物1作为L-精氨酸盐投与。0.1mg至3mg的较低剂量被受试者良好耐受,仅报告了较少的不良事件,其中最常见的是头痛和接触性皮炎。在>0.35mg的所有剂量中观察到心率的剂量依赖性降低,然而,在低于5mg剂量的剂量下没有报告与心动过缓相关的不良事件。在5mg剂量下观察到剂量限制性不良事件,其中3名(50%)受试者经历4AE心动过缓并伴有一级或二级房室(AV)阻滞,导致剂量递增中断。研究中的最大耐受剂量是3mg。研究中没有死亡或严重不良事件。
除了对外周血淋巴细胞计数的预期药理学作用之外,在生命体征、ECG、肺功能测试、检眼镜检查或临床实验室测试方面没有其它临床上显著的安全问题。以3mg和5mg的剂量给药引起外周血B细胞、T细胞、NK细胞以及除TEM细胞外的所有T细胞亚群的绝对数量的剂量反应性下降。投与后2-4小时总外周血淋巴细胞(PBL)计数降低,到第8小时达到最低点,持续24小时,随后4天恢复到基线。在3mg和5mg剂量水平下,PBL计数降低了约40%和约55%。TEM细胞不表达CCR7,并且能够独立于S1P受体表达而再循环。因此,这些结果与S1P受体激动剂在临床前研究和人类中的预期药效学作用一致(Gergely等人,《英国药理学杂志(Br J Pharmacol)》167(5):1035-1047,2012;Brossard等人,《英国临床药理学杂志(Br JClin Pharmacol)》2013年4月18日.doi:10.1111/bcp.12129.[Epub提前打印]PubMedPMID:23594176和Kovarik等人,《临床药理学杂志(J Clin Pharmacol)》44(5):532-537,2004)。
S1P
在一个实施例中,本发明涵盖为S1P
S1P
在一些实施例中,鞘氨醇1-磷酸盐亚型1(S1P
在一些实施例中,S1P
在一些实施例中,S1P
在一些实施例中,S1P
在一些实施例中,S1P
在一些实施例中,S1P
在一些实施例中,S1P
在一些实施例中,S1P
在一些实施例中,S1P
在一些实施例中,S1P
在一些实施例中,S1P
在一些实施例中,S1P
在一些实施例中,S1P
在一些实施例中,S1P
在一些实施例中,S1P
在一些实施例中,S1P
在一些实施例中,S1P
在一些实施例中,S1P
在一些实施例中,S1P
在一些实施例中,S1P
在一些实施例中,S1P
在一些实施例中,S1P
在一些实施例中,S1P
在一些实施例中,S1P
在一些实施例中,S1P1受体相关病症是心肌缺血-再灌注损伤。
在一些实施例中,S1P
在一些实施例中,S1P
在一些实施例中,以相当于约0.5mg至约5.0mg的化合物1的量投与化合物1或其药学上可接受的盐、水合物或溶剂合物。
在一些实施例中,以相当于约0.5、0.6、0.7、0.75、0.8、0.9、1.0、1.1、1.25、1.2、1.3、1.4、1.5、1.6、1.7、1.75、1.8、1.9、2.0、2.1、2.2、2.25、2.3、2.4、2.5、2.6、2.7、2.75、2.8、2.9、3.0、3.1、3.2、3.25、3.3、3.4、3.5、3.6、3.7、3.75、3.8、3.9、4.0、4.1、4.2、4.25、4.3、4.4、4.5、4.6、4.7、4.75、4.8、4.9或5.0mg的化合物1的量投与化合物1或其药学上可接受的盐、水合物或溶剂合物。
在一些实施例中,以相当于1mg的化合物1的量投与化合物1或其药学上可接受的盐、水合物或溶剂合物。
在一些实施例中,以相当于1.5mg的化合物1的量投与化合物1或其药学上可接受的盐、水合物或溶剂合物。
在一些实施例中,以相当于2mg的化合物1的量投与化合物1或其药学上可接受的盐、水合物或溶剂合物。
在一些实施例中,以相当于2.5mg的化合物1的量投与化合物1或其药学上可接受的盐、水合物或溶剂合物。
在一些实施例中,以相当于3mg的化合物1的量投与化合物1或其药学上可接受的盐、水合物或溶剂合物。
在一些实施例中,向个体每天一次投与化合物1或其药学上可接受的盐、水合物或溶剂合物。
在一些实施例中,口服投与化合物1或其药学上可接受的盐、水合物或溶剂合物。
在一些实施例中,将化合物1或其药学上可接受的盐、水合物或溶剂合物调配为适合于口服投与的胶囊或片剂。
在一些实施例中,化合物1或其药学上可接受的盐、水合物或溶剂合物选自:化合物1;化合物1的钙盐;和化合物1的L-精氨酸盐。在一些实施例中,化合物1或其药学上可接受的盐、水合物或溶剂合物是化合物1的L-精氨酸盐。在一些实施例中,化合物1或其药学上可接受的盐、水合物或溶剂合物是化合物1的L-精氨酸盐的无水、非溶剂化结晶形式。在一些实施例中,化合物1或其药学上可接受的盐、水合物或溶剂合物是化合物1的无水、非溶剂化结晶形式。
在一些实施例中,还向个体投与治疗剂量的口服5-ASA化合物。
在一些实施例中,还向个体投与治疗剂量的口服皮质类固醇疗法。在一些实施例中,皮质类固醇是泼尼松,例如剂量≤20mg/天的泼尼松,或等效类固醇。在一些实施例中,皮质类固醇是布地奈德,例如剂量≤9mg/天或等效类固醇。
在一些实施例中,还向个体投与治疗剂量的免疫抑制剂。在一些实施例中,还向个体投与治疗剂量的洛哌丁胺。在一些实施例中,还向个体投与治疗剂量的6-巯基嘌呤。
在一些实施例中,还向个体投与治疗剂量的益生菌。在一些实施例中,还向个体投与治疗剂量的康萃乐(Culturelle)。在一些实施例中,还向个体投与治疗剂量的布拉酵母菌(Saccharomyces boulardii)。
在一些实施例中,还向个体投与治疗剂量的止泻药。在一些实施例中,还向个体投与治疗剂量的洛哌丁胺。在一些实施例中,还向个体投与治疗剂量的苯乙呱啶和阿托品。
本发明的一些实施例包括制备用于“组合疗法”的药物组合物的方法,所述方法包含将至少一种根据本文公开的任何化合物实施例的化合物与至少一种如本文所述的已知药剂和药学上可接受的载体配混。
还提供包含化合物1或其药学上可接受的盐、水合物或溶剂合物和任选地一种或多种药学上可接受的载剂的药物组合物。还提供包含化合物1或其药学上可接受的盐、水合物或溶剂合物,任选地一种或多种药学上可接受的载剂的药物组合物。在与配制物的其他成分相容并且对其接受者无害的意义上,载体必须是“可接受的”。
在一些实施例中,化合物1或其药学上可接受的盐、水合物或溶剂合物以原始或纯化学物质(例如以胶囊调配物中的粉末形式)形式投与。
在一些实施例中,将化合物1或其药学上可接受的盐、水合物或溶剂合物调配为进一步包含一种或多种药学上可接受的载剂的药物组合物。
药物组合物可通过任何合适的方法制备,通常通过以所需的比例将活性化合物与液体或细粉状固体载剂或这两者均匀混合,随后,如果需要,将所得混合物形成所需形状。
常规的赋形剂,如粘合剂、填充剂、可接受的湿润剂、压片润滑剂和崩解剂可用于口服投与的片剂和胶囊中。能够使用本领域技术人员熟知的技术将本文所述的化合物调配成药物组合物。除了本文提到的那些,合适的药学上可接受的载体是本领域已知的;例如,参见《雷明顿:药学的科学与实践(Remington,The Science and Practice ofPharmacy)》,第20版,2000,利平科特威廉姆斯和维尔金斯出版社(Lippincott Williams&Wilkins),(编辑:Gennaro等人)。
对于口服投与,药物组合物可呈例如片剂或胶囊的形式。药物组合物优选以含有特定量活性成分的剂量单位的形式制成。这种剂量单位的实例是胶囊、片剂、粉末、颗粒或悬浮液,其具有常规添加剂如乳糖、甘露醇、玉米淀粉或土豆淀粉;具有粘合剂如结晶纤维素、纤维素衍生物、阿拉伯树胶、玉米淀粉或明胶;具有崩解剂如玉米淀粉、土豆淀粉或羧甲基纤维素钠;并且具有润滑剂如滑石或硬脂酸镁。固体形式制剂包括粉剂、片剂、丸剂、胶囊、扁囊剂、栓剂和可分散颗粒。固体载体可以是一种或多种物质,其也可充当稀释剂、调味剂、增溶剂、润滑剂、悬浮剂、粘合剂、防腐剂、片剂崩解剂或包封材料。
在粉剂中,载体是细粉状固体,其与细粉状活性组分混合。
在片剂中,将活性组分与具有必要结合能力的载体以合适的比例混合,并压制成所需的形状和大小。
粉剂和片剂可含有不同百分比量的活性化合物。粉末或片剂中的代表性量可以是活性化合物的0.5%至约90%。但是,技术人员会知道何时需要超出此范围的数量。用于粉剂和片剂的合适载剂包括碳酸镁、硬脂酸镁、滑石、糖、乳糖、果胶、糊精、淀粉、明胶、黄蓍胶、甲基纤维素、羧甲基纤维素钠、低熔点蜡、可可脂等。术语“制剂”包括具有包封材料作为提供胶囊的载剂的活性化合物的调配物,其中具有或不具有载剂的活性组分被载剂包围,所述载剂因此与其结合。类似地,包括扁囊剂和锭剂。片剂、粉剂、胶囊、丸剂、扁囊剂和锭剂可用作适合于口服投与的固体形式。
药物制剂优选地呈单位剂型。在这种形式中,将制剂细分为含有适量活性成分的单位剂量。单位剂型可以是包装制剂,所述包装含有离散量的制剂,如包装的片剂或胶囊。此外,单位剂型可以是胶囊或片剂本身,或它可以是适当数量的包装形式的这些中的任一种。
其它实施例包括以下实例中所公开的实施例,其不应理解为以任何方式限制。
实例
实例1
如表1所示,制备由含有化合物1的L-精氨酸盐的速释硬明胶胶囊组成的调配物。
表1
如表2所示,还制备了由含有微晶纤维素的硬明胶胶囊组成的安慰剂调配物。
表2
实例2
进行随机、双盲、安慰剂对照、序贯、递增、多剂量研究以评估向健康成人受试者投与化合物1的L-精氨酸盐的安全性、耐受性和药代动力学。此研究被设计来评价化合物1的L-精氨酸盐的安全性、耐受性、药代动力学和药效学。
下表3和表4提供了按治疗组的人口统计数据的摘要以及对安全人群的更详细分析。
表3
表4
向群组1给药0.7mg(通过投与两种0.35mg调配物)持续21天。向群组2给药1.35mg(通过投与0.35mg调配物和1mg调配物两者)持续21天。向群组3给药2.0mg持续21天。向群组4给药0.35mg持续7天,然后给药2.0mg持续14天。向群组5给药0.5持续7天,然后给药3.0mg(通过投与1mg调配物和2mg调配物两者)持续14天。
进行了以下安全评估:利用检眼镜检查的体格检查、临床实验室试验(血清化学、凝血和尿液分析)、生命体征、连续遥测(12导联ECG)、安全ECG、肺功能试验(PFT)、血清蛋白电泳(SPEP)和血清免疫电泳(IEP)及不良事件报告。
化合物1的L-精氨酸盐在所有剂量水平下耐受。最常见的不良事件包括了接触性皮炎和白细胞减少症,后面是便秘、腹泻、恶心和腹痛。观察到的接触性皮炎与通常从研究中使用的ECG引线在胶带情况下看见的东西一致并且不会在被治疗组中更频繁地发生。大多数不良事件是轻度的。关于生命体征、ECG、PFT、检眼镜检查或临床实验室试验,没有其他临床上重要的安全问题。没有受试者由于不良事件而中断。在研究期间未发生SAE或死亡。
未发现二度心脏传导阻滞。三名受试者开发了新的(在给药之前不存在)一度房室传导阻滞:1名受试者在安慰剂组中,1名受试者在2mg组中,并且1名受试者在0.5、3mg组中。一名受试者(1.35mg剂量)在给药后具有轻度异常可再现性(NCS)肺功能试验结果(FEV1低于80%,FVC)。
两名受试者具有轻度异常非临床上显著的治疗后肝功能试验(丙氨酸转氨酶(ALT)升高并且天冬氨酸转氨酶(AST)>2倍正常上限(ULN)):1名受试者在2mg组中并且1名受试者在0.5逐步上升至3mg组中。
在检查时未发现检眼镜检查结果中相对于基线的临床显著变化。图1示出了安全人群中观察到的淋巴细胞计数(10
表5
表6示出了心率(BPM):安全人群在给药后(第1天至第28天)最小值相对于基线的变化的摘要。另参见图3。
表6
表7示出了收缩压(mmHg):安全人群在给药后(第1天至第28天)的最小值相对于基线的变化的摘要。
表7
表8示出了舒张压BP(mmHg):安全人群在给药后(第1天至第28天)最小值相对于基线的变化的摘要。
表8
表9示出了QTc(MS):安全人群在给药后(第1天至第23天)最大值相对于基线的变化的摘要。
表9
总之,临床试验示出了对在2mg剂量下具有最大作用的淋巴细胞降低的剂量相关作用。化合物1的L-精氨酸盐在所有试验剂量下很好地耐受。
实例3
进行随机、双盲、安慰剂对照、平行组、剂量范围研究以评估两种口服投与剂量(1mg和2mg)的艾曲莫德在患有溃疡性结肠炎的患者中的安全性和功效。表10提供了按治疗组的人口统计数据的摘要。
表10
表11
患者被随机成双盲、安慰剂对照研究以按照1:1:1比率接受每日一次(qd)剂量的化合物1的L-精氨酸盐(1mg或2mg)或匹配安慰剂持续12周。试验招募了患有中度至重度溃疡性结肠炎的156名患者(3分量梅奥评分为4-9,包括内窥镜分项评分≥2,直肠出血评分≥1)。
治疗调配物由含有化合物1的L-精氨酸盐的速释硬明胶胶囊组成。安慰剂由含有微晶纤维素的硬明胶胶囊组成。
患者在先前5年时段期间,已证明了对以下试剂中的至少一种的不足反应、对以下试剂中的至少一种的反应的丧失、或对以下试剂中的至少一种的耐受:
口服5-氨基水杨酸(5-ASA)(例如,美沙拉敏);
皮质类固醇,其中不管至少一种4周诱导方案的病史,患者都显示出持久活动性疾病的体征和症状,所述方案包括了相当于每天泼尼松30mg的剂量;或使皮质类固醇逐渐减少至低于相当于每天泼尼松10mg的剂量的2次失败的尝试;或皮质类固醇的不耐受的病史(包括但不限于库欣综合征、骨质减少症/骨质疏松症、高血糖症、失眠和感染);
免疫抑制剂,其中不管口服硫唑嘌呤(≥1.5mg/kg)或6-巯基嘌呤mg/kg(≥0.75mg/kg)的至少一种8周方案的病史;或这些免疫抑制剂中的至少一种的不耐受的病史(包括但不限于恶心/呕吐、腹痛、胰腺炎、LFT异常、淋巴细胞减少、TPMT基因突变、感染),患者都显示出持久活动性疾病的症状和体征;或者
TNFα拮抗剂,其中不管用下列中的至少一种完成诱导方案的病史,患者都显示出持久活动性疾病的体征和症状:剂量按照当前标签和/或医疗机构标准的英利昔单抗、阿达木单抗或戈利木单抗;或症状在现有临床获益后在用英利昔单抗、阿达木单抗或戈利木单抗维持给药期间复发(不管临床获益都不准予中断);或对英利昔单抗、阿达木单抗或戈利木单抗不耐受的病史(包括但不限于与输注或注射有关的反应、脱髓鞘、充血性心力衰竭、感染);或
整联蛋白拮抗剂,其中患者显示出症状在现有临床获益后在用维他珠单抗维持给药期间复发(不管临床获益都准予中断);或对维他珠单抗不耐受的病史(包括但不限于与输注有关的反应)。
患者被指示空腹服用其胶囊(隔夜禁食大约8小时)并且避免在给药之后大约1小时内进食。
此概念验证研究的主要目的是为了确定在12周时改变3分量梅奥诊所评分(范围为0到9的评分,包括大便频率、直肠出血和内窥镜检查结果)时用化合物1的L-精氨酸盐进行治疗的效果。
次要终点是在第12周达到内窥镜改善的患者的比例;在第12周2分量梅奥评分的变化(范围为0到6的评分,包括直肠出血和内窥镜检查结果);以及在第12周总梅奥评分的变化(范围为0到12的评分,包括大便频率、直肠出血、内窥镜检查结果和医师全局评估)。
探索性终点包括了在第1、2、4、8和12周淋巴细胞计数相对于基线的变化;在第12周达到临床缓解的患者的比例;以及在第12周达到临床反应的患者的比例。
针对当前口服糖皮质激素使用、对TNF-α拮抗剂的在先暴露和基线值而调整的ANCOVA模型用于估计梅奥诊所评分的变化。Mantel-Haenszel方法(通过调整当前口服皮质类固醇使用和对TNF-α拮抗剂的在先暴露来估计治疗差异)用于针对二分参数估计比例差异。缺少影响功效量度的个别梅奥分项评分与针对敏感性观察到的案例分析一起使用多重插补方法学来插补。统计试验被预先指定为单面的,其中p<0.025反映常规统计显著性。使用了在0.05α水平下针对主要和次要终点的层次封闭试验程序。
接受高剂量(2mg)的化合物1的L-精氨酸盐的患者以统计显著性达到了主要和所有次要终点。
相对于安慰剂,在第12周以2mg利用化合物1的L-精氨酸盐在3分量部分梅奥评分(PMS;范围为0到9的评分,包括大便频率、直肠出血和内窥镜检查结果)中存在0.99改善,这是统计上显著的(p=0.009)。在低剂量(1mg)组中,相对于安慰剂在第12周在PMS中存在0.43改善,这不是统计上显著的(p=0.146)。
化合物1的L-精氨酸盐(2mg)组中显著更多的患者与安慰剂比较达到了内窥镜改善(41.8%对17.8%,p=0.003)。对于1mg组,22.5%的患者达到了内窥镜改善(p=0.306)。
相对于安慰剂,在第12周在2分量梅奥评分(范围为0到6的评分,包括直肠出血和内窥镜检查结果)中存在0.84改善,这是统计上显著的(p=0.002)。在低剂量(1mg)组中,相对于安慰剂存在0.39改善,这不是统计上显著的(p=0.086)。
相对于安慰剂,在第12周在总梅奥评分(范围为0到12的评分,包括大便频率、直肠出血、内窥镜检查结果和医师全局评估)中存在1.27改善,对于2mg组来说(p=0.010)。在低剂量(1mg)组中,相对于安慰剂存在0.60改善,这不是统计上显著的(p=0.128)。
在探索性分析中,通过3分量梅奥评分定义的达到临床缓解的患者的比例与安慰剂组的8.1%(p<0.001)比较在化合物1的L-精氨酸盐(2mg)组中是33.0%。对于1mg组,16.0%的患者达到了临床缓解(p=0.136)
通过4分量总梅奥评分定义的缓解对于化合物1的L-精氨酸盐和安慰剂分别为24.5%和6.0%(p=0.004)。1mg组的缓解是15.4%(p=0.077)。
相对于安慰剂,在12周对于2mg组淋巴细胞减少57%(p<0.001)而对于1mg组存在37%减少。
图4示出了针对溃疡性结肠炎的各种治疗的具有内窥镜改善的患者的百分比的比较。图5示出了针对溃疡性结肠炎的各种治疗的临床缓解患者的百分比的比较,所述百分比被定义为总梅奥评分≤2分且无分项评分>1的患者的比例。注意,缓解的定义跨研究不同并且比较不由直接面对面研究产生
与安慰剂比较,化合物1的L-精氨酸盐耐受很好并且严重的不良事件(SAE)较少(在2mg中为0%;在1mg中为5.8%;而在安慰剂中为11.1%)。
表12
对心率和AV传导的影响在整个研究期间低,而不会因与心动过缓或AV阻滞有关的研究而中断。与安慰剂比较肝功能试验(LFT)没有增加并且没有黄斑水肿或肺功能试验异常的报告。
关于可能的心脏事件,在1mg组和2mg组两者中第1天的每小时ECG示出了心率的轻度减小,同时在任何时间点在任何一组中平均比率变化>10bpm。在第1天之后,相对于基线的平均心率减小在12周自始至终在任何一个剂量组中不超过6bpm。没有记录与心率变化或房室传导阻滞有关的严重的不良事件。
与安慰剂比较肝功能试验没有增加;没有黄斑水肿的报告;并且没有异常肺功能试验的报告。
研究人员将感染和侵扰中的不良事件评估为轻度或中度。未发生严重或威胁生命的感染。大多数不良事件是上呼吸道感染。
实例4
患者被随机以接受艾曲莫德(化合物1的L-精氨酸盐)1mg(n=52)、艾曲莫德2mg(n=50)或安慰剂(n=54)。使用梅奥诊所评分在基线和第12周评价临床和内窥镜结果。改良的梅奥诊所评分(改良的MCS)包括内窥镜、直肠出血(RB)和大便频率(SF)分项评分。缓解被定义为内窥镜分项评分≤1(不存在脆性),RB和SF评分≤1,并且SF相对于基线减小≥1。反应被定义为≥2分且相对于基线减小≥30%的临床缓解或改良的MCS减小,同时RB减小≥1或RB评分≤1。内窥镜改善被定义为分项评分≤1。分别根据大便和血液样品在基线和第4、8和12周测定粪便钙卫蛋白(FC)和C反应蛋白(CRP)。针对重复量度(1面P值)用混合模型分析随时间的治疗效果趋势,其中以当前口服皮质类固醇使用、对TNF-α拮抗剂的在先暴露、治疗、周和按周治疗相互作用作为因子,并且以基线值作为协变量。用Wilcoxon秩和试验(2面P值)评估子组之间的比较。使用斯皮尔曼等级系数(2面P值)来进行变量之间的相关性的分析。
接受艾曲莫德2mg的患者跨研究与安慰剂比较在FC和CRP方面具有显著减小(分别为0.42[P<0.001]和0.70[P=0.01])。接受艾曲莫德1mg的患者跨研究与安慰剂比较在CRP方面具有显著减小(0.72[P=0.02]),并且与安慰剂比在FC方面具有未达到统计显著性(0.71[P=0.08])的减小。与安慰剂比较接受艾曲莫德2mg的患者中的FC和CRP水平的减小首先在第4周观察到并且在第12周中自始至终持续(参见图6)。
与未达到缓解的患者比较,接受了艾曲莫德2mg并且在第12周达到了缓解的患者在所有基线后的时间点具有显著较低水平的FC(参见图7A)。达到了缓解的患者对未达到缓解的患者在第12周的中位数FC是62.0对1129μg/g(P<0.001)。与未达到缓解的患者比较,接受了艾曲莫德2mg并且在第12周达到了缓解的患者在包括基线的所有时间点具有显著较低水平的CRP(参见图7B)。在基线的高CRP水平与诱导治疗期间的较低缓解率相关联。
在第12周在FC的临床结果与内窥镜结果之间具有良好的相关性(rho分别为0.71和0.70,对两者来说P<0.001)。在艾曲莫德2mg组中,在改良的MCS与FC之间、在内窥镜结果与FC之间、并且在改良的MCS与CRP之间观察到强相关性(>0.5)。在内窥镜结果与CRP之间存在中度相关性(0.3至≤0.5)(表13)。在艾曲莫德2mg组中,在CRP与FC之间存在强相关性。
表13在第12周临床和内窥镜疾病活动、粪便钙卫蛋白和C反应蛋白之间的相关性
FC和CRP是接受艾曲莫德的患有溃疡性结肠炎的患者的临床和内窥镜反应的替代标志物。接受艾曲莫德2mg的患者在治疗期间在FC和CRP中具有显著减小。
尤其基于对本专利文献的回顾,所公开的方法的其它用途对于所属领域的技术人员将变得显而易见。
- 治疗与S1P1受体有关的病况的方法
- 调整MC5受体活性的方法以及与这种受体相关的病况的治疗
